È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Elettromiografia a fibra singola stimolata (SFEMG) per la valutazione della trasmissione della giunzione neuromuscolare in modelli di roditori
In questo articolo
Riepilogo
In questo studio, dimostriamo un raffinato protocollo di elettromiografia a fibra singola (SFEMG) per consentire la misurazione in vivo della trasmissione della giunzione neuromuscolare (NMJ) in modelli di roditori. Viene descritto un approccio graduale alla tecnica SFEMG per consentire la quantificazione della variabilità e del fallimento della trasmissione NMJ nel muscolo gastrocnemio di ratto.
Abstract
Come collegamento finale tra il sistema nervoso e il muscolo, la trasmissione alla giunzione neuromuscolare (NMJ) è fondamentale per la normale funzione motoria. L'elettromiografia a fibra singola (SFEMG) è una tecnica clinicamente rilevante e sensibile che misura le risposte al potenziale d'azione di una singola fibra muscolare durante le contrazioni volontarie o le stimolazioni nervose per valutare la trasmissione della NMJ. La valutazione e la quantificazione della trasmissione NMJ coinvolge due parametri: jitter e blocking. Il jitter si riferisce alla variabilità dei tempi (latenza) tra potenziali d'azione consecutivi a fibra singola (SFAP). Il blocco indica l'impossibilità della trasmissione NMJ di avviare una risposta SFAP. Sebbene la SFEMG sia un test ben consolidato e sensibile in ambito clinico, la sua applicazione nella ricerca preclinica è stata relativamente rara. Questo rapporto delinea i passaggi e i criteri impiegati nell'esecuzione di SFEMG stimolato per quantificare il jitter e il blocco nei modelli di roditori. Questa tecnica può essere utilizzata in studi preclinici e clinici per ottenere informazioni sulla funzione NMJ nel contesto della salute, dell'invecchiamento e della malattia.
Introduzione
L'elettromiografia a fibra singola (SFEMG) è stata inizialmente sviluppata da Stålberg ed Ekstedt negli anni '60 per identificare e analizzare i potenziali d'azione delle singole fibre muscolari, principalmente per studiare l'affaticamento muscolare1. La SFEMG è la tecnica clinica più sensibile per la valutazione della trasmissione della giunzione neuromuscolare (NMJ)2. La SFEMG viene condotta registrando selettivamente i potenziali d'azione a fibra singola (SFAP)3. La trasmissione della NMJ può essere compromessa a causa di fattori come l'invecchiamento 4,5 e vari disturbi neuromuscolari come la miastenia grave e la sclerosi laterale amiotrofica6. Inoltre, condizioni come l'ischemia, le fluttuazioni di temperatura e l'uso di agenti bloccanti neuromuscolari possono causare carenze nella trasmissione di NMJ, manifestate da un aumento della variabilità della trasmissione di NMJ e da occorrenze di fallimento di NMJ2.
Esistono due approcci alla registrazione della SFEMG: SFEMG stimolata e volontaria. La SFEMG volontaria comporta la registrazione di SFAP da due NMJ forniti dallo stesso assone motore utilizzando un elettrodo ad ago concentrico inserito nel muscolo da testare durante l'attivazione volontaria7. Di conseguenza, la SFEMG volontaria richiede la collaborazione del soggetto e può valutare solo le unità motorie a bassa soglia (quelle attivate durante le contrazioni deboli)3. La SFEMG stimolata utilizza una coppia di elettrodi stimolanti per stimolare gli assoni motori durante la registrazione delle SFAP con un elettrodo ad ago SFEMG inserito nel muscolo da testare7.
Sia nella SFEMG volontaria che in quella stimolata, il jitter e il blocco sono i due parametri utilizzati per valutare e quantificare la trasmissione NMJ8. Il jitter descrive la variabilità della temporizzazione (latenza) tra SFAP consecutivi. Durante la SFEMG volontaria, il jitter viene quantificato valutando le differenze di latenza tra una coppia di SCAP (forniti dallo stesso assone motore) durante da 50 a 100 scariche consecutive. Durante la SFEMG stimolata, il jitter viene quantificato valutando le differenze di latenza tra i tempi di stimolazione e l'insorgenza della SFAP durante 50-100 scariche consecutive. Il blocco indica l'incapacità della trasmissione NMJ di innescare una risposta SFAP e può essere quantificato come la presenza o l'assenza di ciascuna coppia di SFAP durante SFEMG volontario o per ogni NMJ durante SFEMGstimolato 2,7.
Sebbene sia un test consolidato e sensibile in ambito clinico, SFEMG è stato applicato solo raramente nella ricerca preclinica 4,5,9,10,11,12,13,14,15,16,17,18 . In questo rapporto, descriviamo l'approccio all'esecuzione e all'analisi delle registrazioni SFEMG in modelli preclinici di roditori. Inoltre, presentiamo dati rappresentativi che evidenziano risultati rappresentativi su SFEMG che indicano una compromissione della trasmissione NMJ in seguito alla somministrazione di un agente bloccante neuromuscolare non depolarizzante, il rocuronio.
Protocollo
Tutti i protocolli sono stati approvati ed eseguiti in conformità con le normative stabilite dal Comitato istituzionale per la cura e l'uso degli animali presso l'Università del Missouri.
1. Preparazione degli animali e somministrazione dell'anestesia
- Indossare adeguati dispositivi di protezione individuale.
- Prima della procedura, misurare il peso del ratto per determinare la dose appropriata per i farmaci basati sul peso e le impostazioni del ventilatore.
- Indurre l'anestesia con isoflurano inalato al 3%-5%. Una volta stabilito un livello adeguato di anestesia, posizionare il ratto in posizione prona e mantenere l'anestesia con l'1%-3% di isoflurano inalato.
- Verificare l'adeguatezza della profondità dell'anestesia premendo delicatamente il cuscinetto del piede dell'arto posteriore con una pinza per osservare l'assenza di una risposta di ritiro.
- Mantenere la temperatura corporea a 37 °C.
- Applicare un unguento a base di petrolio approvato dal veterinario sugli occhi per prevenire la secchezza. Monitora la profondità dell'anestesia osservando la frequenza respiratoria e valutando le risposte di astinenza quando applichi pressione al cuscinetto del piede usando una pinza.
- Radere l'arto posteriore da valutare con un tagliacapelli. Dopo un'adeguata epilazione, utilizzando del nastro adesivo, posizionare l'arto da studiare con la caviglia fissata a circa 90° di dorsiflessione, il ginocchio in estensione e l'anca in abduzione.
- Monitorare continuamente la respirazione e la frequenza cardiaca del ratto durante l'intero esperimento.
NOTA: Un aumento della frequenza cardiaca è comunemente usato come indicatore di una profondità anestesiologica inadeguata. - Somministrare isoflurano per l'eutanasia del ratto, con una dose del 5% o superiore, fino a quando la respirazione non si è interrotta per almeno 3 minuti. Confermare l'eutanasia per decapitazione.
2. Posizionamento e configurazione dell'elettrodo
NOTA: La trasmissione NMJ del nervo sciatico e del muscolo gastrocnemio viene valutata utilizzando il sistema elettromiografico (EMG). Fare riferimento alla Tabella dei materiali.
- Inserire un paio di aghi monopolari isolati da 28 G per stimolare il nervo sciatico con il catodo nella regione dell'arto posteriore prossimale, mentre l'anodo è più prossimalmente all'interno del tessuto sottocutaneo che si sovrappone all'osso sacro.
- Assicurarsi che gli elettrodi stimolanti non siano posizionati nelle immediate vicinanze del nervo sciatico o eccessivamente profondi per evitare danni diretti al nervo sciatico o ad altre strutture adiacenti.
- Posizionare un elettrodo di terra monouso sull'arto posteriore o sulla coda controlaterale.
- Posizionare con cautela un elettrodo ad ago da 25 mm calibro 27 specificamente progettato per EMG a fibra singola, dotato di una superficie di registrazione in materiale platino-iridio nel muscolo gastrocnemio destro. Assicurarsi che gli elettrodi SFEMG siano sterilizzati in autoclave prima di ogni utilizzo per mantenere la sterilità.
- Inserire l'elettrodo ad ago SFEMG in parallelo con le fibre muscolari del gastrocnemio per catturare i potenziali d'azione a fibra singola (SFAP).
- Evitare danni muscolari durante l'inserimento e la manovra dell'ago SFEMG all'interno del muscolo.
3. Procedura di elettromiografia a fibra singola stimolata (SFEMG)
- Applicare una stimolazione a corrente costante al nervo sciatico destro a una frequenza di 10 Hz utilizzando un intervallo di intensità di 0,3-10 mA e una durata dell'impulso di 0,1 ms.
- Configurare le impostazioni del filtro all'interno di un filtro a bassa frequenza di 1 kHz e di un filtro ad alta frequenza di 10 kHz. Regola il guadagno da 200 μV a 1000 μV per divisione per facilitare la visualizzazione dei potenziali. Impostare la velocità di scansione a 500 μs per divisione.
- Regola l'intensità dello stimolo per attivare e isolare gli SFAP per la registrazione e la successiva analisi.
- Per identificare e analizzare una risposta come SFAP, assicurarsi che siano soddisfatti i criteri specifici indicati di seguito: assicurarsi che il tempo di salita dal picco di base alla fase negativa sia inferiore a 500 μs, che l'ampiezza minima (da picco basale a negativo) sia di almeno 200 μV e che la risposta mostri costantemente un comportamento tutto o niente (dimensioni e forma stabili tra le risposte).
NOTA: È essenziale che le risposte ricorrenti mostrino fasi ascendenti coerenti senza tacche o punti di flesso. Si noti che l'ultimo criterio è fondamentale per distinguere un segnale di qualità dalla somma di più segnali.
- Per identificare e analizzare una risposta come SFAP, assicurarsi che siano soddisfatti i criteri specifici indicati di seguito: assicurarsi che il tempo di salita dal picco di base alla fase negativa sia inferiore a 500 μs, che l'ampiezza minima (da picco basale a negativo) sia di almeno 200 μV e che la risposta mostri costantemente un comportamento tutto o niente (dimensioni e forma stabili tra le risposte).
- Calcolare il jitter, o variabilità della latenza SFAP (tempo tra la stimolazione e la fase di salita del picco negativo di SFAP) tra scariche consecutive, a seguito di almeno 50 stimolazioni (50-100 stimolazioni), e valutare e quantificare il blocco.
NOTA: Il blocco può essere valutato come la presenza o l'assenza in ciascuna sinapsi o come la percentuale di stimolazioni che non riescono a innescare la generazione di potenziali d'azione di una singola fibra. Il jitter viene calcolato utilizzando la seguente equazione7 (il jitter viene in genere calcolato automaticamente dai sistemi di elettromiografia clinica):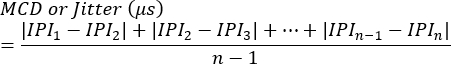
MCD = Valore medio della differenza consecutiva
IPI = Intervallo interpotenziale - Ripetere la procedura per ulteriori risposte SFAP. In media, valutare 10 sinapsi di ciascun animale per calcolare il jitter e successivamente determinare i valori medi per animale.
- Escludere dalle analisi gli SFAP con jitter inferiore a 4 μs per evitare l'inclusione di potenziali che potrebbero essere stati evocati dalla stimolazione muscolare diretta11.
- Quando si registrano potenziali che mostrano un blocco intermittente, aumentare l'intensità dello stimolo per verificare che il fallimento della SFAP non sia attribuibile alla stimolazione submassimale.
Risultati
Per dimostrare un aumento del jitter e del blocco nel contesto del fallimento della trasmissione NMJ, la SFEMG stimolata è stata eseguita con e senza somministrazione endovenosa di rocuronio. Il rocuronio è un agente bloccante neuromuscolare ad azione intermedia e non depolarizzante, ampiamente utilizzato in ambito clinico per indurre la paralisi muscolare durante interventi chirurgici o procedure mediche. Funziona legandosi in modo competitivo ai recettori nicotinici dell'acetilcolina...
Discussione
SFEMG è comunemente usato per i test diagnostici in pazienti con sospette forme autoimmuni, acquisite e genetiche della malattia NMJ. SFEMG è considerato il test più sensibile per la diagnosi del disturbo NMJ, miastenia gravis20,21. La stimolazione nervosa ripetitiva (RNS) è un altro metodo più comunemente utilizzato nei test diagnostici clinici e prevede la stimolazione di un nervo periferico con un treno di stimoli e la qu...
Divulgazioni
W. David Arnold ha ricevuto finanziamenti per la ricerca da NMD Pharma e Avidity Biosciences ed è consulente per NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics e Catalyst Pharmaceuticals.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. Martin Brandhøj Skov di NMD Pharma per i suoi preziosi consigli sul dosaggio del rocuronio e Arash Karimi del Dipartimento di Ingegneria Biomedica della Stony Brook University per la sua assistenza nei calcoli. Questo studio è stato supportato in parte da finanziamenti da NIH a WDA (R01AG067758 e R01AG078129).
Materiali
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Riferimenti
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon