需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
刺激单纤维肌电图 (SFEMG) 用于评估啮齿动物模型中神经肌肉接头的传递
摘要
在这项研究中,我们展示了一种改进的单纤维肌电图 (SFEMG) 协议,允许在 啮 齿动物模型中对神经肌肉接头 (NMJ) 传递进行体内测量。描述了 SFEMG 技术的循序渐进方法,以允许量化大鼠腓肠肌中的 NMJ 传递变异性和衰竭。
摘要
作为神经系统和肌肉之间的最终连接,神经肌肉接头 (NMJ) 的传递对于正常的运动功能至关重要。单纤维肌电图 (SFEMG) 是一种临床相关且敏感的技术,可测量自主收缩或神经刺激期间的单根肌纤维动作电位反应,以评估 NMJ 传递。NMJ 传输的评估和量化涉及两个参数:抖动和阻塞。抖动是指连续单纤维动作电位 (SFAP) 之间的时序(延迟)变化。阻塞表示 NMJ 传输无法启动 SFAP 响应。尽管 SFEMG 在临床环境中是一种成熟且敏感的测试,但它在临床前研究中的应用相对较少。本报告概述了执行刺激 SFEMG 以量化啮齿动物模型中的抖动和阻塞所采用的步骤和标准。该技术可用于临床前和临床研究,以深入了解 NMJ 在健康、衰老和疾病方面的功能。
引言
单纤维肌电图 (SFEMG) 最初由 Stålberg 和 Ekstedt 在 1960 年代开发,用于识别和分析单个肌肉纤维的动作电位,主要用于研究肌肉疲劳1。SFEMG 是评估神经肌肉接头 (NMJ) 传递的最敏感的临床技术2。SFEMG 是通过选择性记录单纤维动作电位 (SFAP) 3 进行的。由于衰老 4,5 和各种神经肌肉疾病(如重症肌无力和肌萎缩侧索硬化症6)等因素,NMJ 传递可能会受到影响。此外,缺血、温度波动和使用神经肌肉阻滞剂等情况会导致 NMJ 传递缺陷,表现为 NMJ 传递变异性增加和 NMJ 衰竭的发生2。
记录 SFEMG 有两种方法:刺激和自愿 SFEMG。自愿 SFEMG 涉及在自愿激活期间使用插入被测肌肉的同心针电极记录来自同一运动轴突提供的两个 NMJ 的SFAP,7。因此,自愿 SFEMG 需要受试者的合作,并且只能评估低阈值运动单位(在微弱收缩期间激活的单位)3。受刺激的 SFEMG 使用一对刺激电极刺激运动轴突,同时将 SFEMG 针状电极插入被测肌肉中记录 SFAP7。
在自主和刺激 SFEMG 中,抖动和阻塞是用于评估和量化 NMJ 传递的两个参数8。抖动描述了连续 SFAP 之间的计时 (延迟) 变化。在自主 SFEMG 期间,通过评估一对 SFAP(由同一运动轴突提供)在 50 到 100 次连续放电期间的潜伏期差异来量化抖动。在受刺激的 SFEMG 期间,通过评估 50 至 100 次连续放电期间刺激时间和 SFAP 开始之间的潜伏期差异来量化抖动。阻断表示 NMJ 传递未能触发 SFAP 反应,它可以量化为自主 SFEMG 期间每对 SFAP 的存在与否,或被刺激的 SFEMG 期间每对 NMJ 的存在与否 2,7。
虽然 SFEMG 在临床环境中是一种成熟且敏感的测试,但在临床前研究中很少得到应用 4,5,9,10,11,12,13,14,15,16,17,18 .在本报告中,我们概述了在临床前啮齿动物模型中执行和分析 SFEMG 记录的方法。此外,我们提供了代表性数据,突出了 SFEMG 的代表性发现,这些发现表明在给予非去极化神经肌肉阻滞剂罗库溴铵后 NMJ 传递受损。
研究方案
所有方案均已根据密苏里大学机构动物护理和使用委员会制定的规定获得批准和执行。
1. 动物准备和麻醉管理
- 穿戴适当的个人防护装备。
- 在手术之前,测量大鼠的体重以确定基于体重的药物和呼吸机设置的适当剂量。
- 用 3%-5% 吸入异氟醚诱导麻醉。一旦建立了足够的麻醉水平,将大鼠置于俯卧位,并用 1%-3% 吸入异氟醚维持麻醉。
- 用镊子轻轻按压后肢脚垫,观察是否有戒断反应,以验证麻醉深度的充分性。
- 将体温保持在 37 °C。
- 将兽医认可的石油基软膏涂抹在眼睛上,以防止干燥。通过观察呼吸频率并评估使用镊子对脚垫施加压力时的戒断反应来监测麻醉深度。
- 剃掉后肢以使用剪刀进行评估。充分脱毛后,使用胶带将要研究的肢体定位,踝关节固定在约 90° 背屈,膝关节伸展,髋关节外展。
- 在整个实验过程中持续监测大鼠的呼吸和心率。
注意:心率增加通常用作麻醉深度不足的指标。 - 施用异氟醚对大鼠实施安乐死,剂量为 5% 或更高,直到呼吸停止至少 3 分钟。通过斩首确认安乐死。
2. 电极放置和设置
注意:使用肌电图 (EMG) 系统评估坐骨神经和腓肠肌的 NMJ 传递。请参阅 材料表。
- 插入一对绝缘的 28 G 单极针,用阴极刺激坐骨神经进入后肢近端区域,而阳极位于覆盖骶骨的皮下组织内。
- 确保刺激电极不要立即靠近坐骨神经或放置得太深,以避免直接伤害坐骨神经或其他邻近结构。
- 将一次性接地电极放在对侧后肢或尾部。
- 小心地将专为单纤维 EMG 设计的 27 号、25 毫米针状电极放入右侧腓肠肌中,该电极具有由铂铱材料制成的记录表面。确保 SFEMG 电极在每次使用前都经过高压灭菌,以保持无菌。
- 将 SFEMG 针状电极与腓肠肌纤维平行插入,以捕获单纤维动作电位 (SFAP)。
- 在肌肉内插入和操纵 SFEMG 针头时避免肌肉损伤。
3. 刺激单纤维肌电图 (SFEMG) 程序
- 使用 0.3-10 mA 的强度范围和 0.1 ms 的脉冲持续时间,以 10 Hz 的频率对右侧坐骨神经施加恒流刺激。
- 在 1 kHz 的低频滤波器和 10 kHz 的高频滤波器中配置滤波器设置。将增益从每格 200 μV 调整到 1000 μV,以促进电位的可视化。将扫描速度设置为每格 500 μs。
- 调整刺激强度以触发和隔离 SFAP,以便进行记录和后续分析。
- 要识别和分析作为 SFAP 的响应,请确保满足以下特定标准:确保从基线峰值到负相的上升时间小于 500 μs,最小幅度(基线峰值到负值)至少为 200 μV,并且响应始终表现出全有或全无行为(响应之间的稳定大小和形状)。
注意:重复的响应必须表现出一致的上升阶段,没有任何缺口或拐点。请注意,最后一个标准对于区分质量信号和多个信号的总和至关重要。
- 要识别和分析作为 SFAP 的响应,请确保满足以下特定标准:确保从基线峰值到负相的上升时间小于 500 μs,最小幅度(基线峰值到负值)至少为 200 μV,并且响应始终表现出全有或全无行为(响应之间的稳定大小和形状)。
- 在至少 50 次刺激(50-100 次刺激)之后,计算连续放电之间的抖动或 SFAP 潜伏期(刺激和 SFAP 负峰值上升阶段之间的时间)的变化性,并评估和量化阻塞。
注意:阻断可以评估为每个突触的存在与否,或评估为未能触发单纤维动作电位产生的刺激的百分比。抖动使用以下公式7 计算(抖动通常由临床肌电图系统自动计算):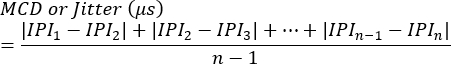
MCD = 连续差值的平均值
IPI = 电位间隔 - 对其他 SFAP 响应重复此过程。平均而言,评估每只动物的 10 个突触以计算抖动,然后确定每只动物的平均值。
- 从分析中排除抖动小于 4 μs 的 SFAP,以防止包含可能由直接肌肉刺激诱发的电位11。
- 当记录显示间歇性阻塞的电位时,增加刺激强度以验证 SFAP 失败不是由于次极大刺激造成的。
结果
为了证明在 NMJ 传递失败的情况下抖动和阻塞增加,在有和没有静脉注射罗库溴铵的情况下进行刺激 SFEMG。罗库溴铵是一种中效、非去极化神经肌肉阻滞剂,广泛用于临床环境,以在手术或医疗程序中诱导肌肉麻痹。它通过与 NMJ19 的烟碱乙酰胆碱受体竞争性结合来发挥作用。在给予罗库溴铵之前,如第 1 节所述制备成年野生型大鼠 (Sprague Dawley) 并麻?...
讨论
SFEMG 通常用于疑似自身免疫、获得性和遗传性 NMJ 疾病患者的诊断检测。SFEMG 被认为是诊断 NMJ 疾病、重症肌无力20,21 的最敏感测试。重复神经刺激 (RNS) 是另一种更常用于临床诊断测试的方法,涉及用一系列刺激刺激周围神经并量化神经支配肌肉的总复合肌肉动作电位反应 5,22。与...
披露声明
W. David Arnold 获得了 NMD Pharma 和 Avidity Biosciences 的研究资助,并为 NMD Pharma、Avidity Biosciences、Dyne Therapeutics、Novartis、Design Therapeutics 和 Catalyst Pharmaceuticals 提供咨询。
致谢
作者要感谢 NMD Pharma 的 Martin Brandhøj Skov 博士对罗库溴铵剂量的宝贵建议,以及石溪大学生物医学工程系的 Arash Karimi 在计算方面的帮助。这项研究部分得到了 NIH 到 WDA (R01AG067758 和 R01AG078129) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
参考文献
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。