Method Article
فحص الدم الكامل مع التحفيز المشترك المزدوج للتحليل الخاص بالمستضد لمناعة المضيف ضد مسببات الأمراض الفطرية والفيروسية
* These authors contributed equally
In This Article
Summary
توفر المقايسات المناعية القائمة على الدم الكامل أداة سهلة وفعالة للموارد لتحليل المناعة الخاصة بالمستضد لأغراض التشخيص والبحث. توفر هذه المقالة بروتوكولا محسنا قائما على الدم الكامل مع تحفيز مشترك مزدوج لتحليل شامل لمناعة المضيف لمسببات الأمراض الفطرية والفيروسية ، بما في ذلك نسخة منخفضة الحجم لمرضى الأطفال الصغيرة.
Abstract
تعد معالجة العينات السريعة والفعالة للموارد والإنتاجية العالية والمتانة العالية أمرا بالغ الأهمية للتطبيق العلمي والسريري الفعال للمقايسات المناعية المتقدمة الخاصة بالمستضد. تقليديا ، غالبا ما تعتمد هذه المقايسات المناعية ، وخاصة تحليل الخلايا التائية الخاصة بالمستضد عن طريق قياس التدفق الخلوي أو فحوصات البقع الممتزة المناعية المرتبطة بالإنزيم ، على عزل خلايا الدم المحيطية أحادية النواة. تستغرق هذه العملية وقتا طويلا ، وتخضع للعديد من العوامل المربكة قبل التحليل ، وتتطلب كميات كبيرة من الدم. توفر المقايسات القائمة على الدم الكامل بديلا سهلا مع زيادة متانة ما قبل التحليل ومتطلبات أقل لحجم الدم. علاوة على ذلك ، تسمح المقايسات القائمة على الدم الكامل بالحفاظ على التفاعلات بين الخلايا التي لا يتم التقاطها بواسطة المقايسات باستخدام مجموعات فرعية من الخلايا المعزولة. في الآونة الأخيرة ، تم اقتراح اختبار مناعي مكرر للدم الكامل مع التحفيز المشترك المزدوج المضاد ل CD28 ومضاد CD49d لتحليل شامل لكل من وظائف الخلايا التائية الخاصة بالمستضد والتفاعلات المعقدة بين الخلايا استجابة لمختلف المستضدات الفطرية والفيروسية. يوفر هذا البروتوكول إرشادات لإعداد أنابيب التحفيز ، وتحفيز الدم ، ومعالجة العينات النهائية لقياس التدفق الخلوي ، ومقايسات إفراز السيتوكين ، وتحليلات النسخ. يتضمن ذلك بروتوكولا منخفض الحجم تم التحقق من صحته ومكافئا وظيفيا وغير منشور سابقا (250 ميكرولتر) لجعل مراقبة الخلايا التائية القائمة على التدفق الخلوي والسيتوكينات أكثر سهولة للدراسات التي أجريت على مرضى الأطفال أو الدراسات قبل السريرية على الصغيرة (مثل الفئران). إجمالا ، توفر هذه البروتوكولات مجموعة أدوات متعددة الاستخدامات للتحليل المناعي المعقد الخاص بالمستضد في كل من إعدادات البحث السريرية والتحويلية.
Introduction
يعد القياس الكمي وتوصيف المناعة الخاصة بالمستضد ، وخاصة استجابات الخلايا التائية المحددة ، أمرا محوريا لأبحاث علم الأحياء المناعية والتطعيم ، بالإضافة إلى بعض الاختبارات التشخيصية. تقليديا ، تعتمد المقايسات المناعية الخاصة بالمستضد بشكل شائع على خلايا الدم المحيطية أحادية النواة المعزولة (PBMCs). ومع ذلك ، فإن عزل هذه الخلايا يستغرق وقتا طويلا ويتطلب الكثير من الموارد وغالبا ما يتطلب كميات كبيرة نسبيا من الدم. بالإضافة إلى ذلك ، لمنع تنشيط الخلايا الحبيبية واضطراب الخلايا التائية اللاحق أثناء التخزين قبل التحليل، تعد المعالجة السريعة للعينات أمرا بالغ الأهمية ، وهو أمر غير ممكن في كثير من الأحيان في الممارسة السريرية. تعيق هذه القيود قابلية المقايسات المناعية الخاصة بالمستضد في سيناريوهات البحث عالية الإنتاجية والروتين السريري. لذلك ، فإن تطوير مناهج تعتمد على الدم الكامل سهلة الاستخدام وقابلة للتشغيل الآلي في السنوات الأخيرة قد فتح مجالات جديدة لتطبيقات المقايسة المناعية. ومع ذلك ، فإن الأنظمة الحالية المتاحة تجاريا عادة ما تفتقر إلى البيئات التحفيزية المشتركة المثلى للخلايا التائية وتكون عرضة للتأخير قبل التحليل. على سبيل المثال ، فإن مقايسة إطلاق IFN-γ المستندة إلى الدم الكامل المستخدمة على نطاق واسع لها معدل ارتداد إيجابي إلى سلبي بنسبة 19٪ بعد 6 ساعات من تخزين الدم قبل التحليل2. تم تطوير بروتوكولات محسنة مع التحفيز المشترك المزدوج المضاد ل CD28 ومضاد CD49d للتغلب على هذه القيود3،4،5،6.
يسمح البروتوكول المقدم هنا بقياس وتوصيف الخلايا التائية الخاصة بالمستضد بدقة وقابلة للتكرار ، وتقييم استجابات السيتوكين التي يسببها المستضد ، وغيرها من المؤشرات المناعية الوظيفية (قياس التدفق الخلوي أو النسخ) من الحد الأدنى من حجم الدم ، أي 500 ميكرولتر من الدم لكل أنبوب تحفيز. تشمل المزايا الإضافية لهذا البروتوكول انخفاض الوقت العملي ، والمرونة العالية للعوامل المربكة قبل التحليل ، والحفاظ على التفاعلات الوظيفية بين الخلايا في بيئة فسيولوجية نسبيا خارج الجسم الحي . تم عرض قابلية مقارنة توصيف الخلايا التائية الخاصة بمستضد قياس التدفق الخلوي القائم على الدم الكامل مع البيانات التي تم إنشاؤها من المقايسات التقليدية القائمة على PBMC في سياق القياس الكمي للخلايا التائية الخاصة بالعفن6. علاوة على ذلك ، فإن التحفيز المباشر لدم الأشخاص يلغي الحاجة إلى مكملات مصل ذاتي أو ملون أو حتى غريب المنشأ المطلوب عادة لتحفيز PBMC الأمثل. يقلل إغفال عزل الخلية أيضا من إجهاد القص ودرجة الحرارة ، وبالتالي تحسين بقاء الخلية. الأهم من ذلك ، أن المقايسات القائمة على الدم الكامل تحافظ على مجموعات الخلايا المحببة التي تفقد أثناء الطرد المركزي المتدرج لعزل PBMCs7. وبالتالي ، يحافظ إعداد الفحص هذا على حلقات التفاعل الوظيفية بين الخلايا المحببة والخلايا أحادية النواةويلتقطها 4.
وتجدر الإشارة إلى أن هذا البروتوكول لا يتطلب سوى الحد الأدنى من التعديلات لاستيعاب طرائق القراءة المختلفة ، بل ويسمح بالتحليل المزدوج لإطلاق السيتوكين واستجابات النسخ من نفس أنبوب التحفيز. على وجه التحديد ، بينما يتم تحليل السيتوكينات من المادة الطافية بعد التحفيز ، يمكن استخدام حبيبات الخلية لعزل الحمض النووي الريبي مع تحليل النسخ اللاحق. يتم تلخيص سير العمل العام لطرائق القراءة المختلفة في الشكل 1.
في السنوات الأخيرة ، تم تطوير عدد متزايد من المقايسات القائمة على الدم الكامل لمراقبة المناعة التفاعلية لمسببات الأمراض في البيئات البحثية والسريرية ، على سبيل المثال ، للمفطرة السلية8،9 ، والسعال الديكي Bordetella3 ، و Orientia tsutsugamushi10 ، و SARS-CoV-25،11،12. على سبيل المثال ، تم استخدام نظام تم إنشاؤه مسبقا لمستضدات متعددة ، بما في ذلك M. tuberculosis ، وفيروس الأنفلونزا A ، و SARS-CoV-2 ، ولكنه لا يستخدم عوامل التحفيز المشترك المحسنة لتحفيز الخلايا T-helper (Th)13،14،15. على الرغم من أن حجم الدم المطلوب لهذه المقايسات أقل بكثير من ذلك المستخدم في المقايسات التقليدية القائمة على PBMC أو مجموعات تحفيز الدم الكامل المتاحة تجاريا ، فقد يكون هناك ما يبرر حجم عينة أصغر للتطبيقات في طب الأطفال وحديثي الولادة والمرضى في وحدة العناية المركزة (ICU) والبحوث قبل السريرية في نماذج الصغيرة. على سبيل المثال ، حتى أخذ عينات الدم النهائي من الفئران (على سبيل المثال ، عن طريق ثقب القلب) ينتج عادة ما ينتج عنه 0.7-1 مل من الدم كحد أقصى. وبالتالي ، تم تقييم إمكانية تقليص بروتوكولات المقايسة المناعية القائمة على الدم الكامل التي تم إنشاؤها مسبقا4،6 من أجل القياس الكمي الدقيق وتوصيف استجابات الخلايا التائية التفاعلية للمستضد من 250 ميكرولتر من حجم الدم لكل أنبوب تحفيز كجزء من هذا البروتوكول.
Protocol
وافق المجلس الأخلاقي لجامعة لودفيج ماكسيميليان في ميونيخ (المشروع رقم 21-0689) على جمع عينات الدم البشري. بالإضافة إلى ذلك ، تم إنشاء أجزاء من مجموعات البيانات التمثيلية تحت Corona-Register-Study رقم 20-426 ، والذي تمت الموافقة عليه أيضا من قبل لجنة الأخلاقيات في جامعة لودفيج ماكسيميليان في ميونيخ. تم الحصول على الموافقة المستنيرة.
1. تحضير أنابيب تحفيز الدم بالكامل
ملاحظة: هذه الخطوة مقتبسة من Lauruschkat et al.4 و Weis et al.6. يلخص الجدول 1 تركيزات وأحجام الكاشف التفصيلية.
- في ظل ظروف معقمة (طاولة عمل معقمة) ، قم بإعداد أنابيب جمع الدم سعة 2.7 مل بدون مضادات التخثر ، مع مستضدات وأجسام مضادة محفزة مشتركة. أضف 1 ميكروغرام / مل من α-CD28 و 1 ميكروغرام / مل من α-CD49d إلى كل أنبوب ، بما في ذلك التحكم السلبي. ضع في اعتبارك حجم الدم الذي يجب إضافته لتحفيز الدم الكامل عند تحديد التركيزات النهائية (250 ميكرولتر أو 500 ميكرولتر). للحفاظ على هندسة الغرفة وإمكانية الوصول إلى العينة ، لا تسحب المكبس من أنبوب جمع الدم.
- بناء على تصميم الدراسة ، حدد ما إذا كانت أنابيب التحكم السلبية يجب ألا تحتوي على محفزات إضافية (التحكم في الخلفية غير المحفز ، كما هو موضح في الجدول 1) أو استخدام المستضدات التي يجب أن لا تحتوي مجموعة الدراسة على خلايا تائية خاصة بالمستضد أو الحد الأدنى منها (على سبيل المثال ، تجمع الببتيد لفيروس العوز المناعي البشري في الأفراد مصابين بفيروس العوز المناعي البشري 16).
- للتحفيز الخاص بالمستضد، قم بتحسين التركيزات المثالية للمستضدات عن طريق المعايرة بالتحليل الحجمي في التجارب الأولية. لإنشاء البيانات التمثيلية أدناه ، استخدم تركيزات المستضد المحسنة التالية: 1.2 ميكروغرام / مل HSV-1 محللة ، 0.6 نانومتر / ببتيد / مل CMV pp65 ، 0.6 نانومتر / ببتيد / مل SARS-CoV-2 Prot_S ، 50 ميكروغرام / مل Aspergillus fumigatus lysate ، و 1 نانوغرام / مل CRX-527.
- قم بتضمين عنصر تحكم إيجابي ، خاصة للدراسات التي أجريت على مرضى اللمفاويات أو أولئك الذين يتلقون العلاج الدوائي المثبط للمناعة. استخدم محلول التحكم الإيجابي CPI (0.6 نانومتر / الببتيد / مل) ، والذي يتكون من الفيروس المضخم للخلايا وفيروس نظير الأنفلونزا وببتيدات فيروس الأنفلونزا.
ملاحظة: بدلا من ذلك ، يمكن استخدام المحفزات الاصطناعية ، مثل PMA (10 ميكروغرام / مل) ± الأيونوميسين (1 ميكروغرام / مل) ، لكنها تحفز تفاعلات فسيولوجية أقل ويمكن أن تؤثر على التعبير عن المستضدات السطحية التي يشيع استخدامها كعلامات سكانية لقياس التدفق الخلوي (وعلى الأخص ، CD417). لاحظ أن الأجسام المضادة التحفيزية المشتركة ليست ضرورية بالتزامن مع معظم محفزات التحكم الإيجابية الاصطناعية وقد تؤثر سلبا على بقاء الخلية واستجابتها. - لتنسيق أحجام الكاشف عبر جميع أنابيب التحفيز ، أضف وسيط RPMI 1640 حتى الأحجام الإجمالية التالية: الفحص الكامل لقياس التدفق الخلوي: 50 ميكرولتر ؛ فحص واسع النطاق لتحليل السيتوكين والنسخ: 500 ميكرولتر ؛ مقايسة صغيرة الحجم لقياس التدفق الخلوي: 25 ميكرولتر ؛ مقايسة صغيرة الحجم لتحليل السيتوكين والنسخ: 250 ميكرولتر.
ملاحظة: لإعداد مجموعات متعددة من أنابيب التحفيز ، يوصى بإعداد خلطات رئيسية بما في ذلك جميع المكونات بسبب انخفاض مخاطر التلوث وانخفاض حجم العوامل المحفزة والمنبهات. - استخدم الأنابيب المحضرة على الفور أو احتفظ بها بالتبريد عند -20 درجة مئوية. يمكن تخزين معظم الكواشف لمدة تصل إلى 4 أسابيع ؛ ومع ذلك ، قم بالتحقق المسبق من صحة فترات التخزين القصوى للكواشف / المحفزات الجديدة.
2. تحفيز وحضانة عينات الدم الكامل
- قبل حوالي 30-60 دقيقة من تحفيز الدم الكامل ، قم بإذابة أنابيب التحفيز الجاهزة للاستخدام واحتفظ بها في درجة حرارة الغرفة.
- جمع الدم الوريدي من المتبرع / المريض باستخدام أنابيب جمع الدم مع مضاد التخثر هيبارين الليثيوم. تأكد من أن حجم الدم الذي تم جمعه يلبي متطلبات التجربة الفردية ، أي أن الحد الأدنى من 750 ميكرولتر مطلوب ل 3 شروط من الفحص الصغير ، بما في ذلك التحكم السلبي والإيجابي. بالنسبة لأنابيب جمع الدم المكتسبة تجاريا ، املأها بالكامل لتحقيق تركيزات عمل الهيبارين من 16 إلى 25 وحدة دولية / مل في الدم.
ملاحظة: البيانات الديموغرافية للأشخاص البالغين الأصحاء الذين تم تجنيدهم لإنشاء مجموعات البيانات التمثيلية موضحة في الجدول 2. - نقل الكمية المطلوبة من الدم الكامل الهيباريني (250 ميكرولتر أو 500 ميكرولتر للمقايسة الصغيرة أو الكاملة، على التوالي) إلى أنابيب التحفيز عن طريق سحب العينة تحت طاولة عمل معقمة.
ملاحظة: إذا لم تكن طاولة العمل المعقمة متوفرة أو عند العمل مع عينات تظهر فيها الحد الأدنى من خطر الإصابة بالعدوى (أي دم البشر أو التي تم فحصها مسبقا) ، فيمكن نقل العينات إلى أنابيب التحفيز باستخدام محاقن معقمة. تتيح هذه الطريقة أيضا معالجة العينات بجانب السرير مباشرة بعد جمع الدم ، مما يقلل من التخزين قبل التحليل وضعف الخلايا التائية. قبل حقن الدم ، قم بتطهير الأختام المطاطية لكل من أنبوب جمع الدم وجميع أنابيب التحفيز بمطهر كحولي. اترك المطهر يجف لمدة 1 دقيقة على الأقل. - اقلب أنابيب التحفيز بعناية 5x-10x. ضع أنابيب التحفيز في حاضنة 37 درجة مئوية. لاحظ أن حاضنة ثاني أكسيد الكربون2 غير مطلوبة. لمنع تنشيط العدلات غير المحدد ، لا تقم بتبريد أنبوب جمع الدم.
ملاحظة: تم التحقق من صحة هذا البروتوكول لتخزين الدم قبل التحليل لمدة تصل إلى 8 ساعات في درجة حرارة الغرفة للسماح بنقل العينات. إذا كان ذلك ممكنا ، فمن الأفضل حقن الدم الكامل في أنابيب التحفيز في موقع الجمع ونقل الدم إلى مختبر مركزي في أنابيب التحفيز ، حيث أن العوامل المحفزة المشتركة ستعمل على تحسين صلاحية الخلايا الليمفاوية18،19. - فقط بالنسبة للعينات المستخدمة في فحوصات قياس التدفق الخلوي مع التلوين داخل الخلايا ، أضف بريفيلدين أ (التركيز النهائي 10 ميكروغرام / مل) إلى كل أنبوب تحفيز بعد 4 ساعات من الحضانة.
- قم بإعداد محلول بريفيلدين أ 1 مجم / مل في RPMI وأضف 1 ميكرولتر من المحلول لكل حجم عينة 100 ميكرولتر (أي كوكتيل تحفيز مسبق الخلط + حجم الدم الكامل). أضف brefeldin A عن طريق فك غطاء الأنابيب وسحب العينات تحت طاولة عمل معقمة. تلخيص وإعادة الأنابيب إلى حاضنة 37 درجة مئوية لمدة 16-18 ساعة أخرى عند 37 درجة مئوية (20-22 ساعة في المجموع).
- بالنسبة لمقايسات إفراز السيتوكين أو تحليلات النسخ ، لا تضيف بريفيلدين أ واحتضان العينات باستمرار عند 37 درجة مئوية لمدة 24-26 ساعة.
ملاحظة: يثبط Brefeldin A جهاز Golgi وبالتالي يلغي إفراز السيتوكين ونقل البروتينات إلى سطح الخلية. نظرا لأن الإفراز أو التعبير السطحي سيؤدي في النهاية إلى فقدان البروتين وتدهوره بعد إعادة الاستيعاب ، على التوالي ، فإن مثبطات إفراز الخلايا ضرورية للتراكم داخل الخلايا وتلطيخ السيتوكينات وبعض علامات التنشيط (على سبيل المثال ، CD154) لدراسات قياس التدفق الخلوي. ومع ذلك ، فإن brefeldin A يعطل أيضا العمليات الخلوية الفسيولوجية المرئية في النسخ ويبطل فحوصات إفراز السيتوكين من المواد الطافية المزروعة20،21 ، مما يستلزم استخدام أنبوبي اختبار منفصلين (أحدهما مع والآخر بدون brefeldin A) لإجراء هذه القراءات بالتوازي.
3. تحضير عينات لقياس التدفق الخلوي
- أضف 500 ميكرولتر من محلول EDTA 0.5 M إلى كل أنبوب تحفيز واحتضان العينة لمدة 15 دقيقة في درجة حرارة الغرفة لفصل الخلايا الملتصقة عن سطح الأنابيب.
- نقل العينات إلى أنابيب طرد مركزي جديدة سعة 15 مل. اشطف أنابيب التحفيز ب 1 مل من محلول تحلل كريات الدم الحمراء لجمع خلايا الدم المتبقية ، ثم أضف المخزن المؤقت والخلايا إلى نفس أنابيب الطرد المركزي سعة 15 مل.
- جهاز الطرد المركزي الأنابيب سعة 15 مل لمدة 7 دقائق عند 600 × جم. تخلص بعناية من المادة الطافية
- أعد تعليق حبيبات خلايا الدم في المخزن المؤقت لتحلل كريات الدم الحمراء (الشكل 2 أ). استخدم 5 مل من محلول تحلل كريات الدم الحمراء ل 500 ميكرولتر من الدم الكامل و 3 مل ل 250 ميكرولتر من الدم الكامل.
ملاحظة: يجب إجراء تقييم مسبق لظروف تحلل كريات الدم الحمراء المثلى للمخزن المؤقت المحدد المستخدم (المنتج المحضر داخليا أو تجاريا). تم تحسين التعليمات الواردة هنا للمخزن المؤقت لتحلل كريات الدم الحمراء المدرجة في جدول المواد. - احتضان العينات في درجة حرارة الغرفة حتى تظهر العينات واضحة (الشكل 2 ب). لمنع تحلل الخلايا المحببة وتجميعها ، لا تتجاوز 6 دقائق من الحضانة. مؤشر على تحلل كريات الدم الحمراء الناجح هو القدرة على رؤية الأرقام والمقياس على أنبوب 15 مل من خلال السائل (الشكل 2 ج).
- جهاز الطرد المركزي الأنابيب سعة 15 مل لمدة 7 دقائق عند 600 × جم. تخلص من المادة الطافية بعناية ، كرر الخطوات 3.4 - 3.5 إذا كانت حبيبات الخلية لا تزال حمراء بشكل ملحوظ.
- أعد تعليق حبيبات الخلية في 1 مل من HBSS ونقل الخلايا إلى 2 مل أنابيب تفاعل.
- جهاز طرد مركزي أنابيب 2 مل لمدة 5 دقائق عند 400 × جم. تخلص بعناية من المادة الطافية
- قم بإجراء تلطيخ التدفق الخلوي وفقا لتعليمات الشركة المصنعة لمجموعة التلوين داخل الخلايا والأجسام المضادة المستخدمة.
ملاحظة: يتم تلخيص لوحة الأجسام المضادة المستخدمة لإنشاء مجموعة البيانات التمثيلية في الجدول 3.
4. تحضير عينات لفحوصات السيتوكين
- بعد الخطوة 2.6 ، انقل الدم المخفف من أنابيب التحفيز إلى أنابيب 1.5 مل.
- جهاز طرد مركزي أنابيب 1.5 مل لمدة 20 دقيقة عند 2000 × جم. قم بوضع الماصة الطافية بعناية في أنبوب جديد سعة 1.5 مل واستخدمه إما على الفور لتحليل السيتوكين أو حفظ المواد الطافية بالتبريد عند -80 درجة مئوية.
- قم بالطرد المركزي للطاف مرة أخرى لمدة 5 دقائق عند ≥ 7000 × جم (في أنابيب 1.5 مل) لإزالة بقايا الخلايا المتبقية قبل التحليل ، خاصة بعد الذوبان. اعتمادا على بروتوكول فحص السيتوكين ، قم بإجراء التخفيف المسبق للعينات.
- أعد تعليق حبيبات الخلية في 1 مل من المخزن المؤقت لحماية الحمض النووي الريبي وحفظها بالتبريد عند -80 درجة مئوية لعزل الحمض النووي الريبي اللاحق. بدلا من ذلك ، أعد تعليق حبيبات الخلية في المخزن المؤقت للتحلل لعزل الحمض النووي الريبي الفوري وفقا للتعليمات الخاصة بمجموعة عزل الحمض النووي الريبي (أو البروتوكول الداخلي).
ملاحظة: إذا لزم الأمر ، اعتمادا على بروتوكول معالجة الحمض النووي الريبي اللاحق ، يمكن إضافة خطوة تحلل كريات الدم الحمراء المشابهة ل 3.4-3.5 قبل إضافة المخزن المؤقت لحماية الحمض النووي الريبي.
النتائج
التحليل متعدد الوسائط للاستجابات المناعية الخاصة بالمستضد بعد تحفيز الدم الكامل باستخدام المستضدات المرتبطة بممرض الأمراض
لإنشاء مجموعة بيانات تمثيلية ، تم اختيار متبرع بالغ سليم إيجابي المصل لفيروس الهربس البسيط -1 والفيروس المضخم للخلايا الذي تلقى لقاحات SARS-CoV-2. بالإضافة إلى المكافحة غير المحفزة ، تم استخدام المحفزات التالية كما هو موضح أعلاه: تحلل فيروس الهربس البسيط 1 (HSV) (توصية الشركة المصنعة ، بيانات غير منشورة) ، الفيروس المضخم للخلايا (CMV) pp6522 ، فيروس كورونا 2 (SARS-CoV-2) Prot_S5،23 ، Aspergillus fumigatus lysate (ممرض بيئي في كل مكان)4،24، CRX-527 (محفز مستقبلات شبيهة بالحصيلة 4 يعتمد على عديدات السكاريد الدهنية ، والتي لا ينبغي أن تنشط الخلايا التائية في حد ذاتها) 25 ، و CPI (التحكم الإيجابي في تنشيط الخلايا التائية CD4 + التي تتكون من CMV وفيروس نظير الأنفلونزا وببتيدات فيروس الأنفلونزا)26. يتم عرض بيانات قياس التدفق الخلوي واستراتيجية البوابات في الشكل 3. بشكل عام ، ينصح بقياس أكبر عدد ممكن من الخلايا الليمفاوية عند استهداف مجموعات الخلايا النادرة (50،000 - 100،000 خلية ليمفاوية) ، حيث تعتمد دقة وموثوقية القياسات على العدد الإجمالي للأحداث27. تستخدم العينة غير المحفزة لبوابات مجموعات فرعية فردية من الخلايا (على سبيل المثال ، خلايا CD3 + CD4 + ). يجب ضبط بوابات CD45RO و CCR7 للتنميط الظاهري للخلايا التائية للذاكرة على إجمالي مجموعة CD3 + CD4 + ثم نقلها إلى مجموعات موجبة لعلامة التنشيط ، حيث أن أرقام الأحداث المنخفضة على الأخيرة غالبا ما تمنع التحديد الواضح للمجموعات السكانية المتميزة. قد تكون التعديلات الطفيفة ضرورية للبوابات الفردية ، على سبيل المثال ، لمراعاة الاختلافات في صلاحية الخلايا الليمفاوية. تم وصف تنظيم CD154 (أو ترابط CD40) بأنه علامة تنشيط خلية التائية المساعدة العالمية والمتسقة وسريعةالاستحث 28،29. تعتبر IFN-γ واحدة من أبرز علامات تنشيط الخلايا التائية من النوع 130،31. الأهم من ذلك ، تم اختبار هذا الاختبار ونشره مع العديد من علامات التنشيط والإرهاق والسيتوكين الإضافية (انظر الجدول 4 و24).
تمثل ترددات المجموعات السكانية الإيجابية لعلامة التنشيط في العينة غير المحفزة خلفيات غير محددة وتم طرحها من الترددات المحفزة بالمستضد. بعد طرح خلفية غير محددة ، كان لدى المتبرع التمثيلي 0.75٪ (HSV) و 0.09٪ (CMV) و 0.06٪ (SARS-CoV-2) و 0.34٪ (A. fumigatus) و 0.00٪ (CRX-527) و 1.21٪ (CPI) خلايا مساعدة T محددة CD154 + / CD3 + CD4 + ، على التوالي. يمكن تحليل تعبير IFN-γ بالمثل ، مما ينتج عنه 0.12٪ (HSV) و 0.07٪ (CMV) و 0.03٪ (SARS-CoV-2) و 0.04٪ (A. fumigatus) و 0٪ (CRX-527) و 0.74٪ (CPI) IFN-γ + / CD3 + CD4 + .
يمكن تقسيم مجموعات الخلايا التائية إلى خلايا تائية ساذجة (TN ، CD45RO-CCR7 +) ، وخلايا ذاكرة تائية مركزية (TCM ، CD45RO + CCR7 +) ، وخلايا T للذاكرة المستجيبة (TEM ، CD45RO + CCR7-) ، والخلايا التائية المستجيبة (والخلايا التائية للذاكرة المستجيبة التي تعيد التعبير عن CD45RA ، TE / TEMRA ، CD45RO-CCR7-). من بين الخلايا التائية العالمية CD3 + CD4 + ، كان لدى المتبرع التمثيلي 38.34٪ TN و 38.33٪ TCM و 20.77٪ T EM و 2.56٪ TE / TEMRA ، على التوالي ، على النحو المحدد باستخدام العينة غير المحفزة (الشكل 3 أ). ومع ذلك ، من بين الخلايا التائية التفاعلية الخاصة بالمستضد (CD154 + IFN-γ +) ، كانت TCM و TEM أبرز المجموعات الفرعية ، بمتوسط 22.14٪ و 73.97٪ على التوالي.
تم نشر بيانات عن مجموعات الكريات البيض الإضافية سابقا باستخدام هذه المنهجية24. يتم عرض مجموعات الأجسام المضادة المستخدمة في الجدول 4 لمزيد من الرجوع إليها.
علاوة على ذلك ، لإظهار الإمكانات الكاملة لهذه المنهجية ، تم إجراء IFN-γ ELISA على مجموعة ثانية من العينات المحفزة (بدون إضافة brefeldin A). لمنع تجاوز نطاق الكشف عن مجموعة IFN-γ ELISA ، تم تخفيف البلازما من العينات المحفزة CPI مسبقا بنسبة 1: 4. تم قياس تركيزات IFN-γ التالية وتطبيعها لكل مل من حجم دم الشخص ، أي تم تصحيحها للتخفيف في كل من أنابيب التحفيز وتخفيفات ما قبل ELISA: 0 بيكوغرام / مل (غير محفز) ، 69.4 بيكوغرام / مل (HSV) ، 471 بيكوغرام / مل (CMV) ، 17.8 بيكوغرام / مل (SARS-CoV-2) ، 61.9 بيكوغرام / مل (A. fumigatus) ، 34.0 بيكوغرام / مل (CRX-527) ، و 1958 بيكوغرام / مل (CPI).
أخيرا ، تم عزل الحمض النووي الريبي من نفس العينات بنتائج متسقة. كان متوسط العائد 719 نانوغرام ، بمتوسط نسبة امتصاص 260 نانومتر / 280 نانومتر هو 1.98.
إجمالا ، توضح مجموعة البيانات هذه أن البروتوكول المقدم يسمح بطيف قراءة متعدد الأوجه وتحليل مصاحب لمختلف المستضدات المرتبطة بالعدوى باستخدام الحد الأدنى من حجم الدم ، أي 8 مل في المجموع لمحفزات متعددة وطرائق قراءة.
مجموعة بيانات تمثيلية لتحليلات النسخ لتتبع استجابة التطعيم باستخدام الدم الكامل المحفز بالمستضد
كدليل على مبدأ الدراسات النسخية التي أجريت على الدم الكامل المحفز بالمستضد ، تم جمع الدم من 9 أشخاص بالغين أصحاء قبل وشهر واحد بعد التطعيم المعزز الأول ب BNT162b2 (لقاح SARS-CoV-2 mRNA) 32،33 بعد 7-9 أشهر من سلسلة اللقاحات الأولية المكونة من جرعتين. كان متوسط إنتاج الحمض النووي الريبي من 500 ميكرولتر من الدم الكامل غير المحفز والمحفز Prot_S 1.1 ميكروغرام من الحمض النووي الريبي عالي النقاء ، بمتوسط نسبة امتصاص 260/280 تبلغ 1.99. بعد تحليل nCounter ، تم تطبيع أعداد الحمض النووي الريبي إلى 12 جينا للتدبير المنزلي للوحة (المتوسط الهندسي). بعد ذلك ، تم تحديد نسبة عدد الرنا المرسال الطبيعي في العينات المحفزة Prot_S مقابل ضوابط الخلفية غير المحفزة لكل موضوع وجين. تم تحديد نسب الوسيط إلى المتوسط لقياسات ما بعد التطعيم مقابل ما قبل التطعيم، وتم إجراء تحليل تخصيب المسار باستخدام حزمة البرامج المدرجة في جدول المواد. اعتبر إثراء المسارات الكنسية مهما عند قيمة درجة z المطلقة ≥ 1.25 وقيمة p المعدلة من Benjamini-Hochberg < 0.05. يتم تلخيص المسارات المخصبة بشكل مختلف بشكل كبير في الشكل 4 أ ، وتظهر شبكة مبسطة من التغييرات المعدلة في الخلفية في استجابة ما بعد التطعيم مقابل ما قبل التطعيم Prot_S في الشكل 4 ب. بالإضافة إلى ذلك ، يظهر تحريض أقوى معدل للخلفية للجينات التمثيلية المتعلقة بنضوج الخلية العارضة للمستضد وتنشيط الخلايا التائية التي يسببها Prot_S بعد التطعيم المعزز في (ص < 0.01-0.03) الشكل 4 ج. أخيرا ، تم تأكيد زيادة في الخلايا المساعدة من النوع 1 من النوع Prot_S المعدلة في الخلفية (CD69 + IFN-γ +) بعد التطعيم في معظم المتبرعين عن طريق قياس التدفق الخلوي باستخدام مجموعة ثانية من أنابيب التحفيز (ص = 0.03 ، الشكل 4 د).
مقارنة استجابات الخلايا التائية التفاعلية للفيروس في بروتوكولات المقايسة المناعية القائمة على الدم الكامل والحجم الصغير
بعد ذلك ، تمت مقارنة ترددات الخلايا التائية المساعدة CD154 + IFN-γ + التفاعلية للفيروس (خلايا CD3 + CD4 + ) في المتطوعين الأصحاء باستخدام بروتوكولات تحفيز مستضد الدم الكامل على نطاق واسع (500 ميكرولتر ، WB) والحجم الصغير (250 ميكرولتر ، WBS) (الشكل 5). كما تم الإبلاغ سابقاعن 34 ، شوهدت الحد الأدنى من ترددات الخلفية غير المحددة لخلايا CD154 + IFN-γ + مع أي من البروتوكولين على الرغم من التحفيز المشترك المزدوج (يعني ، 0.010٪ و 0.011٪ ل WB و WBS ، على التوالي). وتجدر الإشارة إلى أنه على الرغم من طرح استجابات الخلفية غير المحددة من الاستجابات الخاصة بالمستضد ، إلا أنها لا تزال تساهم في زيادة عدم دقة الفحص ، كما تمت مناقشتهسابقا 27. يمكن أن تشير إشارات الخلفية المرتفعة (أي خلايا CD154 + Th >0.07-0.1٪ أو خلايا CD154 + IFN-γ+ >0.05٪) إلى تلوث العينة ، أو عدوى حادة للموضوع ، أو يمكن أن تكون نتيجة لمعالجة عينة ما قبل التحليل غير المناسبة.
كان متوسط ترددات الخلايا التائية التفاعلية لفيروس الهربس البسيط في المتبرعين الإيجابيين المصلية (ن = 5) 0.151٪ و 0.107٪ في أنظمة WB و WBS ، على التوالي ، مقارنة ب 0.012٪ و 0.004٪ في المتبرعين سالبين المصل (ن = 4). مع مجموعة الببتيد CMV pp65 ، كان لدى المتبرعين الإيجابيين للمصليات (ن = 4) خلايا تائية تفاعلية بنسبة 0.041٪ و 0.049٪ مقارنة ب 0.001٪ و 0.004٪ في المتبرعين السلبية المصلية (ن = 5). كانت معاملات ارتباط التوافق في لين 0.868 لفيروس الهربس البسيط و 0.985 ل CMV ، مما يشير إلى وجود ارتباط قوي (الشكل 5 أ). والجدير بالذكر أن اختبار الخلايا التائية الخاصة بالفيروسات المكشوفة للخلايا يمكن أن يكون سلبيا في الأشخاص الأصحاء الإيجابيين للمصل الذين لم يكن لديهم أحداث إعادة تنشيط حديثة. تم تمييز كل من ذخيرة الخلايا الكلية والمستضدية CD3 + CD4 + T-helper بناء على تعبير CCR7 و CD45RO (الشكل 5 ب). ومما يبعث على الاطمئنان أن النتائج التي تم الحصول عليها باستخدام بروتوكولات البنك الدولي وبروتوكول تنظيم الضفة الغربية كانت قابلة للمقارنة بالنسبة لكل من المجموعات الكلية وتفاعلية للمستضد. من المتوقع ، مع كلا المقياسين ، أن نسبة خلايا الذاكرة Th الأكثر تمايزا (أي خلايا الذاكرة المستجيبة) أعلى بين الخلايا التائية المتفاعلة مع المستضد منها بين إجمالي مجموعة الخلايا Th. كما هو متوقع ، تم تنشيط عدد قليل فقط من الخلايا التائية الساذجة بواسطة المنشطات الفيروسية (الشكل 5 ب).
علاوة على ذلك ، في مجموعة أخرى من التجارب ، تم تحليل المواد الطفية المحفزة بواسطة IFN-γ ELISA (الشكل 5 ج). شوهدت خلفية غير محددة للحد الأدنى (متوسط 1.29 بيكوغرام/مل و2.18 بيكوغرام/مل في بروتوكولات البنك الأبيض وتنظيم المل، على التوالي). أظهرت عينات الدم من المتبرعين الإيجابيين لفيروس الهربس البسيط متوسط تركيزات IFN-γ الناجمة عن فيروس الهربس البسيط المعدلة في الخلفية من 111 بيكوغرام / مل و 125 بيكوغرام / مل في نظام WB و WBS ، على التوالي. في المقابل ، كانت تركيزات IFN-γ في العينات السالبة المصلية أقل باستمرار من 10 بيكوغرام / مل في كلا النظامين (معامل ارتباط توافق لين = 0.972 ، الشكل 5 ج). وبالمثل ، أسفر تحفيز pp65 للدم من المتبرعين الإيجابيين للمضخم للخلايا عن متوسط تركيزات IFN-γ يبلغ 258 بيكوغرام / مل و 272 بيكوغرام / مل في أنظمة WB و WBS ، على التوالي ، في حين شوهد الحد الأدنى من إفراز IFN-γ الناجم عن pp65 في كلا النظامين باستخدام عينات سالبة المصل (معامل ارتباط التوافق لين = 0.953 ، الشكل 5 ج).
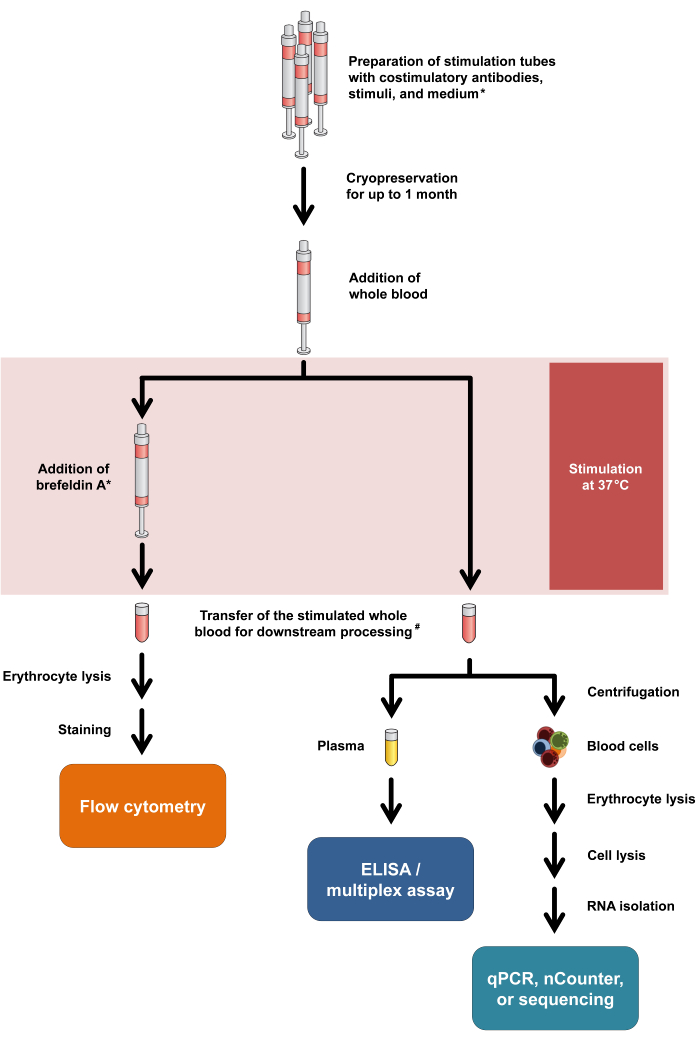
الشكل 1: مخطط انسيابي يلخص الإجراءات التجريبية والقراءات. تعني علامة النجمة أن Brefeldin A مطلوب لبعض علامات تنشيط الخلايا التائية (على سبيل المثال ، CD154) وتلوين السيتوكين داخل الخلايا. انظر خطوتي البروتوكول 2.5 و 2.6. #: يتم نقل الدم لقياس التدفق الخلوي في البداية إلى أنابيب الطرد المركزي سعة 15 مل لتحلل كريات الدم الحمراء ، بينما يتم نقل الدم لمقايسات السيتوكين والنسخ إلى أنابيب الطرد المركزي الدقيقة سعة 1.5 مل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحلل كريات الدم الحمراء. بعد إعادة تعليق الدم المحفز في (أ) محلول تحلل كريات الدم الحمراء ، يتم احتضانه حتى (ب) يبدو السائل صافيا ، ولكن ليس أكثر من 6 دقائق. (ج) عند استخدام أنبوب متدرج سعة 15 مل ، يجب أن يصبح مقياسه مرئيا من خلال العينة الشفافة بشكل متزايد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
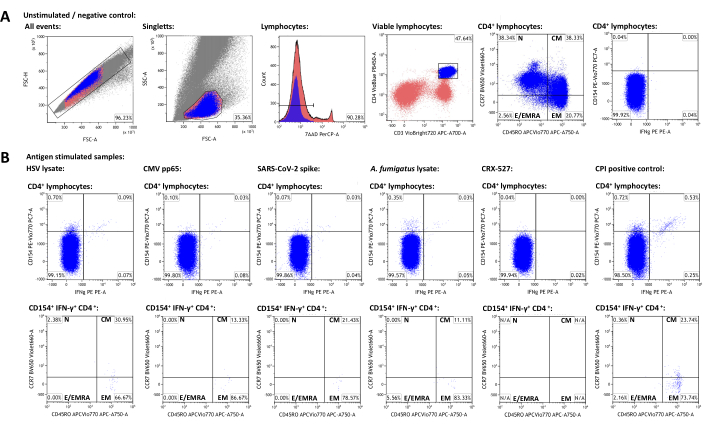
الشكل 3: مجموعة البيانات التمثيلية ومخططات بوابات التدفق الخلوي. (أ) يتم تحديد الأحداث الفردية بواسطة خصائص FSC-A و FSC-H. من بين هؤلاء ، يتم بوابات الخلايا الليمفاوية باستخدام FSC-A و SSC-A. تتمايز الخلايا الليمفاوية إلى خلايا CD3 + CD4 + T-helper. تستخدم مستويات تعبير CD45RO و CCR7 للتنميط الظاهري لمجموعات خلايا الذاكرة والمستجيب. تم استخدام IFN-γ و CD154 كعلامات تنشيط. تم تعيين البوابات بناء على IFN-γ-CD154- في العينة غير المحفزة. تم نقل البوابات لاحقا إلى العينات المحفزة (ب). تم تحقيق توصيف مجموعات الذاكرة للخلايا التائية المنشطة عن طريق نقل البوابة الرباعية CCR7 / CD45RO من مجموعة CD3 + CD4 + إلى مجموعات IFN-γ + CD154 + CD3 + CD4 +. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
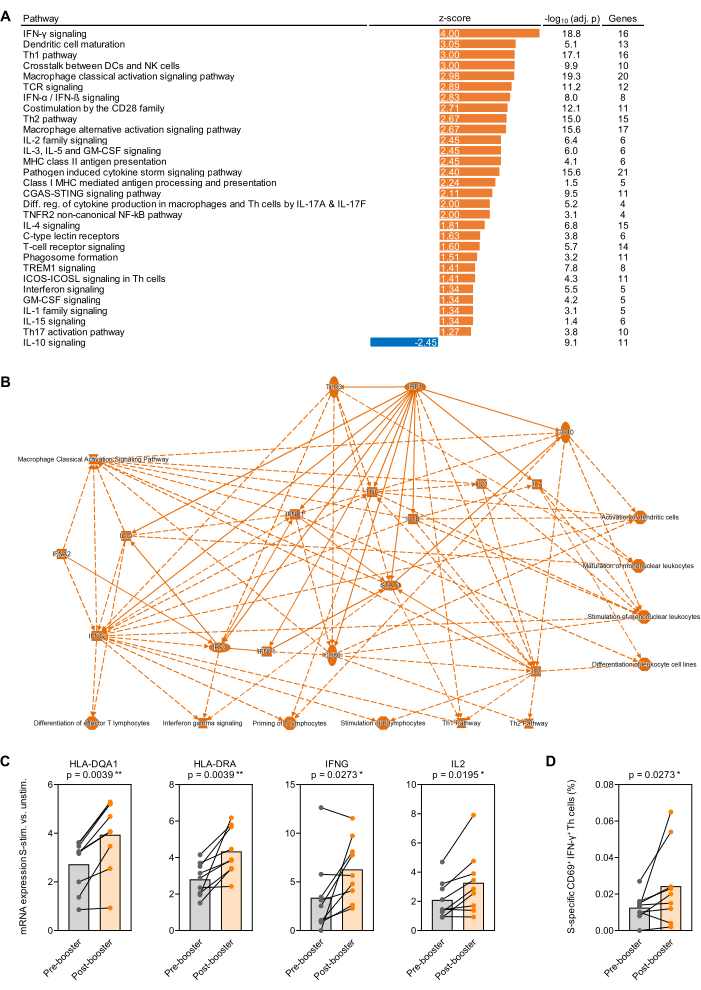
الشكل 4: تغييرات النسخ الناجمة عن المستضد بعد التطعيم المعزز ل SARS-CoV-2. (أ) تم تحليل التخصيب المعدل للخلفية لمسارات النسخ في بروتين سبايك SARS-CoV-2 (Prot_S) المحفز بالدم الكامل بعد التطعيم المعزز BNT162b2 mRNA (الأول) قبل 9 أشخاص بالغين أصحاء. يتم عرض المسارات الكنسية المتعلقة بالمناعة مع Benjamini-Hochberg المعدلة (BH-adj.) قيمة p <0.05 (-log10 [BH-adj. p] >1.3) ودرجة z المطلقة >1.25. (ب) شبكة مبسطة تلخص الجينات والمسارات المخصبة بقوة أكبر في الدم الكامل المحفز ب S بعد التطعيم المعزز مقابل قبله. (ج) مستويات التعبير المعدلة في الخلفية للجينات التمثيلية المرتبطة بعرض المستضد وتنشيط الخلايا التائية في الدم الكامل المحفز Prot_S قبل التطعيم المعزز وبعده. اختبار ويلكوكسون المزدوج. (د) الترددات المصححة في الخلفية للخلايا التائية IFN-γ + CD69 + الخاصة Prot_S قبل التطعيم المعزز وبعده. اختبار ويلكوكسون المزدوج. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
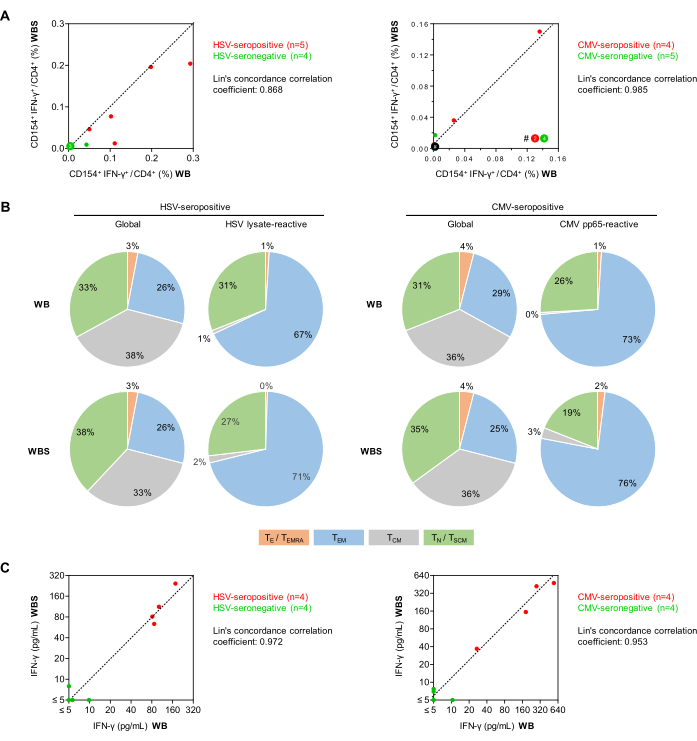
الشكل 5: تفاعل الخلايا التائية المضادة للفيروسات في قياس التدفق الخلوي و ELISA. (أ) يتم عرض مخططات الارتباط لترددات الخلايا التائية CD154 + IFN-γ + / CD3 + CD4 + (قياس التدفق الخلوي) من فحوصات الدم الكامل (WB) والحجم الصغير (WBS). تمثل النقاط الخضراء والحمراء الأشخاص الذين يعانون من سلبية المصل والإيجابية المصلية للفيروس المختبر ، على التوالي. (ب) باستخدام تقييم قياس التدفق الخلوي لتعبير CD45RO و CCR7 ، تم تحديد الأنماط الظاهرية للخلايا التائية للذاكرة / المستجيب بين الخلايا التائية العالمية CD3 + CD4 + والخلايا التائية IFN-γ + CD154 + CD3 + CD4 + بعد التحفيز باستخدام محللة فيروس الهربس البسيط أو CMV pp65 باستخدام دم من متبرعين إيجابيين مصلية (ن = 5 و 4 ، على التوالي). يتم عرض متوسط التوزيعات. أخضر: الخلايا التائية الساذجة (TN) ، CD45RO-CCR7 +. رمادي: خلايا تائية للذاكرة المركزية (TCM) ، CD45RO + CCR7 +. الأزرق: خلايا T للذاكرة المستجيب (TEM) ، CD45RO + CCR7-. برتقالي: الخلايا التائية المستجيب والخلايا التائية الذاكرة المستجيبة تعيد التعبير عن CD45RA (TE / TEMRA) ، CD45RO-CCR7-. (ج) مخططات الارتباط لإطلاق IFN-γ المصحح في الخلفية (ELISA) المقاسة باستخدام فحوصات WB و WBS. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: محتويات أنبوب التحفيز. يتم تلخيص تركيزات مخزون المحفزات والمذيبات. يتم إجراء فحص الدم الكامل (WB) على نطاق واسع باستخدام 500 ميكرولتر من الدم الكامل بالهيبارين بالليثيوم ، بينما تتطلب النسخة الصغيرة (WBS) 250 ميكرولتر فقط من الدم. بالنسبة إلى هيكل تنظيم العمل، تكون جميع وحدات تخزين الكاشف نصف وحدات تخزين هيكل العمل. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: البيانات الديموغرافية للأشخاص البالغين الأصحاء التي تم أخذ عينات منها لإنشاء مجموعات البيانات التمثيلية. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 3: لوحة قياس التدفق الخلوي التمثيلية لتحليل الخلايا التائية. تم استخدام لوحة قياس التدفق الخلوي هذه لإنشاء مجموعة البيانات التمثيلية. النتائج موضحة بالتفصيل في الشكل 3. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 4: لوحات قياس التدفق الخلوي المنشورة سابقا. تم نشر البيانات التي تستخدم مجموعات الأجسام المضادة هذه سابقا بواسطة Tappe et al.24. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
توفر المقايسات المناعية الخاصة بالمستضد نظرة ثاقبة حول التفاعلات بين المضيف والميكروب ، وهي محورية لأبحاث التطعيم والعلاج المناعي ، ويتم التعرف عليها بشكل متزايد على أنها طرائق تشخيصية وتنبؤية في المرضى الذين يعانون من عدوى انتهازية35. يصف هذا البروتوكول نظام تحفيز مستضد سهل يسمح بتحليل قوي ومتعدد الوسائط للمناعة الخاصة بالمستضد باستخدام الحد الأدنى من أحجام الدم (250-500 ميكرولتر لكل مستضد). أسفر البروتوكول المصغر البالغ 250 ميكرولتر عن ارتباط ممتاز بين ترددات الخلايا التائية الخاصة بالمستضد والأنماط الظاهرية وإنتاج السيتوكين عند مقارنته ببروتوكول 500 ميكرولتر الذي تم إنشاؤه مسبقا. على الرغم من توفر حلول صغيرة الحجم لبعض خطوات معالجةالعينات 36 ، على حد علم المؤلفين ، لا يوجد نظام تجاري متاح حاليا يمكنه دعم تحفيز المستضد والتحليل الوظيفي متعدد الأوجه للاستجابات المناعية الوظيفية التي تحركها الخلايا التائية عن طريق قياس التدفق الخلوي ، ومقايسات إطلاق السيتوكين ، والنسخ من أحجام الدم 250-500 ميكرولتر. يستخدم النظام التجاري الأكثر استخداما الذي يسهل مجموعة مماثلة من التطبيقات البحثية حجم دم 1 مل في بيئة تحفيز 3 مل ، مما يؤدي إلى تكلفة أعلى بكثير وكميات المستضدات اللازمة مقارنة بالبروتوكول المقدم هنا13،14،15.
على الرغم من التحسين المستمر للبروتوكولات القائمة على الدم الكامل للقياس الكمي للتدفق الخلوي للخلايا التائية الخاصةبالمستضد 6،37،38 ، فإن قياسات قياس التدفق الخلوي لها عيوب عديدة. على وجه الخصوص ، لا تزال شاقة بطبيعتها ويصعب توحيدها بسبب التباين الكبير بين المشغلين (على سبيل المثال ، عملية البوابات الذاتية) وإعدادات المعدات المختلفة ، وبروتوكولات التعويض ، ومعلمات الاستحواذ بين المختبرات. على الرغم من أن التقارير الموحدة39 واستخدام برامج التحليل والبوابات الآلية قد يحسن توحيد وقابلية المقارنة لمجموعات البيانات متعددة الألوان المعقدةبشكل متزايد 40،41 ، فقد تم تصميم بروتوكول التحفيز الموصوف هنا لاستيعاب مختلف طرائق القراءة غير التدفقية الخلوية.
على وجه الخصوص ، يمكن إجراء فحوصات إطلاق السيتوكين بوقت عملي منخفض ومعدات غير مكلفة نسبيا ، وغالبا ما يتم توحيدها بسهولة للتطبيقات السريرية الروتينية. علاوة على ذلك ، كما هو موضح في الدراسات السابقة باستخدام هذا البروتوكول ، يمكن قياس العديد من استجابات السيتوكين من الحد الأدنى من أحجام العينات باستخدام فحوصات متعددة الإرسال الحديثة ، مما يسمح بتنميط توقيعات السيتوكين المعقدة في إعدادات البحث24،42. وتجدر الإشارة إلى أن هذا البروتوكول القوي مع التحفيز المشترك المزدوج يسهل القياس الكمي الموثوق به لاستجابات السيتوكين الخاصة بالمستضد في المرضى غير اللمفاويين (>800 خلية ليمفاوية / ميكرولتر دم) ، حتى في أولئك الذين يتلقون تثبيط المناعة علاجيالمنشأ 26،34. كعيب في فحوصات إطلاق السيتوكين ، خاصة في مرضى قلات الكريات البيض ، لا يمكن إرجاع السيتوكينات المفرزة إلى مجموعات الخلايا الفردية. في بعض الحالات ، يمكن تخفيف ذلك عن طريق استخدام محفزات خاصة بالخلايا ، إن وجدت. ومع ذلك ، قد تكون هناك حاجة إلى مزيج من تركيزات السيتوكين مع طرائق القراءة الأخرى و / أو تعديل استجابات السيتوكين بناء على أمراض الدم السريرية (أي تعداد الدم الكامل مع تمايز الكريات البيض). والجدير بالذكر أن البروتوكول المقدم هنا يسمح بمزيج من قراءات السيتوكين وتوقيعات النسخ من نفس العينة ، مما يسمح بتحليل متوافق لعلامات تنشيط النسخ المحددة جيدا والتي قد تضيف سياقا خلويا وخصوصية إلى توقيعات السيتوكين العالمية.
ستكون الخطوة المستقبلية نحو التوحيد القياسي الكامل والتطبيق العملي السريري الأفضل هي الأتمتة الكاملة لهذه المقايسات من معالجة العينات إلى قراءة التحليل. على الرغم من أن العزل الآلي الدقيق لمجموعات الخلايا الفردية قد تم إنشاؤهبنجاح 43،44 ، إلا أن تحليل الخلايا التائية الخاصة بالمستضد لا يزال يتطلب من موظفي المختبر اتخاذ خطوات معالجة متقطعة. ومع ذلك ، فإن إغفال عزل الخلايا والتعامل مع PBMC الضعيفة واستخدام أنابيب التحفيز التجارية المتوافقة مع الأتمتة قد يسهل تنفيذ تدفقات عمل بسيطة مؤتمتة بالكامل تعتمد على الدم الكامل للمقايسات المناعية الوظيفية.
إجمالا ، تحمل البروتوكولات متعددة الاستخدامات القائمة على الدم الكامل ، مثل البروتوكول الوارد هنا ، وعدا كبيرا بتوسيع تطبيقات المقايسات المناعية الوظيفية الخاصة بالمستضد إلى مجموعات جديدة من المرضى ومجالات البحث ، بما في ذلك الدراسات قبل السريرية على الصغيرة. المقايسات المناعية الوظيفية الخاصة بالمستضد غير مجدية حاليا إلى حد كبير في نماذج الفئران أو تتطلب تجميع الدم من العديد من و / أو استخدام مستخلصات الخلايا غير الموحدة مثل خلايا الطحال. بالنظر إلى الاهتمام الناشئ بالتدخلات العلاجية المناعية لتعزيز دفاع المضيف ضد العدوى الانتهازية (على سبيل المثال ، مثبطات نقاط التفتيش المناعية ، وعوامل النمو المكونة للدم ، والسيتوكينات ، وما إلى ذلك) والزيادة في تقنيات التطعيم المبتكرة ، من المتوقع أن تلعب المقايسات المناعية الوظيفية الخاصة بالمستضد دورا متزايدا في كل من أبحاث الأمراض المعدية قبل السريرية والتطبيقات السريرية في مجموعات متنوعة من المرضى. قد يسهل نظام تحفيز المستضد القوي وغير المكلف وسهل الاستخدام ومنخفض الحجم المعروض هنا إجراء تحليلات مناعية شاملة خاصة بالمستضد في المناطق غير المستغلة. علاوة على ذلك ، فإن متانة ما قبل التحليل لهذا البروتوكول السهل قد تخلق فرصا لتحسين دمج تطبيقات المقايسة المناعية في الروتين السريري ، مما يسمح لنا بالاقتراب خطوة واحدة من الإدارة الشخصية التي تعتمد على المؤشرات الحيوية للأمراض المعدية.
Disclosures
لا يوجد تضارب في المصالح يجب أن يفصح عنه المؤلفون.
Acknowledgements
نشكر أقسام الكيمياء السريرية وأمصال العدوى في معهد الطب المخبري وعلم الأحياء الدقيقة ، مستشفى جامعة أوغسبورغ ، على إجراء قياسات الأجسام المضادة في الدم. نشكر الدكتورة فريدريك ليش ستارنيكر ومعهد علم الأمراض والتشخيص الجزيئي التابع لمستشفى جامعة أوغسبورغ على توفير مرافق النسخ. نشكر ماري فريتاغ من مستشفى جامعة أوغسبورغ على تقديم الدعم في الخدمات اللوجستية للفقاحات والحصول على العينات. نشكر الدكتور أولاف كنيماير ومعهد هانز نويل في جينا ، ألمانيا ، على توفير محلول الرشاشيات fumigatus . دعمت هذا العمل مبادرة البحث Bay-VOC (رقم التمويل GE2-2452-200-D37666 / 2022) ، ووزارة العلوم والفنون في ولاية بافاريا ، وكذلك جامعة أوغسبورغ بألمانيا.
Materials
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
References
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved