Method Article
בדיקת דם מלא עם גירוי משותף כפול לניתוח ספציפי לאנטיגן של חסינות המארח לפתוגנים פטרייתיים ונגיפיים
* These authors contributed equally
In This Article
Summary
בדיקות חיסוניות מבוססות דם מלא מספקות כלי קל וחסכוני במשאבים לניתוח חסינות ספציפית לאנטיגן למטרות אבחון ומחקר. מאמר זה מספק פרוטוקול אופטימלי מבוסס דם מלא עם גירוי משותף כפול לניתוח מקיף של חסינות המאכסן לפתוגנים פטרייתיים ונגיפיים, כולל גרסה בנפח נמוך עבור חולים ילדים ובעלי חיים קטנים.
Abstract
עיבוד דגימות מהיר וחסכוני במשאבים, תפוקה גבוהה ועמידות גבוהה הם קריטיים ליישום מדעי וקליני יעיל של בדיקות חיסוניות מתקדמות ספציפיות לאנטיגן. באופן מסורתי, בדיקות חיסוניות כאלה, במיוחד ניתוח תאי T ספציפיים לאנטיגן על ידי ציטומטריית זרימה או בדיקות נקודה אימונוסורבנטיות מקושרות אנזים, מסתמכות לעתים קרובות על בידוד של תאים חד-גרעיניים היקפיים בדם. תהליך זה גוזל זמן, נתון לגורמים מבלבלים פרה-אנליטיים רבים, ודורש נפחי דם גדולים. בדיקות דם מלא מספקות חלופה קלה עם חוסן טרום אנליטי מוגבר ודרישות נפח דם נמוכות יותר. יתר על כן, בדיקות מבוססות דם מלא מאפשרות שימור של אינטראקציות בין-תאיות שאינן נלכדות על ידי בדיקות באמצעות תת-קבוצות תאים מבודדות. לאחרונה, הוצע חיסון מזוקק בדם מלא עם גירוי משותף כפול נגד CD28 ו- anti-CD49d לניתוח מקיף של תפקודי תאי T ספציפיים לאנטיגן ואינטראקציות בין-תאיות מורכבות בתגובה לאנטיגנים פטרייתיים ונגיפיים שונים. פרוטוקול זה מספק הדרכה להכנת צינורות גירוי, גירוי דם ועיבוד דגימות במורד הזרם עבור ציטומטריית זרימה, בדיקות הפרשת ציטוקינים וניתוחי שעתוק. זה כולל פרוטוקול מאומת ושווה ערך מבחינה תפקודית, שלא פורסם בעבר, בנפח נמוך (250 μL) כדי להפוך את ניטור תאי T ציטומטרי וציטוקיני לנגיש יותר למחקרים בחולים ילדים או למחקרים פרה-קליניים בבעלי חיים קטנים (למשל, עכברים). בסך הכל, פרוטוקולים אלה מספקים ארגז כלים רב-תכליתי לניתוח חיסוני מורכב ספציפי לאנטיגן הן במסגרות מחקר קליניות והן במסגרות מחקר תרגומיות.
Introduction
כימות ואפיון של חסינות ספציפית לאנטיגן, במיוחד תגובות ספציפיות של תאי T, הוא חיוני למחקר אימונוביולוגיה וחיסונים, כמו גם לכמה בדיקות אבחון. באופן מסורתי, בדיקות חיסוניות ספציפיות לאנטיגן הסתמכו בדרך כלל על תאי דם חד-גרעיניים היקפיים מבודדים (PBMCs). עם זאת, בידוד של תאים אלה גוזל זמן ומשאבים רבים ולעתים קרובות דורש נפחי דם גדולים יחסית. בנוסף, כדי למנוע הפעלת גרנולוציטים והפרעה בתאי T לאחר מכן במהלך אחסון טרום אנליטי1 עיבוד מהיר של הדגימות הוא בעל חשיבות עליונה, אשר לעתים קרובות אינו אפשרי בפרקטיקה הקלינית. מגבלות אלה פוגעות בישימות של בדיקות חיסוניות ספציפיות לאנטיגן בתרחישי מחקר בעלי תפוקה גבוהה ובשגרות קליניות. לכן, הפיתוח של גישות קלות לשימוש ואוטומטיות מבוססות דם מלא בשנים האחרונות פתח תחומים חדשים של יישומי immunoassay. עם זאת, המערכות המסחריות הנוכחיות חסרות בדרך כלל סביבות גירוי משותף אופטימליות עבור תאי T והן רגישות לעיכובים פרה-אנליטיים. לדוגמה, לבדיקת שחרור IFN-γ מבוססת דם מלא נפוצה יש שיעור המרה חיובי לשלילי של 19% לאחר 6 שעות של אחסון דם טרום אנליטי2. פרוטוקולים ממוטבים עם גירוי משותף כפול של anti-CD28 ו- anti-CD49d פותחו כדי להתגבר על מגבלות אלה 3,4,5,6.
הפרוטוקול המוצג כאן מאפשר כימות ואפיון מדויקים וניתנים לשחזור של תאי T ספציפיים לאנטיגן, הערכה של תגובות ציטוקינים המושרות על ידי אנטיגן, וסמנים חיסוניים פונקציונליים אחרים (זרימה ציטומטרית או שעתוק) מנפח דם מינימלי, כלומר 500 מיקרוליטר דם לכל צינור גירוי. יתרונות נוספים של פרוטוקול זה כוללים זמן ידיים נמוך, עמידות גבוהה למבלבלים פרה-אנליטיים, ושימור אינטראקציות בין-תאיות תפקודיות בסביבה פיזיולוגית יחסית ex-vivo . יכולת ההשוואה של אפיון תאי T ציטומטריים ספציפיים לאנטיגן עם נתונים המופקים מבדיקות מסורתיות מבוססות PBMC הוצגה בעבר בהקשר של כימות תאי T ספציפיים לעובש6. יתר על כן, גירוי ישיר של הדם של הנבדקים מבטל את הצורך בתוספת עם סרום אוטולוגי, אלוגני או אפילו קסנוגני הנדרש בדרך כלל לגירוי PBMC אופטימלי. השמטת בידוד התאים מפחיתה גם את לחץ הגזירה והטמפרטורה, ובכך משפרת את יכולת הקיום של התא. והכי חשוב, בדיקות דם שלמות משמרות אוכלוסיות גרנולוציטים שאבדו במהלך צנטריפוגה הדרגתית לצורך בידוד PBMCs7. בכך, מערך בדיקה זה משמר ולוכד לולאות אינטראקציה פונקציונליות בין גרנולוציטים ותאים חד-גרעיניים4.
יש לציין כי פרוטוקול זה דורש שינויים מינימליים בלבד כדי להתאים לאופני קריאה שונים ואף מאפשר ניתוח כפול של שחרור ציטוקינים ותגובות שעתוק מאותו צינור גירוי. באופן ספציפי, בעוד ציטוקינים מנותחים מן supernatant תרבית לאחר גירוי, גלולת התא יכול לשמש לבידוד RNA עם ניתוח transcriptomic לאחר מכן. זרימת העבודה הכללית עבור אופני הקריאה השונים מסוכמת באיור 1.
בשנים האחרונות, מספר גדל והולך של בדיקות מבוססות דם מלא פותחו עבור ניטור חיסוני תגובתי פתוגן במסגרות מחקר וקליניות, למשל, עבור Mycobacterium tuberculosis 8,9, Bordetella pertussis3, Orientia tsutsugamushi10, ו- SARS-CoV-2 5,11,12. לדוגמה, מערכת שהוקמה בעבר שימשה עבור אנטיגנים מרובים, כולל שחפת, נגיף שפעת A ו- SARS-CoV-2, אך אינה משתמשת בגורמים ממריצים משותפים הממוטבים לגירוי תאי T-helper (Th) 13,14,15. אף על פי שנפח הדם הנדרש לבדיקות אלה כבר נמוך משמעותית מזה המשמש לבדיקות מסורתיות מבוססות PBMC או ערכות מסחריות לגירוי דם מלא, נפח דגימה קטן עוד יותר עשוי להיות מוצדק ליישומים ברפואת ילדים, ניאונטולוגיה, חולים ביחידה לטיפול נמרץ (ICU) ומחקר פרה-קליני במודלים של בעלי חיים קטנים. לדוגמה, אפילו דגימת דם סופנית מעכברים (למשל, על ידי ניקוב לב) מניבה בדרך כלל מקסימום של 0.7-1 מ"ל דם. לפיכך, האפשרות לצמצם עוד יותר את פרוטוקולי החיסון מבוססי הדם המלא 4,6 שנקבעו בעבר לכימות ואפיון מדויקים של תגובות תאי T תגובתיים לאנטיגן מנפח דם של 250 מיקרוליטר לכל צינור גירוי הוערכה כחלק מפרוטוקול זה.
Protocol
המועצה האתית של אוניברסיטת לודוויג מקסימיליאן במינכן (פרויקט מספר 21-0689) אישרה את איסוף דגימות הדם האנושיות. בנוסף, חלקים ממערכי הנתונים המייצגים נוצרו תחת קורונה-רישום-מחקר מספר 20-426, שאושר גם על ידי ועדת האתיקה של אוניברסיטת לודוויג מקסימיליאן במינכן. התקבלה הסכמה מדעת.
1. הכנת צינורות גירוי דם שלם
הערה: שלב זה נלקח מ Lauruschkat et al.4 ו Weis et al.6. טבלה 1 מסכמת ריכוזים ונפחים מפורטים של ריאגנטים.
- בתנאים סטריליים (שולחן עבודה סטרילי), הכינו צינורות איסוף דם של 2.7 מ"ל ללא נוגדי קרישה, עם אנטיגנים ונוגדנים ממריצים משותפים. הוסף 1 מיקרוגרם/מ"ל של α-CD28 ו-1 מיקרוגרם/מ"ל של α-CD49d לכל צינור, כולל הבקרה השלילית. שקול את נפח הדם שיש להוסיף לגירוי דם שלם בעת קביעת הריכוזים הסופיים (250 μL או 500 μL). כדי לשמור על הגיאומטריה של התא ועל נגישות הדגימה, אין להוציא את הבוכנה מצינור איסוף הדם.
- בהתבסס על תכנון המחקר, קבע אם צינורות הבקרה השליליים לא צריכים להכיל גירוי נוסף (בקרת רקע לא מגורה, כפי שמוצג בטבלה 1) או להשתמש באנטיגנים שקבוצת המחקר לא צריכה להכיל תאי T ספציפיים לאנטיגן או מינימליים (למשל, מאגר פפטידי HIV באנשים סרונגטיביים ל- HIV 16).
- עבור גירוי ספציפי לאנטיגן, מטב את הריכוזים האידיאליים של אנטיגנים על ידי טיטרציה בניסויים מקדימים. כדי להפיק את הנתונים המייצגים להלן, השתמש בריכוזי האנטיגן הממוטבים הבאים: 1.2 מיקרוגרם/מ"ל HSV-1 ליזט, 0.6 ננומטר/פפטיד/מ"ל CMV pp65, 0.6 ננומטר/פפטיד/מ"ל SARS-CoV-2 Prot_S, 50 מיקרוגרם/מ"ל Aspergillus fumigatus lysate ו-1 ng/mL CRX-527.
- כלול בקרה חיובית, במיוחד עבור מחקרים בחולים לימפופנים או אלה המקבלים טיפול תרופתי מדכא חיסון. השתמש בתמיסת בקרה חיובית למדד המחירים לצרכן (0.6 ננומטר/פפטיד / מ"ל), המורכבת מציטומגלווירוס, נגיף פרא-אינפלואנזה ופפטידים של נגיף השפעת.
הערה: לחלופין, ניתן להשתמש בגירויים סינתטיים, כגון PMA (10 מיקרוגרם / מ"ל) ± יונומיצין (1 מיקרוגרם / מ"ל), אך הם גורמים פחות תגובות פיזיולוגיות ויכולים להשפיע על ביטוי של אנטיגנים על פני השטח המשמשים בדרך כלל כסמנים אוכלוסייה עבור ציטומטריית זרימה (בעיקר, CD417). שימו לב כי נוגדנים ממריצים משותפים אינם נחוצים בשילוב עם רוב גירויי הבקרה החיוביים הסינתטיים ואף עלולים להשפיע לרעה על יכולת הקיום וההיענות של התא. - כדי ליצור הרמוניה בין נפחי ריאגנטים על פני כל צינורות הגירוי, הוסף מדיום RPMI 1640 עד לנפחים הכוללים הבאים: בדיקה בקנה מידה מלא עבור ציטומטריית זרימה: 50 μL; בדיקה בקנה מידה מלא לניתוח ציטוקינים ושעתוק ציטוקינים: 500 μL; בדיקה בקנה מידה קטן עבור ציטומטריית זרימה: 25 μL; בדיקה בקנה מידה קטן לניתוח ציטוקינים ושעתוק ציטוקינים: 250 μL.
הערה: להכנת סטים מרובים של צינורות גירוי, מומלץ להכין תערובות מאסטר הכוללות את כל המרכיבים בגלל הסיכון הנמוך יותר לזיהום והנפח הנמוך של גורמים וגירויים קו-גירויים. - השתמש בצינורות מוכנים מיד או cryoלשמר אותם ב -20 ° C. רוב ריאגנטים ניתן לאחסן עד 4 שבועות; עם זאת, אמת מראש תקופות אחסון מרביות עבור ריאגנטים/גירויים חדשים.
2. גירוי ודגירה של דגימות דם שלמות
- כ-30-60 דקות לפני גירוי דם שלם, הפשירו את צינורות הגירוי המוכנים לשימוש ושמרו אותם בטמפרטורת החדר.
- יש לאסוף דם ורידי מהתורם/מטופל באמצעות צינורות איסוף דם עם נוגד קרישה ליתיום הפרין. ודא כי נפח הדם שנאסף עומד בדרישות הניסוי הבודד, כלומר, מינימום של 750 μL נדרש עבור 3 תנאים של הבדיקה בקנה מידה קטן, כולל בקרה שלילית וחיובית. עבור צינורות איסוף הדם שנרכשו באופן מסחרי, מלא אותם לחלוטין כדי להשיג ריכוזי עבודה הפרין של 16 - 25 IU / mL דם.
הערה: הנתונים הדמוגרפיים של הנבדקים הבוגרים הבריאים שגויסו כדי ליצור את מערכי הנתונים המייצגים מוצגים בטבלה 2. - להעביר את הכמות הנדרשת של דם שלם heparinized (250 μL או 500 μL עבור בדיקה בקנה מידה קטן או מלא, בהתאמה) לתוך צינורות גירוי על ידי pipetting מתחת שולחן עבודה סטרילי.
הערה: אם שולחן עבודה סטרילי אינו זמין או בעת עבודה עם דגימות המציגות סיכון מינימלי לזיהום (כלומר, דם של נבדקים אנושיים או בעלי חיים שנבדקו מראש), ניתן להעביר דגימות לצינורות הגירוי באמצעות מזרקים סטריליים. שיטה זו מאפשרת גם עיבוד דגימות ליד המיטה מיד לאחר איסוף הדם, מה שממזער את האחסון הפרה-אנליטי ואת הפגיעה בתאי T. לפני הזרקת הדם, יש לחטא באופן נרחב את חותמות הגומי של צינור איסוף הדם ואת כל צינורות הגירוי באמצעות חומר חיטוי אלכוהולי. הניחו לחומר החיטוי להתייבש למשך דקה אחת לפחות. - בזהירות להפוך את צינורות גירוי 5x-10x. מניחים צינורות גירוי באינקובטור של 37 מעלות צלזיוס. שימו לב שאין צורך בחממת CO2 . כדי למנוע הפעלת נויטרופילים לא ספציפית, אין לקרר את צינור איסוף הדם.
הערה: פרוטוקול זה אומת לאחסון דם טרום אנליטי של עד 8 שעות בטמפרטורת החדר כדי לאפשר העברת דגימה. במידת האפשר, עדיף להזריק דם שלם לצינורות הגירוי במקום האיסוף ולהעביר דם למעבדה מרכזית בצינורות הגירוי, שכן גורמים קו-סטימולטוריים ישפרו את כדאיות הלימפוציטים18,19. - רק עבור דגימות המשמשות לבדיקות ציטומטריות זרימה עם צביעה תוך תאית, יש להוסיף ברפלדין A (ריכוז סופי של 10 מיקרוגרם/מ"ל) לכל צינור גירוי לאחר 4 שעות של דגירה.
- הכינו תמיסה של 1 מ"ג/מ"ל ברפלדין A בסל"ד והוסיפו 1 מיקרוליטר של התמיסה לכל נפח דגימה של 100 מיקרוליטר (כלומר, קוקטייל גירוי מעורבב מראש + נפח דם שלם). מוסיפים ברפלדין A על ידי פתיחת הצינורות ופיפטוף מתחת לשולחן עבודה סטרילי. סיכום והחזרת צינורות לאינקובטור של 37 מעלות צלזיוס למשך 16-18 שעות נוספות ב- 37 מעלות צלזיוס (20-22 שעות בסך הכל).
- לבדיקות הפרשת ציטוקינים או ניתוחי שעתוק, אין להוסיף ברפלדין A ולדגור ברציפות על הדגימות בטמפרטורה של 37°C למשך 24-26 שעות.
הערה: ברפלדין A מעכב את מנגנון גולג'י ובכך מבטל את הפרשת הציטוקינים והובלת חלבונים אל פני התא. מכיוון שהפרשה או ביטוי פני השטח יגרמו בסופו של דבר לאובדן ופירוק חלבונים לאחר הפנמה מחדש, בהתאמה, מעכבי אקסוציטוזה חיוניים להצטברות תוך תאית וצביעה של ציטוקינים ולסמני הפעלה מסוימים (למשל, CD154) למחקרי ציטומטריית זרימה. עם זאת, ברפלדין A משבש גם תהליכים תאיים פיזיולוגיים הנראים בשעתוק ופוסל מבחני הפרשת ציטוקינים מתרבית20,21, מה שמחייב שימוש בשתי מבחנות נפרדות (אחת עם ואחת ללא ברפלדין A) לביצוע קריאות אלה במקביל.
3. הכנת דגימות לציטומטריית זרימה
- הוסף 500 μL של תמיסת 0.5 M EDTA לכל צינור גירוי ודגר על הדגימה במשך 15 דקות בטמפרטורת החדר כדי לנתק תאים דבקים מפני השטח של הצינורות.
- העברת דגימות לצינורות צנטריפוגות חדשים של 15 מ"ל. שטפו את צינורות הגירוי עם 1 מ"ל של חיץ אריתרוציטים ליזה כדי לאסוף את תאי הדם הנותרים, ולאחר מכן הוסיפו את המאגר והתאים לאותם צינורות צנטריפוגות של 15 מ"ל.
- צנטריפוגה את צינורות 15 מ"ל במשך 7 דקות ב 600 x גרם. בזהירות להשליך את supernatant.
- השהו מחדש את כדורית תאי הדם במאגר אריתרוציטים ליזה (איור 2A). השתמש 5 מ"ל של חיץ אריתרוציטים ליזה עבור 500 μL של דם שלם ו 3 מ"ל עבור 250 μL דם שלם.
הערה: יש להעריך מראש תנאי ליזה אופטימליים של אריתרוציטים עבור המאגר הספציפי שבו נעשה שימוש (מוצר ביתי או מסחרי). ההוראות המסופקות כאן הותאמו עבור חיץ אריתרוציטים ליזה המפורטים בטבלת החומרים. - דגרו על דגימות בטמפרטורת החדר עד שהדגימות נראות ברורות (איור 2B). כדי למנוע גרנולוציטים ליזה וצבירה, אין לחרוג מ -6 דקות של דגירה. אינדיקטור לליזה אריתרוציטית מוצלחת הוא היכולת לראות את המספרים ואת קנה המידה בצינור של 15 מ"ל דרך הנוזל (איור 2C).
- צנטריפוגה את צינורות 15 מ"ל במשך 7 דקות ב 600 x גרם. יש להשליך בזהירות את הסופרנטנט, לחזור על שלבים 3.4-3.5 אם גלולת התא עדיין אדומה במידה ניכרת.
- להשעות מחדש את גלולת התא ב 1 מ"ל של HBSS ולהעביר את התאים לתוך 2 מ"ל צינורות תגובה.
- צנטריפוגה את צינורות 2 מ"ל במשך 5 דקות ב 400 x גרם. בזהירות להשליך את supernatant.
- יש לבצע צביעה ציטומטרית בזרימה בהתאם להוראות היצרן לערכת הצביעה התוך תאית ולנוגדנים בהם נעשה שימוש.
הערה: לוח הנוגדנים המשמש ליצירת מערך הנתונים המייצג מסוכם בטבלה 3.
4. הכנת דגימות לבדיקות ציטוקינים
- לאחר שלב 2.6, להעביר את הדם המדולל מן צינורות גירוי לתוך צינורות 1.5 מ"ל.
- צנטריפוגה צינורות 1.5 מ"ל במשך 20 דקות ב 2000 x גרם. הכניסו בזהירות את הסופרנאטנט לצינור טרי של 1.5 מ"ל והשתמשו בו באופן מיידי לניתוח ציטוקינים או לשימור הסופרנאטים בטמפרטורה של -80°C.
- צנטריפוגה את הסופרנאטנט שוב למשך 5 דקות ב ≥ 7000 x גרם (בצינורות 1.5 מ"ל) כדי להסיר פסולת תאים שיורית לפני הניתוח, במיוחד לאחר הפשרה. בהתאם לפרוטוקול בדיקת הציטוקינים, בצע דילול מראש של הדגימות.
- השהה מחדש את כדורית התא ב -1 מ"ל של מאגר הגנת RNA ושמור אותו בהקפאה ב -80 ° C לבידוד RNA לאחר מכן. לחלופין, יש להשהות מחדש את כדורית התא במאגר ליזיס לצורך בידוד RNA מיידי בהתאם להוראות ערכת בידוד הרנ"א (או פרוטוקול פנימי).
הערה: במידת הצורך, בהתאם לפרוטוקול עיבוד הרנ"א הבא, ניתן להוסיף שלב ליזה של כדורית דם הדומה ל-3.4-3.5 לפני הוספת מאגר ההגנה של ה-RNA.
תוצאות
ניתוח רב-מודאלי של תגובות חיסוניות ספציפיות לאנטיגן לאחר גירוי דם שלם עם אנטיגנים הקשורים לפתוגן
כדי ליצור מערך נתונים מייצג, נבחר תורם מבוגר בריא סרופוזיטיב עבור HSV-1 ו- CMV שקיבל חיסונים נגד SARS-CoV-2. בנוסף לבקרה לא מגורה, נעשה שימוש בגירויים הבאים כמתואר לעיל: וירוס הרפס סימפלקס 1 (HSV) ליזט (המלצת היצרן, נתונים שלא פורסמו), ציטומגלווירוס (CMV) pp6522, תסמונת נשימה חריפה חמורה קורונה 2 (SARS-CoV-2) Prot_S 5,23, Aspergillus fumigatus lysate (פתוגן סביבתי בכל מקום)4,24CRX-527 (גירוי קולטן דמוי אגרה 4 המבוסס על ליפופוליסכרידים, שלא אמור להפעיל תאי T בפני עצמו)25, ו-CPI (בקרה חיובית להפעלת תאי T CD4+ המורכבת מ-CMV, נגיף פרא-אינפלואנזה ופפטידים של נגיף השפעת)26., הנתונים הציטומטריים של הזרימה ואסטרטגיית הגאטינג מוצגים באיור 3. באופן כללי, מומלץ למדוד כמה שיותר לימפוציטים כאשר מתמקדים באוכלוסיות תאים נדירות (50,000 - 100,000 לימפוציטים), שכן דיוק ואמינות המדידות תלויים במספר הכולל של האירועים27. הדגימה הלא מגורה משמשת לגירוי של תת-קבוצות תאים בודדות (למשל, תאי CD3+CD4). יש להגדיר את השערים עבור CD45RO ו- CCR7 עבור פנוטיפ תאי T של זיכרון על כלל אוכלוסיית CD3+CD4+ ולאחר מכן להעביר לאוכלוסיות סמן ההפעלה החיוביות, מכיוון שמספרי האירועים הנמוכים על האחרונים מונעים לעתים קרובות זיהוי ברור של אוכלוסיות מובחנות. ייתכן שיהיה צורך בהתאמות קלות עבור שערים בודדים, למשל, כדי להסביר הבדלים בכדאיות הלימפוציטים. Upregulation של CD154 (או ליגנד CD40) תואר כסמן הפעלה גלובלי, עקבי ומושרה במהירות של תאי T-helper28,29. IFN-γ נחשב לאחד מסמני ההפעלה הבולטים והספציפיים ביותר של תאי Tמסוג 1 30,31. חשוב לציין כי בדיקה זו נבדקה ופורסמה עם סמני הפעלה, תשישות וציטוקינים נוספים שונים (ראו טבלה 4 ו-24).
תדירויות של אוכלוסיות סמן הפעלה חיוביות במדגם הלא מגורה מייצגות רקעים לא ספציפיים והופחתו מתדרים מעוררי אנטיגן. לאחר חיסור של רקע לא ספציפי, לתורם המייצג היו 0.75% (HSV), 0.09% (CMV), 0.06% (SARS-CoV-2), 0.34% (A. fumigatus), 0.00% (CRX-527) ו- 1.21% (CPI) ספציפיים CD154+/CD3+CD4+ T-helper, בהתאמה. ביטוי IFN-γ ניתן לנתח באופן דומה, וכתוצאה מכך 0.12% (HSV), 0.07% (CMV), 0.03% (SARS-CoV-2), 0.04% (A. fumigatus), 0% (CRX-527) ו- 0.74% (CPI) IFN-γ+/CD3+CD4+ תאים.
ניתן לחלק את אוכלוסיות תאי T לתאי T נאיביים (TN, CD45RO-CCR7+), תאי T מרכזיים של זיכרון (TCM, CD45RO+CCR7+), תאי T של זיכרון אפקט (T EM, CD45RO+CCR7-), ותאי T משפיעים (ותאי T של זיכרון אפקט המבטאים מחדש CD45RA, TE/TEMRA, CD45RO-CCR7-). בקרב תאי T גלובליים CD3+CD4+, לתורם המייצג היו 38.34% TN, 38.33% TCM, 20.77% TEM ו-2.56% TE/TEMRA, בהתאמה, כפי שנקבע באמצעות הדגימה הבלתי מגורה (איור 3A). עם זאת, בקרב תאי T-helper תגובתיים ספציפיים לאנטיגן (CD154+IFN-γ+), TCM ו- TEM היו ללא ספק תת-הקבוצות הבולטות ביותר, עם אמצעים של 22.14% ו- 73.97%, בהתאמה.
נתונים על אוכלוסיות לויקוציטים נוספות פורסמו בעבר במתודולוגיה זו24. שילובי הנוגדנים בהם נעשה שימוש מוצגים בטבלה 4 להתייחסות נוספת.
יתר על כן, כדי להראות את מלוא הפוטנציאל של מתודולוגיה זו, IFN-γ ELISA בוצע על קבוצה שנייה של דגימות מגורות (ללא תוספת של brefeldin A). כדי למנוע חריגה מטווח הזיהוי של ערכת IFN-γ ELISA, פלזמה מדגימות מעוררות CPI דוללה מראש ביחס של 1:4. ריכוזי IFN-γ הבאים נמדדו ונורמלו למ"ל מנפח הדם של הנבדק, כלומר תוקנו לדילול הן בצינורות הגירוי והן בדילול טרום ELISA: 0 pg/mL (לא מגורה), 69.4 pg/mL (HSV), 471 pg/mL (CMV), 17.8 pg/mL (SARS-CoV-2), 61.9 pg/mL (A. fumigatus), 34.0 pg/mL (CRX-527) ו-1958 pg/mL (CPI).
לבסוף, RNA בודד מאותן דגימות עם תוצאות עקביות. התפוקה הממוצעת הייתה 719 ננוגרם, כאשר יחס ספיגה ממוצע של 260 ננומטר/280 ננומטר היה 1.98.
בסך הכל, מערך נתונים זה ממחיש כי הפרוטוקול המוצג מאפשר ספקטרום קריאה רב-גוני וניתוח במקביל של אנטיגנים שונים הקשורים לזיהום באמצעות נפח דם מינימלי, כלומר, 8 מ"ל בסך הכל עבור גירויים מרובים ושיטות קריאה.
מערך נתונים מייצג לניתוחי שעתוק למעקב אחר תגובת החיסון באמצעות דם שלם מגורה אנטיגן
כהוכחה עקרונית למחקרי שעתוק שבוצעו על דם שלם מגורה אנטיגן, דם נאסף מ -9 נבדקים בוגרים בריאים מיד לפני וחודש לאחר חיסון הדחף הראשון עם BNT162b2 (חיסון mRNA SARS-CoV-2)32,33 7-9 חודשים לאחר סדרת החיסונים הראשונית בשתי מנות. תפוקת הרנ"א הממוצעת מ-500 מיקרוליטר של דם שלם לא מגורה ו-Prot_S מגורה הייתה 1.1 מיקרוגרם של רנ"א טהור ביותר, עם יחס ספיגה ממוצע של 260/280 של 1.99. לאחר ניתוח nCounter, ספירות הרנ"א נורמלו ל-12 הגנים של הפאנל (ממוצע גיאומטרי). לאחר מכן, נקבע היחס בין ספירות mRNA מנורמלות בדגימות עם גירוי Prot_S לעומת בקרות רקע לא מגורות עבור כל נבדק וגן. נקבע יחס חציוני לחציוני של מדידות לאחר החיסון לעומת לפני החיסון, וניתוח העשרת מסלולים בוצע באמצעות חבילת התוכנה המפורטת בטבלת החומרים. העשרה של מסלולים קנוניים נחשבה משמעותית בערך ציון z מוחלט ≥ 1.25 וערך p מותאם של בנימיני-הוכברג < 0.05. מסלולים מועשרים שונים באופן משמעותי מסוכמים באיור 4A, ורשת מפושטת של שינויים מותאמים לרקע בתגובה Prot_S לאחר החיסון לעומת לפני החיסון מוצגת באיור 4B. נוסף על כך, השראות חזקות יותר של גנים מייצגים הקשורים להבשלת תאים מציגי אנטיגן והפעלת תאי T המושרה על ידי Prot_S לאחר חיסון דחף מוצגת באיור 4C (p < 0.01-0.03). לבסוף, עלייה בתאי T-helper מותאמים Prot_S לרקע מסוג 1 (CD69+IFN-γ+) לאחר החיסון ברוב התורמים אושרה על-ידי ציטומטריית זרימה באמצעות קבוצה שנייה של צינורות גירוי (p = 0.03, איור 4D).
השוואה בין תגובות תאי T תגובתיות לווירוס בפרוטוקולי בדיקות חיסוניות מבוססות דם מלא ונפח קטן
לאחר מכן, התדרים של תאי T-helper מגיבי לווירוס CD154+IFN-γ+ (תאי CD3+CD4+ ) במתנדבים בריאים הושוו באמצעות פרוטוקולי גירוי אנטיגן דם מלא (500 μL, WB) ונפח קטן (250 μL, WBS) (איור 5). כפי שדווח בעבר34, תדרי רקע מינימליים לא ספציפיים של תאי CD154+IFN-γ+ נראו עם כל אחד מהפרוטוקולים למרות גירוי משותף כפול (פירוש, 0.010% ו-0.011% עבור WB ו-WBS, בהתאמה). יש לציין כי למרות שתגובות רקע לא ספציפיות מופחתות מתגובות ספציפיות לאנטיגן, הן עדיין תורמות לחוסר דיוק מוגבר במבחנים, כפי שנדון קודם לכן27. אותות רקע גבוהים (כלומר, >0.07-0.1% CD154+ תאי Th או >0.05% CD154+IFN-γ+ תאים) יכולים להצביע על זיהום דגימה, זיהום חריף של הנבדק, או יכולים להיות תוצאה של טיפול לא הולם בדגימה פרה-אנליטית.
התדרים הממוצעים של תאי T תגובתיים ליזט HSV בתורמים סרופוזיטיבים (n = 5) היו 0.151% ו-0.107% במערכות WB ו-WBS, בהתאמה, בהשוואה ל-0.012% ו-0.004% בתורמים סרונגטיביים (n = 4). עם מאגר הפפטידים CMV pp65, לתורמים סרופוזיטיבים (n = 4) היו 0.041% ו- 0.049% תאי T תגובתיים בהשוואה ל- 0.001% ו- 0.004% בתורמים סרונגטיביים (n = 5). מקדמי מתאם הקונקורדנציה של לין היו 0.868 עבור HSV ו-0.985 עבור CMV, מה שמרמז על מתאם חזק (איור 5A). יש לציין, בדיקת תאי T ספציפיים ל- CMV יכולה להיות שלילית בנבדקים סרופוזיטיבים בריאים שלא היו להם אירועי הפעלה מחדש לאחרונה. הן הרפרטואר הכולל והן רפרטואר תאי העזר CD3+CD4+ T-helper תגובתי האנטיגן התמינו עוד יותר בהתבסס על ביטוי CCR7 ו-CD45RO (איור 5B). באופן מרגיע, התוצאות שהתקבלו באמצעות פרוטוקולי WB ו- WBS היו דומות הן עבור כלל האוכלוסייה והן עבור אוכלוסיות תגובתיות אנטיגן. כצפוי, עם שתי הבדיקות, שיעור תאי הזיכרון המובחנים יותר (כלומר, תאי זיכרון משפיעים) היה גבוה יותר בקרב תאי T תגובתי אנטיגן מאשר בקרב כלל אוכלוסיית תאי Th. כצפוי, רק כמה תאי T נאיביים הופעלו על-ידי ממריצים נגיפיים (איור 5B).
יתר על כן, בסדרה אחרת של ניסויים, סופרנאטנטים של תרביות מגורות נותחו על-ידי IFN-γ ELISA (איור 5C). רקע מינימלי לא ספציפי נצפה (אמצעים של 1.29 pg/mL ו- 2.18 pg/mL בפרוטוקולי WB ו- WBS, בהתאמה). דגימות דם מתורמים HSV-seropositive הראו ריכוזי IFN-γ ממוצעים של 111 pg/mL ו-125 pg/mL במערכת WB ו-WBS, בהתאמה. לעומת זאת, ריכוזי IFN-γ בדגימות סרונגטיביות היו באופן עקבי מתחת ל-10 pg/mL בשתי המערכות (מקדם מתאם הקונקורדנציה של לין = 0.972, איור 5C). כמו כן, גירוי דם pp65 מתורמים סרופוזיטיבים של CMV הניב ריכוזים ממוצעים של IFN-γ של 258 pg/mL ו-272 pg/mL במערכות WB ו-WBS, בהתאמה, בעוד שהפרשת IFN-γ מינימלית המושרה על ידי pp65 נצפתה בשתי המערכות באמצעות דגימות סרונגטיביות (מקדם מתאם קונקורדנציה של לין = 0.953, איור 5C).
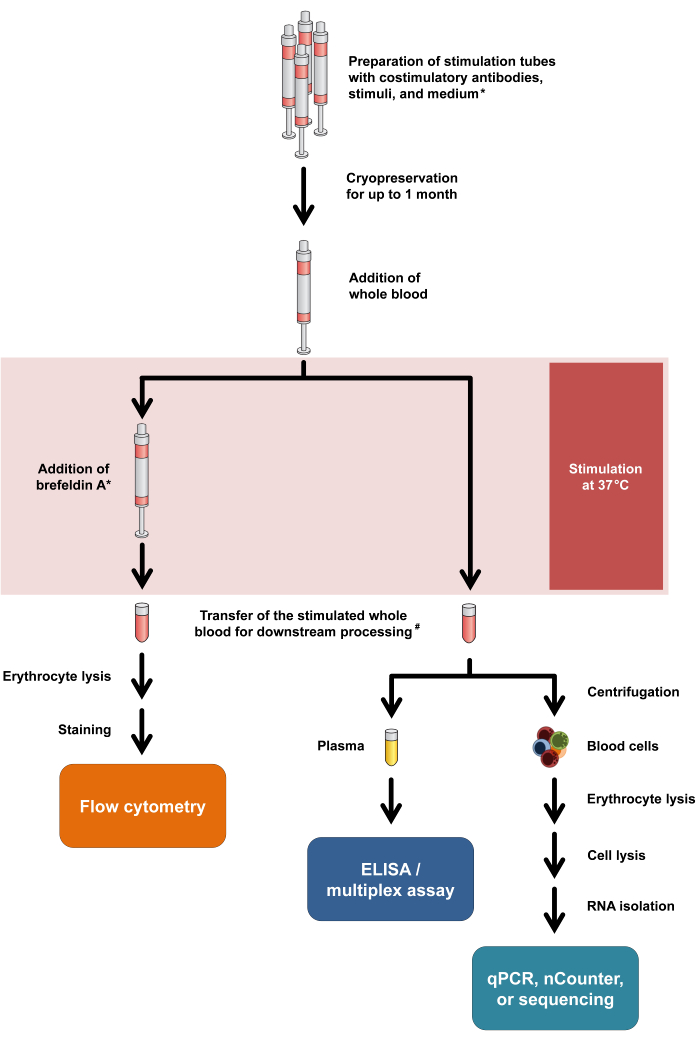
איור 1: תרשים זרימה המסכם פרוצדורות ניסוי וקריאות. כוכבית פירושה שברפלדין A נדרש עבור סמני הפעלה מסוימים של תאי T (למשל, CD154) וצביעת ציטוקינים תוך תאית. ראה פרוטוקול שלבים 2.5 ו- 2.6. #: דם עבור ציטומטריה זרימה מועבר בתחילה לצינורות צנטריפוגות 15 מ"ל עבור ליזה אריתרוציטים, ואילו דם עבור בדיקות ציטוקינים ושעתוק מועבר לצינורות מיקרוצנטריפוגות 1.5 מ"ל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: אריתרוציטים ליזה. לאחר שהדם המגורה הושעה מחדש במאגר (A) אריתרוציטים ליזיס, הוא מודגר עד (B) הנוזל נראה צלול, אך לא יותר מ-6 דקות. (C) בעת שימוש בצינור מדורג של 15 מ"ל, קנה המידה שלו אמור להיראות דרך הדגימה השקופה יותר ויותר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
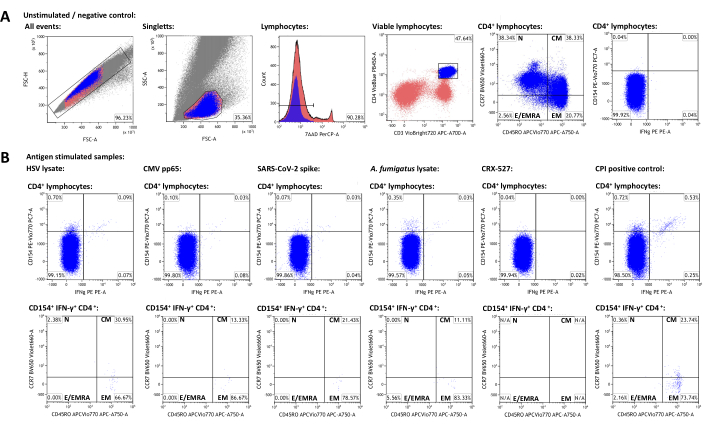
איור 3: מערך נתונים מייצג וסכמות gating ציטומטריות של זרימה. (A) אירועי סינגלט מזוהים לפי מאפייני FSC-A ו-FSC-H. מתוכם, לימפוציטים מגודרים באמצעות FSC-A ו- SSC-A. לימפוציטים מתמיינים לתאי T-helper CD3+CD4+. רמות ביטוי CD45RO ו- CCR7 משמשות לפנוטיפ של אוכלוסיות זיכרון ותאי אפקטורים. IFN-γ ו- CD154 שימשו כסמני הפעלה. השערים נקבעו בהתבסס על אוכלוסיית IFN-γ-CD154 במדגם הלא מגורה. גייטס הועבר לאחר מכן לדגימות המגורות (B). אפיון אוכלוסיות הזיכרון של תאי T המופעלים הושג על ידי העברת שער הרביע CCR7/CD45RO מאוכלוסיית CD3+CD4+ לאוכלוסיות IFN-γ+CD154+CD3+CD4+. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
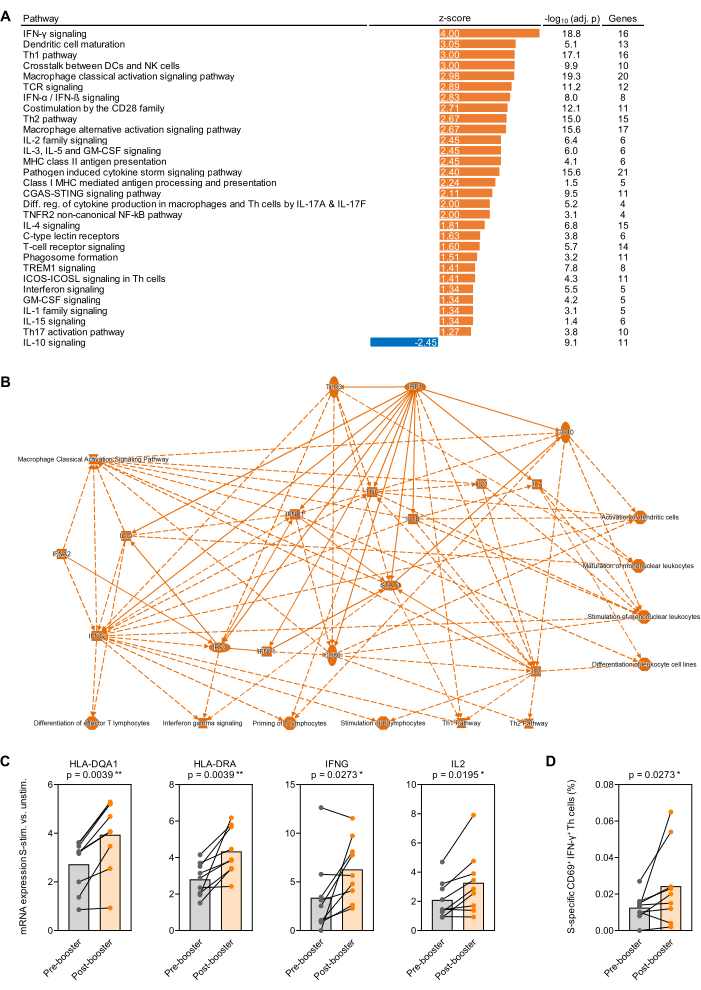
איור 4: שינויי שעתוק הנגרמים על-ידי אנטיגן לאחר חיסון הדחף של SARS-CoV-2. (A) העשרה מותאמת רקע של מסלולי שעתוק בחלבון ספייק של SARS-CoV-2 (Prot_S) - מגורה דם שלם לאחר לעומת לפני (ראשון) חיסון דחף BNT162b2 mRNA נותחה ב -9 נבדקים בוגרים בריאים. מסלולים קנוניים הקשורים למערכת החיסון עם ערך p מותאם בנימיני-הוכברג (BH-adj.) <0.05 (-log10[BH-adj. p] >1.3) וציון z מוחלט >1.25. (B) רשת פשוטה המסכמת גנים ומסלולים המועשרים בצורה חזקה יותר בדם שלם מגורה S לאחר לעומת לפני חיסון דחף. (C) רמות ביטוי מותאמות רקע של גנים מייצגים הקשורים להצגת אנטיגן והפעלת תאי T בדם מלא מגורה Prot_S לפני ואחרי חיסון דחף. מבחן וילקוקסון זוגי. (D) תדרים מתוקני רקע של תאי T ספציפיים ל-Prot_S IFN-γ+CD69+ לפני ואחרי חיסון דחף. מבחן וילקוקסון זוגי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
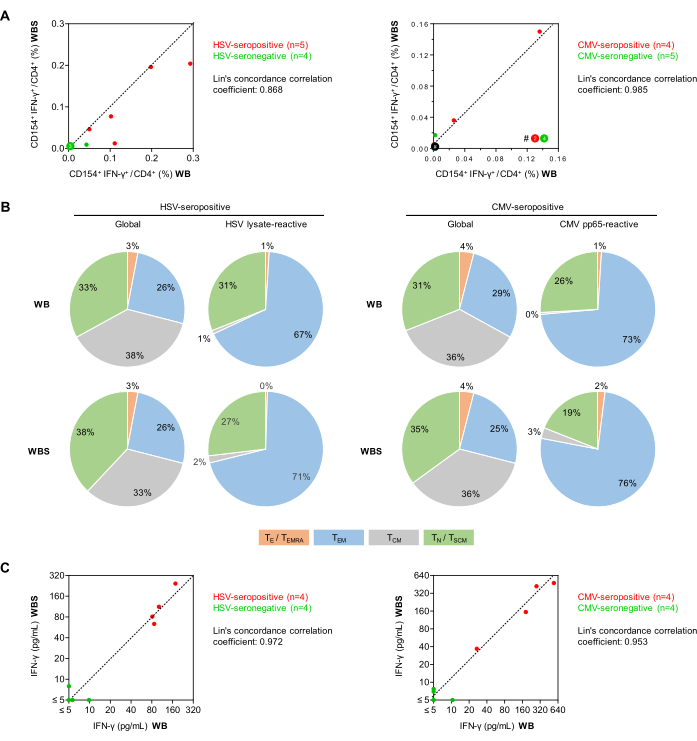
איור 5: תגובתיות אנטי-ויראלית של תאי T בציטומטריית זרימה וב-ELISA. (A) מוצגות חלקות מתאם של תדרי תאי T מתוקנים ברקע CD154+IFN-γ+/CD3+CD4+ (ציטומטריית זרימה) מבדיקות הדם המלא המבוססות (WB) והנפח הקטן (WBS). נקודות ירוקות ואדומות מייצגות נבדקים שהם סרושליליים וסרופוזיטיבים לנגיף הנבדק, בהתאמה. (B) באמצעות הערכה ציטומטרית של זרימה של ביטוי CD45RO ו- CCR7, פנוטיפים של תאי T של זיכרון/אפקט נקבעו בקרב תאי T גלובליים CD3+CD4+ ותאי T מגיבי אנטיגן IFN-γ+CD154+CD3+CD4+ לאחר גירוי עם HSV lysate או CMV pp65 באמצעות דם מתורמים סרופוזיטיבים (n = 5 ו- 4, בהתאמה). הפצות ממוצעות מוצגות. ירוק: תאי T נאיביים (TN), CD45RO-CCR7+. אפור: תאי T של זיכרון מרכזי (TCM), CD45RO+CCR7+. כחול: תאי T של זיכרון אפקט (TEM), CD45RO + CCR7-. כתום: תאי T משפיעים ותאי T של זיכרון אפקט המבטאים מחדש CD45RA (TE/TEMRA), CD45RO-CCR7-. (C) תרשימי מתאם של שחרור IFN-γ מתוקן רקע (ELISA) שנמדדו באמצעות מבחני WB ו- WBS. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: תכולת צינור הגירוי. ריכוזי מלאי של גירויים וממסים מסוכמים. בדיקת הדם המלא (WB) מבוצעת באמצעות 500 μL של דם שלם ליתיום heparinized, בעוד הגרסה בקנה מידה קטן (WBS) דורש רק 250 μL של דם. עבור WBS, כל אמצעי האחסון של מגיבים הם מחצית מאמצעי האחסון של WB. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: נתונים דמוגרפיים של נבדקים בוגרים בריאים שנדגמו כדי ליצור את מערכי הנתונים המייצגים. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: לוח ציטומטרי של זרימה מייצגת לאנליזה של תאי T. לוח ציטומטרי זרימה זה שימש ליצירת מערך הנתונים המייצג. התוצאות מוצגות בפירוט באיור 3. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: לוחות ציטומטריים של זרימה שפורסמו בעבר. נתונים המשתמשים בשילובי נוגדנים אלה פורסמו בעבר על ידי Tappe et al.24. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
בדיקות חיסוניות ספציפיות לאנטיגן מספקות תובנות לגבי אינטראקציות בין מיקרוב למארח, הן חיוניות למחקר חיסונים ואימונותרפיה, ומוכרות יותר ויותר כשיטות אבחון ופרוגנוסטיקה בחולים עם זיהומים אופורטוניסטיים35. פרוטוקול זה מתאר מערכת גירוי אנטיגן קלה המאפשרת ניתוח חזק ורב-מודאלי של חסינות ספציפית לאנטיגן באמצעות נפחי דם מינימליים (250-500 מיקרוליטר לאנטיגן). פרוטוקול 250 μL שהוקטן הניב מתאם מצוין בין תדירויות תאי T ספציפיים לאנטיגן, פנוטיפים וייצור ציטוקינים בהשוואה לפרוטוקול 500 μL שנקבע קודם לכן. למרות זמינותם של פתרונות בנפח קטן עבור שלבים מסוימים של עיבוד דגימות36, למיטב ידיעת המחברים, אף מערכת מסחרית זמינה כיום אינה יכולה לתמוך באופן אמין בגירוי אנטיגן ובניתוח פונקציונלי רב-פנים של תגובות חיסוניות תפקודיות מונעות תאי T על ידי ציטומטריית זרימה, בדיקות שחרור ציטוקינים ושעתוק מנפחי דם של 250-500 מיקרוליטר. המערכת המסחרית הנפוצה ביותר המאפשרת ספקטרום דומה של יישומי מחקר משתמשת בנפח דם של 1 מ"ל בסביבת גירוי של 3 מ"ל, וכתוצאה מכך עלות וכמויות אנטיגנים גבוהות משמעותית בהשוואה לפרוטוקול המוצג כאן 13,14,15.
למרות אופטימיזציה מתמשכת של פרוטוקולים מבוססי דם שלם לכימות ציטומטרי זרימה של תאי T ספציפיים לאנטיגן 6,37,38, למדידות ציטומטריות של זרימה יש מספר חסרונות. בפרט, הם נשארים מייגעים באופיים וקשה לתקנן אותם בשל שונות ניכרת בין מפעילים (למשל, תהליך ה- gating הסובייקטיבי) והגדרות ציוד שונות, פרוטוקולי פיצוי ופרמטרים של רכישה בין מעבדות. למרות שדיווח סטנדרטי39 והשימוש בתוכנות ניתוח וגטינג אוטומטיות עשויים לשפר את הסטנדרטיזציה ואת יכולת ההשוואה של ערכות נתונים צבעוניות מורכבות יותרויותר 40,41, פרוטוקול הגירוי המתואר כאן תוכנן להתאים לשיטות קריאה ציטומטריות שונות שאינן זרימה.
בפרט, בדיקות שחרור ציטוקינים יכולות להתבצע עם זמן ידיים נמוך וציוד זול יחסית, ולעתים קרובות הן מתוקננות בקלות ליישומים קליניים שגרתיים. יתר על כן, כפי שהוכח במחקרים קודמים המשתמשים בפרוטוקול זה, ניתן למדוד מספר רב של תגובות ציטוקינים מנפחי דגימה מינימליים עם בדיקות מרובבות מודרניות, ובכך לאפשר פרופיל של חתימות ציטוקינים מורכבות בסביבות מחקר24,42. יש לציין כי פרוטוקול חזק זה עם גירוי משותף כפול מאפשר כימות אמין של תגובות ציטוקינים ספציפיות לאנטיגן בחולים שאינם לימפופנים (>800 לימפוציטים / μL דם), אפילו באלה שקיבלו דיכוי חיסוני יאטרוגני26,34. כחיסרון של מבחני שחרור ציטוקינים, במיוחד בחולים עם לוקופניה, לא ניתן לייחס ציטוקינים המופרשים לאוכלוסיות תאים בודדות. במקרים מסוימים, ניתן להקל על כך על ידי שימוש בגירויים ספציפיים לתא, אם זמינים. עם זאת, ייתכן שיהיה צורך בשילוב של ריכוזי ציטוקינים עם שיטות קריאה אחרות ו / או התאמה של תגובות ציטוקינים בהתבסס על המטולוגיה קלינית (כלומר, ספירת דם מלאה עם התמיינות לויקוציטים). יש לציין כי הפרוטוקול המוצג כאן מאפשר שילוב של קריאות ציטוקינים וחתימות שעתוק מאותה דגימה, ובכך מאפשר ניתוח קונקורדנטי של סמני הפעלת שעתוק מוגדרים היטב שעשויים להוסיף הקשר תאי וספציפיות לחתימות ציטוקינים גלובליות.
צעד עתידי לקראת סטנדרטיזציה מלאה ומעשיות קלינית טובה עוד יותר יהיה אוטומציה מלאה של בדיקות אלה מעיבוד הדגימה ועד לקריאה אנליטית. למרות שבידוד אוטומטי מדויק של אוכלוסיות תאים בודדים נקבע בהצלחה43,44, ניתוח תאי T ספציפיים לאנטיגן עדיין דורש מאנשי המעבדה לנקוט בצעדי טיפול לסירוגין. עם זאת, השמטת בידוד תאים וטיפול ב- PBMC פגיע והשימוש בצינורות גירוי מסחריים תואמי אוטומציה עשויים להקל על יישום זרימות עבודה פשוטות ואוטומטיות לחלוטין מבוססות דם מלא עבור בדיקות חיסוניות פונקציונליות.
בסך הכל, פרוטוקולים רב-תכליתיים מבוססי דם מלא, כמו זה המוצג כאן, טומנים בחובם הבטחה משמעותית להרחיב את היישומים של בדיקות חיסוניות תפקודיות ספציפיות לאנטיגן לקבוצות חולים חדשות ולתחומי מחקר, כולל מחקרים פרה-קליניים בבעלי חיים קטנים. בדיקות חיסוניות תפקודיות ספציפיות לאנטיגן אינן אפשריות כיום במודלים של מורין או דורשות איגום דם ממספר בעלי חיים ו / או שימוש בתמציות תאים לא סטנדרטיות כגון טחול. בהתחשב בעניין הגובר בהתערבויות אימונותרפיות להגברת ההגנה של המארח מפני זיהומים אופורטוניסטיים (למשל, מעכבי נקודות בקרה חיסוניות, גורמי גדילה המטופויטיים, ציטוקינים וכו ') והזינוק בטכנולוגיות חיסון חדשניות, בדיקות חיסוניות תפקודיות ספציפיות לאנטיגן צפויות לשחק תפקיד הולך וגדל הן במחקר מחלות זיהומיות פרה-קליניות והן ביישומים קליניים באוכלוסיות חולים מגוונות. מערכת גירוי האנטיגן החזקה, הזולה, הקלה לשימוש ובעלת נפח נמוך המוצגת כאן עשויה להקל על ניתוחים חיסוניים מקיפים ספציפיים לאנטיגן באזורים לא מנוצלים. יתר על כן, החוסן הפרה-אנליטי של פרוטוקול קל זה עשוי ליצור הזדמנויות לשילוב משופר של יישומי בדיקות חיסוניות בשגרה הקלינית, מה שיאפשר לנו להתקרב צעד אחד קרוב יותר לניהול מותאם אישית, מונחה סמנים ביולוגיים של מחלות זיהומיות.
Disclosures
אין ניגודי עניינים שיש לחשוף על ידי המחברים.
Acknowledgements
אנו מודים לחטיבות הכימיה הקלינית וסרולוגיה של זיהומים במכון לרפואת מעבדה ומיקרוביולוגיה, בית החולים האוניברסיטאי של אוגסבורג, על ביצוע מדידות נוגדנים בסרום. אנו מודים לד"ר פרידריקה לישה-שטרנקר ולמכון לפתולוגיה ואבחון מולקולרי של בית החולים האוניברסיטאי אוגסבורג על אספקת מתקני התמלול. אנו מודים למארי פרייטאג מבית החולים האוניברסיטאי אוגסבורג על התמיכה בלוגיסטיקה של חיסונים וברכישת דגימות. אנו מודים לד"ר אולף קנימאייר ולמכון הנס-קנואל ביינה, גרמניה, על מתן Aspergillus fumigatus lysate. יוזמת המחקר Bay-VOC (מספר מימון GE2-2452-200-D37666/2022), משרד המדינה הבווארית למדע ואמנות, כמו גם אוניברסיטת אוגסבורג, גרמניה, תמכו בעבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
References
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved