Method Article
Dosage du sang total avec double costimulation pour l’analyse spécifique de l’antigène de l’immunité de l’hôte contre les agents pathogènes fongiques et viraux
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les immunodosages à base de sang total constituent un outil facile et économe en ressources pour analyser l’immunité spécifique de l’antigène à des fins de diagnostic et de recherche. Cet article fournit un protocole optimisé à base de sang total avec double co-stimulation pour une analyse complète de l’immunité de l’hôte contre les agents pathogènes fongiques et viraux, y compris une version à faible volume pour les patients pédiatriques et les petits animaux.
Résumé
Un traitement rapide et économe en ressources des échantillons, un débit élevé et une grande robustesse sont essentiels pour une application scientifique et clinique efficace des immunodosages avancés spécifiques à l’antigène. Traditionnellement, ces immunoessais, en particulier l’analyse des lymphocytes T spécifiques de l’antigène par cytométrie en flux ou les dosages ponctuels immuno-enzymatiques, reposent souvent sur l’isolement de cellules mononucléées du sang périphérique. Ce processus prend du temps, est sujet à de nombreux facteurs de confusion pré-analytiques et nécessite de grands volumes sanguins. Les tests à base de sang total offrent une alternative facile avec une robustesse pré-analytique accrue et des besoins en volume sanguin plus faibles. De plus, les tests à base de sang total permettent de préserver les interactions intercellulaires qui ne sont pas capturées par des tests utilisant des sous-ensembles de cellules isolées. Récemment, un immunodosage raffiné du sang total avec double co-stimulation anti-CD28 et anti-CD49d pour une analyse complète des fonctions des lymphocytes T spécifiques de l’antigène et des interactions intercellulaires complexes en réponse à divers antigènes fongiques et viraux a été proposé. Ce protocole fournit des conseils pour la préparation des tubes de stimulation, la stimulation sanguine et le traitement des échantillons en aval pour la cytométrie en flux, les tests de sécrétion de cytokines et les analyses transcriptionnelles. Cela comprend un protocole à faible volume (250 μL) validé et fonctionnellement équivalent, non publié auparavant, afin de rendre la surveillance des lymphocytes T en flux et des cytokines plus accessible pour les études chez les patients pédiatriques ou les études précliniques chez les petits animaux (p. ex., les souris). Dans l’ensemble, ces protocoles fournissent une boîte à outils polyvalente pour l’analyse immunitaire complexe spécifique à l’antigène dans les contextes de recherche clinique et translationnelle.
Introduction
La quantification et la caractérisation de l’immunité spécifique de l’antigène, en particulier des réponses spécifiques des lymphocytes T, sont essentielles pour la recherche en immunobiologie et sur la vaccination, ainsi que pour certains tests de diagnostic. Traditionnellement, les immunoessais spécifiques de l’antigène reposaient généralement sur des cellules mononucléées isolées du sang périphérique (PBMC). Cependant, l’isolement de ces cellules prend du temps et nécessite beaucoup de ressources et nécessite souvent des volumes sanguins relativement importants. De plus, pour prévenir l’activation des granulocytes et les perturbations ultérieures des lymphocytes T pendant le stockage pré-analytique,1 un traitement rapide des échantillons est primordial, ce qui n’est souvent pas réalisable dans la pratique clinique. Ces limites entravent la praticabilité des immunodosages spécifiques de l’antigène dans les scénarios de recherche à haut débit et les routines cliniques. Par conséquent, le développement d’approches basées sur le sang total faciles à utiliser et potentiellement automatisables au cours des dernières années a ouvert de nouveaux domaines d’applications des immunoessais. Cependant, les systèmes actuellement disponibles dans le commerce manquent généralement d’environnements de costimulation optimaux pour les lymphocytes T et sont sensibles aux retards pré-analytiques. Par exemple, un test de libération d’IFN-γ à base de sang total largement utilisé a un taux de réversion positif à négatif de 19 % après 6 h de stockage de sang pré-analytique2. Des protocoles optimisés avec une double co-stimulation anti-CD28 et anti-CD49d ont été développés pour pallier ces limitations 3,4,5,6.
Le protocole présenté ici permet une quantification et une caractérisation précises et reproductibles des lymphocytes T spécifiques de l’antigène, l’évaluation des réponses cytokiniques induites par l’antigène et d’autres marqueurs immunitaires fonctionnels (cytométrie en flux ou transcriptionnel) à partir d’un volume sanguin minimal, c’est-à-dire 500 μL de sang par tube de stimulation. Parmi les autres avantages de ce protocole, citons le faible temps de manipulation, la grande résilience aux facteurs de confusion pré-analytiques et la préservation des interactions intercellulaires fonctionnelles dans un environnement ex vivo relativement physiologique. La comparabilité de la caractérisation des lymphocytes T spécifiques de l’antigène cytométrique en flux sanguin total avec les données générées par les tests traditionnels basés sur le PBMC a déjà été démontrée dans le contexte de la quantification des lymphocytes T spécifiques aux moisissures6. De plus, la stimulation directe du sang des sujets élimine la nécessité d’une supplémentation en sérum autologue, allogénique ou même xénogénique qui est généralement nécessaire pour une stimulation optimale de la PBMC. L’omission de l’isolement cellulaire réduit également le stress de cisaillement et de température, améliorant ainsi la viabilité cellulaire. Plus important encore, les tests à base de sang total préservent les populations de granulocytes qui sont perdues lors de la centrifugation en gradient pour l’isolement des PBMC7. Ainsi, ce dispositif de test préserve et capture les boucles d’interaction fonctionnelles entre les granulocytes et les cellules mononucléées4.
Il convient de noter que ce protocole ne nécessite que des modifications minimes pour s’adapter aux différentes modalités de lecture et permet même une double analyse de la libération de cytokines et des réponses transcriptionnelles à partir du même tube de stimulation. Plus précisément, alors que les cytokines sont analysées à partir du surnageant de culture après stimulation, la pastille cellulaire peut être utilisée pour l’isolement de l’ARN avec une analyse transcriptomique ultérieure. Le flux de travail général pour les différentes modalités de lecture est résumé à la figure 1.
Au cours des dernières années, un nombre croissant de tests à base de sang total ont été mis au point pour la surveillance immunitaire réactive aux agents pathogènes dans la recherche et les milieux cliniques, par exemple pour Mycobacterium tuberculosis 8,9, Bordetella pertussis3, Orientia tsutsugamushi10 et SARS-CoV-2 5,11,12. Par exemple, un système précédemment établi a été utilisé pour plusieurs antigènes, y compris M. tuberculosis, le virus de la grippe A et le SRAS-CoV-2, mais n’utilise pas de facteurs de co-stimulation optimisés pour la stimulation des cellules T auxiliaires (Th) 13,14,15. Même si le volume sanguin requis pour ces tests est déjà nettement inférieur à celui utilisé pour les tests traditionnels basés sur le PBMC ou les kits de stimulation du sang entier disponibles dans le commerce, un volume d’échantillon encore plus petit pourrait être justifié pour des applications en pédiatrie, en néonatalogie, chez les patients en unité de soins intensifs (USI) et la recherche préclinique sur de petits modèles animaux. Par exemple, même un prélèvement sanguin terminal sur des souris (par exemple, par ponction cardiaque) donne généralement un maximum de 0,7 à 1 ml de sang. Ainsi, la possibilité de réduire davantage les protocoles d’immunodosage à base de sang totalprécédemment établis 4,6 pour une quantification et une caractérisation précises des réponses des lymphocytes T réactifs à l’antigène à partir de 250 μL de volume sanguin par tube de stimulation a été évaluée dans le cadre de ce protocole.
Protocole
Le comité d’éthique de l’Université Ludwig Maximilians de Munich (numéro de projet 21-0689) a approuvé la collecte d’échantillons de sang humain. De plus, une partie des ensembles de données représentatifs a été générée sous le numéro d’étude 20-426 du registre Corona, également approuvé par le comité d’éthique de l’Université Ludwig Maximilian de Munich. Le consentement éclairé a été obtenu.
1. Préparation des tubes de stimulation du sang entier
REMARQUE : Cette étape est adaptée de Lauruschkat et al.4 et de Weis et al.6. Le tableau 1 résume les concentrations et les volumes détaillés des réactifs.
- Dans des conditions stériles (établi stérile), préparer des tubes de prélèvement sanguin de 2,7 mL sans anticoagulant, avec des antigènes et des anticorps co-stimulateurs. Ajouter 1 μg/mL de α-CD28 et 1 μg/mL de α-CD49d dans chaque tube, y compris le témoin négatif. Tenez compte du volume sanguin à ajouter pour la stimulation du sang total lors de la détermination des concentrations finales (250 μL ou 500 μL). Pour maintenir la géométrie de la chambre et l’accessibilité de l’échantillon, ne rétractez pas le piston du tube de prélèvement sanguin.
- D’après la conception de l’étude, déterminer si les tubes de contrôle négatif ne doivent contenir aucun stimulus supplémentaire (contrôle de fond non stimulé, comme le montre le tableau 1) ou utiliser des antigènes pour lesquels la cohorte de l’étude ne devrait pas héberger de lymphocytes T spécifiques de l’antigène ou un nombre minimal de lymphocytes T spécifiques de l’antigène (p. ex., un pool de peptides du VIH chez les personnes séronégatives pour le VIH 16).
- Pour la stimulation spécifique de l’antigène, optimisez les concentrations idéales d’antigènes par titrage lors d’expériences préliminaires. Pour générer les données représentatives ci-dessous, utilisez les concentrations d’antigènes optimisées suivantes : 1,2 μg/mL de lysat HSV-1, 0,6 nM/peptide/mL de CMV pp65, 0,6 nM/peptide/mL de SARS-CoV-2 Prot_S, 50 μg/mL de lysat d’Aspergillus fumigatus et 1 ng/mL de CRX-527.
- Inclure un témoin positif, en particulier pour les études chez les patients lymphopéniques ou ceux recevant une pharmacothérapie immunosuppressive. Utiliser une solution de contrôle positif CPI (0,6 nM/peptide/mL), composée de peptides de cytomégalovirus, de virus parainfluenza et de virus grippal.
REMARQUE : Des stimuli synthétiques, tels que le PMA (10 μg/mL) ± l’ionomycine (1 μg/mL), peuvent être utilisés, mais ils induisent moins de réactions physiologiques et peuvent affecter l’expression des antigènes de surface couramment utilisés comme marqueurs de population pour la cytométrie en flux (plus particulièrement, CD417). Notez que les anticorps co-stimulateurs ne sont pas nécessaires en conjonction avec la plupart des stimuli de contrôle positif synthétique et peuvent même avoir un impact négatif sur la viabilité et la réactivité cellulaires. - Pour harmoniser les volumes de réactifs sur tous les tubes de stimulation, ajoutez le milieu RPMI 1640 jusqu’aux volumes totaux suivants : Test à grande échelle pour la cytométrie en flux : 50 μL ; Dosage grandeur nature pour l’analyse des cytokines et la transcriptomique : 500 μL ; Dosage à petite échelle pour la cytométrie en flux : 25 μL ; Test à petite échelle pour l’analyse des cytokines et la transcriptomique : 250 μL.
REMARQUE : Pour la préparation de plusieurs ensembles de tubes de stimulation, il est recommandé de préparer des mélanges maîtres comprenant tous les ingrédients en raison du risque plus faible de contamination et du faible volume de facteurs de co-stimulation et de stimuli. - Utilisez immédiatement les tubes préparés ou cryoconservez-les à -20 °C. La plupart des réactifs peuvent être conservés jusqu’à 4 semaines ; Cependant, pré-validez les périodes de stockage maximales pour les nouveaux réactifs/stimuli.
2. Stimulation et incubation d’échantillons de sang total
- Environ 30 à 60 minutes avant la stimulation du sang total, décongelez les tubes de stimulation prêts à l’emploi et conservez-les à température ambiante.
- Prélever le sang veineux du donneur/patient à l’aide de tubes de prélèvement sanguin avec un anticoagulant à l’héparine de lithium. Assurez-vous que le volume sanguin collecté répond aux exigences de chaque expérience, c’est-à-dire qu’un minimum de 750 μL est requis pour 3 conditions du test à petite échelle, y compris le contrôle négatif et le contrôle positif. Pour les tubes de prélèvement sanguin acquis dans le commerce, remplissez-les complètement pour atteindre des concentrations d’héparine de 16 à 25 UI/mL de sang.
REMARQUE : Le tableau 2 présente les données démographiques des sujets adultes en bonne santé recrutés pour générer les ensembles de données représentatifs. - Transférez la quantité requise de sang total hépariné (250 μL ou 500 μL pour un test à petite échelle ou à grande échelle, respectivement) dans les tubes de stimulation en pipetant sous une paillasse stérile.
REMARQUE : S’il n’y a pas d’établi stérile ou si l’on travaille avec des échantillons présentant un risque minime d’infection (c’est-à-dire du sang de sujets humains ou d’animaux présélectionnés), les échantillons peuvent être transférés dans les tubes de stimulation à l’aide de seringues stériles. Cette méthode permet également le traitement des échantillons au chevet du patient immédiatement après le prélèvement sanguin, ce qui minimise le stockage pré-analytique et l’altération des cellules T. Avant d’injecter le sang, désinfectez soigneusement les joints en caoutchouc du tube de prélèvement sanguin et de tous les tubes de stimulation avec un désinfectant alcoolique. Laissez sécher le désinfectant pendant au moins 1 min. - Inversez soigneusement les tubes de stimulation 5x-10x. Placez les tubes de stimulation dans un incubateur à 37 °C. Notez qu’un incubateur deCO2 n’est pas nécessaire. Pour éviter l’activation non spécifique des neutrophiles, ne réfrigérez pas le tube de prélèvement sanguin.
REMARQUE : Ce protocole a été validé pour l’entreposage pré-analytique du sang jusqu’à 8 h à température ambiante afin de permettre le transport des échantillons. Si possible, il est préférable d’injecter du sang total dans les tubes de stimulation au site de prélèvement et de transporter le sang vers un laboratoire central dans les tubes de stimulation, car les facteurs de co-stimulation amélioreront la viabilité des lymphocytes18,19. - Uniquement pour les échantillons utilisés pour des tests de cytométrie en flux avec coloration intracellulaire, ajouter de la bréfeldine A (concentration finale de 10 μg/mL) dans chaque tube de stimulation après 4 h d’incubation.
- Préparez une solution de brefeldine A à 1 mg/mL dans une IMRP et ajoutez 1 μL de la solution par volume d’échantillon de 100 μL (c.-à-d. cocktail de stimulation prémélangé + volume de sang total). Ajouter la bréfeldine A en débouchant les tubes et en pipetant sous un établi stérile. Rebouchez et retournez les tubes dans l’incubateur à 37 °C pendant encore 16 à 18 h à 37 °C (20 à 22 h au total).
- Pour les tests de sécrétion de cytokines ou les analyses transcriptionnelles, n’ajoutez pas de bréfeldine A et incubez continuellement les échantillons à 37 °C pendant 24 à 26 h.
REMARQUE : La brefeldine A inhibe l’appareil de Golgi et abroge ainsi la sécrétion de cytokines et le transport des protéines à la surface cellulaire. Comme la sécrétion ou l’expression de surface entraînera finalement la perte et la dégradation des protéines après réinternalisation, respectivement, les inhibiteurs d’exocytose sont essentiels à l’accumulation intracellulaire et à la coloration des cytokines et de certains marqueurs d’activation (par exemple, CD154) pour les études de cytométrie en flux. Cependant, la bréfeldine A perturbe également les processus cellulaires physiologiques visibles dans le transcriptome et invalide les dosages de sécrétion de cytokines des surnageantsde culture 20,21, nécessitant l’utilisation de deux tubes à essai distincts (un avec et un sans brefeldine A) pour effectuer ces lectures en parallèle.
3. Préparation des échantillons pour la cytométrie en flux
- Ajouter 500 μL de solution d’EDTA 0,5 M dans chaque tube de stimulation et incuber l’échantillon pendant 15 minutes à température ambiante pour détacher les cellules adhérentes de la surface des tubes.
- Transférez les échantillons dans de nouveaux tubes à centrifuger de 15 ml. Rincez les tubes de stimulation avec 1 mL de tampon de lyse érythrocytaire pour recueillir les cellules sanguines restantes, puis ajoutez le tampon et les cellules dans les mêmes tubes à centrifuger de 15 mL.
- Centrifugez les tubes de 15 mL pendant 7 min à 600 x g. Jetez soigneusement le surnageant.
- Remettre en suspension la pastille de cellules sanguines dans le tampon de lyse des érythrocytes (Figure 2A). Utilisez 5 ml de tampon de lyse érythrocytaire pour 500 μL de sang total et 3 ml pour 250 μL de sang total.
REMARQUE : Les conditions optimales de lyse des érythrocytes doivent être pré-évaluées pour le tampon spécifique utilisé (préparé sur place ou produit commercial). Les instructions fournies ici ont été optimisées pour le tampon de lyse érythrocytaire répertorié dans la table des matériaux. - Incuber les échantillons à température ambiante jusqu’à ce qu’ils semblent clairs (figure 2B). Pour éviter la lyse et l’agrégation des granulocytes, ne pas dépasser 6 min d’incubation. Un indicateur de la réussite de la lyse érythrocytaire est la capacité de voir les chiffres et le tartre sur le tube de 15 mL à travers le liquide (figure 2C).
- Centrifugez les tubes de 15 mL pendant 7 min à 600 x g. Jetez soigneusement le surnageant, répétez les étapes 3.4 à 3.5 si la pastille de cellule est toujours visiblement rouge.
- Remettre la pastille de cellule en suspension dans 1 mL de HBSS et transférer les cellules dans des tubes de réaction de 2 mL.
- Centrifugez les tubes de 2 mL pendant 5 min à 400 x g. Jetez soigneusement le surnageant.
- Effectuer une coloration par cytométrie en flux conformément aux instructions du fabricant pour le kit de coloration intracellulaire et les anticorps utilisés.
REMARQUE : Le panel d’anticorps utilisé pour générer l’ensemble de données représentatif est résumé dans le tableau 3.
4. Préparation des échantillons pour les dosages de cytokines
- Après l’étape 2.6, transférez le sang dilué des tubes de stimulation dans des tubes de 1,5 ml.
- Centrifugez les tubes de 1,5 mL pendant 20 min à 2000 x g. Pipetez soigneusement le surnageant dans un tube frais de 1,5 ml et utilisez-le immédiatement pour l’analyse des cytokines ou cryoconservez les surnageants à -80 °C.
- Centrifuger à nouveau le surnageant pendant 5 minutes à ≥ 7000 x g (dans des tubes de 1,5 mL) pour éliminer les débris cellulaires résiduels avant l’analyse, en particulier après la décongélation. Selon le protocole de dosage des cytokines, effectuer une pré-dilution des échantillons.
- Remettre en suspension la pastille cellulaire dans 1 mL de tampon de protection d’ARN et la cryoconserver à -80 °C pour l’isolement ultérieur de l’ARN. Alternativement, remettez en suspension la pastille cellulaire dans un tampon de lyse pour une isolation immédiate de l’ARN conformément aux instructions du kit d’isolement de l’ARN (ou du protocole interne).
REMARQUE : Si nécessaire, en fonction du protocole de traitement de l’ARN ultérieur, une étape de lyse érythrocytaire similaire à 3.4-3.5 peut être ajoutée avant l’ajout du tampon de protection de l’ARN.
Résultats
Analyse multimodale des réponses immunitaires spécifiques de l’antigène après stimulation du sang entier avec des antigènes associés à des agents pathogènes
Afin de générer un ensemble de données représentatif, un donneur adulte en bonne santé séropositif pour le HSV-1 et le CMV qui avait reçu des vaccins contre le SRAS-CoV-2 a été sélectionné. En plus d’un contrôle non stimulé, les stimuli suivants ont été utilisés comme décrit ci-dessus : lysat du virus de l’herpès simplex 1 (HSV) (recommandation du fabricant, données non publiées), cytomégalovirus (CMV) pp6522, coronavirus du syndrome respiratoire aigu sévère 2 (SRAS-CoV-2) Prot_S 5,23, lysat d’Aspergillus fumigatus (un pathogène environnemental omniprésent)4,24, CRX-527 (un stimulus du récepteur 4 de type Toll basé sur le lipopolysaccharide, qui ne devrait pas activer les lymphocytes T en soi)25, et CPI (contrôle positif de l’activation des lymphocytes T CD4+ composé de peptides CMV, du virus parainfluenza et du virus de la grippe)26. Les données de cytométrie en flux et la stratégie de déclenchement sont illustrées à la figure 3. En général, il est conseillé de mesurer autant de lymphocytes que possible lorsque l’on cible des populations de cellules rares (50 000 à 100 000 lymphocytes), car la précision et la fiabilité des mesures dépendent du nombre total d’événements27. L’échantillon non stimulé est utilisé pour le contrôle de sous-ensembles de cellules individuelles (par exemple, les cellules CD3 + CD4+). Les portes pour CD45RO et CCR7 pour le phénotypage des lymphocytes T mémoires doivent être définies sur la population totale de CD3+CD4+, puis transférées aux populations positives aux marqueurs d’activation, car le faible nombre d’événements sur ces dernières empêche souvent l’identification claire de populations distinctes. De légers ajustements peuvent être nécessaires pour des portes individuelles, par exemple pour tenir compte des différences de viabilité lymphocytaire. La régulation positive de CD154 (ou ligand CD40) a été décrite comme un marqueur d’activation des lymphocytes T auxiliaires global, cohérent et rapidement induit28,29. L’IFN-γ est considéré comme l’un des marqueurs d’activation des lymphocytes T les plus importants et spécifiques de type 130,31. Il est important de noter que ce test a été testé et publié avec divers marqueurs supplémentaires d’activation, d’épuisement et de cytokines (voir les tableaux 4 et24).
Les fréquences des populations positives aux marqueurs d’activation dans l’échantillon non stimulé représentent des antécédents non spécifiques et ont été soustraites des fréquences stimulées par l’antigène. Après soustraction du bruit de fond non spécifique, le donneur représentatif avait 0,75 % (HSV), 0,09 % (CMV), 0,06 % (SARS-CoV-2), 0,34 % (A. fumigatus), 0,00 % (CRX-527) et 1,21 % (CPI) de cellules T auxiliaires CD154+/CD3+CD4+ , respectivement. L’expression de l’IFN-γ peut être analysée de la même manière, ce qui donne 0,12 % (HSV), 0,07 % (CMV), 0,03 % (SARS-CoV-2), 0,04 % (A. fumigatus), 0 % (CRX-527) et 0,74 % (CPI) de cellules IFN-γ+/CD3+CD4+ .
Les populations de lymphocytes T peuvent être subdivisées en lymphocytes T naïfs (TN, CD45RO-CCR7+), lymphocytes T à mémoire centrale (TCM, CD45RO+CCR7+), lymphocytes T effecteurs (TEM, CD45RO+CCR7-) et lymphocytes T effecteurs (et lymphocytes T effecteurs réexprimant CD45RA, TE/TEMRA, CD45RO-CCR7-). Parmi les lymphocytes T CD3+CD4+ globaux, le donneur représentatif avait respectivement 38,34 % de TN, 38,33 % de TCM, 20,77 % de TEM et 2,56 % de TE/TEMRA, comme déterminé à l’aide de l’échantillon non stimulé (figure 3A). Cependant, parmi les lymphocytes T auxiliaires réactifs spécifiques de l’antigène (CD154+IFN-γ+), TCM et TEM étaient de loin les sous-ensembles les plus importants, avec des moyennes de 22,14 % et 73,97 %, respectivement.
Des données sur d’autres populations de leucocytes ont déjà été publiées à l’aide de cette méthodologie24. Les combinaisons d’anticorps utilisées sont présentées dans le tableau 4 à titre de référence.
De plus, pour montrer tout le potentiel de cette méthodologie, un ELISA γ IFN-a a été réalisé sur un deuxième ensemble d’échantillons stimulés (sans ajout de brefeldine A). Pour éviter le dépassement de la portée de détection du kit ELISA IFN-γ, le plasma d’échantillons stimulés par CPI a été pré-dilué 1:4. Les concentrations d’IFN-γ suivantes ont été mesurées et normalisées par mL du volume sanguin du sujet, c’est-à-dire corrigées pour tenir compte de la dilution dans les tubes de stimulation et des dilutions pré-ELISA : 0 pg/mL (non stimulé), 69,4 pg/mL (HSV), 471 pg/mL (CMV), 17,8 pg/mL (SRAS-CoV-2), 61,9 pg/mL (A. fumigatus), 34,0 pg/mL (CRX-527) et 1958 pg/mL (CPI).
Enfin, l’ARN a été isolé à partir des mêmes échantillons avec des résultats cohérents. Le rendement moyen était de 719 ng, avec un rapport d’absorbance moyen de 260 nm/280 nm étant de 1,98.
Dans l’ensemble, cet ensemble de données illustre que le protocole présenté permet un spectre de lecture à multiples facettes et une analyse concomitante de divers antigènes associés à l’infection en utilisant un volume sanguin minimal, c’est-à-dire 8 ml au total pour plusieurs stimuli et modalités de lecture.
Ensemble de données représentatif pour les analyses transcriptionnelles afin de suivre la réponse à la vaccination à l’aide de sang total stimulé par l’antigène
À titre de preuve de principe pour les études transcriptionnelles réalisées sur du sang total stimulé par l’antigène, du sang a été prélevé chez 9 sujets adultes en bonne santé immédiatement avant et 1 mois après la première vaccination de rappel avec BNT162b2 (vaccin à ARNm contre le SRAS-CoV-2)32,33 7 à 9 mois après la série initiale de deux doses de vaccin. Le rendement moyen en ARN de 500 μL de sang total non stimulé et stimulé par Prot_S était de 1,1 μg d’ARN très pur, avec un rapport d’absorption moyen de 260/280 de 1,99. Après l’analyse nCounter, le nombre d’ARN a été normalisé en fonction des 12 gènes d’entretien du panel (moyenne géométrique). Par la suite, le rapport entre le nombre normalisé d’ARNm dans les échantillons stimulés par Prot_S et les témoins de fond non stimulés a été déterminé pour chaque sujet et gène. Les rapports médians-médians des mesures post-vaccination par rapport aux mesures pré-vaccination ont été déterminés, et l’analyse de l’enrichissement des voies a été effectuée à l’aide du progiciel répertorié dans la Table des matériaux. L’enrichissement des voies canoniques a été considéré comme significatif avec une valeur de score z absolue ≥ 1,25 et une valeur p ajustée de Benjamini-Hochberg < 0,05. La figure 4A résume les voies enrichies de manière significativement différente, et la figure 4B présente un réseau simplifié de changements ajustés en fonction du contexte dans la réponse post-vaccination par rapport à la réponse pré-vaccinale à la Prot_S. De plus, l’induction plus forte de gènes représentatifs liés à la maturation des cellules présentatrices d’antigène et à l’activation des lymphocytes T induite par Prot_S après une vaccination de rappel est illustrée dans la figure 4C (p < 0,01-0,03). Enfin, une augmentation des lymphocytes T auxiliaires de type 1 spécifiques au contexte ajustés Prot_S (CD69+IFN-γ+) après vaccination chez la plupart des donneurs a été confirmée par cytométrie en flux à l’aide d’un deuxième ensemble de tubes de stimulation (p = 0,03, figure 4D).
Comparaison des réponses des lymphocytes T réactifs au virus dans des protocoles d’immunodosage à base de sang total à grande échelle et à petit volume
Ensuite, les fréquences des cellules T auxiliaires CD154+IFN-γ+ réactives au virus (cellules CD3+CD4+ ) chez des volontaires sains ont été comparées à l’aide des protocoles de stimulation de l’antigène du sang total à grande échelle (500 μL, WBS) et à petit volume (250 μL, WBS) (Figure 5). Comme indiqué précédemment34, des fréquences de fond minimales non spécifiques de cellules CD154+IFN-γ+ ont été observées avec l’un ou l’autre protocole malgré la double costimulation (moyennes de 0,010 % et 0,011 % pour la WB et la WBS, respectivement). Il convient de noter que, bien que les réponses contextuelles non spécifiques soient soustraites des réponses spécifiques à l’antigène, elles contribuent toujours à une imprécision accrue du dosage, comme nous l’avons vu précédemment27. Des signaux de fond élevés (c.-à-d. >0,07 à 0,1 % de cellules Th CD154+ ou >0,05 % de cellules CD154+IFN-γ+ ) pourraient indiquer une contamination de l’échantillon, une infection aiguë du sujet ou pourraient être le résultat d’une manipulation inappropriée de l’échantillon avant l’analyse.
La fréquence moyenne des lymphocytes T réactifs au lysat du HSV chez les donneurs séropositifs (n = 5) était de 0,151 % et de 0,107 % dans les systèmes WB et WBS, respectivement, contre 0,012 % et 0,004 % chez les donneurs séronégatifs (n = 4). Avec le pool de peptides CMV pp65, les donneurs séropositifs (n = 4) avaient 0,041 % et 0,049 % de lymphocytes T réactifs contre 0,001 % et 0,004 % chez les donneurs séronégatifs (n = 5). Les coefficients de corrélation de concordance de Lin étaient de 0,868 pour le VHS et de 0,985 pour le CMV, ce qui suggère une forte corrélation (figure 5A). Notamment, le test des lymphocytes T spécifiques du CMV peut être négatif chez les sujets séropositifs sains qui n’ont pas eu d’événements de réactivation récents. Les répertoires des lymphocytes T auxiliaires CD3+CD4+ réactifs à l’antigène ont été différenciés en fonction de l’expression de CCR7 et CD45RO (figure 5B). Il est rassurant de constater que les résultats obtenus à l’aide des protocoles WB et WBS étaient comparables pour les populations totales et réactives aux antigènes. Comme on pouvait s’y attendre, avec les deux essais, la proportion de lymphocytes Th à mémoire plus différenciés (c’est-à-dire les cellules à mémoire effecteur) était plus élevée parmi les lymphocytes T réactifs à l’antigène que parmi la population totale de lymphocytes Th. Comme prévu, seuls quelques lymphocytes T naïfs ont été activés par des stimulants viraux (Figure 5B).
De plus, dans une autre série d’expériences, des surnageants de culture stimulés ont été analysés par IFN-γ ELISA (Figure 5C). Un bruit de fond minimal non spécifique a été observé (moyennes de 1,29 pg/mL et 2,18 pg/mL dans les protocoles WB et WBS, respectivement). Des échantillons de sang provenant de donneurs séropositifs pour le VHS ont montré des concentrations moyennes d’IFN-γ induites par le VHS ajustées en arrière-plan de 111 pg/mL et de 125 pg/mL dans les systèmes WB et WBS, respectivement. En revanche, les concentrations d’IFN-γ dans les échantillons séronégatifs étaient constamment inférieures à 10 pg/mL dans les deux systèmes (coefficient de corrélation de concordance de Lin = 0,972, figure 5C). De même, la stimulation par pp65 du sang de donneurs séropositifs au CMV a donné des concentrations moyennes d’IFN-γ de 258 pg/mL et 272 pg/mL dans les systèmes WB et WBS, respectivement, tandis qu’une sécrétion minimale d’IFN-γ induite par pp65 a été observée dans les deux systèmes en utilisant des échantillons séronégatifs (coefficient de corrélation de concordance de Lin = 0,953, figure 5C).
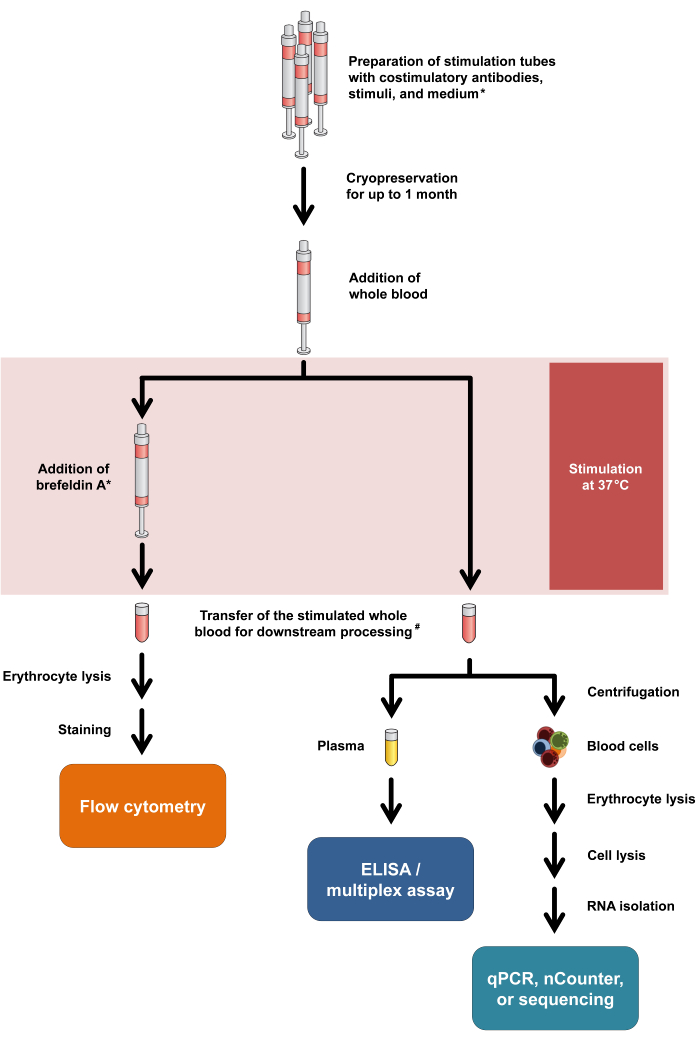
Figure 1 : Organigramme résumant les procédures expérimentales et les lectures. Asterisk signifie que la Brefeldin A est nécessaire pour certains marqueurs d’activation des lymphocytes T (par exemple, CD154) et la coloration intracellulaire des cytokines. Voir les étapes 2.5 et 2.6 du protocole. # : Le sang pour la cytométrie en flux est initialement transféré dans des tubes à centrifuger de 15 ml pour la lyse des érythrocytes, tandis que le sang pour les dosages de cytokines et la transcriptomique est transféré dans des tubes de microcentrifugation de 1,5 ml. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Lyse des érythrocytes. Une fois que le sang stimulé a été remis en suspension dans (A) un tampon de lyse érythrocytaire, il est incubé jusqu’à ce que (B) le liquide semble clair, mais pas plus de 6 min. (C) Lors de l’utilisation d’un tube gradué de 15 ml, son écaille doit devenir visible à travers l’échantillon de plus en plus translucide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
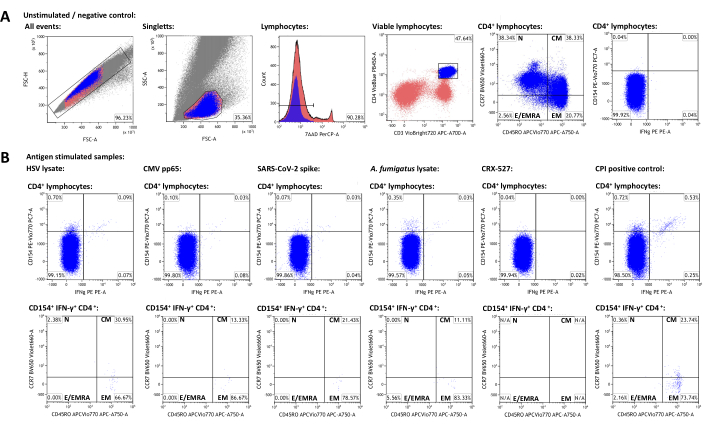
Figure 3 : Ensemble de données représentatif et schémas de contrôle de cytométrie en flux. (A) Les événements singulet sont identifiés par les propriétés FSC-A et FSC-H. Parmi ceux-ci, les lymphocytes sont bloqués à l’aide de FSC-A et de SSC-A. Les lymphocytes sont différenciés en cellules T auxiliaires CD3+CD4+. Les niveaux d’expression de CD45RO et CCR7 sont utilisés pour le phénotypage des populations de cellules mémoires et effectrices. L’IFN-γ et le CD154 ont été utilisés comme marqueurs d’activation. Les seuils ont été établis en fonction de la population IFN-γ-CD154- dans l’échantillon non stimulé. Les portes ont ensuite été transférées aux échantillons stimulés (B). La caractérisation des populations mémoires des lymphocytes T activés a été réalisée en transférant la porte du quadrant CCR7/CD45RO de la population CD3+CD4+ aux populations IFN-γ+CD154+CD3+CD4+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
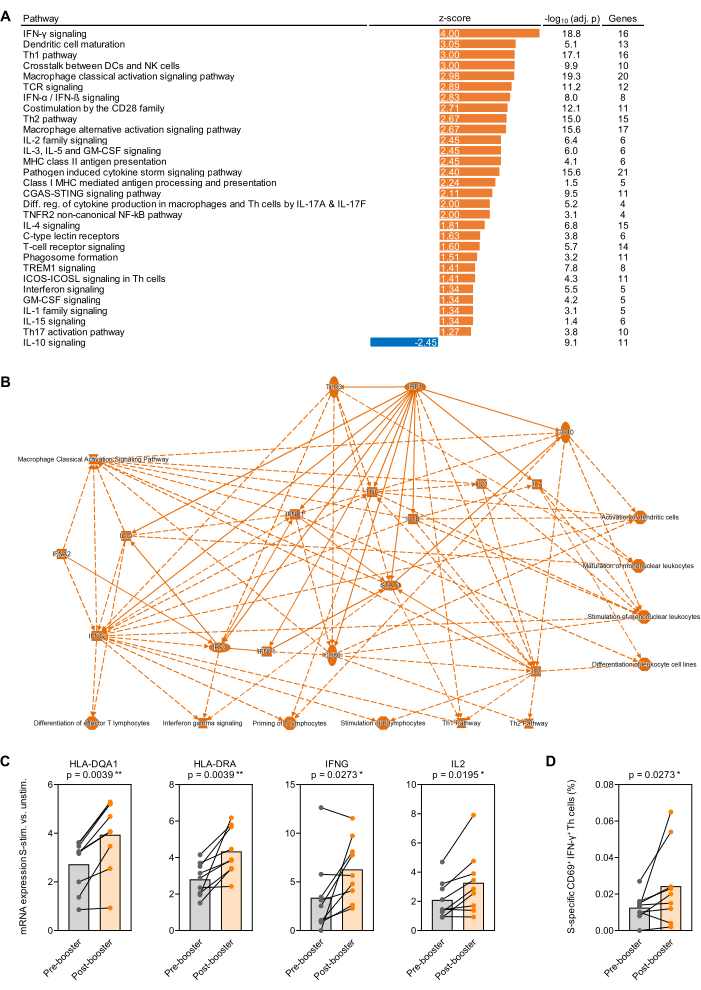
Figure 4 : Modifications transcriptionnelles induites par l’antigène après la vaccination de rappel du SRAS-CoV-2. (A) L’enrichissement ajusté en fonction du contexte des voies transcriptionnelles dans le sang total stimulé par la protéine de spicule (Prot_S) du SRAS-CoV-2 après versus avant la (première) vaccination de rappel de l’ARNm BNT162b2 a été analysé chez 9 sujets adultes en bonne santé. Les voies canoniques liées au système immunitaire avec une valeur p ajustée à Benjamini-Hochberg (BH-adj.) <0,05 (-log10[BH-adj. p] >1,3) et un score z absolu >1,25 sont présentées. (B) Réseau simplifié résumant les gènes et les voies plus fortement enrichis dans le sang total stimulé par le S après par rapport à avant la vaccination de rappel. (C) Niveaux d’expression ajustés en fonction du contexte des gènes représentatifs associés à la présentation de l’antigène et à l’activation des lymphocytes T dans le sang total stimulé par Prot_S avant et après la vaccination de rappel. Test de Wilcoxon apparié. (D) Fréquences corrigées en fonction du bruit de fond des lymphocytes T IFN-γ+CD69+ spécifiques à l’IFN-Prot_S avant et après la vaccination de rappel. Test de Wilcoxon apparié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
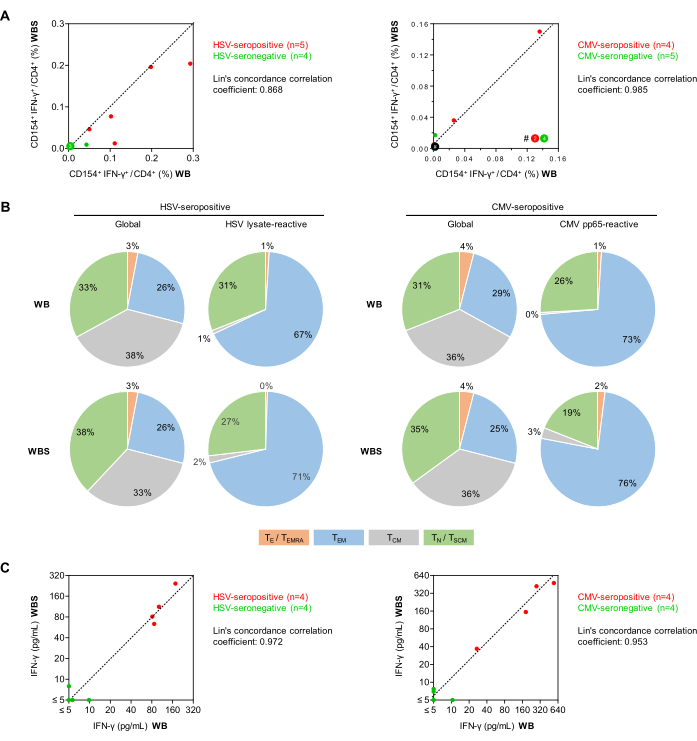
Figure 5 : Réactivité des lymphocytes T antiviraux en cytométrie en flux et ELISA. (A) Des diagrammes de corrélation des fréquences des lymphocytes T CD154+IFN-γ+/CD3+CD4+ corrigés du bruit de fond (cytométrie en flux) à partir des tests de sang total établis (WB) et de petits volumes (WBS) sont présentés. Les points verts et rouges représentent respectivement les sujets séronégatifs et séropositifs pour le virus testé. (B) À l’aide de l’évaluation cytométrique en flux de l’expression de CD45RO et CCR7, les phénotypes des lymphocytes T mémoire/effecteurs ont été déterminés parmi les lymphocytes T CD3+CD4+ globaux et les lymphocytes T IFN-γ+CD154+CD3+CD4+ réactifs à l’antigène après stimulation avec du lysat de VHS ou du CMV pp65 à partir de sang de donneurs séropositifs (n = 5 et 4, respectivement). Les distributions moyennes sont affichées. Vert : lymphocytes T naïfs (TN), CD45RO-CCR7+. Gris : cellules T à mémoire centrale (TCM), CD45RO+CCR7+. Bleu : lymphocytes T À MÉMOIRE EFFECTEUR (TEM), CD45RO+CCR7-. Orange : lymphocytes T effecteurs et lymphocytes T mémoires effecteurs réexprimant CD45RA (TE/TEMRA), CD45RO-CCR7-. (C) Graphiques de corrélation de la libération d’IFN-γ corrigée en arrière-plan (ELISA) mesurée à l’aide des tests WB et WBS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Contenu du tube de stimulus. Les concentrations de stock de stimuli et de solvants sont résumées. Le test de sang total (WB) à grande échelle est effectué à l’aide de 500 μL de sang total hépariné au lithium, tandis que la version à petite échelle (WBS) ne nécessite que 250 μL de sang. Pour le WBS, tous les volumes de réactifs représentent la moitié des volumes WB. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Données démographiques de sujets adultes en bonne santé échantillonnés pour générer les ensembles de données représentatifs. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Panel cytométrique en flux représentatif pour l’analyse des lymphocytes T. Ce panel de cytométrie en flux a été utilisé pour générer l’ensemble de données représentatif. Les résultats sont présentés en détail à la figure 3. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Panels de cytométrie en flux publiés précédemment. Les données utilisant ces combinaisons d’anticorps ont déjà été publiées par Tappe et al.24. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Les immunotests spécifiques à l’antigène donnent un aperçu des interactions hôte-microbe, sont essentiels pour la recherche sur la vaccination et l’immunothérapie, et sont de plus en plus reconnus comme des modalités de diagnostic et de pronostic chez les patients atteints d’infections opportunistes35. Ce protocole décrit un système de stimulation antigénique facile qui permet une analyse robuste et multimodale de l’immunité spécifique de l’antigène en utilisant des volumes sanguins minimaux (250-500 μL par antigène). Le protocole réduit de 250 μL a produit une excellente corrélation entre les fréquences des lymphocytes T spécifiques de l’antigène, les phénotypes et la production de cytokines par rapport au protocole de 500 μL précédemment établi. Malgré la disponibilité de solutions à petit volume pour certaines étapes du traitement des échantillons36, à la connaissance des auteurs, aucun système commercial actuellement disponible ne peut soutenir de manière fiable la stimulation antigénique et l’analyse fonctionnelle multidimensionnelle des réponses immunitaires fonctionnelles induites par les lymphocytes T par cytométrie en flux, tests de libération de cytokines et transcriptomique à partir de volumes sanguins de 250 à 500 μL. Le système commercial le plus largement utilisé, facilitant un éventail similaire d’applications de recherche, utilise un volume sanguin de 1 mL dans un environnement de stimulation de 3 mL, ce qui entraîne un coût et des quantités d’antigènes nécessaires considérablement plus élevés par rapport au protocole présenté ici 13,14,15.
Malgré l’optimisation continue des protocoles basés sur le sang total pour la quantification par cytométrie en flux des lymphocytes T spécifiques de l’antigène 6,37,38, les mesures par cytométrie en flux présentent plusieurs inconvénients. En particulier, ils restent laborieux par nature et sont difficiles à normaliser en raison de la variabilité considérable entre les opérateurs (par exemple, le processus subjectif de contrôle) et des différentes configurations d’équipements, protocoles de compensation et paramètres d’acquisition entre les laboratoires. Bien que la production de rapports normalisés39 et l’utilisation de logiciels d’analyse et de contrôle automatisés puissent améliorer la normalisation et la comparabilité d’ensembles de données multicolores de plus en plus complexes40,41, le protocole de stimulation décrit ici a été conçu pour s’adapter à diverses modalités de lecture non cytométriques en flux.
En particulier, les tests de libération de cytokines peuvent être effectués avec peu de temps de manipulation et un équipement relativement peu coûteux, et ils sont souvent facilement standardisés pour les applications cliniques de routine. De plus, comme l’ont montré des études antérieures utilisant ce protocole, une multitude de réponses aux cytokines peuvent être mesurées à partir de volumes d’échantillons minimaux avec des tests multiplexés modernes, permettant ainsi le profilage de signatures cytokiniques complexes dans des contextes de recherche24,42. Il convient de noter que ce protocole robuste avec double co-stimulation facilite la quantification fiable des réponses cytokiniques spécifiques de l’antigène chez les patients non lymphopéniques (>800 lymphocytes/μL de sang), même chez ceux recevant une immunosuppression iatrogène26,34. Comme inconvénient des tests de libération de cytokines, en particulier chez les patients atteints de leucopénie, les cytokines sécrétées ne peuvent pas être retracées dans des populations cellulaires individuelles. Dans certains cas, cela pourrait être atténué par l’utilisation de stimuli spécifiques aux cellules, le cas échéant. Cependant, une combinaison de concentrations de cytokines avec d’autres modalités de lecture et/ou un ajustement des réponses cytokiniques basé sur l’hématologie clinique (c’est-à-dire une numération sanguine complète avec différenciation des leucocytes) peut être nécessaire. Notamment, le protocole présenté ici permet une combinaison de lectures de cytokines et de signatures transcriptionnelles à partir du même échantillon, permettant ainsi une analyse concordante de marqueurs d’activation transcriptionnelle bien définis qui pourraient ajouter un contexte cellulaire et une spécificité aux signatures globales de cytokines.
Une étape future vers une standardisation complète et une praticabilité clinique encore meilleure serait l’automatisation complète de ces tests, du traitement des échantillons à la lecture de l’analyte. Même si l’isolement automatisé précis de populations cellulaires individuelles a été établi avec succès43,44, l’analyse des lymphocytes T spécifiques de l’antigène nécessite toujours que le personnel de laboratoire prenne des mesures de manipulation intermittentes. Cependant, l’omission de l’isolement cellulaire et de la manipulation des PBMC vulnérables et l’utilisation de tubes de stimulation commerciaux compatibles avec l’automatisation pourraient faciliter la mise en œuvre de flux de travail simples et entièrement automatisés à base de sang total pour les immunoessais fonctionnels.
Dans l’ensemble, les protocoles polyvalents à base de sang total, tels que celui présenté ici, sont très prometteurs pour étendre les applications des immunodosages fonctionnels spécifiques de l’antigène à de nouvelles cohortes de patients et à de nouveaux domaines de recherche, y compris les études précliniques sur de petits animaux. Les immunoessais fonctionnels spécifiques de l’antigène sont actuellement largement irréalisables dans des modèles murins ou nécessitent une accumulation de sang de plusieurs animaux et/ou l’utilisation d’extraits cellulaires non standardisés tels que les splénocytes. Compte tenu de l’intérêt émergent pour les interventions immunothérapeutiques visant à renforcer la défense de l’hôte contre les infections opportunistes (par exemple, les inhibiteurs de point de contrôle immunitaire, les facteurs de croissance hématopoïétiques, les cytokines, etc.) et de l’essor des technologies de vaccination innovantes, les immunodosages fonctionnels spécifiques de l’antigène devraient jouer un rôle croissant dans la recherche préclinique sur les maladies infectieuses et les applications cliniques dans diverses populations de patients. Le système de stimulation antigénique robuste, peu coûteux, facile à utiliser et à faible volume présenté ici peut faciliter des analyses immunitaires complètes spécifiques à l’antigène dans des zones inexploitées. De plus, la robustesse pré-analytique de ce protocole facile pourrait créer des opportunités pour une meilleure intégration des applications d’immunodosage dans la routine clinique, ce qui nous permettrait de nous rapprocher d’une prise en charge personnalisée des maladies infectieuses basée sur les biomarqueurs.
Déclarations de divulgation
Il n’y a aucun conflit d’intérêts à divulguer par les auteurs.
Remerciements
Nous remercions les services de chimie clinique et de sérologie des infections de l’Institut de médecine de laboratoire et de microbiologie de l’hôpital universitaire d’Augsbourg pour avoir effectué des mesures d’anticorps sériques. Nous remercions le Dr Friederike Liesche-Starnecker et l’Institut de pathologie et de diagnostic moléculaire de l’hôpital universitaire d’Augsbourg pour la mise à disposition des installations de transcriptomique. Nous remercions Marie Freitag de l’hôpital universitaire d’Augsbourg pour son soutien dans la logistique des vaccinations et l’acquisition d’échantillons. Nous remercions le Dr Olaf Kniemeyer et l’Institut Hans-Knoell d’Iéna, en Allemagne, de nous avoir fourni du lysat d’Aspergillus fumigatus . L’initiative de recherche Bay-VOC (numéro de financement GE2-2452-200-D37666/2022), le ministère bavarois des Sciences et des Arts, ainsi que l’Université d’Augsbourg, en Allemagne, ont soutenu ces travaux.
matériels
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
Références
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon