Method Article
Fungal ve Viral Patojenlere Karşı Konak Bağışıklığının Antijene Özgü Analizi için İkili Ko-stimülasyonlu Tam Kan Testi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Tam kan bazlı immünolojik testler, tanı ve araştırma amaçları için antijene özgü bağışıklığı analiz etmek için kolay ve kaynak açısından verimli bir araç sağlar. Bu makale, pediatrik hastalar ve küçük hayvanlar için düşük hacimli bir versiyon da dahil olmak üzere, mantar ve viral patojenlere karşı konak bağışıklığının kapsamlı analizi için ikili ko-stimülasyonlu optimize edilmiş bir tam kan bazlı protokol sağlar.
Özet
Hızlı ve kaynak açısından verimli numune işleme, yüksek verim ve yüksek sağlamlık, gelişmiş antijene özgü immünolojik testlerin etkili bilimsel ve klinik uygulaması için kritik öneme sahiptir. Geleneksel olarak, bu tür immünolojik testler, özellikle akış sitometrisi veya enzime bağlı immünosorbent nokta testleri ile antijene özgü T hücresi analizi, genellikle periferik kan mononükleer hücrelerinin izolasyonuna dayanır. Bu işlem zaman alıcıdır, birçok analitik öncesi karışıklığa tabidir ve büyük kan hacimleri gerektirir. Tam kan bazlı tahliller, artan analiz öncesi sağlamlık ve daha düşük kan hacmi gereksinimleri ile kolay bir alternatif sunar. Ayrıca, tam kan bazlı tahliller, izole hücre alt kümeleri kullanılarak yapılan tahliller tarafından yakalanmayan hücreler arası etkileşimlerin korunmasına izin verir. Son zamanlarda, çeşitli fungal ve viral antijenlere yanıt olarak hem antijene özgü T hücresi fonksiyonlarının hem de karmaşık hücreler arası etkileşimlerin kapsamlı analizi için ikili anti-CD28 ve anti-CD49d ko-stimülasyonu ile rafine bir tam kan immünolojik testi önerilmiştir. Bu protokol, stimülasyon tüplerinin hazırlanması, kan stimülasyonu ve akış sitometrisi, sitokin sekresyon testleri ve transkripsiyonel analizler için aşağı akış numune işleme için rehberlik sağlar. Bu, akış sitometrik ve sitokin bazlı T hücresi izlemeyi pediatrik hastalarda yapılan çalışmalar veya küçük hayvanlarda (örn. fareler) klinik öncesi çalışmalar için daha erişilebilir hale getirmek için doğrulanmış ve işlevsel olarak eşdeğer, daha önce yayınlanmamış, düşük hacimli bir protokolü (250 μL) içerir. Toplamda, bu protokoller hem klinik hem de translasyonel araştırma ortamlarında karmaşık antijene özgü bağışıklık analizi için çok yönlü bir araç kutusu sağlar.
Giriş
Antijene özgü bağışıklığın, özellikle spesifik T hücresi yanıtlarının niceliği ve karakterizasyonu, immünobiyoloji ve aşılama araştırmalarının yanı sıra bazı tanı testleri için çok önemlidir. Geleneksel olarak, antijene özgü immünolojik testler genellikle izole edilmiş periferik kan mononükleer hücrelerine (PBMC'ler) dayanır. Bununla birlikte, bu hücrelerin izolasyonu zaman alıcı ve kaynak yoğundur ve genellikle nispeten büyük kan hacimleri gerektirir. Ek olarak, pre-analitik depolama sırasında granülosit aktivasyonunu ve müteakip T hücresi bozulmasını önlemek için1 numunelerin hızlı işlenmesi çok önemlidir ve bu genellikle klinik uygulamada mümkün değildir. Bu sınırlamalar, yüksek verimli araştırma senaryolarında ve klinik rutinlerde antijene özgü immünolojik testlerin uygulanabilirliğini engellemektedir. Bu nedenle, son yıllarda kullanımı kolay ve potansiyel olarak otomatikleştirilebilir tam kan bazlı yaklaşımların geliştirilmesi, immünoassay uygulamalarında yeni alanlar açmıştır. Bununla birlikte, ticari olarak mevcut sistemler genellikle T hücreleri için en uygun yardımcı uyarıcı ortamlardan yoksundur ve analiz öncesi gecikmelere karşı hassastır. Örneğin, yaygın olarak kullanılan tam kan bazlı bir IFN-γ salınım testi, 6 saatlik pre-analitik kan depolamasından sonra %19'luk bir pozitiften negatife geri dönüş oranına sahiptir2. Bu sınırlamaların üstesinden gelmek için çift anti-CD28 ve anti-CD49d ko-stimülasyonu ile optimize edilmiş protokoller geliştirilmiştir 3,4,5,6.
Burada sunulan protokol, antijene özgü T hücrelerinin doğru ve tekrarlanabilir bir şekilde ölçülmesine ve karakterizasyonuna, antijenin neden olduğu sitokin yanıtlarının değerlendirilmesine ve minimum kan hacminden, yani stimülasyon tüpü başına 500 μL kandan diğer (akış sitometrik veya transkripsiyonel) fonksiyonel immün belirteçlere izin verir. Bu protokolün diğer avantajları arasında düşük uygulama süresi, analiz öncesi karışıklıklara karşı yüksek esneklik ve nispeten fizyolojik bir ex vivo ortamda fonksiyonel hücreler arası etkileşimlerin korunması yer alır. Tam kan bazlı akış sitometrik antijene özgü T hücresi karakterizasyonunun geleneksel PBMC bazlı testlerden üretilen verilerle karşılaştırılabilirliği daha önce küf spesifik T hücresi miktar tayini6 bağlamında gösterilmiştir. Ayrıca, deneklerin kanının doğrudan uyarılması, optimal PBMC stimülasyonu için yaygın olarak gerekli olan otolog, allojenik ve hatta ksenojenik serum ile takviye ihtiyacını ortadan kaldırır. Hücre izolasyonunun ihmal edilmesi ayrıca kesme ve sıcaklık stresini azaltır, böylece hücre canlılığını artırır. En önemlisi, tam kan bazlı tahliller, PBMC'lerinizolasyonu için gradyan santrifüjleme sırasında kaybedilen granülosit popülasyonlarını korur 7. Böylece, bu tahlil kurulumu, granülositler ve mononükleer hücreler arasındaki fonksiyonel etkileşim döngülerini korur ve yakalar4.
Dikkat çekici bir şekilde, bu protokol farklı okuma modalitelerini barındırmak için yalnızca minimum modifikasyonlar gerektirir ve hatta aynı stimülasyon tüpünden sitokin salınımı ve transkripsiyonel yanıtların ikili analizine izin verir. Spesifik olarak, sitokinler stimülasyondan sonra kültür süpernatından analiz edilirken, hücre peleti sonraki transkriptomik analiz ile RNA izolasyonu için kullanılabilir. Çeşitli okuma modaliteleri için genel iş akışı Şekil 1'de özetlenmiştir.
Son yıllarda, araştırma ve klinik ortamlarda patojen-reaktif immün izleme için, örneğin Mycobacterium tuberculosis8,9, Bordetella pertussis3, Orientia tsutsugamushi10 ve SARS-CoV-2 5,11,12 için artan sayıda tam kan bazlı test geliştirilmiştir. Örneğin, M. tuberculosis, Influenza A virüsü ve SARS-CoV-2 dahil olmak üzere çoklu antijenler için önceden kurulmuş bir sistem kullanılmıştır, ancak T-helper (Th) hücre stimülasyonu 13,14,15 için optimize edilmiş ko-stimülatör faktörleri kullanmaz. Bu tahliller için gereken kan hacmi, geleneksel PBMC bazlı tahliller veya ticari olarak temin edilebilen tam kan stimülasyon kitleri için kullanılandan önemli ölçüde daha düşük olsa da, pediatri, neonatoloji, yoğun bakım ünitesindeki hastalar (YBÜ) ve küçük hayvan modellerinde klinik öncesi araştırmalar. Örneğin, farelerden terminal kan örneklemesi bile (ör., kardiyak ponksiyon ile) genellikle maksimum 0.7-1 mL kan verir. Bu nedenle, stimülasyon tüpü başına 250 μL kan hacminden antijen-reaktif T hücresi yanıtlarının kesin miktar tayini ve karakterizasyonu için önceden belirlenmiş tam kan bazlı immünoassay protokollerinin4,6 daha da küçültülmesi olasılığı bu protokolün bir parçası olarak değerlendirilmiştir.
Protokol
Münih Ludwig Maximilians Üniversitesi etik kurulu (proje numarası 21-0689) insan kanı örneklerinin toplanmasını onayladı. Ek olarak, temsili veri kümelerinin bir kısmı, Münih Ludwig Maximilians Üniversitesi etik komitesi tarafından da onaylanan 20-426 numaralı Corona-Register-Study altında oluşturulmuştur. Bilgilendirilmiş onam alındı.
1. Tam kan stimülasyon tüplerinin hazırlanması
NOT: Bu adım Lauruschkat ve ark.4 ve Weis ve ark.6'dan uyarlanmıştır. Tablo 1 , ayrıntılı reaktif konsantrasyonlarını ve hacimlerini özetlemektedir.
- Steril koşullar altında (steril çalışma tezgahı), anti-koagülan içermeyen, antijenler ve ko-stimülatör antikorlar içeren 2.7 mL kan alma tüpleri hazırlayın. Negatif kontrol de dahil olmak üzere her tüpe 1 μg / mL α-CD28 ve 1 μg / mL α-CD49d ekleyin. Nihai konsantrasyonları (250 μL veya 500 μL) belirlerken tam kan stimülasyonu için eklenecek kan hacmini göz önünde bulundurun. Hazne geometrisini ve numune erişilebilirliğini korumak için pistonu kan alma tüpünden geri çekmeyin.
- Çalışma tasarımına dayanarak, negatif kontrol tüplerinin ek bir uyaran içermemesi ( Tablo 1'de gösterildiği gibi uyarılmamış arka plan kontrolü) veya çalışma kohortunun antijene özgü T hücrelerini barındırmaması veya minimal düzeyde barındırması gereken antijenler kullanıp kullanmaması gerektiğini belirleyin (ör., HIV-seronegatif bireylerde bir HIV peptit havuzu 16).
- Antijene özgü stimülasyon için, ön deneylerde titrasyon yoluyla ideal antijen konsantrasyonlarını optimize edin. Aşağıdaki temsili verileri oluşturmak için aşağıdaki optimize edilmiş antijen konsantrasyonlarını kullanın: 1.2 μg/mL HSV-1 lizat, 0.6 nM/peptit/mL CMV pp65, 0.6 nM/Peptit/mL SARS-CoV-2 Prot_S, 50 μg/mL Aspergillus fumigatus lizat ve 1 ng/mL CRX-527.
- Özellikle lenfopenik hastalarda veya immünosüpresif farmakoterapi alan hastalarda yapılan çalışmalar için pozitif bir kontrol ekleyin. Sitomegalovirüs, parainfluenza virüsü ve influenza virüsü peptitlerinden oluşan CPI pozitif kontrol solüsyonu (0.6 nM / peptid / mL) kullanın.
NOT: Alternatif olarak, PMA (10 μg/mL) ± iyonomisin (1 μg/mL) gibi sentetik uyaranlar kullanılabilir, ancak bunlar daha az fizyolojik reaksiyona neden olur ve akış sitometrisi için popülasyon belirteçleri olarak yaygın olarak kullanılan yüzey antijenlerinin ekspresyonunu etkileyebilir (en önemlisi, CD417). Ko-stimülatör antikorların çoğu sentetik pozitif kontrol uyaranıyla birlikte gerekli olmadığını ve hatta hücre canlılığını ve yanıtını olumsuz yönde etkileyebileceğini unutmayın. - Tüm stimülasyon tüplerindeki reaktif hacimlerini uyumlu hale getirmek için, aşağıdaki toplam hacimlere kadar RPMI 1640 ortamı ekleyin: Akış sitometrisi için tam ölçekli test: 50 μL; Sitokin analizi ve transkriptomik için tam ölçekli test: 500 μL; Akış sitometrisi için küçük ölçekli test: 25 μL; Sitokin analizi ve transkriptomik için küçük ölçekli test: 250 μL.
NOT: Birden fazla stimülasyon tüpü setinin hazırlanması için, daha düşük kontaminasyon riski ve düşük ko-stimülatör faktör ve uyaran hacmi nedeniyle tüm bileşenleri içeren ana karışımların hazırlanması önerilir. - Hazırlanan tüpleri hemen kullanın veya -20 °C'de dondurarak saklayın. Çoğu reaktif 4 haftaya kadar saklanabilir; Bununla birlikte, yeni reaktifler/uyaranlar için maksimum saklama sürelerini önceden doğrulayın.
2. Tam kan örneklerinin uyarılması ve inkübasyonu
- Tam kan stimülasyonundan yaklaşık 30-60 dakika önce, kullanıma hazır stimülasyon tüplerini çözdürün ve oda sıcaklığında tutun.
- Lityum heparin antikoagülanı içeren kan alma tüplerini kullanarak vericiden/hastadan venöz kan alın. Toplanan kan hacminin bireysel deney gereksinimlerini karşıladığından emin olun, yani negatif ve pozitif kontrol dahil olmak üzere küçük ölçekli testin 3 koşulu için minimum 750 μL gereklidir. Ticari olarak elde edilen kan alma tüpleri için, 16 - 25 IU / mL kan heparin çalışma konsantrasyonları elde etmek için bunları tamamen doldurun.
NOT: Temsili veri kümelerini oluşturmak için işe alınan sağlıklı yetişkin deneklerin demografik verileri Tablo 2'de gösterilmektedir. - Gerekli miktarda heparinize tam kanı (küçük veya tam ölçekli tahlil için sırasıyla 250 μL veya 500 μL) steril bir tezgah altında pipetleyerek stimülasyon tüplerine aktarın.
NOT: Steril bir çalışma tezgahı mevcut değilse veya minimum enfeksiyon riski gösteren numunelerle (yani, önceden taranmış insan deneklerin veya hayvanların kanı) çalışırken, numuneler steril şırıngalar kullanılarak stimülasyon tüplerine aktarılabilir. Bu yöntem aynı zamanda kan alımından hemen sonra yatak başında numune işlemeye olanak tanır, bu da preanalitik depolamayı ve T hücresi bozulmasını en aza indirir. Kanı enjekte etmeden önce, hem kan alma tüpünün hem de tüm stimülasyon tüplerinin lastik contalarını alkollü bir dezenfektanla kapsamlı bir şekilde dezenfekte edin. Dezenfektanı en az 1 dakika kurumaya bırakın. - Stimülasyon tüplerini 5x-10x dikkatlice ters çevirin. Stimülasyon tüplerini 37 °C'lik bir inkübatöre yerleştirin. Bir CO2 inkübatörünün gerekli olmadığını unutmayın. Spesifik olmayan nötrofil aktivasyonunu önlemek için kan alma tüpünü soğutmayın.
NOT: Bu protokol, numune taşınmasına izin vermek için oda sıcaklığında 8 saate kadar analiz öncesi kan saklama için doğrulanmıştır. Mümkünse, ko-stimülatör faktörler lenfosit canlılığını artıracağından, toplama yerindeki stimülasyon tüplerine tam kan enjekte etmek ve kanın stimülasyon tüplerindeki merkezi bir laboratuvara taşınması tercih edilir18,19. - Sadece hücre içi boyama ile akış sitometrik tahlilleri için kullanılan numuneler için, 4 saatlik inkübasyondan sonra her bir stimülasyon tüpüne brefeldin A (10 μg / mL'lik nihai konsantrasyon) ekleyin.
- RPMI'de 1 mg / mL brefeldin A çözeltisi hazırlayın ve 100 μL numune hacmi başına 1 μL çözelti ekleyin (ör., önceden karıştırılmış stimülasyon kokteyli + tam kan hacmi). Tüplerin kapağını açarak ve steril bir tezgah altında pipetleyerek brefeldin A'yı ekleyin. Tüpleri 37 °C'de 16-18 saat daha (toplamda 20-22 saat) 37 °C'lik inkübatöre geri dönün ve geri koyun.
- Sitokin sekresyon testleri veya transkripsiyonel analizler için brefeldin A eklemeyin ve numuneleri 37 ° C'de 24-26 saat boyunca sürekli olarak inkübe edin.
NOT: Brefeldin A, Golgi aygıtını inhibe eder ve böylece sitokin salgılanmasını ve proteinlerin hücre yüzeyine taşınmasını engeller. Sekresyon veya yüzey ekspresyonu, sırasıyla yeniden içselleştirmeden sonra protein kaybı ve bozunması ile sonuçlanacağından, ekzositoz inhibitörleri, sitokinlerin hücre içi birikimi ve boyanması ve akış sitometrisi çalışmaları için bazı aktivasyon belirteçleri (örneğin, CD154) için gereklidir. Bununla birlikte, brefeldin A ayrıca transkriptomda görülebilen fizyolojik hücresel süreçleri bozar ve kültür süpernatantlarından(20,21) sitokin sekresyon testlerini geçersiz kılar, bu da bu okumaları paralel olarak gerçekleştirmek için iki ayrı test tüpünün (biri brefeldin A ile ve diğeri brefeldin A olmadan) kullanılmasını gerektirir.
3. Akış sitometrisi için numunelerin hazırlanması
- Her bir stimülasyon tüpüne 500 μL 0.5 M EDTA çözeltisi ekleyin ve yapışan hücreleri tüplerin yüzeyinden ayırmak için numuneyi oda sıcaklığında 15 dakika inkübe edin.
- Numuneleri yeni 15 mL'lik santrifüj tüplerine aktarın. Kalan kan hücrelerini toplamak için stimülasyon tüplerini 1 mL eritrosit lizis tamponu ile durulayın, ardından tamponu ve hücreleri aynı 15 mL santrifüj tüplerine ekleyin.
- 15 mL'lik tüpleri 600 x g'da 7 dakika santrifüjleyin. Süpernatanı dikkatlice atın.
- Eritrosit lizis tamponunda kan hücresi peletini yeniden süspanse edin (Şekil 2A). 500 μL tam kan için 5 mL eritrosit lizis tamponu ve 250 μL tam kan için 3 mL kullanın.
NOT: Optimal eritrosit lizis koşullarının, kullanılan spesifik tampon (kurum içi veya ticari ürün içinde hazırlanan) için önceden değerlendirilmesi gerekir. Burada verilen talimatlar, malzeme tablosunda listelenen eritrosit lizis tamponu için optimize edilmiştir. - Numuneler berrak görünene kadar numuneleri oda sıcaklığında inkübe edin (Şekil 2B). Granülosit lizizini ve agregasyonunu önlemek için, 6 dakikalık inkübasyonu aşmayın. Başarılı eritrosit lizizinin bir göstergesi, sıvının içinden 15 mL'lik tüp üzerindeki sayıları ve ölçeği görme yeteneğidir (Şekil 2C).
- 15 mL'lik tüpleri 600 x g'da 7 dakika santrifüjleyin. Süpernatanı dikkatlice atın, hücre peleti hala gözle görülür şekilde kırmızıysa 3.4-3.5 adımlarını tekrarlayın.
- Hücre peletini 1 mL HBSS'de yeniden süspanse edin ve hücreleri 2 mL reaksiyon tüplerine aktarın.
- 2 mL'lik tüpleri 400 x g'da 5 dakika santrifüjleyin. Süpernatanı dikkatlice atın.
- Hücre içi boyama kiti ve kullanılan antikorlar için üreticinin talimatlarına göre akış sitometrik boyama yapın.
NOT: Temsili veri setini oluşturmak için kullanılan antikor paneli Tablo 3'te özetlenmiştir.
4. Sitokin tahlilleri için numunelerin hazırlanması
- Adım 2.6'dan sonra, seyreltilmiş kanı stimülasyon tüplerinden 1.5 mL'lik tüplere aktarın.
- 1.5 mL'lik tüpleri 2000 x g'da 20 dakika santrifüjleyin. Süpernatanı dikkatlice 1,5 mL'lik yeni bir tüpe pipetleyin ve hemen sitokin analizi için kullanın veya süpernatanları -80 °C'de kriyoprezervasyon yapın.
- Analizden önce, özellikle çözüldükten sonra artık hücre kalıntılarını gidermek için süpernatanı ≥ 7000 x g'de (1.5 mL tüplerde) 5 dakika boyunca tekrar santrifüjleyin. Sitokin tahlil protokolüne bağlı olarak, numunelerin ön seyreltmesini gerçekleştirin.
- Hücre peletini 1 mL RNA koruma tamponunda yeniden süspanse edin ve sonraki RNA izolasyonu için -80 °C'de kriyoprezervasyon yapın. Alternatif olarak, RNA izolasyon kiti (veya kurum içi protokol) talimatlarına göre anında RNA izolasyonu için hücre peletini lizis tamponunda yeniden süspanse edin.
NOT: Gerekirse, sonraki RNA işleme protokolüne bağlı olarak, RNA koruma tamponu eklenmeden önce 3.4-3.5'e benzer bir eritrosit lizis adımı eklenebilir.
Sonuçlar
Patojenle ilişkili antijenlerle tam kan stimülasyonu sonrası antijene özgü immün yanıtların multimodal analizi
Temsili bir veri seti oluşturmak için, SARS-CoV-2 aşıları almış HSV-1 ve CMV için sağlıklı bir yetişkin donör seropozitif seçildi. Uyarılmamış bir kontrole ek olarak, yukarıda açıklandığı gibi aşağıdaki uyaranlar kullanılmıştır: Herpes simpleks virüsü 1 (HSV) lizat (üreticinin tavsiyesi, yayınlanmamış veriler), sitomegalovirüs (CMV) pp6522, şiddetli akut solunum sendromu koronavirüs 2 (SARS-CoV-2) Prot_S 5,23, Aspergillus fumigatus lizat (her yerde bulunan bir çevresel patojen)4,24, CRX-527 (T hücrelerini kendi içinde aktive etmemesi gereken lipopolisakkarit bazlı bir Toll benzeri Reseptör 4 uyarıcısı)25 ve CPI (CMV, parainfluenza virüsü ve influenza virüsü peptitlerinden oluşan CD4+ T hücresi aktivasyonu için pozitif kontrol)26. Akış sitometrik verileri ve geçit stratejisi Şekil 3'te gösterilmektedir. Genel olarak, nadir hücre popülasyonlarını (50.000 - 100.000 lenfosit) hedeflerken mümkün olduğu kadar çok lenfositin ölçülmesi tavsiye edilir, çünkü ölçümlerin kesinliği ve güvenilirliği toplam olay sayısınabağlıdır 27. Uyarılmamış numune, tek tek hücre alt kümelerinin (örneğin, CD3 + CD4 + hücreleri) geçitlenmesi için kullanılır. Bellek T hücresi fenotiplemesi için CD45RO ve CCR7 kapıları, toplam CD3 + CD4 + popülasyonunda ayarlanmalı ve daha sonra aktivasyon belirteci pozitif popülasyonlara aktarılmalıdır, çünkü ikincisi üzerindeki düşük olay sayıları genellikle farklı popülasyonların net bir şekilde tanımlanmasını önler. Bireysel kapılar için, örneğin lenfosit canlılığındaki farklılıkları hesaba katmak için küçük ayarlamalar gerekli olabilir. CD154'ün (veya CD40 ligandının) yukarı regülasyonu, küresel, tutarlı ve hızlı bir şekilde indüklenen bir T-yardımcı hücre aktivasyon belirteciolarak tanımlanmıştır 28,29. IFN-γ, en belirgin ve tip 1'e özgü T hücresi aktivasyon belirteçlerinden biri olarak kabul edilir30,31. Daha da önemlisi, bu test çeşitli ek aktivasyon, tükenme ve sitokin belirteçleri ile test edilmiş ve yayınlanmıştır (bakınız Tablo 4 ve24).
Uyarılmamış örnekteki aktivasyon markörü pozitif popülasyonların frekansları, spesifik olmayan arka planları temsil eder ve antijen ile uyarılan frekanslardan çıkarılmıştır. Spesifik olmayan arka planın çıkarılmasından sonra, temsili donörde sırasıyla% 0.75 (HSV),% 0.09 (CMV),% 0.06 (SARS-CoV-2)% 0.34 (A. fumigatus),% 0.00 (CRX-527) ve% 1.21 (CPI) spesifik CD154 +/CD3 + CD4 + T-yardımcı hücreleri vardı. IFN-γ ekspresyonu benzer şekilde analiz edilebilir ve %0.12 (HSV), %0.07 (CMV), %0.03 (SARS-CoV-2), %0.04 (A. fumigatus), %0 (CRX-527) ve %0.74 (CPI) IFN-γ+/CD3+CD4+ hücreleri.
T hücresi popülasyonları ayrıca naif T hücreleri (TN, CD45RO-CCR7 +), merkezi bellek T hücreleri (TCM, CD45RO + CCR7 +), efektör bellek T hücreleri (TEM, CD45RO + CCR7-) ve efektör T hücreleri (ve CD45RA, TE / TEMRA, CD45RO--CCR7-'yi yeniden eksprese eden efektör bellek T hücreleri) olarak alt gruplara ayrılabilir. Global CD3 + CD4 + T hücreleri arasında, temsili donör, uyarılmamış numune kullanılarak belirlendiği gibi sırasıyla% 38.34T N,% 38.33 TCM,% 20.77 TEM ve% 2.56 TE / TEPRA'ya sahipti (Şekil 3A). Bununla birlikte, antijene özgü reaktif T-yardımcı hücreler (CD154 + IFN-γ +) arasında, TCM ve TEM, sırasıyla% 22.14 ve% 73.97 ile en belirgin alt gruplardı.
Ek lökosit popülasyonlarına ilişkin veriler daha önce bu metodoloji kullanılarak yayınlanmıştır24. Kullanılan antikor kombinasyonları, daha fazla referans için Tablo 4'te sunulmuştur.
Ayrıca, bu metodolojinin tam potansiyelini göstermek için, ikinci bir uyarılmış numune seti üzerinde (brefeldin A ilavesi olmadan) bir IFN-γ ELISA gerçekleştirilmiştir. IFN-γ ELISA kitinin tespit aralığının aşılmasını önlemek için, CPI ile uyarılmış numunelerden alınan plazma 1: 4 oranında önceden seyreltildi. Aşağıdaki IFN-γ konsantrasyonları, deneğin kan hacminin mL'si başına ölçüldü ve normalize edildi, D.D., hem stimülasyon tüplerinde hem de ELISA öncesi seyreltmelerde seyreltme için düzeltildi: 0 pg / mL (uyarılmamış), 69.4 pg / mL (HSV), 471 pg / mL (CMV), 17.8 pg / mL (SARS-CoV-2), 61.9 pg / mL (A. fumigatus), 34.0 pg / mL (CRX-527) ve 1958 pg / mL (CPI).
Son olarak, RNA aynı örneklerden tutarlı sonuçlarla izole edildi. Ortalama verim 719 ng idi ve 260nm / 280nm ortalama absorbans oranı 1.98 idi.
Toplamda, bu veri seti, sunulan protokolün, minimal kan hacmi, yani çoklu uyaranlar ve okuma modaliteleri için toplam 8 mL kullanılarak çok yönlü bir okuma spektrumuna ve çeşitli enfeksiyonla ilişkili antijenlerin eşzamanlı analizine izin verdiğini göstermektedir.
Antijenle uyarılmış tam kan kullanarak aşılama yanıtını izlemek için transkripsiyonel analizler için temsili veri seti
Antijenle uyarılmış tam kan üzerinde gerçekleştirilen transkripsiyonel çalışmalar için bir prensip kanıtı olarak, BNT162b2 (SARS-CoV-2 mRNA aşısı) ile ilk takviye aşılamasından hemen önce ve 1 ay sonra 9 sağlıklı yetişkin denekten kan alındı.32,33 İlk iki dozluk aşı serisinden 7-9 ay sonra. 500 μL uyarılmamış ve Prot_S uyarılmış tam kandan elde edilen ortalama RNA verimi, ortalama 260/280 absorpsiyon oranı 1.99 olan 1.1 μg yüksek saflıkta RNA idi. nCounter analizinin ardından, RNA sayıları panelin 12 temizlik genine (geometrik ortalama) normalize edildi. Daha sonra, her bir denek ve gen için Prot_S ile uyarılan örneklerdeki normalleştirilmiş mRNA sayımlarının uyarılmamış arka plan kontrollerine oranı belirlendi. Aşılama sonrası ve aşılama öncesi ölçümlerin medyan-medyan oranları belirlendi ve Malzeme Tablosunda listelenen yazılım paketi kullanılarak yol zenginleştirme analizi yapıldı. Kanonik yolların zenginleşmesi, 1.25'≥ mutlak z-skor değerinde ve 0.05< Benjamini-Hochberg düzeltilmiş p-değeri ile anlamlı kabul edildi. Önemli ölçüde farklı şekilde zenginleştirilmiş yollar Şekil 4A'da özetlenmiştir ve Şekil 4B'de Prot_S aşılama sonrası ve öncesi yanıtta arka plana göre ayarlanmış basitleştirilmiş bir değişiklikler ağı gösterilmektedir. Ek olarak, antijen sunan hücre olgunlaşması ve güçlendirici aşılamadan sonra Prot_S ile indüklenen T hücresi aktivasyonu ile ilgili temsili genlerin daha güçlü arka plan ayarlı indüksiyonu (p < 0.01-0.03) Şekil 4C'de gösterilmiştir. Son olarak, çoğu donörde aşılamadan sonra arka plana göre ayarlanmış Prot_S spesifik tip 1 T-yardımcı hücrelerinde (CD69 + IFN-γ +) bir artış, ikinci bir stimülasyon tüpü seti kullanılarak akış sitometrisi ile doğrulandı (p = 0.03, Şekil 4D).
Tam ölçekli ve küçük hacimli tam kan bazlı immünoassay protokollerinde virüse duyarlı T hücresi yanıtlarının karşılaştırılması
Daha sonra, sağlıklı gönüllülerde virüse duyarlı CD154+IFN γ+ T-yardımcı hücrelerin (CD3+CD4+ hücreleri) frekansları, tam ölçekli (500 μL, WB) ve küçük hacimli (250 μL, WBS) tam kan antijen stimülasyon protokolleri kullanılarak karşılaştırıldı (Şekil 5). Daha önce bildirildiği gibi34, ikili ko-stimülasyona rağmen her iki protokolde de CD154 + IFN-γ + hücrelerinin minimal spesifik olmayan arka plan frekansları görülmüştür (ortalama, WB ve WBS için sırasıyla% 0.010 ve% 0.011). Dikkat çekici bir şekilde, spesifik olmayan arka plan yanıtları antijene özgü yanıtlardan çıkarılsa da, daha önce tartışıldığı gibi hala artan test belirsizliğine katkıda bulunurlar27. Yüksek arka plan sinyalleri (ör.% > 0.07-0.1% CD154 + Th hücreleri veya >% 0.05 CD154 + IF γ + hücreleri) numune kontaminasyonunu, deneğin akut bir enfeksiyonunu gösterebilir veya uygun olmayan analitik öncesi numune işlemenin sonucu olabilir.
Seropozitif donörlerde (n = 5) ortalama HSV lizat-reaktif T hücresi frekansları, seronegatif donörlerde (n = 4) WB ve WBS sistemlerinde sırasıyla% 0.151 ve% 0.107 iken, seronegatif donörlerde% 0.012 ve% 0.004 idi (n = 4). CMV pp65 peptit havuzu ile seropozitif donörlerde (n = 4), seronegatif donörlerde (n = 5) %0.001 ve %0.004'e kıyasla %0.041 ve %0.049 reaktif T hücreleri vardı. Lin'in uyum korelasyon katsayıları HSV için 0.868 ve CMV için 0.985 idi ve bu da güçlü bir korelasyon olduğunu düşündürmektedir (Şekil 5A). Özellikle, CMV'ye özgü T hücresi testi, yakın zamanda reaktivasyon olayı olmayan sağlıklı seropozitif hastalarda negatif olabilir. Hem total hem de antijen reaktif CD3 + CD4 + T-yardımcı hücre repertuarları, CCR7 ve CD45RO ekspresyonuna dayalı olarak daha da farklılaştırıldı (Şekil 5B). Güven verici bir şekilde, WB ve WBS protokolleri kullanılarak elde edilen sonuçlar hem toplam hem de antijen reaktif popülasyonlar için karşılaştırılabilirdi. Beklendiği gibi, her iki tahlilde de, daha farklılaşmış bellek Th hücrelerinin (yani, efektör bellek hücreleri) oranı, antijen-reaktif T hücreleri arasında toplam Th-hücresi popülasyonundan daha yüksekti. Beklendiği gibi, sadece birkaç saf T hücresi viral uyarıcılar tarafından aktive edildi (Şekil 5B).
Ayrıca, başka bir deney setinde, uyarılmış kültür süpernatanları IFN-γ ELISA ile analiz edildi (Şekil 5C). Minimal spesifik olmayan bir arka plan görüldü (WB ve WBS protokollerinde sırasıyla 1.29 pg/mL ve 2.18 pg/mL ortalamaları). HSV-seropozitif donörlerden alınan kan örnekleri, WB ve WBS sisteminde sırasıyla 111 pg / mL ve 125 pg / mL'lik arka plana göre ayarlanmış HSV kaynaklı IFN-γ konsantrasyonları gösterdi. Buna karşılık, seronegatif örneklerdeki IFN-γ konsantrasyonları her iki sistemde de sürekli olarak 10 pg / mL'nin altındaydı (Lin'in uyum korelasyon katsayısı = 0.972, Şekil 5C). Benzer şekilde, CMV seropozitif donörlerden alınan kanın pp65 ile uyarılması, WB ve WBS sistemlerinde sırasıyla 258 pg / mL ve 272 pg / mL'lik ortalama IFN-γ konsantrasyonları verirken, seronegatif örnekler kullanılarak her iki sistemde de minimal pp65 kaynaklı IFN-γ sekresyonu görülmüştür (Lin'in uyum korelasyon katsayısı = 0.953, Şekil 5C).
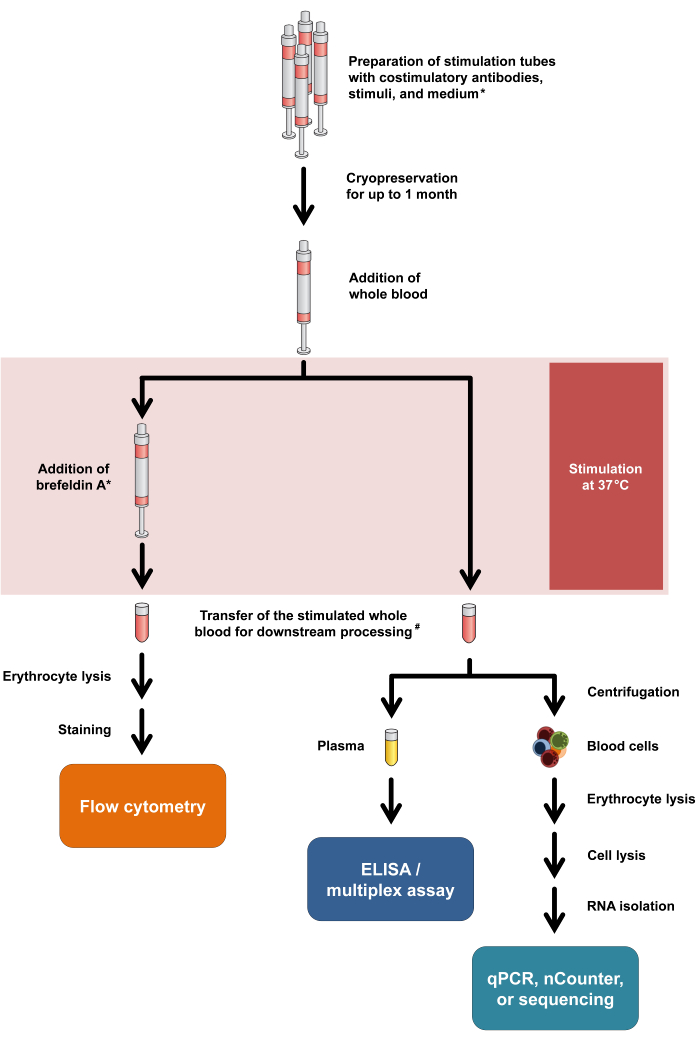
Şekil 1: Deneysel prosedürleri ve okumaları özetleyen akış şeması. Yıldız, bazı T hücresi aktivasyon belirteçleri (örneğin, CD154) ve hücre içi sitokin boyaması için Brefeldin A'nın gerekli olduğu anlamına gelir. Protokol adımları 2.5 ve 2.6'ya bakın. #: Akış sitometrisi için kan başlangıçta eritrosit lizizi için 15 mL santrifüj tüplerine aktarılırken, sitokin testleri ve transkriptomik için kan 1.5 mL mikrosantrifüj tüplerine aktarılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Eritrosit lizisi. Uyarılmış kan (A) eritrosit lizis tamponunda yeniden süspanse edildikten sonra, (B) sıvı berrak görünene kadar inkübe edilir, ancak 6 dakikadan daha uzun sürmez. (C) Dereceli 15 mL'lik bir tüp kullanıldığında, ölçeği giderek yarı saydam olan numune boyunca görünür hale gelmelidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
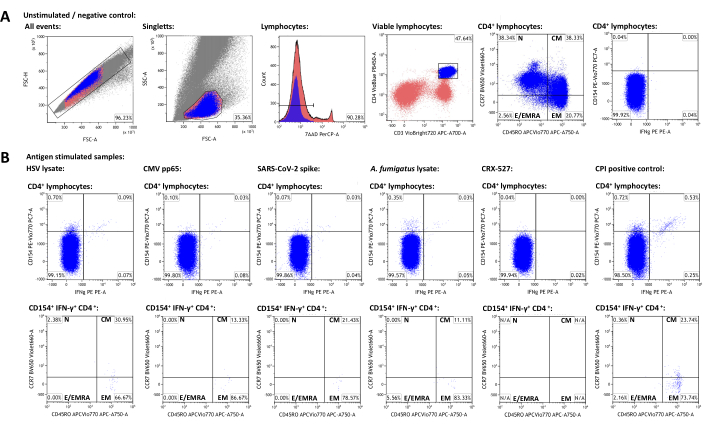
Şekil 3: Temsili veri seti ve akış sitometrik geçit şemaları. (A) Singlet olayları FSC-A ve FSC-H özellikleri ile tanımlanır. Bunlardan lenfositler FSC-A ve SSC-A kullanılarak kapılanır. Lenfositler CD3+CD4+T-yardımcı hücrelere ayrılır. CD45RO ve CCR7 ekspresyon seviyeleri, bellek ve efektör hücre popülasyonlarının fenotiplendirilmesi için kullanılır. Aktivasyon markörü olarak IFN-γ ve CD154 kullanıldı. Gates, uyarılmamış örneklemdeki IFN-γ-CD154- popülasyonuna göre ayarlandı. Gates daha sonra uyarılmış numunelere (B) aktarıldı. Aktive edilmiş T hücrelerinin hafıza popülasyonlarının karakterizasyonu, CCR7 / CD45RO kadran kapısının CD3 + CD4 + popülasyonundan IFN-γ + CD154 + CD3 + CD4 + popülasyonlarına aktarılmasıyla sağlandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
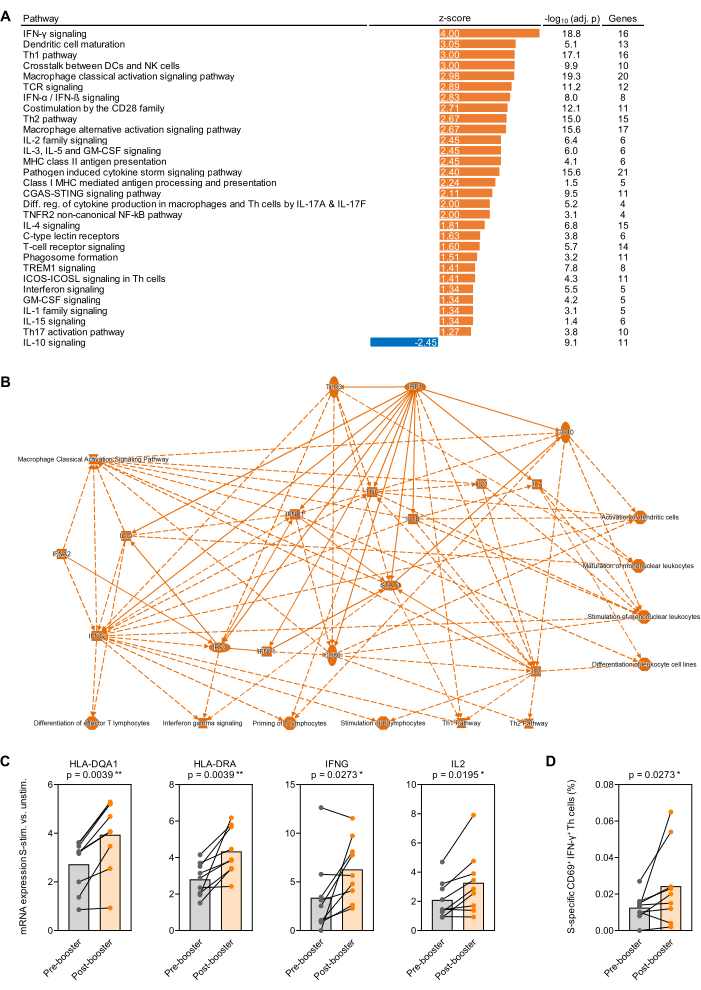
Şekil 4: SARS-CoV-2 takviye aşılamasından sonra antijenin neden olduğu transkripsiyonel değişiklikler. (A) SARS-CoV-2 spike proteini (Prot_S) ile uyarılan tam kandaki transkripsiyonel yolların arka plana göre ayarlanmış zenginleşmesi, (ilk) BNT162b2 mRNA takviye aşılamasından önce ve 9 sağlıklı yetişkin denekte analiz edildi. Benjamini-Hochberg ayarlı (BH-adj.) p değeri <0.05 (-log10 [BH-adj. p] >1.3) ve mutlak z-skoru >1.25) olan bağışıklıkla ilgili kanonik yollar gösterilmiştir. (B) Güçlendirici aşılamadan önce değil, S ile uyarılmış tam kanda daha güçlü bir şekilde zenginleştirilmiş genleri ve yolları özetleyen basitleştirilmiş ağ. (C) Güçlendirici aşılamadan önce ve sonra Prot_S ile uyarılmış tam kanda antijen sunumu ve T hücresi aktivasyonu ile ilişkili temsili genlerin arka plana göre ayarlanmış ekspresyon seviyeleri. Eşleştirilmiş Wilcoxon testi. (D) Güçlendirici aşılamadan önce ve sonra Prot_S spesifik IFN-γ+CD69+ T hücrelerinin arka plan düzeltilmiş frekansları. Eşleştirilmiş Wilcoxon testi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
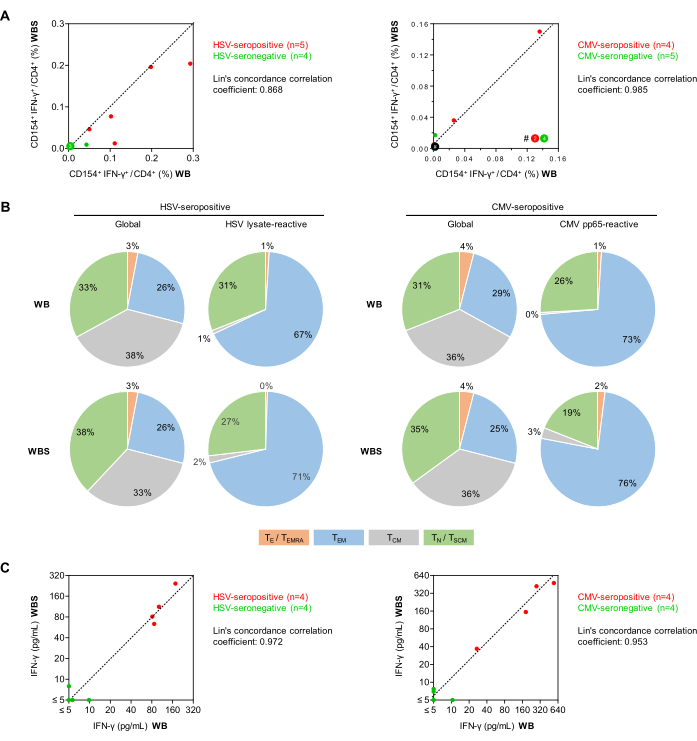
Şekil 5: Akış sitometrisi ve ELISA'da antiviral T hücresi reaktivitesi. (A) Yerleşik (WB) ve küçük hacimli (WBS) tam kan tahlillerinden arka plan düzeltmeli CD154 + IFN-γ + / CD3 + CD4 + T hücresi frekanslarının (akış sitometrisi) korelasyon grafikleri gösterilmiştir. Yeşil ve kırmızı noktalar, test edilen virüs için sırasıyla seronegatif ve seropozitif olan konuları temsil eder. (B) CD45RO ve CCR7 ekspresyonunun akış sitometrik değerlendirmesi kullanılarak, seropozitif donörlerden alınan kan kullanılarak HSV lizat veya CMV pp65 ile stimülasyondan sonra global CD3 + CD4 + T hücreleri ve antijen reaktif IFN γ + CD154 + CD3 + CD4 + T hücreleri arasında bellek / efektör T hücresi fenotipleri belirlendi (n = 5 ve 4, sırasıyla). Ortalama dağılımlar gösterilir. Yeşil: saf T hücreleri (TN), CD45RO-CCR7 +. Gri: merkezi bellek T hücreleri (TCM), CD45RO+CCR7+. Mavi: efektör bellek T hücreleri (TEM), CD45RO + CCR7-. Turuncu: CD45RA'YI (TE / T E, 45-) yeniden eksprese eden efektör T hücreleri ve efektör bellekT-hücreleri. (C) WB ve WBS tahlilleri kullanılarak ölçülen arka plan düzeltmeli IFN-γ salınımının (ELISA) korelasyon grafikleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Uyarı tüpü içeriği. Uyarıcıların ve çözücülerin stok konsantrasyonları özetlenmiştir. Tam ölçekli tam kan tahlili (WB) 500 μL lityum heparinize tam kan kullanılarak gerçekleştirilirken, küçük ölçekli versiyon (WBS) sadece 250 μL kan gerektirir. WBS için, tüm reaktif hacimleri WB hacimlerinin yarısıdır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Temsili veri kümelerini oluşturmak için örneklenen sağlıklı yetişkin deneklerin demografik verileri. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: T hücresi analizi için temsili akış sitometrik paneli. Bu akış sitometrik paneli, temsili veri kümesini oluşturmak için kullanılmıştır. Sonuçlar Şekil 3'te ayrıntılı olarak gösterilmiştir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 4: Daha önce yayınlanmış akış sitometrik panelleri. Bu antikor kombinasyonlarını kullanan veriler daha önce Tappe ve ark.24 tarafından yayınlanmıştır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Antijene özgü immünolojik testler, konak-mikrop etkileşimleri hakkında bilgi sağlar, aşılama ve immünoterapi araştırmaları için çok önemlidir ve fırsatçı enfeksiyonları olan hastalarda giderek daha fazla tanısal ve prognostik modaliteler olarak kabul edilmektedir35. Bu protokol, minimum kan hacimleri (antijen başına 250-500 μL) kullanarak antijene özgü bağışıklığın sağlam ve multimodal analizine izin veren basit bir antijen stimülasyon sistemini tanımlar. Küçültülmüş 250 μL protokolü, daha önce kurulan 500 μL protokolüyle karşılaştırıldığında, antijene özgü T hücresi frekansları, fenotipler ve sitokin üretimi arasında mükemmel bir korelasyon sağladı. Numune işlemenin bazı adımları için küçük hacimli çözümlerinmevcut olmasına rağmen36, yazarların bilgisi dahilinde, şu anda mevcut olan hiçbir ticari sistem, antijen stimülasyonunu ve akış sitometrisi, sitokin salınım testleri ve 250-500 μL'lik kan hacimlerinden transkriptomik yoluyla T hücresi güdümlü fonksiyonel immün yanıtların çok yönlü fonksiyonel analizini güvenilir bir şekilde destekleyemez. Benzer bir araştırma uygulamaları yelpazesini kolaylaştıran en yaygın kullanılan ticari sistem, 3 mL'lik bir stimülasyon ortamında 1 mL kan hacmi kullanır, bu da burada sunulan protokole kıyasla önemli ölçüde daha yüksek maliyet ve ihtiyaç duyulan antijen miktarları ile sonuçlanır 13,14,15.
Antijene özgü T hücrelerinin 6,37,38 akış sitometrik kantifikasyonu için tam kan bazlı protokollerin sürekli optimizasyonuna rağmen, akış sitometrik ölçümlerinin çeşitli dezavantajları vardır. Özellikle, doğaları gereği zahmetli olmaya devam ederler ve önemli operatörler arası değişkenlik (örneğin, öznel geçit süreci) ve farklı ekipman kurulumları, kompanzasyon protokolleri ve laboratuvarlar arasındaki edinim parametreleri nedeniyle standartlaştırılmaları zordur. Standartlaştırılmış raporlama39 ve otomatik analiz ve geçit yazılımının kullanımı, giderek karmaşıklaşan çok renkli veri kümelerinin40,41 standardizasyonunu ve karşılaştırılabilirliğini iyileştirebilse de, burada açıklanan stimülasyon protokolü, çeşitli akış-sitometrik olmayan okuma modalitelerini barındıracak şekilde tasarlanmıştır.
Özellikle, sitokin salınım testleri, düşük uygulamalı süre ve nispeten ucuz ekipmanla gerçekleştirilebilir ve genellikle rutin klinik uygulamalar için kolayca standardize edilirler. Ayrıca, bu protokolü kullanan önceki çalışmalarda gösterildiği gibi, modern çoğullanmış tahlillerle minimal numune hacimlerinden çok sayıda sitokin yanıtı ölçülebilir, böylece araştırma ortamlarında karmaşık sitokin imzalarının profillenmesine izin verilir24,42. Çift ko-stimülasyonlu bu sağlam protokol, lenfopenik olmayan hastalarda (>800 lenfosit/μL kan), hatta iyatrojenik immünosupresyon alan hastalarda bile antijene özgü sitokin yanıtlarının güvenilir bir şekilde ölçülmesini kolaylaştırır 26,34. Sitokin salınım testlerinin bir dezavantajı olarak, özellikle lökopenili hastalarda, salgılanan sitokinler tek tek hücre popülasyonlarına geri izlenemez. Bazı durumlarda, bu, varsa hücreye özgü uyaranların kullanılmasıyla hafifletilebilir. Bununla birlikte, sitokin konsantrasyonlarının diğer okuma modaliteleri ile bir kombinasyonu ve / veya klinik hematolojiye dayalı sitokin yanıtlarının ayarlanması (ör., lökosit farklılaşması ile tam kan sayımı) gerekebilir. Özellikle, burada sunulan protokol, aynı numuneden sitokin okumalarının ve transkripsiyonel imzaların bir kombinasyonuna izin verir, böylece küresel sitokin imzalarına hücresel bağlam ve özgüllük ekleyebilecek iyi tanımlanmış transkripsiyonel aktivasyon belirteçlerinin uyumlu analizine izin verir.
Tam standardizasyona ve hatta daha iyi klinik uygulanabilirliğe yönelik gelecekteki bir adım, numune işlemeden analit okumasına kadar bu tahlillerin tam otomasyonu olacaktır. Bireysel hücre popülasyonlarının hassas otomatik izolasyonu başarılı bir şekilde kurulmuş olsa da43,44, antijene özgü T hücresi analizi hala laboratuvar personelinin aralıklı işlem adımları atmasını gerektirir. Bununla birlikte, hücre izolasyonunun ve hassas PBMC'nin ele alınmasının ihmal edilmesi ve ticari, otomasyonla uyumlu stimülasyon tüplerinin kullanılması, fonksiyonel immünolojik testler için basit, tam otomatik tam kan bazlı iş akışlarının uygulanmasını kolaylaştırabilir.
Toplamda, burada sunulanlar gibi çok yönlü tam kan bazlı protokoller, antijene özgü fonksiyonel immünolojik testlerin uygulamalarını küçük hayvanlarda klinik öncesi çalışmalar da dahil olmak üzere yeni hasta kohortlarına ve araştırma alanlarına genişletmek için önemli bir umut vaat etmektedir. Antijene özgü fonksiyonel immünolojik testler şu anda fare modellerinde büyük ölçüde mümkün değildir veya birkaç hayvandan kan havuzlanmasını ve / veya splenositler gibi standartlaştırılmamış hücre ekstraktlarının kullanılmasını gerektirir. Fırsatçı enfeksiyonlara (örneğin, immün kontrol noktası inhibitörleri, hematopoietik büyüme faktörleri, sitokinler, vb.) karşı konak savunmasını güçlendirmek için immünoterapötik müdahalelere artan ilgi ve yenilikçi aşılama teknolojilerindeki artış göz önüne alındığında, antijene özgü fonksiyonel immünolojik testlerin hem klinik öncesi bulaşıcı hastalıklar araştırmalarında hem de çeşitli hasta popülasyonlarında klinik uygulamalarda artan bir rol oynaması beklenmektedir. Burada sunulan sağlam, ucuz, kullanımı kolay, düşük hacimli antijen stimülasyon sistemi, kullanılmayan alanlarda kapsamlı antijene özgü immün analizleri kolaylaştırabilir. Ayrıca, bu kolay protokolün pre-analitik sağlamlığı, immünoassay uygulamalarının klinik rutine daha iyi dahil edilmesi için fırsatlar yaratabilir ve bulaşıcı hastalıkların kişiselleştirilmiş, biyobelirteç odaklı yönetimine bir adım daha yaklaşmamızı sağlayabilir.
Açıklamalar
Yazarlar tarafından açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Augsburg Üniversitesi Hastanesi Laboratuvar Tıbbı ve Mikrobiyoloji Enstitüsü'ndeki klinik kimya ve enfeksiyon serolojisi bölümlerine serum antikor ölçümleri için teşekkür ederiz. Dr. Friederike Liesche-Starnecker ve Augsburg Üniversite Hastanesi Patoloji ve Moleküler Teşhis Enstitüsü'ne transkriptomik olanaklar sağladıkları için teşekkür ederiz. Augsburg Üniversite Hastanesi'nden Marie Freitag'a aşı lojistiği ve numune alımında destek sağladığı için teşekkür ederiz. Dr. Olaf Kniemeyer'e ve Almanya'nın Jena kentindeki Hans-Knoell Enstitüsü'ne Aspergillus fumigatus lizatını sağladıkları için teşekkür ederiz. Araştırma girişimi Bay-VOC (finansman numarası GE2-2452-200-D37666/2022), Bavyera Eyaleti Bilim ve Sanat Bakanlığı ve Almanya'daki Augsburg Üniversitesi bu çalışmayı destekledi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
Referanslar
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır