Method Article
Saggio su sangue intero con doppia co-stimolazione per l'analisi antigene-specifica dell'immunità dell'ospite a patogeni fungini e virali
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I test immunologici basati su sangue intero forniscono uno strumento semplice ed efficiente in termini di risorse per analizzare l'immunità antigene-specifica a fini diagnostici e di ricerca. Questo articolo fornisce un protocollo ottimizzato basato su sangue intero con doppia co-stimolazione per un'analisi completa dell'immunità dell'ospite ai patogeni fungini e virali, inclusa una versione a basso volume per pazienti pediatrici e piccoli animali.
Abstract
L'elaborazione rapida ed efficiente dei campioni, l'elevata produttività e l'elevata robustezza sono fondamentali per un'efficace applicazione scientifica e clinica dei dosaggi immunologici avanzati antigene-specifici. Tradizionalmente, tali saggi immunologici, in particolare l'analisi delle cellule T antigene-specifiche mediante citometria a flusso o saggi spot di immunoassorbimento enzimatico, spesso si basano sull'isolamento di cellule mononucleate del sangue periferico. Questo processo richiede molto tempo, è soggetto a molti fattori confondenti pre-analitici e richiede grandi volumi di sangue. I test basati su sangue intero forniscono un'alternativa facile con una maggiore robustezza pre-analitica e requisiti di volume ematico inferiori. Inoltre, i saggi basati sul sangue intero consentono la conservazione delle interazioni intercellulari che non vengono catturate dai saggi che utilizzano sottogruppi di cellule isolate. Recentemente, è stato proposto un test immunologico su sangue intero raffinato con doppia co-stimolazione anti-CD28 e anti-CD49d per un'analisi completa sia delle funzioni delle cellule T antigene-specifiche che delle complesse interazioni intercellulari in risposta a vari antigeni fungini e virali. Questo protocollo fornisce una guida per la preparazione di tubi di stimolazione, la stimolazione del sangue e l'elaborazione dei campioni a valle per la citometria a flusso, i saggi di secrezione di citochine e le analisi trascrizionali. Ciò include un protocollo a basso volume convalidato e funzionalmente equivalente, precedentemente non pubblicato, per rendere più accessibile il monitoraggio citofluorimetrico e delle cellule T basato su citochine per gli studi su pazienti pediatrici o gli studi preclinici su piccoli animali (ad esempio, topi). Nel complesso, questi protocolli forniscono una cassetta degli attrezzi versatile per l'analisi immunitaria antigene-specifica complessa in contesti di ricerca clinica e traslazionale.
Introduzione
La quantificazione e la caratterizzazione dell'immunità antigene-specifica, in particolare delle risposte specifiche delle cellule T, è fondamentale per l'immunobiologia e la ricerca sui vaccini, così come per alcuni test diagnostici. Tradizionalmente, i dosaggi immunologici antigene-specifici si basavano comunemente su cellule mononucleate isolate del sangue periferico (PBMC). Tuttavia, l'isolamento di queste cellule richiede molto tempo e risorse e spesso richiede volumi di sangue relativamente grandi. Inoltre, per prevenire l'attivazione dei granulociti e il conseguente disturbo delle cellule T durante la conservazione pre-analitica1, è fondamentale un rapido trattamento dei campioni, che spesso non è fattibile nella pratica clinica. Queste limitazioni ostacolano la praticabilità dei saggi immunologici antigene-specifici in scenari di ricerca ad alto rendimento e routine cliniche. Pertanto, negli ultimi anni lo sviluppo di approcci basati sul sangue intero facili da usare e potenzialmente automatizzabili ha aperto nuove aree di applicazioni di immunodosaggio. Tuttavia, gli attuali sistemi disponibili in commercio di solito mancano di ambienti co-stimolatori ottimali per le cellule T e sono suscettibili a ritardi pre-analitici. Ad esempio, un test di rilascio di IFN-γ basato su sangue intero ampiamente utilizzato ha un tasso di reversione positivo-negativo del 19% dopo 6 ore di conservazione pre-analiticadel sangue 2. Per superare queste limitazionisono stati sviluppati protocolli ottimizzati con doppia co-stimolazione anti-CD28 e anti-CD49d 3,4,5,6.
Il protocollo qui presentato consente una quantificazione e una caratterizzazione accurate e riproducibili delle cellule T antigene-specifiche, la valutazione delle risposte citochine indotte dall'antigene e altri marcatori immunitari funzionali (citometrici a flusso o trascrizionali) da un volume minimo di sangue, ovvero 500 μL di sangue per tubo di stimolazione. Ulteriori vantaggi di questo protocollo includono un basso tempo di utilizzo manuale, un'elevata resilienza ai confondenti pre-analitici e la conservazione delle interazioni intercellulari funzionali in un ambiente ex vivo relativamente fisiologico. La comparabilità della caratterizzazione delle cellule T antigene-specifiche basate sulla citofluorimetria basata sul sangue intero con i dati generati dai tradizionali saggi basati su PBMC è stata precedentemente dimostrata nel contesto della quantificazione delle cellule T specifiche per muffa6. Inoltre, la stimolazione diretta del sangue dei soggetti abroga la necessità di un'integrazione con siero autologo, allogenico o anche xenogenico che è comunemente richiesto per una stimolazione ottimale della PBMC. L'omissione dell'isolamento cellulare riduce anche lo stress da taglio e temperatura, migliorando così la vitalità cellulare. Ancora più importante, i saggi basati su sangue intero preservano le popolazioni di granulociti che vengono perse durante la centrifugazione in gradiente per l'isolamento delle PBMC7. In questo modo, questa configurazione del saggio preserva e cattura i cicli di interazione funzionale tra granulociti e cellule mononucleate4.
Da notare che questo protocollo richiede solo modifiche minime per adattarsi a diverse modalità di lettura e consente anche una doppia analisi del rilascio di citochine e delle risposte trascrizionali dallo stesso tubo di stimolazione. In particolare, mentre le citochine vengono analizzate dal surnatante di coltura dopo la stimolazione, il pellet cellulare può essere utilizzato per l'isolamento dell'RNA con successiva analisi trascrittomica. Il flusso di lavoro generale per le varie modalità di lettura è riassunto nella Figura 1.
Negli ultimi anni, è stato sviluppato un numero crescente di test basati su sangue intero per il monitoraggio immunitario reattivo ai patogeni in ambito clinico e di ricerca, ad esempio per Mycobacterium tuberculosis 8,9, Bordetella pertussis3, Orientia tsutsugamushi10 e SARS-CoV-2 5,11,12. Ad esempio, un sistema precedentemente consolidato è stato utilizzato per più antigeni, tra cui M. tuberculosis, virus dell'influenza A e SARS-CoV-2, ma non utilizza fattori co-stimolatori ottimizzati per la stimolazione delle cellule T-helper (Th) 13,14,15. Anche se il volume ematico richiesto per questi test è già significativamente inferiore a quello utilizzato per i test tradizionali basati su PBMC o per i kit di stimolazione del sangue intero disponibili in commercio, un volume di campione ancora più piccolo potrebbe essere giustificato per applicazioni in pediatria, neonatologia, pazienti nell'unità di terapia intensiva (ICU) e ricerca preclinica su piccoli modelli animali. Ad esempio, anche il prelievo terminale di sangue dai topi (ad esempio, mediante puntura cardiaca) produce comunemente un massimo di 0,7-1 ml di sangue. Pertanto, nell'ambito di questo protocollo è stata valutata la possibilità di ridimensionare ulteriormente i protocolli di immunodosaggio basati su sangue intero precedentemente stabiliti 4,6 per una quantificazione e una caratterizzazione precise delle risposte delle cellule T reattive all'antigene a partire da 250 μL di volume ematico per provetta di stimolazione.
Protocollo
Il comitato etico dell'Università Ludwig Maximilians di Monaco di Baviera (numero di progetto 21-0689) ha approvato la raccolta di campioni di sangue umano. Inoltre, parti dei set di dati rappresentativi sono stati generati con il numero 20-426 del Corona-Register-Study, anch'esso approvato dal comitato etico dell'Università Ludwig Maximilians di Monaco. È stato ottenuto il consenso informato.
1. Preparazione di tubi di stimolazione del sangue intero
NOTA: Questo passaggio è adattato da Lauruschkat et al.4 e Weis et al.6. La tabella 1 riassume in dettaglio le concentrazioni e i volumi dei reagenti.
- In condizioni sterili (banco di lavoro sterile), preparare provette per la raccolta del sangue da 2,7 mL senza anticoagulante, con antigeni e anticorpi costimolatori. Aggiungere 1 μg/mL di α-CD28 e 1 μg/mL di α-CD49d a ciascuna provetta, compreso il controllo negativo. Considerare il volume ematico da aggiungere per la stimolazione del sangue intero quando si determinano le concentrazioni finali (250 μL o 500 μL). Per mantenere la geometria della camera e l'accessibilità del campione, non ritrarre lo stantuffo dalla provetta di raccolta del sangue.
- Sulla base del disegno dello studio, determinare se le provette di controllo negative non devono contenere stimoli aggiuntivi (controllo di fondo non stimolato, come mostrato nella Tabella 1) o utilizzare antigeni per i quali la coorte di studio dovrebbe ospitare cellule T antigene-specifiche o minime (ad esempio, un pool di peptidi HIV in individui sieronegativi all'HIV 16).
- Per la stimolazione antigene-specifica, ottimizzare le concentrazioni ideali di antigeni mediante titolazione in esperimenti preliminari. Per generare i dati rappresentativi di seguito, utilizzare le seguenti concentrazioni di antigene ottimizzate: 1,2 μg/mL di HSV-1 lisato, 0,6 nM/peptide/mL di CMV pp65, 0,6 nM/peptide/mL di SARS-CoV-2 Prot_S, 50 μg/mL di Aspergillus fumigatus lisato e 1 ng/mL di CRX-527.
- Includere un controllo positivo, soprattutto per gli studi in pazienti linfopenici o in terapia farmacosoppressiva immunosoppressiva. Utilizzare una soluzione di controllo positivo CPI (0,6 nM/peptide/mL), costituita da citomegalovirus, virus parainfluenzale e peptidi del virus dell'influenza.
NOTA: In alternativa, possono essere utilizzati stimoli sintetici, come PMA (10 μg/mL) ± ionomicina (1 μg/mL), ma inducono meno reazioni fisiologiche e possono influenzare l'espressione di antigeni di superficie comunemente usati come marcatori di popolazione per la citometria a flusso (in particolare, CD417). Si noti che gli anticorpi co-stimolatori non sono necessari in combinazione con la maggior parte degli stimoli di controllo positivo sintetici e potrebbero persino avere un impatto negativo sulla vitalità e sulla reattività cellulare. - Per armonizzare i volumi dei reagenti in tutte le provette di stimolazione, aggiungere il terreno RPMI 1640 fino ai seguenti volumi totali: Saggio su scala completa per citometria a flusso: 50 μL; Saggio su larga scala per l'analisi delle citochine e la trascrittomica: 500 μL; Saggio su piccola scala per citometria a flusso: 25 μL; Saggio su piccola scala per l'analisi delle citochine e la trascrittomica: 250 μL.
NOTA: Per la preparazione di più set di tubi di stimolazione, si consiglia di preparare miscele master che includano tutti gli ingredienti a causa del minor rischio di contaminazione e del basso volume di fattori e stimoli co-stimolatori. - Utilizzare immediatamente le provette preparate o crioconservarle a -20 °C. La maggior parte dei reagenti può essere conservata per un massimo di 4 settimane; Tuttavia, convalidare in anticipo i periodi massimi di conservazione per nuovi reagenti/stimoli.
2. Stimolazione e incubazione di campioni di sangue intero
- Circa 30-60 minuti prima della stimolazione del sangue intero, scongelare i tubi di stimolazione pronti all'uso e mantenerli a temperatura ambiente.
- Raccogliere il sangue venoso dal donatore/paziente utilizzando provette per la raccolta del sangue con anticoagulante al litio eparina. Assicurarsi che il volume di sangue raccolto soddisfi i requisiti individuali dell'esperimento, ovvero è richiesto un minimo di 750 μl per 3 condizioni del test su piccola scala, incluso il controllo negativo e positivo. Per le provette per la raccolta del sangue acquistate in commercio, riempirle completamente per ottenere concentrazioni di lavoro di eparina di 16 - 25 UI/mL di sangue.
NOTA: I dati demografici dei soggetti adulti sani reclutati per generare i set di dati rappresentativi sono mostrati nella Tabella 2. - Trasferire la quantità necessaria di sangue intero eparinizzato (250 μl o 500 μl per test su piccola scala o su scala intera, rispettivamente) nei tubi di stimolazione mediante pipettaggio sotto un banco di lavoro sterile.
NOTA: Se non è disponibile un banco di lavoro sterile o quando si lavora con campioni che presentano un rischio minimo di infezione (ad esempio, sangue di soggetti umani o animali pre-selezionati), i campioni possono essere trasferiti nei tubi di stimolazione utilizzando siringhe sterili. Questo metodo consente inoltre l'elaborazione dei campioni al letto del paziente subito dopo il prelievo del sangue, riducendo al minimo la conservazione pre-analitica e la compromissione delle cellule T. Prima di iniettare il sangue, disinfettare accuratamente le guarnizioni in gomma sia della provetta di raccolta del sangue che di tutte le provette di stimolazione con un disinfettante alcolico. Lasciare asciugare il disinfettante per almeno 1 minuto. - Capovolgere con cautela i tubi di stimolazione 5x-10x. Posizionare i tubi di stimolazione in un'incubatrice a 37 °C. Si noti che non è necessaria un'incubatrice a CO2 . Per prevenire l'attivazione aspecifica dei neutrofili, non refrigerare la provetta per il prelievo del sangue.
NOTA: Questo protocollo è stato convalidato per la conservazione pre-analitica del sangue fino a 8 ore a temperatura ambiente per consentire il trasporto del campione. Se possibile, è preferibile iniettare sangue intero nei tubi di stimolazione nel sito di raccolta e trasportare il sangue a un laboratorio centrale nei tubi di stimolazione, poiché i fattori co-stimolatori miglioreranno la vitalità dei linfociti18,19. - Solo per i campioni utilizzati per saggi di citofluorimetria con colorazione intracellulare, aggiungere brefeldina A (concentrazione finale di 10 μg/mL) a ciascuna provetta di stimolazione dopo 4 ore di incubazione.
- Preparare una soluzione di brefeldina A da 1 mg/mL in RPMI e aggiungere 1 μL di soluzione per 100 μL di volume di campione (ad esempio, cocktail di stimolazione premiscelato + volume di sangue intero). Aggiungere la brefeldina A disopercolando le provette e pipettandole sotto un banco di lavoro sterile. Richiudere e rimettere le provette nell'incubatore a 37 °C per altre 16-18 ore a 37 °C (20-22 ore in totale).
- Per i saggi di secrezione di citochine o le analisi trascrizionali, non aggiungere brefeldina A e incubare continuamente i campioni a 37 °C per 24-26 ore.
NOTA: La brefeldina A inibisce l'apparato di Golgi e quindi abroga la secrezione di citochine e il trasporto delle proteine sulla superficie cellulare. Poiché la secrezione o l'espressione di superficie alla fine porteranno alla perdita e alla degradazione delle proteine dopo la reinternalizzazione, rispettivamente, gli inibitori dell'esocitosi sono essenziali per l'accumulo intracellulare e la colorazione delle citochine e di alcuni marcatori di attivazione (ad esempio, CD154) per gli studi di citometria a flusso. Tuttavia, la brefeldina A interrompe anche i processi cellulari fisiologici visibili nel trascrittoma e invalida i saggi di secrezione di citochine dai surnatanti di coltura20,21, richiedendo l'uso di due provette separate (una con e una senza brefeldina A) per eseguire queste letture in parallelo.
3. Preparazione dei campioni per la citometria a flusso
- Aggiungere 500 μl di soluzione di EDTA 0,5 M a ciascun tubo di stimolazione e incubare il campione per 15 minuti a temperatura ambiente per staccare le cellule aderenti dalla superficie dei tubi.
- Trasferite i campioni in nuove provette da centrifuga da 15 mL. Sciacquare i tubi di stimolazione con 1 mL di tampone per lisi eritrocitaria per raccogliere le cellule del sangue rimanenti, quindi aggiungere il tampone e le cellule alle stesse provette da centrifuga da 15 mL.
- Centrifugare le provette da 15 mL per 7 minuti a 600 x g. Eliminare con cautela il surnatante.
- Risospendere il pellet di cellule del sangue nel tampone di lisi degli eritrociti (Figura 2A). Utilizzare 5 mL di tampone per lisi eritrocitaria per 500 μL di sangue intero e 3 mL per 250 μL di sangue intero.
NOTA: Le condizioni ottimali di lisi degli eritrociti devono essere pre-valutate per il tampone specifico utilizzato (preparato internamente o prodotto commerciale). Le istruzioni fornite qui sono state ottimizzate per il tampone di lisi eritrocitaria elencato nella tabella dei materiali. - Incubare i campioni a temperatura ambiente fino a quando i campioni non appaiono limpidi (Figura 2B). Per prevenire la lisi e l'aggregazione dei granulociti, non superare i 6 minuti di incubazione. Un indicatore del successo della lisi degli eritrociti è la capacità di vedere i numeri e la scala sul tubo da 15 ml attraverso il fluido (Figura 2C).
- Centrifugare le provette da 15 mL per 7 minuti a 600 x g. Scartare con cautela il surnatante, ripetere i passaggi 3.4-3.5 se il pellet della cella è ancora notevolmente rosso.
- Risospendere il pellet cellulare in 1 mL di HBSS e trasferire le cellule in provette di reazione da 2 mL.
- Centrifugare le provette da 2 mL per 5 minuti a 400 x g. Eliminare con cautela il surnatante.
- Eseguire la colorazione citofluorimetrica secondo le istruzioni del produttore per il kit di colorazione intracellulare e gli anticorpi utilizzati.
NOTA: Il pannello di anticorpi utilizzato per generare il set di dati rappresentativo è riassunto nella Tabella 3.
4. Preparazione di campioni per saggi di citochine
- Dopo il passaggio 2.6, trasferire il sangue diluito dai tubi di stimolazione in tubi da 1,5 mL.
- Centrifugare le provette da 1,5 mL per 20 minuti a 2000 x g. Pipettare con cura il surnatante in una provetta fresca da 1,5 mL e utilizzarlo immediatamente per l'analisi delle citochine o per crioconservare i surnatanti a -80 °C.
- Centrifugare nuovamente il surnatante per 5 minuti a ≥ 7000 x g (in provette da 1,5 mL) per rimuovere i detriti cellulari residui prima dell'analisi, soprattutto dopo lo scongelamento. A seconda del protocollo di dosaggio delle citochine, eseguire la pre-diluizione dei campioni.
- Risospendere il pellet cellulare in 1 mL di tampone di protezione dell'RNA e crioconservarlo a -80 °C per il successivo isolamento dell'RNA. In alternativa, risospendere il pellet cellulare nel tampone di lisi per l'isolamento immediato dell'RNA secondo le istruzioni del kit di isolamento dell'RNA (o del protocollo interno).
NOTA: Se necessario, a seconda del successivo protocollo di processamento dell'RNA, è possibile aggiungere una fase di lisi degli eritrociti simile a 3,4-3,5 prima di aggiungere il tampone di protezione dell'RNA.
Risultati
Analisi multimodale delle risposte immunitarie antigene-specifiche dopo stimolazione del sangue intero con antigeni associati a patogeni
Per generare un set di dati rappresentativo, è stato selezionato un donatore adulto sano sieropositivo per HSV-1 e CMV che aveva ricevuto vaccinazioni SARS-CoV-2. Oltre a un controllo non stimolato, sono stati utilizzati i seguenti stimoli come descritto sopra: Herpes simplex virus 1 (HSV) lisato (raccomandazione del produttore, dati non pubblicati), citomegalovirus (CMV) pp6522, sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2) Prot_S 5,23, Aspergillus fumigatus lisato (un patogeno ambientale ubiquitario)4,24, CRX-527 (uno stimolo del recettore Toll-like 4 basato sul lipopolisaccaride, che non dovrebbe attivare le cellule T di per sé)25 e CPI (controllo positivo per l'attivazione delle cellule T CD4+ costituito da CMV, virus parainfluenzale e peptidi del virus dell'influenza)26. I dati citometrici a flusso e la strategia di gating sono mostrati nella Figura 3. In generale, si consiglia di misurare il maggior numero possibile di linfociti quando si prendono di mira popolazioni cellulari rare (50.000 - 100.000 linfociti), poiché la precisione e l'affidabilità delle misurazioni dipendono dal numero totale di eventi27. Il campione non stimolato viene utilizzato per il gating di singoli sottogruppi di cellule (ad esempio, cellule CD3+CD4+). I gate per CD45RO e CCR7 per la fenotipizzazione delle cellule T di memoria dovrebbero essere impostati sulla popolazione totale CD3+CD4+ e quindi trasferiti alle popolazioni positive ai marcatori di attivazione, poiché il basso numero di eventi su queste ultime spesso impedisce una chiara identificazione di popolazioni distinte. Potrebbero essere necessari lievi aggiustamenti per le singole porte, ad esempio per tenere conto delle differenze nella vitalità dei linfociti. L'upregolazione di CD154 (o ligando CD40) è stata descritta come un marcatore di attivazione delle cellule T-helper globale, consistente e rapidamente indotta28,29. L'IFN-γ è considerato uno dei marcatori di attivazione delle cellule T più importanti e specifici di tipo 130,31. È importante sottolineare che questo test è stato testato e pubblicato con vari marcatori aggiuntivi di attivazione, esaurimento e citochine (vedere Tabella 4 e24).
Le frequenze delle popolazioni positive ai marcatori di attivazione nel campione non stimolato rappresentano background non specifici e sono state sottratte dalle frequenze stimolate dall'antigene. Dopo la sottrazione del background aspecifico, il donatore rappresentativo aveva rispettivamente 0,75% (HSV), 0,09% (CMV), 0,06% (SARS-CoV-2), 0,34% (A. fumigatus), 0,00% (CRX-527) e 1,21% (CPI) di cellule T helper CD154+/CD3+CD4+ specifiche. L'espressione dell'IFN-γ può essere analizzata in modo simile, risultando in cellule IFN-γ+/CD3+, 0,12% (HSV), 0,07% (CMV), 0,03% (SARS-CoV-2), 0,04% (A. fumigatus), 0% (CRX-527) e 0,74% (CPI).
Le popolazioni di cellule T possono essere ulteriormente suddivise in cellule T naive (TN, CD45RO-CCR7+), cellule T della memoria centrale (TCM, CD45RO+CCR7+), cellule T della memoria effettrice (TEM, CD45RO+CCR7-) e cellule T effettrici (e cellule T della memoria effettrice che riesprimono CD45RA, TE/TEMRA, CD45RO-CCR7-). Tra le cellule T CD3+CD4+ globali, il donatore rappresentativo aveva rispettivamente il 38,34% di TN, il 38,33% di TCM, il 20,77% di TEM e il 2,56% di TE/TEMRA, come determinato utilizzando il campione non stimolato (Figura 3A). Tuttavia, tra le cellule T-helper reattive antigene-specifiche (CD154+IFN-γ+), TCM e TEM erano di gran lunga i sottogruppi più importanti, con medie rispettivamente del 22,14% e del 73,97%.
I dati su ulteriori popolazioni di leucociti sono stati precedentemente pubblicati utilizzando questa metodologia24. Le combinazioni di anticorpi utilizzate sono presentate nella Tabella 4 per ulteriori riferimenti.
Inoltre, per mostrare il pieno potenziale di questa metodologia, è stato eseguito un test ELISA γ IFN su un secondo set di campioni stimolati (senza l'aggiunta di brefeldina A). Per evitare il superamento dell'intervallo di rilevamento del kit ELISA IFN-γ, il plasma proveniente da campioni stimolati con CPI è stato pre-diluito 1:4. Le seguenti concentrazioni di IFN-γ sono state misurate e normalizzate per mL del volume ematico del soggetto, cioè corrette per la diluizione sia nei tubi di stimolazione che nelle diluizioni pre-ELISA: 0 pg/mL (non stimolato), 69,4 pg/mL (HSV), 471 pg/mL (CMV), 17,8 pg/mL (SARS-CoV-2), 61,9 pg/mL (A. fumigatus), 34,0 pg/mL (CRX-527) e 1958 pg/mL (CPI).
Infine, l'RNA è stato isolato dagli stessi campioni con risultati coerenti. La resa media è stata di 719 ng, con un rapporto medio di assorbanza di 260 nm/280 nm pari a 1,98.
Nel complesso, questo set di dati illustra che il protocollo presentato consente uno spettro di lettura multiforme e l'analisi concomitante di vari antigeni associati all'infezione utilizzando un volume ematico minimo, ovvero 8 ml in totale per stimoli multipli e modalità di lettura.
Set di dati rappresentativo per analisi trascrizionali per monitorare la risposta alla vaccinazione utilizzando sangue intero stimolato con antigene
Come prova di principio per gli studi trascrizionali condotti su sangue intero stimolato con antigene, il sangue è stato raccolto da 9 soggetti adulti sani immediatamente prima e 1 mese dopo la prima vaccinazione di richiamo con BNT162b2 (vaccino mRNA SARS-CoV-2)32,33 7-9 mesi dopo la serie iniziale di vaccini a due dosi. La resa media di RNA da 500 μL di sangue intero non stimolato e stimolato con Prot_S è stata di 1,1 μg di RNA altamente puro, con un rapporto di assorbimento medio di 260/280 di 1,99. A seguito dell'analisi nCounter, la conta degli RNA è stata normalizzata ai 12 geni housekeeping del pannello (media geometrica). Successivamente, è stato determinato il rapporto tra la conta dell'mRNA normalizzata nei campioni stimolati con Prot_S rispetto ai controlli di fondo non stimolati per ciascun soggetto e gene. Sono stati determinati i rapporti mediana/mediana delle misurazioni post-vaccinali rispetto a quelle pre-vaccinazione e l'analisi dell'arricchimento del percorso è stata eseguita utilizzando il pacchetto software elencato nella Tabella dei materiali. L'arricchimento delle vie canoniche è stato considerato significativo con un valore assoluto di z-score ≥ 1,25 e un valore p aggiustato di Benjamini-Hochberg < 0,05. Nella Figura 4A sono riassunti percorsi arricchiti in modo significativamente diverso e nella Figura 4B è mostrata una rete semplificata di cambiamenti aggiustati per il background nella risposta post- rispetto a quella pre-vaccinazione alla Prot_S. Inoltre, l'induzione più forte aggiustata per il background di geni rappresentativi correlati alla maturazione delle cellule presentanti l'antigene e all'attivazione delle cellule T indotta da Prot_S dopo la vaccinazione di richiamo è mostrata nella Figura 4C (p < 0,01-0,03). Infine, un aumento delle cellule T helper di tipo 1 Prot_S-specifiche aggiustate per il fondo (CD69+IFN-γ+) dopo la vaccinazione è stato confermato dalla citometria a flusso utilizzando un secondo set di tubi di stimolazione (p = 0,03, Figura 4D).
Confronto delle risposte delle cellule T reattive al virus in protocolli di immunodosaggio basati su sangue intero su larga scala e su piccolo volume
Successivamente, le frequenze delle cellule T helper CD154+IFN-γ+ reattive al virus (cellule CD3+CD4+) in volontari sani sono state confrontate utilizzando i protocolli di stimolazione dell'antigene del sangue intero su scala intera (500 μL, WB) e di piccolo volume (250 μL, WBS) (Figura 5). Come riportato in precedenza34, sono state osservate frequenze di fondo minime non specifiche delle cellule CD154+IFN-γ+ con entrambi i protocolli nonostante la doppia co-stimolazione (medie, 0,010% e 0,011% per WB e WBS, rispettivamente). Da notare che, sebbene le risposte di fondo non specifiche siano sottratte dalle risposte antigene-specifiche, esse contribuiscono comunque ad aumentare l'imprecisione del test, come discusso in precedenza27. Segnali di fondo elevati (ad esempio, cellule Th CD154+ >0,07-0,1% o cellule >CD154+ γ+ 0,05%) potrebbero indicare la contaminazione del campione, un'infezione acuta del soggetto o potrebbero essere il risultato di una manipolazione pre-analitica inappropriata del campione.
Le frequenze medie delle cellule T reattive al lisato dell'HSV nei donatori sieropositivi (n = 5) erano rispettivamente dello 0,151% e dello 0,107% nei sistemi WB e WBS, rispetto allo 0,012% e allo 0,004% nei donatori sieronegativi (n = 4). Con il pool di peptidi pp65 del CMV, i donatori sieropositivi (n = 4) avevano lo 0,041% e lo 0,049% di cellule T reattive rispetto allo 0,001% e allo 0,004% dei donatori sieronegativi (n = 5). I coefficienti di correlazione della concordanza di Lin erano 0,868 per l'HSV e 0,985 per il CMV, suggerendo una forte correlazione (Figura 5A). In particolare, il test delle cellule T specifiche per il CMV può essere negativo in soggetti sani sieropositivi che non hanno avuto eventi di riattivazione recenti. Sia il repertorio totale che quello delle cellule T-helper CD3+CD4+ reattive all'antigene sono stati ulteriormente differenziati in base all'espressione di CCR7 e CD45RO (Figura 5B). È rassicurante che i risultati ottenuti utilizzando i protocolli WB e WBS siano stati comparabili sia per la popolazione totale che per quella reattiva all'antigene. Prevedibilmente, con entrambi i saggi, la proporzione di cellule Th di memoria più differenziate (cioè cellule di memoria effettrici) era più alta tra le cellule T reattive all'antigene rispetto alla popolazione totale di cellule Th. Come previsto, solo poche cellule T naive sono state attivate da stimolanti virali (Figura 5B).
Inoltre, in un'altra serie di esperimenti, i surnatanti di coltura stimolati sono stati analizzati mediante IFN-γ ELISA (Figura 5C). È stato osservato un fondo non specifico minimo (medie di 1,29 pg/mL e 2,18 pg/mL nei protocolli WB e WBS, rispettivamente). I campioni di sangue di donatori sieropositivi all'HSV hanno mostrato concentrazioni medie di IFN-γ indotte da HSV aggiustate per il fondo, rispettivamente di 111 pg/mL e 125 pg/mL nel sistema WB e WBS. Al contrario, le concentrazioni di IFN-γ nei campioni sieronegativi erano costantemente inferiori a 10 pg/mL in entrambi i sistemi (coefficiente di correlazione della concordanza di Lin = 0,972, Figura 5C). Allo stesso modo, la stimolazione con pp65 del sangue da donatori sieropositivi per CMV ha prodotto concentrazioni medie di IFN-γ rispettivamente di 258 pg/mL e 272 pg/mL nei sistemi WB e WBS, mentre una minima secrezione di IFN-γ indotta da pp65 è stata osservata in entrambi i sistemi utilizzando campioni sieronegativi (coefficiente di correlazione della concordanza di Lin = 0,953, Figura 5C).
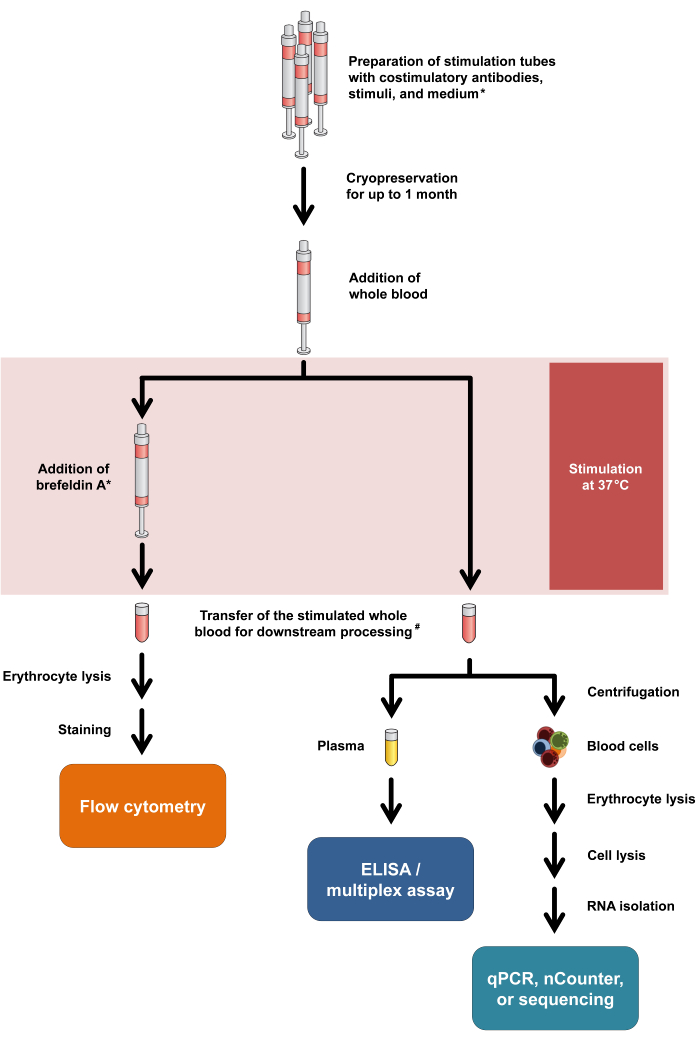
Figura 1: Diagramma di flusso che riassume le procedure sperimentali e le letture. L'asterisco significa che la brefeldina A è necessaria per alcuni marcatori di attivazione delle cellule T (ad esempio, CD154) e per la colorazione intracellulare delle citochine. Vedere i passaggi del protocollo 2.5 e 2.6. #: Il sangue per la citometria a flusso viene inizialmente trasferito in provette da centrifuga da 15 mL per la lisi degli eritrociti, mentre il sangue per i saggi delle citochine e la trascrittomica viene trasferito in provette per microcentrifuga da 1,5 mL. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Lisi eritrocitaria. Dopo che il sangue stimolato è stato risospeso in (A) tampone di lisi eritrocitaria, viene incubato fino a quando (B) il fluido appare limpido, ma non più di 6 minuti. (C) Quando si utilizza una provetta graduata da 15 mL, la sua scala dovrebbe diventare visibile attraverso il campione sempre più traslucido. Clicca qui per visualizzare una versione più grande di questa figura.
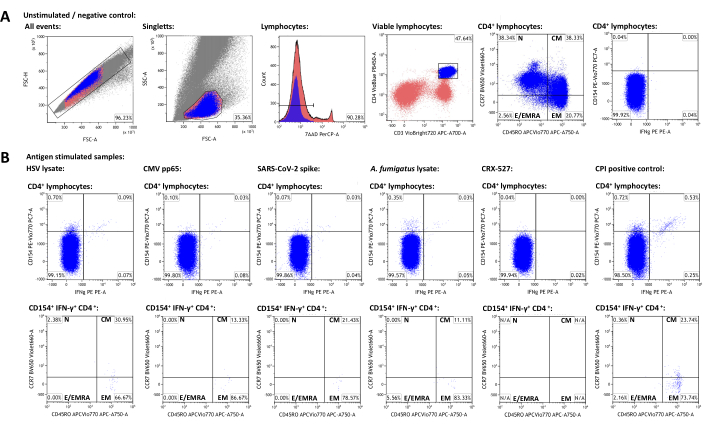
Figura 3: Set di dati rappresentativo e schemi di gating citofluorimetrico. (A) Gli eventi singoletto sono identificati dalle proprietà FSC-A e FSC-H. Di questi, i linfociti sono controllati utilizzando FSC-A e SSC-A. I linfociti sono differenziati in cellule T helper CD3+CD4+. I livelli di espressione di CD45RO e CCR7 sono utilizzati per la fenotipizzazione delle popolazioni di cellule di memoria e di cellule effettrici. IFN-γ e CD154 sono stati utilizzati come marcatori di attivazione. I cancelli sono stati impostati in base alla popolazione IFN-γ-CD154- nel campione non stimolato. I cancelli sono stati successivamente trasferiti ai campioni stimolati (B). La caratterizzazione delle popolazioni di memoria delle cellule T attivate è stata ottenuta trasferendo il cancello del quadrante CCR7/CD45RO dalla popolazione CD3+CD4+ alle popolazioni IFN-γ+CD154+CD3+CD4+. Clicca qui per visualizzare una versione più grande di questa figura.
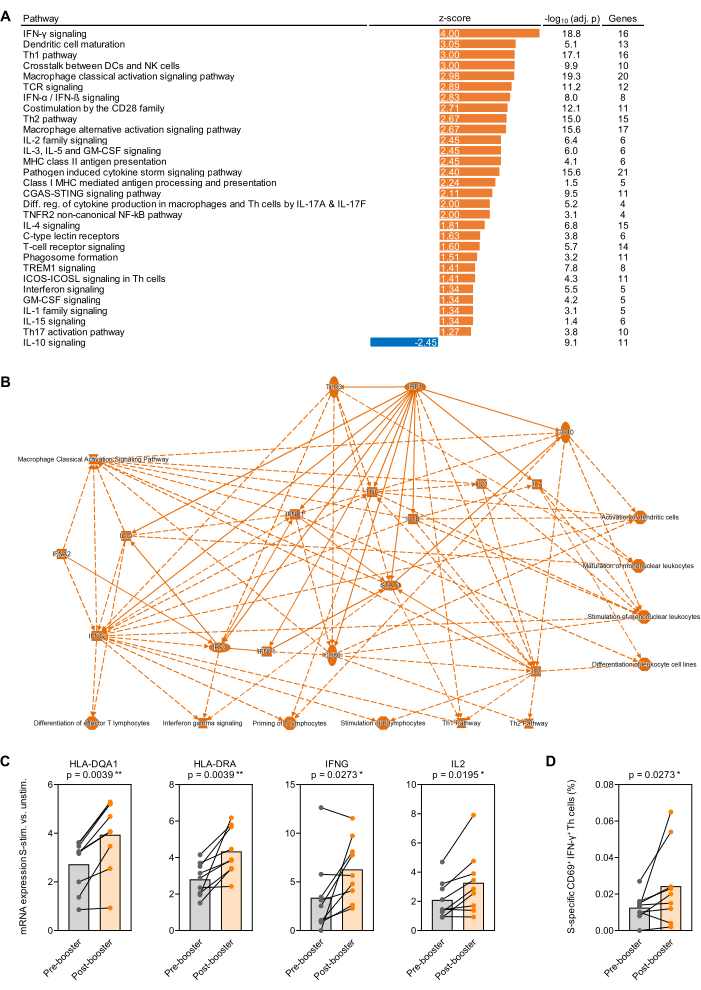
Figura 4: Cambiamenti trascrizionali indotti dall'antigene dopo la vaccinazione di richiamo contro SARS-CoV-2. (A) L'arricchimento aggiustato per lo sfondo delle vie trascrizionali nel sangue intero stimolato con la proteina spike (Prot_S) SARS-CoV-2 dopo rispetto a prima (prima) della vaccinazione di richiamo con mRNA BNT162b2 è stato analizzato in 9 soggetti adulti sani. Sono mostrate le vie canoniche immuno-correlate con un valore p aggiustato per Benjamini-Hochberg (BH-agg.) <0,05 (-log10[BH-agg. p] >1,3) e un punteggio z assoluto >1,25. (B) Rete semplificata che riassume i geni e le vie più fortemente arricchite nel sangue intero stimolato da S dopo rispetto a prima della vaccinazione di richiamo. (C) Livelli di espressione aggiustati per il background di geni rappresentativi associati alla presentazione dell'antigene e all'attivazione delle cellule T nel sangue intero stimolato con Prot_S prima e dopo la vaccinazione di richiamo. Test di Wilcoxon accoppiato. (D) Frequenze corrette per il background delle cellule T IFN-γ+CD69+ specifiche per Prot_S prima e dopo la vaccinazione di richiamo. Test di Wilcoxon accoppiato. Clicca qui per visualizzare una versione più grande di questa figura.
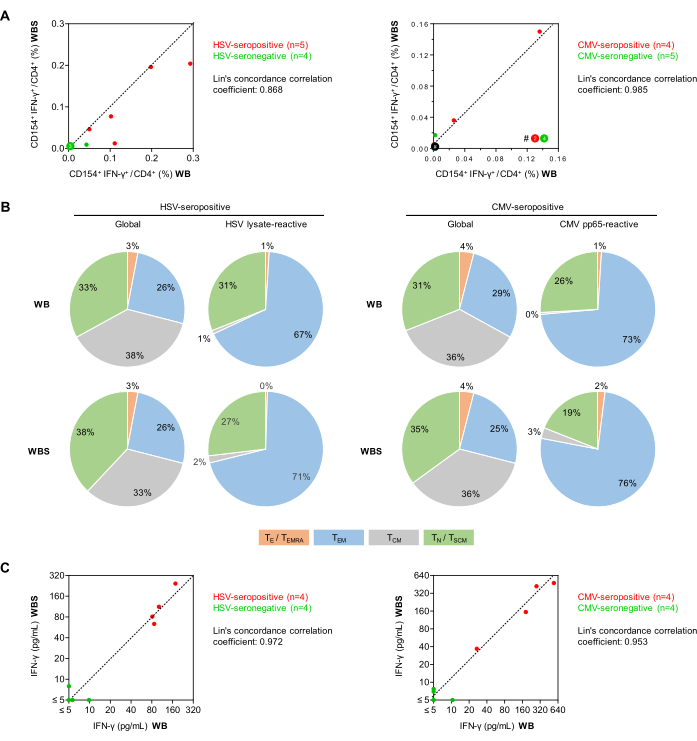
Figura 5: Reattività delle cellule T antivirali nella citometria a flusso e nell'ELISA. (A) Vengono mostrati i grafici di correlazione delle frequenze delle cellule T CD154+IFN-γ+/CD3+CD4+ corrette per il background (citometria a flusso) dai saggi di sangue intero stabiliti (WB) e di piccolo volume (WBS). I punti verdi e rossi rappresentano soggetti che sono rispettivamente sieronegativi e sieropositivi per il virus testato. (B) Utilizzando la valutazione citofluorimetrica dell'espressione di CD45RO e CCR7, i fenotipi delle cellule T memoria/effettrici sono stati determinati tra le cellule T globali CD3+CD4+ e le cellule T IFN-γ+CD154+CD3+CD4+ reattive all'antigene dopo stimolazione con lisato di HSV o CMV pp65 utilizzando sangue di donatori sieropositivi (n = 5 e 4, rispettivamente). Vengono mostrate le distribuzioni medie. Verde: cellule T naive (TN), CD45RO-CCR7+. Grigio: cellule T della memoria centrale (TCM), CD45RO+CCR7+. Blu: cellule T della memoria effettrice (TEM), CD45RO+CCR7-. Arancione: cellule T effettrici e cellule T effettrici di memoria che riesprimono CD45RA (TE/TEMRA), CD45RO-CCR7-. (C) Grafici di correlazione del rilascio di IFN-γ corretto di fondo (ELISA) misurato utilizzando i saggi WB e WBS. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Contenuto del tubo di stimolo. Vengono riassunte le concentrazioni di stock di stimoli e solventi. Il test su scala completa del sangue intero (WB) viene eseguito utilizzando 500 μL di sangue intero eparinizzato al litio, mentre la versione su piccola scala (WBS) richiede solo 250 μL di sangue. Per la WBS, tutti i volumi dei reagenti sono la metà dei volumi della WB. Clicca qui per scaricare questa tabella.
Tabella 2: Dati demografici di soggetti adulti sani campionati per generare i set di dati rappresentativi. Clicca qui per scaricare questa tabella.
Tabella 3: Pannello citofluorimetrico rappresentativo per l'analisi delle cellule T. Questo pannello citofluorimetrico è stato utilizzato per generare il set di dati rappresentativo. I risultati sono mostrati in dettaglio nella Figura 3. Clicca qui per scaricare questa tabella.
Tabella 4: Pannelli citometrici a flusso precedentemente pubblicati. I dati che utilizzano queste combinazioni di anticorpi sono stati precedentemente pubblicati da Tappe et al.24. Clicca qui per scaricare questa tabella.
Discussione
I dosaggi immunologici antigene-specifici forniscono informazioni sulle interazioni ospite-microbo, sono fondamentali per la ricerca sulla vaccinazione e l'immunoterapia e sono sempre più riconosciuti come modalità diagnostiche e prognostiche nei pazienti con infezioni opportunistiche35. Questo protocollo descrive un sistema di stimolazione antigenica facile che consente un'analisi robusta e multimodale dell'immunità antigene-specifica utilizzando volumi ematici minimi (250-500 μL per antigene). Il protocollo da 250 μL ridimensionato ha prodotto un'eccellente correlazione tra le frequenze delle cellule T antigene-specifiche, i fenotipi e la produzione di citochine rispetto al protocollo da 500 μL precedentemente stabilito. Nonostante la disponibilità di soluzioni di piccolo volume per alcune fasi dell'elaborazione del campione36, per quanto a conoscenza degli autori, nessun sistema commerciale attualmente disponibile può supportare in modo affidabile la stimolazione dell'antigene e l'analisi funzionale multiforme delle risposte immunitarie funzionali guidate dalle cellule T mediante citometria a flusso, saggi di rilascio di citochine e trascrittomica da volumi ematici di 250-500 μL. Il sistema commerciale più utilizzato che facilita uno spettro simile di applicazioni di ricerca utilizza un volume di sangue di 1 mL in un ambiente di stimolazione da 3 mL, con conseguente costo e quantità di antigeni necessari notevolmente più elevati rispetto al protocollo qui presentato 13,14,15.
Nonostante la continua ottimizzazione dei protocolli basati sul sangue intero per la quantificazione citofluorimetrica delle cellule T antigene-specifiche 6,37,38, le misure citofluorimetriche presentano diversi svantaggi. In particolare, rimangono di natura laboriosa e sono difficili da standardizzare a causa della notevole variabilità tra gli operatori (ad esempio, il processo di gating soggettivo) e delle diverse configurazioni delle apparecchiature, dei protocolli di compensazione e dei parametri di acquisizione tra i laboratori. Sebbene la refertazione standardizzata39 e l'uso di software di analisi e gating automatizzati possano migliorare la standardizzazione e la comparabilità di set di dati multicolore sempre più complessi40,41, il protocollo di stimolazione qui descritto è stato progettato per adattarsi a varie modalità di lettura non citofluorimetrica.
In particolare, i saggi di rilascio di citochine possono essere eseguiti con un tempo di utilizzo ridotto e attrezzature relativamente economiche e sono spesso facilmente standardizzati per le applicazioni cliniche di routine. Inoltre, come dimostrato in studi precedenti che utilizzano questo protocollo, una moltitudine di risposte citochiniche può essere misurata da volumi minimi di campione con moderni saggi multiplexati, consentendo così la profilazione di firme citochiniche complesse in contesti di ricerca24,42. Da notare che questo robusto protocollo con doppia co-stimolazione facilita la quantificazione affidabile delle risposte citochine antigene-specifiche in pazienti non linfopenici (>800 linfociti/μL di sangue), anche in quelli sottoposti a immunosoppressione iatrogena 26,34. Come svantaggio dei saggi di rilascio di citochine, specialmente nei pazienti con leucopenia, le citochine secrete non possono essere ricondotte a singole popolazioni cellulari. In alcuni casi, questo potrebbe essere mitigato dall'uso di stimoli specifici per le cellule, se disponibili. Tuttavia, può essere necessaria una combinazione di concentrazioni di citochine con altre modalità di lettura e/o aggiustamento delle risposte delle citochine sulla base dell'ematologia clinica (ad esempio, emocromo completo con differenziazione leucocitaria). In particolare, il protocollo qui presentato consente una combinazione di letture di citochine e firme trascrizionali dallo stesso campione, consentendo così un'analisi concordante di marcatori di attivazione trascrizionale ben definiti che potrebbero aggiungere contesto cellulare e specificità alle firme globali delle citochine.
Un passo futuro verso la completa standardizzazione e una migliore praticabilità clinica sarebbe la completa automazione di questi saggi, dall'elaborazione del campione alla lettura dell'analita. Anche se l'isolamento automatizzato preciso delle singole popolazioni cellulari è stato stabilito con successo43,44, l'analisi delle cellule T antigene-specifiche richiede ancora al personale di laboratorio di adottare misure di manipolazione intermittenti. Tuttavia, l'omissione dell'isolamento cellulare e della manipolazione di PBMC vulnerabili e l'uso di tubi di stimolazione commerciali compatibili con l'automazione potrebbero facilitare l'implementazione di flussi di lavoro semplici e completamente automatizzati basati su sangue intero per i saggi immunologici funzionali.
Nel complesso, i versatili protocolli basati sul sangue intero, come quello presentato nel presente documento, sono molto promettenti per espandere le applicazioni dei saggi immunologici funzionali antigene-specifici a nuove coorti di pazienti e campi di ricerca, compresi gli studi preclinici su piccoli animali. I saggi immunologici funzionali antigene-specifici sono attualmente in gran parte irrealizzabili in modelli murini o richiedono il raggruppamento di sangue da diversi animali e/o l'uso di estratti cellulari non standardizzati come gli splenociti. Dato l'interesse emergente per gli interventi immunoterapeutici per aumentare la difesa dell'ospite contro le infezioni opportunistiche (ad esempio, inibitori del checkpoint immunitario, fattori di crescita ematopoietici, citochine, ecc.) e l'aumento delle tecnologie di vaccinazione innovative, si prevede che i saggi immunologici funzionali antigene-specifici svolgeranno un ruolo crescente sia nella ricerca preclinica sulle malattie infettive che nelle applicazioni cliniche in diverse popolazioni di pazienti. Il sistema di stimolazione dell'antigene robusto, economico, facile da usare e a basso volume qui presentato può facilitare analisi immunitarie complete antigene-specifiche in aree non sfruttate. Inoltre, la robustezza pre-analitica di questo facile protocollo potrebbe creare opportunità per una migliore incorporazione delle applicazioni di immunodosaggio nella routine clinica, consentendoci di fare un passo avanti verso una gestione personalizzata e basata sui biomarcatori delle malattie infettive.
Divulgazioni
Non ci sono conflitti di interesse che devono essere divulgati dagli autori.
Riconoscimenti
Ringraziamo le divisioni di chimica clinica e sierologia delle infezioni dell'Istituto di Medicina di Laboratorio e Microbiologia dell'Ospedale Universitario di Augusta, per aver eseguito le misurazioni degli anticorpi sierici. Ringraziamo la Dott.ssa Friederike Liesche-Starnecker e l'Istituto di Patologia e Diagnostica Molecolare dell'Ospedale Universitario di Augusta per aver fornito le strutture di trascrittomica. Ringraziamo Marie Freitag dell'Ospedale Universitario di Augusta per il supporto nella logistica vaccinée e nell'acquisizione dei campioni. Ringraziamo il Dr. Olaf Kniemeyer e l'Hans-Knoell-Institute di Jena, in Germania, per aver fornito lisato di Aspergillus fumigatus . L'iniziativa di ricerca Bay-VOC (numero di finanziamento GE2-2452-200-D37666/2022), il Ministero della Scienza e dell'Arte della Baviera e l'Università di Augusta, in Germania, hanno sostenuto questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
Riferimenti
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon