Method Article
Ensaio de sangue total com coestimulação dupla para análise específica do antígeno da imunidade do hospedeiro a patógenos fúngicos e virais
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os imunoensaios baseados no sangue total fornecem uma ferramenta fácil e eficiente em termos de recursos para analisar a imunidade específica do antígeno para fins de diagnóstico e pesquisa. Este artigo fornece um protocolo otimizado baseado em sangue total com co-estimulação dupla para análise abrangente da imunidade do hospedeiro a patógenos fúngicos e virais, incluindo uma versão de baixo volume para pacientes pediátricos e pequenos animais.
Resumo
O processamento rápido e eficiente de amostras com baixo consumo de recursos, alto rendimento e alta robustez são essenciais para a aplicação científica e clínica eficaz de imunoensaios avançados específicos de antígenos. Tradicionalmente, esses imunoensaios, especialmente a análise de células T antígeno-específicas por citometria de fluxo ou ensaios de ponto imunoenzimáticos, geralmente dependem do isolamento de células mononucleares do sangue periférico. Esse processo é demorado, sujeito a muitos fatores de confusão pré-analíticos e requer grandes volumes de sangue. Os ensaios baseados em sangue total fornecem uma alternativa fácil com maior robustez pré-analítica e menores requisitos de volume sanguíneo. Além disso, os ensaios baseados em sangue total permitem a preservação de interações intercelulares que não são capturadas por ensaios usando subconjuntos de células isoladas. Recentemente, foi proposto um imunoensaio refinado de sangue total com co-estimulação dupla anti-CD28 e anti-CD49d para análise abrangente das funções das células T específicas do antígeno e das interações intercelulares complexas em resposta a vários antígenos fúngicos e virais. Este protocolo fornece orientação para a preparação de tubos de estimulação, estimulação sanguínea e processamento de amostras a jusante para citometria de fluxo, ensaios de secreção de citocinas e análises transcricionais. Isso inclui um protocolo de baixo volume validado e funcionalmente equivalente, inédito e inédito (250 μL) para tornar o monitoramento de citometria de fluxo e de células T baseado em citocinas mais acessível para estudos em pacientes pediátricos ou estudos pré-clínicos em pequenos animais (por exemplo, camundongos). Ao todo, esses protocolos fornecem uma caixa de ferramentas versátil para análises imunológicas complexas específicas de antígenos em ambientes de pesquisa clínica e translacional.
Introdução
A quantificação e caracterização da imunidade específica do antígeno, especialmente as respostas específicas das células T, é fundamental para a pesquisa em imunobiologia e vacinação, bem como alguns testes diagnósticos. Tradicionalmente, os imunoensaios específicos de antígenos geralmente dependiam de células mononucleares isoladas do sangue periférico (PBMCs). No entanto, o isolamento dessas células é demorado e intensivo em recursos e geralmente requer volumes sanguíneos relativamente grandes. Além disso, para evitar a ativação de granulócitos e subsequente distúrbio de células T durante o armazenamento pré-analítico1, o processamento rápido das amostras é fundamental, o que muitas vezes não é viável na prática clínica. Essas limitações dificultam a praticidade de imunoensaios específicos de antígenos em cenários de pesquisa de alto rendimento e rotinas clínicas. Portanto, o desenvolvimento de abordagens baseadas em sangue total fáceis de usar e potencialmente automatizáveis nos últimos anos abriu novas áreas de aplicações de imunoensaios. No entanto, os sistemas atuais disponíveis comercialmente geralmente carecem de ambientes co-estimulatórios ideais para células T e são suscetíveis a atrasos pré-analíticos. Por exemplo, um ensaio de liberação de IFN-γ baseado em sangue total amplamente utilizado tem uma taxa de reversão positiva para negativa de 19% após 6 h de armazenamento de sangue pré-analítico2. Protocolos otimizados com dupla co-estimulação anti-CD28 e anti-CD49d foram desenvolvidos para superar essas limitações 3,4,5,6.
O protocolo aqui apresentado permite a quantificação e caracterização precisas e reprodutíveis de células T específicas do antígeno, avaliação das respostas de citocinas induzidas por antígeno e outros marcadores imunes funcionais (citometria de fluxo ou transcricional) a partir de um volume sanguíneo mínimo, ou seja, 500 μL de sangue por tubo de estimulação. Outras vantagens deste protocolo incluem baixo tempo de prática, alta resiliência a fatores de confusão pré-analíticos e preservação de interações intercelulares funcionais em um ambiente ex vivo relativamente fisiológico. A comparabilidade da caracterização de células T específicas do antígeno por citometria de fluxo baseada no sangue total com dados gerados a partir de ensaios tradicionais baseados em PBMC foi demonstrada anteriormente no contexto da quantificação de células T específicas do molde6. Além disso, a estimulação direta do sangue dos indivíduos anula a necessidade de suplementação com soro autólogo, alogênico ou mesmo xenogênico, comumente necessário para a estimulação ideal do PBMC. A omissão do isolamento celular também reduz o cisalhamento e o estresse térmico, melhorando assim a viabilidade celular. Mais importante ainda, os ensaios baseados em sangue total preservam as populações de granulócitos que são perdidas durante a centrifugação gradiente para isolamento de PBMCs7. Assim, esta configuração de ensaio preserva e captura loops de interação funcional entre granulócitos e células mononucleares4.
É importante observar que este protocolo requer apenas modificações mínimas para acomodar diferentes modalidades de leitura e até permite a análise dupla da liberação de citocinas e das respostas transcricionais do mesmo tubo de estimulação. Especificamente, enquanto as citocinas são analisadas a partir do sobrenadante da cultura após a estimulação, o pellet celular pode ser usado para isolamento de RNA com análise transcriptômica subsequente. O fluxo de trabalho geral para as várias modalidades de leitura está resumido na Figura 1.
Nos últimos anos, um número crescente de ensaios baseados em sangue total foi desenvolvido para monitoramento imunológico reativo a patógenos em ambientes clínicos e de pesquisa, por exemplo, para Mycobacterium tuberculosis 8,9, Bordetella pertussis3, Orientia tsutsugamushi10 e SARS-CoV-2 5,11,12. Por exemplo, um sistema previamente estabelecido foi usado para vários antígenos, incluindo M. tuberculosis, vírus Influenza A e SARS-CoV-2, mas não usa fatores co-estimulatórios otimizados para estimulação de células T auxiliares (Th) 13,14,15. Embora o volume de sangue necessário para esses ensaios já seja significativamente menor do que o usado para ensaios tradicionais baseados em PBMC ou kits de estimulação de sangue total disponíveis comercialmente, um volume de amostra ainda menor pode ser justificado para aplicações em pediatria, neonatologia, pacientes na unidade de terapia intensiva (UTI) e pesquisa pré-clínica em modelos de pequenos animais. Por exemplo, mesmo a amostragem de sangue terminal de camundongos (por exemplo, por punção cardíaca) geralmente produz um máximo de 0,7-1 mL de sangue. Assim, a possibilidade de reduzir ainda mais os protocolos de imunoensaio baseados em sangue total previamente estabelecidos 4,6 para quantificação e caracterização precisas das respostas de células T reativas ao antígeno a partir de 250 μL de volume sanguíneo por tubo de estimulação foi avaliada como parte deste protocolo.
Protocolo
O conselho de ética da Universidade Ludwig Maximilians de Munique (projeto número 21-0689) aprovou a coleta de amostras de sangue humano. Além disso, partes dos conjuntos de dados representativos foram gerados sob o número 20-426 do Corona-Register-Study, também aprovado pelo comitê de ética da Universidade Ludwig Maximilians de Munique. O consentimento informado foi obtido.
1. Preparação de tubos de estimulação de sangue total
NOTA: Esta etapa é adaptada de Lauruschkat et al.4 e Weis et al.6. A Tabela 1 resume as concentrações e volumes detalhados do reagente.
- Em condições estéreis (bancada estéril), prepare tubos de coleta de sangue de 2,7 mL sem anticoagulante, com antígenos e anticorpos co-estimulatórios. Adicionar 1 μg/ml de α-CD28 e 1 μg/ml de α-CD49d a cada tubo, incluindo o controlo negativo. Considere o volume de sangue a ser adicionado para estimulação do sangue total ao determinar as concentrações finais (250 μL ou 500 μL). Para manter a geometria da câmara e a acessibilidade da amostra, não retraia o êmbolo do tubo de coleta de sangue.
- Com base no desenho do estudo, determine se os tubos de controle negativo não devem conter estímulo adicional (controle de fundo não estimulado, conforme mostrado na Tabela 1) ou usar antígenos para os quais a coorte do estudo deve abrigar células T específicas de antígeno ou células T mínimas (por exemplo, um pool de peptídeos do HIV em indivíduos soronegativos para o HIV 16).
- Para estimulação específica do antígeno, otimize as concentrações ideais de antígenos por titulação em experimentos preliminares. Para gerar os dados representativos abaixo, use as seguintes concentrações otimizadas de antígeno: 1,2 μg/mL de lisado HSV-1, 0,6 nM/peptídeo/mL de CMV pp65, 0,6 nM/peptídeo/mL de SARS-CoV-2 Prot_S, 50 μg/mL de lisado de Aspergillus fumigatus e 1 ng/mL de CRX-527.
- Inclua um controle positivo, especialmente para estudos em pacientes linfopenicos ou aqueles que recebem farmacoterapia imunossupressora. Use a solução de controle positivo CPI (0,6 nM / peptídeo / mL), consistindo de citomegalovírus, vírus parainfluenza e peptídeos do vírus influenza.
NOTA: Alternativamente, estímulos sintéticos, como PMA (10 μg/mL) ± ionomicina (1 μg/mL), podem ser usados, mas induzem menos reações fisiológicas e podem afetar a expressão de antígenos de superfície comumente usados como marcadores populacionais para citometria de fluxo (mais notavelmente, CD417). Observe que os anticorpos co-estimulatórios não são necessários em conjunto com a maioria dos estímulos sintéticos de controle positivo e podem até afetar negativamente a viabilidade e a capacidade de resposta celular. - Para harmonizar os volumes de reagentes em todos os tubos de estimulação, adicione o meio RPMI 1640 até os seguintes volumes totais: Ensaio em escala real para citometria de fluxo: 50 μL; Ensaio em escala real para análise de citocinas e transcriptômica: 500 μL; Ensaio em pequena escala para citometria de fluxo: 25 μL; Ensaio em pequena escala para análise de citocinas e transcriptômica: 250 μL.
NOTA: Para a preparação de vários conjuntos de tubos de estimulação, recomenda-se preparar master mixes incluindo todos os ingredientes devido ao menor risco de contaminação e ao baixo volume de fatores co-estimulatórios e estímulos. - Utilizar imediatamente os tubos preparados ou criopreservá-los a -20 °C. A maioria dos reagentes pode ser armazenada por até 4 semanas; no entanto, pré-valide os períodos máximos de armazenamento para novos reagentes/estímulos.
2. Estimulação e incubação de amostras de sangue total
- Cerca de 30-60 minutos antes da estimulação do sangue total, descongele os tubos de estimulação prontos para uso e mantenha-os em temperatura ambiente.
- Colete sangue venoso do doador/paciente usando tubos de coleta de sangue com anticoagulante de heparina de lítio. Certifique-se de que o volume de sangue coletado atenda aos requisitos individuais do experimento, ou seja, um mínimo de 750 μL é necessário para 3 condições do ensaio em pequena escala, incluindo controle negativo e positivo. Para os tubos de coleta de sangue adquiridos comercialmente, encha-os completamente para atingir concentrações de trabalho de heparina de 16 a 25 UI / mL de sangue.
NOTA: Os dados demográficos dos indivíduos adultos saudáveis recrutados para gerar os conjuntos de dados representativos são mostrados na Tabela 2. - Transfira a quantidade necessária de sangue total heparinizado (250 μL ou 500 μL para ensaio em pequena ou escala real, respectivamente) para os tubos de estimulação pipetando sob uma bancada estéril.
NOTA: Se uma bancada de trabalho estéril não estiver disponível ou ao trabalhar com samples exibindo risco mínimo de infecção (ou seja, sangue de seres humanos ou animais pré-selecionados), samples podem ser transferidos para os tubos de estimulação usando seringas estéreis. Este método também permite o processamento da amostra à beira do leito imediatamente após a coleta de sangue, o que minimiza o armazenamento pré-analítico e o comprometimento das células T. Antes de injetar o sangue, desinfete extensivamente as vedações de borracha do tubo de coleta de sangue e de todos os tubos de estimulação com um desinfetante alcoólico. Deixe o desinfetante secar por pelo menos 1 min. - Inverta cuidadosamente os tubos de estimulação 5x-10x. Coloque os tubos de estimulação em uma incubadora a 37 °C. Observe que uma incubadora de CO2 não é necessária. Para evitar a ativação inespecífica de neutrófilos, não refrigere o tubo de coleta de sangue.
NOTA: Este protocolo foi validado para armazenamento de sangue pré-analítico de até 8 h em temperatura ambiente para permitir o transporte da amostra. Se possível, é preferível injetar sangue total nos tubos de estimulação no local da coleta e transportar sangue para um laboratório central nos tubos de estimulação, pois os fatores co-estimulatórios melhorarão a viabilidade dos linfócitos18,19. - Apenas para amostras utilizadas para ensaios de citometria de fluxo com coloração intracelular, adicionar brefeldina A (concentração final de 10 μg/ml) a cada tubo de estimulação após 4 h de incubação.
- Prepare uma solução de brefeldina A de 1 mg/ml em RPMI e adicione 1 μL da solução por 100 μL de volume de amostra (ou seja, cocktail de estimulação pré-misturado + volume de sangue total). Adicione brefeldin A destampando os tubos e pipetando sob uma bancada estéril. Cubra e retorne os tubos para a incubadora a 37 °C por mais 16-18 h a 37 °C (20-22 h no total).
- Para ensaios de secreção de citocinas ou análises transcricionais, não adicione brefeldina A e incube continuamente as amostras a 37 °C por 24-26 h.
NOTA: A brefeldina A inibe o aparelho de Golgi e, assim, anula a secreção de citocinas e o transporte de proteínas para a superfície celular. Como a secreção ou a expressão de superfície resultarão em perda e degradação de proteínas após a reinternalização, respectivamente, os inibidores de exocitose são essenciais para o acúmulo intracelular e coloração de citocinas e alguns marcadores de ativação (por exemplo, CD154) para estudos de citometria de fluxo. No entanto, a brefeldina A também interrompe os processos celulares fisiológicos visíveis no transcriptoma e invalida os ensaios de secreção de citocinas dos sobrenadantes da cultura20,21, necessitando do uso de dois tubos de ensaio separados (um com e outro sem brefeldina A) para realizar essas leituras em paralelo.
3. Preparação de amostras para citometria de fluxo
- Adicione 500 μL de solução de EDTA 0,5 M a cada tubo de estimulação e incube a amostra por 15 minutos em temperatura ambiente para separar as células aderentes da superfície dos tubos.
- Transfira as amostras para novos tubos de centrífuga de 15 mL. Enxágue os tubos de estimulação com 1 mL de tampão de lise eritrocitária para coletar as células sanguíneas restantes e, em seguida, adicione o tampão e as células aos mesmos tubos de centrífuga de 15 mL.
- Centrifugue os tubos de 15 mL por 7 min a 600 x g. Descarte cuidadosamente o sobrenadante.
- Ressuspenda o sedimento de células sanguíneas em tampão de lise eritrocitária (Figura 2A). Use 5 mL de tampão de lise eritrocitária para 500 μL de sangue total e 3 mL para 250 μL de sangue total.
NOTA: As condições ideais de lise eritrocitária precisam ser pré-avaliadas para o tampão específico usado (produto interno ou comercial). As instruções fornecidas aqui foram otimizadas para o tampão de lise eritrocitária listado na tabela de materiais. - Incube as amostras à temperatura ambiente até que pareçam límpidas (Figura 2B). Para evitar a lise e agregação de granulócitos, não exceda 6 min de incubação. Um indicador de lise eritrocitária bem-sucedida é a capacidade de ver os números e a escala no tubo de 15 mL através do fluido (Figura 2C).
- Centrifugue os tubos de 15 mL por 7 min a 600 x g. Descarte cuidadosamente o sobrenadante, repita as etapas 3.4 a 3.5 se o pellet celular ainda estiver visivelmente vermelho.
- Ressuspenda o pellet celular em 1 mL de HBSS e transfira as células para tubos de reação de 2 mL.
- Centrifugue os tubos de 2 mL por 5 min a 400 x g. Descarte cuidadosamente o sobrenadante.
- Realize a coloração por citometria de fluxo de acordo com as instruções do fabricante para o kit de coloração intracelular e os anticorpos usados.
NOTA: O painel de anticorpos usado para gerar o conjunto de dados representativo está resumido na Tabela 3.
4. Preparação de amostras para ensaios de citocinas
- Após a etapa 2.6, transfira o sangue diluído dos tubos de estimulação para tubos de 1,5 mL.
- Centrifugue os tubos de 1,5 mL por 20 min a 2000 x g. Pipetar cuidadosamente o sobrenadante para um tubo novo de 1,5 ml e utilizá-lo imediatamente para análise de citocinas ou criopreservar os sobrenadantes a -80 °C.
- Centrifugue o sobrenadante novamente por 5 min a ≥ 7000 x g (em tubos de 1,5 mL) para remover os detritos celulares residuais antes da análise, especialmente após o descongelamento. Dependendo do protocolo de ensaio de citocinas, realizar a pré-diluição das amostras.
- Ressuspenda o pellet celular em 1 mL de tampão de proteção de RNA e criopreserve-o a -80 ° C para isolamento subsequente de RNA. Como alternativa, ressuspenda o pellet celular em tampão de lise para isolamento imediato de RNA de acordo com as instruções do kit de isolamento de RNA (ou protocolo interno).
NOTA: Se necessário, dependendo do protocolo de processamento de RNA subsequente, uma etapa de lise de eritrócitos semelhante a 3,4-3,5 pode ser adicionada antes de adicionar o tampão de proteção de RNA.
Resultados
Análise multimodal de respostas imunes antígeno-específicas após estimulação sanguínea total com antígenos associados a patógenos
Para gerar um conjunto de dados representativo, foi selecionado um doador adulto saudável soropositivo para HSV-1 e CMV que recebeu vacinas contra SARS-CoV-2. Além de um controle não estimulado, os seguintes estímulos foram usados conforme descrito acima: lisado do vírus Herpes simplex 1 (HSV) (recomendação do fabricante, dados não publicados), citomegalovírus (CMV) pp6522, síndrome respiratória aguda grave coronavírus 2 (SARS-CoV-2) Prot_S 5,23, lisado de Aspergillus fumigatus (um patógeno ambiental onipresente)4,24, CRX-527 (um estímulo do Receptor Toll-like 4 baseado em lipopolissacarídeo, que não deve ativar as células T em si)25, e CPI (controle positivo para ativação de células T CD4+ consistindo em CMV, vírus parainfluenza e peptídeos do vírus influenza)26. Os dados de citometria de fluxo e a estratégia de gating são mostrados na Figura 3. Geralmente, é aconselhável medir o maior número possível de linfócitos quando se trata de populações de células raras (50.000 - 100.000 linfócitos), pois a precisão e a confiabilidade das medidas dependem do número total de eventos27. A amostra não estimulada é usada para gating de subconjuntos de células individuais (por exemplo, células CD3 + CD4 +). As portas para CD45RO e CCR7 para fenotipagem de células T de memória devem ser definidas na população total de CD3 + CD4 + e, em seguida, transferidas para as populações positivas para marcadores de ativação, pois o baixo número de eventos nestas últimas geralmente impede a identificação clara de populações distintas. Pequenos ajustes podem ser necessários para portões individuais, por exemplo, para levar em conta as diferenças na viabilidade dos linfócitos. A regulação positiva de CD154 (ou ligante CD40) foi descrita como um marcador de ativação de células T auxiliares global, consistente e rapidamente induzido28,29. O IFN-γ é considerado um dos marcadores de ativação de células T mais proeminentes e específicos do tipo 1 30,31. É importante ressaltar que este ensaio foi testado e publicado com vários marcadores adicionais de ativação, exaustão e citocinas (ver Tabela 4 e24).
As frequências de populações positivas para marcadores de ativação na amostra não estimulada representam origens inespecíficas e foram subtraídas das frequências estimuladas pelo antígeno. Após a subtração do histórico inespecífico, o doador representativo tinha 0,75% (HSV), 0,09% (CMV), 0,06% (SARS-CoV-2), 0,34% (A. fumigatus), 0,00% (CRX-527) e 1,21% (CPI) de células T CD154+/CD3+CD4+ helper específicas, respectivamente. A expressão de IFN-γ pode ser analisada de forma semelhante, resultando em 0,12% (HSV), 0,07% (CMV), 0,03% (SARS-CoV-2), 0,04% (A. fumigatus), 0% (CRX-527) e 0,74% (CPI) de células IFN-γ+/CD3+CD4+ .
As populações de células T podem ser subdivididas em células T virgens (TN, CD45RO-CCR7+), células T de memória central (TCM, CD45RO+CCR7+), células T de memória efetora (TEM, CD45RO+CCR7-) e células T efetoras (e células T de memória efetora que reexpressam CD45RA, TE/TEMRA, CD45RO-CCR7-). Entre as células T CD3+CD4+ globais, o doador representativo apresentou 38,34% de TN, 38,33% de TCM, 20,77% de TEM e 2,56% de TE/TEMRA, respectivamente, conforme determinado pela amostra não estimulada (Figura 3A). No entanto, entre as células T auxiliares reativas específicas do antígeno (CD154+IFN-γ+), TCM e TEM foram de longe os subconjuntos mais proeminentes, com médias de 22,14% e 73,97%, respectivamente.
Dados sobre populações adicionais de leucócitos foram publicados anteriormente usando essa metodologia24. As combinações de anticorpos usadas são apresentadas na Tabela 4 para referência futura.
Além disso, para mostrar todo o potencial desta metodologia, um ELISA IFN-γ foi realizado em um segundo conjunto de amostras estimuladas (sem a adição de brefeldina A). Para evitar a excedência da faixa de detecção do kit ELISA IFN-γ, o plasma das amostras estimuladas por CPI foi pré-diluído 1:4. As seguintes concentrações de IFN-γ foram medidas e normalizadas por mL de volume sanguíneo do sujeito, ou seja, corrigidas para diluição nos tubos de estimulação e nas diluições pré-ELISA: 0 pg/mL (não estimulado), 69,4 pg/mL (HSV), 471 pg/mL (CMV), 17,8 pg/mL (SARS-CoV-2), 61,9 pg/mL (A. fumigatus), 34,0 pg/mL (CRX-527) e 1958 pg/mL (CPI).
Por fim, o RNA foi isolado das mesmas amostras com resultados consistentes. O rendimento médio foi de 719 ng, com uma taxa de absorbância média de 260 nm / 280 nm sendo 1,98.
Ao todo, esse conjunto de dados ilustra que o protocolo apresentado permite um espectro de leitura multifacetado e análise concomitante de vários antígenos associados à infecção usando volume sanguíneo mínimo, ou seja, 8 mL no total para múltiplos estímulos e modalidades de leitura.
Conjunto de dados representativo para análises transcricionais para rastrear a resposta à vacinação usando sangue total estimulado por antígeno
Como prova de princípio para estudos transcricionais realizados em sangue total estimulado por antígeno, o sangue foi coletado de 9 indivíduos adultos saudáveis imediatamente antes e 1 mês após a primeira vacinação de reforço com BNT162b2 (vacina de mRNA SARS-CoV-2)32,33 7-9 meses após a série inicial de vacinas de duas doses. O rendimento médio de RNA de 500 μL de sangue total não estimulado e estimulado por Prot_S foi de 1,1 μg de RNA altamente puro, com uma taxa média de absorção de 260/280 de 1,99. Após a análise do nCounter, as contagens de RNA foram normalizadas para os 12 genes de manutenção do painel (média geométrica). Posteriormente, a proporção de contagens de mRNA normalizadas em amostras estimuladas por Prot_S versus controles de fundo não estimulados foi determinada para cada sujeito e gene. As proporções medianas para medianas das medições pós-vacinação versus pré-vacinação foram determinadas e a análise do enriquecimento da via foi realizada usando o pacote de software listado na Tabela de Materiais. O enriquecimento das vias canônicas foi considerado significativo em um valor absoluto de escore z ≥ 1,25 e um valor de p ajustado de Benjamini-Hochberg < 0,05. Vias enriquecidas de forma significativamente diferente estão resumidas na Figura 4A, e uma rede simplificada de mudanças ajustadas ao fundo na resposta pós versus pré-vacinação à Prot_S é mostrada na Figura 4B. Além disso, a indução mais forte ajustada ao fundo de genes representativos relacionados à maturação de células apresentadoras de antígenos e à ativação de células T induzida por Prot_S após a vacinação de reforço é mostrada em (p < 0,01-0,03) Figura 4C. Por fim, um aumento nas células T auxiliares do tipo 1 Prot_S específicas do background (CD69 + IFN-γ+) após a vacinação na maioria dos doadores foi confirmado por citometria de fluxo usando um segundo conjunto de tubos de estimulação (p = 0,03, Figura 4D).
Comparação das respostas de células T reativas ao vírus em protocolos de imunoensaio baseados em sangue total em escala real e de pequeno volume
Em seguida, as frequências de células T auxiliares CD154 + IFN-γ + reativas ao vírus (células CD3 + CD4 + ) em voluntários saudáveis foram comparadas usando os protocolos de estimulação de antígeno de sangue total em escala real (500 μL, WB) e pequeno volume (250 μL, WBS) (Figura 5). Como relatado anteriormente34, frequências mínimas de fundo inespecíficas de células CD154 + IFN-γ + foram observadas com qualquer um dos protocolos, apesar da co-estimulação dupla (médias de 0,010% e 0,011% para WB e WBS, respectivamente). É importante observar que, embora as respostas de fundo inespecíficas sejam subtraídas das respostas específicas do antígeno, elas ainda contribuem para aumentar a imprecisão do ensaio, conforme discutido anteriormente27. Sinais de fundo elevados (ou seja, células Th CD154+ CD154+ >0,07-0,1%) ou células CD154+IFN-γ+ >0,05%) podem indicar contaminação da amostra, uma infecção aguda do sujeito ou podem ser o resultado de manuseio inadequado de amostras pré-analíticas.
As frequências médias de células T reativas ao lisado de HSV em doadores soropositivos (n = 5) foram de 0,151% e 0,107% nos sistemas WB e WBS, respectivamente, em comparação com 0,012% e 0,004% em doadores soronegativos (n = 4). Com o pool de peptídeos pp65 do CMV, os doadores soropositivos (n = 4) tiveram 0,041% e 0,049% de células T reativas em comparação com 0,001% e 0,004% nos doadores soronegativos (n = 5). Os coeficientes de correlação de concordância de Lin foram de 0,868 para HSV e 0,985 para CMV, sugerindo uma forte correlação (Figura 5A). Notavelmente, o teste de células T específicas para CMV pode ser negativo em indivíduos soropositivos saudáveis que não tiveram eventos de reativação recentes. Os repertórios de células T auxiliares CD3 + CD4 + reativas ao antígeno foram diferenciados com base na expressão de CCR7 e CD45RO (Figura 5B). Tranquilizadoramente, os resultados obtidos usando os protocolos WB e WBS foram comparáveis para populações totais e reativas ao antígeno. Esperava-se que, com ambos os ensaios, a proporção de células Th de memória mais diferenciadas (ou seja, células de memória efetoras) fosse maior entre as células T reativas ao antígeno do que entre a população total de células Th. Como esperado, apenas algumas células T virgens foram ativadas por estimulantes virais (Figura 5B).
Além disso, em outro conjunto de experimentos, os sobrenadantes de cultura estimulados foram analisados por IFN-γ ELISA (Figura 5C). Observou-se um histórico inespecífico mínimo (médias de 1,29 pg/mL e 2,18 pg/mL nos protocolos WB e WBS, respectivamente). Amostras de sangue de doadores soropositivos para HSV mostraram concentrações médias de IFN-γ induzidas por HSV ajustadas de fundo de 111 pg/mL e 125 pg/mL no sistema WB e WBS, respectivamente. Em contraste, as concentrações de IFN-γ em amostras soronegativas foram consistentemente inferiores a 10 pg/mL em ambos os sistemas (coeficiente de correlação de concordância de Lin = 0,972, Figura 5C). Da mesma forma, a estimulação pp65 do sangue de doadores soropositivos para CMV produziu concentrações médias de IFN-γ de 258 pg/mL e 272 pg/mL nos sistemas WB e WBS, respectivamente, enquanto a secreção mínima de IFN-γ induzida por pp65 foi observada em ambos os sistemas usando amostras soronegativas (coeficiente de correlação de concordância de Lin = 0,953, Figura 5C).
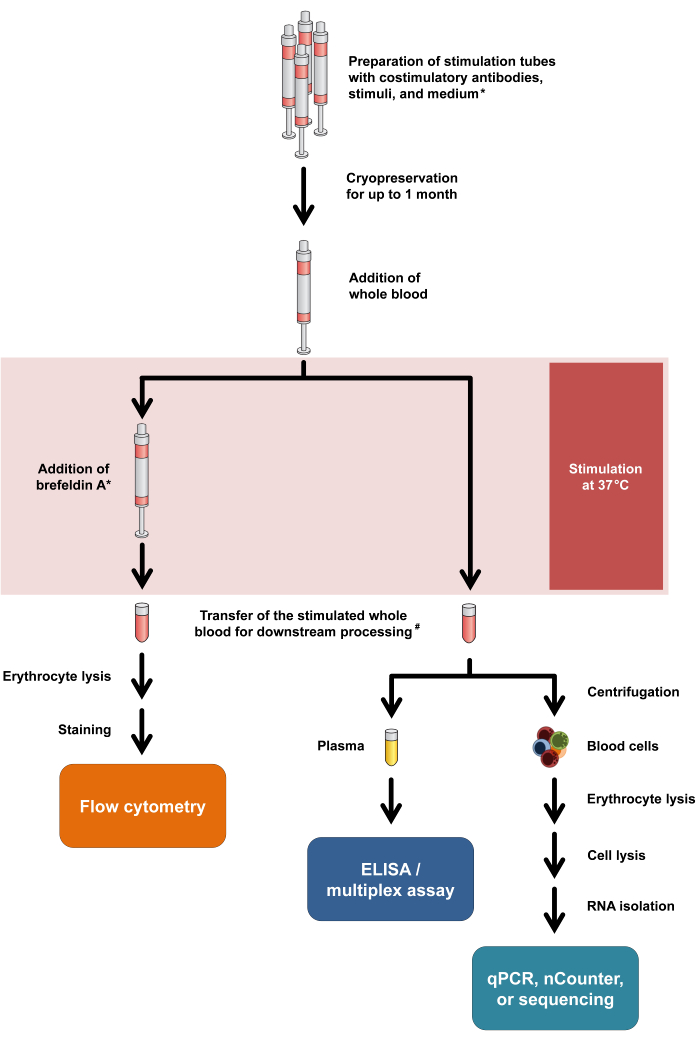
Figura 1: Fluxograma resumindo procedimentos experimentais e leituras. Asterisco significa que Brefeldin A é necessário para alguns marcadores de ativação de células T (por exemplo, CD154) e coloração intracelular de citocinas. Consulte as etapas de protocolo 2.5 e 2.6. #: O sangue para citometria de fluxo é inicialmente transferido para tubos de centrífuga de 15 mL para lise eritrocitária, enquanto o sangue para ensaios de citocinas e transcriptômica é transferido para tubos de microcentrífuga de 1,5 mL. Clique aqui para ver uma versão maior desta figura.

Figura 2: Lise eritrocitária. Depois que o sangue estimulado foi ressuspenso em (A) tampão de lise eritrocitária, ele é incubado até (B) o fluido parecer claro, mas não mais do que 6 min. (C) Ao usar um tubo graduado de 15 mL, sua escama deve se tornar visível através da amostra cada vez mais translúcida. Clique aqui para ver uma versão maior desta figura.
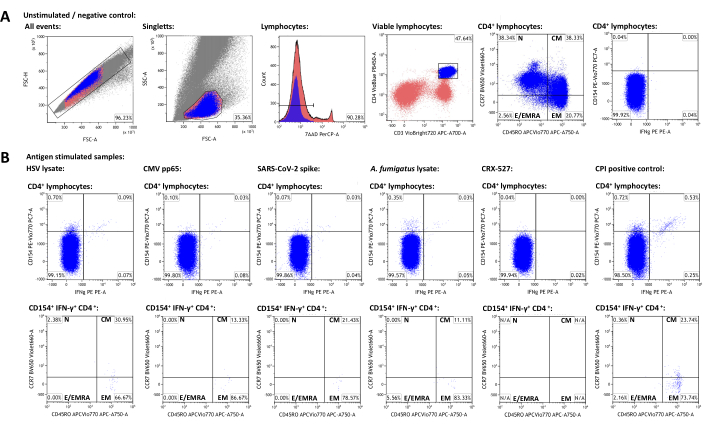
Figura 3: Conjunto de dados representativos e esquemas de passagem por citometria de fluxo. (A) Os eventos singleto são identificados pelas propriedades FSC-A e FSC-H. Destes, os linfócitos são bloqueados usando FSC-A e SSC-A. Os linfócitos são diferenciados em células T auxiliares CD3+CD4+. Os níveis de expressão de CD45RO e CCR7 são usados para fenotipagem de populações de células efetoras e de memória. IFN-γ e CD154 foram usados como marcadores de ativação. As portas foram definidas com base na população de IFN-γ-CD154- na amostra não estimulada. Gates foram posteriormente transferidos para as amostras estimuladas (B). A caracterização das populações de memória das células T ativadas foi obtida transferindo a porta do quadrante CCR7 / CD45RO da população CD3 + CD4 + para as populações IFN-γ + CD154 + CD3 + CD4 +. Clique aqui para ver uma versão maior desta figura.
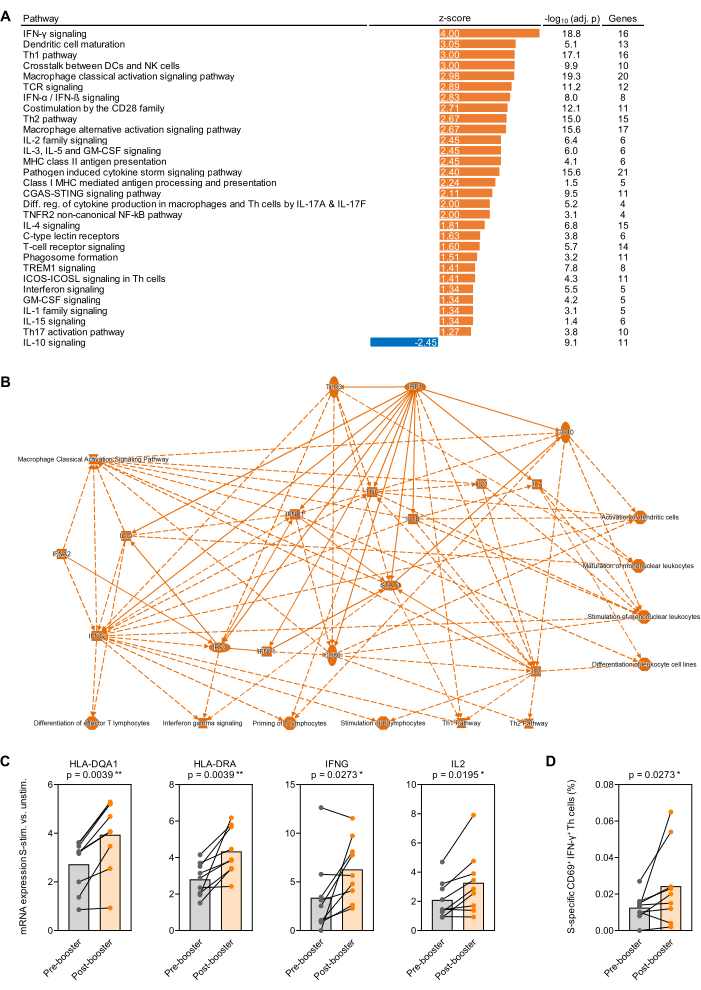
Figura 4: Alterações transcricionais induzidas por antígeno após a vacinação de reforço com SARS-CoV-2. (A) O enriquecimento ajustado ao fundo das vias transcricionais no sangue total estimulado pela proteína spike (Prot_S) do SARS-CoV-2 após versus antes (primeiro) da vacinação de reforço de mRNA BNT162b2 foi analisado em 9 indivíduos adultos saudáveis. São mostradas vias canônicas relacionadas ao sistema imunológico com um valor de p ajustado por Benjamini-Hochberg (BH-aj.) <0,05 (-log10[BH-adj. p] >1,3) e um escore z absoluto >1,25). (B) Rede simplificada resumindo genes e vias mais fortemente enriquecidas em sangue total estimulado por S após versus antes da vacinação de reforço. (C) Níveis de expressão ajustados ao fundo de genes representativos associados à apresentação de antígenos e ativação de células T em sangue total estimulado por Prot_S antes e depois da vacinação de reforço. Teste de Wilcoxon pareado. (D) Frequências corrigidas de fundo de células T IFN-γ+CD69+ específicas para Prot_S antes e depois da vacinação de reforço. Teste de Wilcoxon pareado. Clique aqui para ver uma versão maior desta figura.
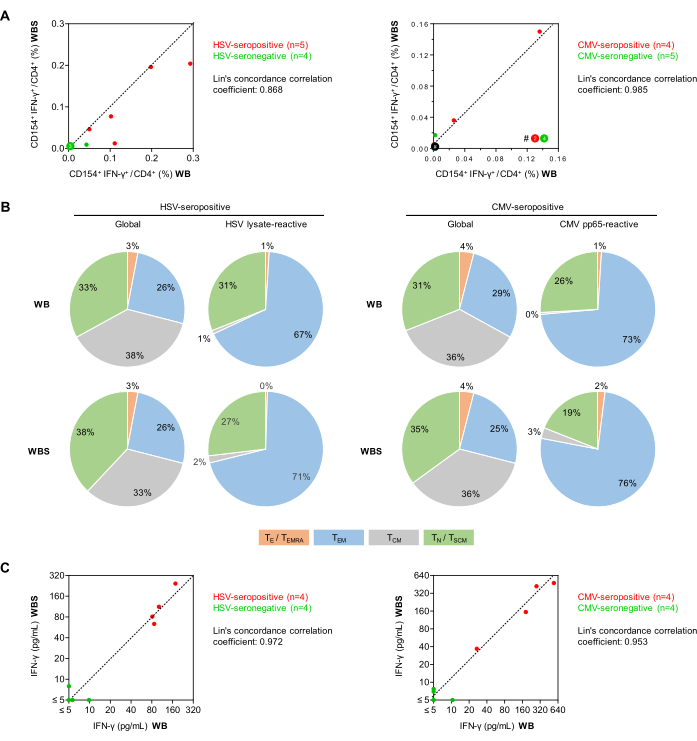
Figura 5: Reatividade antiviral de células T em citometria de fluxo e ELISA. (A) São mostrados gráficos de correlação das frequências de células T CD154 + IFN-γ + / CD3 + CD4 + corrigidas de fundo (citometria de fluxo) dos ensaios de sangue total estabelecidos (WB) e de pequeno volume (WBS). Os pontos verdes e vermelhos representam indivíduos soronegativos e soropositivos para o vírus testado, respectivamente. (B) Usando a avaliação por citometria de fluxo da expressão de CD45RO e CCR7, os fenótipos de células T de memória/efetoras foram determinados entre células T CD3+CD4+ globais e células T IFN-γ+CD154+CD3+CD4+ reativas ao antígeno após estimulação com lisado de HSV ou CMV pp65 usando sangue de doadores soropositivos (n = 5 e 4, respectivamente). As distribuições médias são mostradas. Verde: células T virgens (TN), CD45RO-CCR7+. Cinza: células T de memória central (TCM), CD45RO+CCR7+. Azul: células T de memória efetora (TEM), CD45RO+CCR7-. Laranja: células T efetoras e células T de memória efetora que reexpressam CD45RA (TE/TEMRA), CD45RO-CCR7-. (C) Gráficos de correlação da liberação de IFN-γ corrigida pelo fundo (ELISA) medida usando os ensaios WB e WBS. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Conteúdo do tubo de estímulo. As concentrações de estoque de estímulos e solventes são resumidas. O ensaio de sangue total (WB) em escala real é realizado usando 500 μL de sangue total heparinizado de lítio, enquanto a versão em pequena escala (WBS) requer apenas 250 μL de sangue. Para WBS, todos os volumes de reagentes são metade dos volumes WB. Clique aqui para baixar esta tabela.
Tabela 2: Dados demográficos de indivíduos adultos saudáveis amostrados para gerar os conjuntos de dados representativos. Clique aqui para baixar esta tabela.
Tabela 3: Painel de citometria de fluxo representativo para análise de células T. Este painel de citometria de fluxo foi usado para gerar o conjunto de dados representativo. Os resultados são mostrados em detalhes na Figura 3. Clique aqui para baixar esta tabela.
Tabela 4: Painéis de citometria de fluxo publicados anteriormente. Os dados usando essas combinações de anticorpos foram publicados anteriormente por Tappe et al.24. Clique aqui para baixar esta tabela.
Discussão
Os imunoensaios antígeno-específicos fornecem informações sobre as interações hospedeiro-micróbio, são fundamentais para a pesquisa de vacinação e imunoterapia e são cada vez mais reconhecidos como modalidades diagnósticas e prognósticas em pacientes com infecções oportunistas35. Este protocolo descreve um sistema de estimulação de antígeno fácil que permite uma análise robusta e multimodal da imunidade específica do antígeno usando volumes sanguíneos mínimos (250-500 μL por antígeno). O protocolo reduzido de 250 μL produziu uma excelente correlação de frequências de células T específicas do antígeno, fenótipos e produção de citocinas quando comparado ao protocolo de 500 μL estabelecido anteriormente. Apesar da disponibilidade de soluções de pequeno volume para algumas etapas do processamento de amostras36, até onde os autores sabem, nenhum sistema comercial atualmente disponível pode suportar de forma confiável a estimulação de antígenos e a análise funcional multifacetada de respostas imunes funcionais orientadas por células T por citometria de fluxo, ensaios de liberação de citocinas e transcriptômica de volumes sanguíneos de 250-500 μL. O sistema comercial mais amplamente utilizado que facilita um espectro semelhante de aplicações de pesquisa usa um volume de sangue de 1 mL em um ambiente de estimulação de 3 mL, resultando em custo e quantidades consideravelmente maiores de antígenos necessários em comparação com o protocolo aqui apresentado 13,14,15.
Apesar da otimização contínua de protocolos baseados em sangue total para quantificação por citometria de fluxo de células T específicas do antígeno 6,37,38, as medições de citometria de fluxo têm várias desvantagens. Em particular, eles permanecem trabalhosos por natureza e são difíceis de padronizar devido à considerável variabilidade entre operadores (por exemplo, o processo subjetivo de gating) e diferentes configurações de equipamentos, protocolos de compensação e parâmetros de aquisição entre laboratórios. Embora os relatórios padronizados39 e o uso de software automatizado de análise e gating possam melhorar a padronização e a comparabilidade de conjuntos de dados multicoloridos cada vez mais complexos40,41, o protocolo de estimulação descrito aqui foi projetado para acomodar várias modalidades de leitura não citométrica de fluxo.
Em particular, os ensaios de liberação de citocinas podem ser realizados com pouco tempo de trabalho e equipamentos relativamente baratos, e muitas vezes são prontamente padronizados para aplicações clínicas de rotina. Além disso, como mostrado em estudos anteriores usando este protocolo, uma infinidade de respostas de citocinas pode ser medida a partir de volumes mínimos de amostra com ensaios multiplexados modernos, permitindo assim o perfil de assinaturas complexas de citocinas em ambientes de pesquisa24 , 42 . É importante notar que este protocolo robusto com dupla co-estimulação facilita a quantificação confiável das respostas de citocinas específicas do antígeno em pacientes não linfopenicos (>800 linfócitos/μL de sangue), mesmo naqueles que recebem imunossupressão iatrogênica26,34. Como desvantagem dos ensaios de liberação de citocinas, especialmente em pacientes com leucopenia, as citocinas secretadas não podem ser rastreadas para populações de células individuais. Em alguns casos, isso pode ser atenuado pelo uso de estímulos específicos da célula, se disponíveis. No entanto, pode ser necessária uma combinação de concentrações de citocinas com outras modalidades de leitura e/ou ajuste das respostas de citocinas com base na hematologia clínica (ou seja, hemograma completo com diferenciação de leucócitos). Notavelmente, o protocolo apresentado aqui permite uma combinação de leituras de citocinas e assinaturas transcricionais da mesma amostra, permitindo assim a análise concordante de marcadores de ativação transcricional bem definidos que podem adicionar contexto celular e especificidade às assinaturas globais de citocinas.
Um passo futuro em direção à padronização completa e uma praticidade clínica ainda melhor seria a automação total desses ensaios, desde o processamento da amostra até a leitura do analito. Embora o isolamento automatizado preciso de populações de células individuais tenha sido estabelecido com sucesso43,44, a análise de células T específicas do antígeno ainda requer que o pessoal do laboratório tome medidas intermitentes de manuseio. No entanto, a omissão do isolamento celular e manuseio de PBMC vulnerável e o uso de tubos de estimulação comerciais compatíveis com automação podem facilitar a implementação de fluxos de trabalho simples e totalmente automatizados baseados em sangue total para imunoensaios funcionais.
Ao todo, protocolos versáteis baseados em sangue total, como o aqui apresentado, são uma promessa significativa para expandir as aplicações de imunoensaios funcionais específicos de antígenos para novas coortes de pacientes e campos de pesquisa, incluindo estudos pré-clínicos em pequenos animais. Os imunoensaios funcionais específicos do antígeno são atualmente amplamente inviáveis em modelos murinos ou requerem o acúmulo de sangue de vários animais e/ou o uso de extratos celulares não padronizados, como esplenócitos. Dado o interesse emergente em intervenções imunoterapêuticas para aumentar a defesa do hospedeiro contra infecções oportunistas (por exemplo, inibidores de checkpoint imunológico, fatores de crescimento hematopoiético, citocinas, etc.) e o aumento de tecnologias inovadoras de vacinação, espera-se que os imunoensaios funcionais específicos do antígeno desempenhem um papel crescente na pesquisa pré-clínica de doenças infecciosas e aplicações clínicas em diversas populações de pacientes. O sistema de estimulação de antígenos robusto, barato, fácil de usar e de baixo volume apresentado aqui pode facilitar análises imunológicas abrangentes específicas de antígenos em áreas inexploradas. Além disso, a robustez pré-analítica desse protocolo fácil pode criar oportunidades para uma melhor incorporação de aplicações de imunoensaio na rotina clínica, permitindo-nos dar um passo mais perto do gerenciamento personalizado e orientado por biomarcadores de doenças infecciosas.
Divulgações
Não existem conflitos de interesses a serem divulgados pelos autores.
Agradecimentos
Agradecemos às divisões de química clínica e sorologia de infecção do Instituto de Medicina Laboratorial e Microbiologia do Hospital Universitário de Augsburg, por realizar medições de anticorpos séricos. Agradecemos à Dra. Friederike Liesche-Starnecker e ao Instituto de Patologia e Diagnóstico Molecular do Hospital Universitário de Augsburg por fornecer instalações de transcriptômica. Agradecemos a Marie Freitag, do Hospital Universitário de Augsburg, por fornecer suporte na logística da vacina e na aquisição de amostras. Agradecemos ao Dr. Olaf Kniemeyer e ao Instituto Hans-Knoell em Jena, Alemanha, por fornecer lisado de Aspergillus fumigatus . A iniciativa de pesquisa Bay-VOC (número de financiamento GE2-2452-200-D37666/2022), o Ministério da Ciência e Arte do Estado da Baviera, bem como a Universidade de Augsburg, Alemanha, apoiaram este trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
Referências
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados