Method Article
Анализ цельной крови с двойной костимуляцией для антиген-специфического анализа иммунитета хозяина к грибковым и вирусным патогенам
* Эти авторы внесли равный вклад
В этой статье
Резюме
Иммунологические анализы на основе цельной крови представляют собой простой и ресурсоэффективный инструмент для анализа антиген-специфического иммунитета в диагностических и исследовательских целях. В этой статье представлен оптимизированный протокол на основе цельной крови с двойной костимуляцией для всестороннего анализа иммунитета хозяина к грибковым и вирусным патогенам, включая версию с малым объемом для педиатрических пациентов и мелких животных.
Аннотация
Быстрая и ресурсоэффективная обработка образцов, высокая производительность и высокая надежность имеют решающее значение для эффективного научного и клинического применения передовых антиген-специфических иммунологических анализов. Традиционно такие иммунологические анализы, особенно антиген-специфический Т-клеточный анализ методом проточной цитометрии или иммуноферментного точечного анализа, часто основываются на выделении мононуклеарных клеток периферической крови. Этот процесс занимает много времени, подвержен влиянию многих преаналитических факторов и требует больших объемов крови. Анализы на основе цельной крови представляют собой легкую альтернативу с повышенной преданалитической надежностью и более низкими требованиями к объему крови. Кроме того, анализы на основе цельной крови позволяют сохранить межклеточные взаимодействия, которые не регистрируются анализами с использованием изолированных подмножеств клеток. Недавно был предложен усовершенствованный иммуноферментный анализ цельной крови с двойной костимуляцией анти-CD28 и анти-CD49d для всестороннего анализа как антиген-специфических Т-клеточных функций, так и сложных межклеточных взаимодействий в ответ на различные грибковые и вирусные антигены. Этот протокол содержит рекомендации по подготовке стимулирующих пробирок, стимуляции крови и последующей обработке образцов для проточной цитометрии, анализа секреции цитокинов и транскрипционного анализа. Это включает в себя валидированный и функционально эквивалентный, ранее не публиковавшийся, протокол малого объема (250 мкл), чтобы сделать проточный цитометрический и цитокиновый мониторинг Т-клеток более доступным для исследований у педиатрических пациентов или доклинических исследований на мелких животных (например, мышей). В целом, эти протоколы представляют собой универсальный набор инструментов для комплексного антиген-специфического иммуноанализа как в клинических, так и в трансляционных исследованиях.
Введение
Количественная оценка и характеристика антиген-специфического иммунитета, особенно специфических Т-клеточных реакций, имеет решающее значение для исследований в области иммунобиологии и вакцинации, а также некоторых диагностических тестов. Традиционно, антиген-специфические иммунологические анализы обычно основывались на выделенных мононуклеарных клетках периферической крови (PBMC). Однако выделение этих клеток является трудоемким и ресурсоемким процессом и часто требует относительно больших объемов крови. Кроме того, для предотвращения активации гранулоцитов и последующего нарушения Т-клеток во время преаналитическогохранения1 первостепенное значение имеет быстрая обработка образцов, что часто неосуществимо в клинической практике. Эти ограничения затрудняют практическую применимость антиген-специфических иммунологических анализов в сценариях высокопроизводительных исследований и клинических процедурах. Таким образом, разработка простых в использовании и потенциально автоматизируемых подходов на основе цельной крови в последние годы открыла новые области применения иммунологического анализа. Тем не менее, в настоящее время коммерчески доступные системы обычно не имеют оптимальных костимулирующих сред для Т-клеток и подвержены преданалитическим задержкам. Например, широко используемый анализ высвобождения ИФН-γ на основе цельной крови имеет 19% положительный или отрицательный коэффициент реверсии после 6 часов предварительного аналитического хранения крови. Для преодоления этих ограничений были разработаны оптимизированные протоколы с двойной костимуляцией анти-CD28 и анти-CD49d 3,4,5,6.
Представленный здесь протокол позволяет провести точную и воспроизводимую количественную оценку и характеристику антиген-специфических Т-клеток, оценить антиген-индуцированные цитокиновые ответы и другие (проточные цитометрические или транскрипционные) функциональные иммунные маркеры из минимального объема крови, т.е. 500 мкл крови на стимулирующую пробирку. К другим преимуществам этого протокола относятся низкое время работы, высокая устойчивость к преаналитическим искажающим факторам и сохранение функциональных межклеточных взаимодействий в относительно физиологической среде ex vivo . Сопоставимость характеристик проточных цитометрических антиген-специфических Т-клеток на основе цельной крови с данными, полученными в результате традиционных анализов на основе PBMC, была ранее продемонстрирована в контексте количественного определения Т-клеток, специфичных дляплесени 6. Кроме того, прямая стимуляция крови испытуемых устраняет необходимость в добавках аутологичной, аллогенной или даже ксеногенной сыворотки, которая обычно требуется для оптимальной стимуляции PBMC. Отсутствие изоляции клеток также снижает сдвиговый и температурный стресс, тем самым улучшая жизнеспособность клеток. Самое главное, что анализы на основе цельной крови сохраняют популяции гранулоцитов, которые теряются во время градиентного центрифугирования для выделения PBMC7. Таким образом, эта установка для анализа сохраняет и захватывает функциональные петли взаимодействия между гранулоцитами и мононуклеарными клетками4.
Следует отметить, что этот протокол требует лишь минимальных модификаций для адаптации к различным методам считывания и даже позволяет проводить двойной анализ высвобождения цитокинов и транскрипционных реакций из одной и той же стимулирующей трубки. В частности, в то время как цитокины анализируются из надосадочной жидкости культуры после стимуляции, клеточная гранула может быть использована для выделения РНК с последующим транскриптомным анализом. Общий рабочий процесс для различных модальностей считывания представлен на рисунке 1.
В последние годы все большее число анализов на основе цельной крови разрабатывается для патогенно-реактивного иммунного мониторинга в научных и клинических условиях, например, на Mycobacterium tuberculosis 8,9, Bordetella pertussis3, Orientia tsutsugamushi10 и SARS-CoV-2 5,11,12. Например, ранее созданная система использовалась для нескольких антигенов, включая M. tuberculosis, вирус гриппа А и SARS-CoV-2, но не использовала костимулирующие факторы, оптимизированные для стимуляции Т-хелперных (Th) клеток 13,14,15. Несмотря на то, что объем крови, необходимый для этих анализов, уже значительно ниже, чем объем крови, используемый для традиционных анализов на основе PBMC или коммерчески доступных наборов для стимуляции цельной крови, еще меньший объем образца может быть оправдан для применения в педиатрии, неонатологии, у пациентов в отделении интенсивной терапии (ОИТ) и доклинических исследованиях на моделях мелких животных. Например, даже терминальный забор крови у мышей (например, с помощью пункции сердца) обычно дает максимум 0,7-1 мл крови. Таким образом, в рамках данного протокола была оценена возможность дальнейшего сокращения ранее установленных протоколов иммуноанализа на основе цельной крови 4,6 для точной количественной оценки и характеристики антиген-реактивных Т-клеточных ответов из 250 мкл объема крови на стимулирующую пробирку.
протокол
Совет по этике Мюнхенского университета имени Людвига-Максимилиана (проект No 21-0689) одобрил сбор образцов крови человека. Кроме того, часть репрезентативных наборов данных была сгенерирована в рамках исследования Corona-Register-Study No 20-426, также одобренного комитетом по этике Мюнхенского университета имени Людвига-Максимилиана. Было получено информированное согласие.
1. Подготовка пробирок для стимуляции цельной кровью
ПРИМЕЧАНИЕ: Этот шаг адаптирован из Lauruschkat et al.4 и Weis et al.6. В таблице 1 приведены подробные концентрации и объемы реагентов.
- В стерильных условиях (стерильный верстак) подготовить пробирки для забора крови объемом 2,7 мл без антикоагулянта, с антигенами и костимулирующими антителами. Добавьте 1 мкг/мл α-CD28 и 1 мкг/мл α-CD49d в каждую пробирку, включая отрицательный контроль. При определении конечных концентраций учитывайте объем крови, который необходимо добавить для стимуляции цельной кровью (250 μл или 500 μл). Для сохранения геометрии камеры и доступности образца не втягивайте поршень из пробирки для сбора крови.
- Исходя из плана исследования, определить, должны ли пробирки отрицательного контроля либо не содержать дополнительных стимулов (нестимулированный фоновый контроль, как показано в таблице 1), либо использовать антигены, к которым исследуемая когорта не должна содержать или содержать минимальное количество антиген-специфических Т-клеток (например, пул пептидов ВИЧ у ВИЧ-серонегативных лиц 16).
- Для антиген-специфической стимуляции оптимизируйте идеальные концентрации антигенов путем титрования в предварительных экспериментах. Для получения репрезентативных данных ниже используйте следующие оптимизированные концентрации антигенов: 1,2 мкг/мл лизата ВПГ-1, 0,6 нМ/пептид/мл ЦМВ pp65, 0,6 нМ/пептид/мл SARS-CoV-2 Prot_S, 50 мкг/мл лизата Aspergillus fumigatus и 1 нг/мл CRX-527.
- Включайте положительный контроль, особенно для исследований у пациентов с лимфопенией или тех, кто получает иммуносупрессивную фармакотерапию. Используйте положительный контрольный раствор CPI (0,6 нМоль/пептид/мл), состоящий из пептидов цитомегаловируса, вируса парагриппа и вируса гриппа.
Примечание: В качестве альтернативы можно использовать синтетические стимулы, такие как PMA (10 мкг/мл) ± иономицин (1 мкг/мл), но они вызывают менее физиологические реакции и могут влиять на экспрессию поверхностных антигенов, обычно используемых в качестве популяционных маркеров для проточной цитометрии (в частности, CD417). Следует отметить, что костимулирующие антитела не требуются в сочетании с большинством синтетических положительных контрольных стимулов и могут даже негативно влиять на жизнеспособность и реакцию клеток. - Для гармонизации объемов реагентов по всем стимулирующим пробиркам добавьте среду RPMI 1640 до следующих общих объемов: Полномасштабный анализ для проточной цитометрии: 50 μл; Полномасштабный анализ цитокинов и транскриптомики: 500 μл; Мелкомасштабный анализ для проточной цитометрии: 25 μл; Мелкомасштабный анализ цитокинов и транскриптомики: 250 μл.
ПРИМЕЧАНИЕ: Для приготовления нескольких наборов стимулирующих трубок рекомендуется готовить мастер-смеси, включающие все ингредиенты, из-за более низкого риска загрязнения и малого объема костимулирующих факторов и стимулов. - Готовые пробирки используйте сразу или криоконсервируйте при температуре -20 °C. Большинство реагентов могут храниться до 4 недель; Тем не менее, предварительно проверьте максимальные сроки хранения новых реагентов/стимулов.
2. Стимуляция и инкубация образцов цельной крови
- Примерно за 30-60 минут до стимуляции цельной кровью разморозьте готовые к использованию пробирки для стимуляции и держите их при комнатной температуре.
- Забор венозной крови у донора/пациента осуществляется с помощью пробирок для забора крови с литий-гепариновым антикоагулянтом. Убедитесь, что собранный объем крови соответствует индивидуальным требованиям эксперимента, т.е. требуется минимум 750 мкл для 3 условий мелкомасштабного анализа, включая отрицательный и положительный контроль. Для коммерчески приобретенных пробирок для сбора крови полностью заполните их для достижения рабочих концентраций гепарина 16 - 25 МЕ/мл крови.
Примечание: Демографические данные здоровых взрослых субъектов, набранных для создания репрезентативных наборов данных, показаны в таблице 2. - Переложите необходимое количество гепаринизированной цельной крови (250 мкл или 500 мкл для мелкого или полномасштабного анализа соответственно) в пробирки для стимуляции путем пипетирования под стерильным верстаком.
ПРИМЕЧАНИЕ: Если стерильный верстак недоступен или при работе с образцами с минимальным риском инфицирования (т.е. кровью предварительно обследованных людей или животных), образцы могут быть перенесены в пробирки для стимуляции с помощью стерильных шприцев. Этот метод также позволяет обрабатывать образцы у постели больного сразу после забора крови, что сводит к минимуму преаналитическое хранение и повреждение Т-клеток. Перед введением крови тщательно продезинфицируйте резиновые уплотнители как пробирки для забора крови, так и всех пробирок для стимуляции спиртовым дезинфицирующим средством. Дайте дезинфицирующему средству высохнуть не менее 1 минуты. - Осторожно переверните стимулирующие трубки в 5-10 раз. Поместите стимулирующие трубки в инкубатор с температурой 37 °C. Обратите внимание, что инкубатор CO2 не требуется. Чтобы предотвратить неспецифическую активацию нейтрофилов, не охлаждайте пробирку для сбора крови.
ПРИМЕЧАНИЕ: Этот протокол был валидирован для предварительного аналитического хранения крови в течение 8 часов при комнатной температуре для транспортировки образца. Если это возможно, предпочтительно вводить цельную кровь в стимулирующие пробирки в месте сбора и транспортировать кровь в центральную лабораторию по стимулирующим пробиркам, так как сопутствующие факторы улучшают жизнеспособность лимфоцитов18,19. - Только для образцов, используемых для проточных цитометрических анализов с внутриклеточным окрашиванием, добавляйте брефельдин А (конечная концентрация 10 мкг/мл) в каждую стимулирующую пробирку после 4 ч инкубации.
- Приготовьте раствор брефельдина А в дозе 1 мг/мл в RPMI и добавьте 1 мкл раствора на 100 мкл образца (т.е. предварительно смешанный коктейль для стимуляции + объем цельной крови). Добавьте брефелдин А, открыв пробирки и проведя пипетирование под стерильным верстаком. Закупорка и возврат трубок в инкубатор при температуре 37 °C еще на 16-18 ч при 37 °C (всего 20-22 ч).
- Для анализа секреции цитокинов или транскрипционного анализа не добавляйте брефельдин А и непрерывно инкубируйте образцы при 37 °C в течение 24-26 часов.
Брефельдин А ингибирует аппарат Гольджи и тем самым отменяет секрецию цитокинов и транспорт белков к поверхности клетки. Поскольку секреция или поверхностная экспрессия в конечном итоге приводят к потере белка и деградации после реинтернализации, соответственно, ингибиторы экзоцитоза необходимы для внутриклеточного накопления и окрашивания цитокинов и некоторых маркеров активации (например, CD154) для исследований проточной цитометрии. Тем не менее, брефельдин А также нарушает физиологические клеточные процессы, видимые в транскриптоме, и делает недействительными анализы секреции цитокинов из супернатантовкультур 20,21, что требует использования двух отдельных пробирок (одной с брефельдином А и одной без него) для параллельного выполнения этих показаний.
3. Подготовка образцов для проточной цитометрии
- Добавьте 500 мкл 0,5 М раствора ЭДТА в каждую стимулирующую пробирку и инкубируйте образец в течение 15 минут при комнатной температуре, чтобы отделить адгезивные клетки от поверхности пробирок.
- Переложите образцы в новые центрифужные пробирки объемом 15 мл. Промойте стимулирующие пробирки 1 мл буфера для лизиса эритроцитов, чтобы собрать оставшиеся клетки крови, затем добавьте буфер и клетки в те же 15 мл центрифужных пробирок.
- Центрифугируйте пробирки объемом 15 мл в течение 7 мин при 600 x g. Аккуратно выбросьте надосадочную жидкость.
- Ресуспендируйте гранулу клетки крови в буфере для лизиса эритроцитов (рис. 2A). Используйте 5 мл буфера для лизиса эритроцитов на 500 мкл цельной крови и 3 мл на 250 мкл цельной крови.
ПРИМЕЧАНИЕ: Оптимальные условия лизиса эритроцитов должны быть предварительно оценены для конкретного используемого буфера (собственного производства или коммерческого продукта). Приведенные здесь инструкции были оптимизированы для буфера для лизиса эритроцитов, указанного в таблице материалов. - Инкубируйте образцы при комнатной температуре, пока образцы не станут прозрачными (рисунок 2B). Для предотвращения лизиса и агрегации гранулоцитов не следует проводить инкубацию более 6 минут. Показателем успешного лизиса эритроцитов является способность видеть цифры и масштаб на пробирке объемом 15 мл через жидкость (рис. 2C).
- Центрифугируйте пробирки объемом 15 мл в течение 7 мин при 600 x g. Аккуратно выбросьте надосадочную жидкость, повторите шаги 3.4-3.5, если клеточная гранула все еще заметно красная.
- Повторно суспендируйте клеточную гранулу в 1 мл HBSS и перенесите клетки в реакционные пробирки объемом 2 мл.
- Центрифугируйте пробирки объемом 2 мл в течение 5 минут при давлении 400 x g. Аккуратно выбросьте надосадочную жидкость.
- Проводите проточное цитометрическое окрашивание в соответствии с инструкциями производителя для набора для внутриклеточного окрашивания и используемых антител.
ПРИМЕЧАНИЕ: Панель антител, используемая для создания репрезентативного набора данных, обобщена в таблице 3.
4. Подготовка образцов для анализа цитокинов
- После шага 2.6 переведите разбавленную кровь из стимулирующих пробирок в пробирки объемом 1,5 мл.
- Центрифугируйте пробирки объемом 1,5 мл в течение 20 мин при 2000 x g. Осторожно пипетируйте надосадочную жидкость в свежую пробирку объемом 1,5 мл и используйте ее либо сразу для анализа цитокинов, либо криоконсервируйте надосадочную жидкость при температуре -80 °C.
- Снова центрифугируйте надосадочную жидкость в течение 5 мин при ≥ 7000 x g (в пробирках объемом 1,5 мл) для удаления остаточного клеточного мусора перед анализом, особенно после размораживания. В зависимости от протокола анализа цитокинов, проводят предварительное разведение образцов.
- Ресуспендируйте клеточную таблетку в 1 мл буфера защиты РНК и криоконсервируйте ее при -80 °C для последующего выделения РНК. В качестве альтернативы можно повторно суспендировать клеточную гранулу в буфере для лизиса для немедленного выделения РНК в соответствии с инструкциями к набору для выделения РНК (или внутренним протоколом).
ПРИМЕЧАНИЕ: При необходимости, в зависимости от последующего протокола процессинга РНК, перед добавлением буфера защиты РНК может быть добавлена стадия лизиса эритроцитов, аналогичная 3,4-3,5.
Результаты
Мультимодальный анализ антиген-специфических иммунных реакций после стимуляции цельной крови патоген-ассоциированными антигенами
Для создания репрезентативного набора данных был выбран здоровый взрослый донор, серопозитивный на ВПГ-1 и ЦМВ, получивший вакцинацию против SARS-CoV-2. В дополнение к нестимулированному контролю, были использованы следующие стимулы, как описано выше: лизат вируса простого герпеса 1 (ВПГ) (рекомендация производителя, неопубликованные данные), цитомегаловирус (ЦМВ) pp6522, коронавирус тяжелого острого респираторного синдрома 2 (SARS-CoV-2) Prot_S 5,23, лизат Aspergillus fumigatus (повсеместно распространенный возбудитель окружающей среды)4,24CRX-527 (стимул Toll-подобного рецептора 4 на основе липополисахарида, который сам по себе не должен активировать Т-клетки)25, и CPI (положительный контроль активации CD4+ Т-клеток, состоящий из пептидов ЦМВ, вируса парагриппа и вируса гриппа)26. Данные проточной цитометрии и стратегия гейтирования показаны на рисунке 3. Как правило, рекомендуется измерять как можно больше лимфоцитов при нацеливании на популяции редких клеток (50 000 - 100 000 лимфоцитов), поскольку точность и надежность измерений зависят от общего числа событий. Нестимулированный образец используется для гейтирования отдельных субпопуляций клеток (например, клеток CD3+CD4+). Вентили для CD45RO и CCR7 для фенотипирования Т-клеток памяти должны быть установлены на общую популяцию CD3+CD4+, а затем перенесены на активационно-маркерные популяции, поскольку низкое количество событий на последних часто препятствует четкой идентификации отдельных популяций. Для отдельных ворот может потребоваться незначительная коррекция, например, для учета различий в жизнеспособности лимфоцитов. Активация CD154 (или лиганда CD40) была описана как глобальный, последовательный и быстро индуцированный маркер активации Т-хелперных клеток28,29. ИФН-γ считается одним из наиболее заметных и специфичных для 1-го типа маркеров активации Т-клеток30,31. Важно отметить, что этот анализ был протестирован и опубликован с различными маркерами дополнительной активации, истощения и цитокинов (см. Таблицу 4 и24).
Частоты активационно-маркер-положительных популяций в нестимулированной выборке представляют собой неспецифический фон и были вычтены из частот, стимулированных антигеном. После вычитания неспецифического фона у репрезентативного донора было 0,75% (ВПГ), 0,09% (ЦМВ), 0,06% (SARS-CoV-2), 0,34% (A. fumigatus), 0,00% (CRX-527) и 1,21% (CPI) специфических CD154+/CD3+CD4+ Т-хелперов соответственно. Экспрессия ИФН-γ может быть проанализирована аналогичным образом, в результате чего образуется 0,12% (ВПГ), 0,07% (ЦМВ), 0,03% (SARS-CoV-2), 0,04% (A. fumigatus), 0% (CRX-527) и 0,74% (CPI) клеток ИФН-γ+/CD3+CD4+ .
Популяции Т-клеток можно далее подразделить на наивные Т-клетки (TN, CD45RO-CCR7+), Т-клетки центральной памяти (TCM, CD45RO+CCR7+), эффекторные Т-клетки памяти (TEM, CD45RO+CCR7-) и эффекторные Т-клетки (а также эффекторные Т-клетки памяти, реэкспрессирующие CD45RA, TE/TEMRA, CD45RO-CCR7-). Среди глобальных CD3+CD4+ Т-клеток репрезентативный донор имел 38,34% TN, 38,33% TCM, 20,77% TEM и 2,56% TE/TEMRA соответственно, что было определено с использованием нестимулированной выборки (рис. 3A). Тем не менее, среди антиген-специфических реактивных Т-хелперов (CD154+IFN-γ+) TCM и TEM были наиболее заметными субпопуляциями, со средними значениями 22,14% и 73,97% соответственно.
Данные о дополнительных популяциях лейкоцитов были ранее опубликованы с использованием данной методики24. Используемые комбинации антител представлены в таблице 4 для дальнейшего ознакомления.
Кроме того, чтобы продемонстрировать весь потенциал этой методологии, был проведен ИФА-γ ИФА на втором наборе стимулированных образцов (без добавления брефельдина А). Для предотвращения превышения дальности обнаружения набора ИФН-γ ИФА плазму из образцов, стимулированных CPI, предварительно разбавляли в соотношении 1:4. Были измерены и нормализованы следующие концентрации ИФН-γ на мл объема крови субъекта, т.е. скорректированы на разведение как в пробирках для стимуляции, так и в разведениях до ИФА: 0 пг/мл (без стимуляции), 69,4 пг/мл (ВПГ), 471 пг/мл (ЦМВ), 17,8 пг/мл (SARS-CoV-2), 61,9 пг/мл (A. fumigatus), 34,0 пг/мл (CRX-527) и 1958 пг/мл (CPI).
Наконец, РНК была выделена из одних и тех же образцов с одинаковыми результатами. Средний выход составил 719 нг, а средний коэффициент поглощения 260 нм/280 нм составил 1,98.
В целом, этот набор данных показывает, что представленный протокол позволяет проводить многогранный спектр считывания и сопутствующий анализ различных инфекций-ассоциированных антигенов с использованием минимального объема крови, т.е. 8 мл в сумме для множественных стимулов и методов считывания.
Репрезентативный набор данных для транскрипционного анализа для отслеживания ответа на вакцинацию с использованием цельной крови, стимулированной антигеном
В качестве доказательства принципа транскрипционных исследований, проведенных на цельной крови, стимулированной антигенами, кровь была собрана у 9 здоровых взрослых субъектов непосредственно до и через 1 месяц после первой бустерной вакцинации BNT162b2 (мРНК-вакцина против SARS-CoV-2)32,33 через 7-9 месяцев после первоначальной серии двухдозовой вакцины. Средний выход РНК из 500 мкл нестимулированной и стимулированной Prot_S цельной крови составил 1,1 мкг высокочистой РНК со средним коэффициентом поглощения 260/280 1,99. После анализа nCounter количество РНК было нормализовано по 12 домашним генам панели (среднее геометрическое). После этого для каждого субъекта и гена определяли соотношение нормализованных количеств мРНК в Prot_S-стимулированных образцах по сравнению с нестимулированным фоновым контролем. Были определены медианные и медианные отношения измерений после и до вакцинации, а также проведен анализ обогащения путей с использованием программного пакета, указанного в Таблице материалов. Обогащение канонических путей было признано значимым при абсолютном значении z-балла ≥ 1,25 и скорректированном p-значении Бенджамини-Хохберга < 0,05. Значительно отличающиеся друг от друга пути обобщения обобщены на рисунке 4A, а упрощенная сеть скорректированных на фон изменений в ответе на Prot_S после и до вакцинации показана на рисунке 4B. Кроме того, более сильная индукция репрезентативных генов, скорректированная на фон, связанная с созреванием антигенпрезентирующих клеток и индуцированной Prot_S активацией Т-клеток после бустерной вакцинации, показана на рисунке 4C (p < 0,01-0,03). Наконец, увеличение скорректированных на фон Prot_S-специфичных Т-хелперов типа 1 (CD69+ИФН-γ+) после вакцинации у большинства доноров было подтверждено с помощью проточной цитометрии с использованием второго набора стимулирующих пробирок (p = 0,03, рис. 4D).
Сравнение вирус-реактивных Т-клеточных ответов в протоколах полномасштабного и малообъемного иммуноферментного анализа на основе цельной крови
Затем сравнивали частоты вирус-реактивных CD154+IFN-γ+ Т-хелперов (CD3+CD4+ клеток) у здоровых добровольцев с использованием полномасштабных (500 μл, WB) и малых (250 μл, WBS) протоколов стимуляции антигена цельной крови (рис. 5). Как сообщалось ранее34, минимальные неспецифические фоновые частоты CD154+ИФН-γ+ клеток наблюдались при любом протоколе, несмотря на двойную костимуляцию (в среднем 0,010% и 0,011% для WB и WBS соответственно). Следует отметить, что, хотя неспецифические фоновые реакции вычитаются из антиген-специфических реакций, они все же способствуют увеличению погрешности анализа, о чем говорилось ранее27. Повышенные фоновые сигналы (т.е. >0,07-0,1% CD154+ Т-клеток или >0,05% CD154+ИФН-γ+ клеток) могут указывать на контаминацию образца, острую инфекцию субъекта или могут быть результатом ненадлежащего предварительного аналитического обращения с образцом.
Средние частоты лизат-реактивных Т-клеток ВПГ у серопозитивных доноров (n = 5) составили 0,151% и 0,107% в системах WB и WBS соответственно по сравнению с 0,012% и 0,004% у серонегативных доноров (n = 4). При пуле пептидов ЦМВ pp65 серопозитивные доноры (n = 4) имели 0,041% и 0,049% реактивных Т-клеток по сравнению с 0,001% и 0,004% у серонегативных доноров (n = 5). Коэффициенты корреляции Лина составили 0,868 для ВПГ и 0,985 для ЦМВ, что свидетельствует о сильной корреляции (рис. 5A). Примечательно, что ЦМВ-специфическое тестирование Т-клеток может быть отрицательным у здоровых серопозитивных субъектов, у которых не было недавних событий реактивации. Как общий, так и антиген-реактивный репертуар CD3+CD4+ Т-хелпертуарных клеток был дополнительно дифференцирован на основе экспрессии CCR7 и CD45RO (рис. 5B). Обнадеживает тот факт, что результаты, полученные с использованием протоколов WB и WBS, были сопоставимы как для общей, так и для антиген-реактивной популяции. Как и ожидалось, в обоих анализах доля более дифференцированных Th-клеток памяти (т.е. эффекторных клеток памяти) была выше среди антиген-реактивных Т-клеток, чем среди общей популяции Th-клеток. Как и ожидалось, только несколько наивных Т-клеток были активированы вирусными стимуляторами (рисунок 5B).
Кроме того, в другой серии экспериментов стимулированные супернатанты культур были проанализированы с помощью ИФН-γ ИФА (рис. 5C). Был замечен минимальный неспецифический фон (средние значения 1,29 пг/мл и 2,18 пг/мл в протоколах WB и WBS соответственно). Образцы крови серопозитивных доноров, инфицированных ВПГ, показали средние концентрации ИФН-γ, индуцированные ВПГ, с поправкой на фон, 111 пг/мл и 125 пг/мл в системах WB и WBS соответственно. Напротив, концентрации ИФН-γ в серонегативных образцах были постоянно ниже 10 пг/мл в обеих системах (коэффициент корреляции Лина = 0,972, рис. 5C). Аналогичным образом, стимуляция pp65 крови от серопозитивных доноров ЦМВ привела к средним концентрациям ИФН-γ 258 пг/мл и 272 пг/мл в системах WB и WBS соответственно, в то время как минимальная индуцированная pp65 секреция ИФН-γ наблюдалась в обеих системах с использованием серонегативных образцов (коэффициент корреляции Лина = 0,953, рис. 5C).
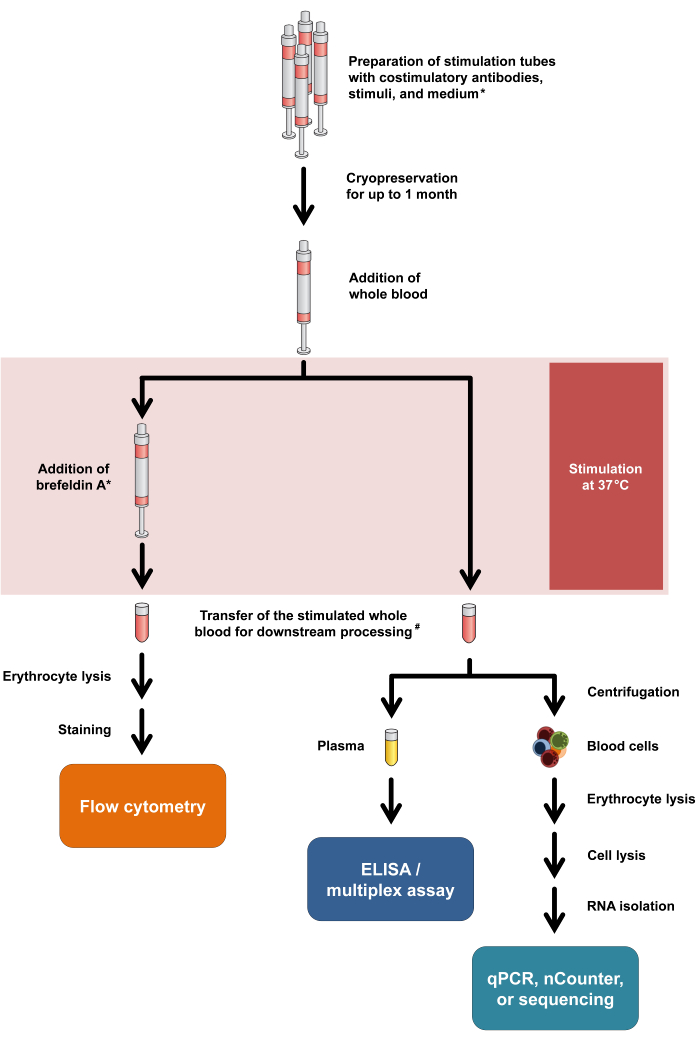
Рисунок 1: Блок-схема, обобщающая экспериментальные процедуры и показания. Звездочка означает, что Брефельдин А необходим для некоторых маркеров активации Т-клеток (например, CD154) и внутриклеточного окрашивания цитокинов. Смотрите шаги протокола 2.5 и 2.6. #: Кровь для проточной цитометрии первоначально переносится в центрифужные пробирки объемом 15 мл для лизиса эритроцитов, тогда как кровь для анализа цитокинов и транскриптомики переносится в микроцентрифужные пробирки объемом 1,5 мл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Лизис эритроцитов. После того, как стимулированная кровь была ресуспендирована в (А) буфере для лизиса эритроцитов, ее инкубируют до тех пор, пока (В) жидкость не станет прозрачной, но не дольше 6 мин. (В) При использовании пробирки объемом 15 мл ее чешуя должна стать видимой через все более прозрачный образец. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
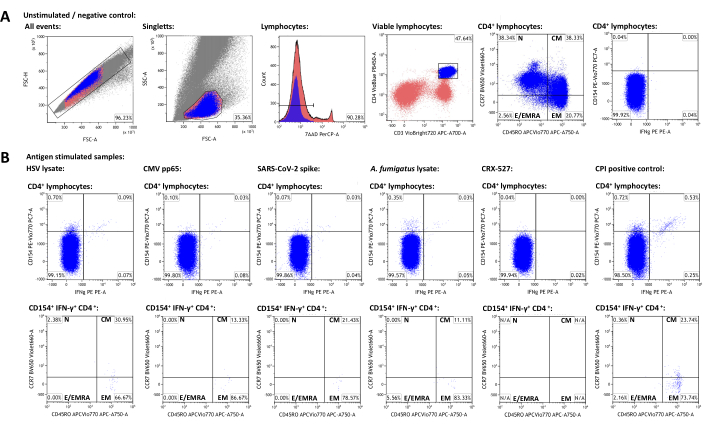
Рисунок 3: Репрезентативный набор данных и схемы проточного цитометрического гейтирования. (A) Синглетные события идентифицируются свойствами FSC-A и FSC-H. Из них лимфоциты гейтируются с помощью FSC-A и SSC-A. Лимфоциты дифференцируются в CD3+CD4+ Т-хелперы. Уровни экспрессии CD45RO и CCR7 используются для фенотипирования популяций клеток памяти и эффекторных клеток. В качестве маркеров активации использовали ИФН-γ и CD154. Гейты были установлены на основе популяции ИФН-γ-CD154- в нестимулированной выборке. Впоследствии ворота переносили на стимулированные образцы (В). Характеристика популяций памяти активированных Т-клеток была достигнута путем переноса квадрантного гейта CCR7/CD45RO из популяции CD3+CD4+ в популяцию ИФН-γ+CD154+CD3+CD4+. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
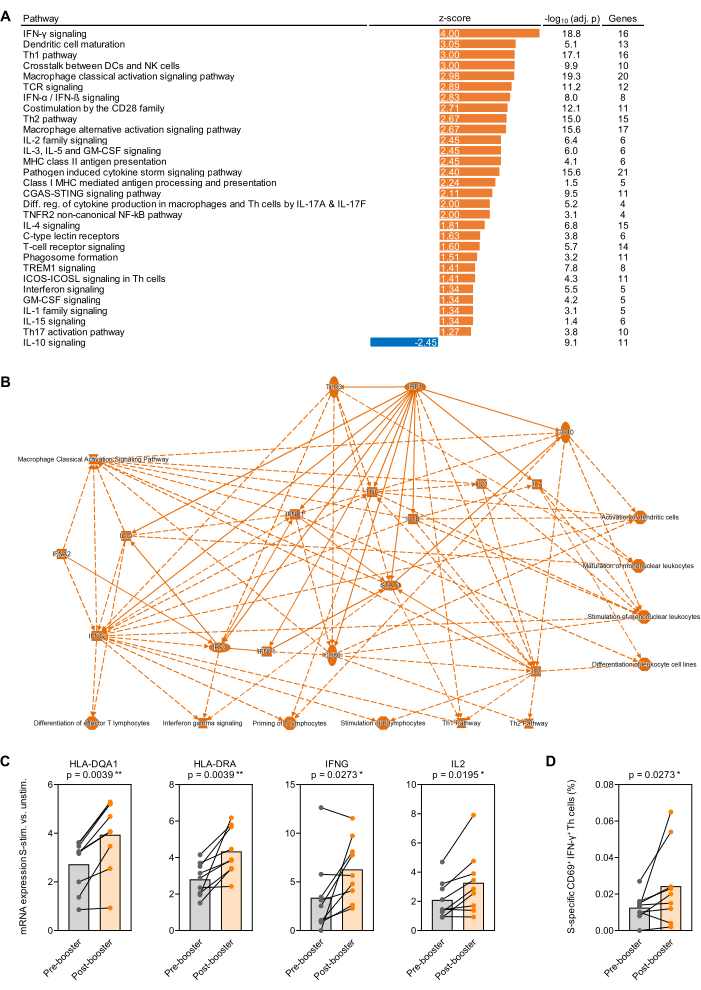
Рисунок 4: Антиген-индуцированные транскрипционные изменения после бустерной вакцинации против SARS-CoV-2. (A) У 9 здоровых взрослых субъектов проанализировано обогащение транскрипционных путей в цельной крови, стимулированной спайковым белком (Prot_S) SARS-CoV-2, по сравнению с до(первой) бустерной вакцинацией мРНК BNT162b2. Показаны иммунозависимые канонические пути с p-значением, скорректированным по шкале Беньямини-Хохберга (BH-adj.) <0,05 (-log10[BH-adj. p] >1,3) и абсолютным z-показателем >1,25. (B) Упрощенная сеть, обобщающая гены и пути, более сильно обогащенные S-стимулированной цельной кровью после бустерной вакцинации, по сравнению с до. (C) Скорректированные на фон уровни экспрессии репрезентативных генов, связанных с презентацией антигена и активацией Т-клеток в цельной крови, стимулированной Prot_S, до и после бустерной вакцинации. Парный тест Вилкоксона. (D) Скорректированные по фону частоты Prot_S-специфичных ИФН-γ+CD69+ Т-клеток до и после бустерной вакцинации. Парный тест Вилкоксона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
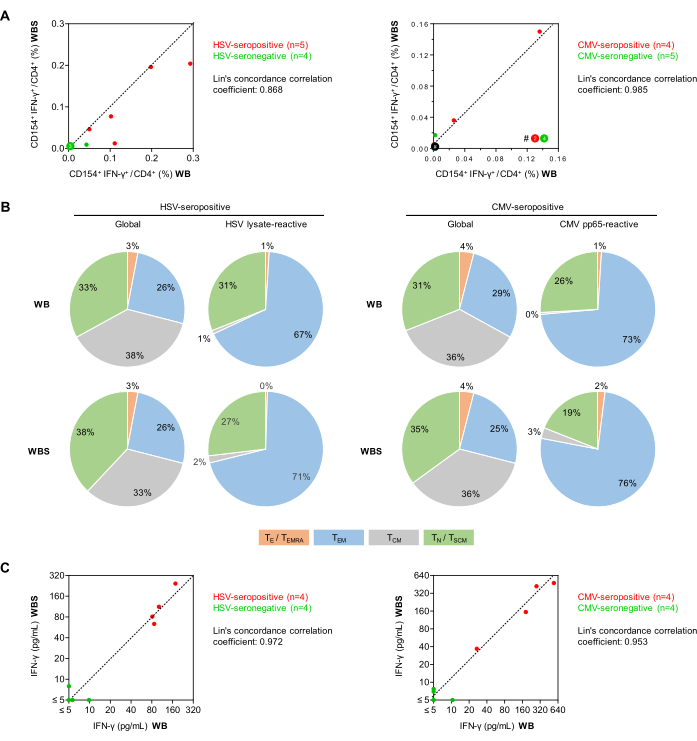
Рисунок 5: Реактивность противовирусных Т-клеток в проточной цитометрии и ИФА. (A) Показаны корреляционные графики частот CD154+IFN-γ+/CD3+CD4+ Т-клеток (проточная цитометрия) с коррекцией фона из установленных (WB) и малых (WBS) анализов цельной крови. Зелеными и красными точками обозначены субъекты, которые являются серонегативными и серопозитивными по отношению к тестируемому вирусу соответственно. (B) С помощью проточной цитометрической оценки экспрессии CD45RO и CCR7 были определены фенотипы памяти/эффекторных Т-клеток среди глобальных CD3+CD4+ Т-клеток и антиген-реактивных ИФН-γ+CD154+CD3+CD4+ Т-клеток после стимуляции лизатом ВПГ или ЦМВ pp65 с использованием крови серопозитивных доноров (n = 5 и 4 соответственно). Показаны средние распределения. Зеленый: наивные Т-клетки (TN), CD45RO-CCR7+. Серый: Т-клетки центральной памяти (TCM), CD45RO+CCR7+. Синий: эффекторные Т-клетки памяти (TEM), CD45RO+CCR7-. Оранжевый: эффекторные Т-клетки и эффекторные Т-клетки памяти, реэкспрессирующие CD45RA (TE/TEMRA), CD45RO-CCR7-. (C) Корреляционные графики фонового скорректированного высвобождения ИФН-γ (ИФА), измеренные с использованием анализов WB и WBS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Содержимое стимульной трубки. Суммируются исходные концентрации стимулов и растворителей. Полномасштабный анализ цельной крови (WB) проводится с использованием 500 μL гепаринизированной цельной крови лития, в то время как для мелкосерийного анализа (WBS) требуется всего 250 μL крови. Для WBS все объемы реагентов составляют половину от объемов WB. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Демографические данные здоровых взрослых субъектов, отобранных для создания репрезентативных наборов данных. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Репрезентативная проточная цитометрическая панель для анализа Т-клеток. Эта проточная цитометрическая панель была использована для создания репрезентативного набора данных. Результаты подробно показаны на рисунке 3. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Ранее опубликованные проточные цитометрические панели. Данные с использованием этих комбинаций антител были ранее опубликованы Tappe et al.24. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Антиген-специфические иммунологические анализы позволяют получить представление о взаимодействии хозяина и микроба, имеют решающее значение для исследований в области вакцинации и иммунотерапии и все чаще признаются в качестве диагностических и прогностических методов у пациентов с оппортунистическимиинфекциями. Этот протокол описывает легкую систему стимуляции антигена, которая позволяет проводить надежный и мультимодальный анализ антиген-специфического иммунитета с использованием минимальных объемов крови (250-500 мкл на антиген). Уменьшенный протокол объемом 250 мкл показал отличную корреляцию частот антиген-специфических Т-клеток, фенотипов и продукции цитокинов по сравнению с ранее установленным протоколом 500 мкл. Несмотря на наличие небольших растворов для некоторых этапов обработкиобразцов36, насколько известно авторам, ни одна из доступных в настоящее время коммерческих систем не может надежно поддерживать стимуляцию антигенов и многогранный функциональный анализ функциональных иммунных реакций, вызванных Т-клетками, с помощью проточной цитометрии, анализов высвобождения цитокинов и транскриптомики из объемов крови объемом 250-500 мкл. Наиболее широко используемая коммерческая система, способствующая аналогичному спектру исследовательских приложений, использует объем крови объемом 1 мл в среде стимуляции объемом 3 мл, что приводит к значительно более высокой стоимости и необходимому количеству антигенов по сравнению с протоколом, представленным здесь 13,14,15.
Несмотря на постоянную оптимизацию протоколов на основе цельной крови для количественного определения антиген-специфических Т-клеток 6,37,38, проточные цитометрические измерения имеют ряд недостатков. В частности, они остаются трудоемкими по своей природе и затрудняются стандартизацией из-за значительной межоператорской вариативности (например, субъективного процесса литникового состава) и различных настроек оборудования, компенсационных протоколов и параметров сбора данных между лабораториями. Несмотря на то, что стандартизированная отчетность39 и использование программного обеспечения для автоматизированного анализа и стробирования могут улучшить стандартизацию и сопоставимость все более сложных многоцветных наборов данных40,41, описанный здесь протокол стимуляции был разработан с учетом различных методов непроточного цитометрического считывания.
В частности, анализы высвобождения цитокинов могут быть выполнены с использованием небольшого времени работы и относительно недорогого оборудования, и они часто легко стандартизируются для рутинного клинического применения. Более того, как было показано в предыдущих исследованиях с использованием этого протокола, множество цитокиновых реакций может быть измерено из минимальных объемов образцов с помощью современных мультиплексных анализов, что позволяет профилировать сложные сигнатуры цитокинов в условиях исследования24,42. Следует отметить, что этот надежный протокол с двойной костимуляцией способствует надежной количественной оценке антиген-специфических цитокиновых ответов у пациентов без лимфопения (>800 лимфоцитов/мкл крови), даже у тех, кто получал ятрогенную иммуносупрессию26,34. Недостатком анализов на высвобождение цитокинов, особенно у пациентов с лейкопенией, является то, что секретируемые цитокины не могут быть прослежены до отдельных клеточных популяций. В некоторых случаях это может быть смягчено использованием клеточно-специфических стимулов, если таковые имеются. Тем не менее, может потребоваться комбинация концентраций цитокинов с другими методами считывания и/или коррекция цитокиновых реакций на основе клинической гематологии (т.е. общий анализ крови с дифференцировкой лейкоцитов). Примечательно, что представленный здесь протокол позволяет комбинировать считывание цитокинов и транскрипционных сигнатур из одного и того же образца, тем самым позволяя проводить согласованный анализ четко определенных маркеров активации транскрипции, которые могут добавить клеточный контекст и специфичность к глобальным сигнатурам цитокинов.
Будущим шагом на пути к полной стандартизации и еще большей клинической осуществимости может стать полная автоматизация этих анализов от обработки образца до считывания аналита. Несмотря на то, что было успешно установлено точное автоматизированное выделение отдельных клеточных популяций43,44, анализ антиген-специфических Т-клеток по-прежнему требует от лабораторного персонала периодических действий по обработке. Тем не менее, отказ от выделения клеток и обработки уязвимых PBMC, а также использование коммерческих, совместимых с автоматизацией стимулирующих трубок может способствовать внедрению простых, полностью автоматизированных рабочих процессов на основе цельной крови для функционального иммунологического анализа.
В целом, универсальные протоколы на основе цельной крови, подобные представленному в настоящем документе, имеют значительные перспективы для расширения применения антиген-специфических функциональных иммунологических анализов для новых когорт пациентов и областей исследований, включая доклинические исследования на мелких животных. Антиген-специфические функциональные иммунологические анализы в настоящее время в значительной степени невозможны на мышиных моделях или требуют объединения крови нескольких животных и/или использования нестандартизированных клеточных экстрактов, таких как спленоциты. Учитывая растущий интерес к иммунотерапевтическим вмешательствам для повышения защиты организма от оппортунистических инфекций (например, ингибиторы контрольных точек иммунного ответа, факторы роста кроветворения, цитокины и т. д.) и всплеск инновационных технологий вакцинации, ожидается, что антиген-специфические функциональные иммунологические анализы будут играть все большую роль как в доклинических исследованиях инфекционных заболеваний, так и в клиническом применении в различных популяциях пациентов. Представленная здесь надежная, недорогая, простая в использовании система стимуляции антигенов в небольших объемах может облегчить проведение комплексного антиген-специфического иммуноанализа в неиспользованных областях. Более того, преаналитическая надежность этого легкого протокола может создать возможности для более эффективного внедрения иммунологических тестовых приложений в клиническую рутину, что позволит нам на шаг приблизиться к персонализированному, основанному на биомаркерах лечению инфекционных заболеваний.
Раскрытие информации
Отсутствуют какие-либо конфликты интересов, которые авторы могли бы раскрыть.
Благодарности
Мы благодарим отделения клинической химии и серологии инфекций Института лабораторной медицины и микробиологии Университетской клиники Аугсбурга за проведение измерений антител в сыворотке крови. Мы благодарим доктора Фридерике Лише-Штарнекер и Институт патологии и молекулярной диагностики Университетской клиники Аугсбурга за предоставленные возможности для транскриптомики. Мы благодарим Мари Фрайтаг из Университетской клиники Аугсбурга за оказанную поддержку в логистике вакцинации и приобретении образцов. Мы благодарим доктора Олафа Книмейера и Институт Ханса Кноэлля в Йене, Германия, за предоставление лизата Aspergillus fumigatus . Эту работу поддержала исследовательская инициатива Bay-VOC (номер финансирования GE2-2452-200-D37666/2022), Баварское государственное министерство науки и искусства, а также Университет Аугсбурга, Германия.
Материалы
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
Ссылки
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены