Method Article
Ensayo de sangre total con coestimulación dual para el análisis específico de antígenos de la inmunidad del huésped a patógenos fúngicos y virales
* Estos autores han contribuido por igual
En este artículo
Resumen
Los inmunoensayos basados en sangre total proporcionan una herramienta fácil y eficiente en recursos para analizar la inmunidad específica del antígeno con fines de diagnóstico e investigación. Este artículo proporciona un protocolo optimizado basado en sangre total con coestimulación dual para un análisis exhaustivo de la inmunidad del huésped a patógenos fúngicos y virales, incluida una versión de bajo volumen para pacientes pediátricos y animales pequeños.
Resumen
El procesamiento rápido y eficiente de las muestras, el alto rendimiento y la alta robustez son fundamentales para la aplicación científica y clínica eficaz de los inmunoensayos avanzados específicos de antígenos. Tradicionalmente, estos inmunoensayos, especialmente el análisis de células T específicas de antígeno mediante citometría de flujo o ensayos puntuales de inmunoabsorción ligados a enzimas, a menudo se basan en el aislamiento de células mononucleares de sangre periférica. Este proceso lleva mucho tiempo, está sujeto a muchos factores de confusión preanalíticos y requiere grandes volúmenes de sangre. Los ensayos basados en sangre total proporcionan una alternativa fácil con una mayor robustez preanalítica y menores requisitos de volumen sanguíneo. Además, los ensayos basados en sangre total permiten la preservación de las interacciones intercelulares que no se capturan mediante ensayos que utilizan subconjuntos de células aisladas. Recientemente, se ha propuesto un inmunoensayo refinado de sangre total con coestimulación dual anti-CD28 y anti-CD49d para el análisis exhaustivo de las funciones de las células T específicas del antígeno y las interacciones intercelulares complejas en respuesta a diversos antígenos fúngicos y virales. Este protocolo proporciona orientación para la preparación de tubos de estimulación, estimulación sanguínea y procesamiento de muestras posteriores para citometría de flujo, ensayos de secreción de citocinas y análisis transcripcionales. Esto incluye un protocolo de bajo volumen validado y funcionalmente equivalente, no publicado anteriormente, (250 μL) para hacer que la monitorización de células T basada en citocinas y citocitometría sea más accesible para estudios en pacientes pediátricos o estudios preclínicos en animales pequeños (por ejemplo, ratones). En conjunto, estos protocolos proporcionan una caja de herramientas versátil para el análisis inmunitario complejo de antígenos específicos tanto en entornos de investigación clínica como traslacional.
Introducción
La cuantificación y caracterización de la inmunidad específica del antígeno, especialmente las respuestas específicas de las células T, es fundamental para la investigación en inmunobiología y vacunación, así como para algunas pruebas diagnósticas. Tradicionalmente, los inmunoensayos específicos de antígeno solían basarse en células mononucleares aisladas de sangre periférica (PBMC). Sin embargo, el aislamiento de estas células requiere mucho tiempo y recursos y, a menudo, requiere volúmenes de sangre relativamente grandes. Además, para prevenir la activación de los granulocitos y la posterior alteración de las células T durante el almacenamiento preanalítico1, es primordial un procesamiento rápido de las muestras, lo que a menudo no es factible en la práctica clínica. Estas limitaciones dificultan la viabilidad de los inmunoensayos específicos de antígeno en escenarios de investigación y rutinas clínicas de alto rendimiento. Por lo tanto, el desarrollo de enfoques basados en sangre total fáciles de usar y potencialmente automatizables en los últimos años ha abierto nuevas áreas de aplicaciones de inmunoensayos. Sin embargo, los sistemas actuales disponibles en el mercado suelen carecer de entornos coestimuladores óptimos para las células T y son susceptibles a retrasos preanalíticos. Por ejemplo, un ensayo de liberación de IFN-γ basado en sangre total ampliamente utilizado tiene una tasa de reversión positiva a negativa del 19% después de 6 h de almacenamiento de sangre preanalítico2. Para superar estas limitaciones se han desarrollado protocolos optimizados con coestimulación dual anti-CD28 y anti-CD49d 3,4,5,6.
El protocolo presentado aquí permite la cuantificación y caracterización precisas y reproducibles de las células T específicas de antígeno, la evaluación de las respuestas de citocinas inducidas por antígeno y otros marcadores inmunes funcionales (citométricos de flujo o transcripcionales) a partir de un volumen sanguíneo mínimo, es decir, 500 μL de sangre por tubo de estimulación. Otras ventajas de este protocolo incluyen el bajo tiempo de manipulación, la alta resistencia a los factores de confusión preanalíticos y la preservación de las interacciones intercelulares funcionales en un entorno ex vivo relativamente fisiológico. La comparabilidad de la caracterización de células T específicas de antígeno por citometría de flujo basada en sangre total con los datos generados a partir de ensayos tradicionales basados en PBMC se ha demostrado previamente en el contexto de la cuantificación de células T específicas de moho6. Además, la estimulación directa de la sangre de los sujetos anula la necesidad de suplementación con suero autólogo, alogénico o incluso xenogénico que se requiere comúnmente para una estimulación óptima de PBMC. La omisión del aislamiento celular también reduce el estrés por cizallamiento y temperatura, mejorando así la viabilidad celular. Lo más importante es que los ensayos basados en sangre total preservan las poblaciones de granulocitos que se pierden durante la centrifugación en gradiente para el aislamiento de PBMC7. De este modo, esta configuración de ensayo preserva y captura los bucles de interacción funcional entre los granulocitos y las células mononucleares4.
Cabe destacar que este protocolo solo requiere modificaciones mínimas para adaptarse a diferentes modalidades de lectura e incluso permite el análisis dual de la liberación de citocinas y las respuestas transcripcionales desde el mismo tubo de estimulación. En concreto, mientras que las citocinas se analizan a partir del sobrenadante de cultivo tras la estimulación, el pellet celular puede utilizarse para el aislamiento de ARN con posterior análisis transcriptómico. El flujo de trabajo general para las diversas modalidades de lectura se resume en la Figura 1.
En los últimos años, se ha desarrollado un número cada vez mayor de ensayos basados en sangre total para la monitorización inmunitaria reactiva a patógenos en entornos clínicos y de investigación, por ejemplo, para Mycobacterium tuberculosis 8,9, Bordetella pertussis3, Orientia tsutsugamushi10 y SARS-CoV-2 5,11,12. Por ejemplo, se ha utilizado un sistema previamente establecido para múltiples antígenos, incluidos M. tuberculosis, el virus de la influenza A y el SARS-CoV-2, pero no utiliza factores coestimuladores optimizados para la estimulación de células T auxiliares (Th) 13,14,15. A pesar de que el volumen de sangre requerido para estos ensayos ya es significativamente más bajo que el utilizado para los ensayos tradicionales basados en PBMC o los kits de estimulación de sangre completa disponibles comercialmente, un volumen de muestra aún más pequeño podría estar justificado para aplicaciones en pediatría, neonatología, pacientes en la unidad de cuidados intensivos (UCI) e investigación preclínica en modelos de animales pequeños. Por ejemplo, incluso las muestras de sangre terminal de ratones (por ejemplo, por punción cardíaca) suelen arrojar un máximo de 0,7-1 mL de sangre. Por lo tanto, se ha evaluado la posibilidad de reducir aún más los protocolos de inmunoensayo basados en sangre total previamente establecidos 4,6 para la cuantificación y caracterización precisas de las respuestas de las células T reactivas al antígeno a partir de 250 μL de volumen sanguíneo por tubo de estimulación.
Protocolo
El comité de ética de la Universidad Ludwig Maximilians de Múnich (proyecto número 21-0689) aprobó la recogida de muestras de sangre humana. Además, partes de los conjuntos de datos representativos se generaron bajo el número de estudio Corona-Register 20-426, también aprobado por el comité de ética de la Universidad Ludwig Maximilians de Múnich. Se obtuvo el consentimiento informado.
1. Preparación de tubos de estimulación de sangre total
NOTA: Este paso es una adaptación de Lauruschkat et al.4 y Weis et al.6. En la tabla 1 se resumen detalladamente las concentraciones y los volúmenes de reactivos.
- En condiciones estériles (banco de trabajo estéril), prepare tubos de extracción de sangre de 2,7 mL sin anticoagulante, con antígenos y anticuerpos coestimuladores. Agregue 1 μg/mL de α-CD28 y 1 μg/mL de α-CD49d a cada tubo, incluido el control negativo. Tenga en cuenta el volumen sanguíneo que se debe agregar para la estimulación de la sangre total al determinar las concentraciones finales (250 μL o 500 μL). Para mantener la geometría de la cámara y la accesibilidad de la muestra, no retraiga el émbolo del tubo de extracción de sangre.
- Con base en el diseño del estudio, determine si los tubos de control negativo no deben contener estímulo adicional (control de fondo no estimulado, como se muestra en la Tabla 1) o si deben usar antígenos para los cuales la cohorte del estudio no debe albergar células T específicas de antígeno o albergar un número mínimo (p. ej., un grupo de péptidos del VIH en individuos seronegativos al VIH 16).
- Para la estimulación específica de antígenos, optimice las concentraciones ideales de antígenos mediante la valoración en experimentos preliminares. Para generar los datos representativos que se indican a continuación, utilice las siguientes concentraciones de antígeno optimizadas: 1,2 μg/mL de lisado de HSV-1, 0,6 nM/péptido/mL de CMV pp65, 0,6 nM/péptido/mL de SARS-CoV-2 Prot_S, 50 μg/mL de lisado de Aspergillus fumigatus y 1 ng/mL de CRX-527.
- Incluir un control positivo, especialmente para estudios en pacientes linfopenicos o que reciben farmacoterapia inmunosupresor. Utilice la solución de control positivo de CPI (0,6 nM/péptido/mL), que consta de citomegalovirus, virus de la parainfluenza y péptidos del virus de la influenza.
NOTA: Alternativamente, se pueden utilizar estímulos sintéticos, como PMA (10 μg/mL) ± ionomicina (1 μg/mL), pero inducen menos reacciones fisiológicas y pueden afectar la expresión de antígenos de superficie comúnmente utilizados como marcadores poblacionales para la citometría de flujo (en particular, CD417). Tenga en cuenta que los anticuerpos coestimuladores no son necesarios junto con la mayoría de los estímulos sintéticos de control positivo e incluso podrían afectar negativamente la viabilidad y la capacidad de respuesta de las células. - Para armonizar los volúmenes de reactivos en todos los tubos de estimulación, añada el medio RPMI 1640 hasta los siguientes volúmenes totales: Ensayo a escala completa para citometría de flujo: 50 μL; Ensayo a escala completa para análisis de citocinas y transcriptómica: 500 μL; Ensayo a pequeña escala para citometría de flujo: 25 μL; Ensayo a pequeña escala para análisis de citocinas y transcriptómica: 250 μL.
NOTA: Para la preparación de múltiples juegos de tubos de estimulación, se recomienda preparar mezclas maestras que incluyan todos los ingredientes debido al menor riesgo de contaminación y al bajo volumen de factores y estímulos coestimuladores. - Utilice los tubos preparados inmediatamente o criopreservalos a -20 °C. La mayoría de los reactivos se pueden almacenar hasta 4 semanas; sin embargo, prevalidar los períodos máximos de almacenamiento para nuevos reactivos/estímulos.
2. Estimulación e incubación de muestras de sangre total
- Unos 30-60 minutos antes de la estimulación con sangre completa, descongele los tubos de estimulación listos para usar y manténgalos a temperatura ambiente.
- Recolectar sangre venosa del donante/paciente utilizando tubos de extracción de sangre con anticoagulante heparina de litio. Asegúrese de que el volumen de sangre recolectado cumpla con los requisitos individuales del experimento, es decir, se requiere un mínimo de 750 μL para 3 condiciones del ensayo a pequeña escala, incluido el control negativo y positivo. En el caso de los tubos de extracción de sangre adquiridos comercialmente, llénelos completamente para lograr concentraciones de trabajo de heparina de 16 a 25 UI/ml de sangre.
NOTA: Los datos demográficos de los sujetos adultos sanos reclutados para generar los conjuntos de datos representativos se muestran en la Tabla 2. - Transfiera la cantidad requerida de sangre entera heparinizada (250 μL o 500 μL para ensayos a pequeña o gran escala, respectivamente) a los tubos de estimulación pipeteando bajo un banco de trabajo estéril.
NOTA: Si no se dispone de un banco de trabajo estéril o cuando se trabaja con muestras que presentan un riesgo mínimo de infección (es decir, sangre de sujetos humanos o animales previamente seleccionados), las muestras pueden transferirse a los tubos de estimulación utilizando jeringas estériles. Este método también permite el procesamiento de muestras en la cabecera del paciente inmediatamente después de la extracción de sangre, lo que minimiza el almacenamiento preanalítico y el deterioro de las células T. Antes de inyectar la sangre, desinfecte exhaustivamente los sellos de goma tanto del tubo de extracción de sangre como de todos los tubos de estimulación con un desinfectante alcohólico. Deje que el desinfectante se seque durante al menos 1 minuto. - Invierta con cuidado los tubos de estimulación 5x-10x. Coloque los tubos de estimulación en una incubadora a 37 °C. Tenga en cuenta que no se requiere una incubadora deCO2 . Para evitar la activación inespecífica de los neutrófilos, no refrigere el tubo de extracción de sangre.
NOTA: Este protocolo ha sido validado para el almacenamiento preanalítico de sangre de hasta 8 h a temperatura ambiente para permitir el transporte de la muestra. Si es factible, es preferible inyectar sangre completa en los tubos de estimulación en el sitio de recolección y transportar la sangre a un laboratorio central en los tubos de estimulación, ya que los factores coestimuladores mejorarán la viabilidad de los linfocitos18,19. - Solo para las muestras utilizadas para ensayos de citometría de flujo con tinción intracelular, añadir brefeldina A (concentración final de 10 μg/mL) a cada tubo de estimulación después de 4 h de incubación.
- Prepare una solución de brefeldina A de 1 mg/mL en RPMI y agregue 1 μL de la solución por cada 100 μL de volumen de muestra (es decir, cóctel de estimulación premezclado + volumen de sangre total). Añada brefeldina A destapando los tubos y pipeteando bajo un banco de trabajo estéril. Vuelva a tapar y devuelva los tubos a la incubadora a 37 °C durante otras 16-18 h a 37 °C (20-22 h en total).
- Para ensayos de secreción de citocinas o análisis transcripcionales, no añadir brefeldina A e incubar continuamente las muestras a 37 °C durante 24-26 h.
NOTA: La brefeldina A inhibe el aparato de Golgi y, por lo tanto, anula la secreción de citocinas y el transporte de proteínas a la superficie celular. Dado que la secreción o la expresión de superficie darán lugar en última instancia a la pérdida y degradación de proteínas después de la reinternalización, respectivamente, los inhibidores de la exocitosis son esenciales para la acumulación intracelular y la tinción de citocinas y algunos marcadores de activación (por ejemplo, CD154) para los estudios de citometría de flujo. Sin embargo, la brefeldina A también interrumpe los procesos celulares fisiológicos visibles en el transcriptoma e invalida los ensayos de secreción de citocinas de los sobrenadantes de cultivo20,21, lo que requiere el uso de dos tubos de ensayo separados (uno con y otro sin brefeldina A) para realizar estas lecturas en paralelo.
3. Preparación de muestras para citometría de flujo
- Añadir 500 μL de solución de EDTA 0,5 M a cada tubo de estimulación e incubar la muestra durante 15 min a temperatura ambiente para separar las células adherentes de la superficie de los tubos.
- Transfiera las muestras a nuevos tubos de centrífuga de 15 mL. Enjuague los tubos de estimulación con 1 mL de tampón de lisis eritrocitaria para recolectar las células sanguíneas restantes, luego agregue el tampón y las células a los mismos tubos de centrífuga de 15 mL.
- Centrifugar los tubos de 15 ml durante 7 min a 600 x g. Deseche con cuidado el sobrenadante.
- Vuelva a suspender el pellet de células sanguíneas en el tampón de lisis de eritrocitos (Figura 2A). Utilice 5 mL de tampón de lisis eritrocitaria para 500 μL de sangre entera y 3 mL para 250 μL de sangre entera.
NOTA: Las condiciones óptimas de lisis globular deben evaluarse previamente para el tampón específico utilizado (producto preparado internamente o comercial). Las instrucciones proporcionadas aquí se han optimizado para el tampón de lisis globular que figura en la tabla de materiales. - Incube las muestras a temperatura ambiente hasta que las muestras parezcan claras (Figura 2B). Para evitar la lisis y agregación de granulocitos, no exceda los 6 minutos de incubación. Un indicador de éxito de la lisis globular es la capacidad de ver los números y las escalas en el tubo de 15 mL a través del líquido (Figura 2C).
- Centrifugar los tubos de 15 ml durante 7 min a 600 x g. Deseche con cuidado el sobrenadante, repita los pasos 3.4-3.5 si la pelletza de la celda aún está notablemente roja.
- Vuelva a suspender el pellet celular en 1 mL de HBSS y transfiera las células a tubos de reacción de 2 mL.
- Centrifugar los tubos de 2 ml durante 5 min a 400 x g. Deseche con cuidado el sobrenadante.
- Realice la tinción por citometría de flujo de acuerdo con las instrucciones del fabricante para el kit de tinción intracelular y los anticuerpos utilizados.
NOTA: El panel de anticuerpos utilizado para generar el conjunto de datos representativo se resume en la Tabla 3.
4. Preparación de muestras para ensayos de citocinas
- Después del paso 2.6, transfiera la sangre diluida de los tubos de estimulación a tubos de 1,5 mL.
- Centrifugar los tubos de 1,5 mL durante 20 min a 2000 x g. Pipetear cuidadosamente el sobrenadante en un tubo nuevo de 1,5 mL y utilizarlo inmediatamente para el análisis de citocinas o criopreservar los sobrenadantes a -80 °C.
- Vuelva a centrifugar el sobrenadante durante 5 minutos a ≥ 7000 x g (en tubos de 1,5 mL) para eliminar los restos de células residuales antes del análisis, especialmente después de la descongelación. Dependiendo del protocolo de ensayo de citocinas, realice la predilución de las muestras.
- Vuelva a suspender el pellet celular en 1 mL de tampón de protección de ARN y criopreservalo a -80 °C para su posterior aislamiento del ARN. Alternativamente, vuelva a suspender el pellet celular en el tampón de lisis para el aislamiento inmediato del ARN de acuerdo con las instrucciones del kit de aislamiento de ARN (o el protocolo interno).
NOTA: Si es necesario, dependiendo del protocolo de procesamiento de ARN posterior, se puede agregar un paso de lisis de eritrocitos similar al 3.4-3.5 antes de agregar el tampón de protección de ARN.
Resultados
Análisis multimodal de las respuestas inmunitarias específicas de antígeno tras la estimulación de sangre total con antígenos asociados a patógenos
Para generar un conjunto de datos representativo, se seleccionó un donante adulto sano seropositivo para VHS-1 y CMV que había recibido vacunas contra el SARS-CoV-2. Además de un control no estimulado, se han utilizado los siguientes estímulos descritos anteriormente: Lisado del virus del herpes simple 1 (VHS) (recomendación del fabricante, datos no publicados), citomegalovirus (CMV) pp6522, coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) Prot_S 5,23, lisado de Aspergillus fumigatus (un patógeno ambiental ubicuo)4,24, CRX-527 (un estímulo del receptor 4 tipo Toll basado en lipopolisacárido, que no debería activar las células T por sí mismo)25, y CPI (control positivo para la activación de células T CD4+ que consiste en CMV, virus de la parainfluenza y péptidos del virus de la influenza)26. Los datos de citometría de flujo y la estrategia de compuerta se muestran en la Figura 3. En general, se aconseja medir el mayor número posible de linfocitos cuando se trata de poblaciones de células raras (50.000 - 100.000 linfocitos), ya que la precisión y la fiabilidad de las mediciones dependen del número total de eventos27. La muestra no estimulada se utiliza para la activación de subconjuntos de células individuales (por ejemplo, células CD3+CD4+). Las puertas para CD45RO y CCR7 para el fenotipado de células T de memoria deben establecerse en la población total de CD3 + CD4+ y luego transferirse a las poblaciones de marcadores de activación positivos, ya que los bajos números de eventos en estas últimas a menudo impiden una identificación clara de poblaciones distintas. Pueden ser necesarios ligeros ajustes para las puertas individuales, por ejemplo, para tener en cuenta las diferencias en la viabilidad de los linfocitos. La regulación positiva de CD154 (o ligando CD40) se ha descrito como un marcador de activación de células T auxiliares global, consistente y rápidamente inducido28,29. El IFN-γ es considerado uno de los marcadores de activación de células T tipo 1 más prominentes y específicos30,31. Es importante destacar que este ensayo se ha probado y publicado con varios marcadores adicionales de activación, agotamiento y citocinas (ver Tabla 4 y24).
Las frecuencias de las poblaciones con marcadores de activación positivos en la muestra no estimulada representan antecedentes inespecíficos y se restaron de las frecuencias estimuladas por antígenos. Después de restar el fondo inespecífico, el donante representativo tenía 0,75% (HSV), 0,09% (CMV), 0,06% (SARS-CoV-2), 0,34% (A. fumigatus), 0,00% (CRX-527) y 1,21% (CPI) de células T auxiliares CD154+/CD3+CD4+ específicas (CPI), respectivamente. La expresión de IFN-γ se puede analizar de manera similar, dando como resultado 0,12% (HSV), 0,07% (CMV), 0,03% (SARS-CoV-2), 0,04% (A. fumigatus), 0% (CRX-527) y 0,74% (CPI) de células IFN-γ+/CD3+CD4+ .
Las poblaciones de linfocitos T se pueden subdividir a su vez en linfocitos T vírgenes (TN, CD45RO-CCR7+), linfocitos T de memoria central (TCM, CD45RO+CCR7+), linfocitos T de memoria efectora (TEM, CD45RO+CCR7-) y linfocitos T efectores (y linfocitos T de memoria efectora que reexpresan CD45RA, TE/TEMRA, CD45RO-CCR7-). Entre las células T CD3+CD4+ globales, el donante representativo tenía 38,34% de TN, 38,33% de TCM, 20,77% de TEM y 2,56% de TE/TEMRA, respectivamente, según se determinó utilizando la muestra no estimulada (Figura 3A). Sin embargo, entre las células T auxiliares reactivas específicas de antígeno (CD154 + IFN-γ+), TCM y TEM fueron, con mucho, los subconjuntos más destacados, con medias de 22,14% y 73,97%, respectivamente.
Los datos sobre poblaciones leucocitarias adicionales se han publicado previamente utilizando esta metodología24. Las combinaciones de anticuerpos utilizadas se presentan en la Tabla 4 para mayor referencia.
Además, para mostrar todo el potencial de esta metodología, se ha realizado un ELISA de IFN-γ en un segundo conjunto de muestras estimuladas (sin la adición de brefeldina A). Para evitar la superación del rango de detección del kit ELISA de IFN-γ, el plasma de las muestras estimuladas por CPI se diluyó previamente 1:4. Se midieron y normalizaron las siguientes concentraciones de IFN-γ por mL del volumen sanguíneo del sujeto, es decir, se corrigieron para la dilución tanto en los tubos de estimulación como en las diluciones previas al ELISA: 0 pg/mL (no estimulado), 69,4 pg/mL (HSV), 471 pg/mL (CMV), 17,8 pg/mL (SARS-CoV-2), 61,9 pg/mL (A. fumigatus), 34,0 pg/mL (CRX-527) y 1958 pg/mL (CPI).
Por último, el ARN se aisló de las mismas muestras con resultados consistentes. El rendimiento medio fue de 719 ng, con una relación de absorbancia media de 260 nm/280 nm de 1,98.
En conjunto, este conjunto de datos ilustra que el protocolo presentado permite un espectro de lectura multifacético y un análisis concomitante de varios antígenos asociados a la infección utilizando un volumen sanguíneo mínimo, es decir, 8 mL en total para múltiples estímulos y modalidades de lectura.
Conjunto de datos representativos de análisis transcripcionales para rastrear la respuesta a la vacunación utilizando sangre total estimulada por antígenos
Como prueba de principio para los estudios transcripcionales realizados en sangre total estimulada por antígenos, se recolectó sangre de 9 sujetos adultos sanos inmediatamente antes y 1 mes después de la primera vacunación de refuerzo con BNT162b2 (vacuna de ARNm contra el SARS-CoV-2)32,33 7-9 meses después de la serie inicial de vacunas de dos dosis. El rendimiento medio de ARN de 500 μL de sangre total no estimulada y estimulada con Prot_S fue de 1,1 μg de ARN de alta pureza, con una relación de absorción media de 260/280 de 1,99. Después del análisis nCounter, los recuentos de ARN se normalizaron a los 12 genes de mantenimiento del panel (media geométrica). A partir de entonces, se determinó la proporción de recuentos de ARNm normalizados en muestras Prot_S estimuladas frente a controles de fondo no estimulados para cada sujeto y gen. Se determinaron las proporciones mediana-mediana de las mediciones posteriores a la vacunación frente a las previas, y el análisis de enriquecimiento de la vía se realizó utilizando el paquete de software enumerado en la Tabla de Materiales. El enriquecimiento de las vías canónicas se consideró significativo con un valor absoluto de la puntuación z ≥ 1,25 y un valor p ajustado de Benjamini-Hochberg < 0,05. En la Figura 4A se resumen las vías enriquecidas significativamente diferentes, y en la Figura 4B se muestra una red simplificada de cambios ajustados en función de los antecedentes en la respuesta a la Prot_S después de la vacunación frente a la prevacunación. Además, en la Figura 4C (p < 0,01-0,03) se muestra una inducción más fuerte ajustada en el fondo de genes representativos relacionados con la maduración de las células presentadoras de antígenos y la activación de las células T inducida por el Prot_S después de la vacunación de refuerzo. Por último, se confirmó un aumento de las células T auxiliares de tipo 1 específicas de Prot_S ajustadas al fondo (CD69 + IFN-γ+) después de la vacunación en la mayoría de los donantes mediante citometría de flujo utilizando un segundo conjunto de tubos de estimulación (p = 0,03, Figura 4D).
Comparación de las respuestas de las células T reactivas al virus en protocolos de inmunoensayo basados en sangre total a gran escala y en pequeño volumen
A continuación, se compararon las frecuencias de células T auxiliares CD154+IFN-γ+ reactivas al virus (células CD3+CD4+ ) en voluntarios sanos utilizando los protocolos de estimulación de antígenos de sangre total a escala completa (500 μL, WBS) y de pequeño volumen (250 μL, WBS) (Figura 5). Como se informó previamente34, se observaron frecuencias de fondo inespecíficas mínimas de células CD154 + IFN-γ+ con cualquiera de los protocolos a pesar de la coestimulación dual (medias, 0,010% y 0,011% para WB y WBS, respectivamente). Cabe destacar que, aunque las respuestas de fondo inespecíficas se restan de las respuestas específicas de antígeno, aún contribuyen a aumentar la imprecisión del ensayo, como se discutió anteriormente27. Las señales de fondo elevadas (es decir, >0,07-0,1% de células Th CD154+ o >0,05% de células CD154+IFN-γ+ ) podrían indicar contaminación de la muestra, una infección aguda del sujeto o podrían ser el resultado de una manipulación inadecuada de la muestra preanalítica.
Las frecuencias medias de células T reactivas al lisado del VHS en donantes seropositivos (n = 5) fueron del 0,151% y del 0,107% en los sistemas WB y WBS, respectivamente, en comparación con el 0,012% y el 0,004% en los donantes seronegativos (n = 4). Con el grupo de péptidos CMV pp65, los donantes seropositivos (n = 4) tenían un 0,041% y un 0,049% de linfocitos T reactivos en comparación con el 0,001% y el 0,004% de los donantes seronegativos (n = 5). Los coeficientes de correlación de concordancia de Lin fueron de 0,868 para el VHS y de 0,985 para el CMV, lo que sugiere una fuerte correlación (Figura 5A). En particular, las pruebas de células T específicas del CMV pueden ser negativas en sujetos sanos seropositivos que no han tenido eventos de reactivación recientes. Tanto el repertorio de células T auxiliares CD3+CD4+ reactivas al antígeno se diferenciaron aún más en función de la expresión de CCR7 y CD45RO (Figura 5B). Tranquilizadoramente, los resultados obtenidos utilizando los protocolos WB y WBS fueron comparables tanto para las poblaciones totales como para las antígenos reactivas. Como era de esperar, con ambos ensayos, la proporción de células Th de memoria más diferenciadas (es decir, células de memoria efectoras) fue mayor entre las células T reactivas al antígeno que entre la población total de células Th. Como era de esperar, solo unas pocas células T ingenuas fueron activadas por estimulantes virales (Figura 5B).
Además, en otro conjunto de experimentos, se analizaron sobrenadantes de cultivo estimulados mediante IFN-γ ELISA (Figura 5C). Se observó un fondo inespecífico mínimo (medias de 1,29 pg/mL y 2,18 pg/mL en los protocolos WB y WBS, respectivamente). Las muestras de sangre de donantes seropositivos para el VHS mostraron concentraciones medias de IFN-γ inducidas por el VHS ajustadas al fondo de 111 pg/mL y 125 pg/mL en el sistema WB y WBS, respectivamente. Por el contrario, las concentraciones de IFN-γ en muestras seronegativas estuvieron consistentemente por debajo de 10 pg/mL en ambos sistemas (coeficiente de correlación de concordancia de Lin = 0,972, Figura 5C). Del mismo modo, la estimulación de pp65 en sangre de donantes seropositivos para CMV arrojó concentraciones medias de IFN-γ de 258 pg/mL y 272 pg/mL en los sistemas WB y WBS, respectivamente, mientras que se observó una secreción mínima de IFN-γ inducida por pp65 en ambos sistemas utilizando muestras seronegativas (coeficiente de correlación de concordancia de Lin = 0,953, Figura 5C).
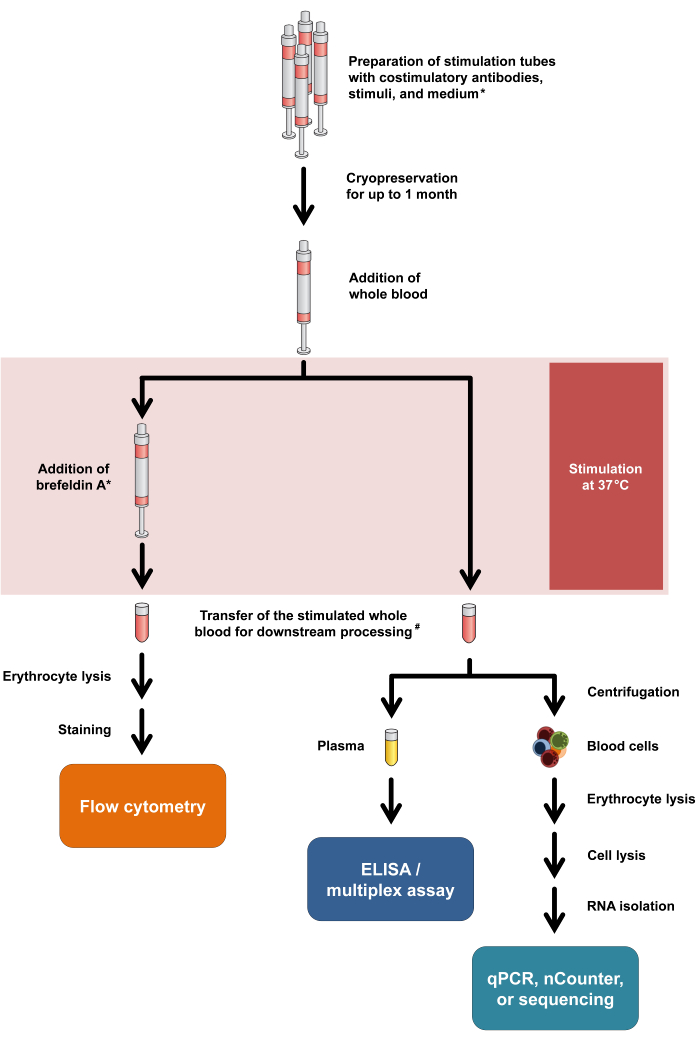
Figura 1: Diagrama de flujo que resume los procedimientos experimentales y las lecturas. Asterisco significa que la brefeldina A es necesaria para algunos marcadores de activación de células T (por ejemplo, CD154) y la tinción de citocinas intracelulares. Consulte los pasos 2.5 y 2.6 del protocolo. #: La sangre para la citometría de flujo se transfiere inicialmente a tubos de centrífuga de 15 mL para la lisis de eritrocitos, mientras que la sangre para los ensayos de citocinas y la transcriptómica se transfiere a tubos de microcentrífuga de 1,5 mL. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Lisis de eritrocitos. Después de que la sangre estimulada se ha resuspendido en (A) tampón de lisis de eritrocitos, se incuba hasta que (B) el líquido parece claro, pero no más de 6 min. (C) Cuando se usa un tubo graduado de 15 mL, su incrustación debe hacerse visible a través de la muestra cada vez más translúcida. Haga clic aquí para ver una versión más grande de esta figura.
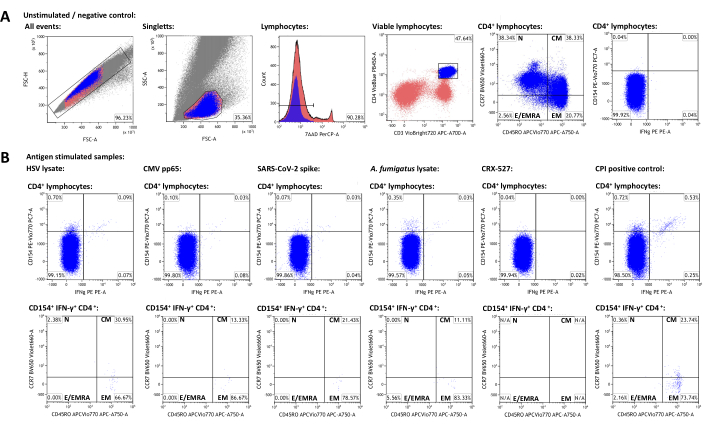
Figura 3: Conjunto de datos representativo y esquemas de compuerta de citometría de flujo. (A) Los eventos singlete se identifican mediante las propiedades FSC-A y FSC-H. De ellos, los linfocitos se controlan mediante FSC-A y SSC-A. Los linfocitos se diferencian en células T auxiliares CD3+CD4+. Los niveles de expresión de CD45RO y CCR7 se utilizan para el fenotipado de poblaciones de células efectoras y de memoria. Se utilizaron IFN-γ y CD154 como marcadores de activación. Las puertas se establecieron en función de la población de IFN-γ-CD154- en la muestra no estimulada. Posteriormente, las puertas se transfirieron a las muestras estimuladas (B). La caracterización de las poblaciones de memoria de las células T activadas se logró mediante la transferencia de la puerta del cuadrante CCR7/CD45RO de la población CD3+CD4+ a las poblaciones IFN-γ+CD154+CD3+CD4+. Haga clic aquí para ver una versión más grande de esta figura.
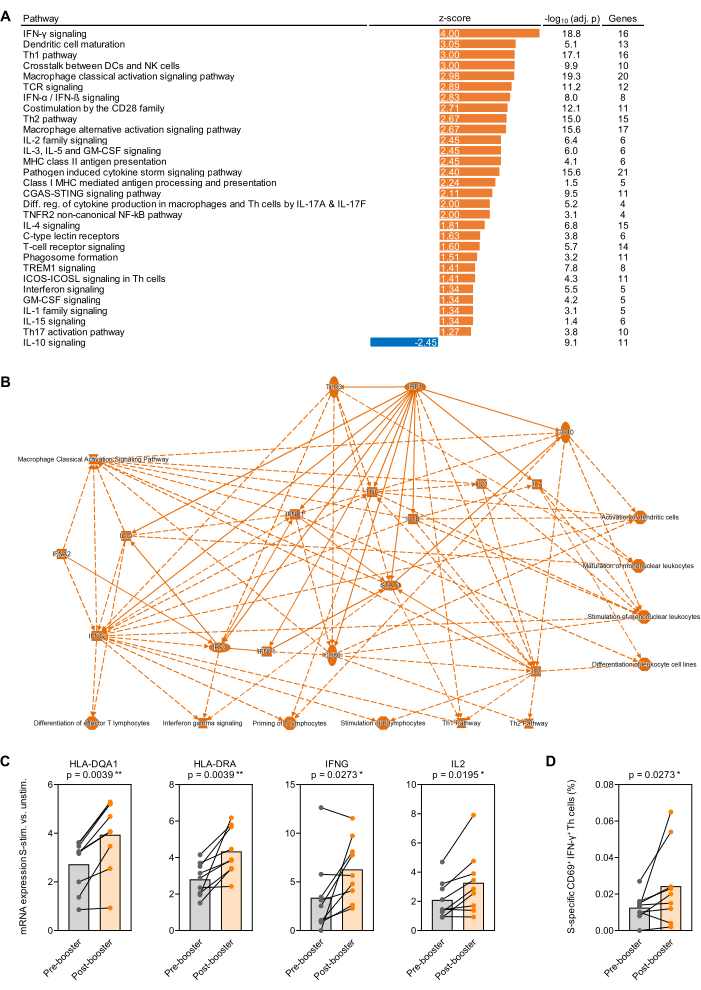
Figura 4: Cambios transcripcionales inducidos por antígenos después de la vacunación de refuerzo contra el SARS-CoV-2. (A) Se analizó el enriquecimiento ajustado a los antecedentes de las vías transcripcionales en sangre entera estimulada con la proteína de pico (Prot_S) del SARS-CoV-2 después de la (primera) vacunación de refuerzo de ARNm BNT162b2 en 9 sujetos adultos sanos. Se muestran vías canónicas inmunorelacionadas con un valor p ajustado por Benjamini-Hochberg (BH-adj.) <0,05 (-log10[BH-adj. p] >1,3) y una puntuación z absoluta >1,25. (B) Red simplificada que resume los genes y las vías más fuertemente enriquecidas en la sangre total estimulada por S después de la vacunación de refuerzo en comparación con antes. (C) Niveles de expresión ajustados a los antecedentes de genes representativos asociados con la presentación de antígenos y la activación de células T en sangre total estimulada por Prot_S antes y después de la vacunación de refuerzo. Prueba de Wilcoxon pareada. (D) Frecuencias corregidas de fondo de las células T IFN-γ+CD69+ específicas de Prot_S antes y después de la vacunación de refuerzo. Prueba de Wilcoxon pareada. Haga clic aquí para ver una versión más grande de esta figura.
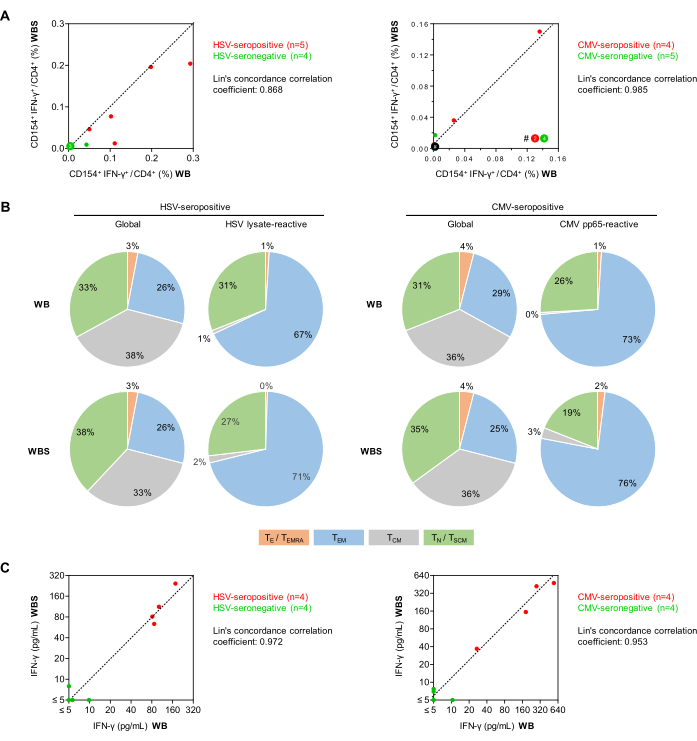
Figura 5: Reactividad de las células T antivirales en citometría de flujo y ELISA. (A) Se muestran gráficos de correlación de las frecuencias de células T CD154 + IFN-γ+/CD3 + CD4+ corregidas en fondo (citometría de flujo) de los ensayos de sangre total establecidos (WB) y de pequeño volumen (WBS). Los puntos verdes y rojos representan a los sujetos que son seronegativos y seropositivos para el virus analizado, respectivamente. (B) Utilizando la evaluación por citometría de flujo de la expresión de CD45RO y CCR7, se determinaron los fenotipos de células T efectoras / de memoria entre las células T CD3 + CD4+ globales y las células T IFN-γ + CD154 + CD3 + CD4+ reactivas al antígeno después de la estimulación con lisado de VHS o CMV pp65 utilizando sangre de donantes seropositivos (n = 5 y 4, respectivamente). Se muestran las distribuciones medias. Verde: linfocitos T vírgenes (TN), CD45RO-CCR7+. Gris: células T de memoria central (TCM), CD45RO+CCR7+. Azul: células T de memoria efectora (TEM), CD45RO+CCR7-. Naranja: linfocitos T efectores y linfocitos T de memoria efectora que reexpresan CD45RA (TE/TEMRA), CD45RO-CCR7-. (C) Gráficos de correlación de la liberación de IFN-γ corregida de fondo (ELISA) medida utilizando los ensayos WB y WBS. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Contenido del tubo de estímulo. Se resumen las concentraciones de estímulos y disolventes. El ensayo de sangre entera (WB) a gran escala se realiza utilizando 500 μL de sangre total heparinizada con litio, mientras que la versión a pequeña escala (WBS) requiere solo 250 μL de sangre. En el caso de WBS, todos los volúmenes de reactivos son la mitad de los volúmenes de WB. Haga clic aquí para descargar esta tabla.
Tabla 2: Datos demográficos de sujetos adultos sanos muestreados para generar los conjuntos de datos representativos. Haga clic aquí para descargar esta tabla.
Tabla 3: Panel representativo de citometría de flujo para el análisis de células T. Este panel de citometría de flujo se ha utilizado para generar el conjunto de datos representativo. Los resultados se muestran en detalle en la Figura 3. Haga clic aquí para descargar esta tabla.
Tabla 4: Paneles de citometría de flujo publicados anteriormente. Los datos que utilizan estas combinaciones de anticuerpos han sido publicados previamente por Tappe et al.24. Haga clic aquí para descargar esta tabla.
Discusión
Los inmunoensayos específicos de antígenos proporcionan información sobre las interacciones entre el huésped y el microbio, son fundamentales para la investigación en vacunación e inmunoterapia, y se reconocen cada vez más como modalidades diagnósticas y pronósticas en pacientes con infecciones oportunistas35. Este protocolo describe un sistema de estimulación de antígenos fácil que permite un análisis robusto y multimodal de la inmunidad específica del antígeno utilizando volúmenes sanguíneos mínimos (250-500 μL por antígeno). El protocolo reducido de 250 μL produjo una excelente correlación de las frecuencias de células T específicas del antígeno, los fenotipos y la producción de citocinas en comparación con el protocolo de 500 μL establecido anteriormente. A pesar de la disponibilidad de soluciones de pequeño volumen para algunos pasos del procesamiento de muestras36, hasta donde saben los autores, ningún sistema comercial disponible actualmente puede respaldar de manera confiable la estimulación de antígenos y el análisis funcional multifacético de las respuestas inmunitarias funcionales impulsadas por células T mediante citometría de flujo, ensayos de liberación de citocinas y transcriptómica a partir de volúmenes sanguíneos de 250-500 μL. El sistema comercial más utilizado, que facilita un espectro similar de aplicaciones de investigación, utiliza un volumen de sangre de 1 mL en un entorno de estimulación de 3 mL, lo que resulta en un costo y cantidades de antígenos necesarios considerablemente más altos en comparación con el protocolo presentado aquí 13,14,15.
A pesar de la optimización continua de los protocolos basados en sangre total para la cuantificación por citometría de flujo de células T específicas de antígeno 6,37,38, las mediciones por citometría de flujo tienen varias desventajas. En particular, siguen siendo laboriosos por naturaleza y son difíciles de estandarizar debido a la considerable variabilidad entre operadores (por ejemplo, el proceso de compuerta subjetivo) y las diferentes configuraciones de equipos, protocolos de compensación y parámetros de adquisición entre laboratorios. Aunque los informes estandarizados39 y el uso de software automatizado de análisis y compuerta podrían mejorar la estandarización y la comparabilidad de conjuntos de datos multicolores cada vez más complejos40,41, el protocolo de estimulación descrito aquí ha sido diseñado para acomodar varias modalidades de lectura no citométricas de flujo.
En particular, los ensayos de liberación de citocinas se pueden realizar con poco tiempo de manipulación y equipos relativamente baratos, y a menudo se estandarizan fácilmente para aplicaciones clínicas rutinarias. Además, como se ha demostrado en estudios previos que utilizan este protocolo, se pueden medir multitud de respuestas de citocinas a partir de volúmenes de muestra mínimos con ensayos multiplexados modernos, lo que permite perfilar firmas de citocinas complejas en entornos de investigación24,42. Cabe destacar que este robusto protocolo con coestimulación dual facilita la cuantificación fiable de las respuestas de citocinas específicas del antígeno en pacientes no linfopenicos (>800 linfocitos/μL de sangre), incluso en aquellos que reciben inmunosupresión iatrogénica26,34. Como desventaja de los ensayos de liberación de citocinas, especialmente en pacientes con leucopenia, las citocinas secretadas no se pueden rastrear a poblaciones celulares individuales. En algunos casos, esto podría mitigarse mediante el uso de estímulos específicos de la célula, si están disponibles. Sin embargo, puede ser necesaria una combinación de concentraciones de citocinas con otras modalidades de lectura y/o un ajuste de las respuestas de citocinas basado en la hematología clínica (es decir, hemograma completo con diferenciación de leucocitos). En particular, el protocolo presentado aquí permite una combinación de lecturas de citocinas y firmas transcripcionales de la misma muestra, lo que permite un análisis concordante de marcadores de activación transcripcional bien definidos que podrían agregar contexto celular y especificidad a las firmas globales de citocinas.
Un paso futuro hacia la estandarización completa e incluso una mejor viabilidad clínica sería la automatización completa de estos ensayos, desde el procesamiento de la muestra hasta la lectura del analito. A pesar de que se ha establecido con éxito el aislamiento automatizado preciso de poblaciones celulares individuales43,44, el análisis de células T específicas de antígeno aún requiere que el personal de laboratorio tome medidas de manipulación intermitentes. Sin embargo, la omisión del aislamiento celular y la manipulación de PBMC vulnerables y el uso de tubos de estimulación comerciales compatibles con la automatización podrían facilitar la implementación de flujos de trabajo sencillos y totalmente automatizados basados en sangre total para inmunoensayos funcionales.
En conjunto, los protocolos versátiles basados en sangre completa, como el que se presenta en este documento, son muy prometedores para ampliar las aplicaciones de los inmunoensayos funcionales específicos de antígeno a nuevas cohortes de pacientes y campos de investigación, incluidos los estudios preclínicos en animales pequeños. Los inmunoensayos funcionales específicos de antígenos son actualmente en gran medida inviables en modelos murinos o requieren la combinación de sangre de varios animales y/o el uso de extractos celulares no estandarizados, como los esplenocitos. Dado el interés emergente en las intervenciones inmunoterapéuticas para aumentar la defensa del huésped contra las infecciones oportunistas (por ejemplo, inhibidores de puntos de control inmunitario, factores de crecimiento hematopoyéticos, citocinas, etc.) y el aumento de las tecnologías innovadoras de vacunación, se espera que los inmunoensayos funcionales específicos de antígeno desempeñen un papel cada vez más importante tanto en la investigación preclínica de enfermedades infecciosas como en las aplicaciones clínicas en diversas poblaciones de pacientes. El sistema de estimulación de antígenos robusto, económico, fácil de usar y de bajo volumen que se presenta aquí puede facilitar análisis inmunitarios completos de antígenos específicos en áreas sin explotar. Además, la solidez preanalítica de este sencillo protocolo podría crear oportunidades para mejorar la incorporación de las aplicaciones de inmunoensayos en la rutina clínica, lo que nos permitiría dar un paso más hacia el tratamiento personalizado de las enfermedades infecciosas basado en biomarcadores.
Divulgaciones
No hay conflictos de intereses que deban ser revelados por los autores.
Agradecimientos
Agradecemos a las divisiones de química clínica y serología de infecciones del Instituto de Medicina de Laboratorio y Microbiología del Hospital Universitario de Augsburgo por realizar las mediciones de anticuerpos séricos. Agradecemos a la Dra. Friederike Liesche-Starnecker y al Instituto de Patología y Diagnóstico Molecular del Hospital Universitario de Augsburgo por proporcionar instalaciones de transcriptómica. Agradecemos a Marie Freitag, del Hospital Universitario de Augsburgo, por su apoyo en la logística de vacunación y la adquisición de muestras. Agradecemos al Dr. Olaf Kniemeyer y al Instituto Hans-Knoell en Jena, Alemania, por proporcionar el lisado de Aspergillus fumigatus . La iniciativa de investigación Bay-VOC (número de financiación GE2-2452-200-D37666/2022), el Ministerio de Ciencia y Arte del Estado de Baviera, así como la Universidad de Augsburgo, Alemania, apoyaron este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
Referencias
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados