Method Article
具有双重共刺激的全血测定,用于宿主对真菌和病毒病原体免疫的抗原特异性分析
* 这些作者具有相同的贡献
摘要
基于全血的免疫测定提供了一种简单且资源高效的工具,可用于分析抗原特异性免疫,用于诊断和研究目的。本文提供了一种优化的基于全血的方案,具有双重共刺激,用于全面分析宿主对真菌和病毒病原体的免疫力,包括用于儿科患者和小动物的小容量版本。
摘要
快速且资源高效的样品处理、高通量和高稳定性对于高级抗原特异性免疫测定的有效科学和临床应用至关重要。传统上,此类免疫测定,尤其是通过流式细胞术或酶联免疫吸附斑点测定进行的抗原特异性 T 细胞分析,通常依赖于外周血单核细胞的分离。这个过程很耗时,受到许多分析前混杂因素的影响,并且需要大量的血液。基于全血的分析提供了一种简单的替代方案,具有更高的分析前稳定性和更低的血容量要求。此外,基于全血的检测可以保留使用分离细胞亚群的检测无法捕获的细胞间相互作用。最近,提出了一种具有双重抗 CD28 和抗 CD49d 共刺激的精细全血免疫测定法,用于全面分析抗原特异性 T 细胞功能和响应各种真菌和病毒抗原的复杂细胞间相互作用。该方案为刺激管的制备、血液刺激和流式细胞术、细胞因子分泌测定和转录分析的下游样品处理提供了指导。这包括一个经过验证且功能等效的、以前未发表的低容量方案 (250 μL),使基于流式细胞术和细胞因子的 T 细胞监测更容易用于儿科患者的研究或小动物(例如小鼠)的临床前研究。总之,这些方案为临床和转化研究环境中的复杂抗原特异性免疫分析提供了一个多功能工具箱。
引言
抗原特异性免疫的定量和表征,尤其是特异性 T 细胞反应,对于免疫生物学和疫苗接种研究以及一些诊断测试至关重要。传统上,抗原特异性免疫测定通常依赖于分离的外周血单核细胞 (PBMC)。然而,分离这些细胞既耗时又耗费资源,并且通常需要相对较大的血容量。此外,为了防止分析前储存过程中的粒细胞活化和随后的 T 细胞干扰1 样品的快速处理至关重要,这在临床实践中通常不可行。这些限制阻碍了抗原特异性免疫测定在高通量研究场景和临床常规中的实用性。因此,近年来开发易于使用且可能可自动化的基于全血的方法开辟了免疫测定应用的新领域。然而,目前的市售系统通常缺乏 T 细胞的最佳共刺激环境,并且容易受到分析前延迟的影响。例如,一种广泛使用的基于全血的 IFN-γ 释放测定在分析前血液储存 6 小时后具有 19% 的阳性到阴性逆转率2。已经开发了具有双重抗 CD28 和抗 CD49d 共刺激的优化方案来克服这些限制 3,4,5,6。
此处介绍的方案允许对抗原特异性 T 细胞进行准确和可重复的定量和表征,评估抗原诱导的细胞因子反应,以及来自最小血容量的其他(流式细胞术或转录)功能性免疫标志物,即每个刺激管 500 μL 血液。该方案的其他优点包括手动操作时间短、对分析前混杂因素的高弹性以及在相对生理 的离体 环境中保留功能性细胞间相互作用。基于全血的流式细胞术抗原特异性 T 细胞表征与传统基于 PBMC 的分析生成的数据的可比性,先前已在霉菌特异性 T 细胞定量的背景下显示6。此外,直接刺激受试者的血液消除了补充自体、同种异体甚至异种血清的需要,而这些血清通常是最佳 PBMC 刺激通常需要的。省略细胞分离还可以降低剪切和温度应力,从而提高细胞活力。最重要的是,基于全血的分析可保留梯度离心过程中丢失的粒细胞群,以分离 PBMC7。因此,该检测设置可保留并捕获粒细胞和单核细胞之间的功能相互作用环4。
值得注意的是,该协议只需要最少的修改以适应不同的读数模式,甚至允许对来自同一刺激管的细胞因子释放和转录反应进行双重分析。具体来说,虽然在刺激后从培养上清液中分析细胞因子,但细胞沉淀可用于 RNA 分离和随后的转录组学分析。 图 1 总结了各种读出模式的一般工作流程。
近年来,在研究和临床环境中开发了越来越多的基于全血的检测方法用于病原体反应性免疫监测,例如结核分枝杆菌 8,9、百日咳博德特氏菌 3、东方 tsutsugamushi10 和 SARS-CoV-2 5,11,12。例如,先前建立的系统已用于多种抗原,包括结核分枝杆菌、甲型流感病毒和 SARS-CoV-2,但未使用针对辅助性 T 细胞 (Th) 刺激优化的共刺激因子 13,14,15。尽管这些检测所需的血量已经明显低于传统的基于 PBMC 的检测或市售全血刺激试剂盒的血量,但对于儿科、新生儿学、重症监护病房 (ICU) 患者和小动物模型的临床前研究,可能需要更小的样品量。例如,即使是从小鼠的终末血液采样(例如,通过心脏穿刺)通常也能产生最多 0.7-1 mL 的血液。因此,作为该方案的一部分,已经评估了进一步缩小先前建立的基于全血的免疫测定方案 4,6 的可能性,以便从每个刺激管 250 μL 的血容量中精确定量和表征抗原反应性 T 细胞反应。
研究方案
慕尼黑路德维希-马克西米利安大学伦理委员会(项目编号 21-0689)批准了人类血液样本的采集。此外,部分代表性数据集是在 Corona-Register-Study 编号 20-426 下生成的,该研究也得到了慕尼黑路德维希-马克西米利安大学伦理委员会的批准。已获得知情同意。
1. 全血刺激管的制备
注意:此步骤改编自 Lauruschkat 等人 4 和 Weis 等人 6。 表 1 总结了详细的试剂浓度和体积。
- 在无菌条件下(无菌工作台),制备 2.7 mL 采血管,不含抗凝剂,含有抗原和共刺激抗体。向每个试管中加入 1 μg/mL 的 α-CD28 和 1 μg/mL 的 α-CD49d,包括阴性对照。在确定最终浓度(250 μL 或 500 μL)时,考虑为全血刺激而添加的血容量。为了保持腔室的几何形状和样品的可及性,请勿从采血管中缩回柱塞。
- 根据研究设计,确定阴性对照管是否应不包含额外的刺激(未刺激的背景对照,如 表 1 所示)或使用研究队列应不包含或最少抗原特异性 T 细胞的抗原(例如,HIV 血清阴性个体中的 HIV 肽库 16)。
- 对于抗原特异性刺激,在初步实验中通过滴定优化抗原的理想浓度。为了生成以下代表性数据,请使用以下优化的抗原浓度:1.2 μg/mL HSV-1 裂解物、0.6 nM/肽/mL CMV pp65、0.6 nM/肽/mL SARS-CoV-2 Prot_S、50 μg/mL 烟曲霉 裂解物和 1 ng/mL CRX-527。
- 包括阳性对照,特别是对于淋巴细胞减少患者或接受免疫抑制药物治疗的患者的研究。使用 CPI 阳性对照溶液 (0.6 nM/肽/mL),由巨细胞病毒、副流感病毒和流感病毒肽组成。
注:或者,可以使用合成刺激物,例如 PMA (10 μg/mL) ±离子霉素 (1 μg/mL),但它们诱导的生理反应较少,并且会影响通常用作流式细胞术群体标志物的表面抗原的表达(最值得注意的是 CD417)。请注意,共刺激抗体不需要与大多数合成阳性对照刺激物结合使用,甚至可能对细胞活力和反应性产生负面影响。 - 为了协调所有刺激管中的试剂体积,添加 RPMI 1640 培养基至以下总体积:流式细胞术的全尺寸测定:50 μL;用于细胞因子分析和转录组学的全尺寸检测:500 μL;用于流式细胞术的小规模检测:25 μL;用于细胞因子分析和转录组学的小规模检测:250 μL。
注:对于多组刺激管的制备,建议制备包括所有成分的预混液,因为污染风险较低,共刺激因子和刺激物的体积较低。 - 立即使用准备好的试管或在 -20 °C 下冷冻保存。 大多数试剂可储存长达 4 周;但是,请预先验证新试剂/刺激物的最长储存期限。
2. 全血样品的刺激和孵育
- 在全血刺激前约 30-60 分钟,解冻即用型刺激管并将其保持在室温下。
- 使用含有肝素锂抗凝剂的采血管从供体/患者那里采集静脉血。确保采集的血容量满足单个实验要求,即小规模检测的 3 种条件(包括阴性和阳性对照)至少需要 750 μL。对于市售的采血管,应将其完全填充,以达到 16 - 25 IU/mL 血液的肝素工作浓度。
注意:为生成代表性数据集而招募的健康成人受试者的人口统计数据如 表 2 所示。 - 通过在无菌工作台下移液,将所需量的肝素化全血(小规模或全尺寸测定分别为 250 μL 或 500 μL)转移到刺激管中。
注意:如果没有无菌工作台,或者当处理感染风险最小的样品(即预先筛选的人类受试者或动物的血液)时,可以使用无菌注射器将样品转移到刺激管中。该方法还可以在采血后立即在床边进行样品处理,从而最大限度地减少分析前储存和 T 细胞损伤。在注射血液之前,用酒精消毒剂对采血管和所有刺激管的橡胶密封件进行全面消毒。让消毒剂干燥至少 1 分钟。 - 小心地将刺激管倒置 5 倍至 10 倍。将刺激管置于 37 °C 培养箱中。请注意,不需要 CO2 培养箱。为防止非特异性中性粒细胞活化,请勿冷藏采血管。
注意:该方案已经过验证,可在室温下储存分析前血液长达 8 小时,以允许样品运输。如果可行,最好在采集部位将全血注射到刺激管中,并将血液输送到刺激管中的中心实验室,因为共刺激因子会提高淋巴细胞活力18,19。 - 仅对于用于细胞内染色的流式细胞术测定的样品,孵育 4 小时后向每个刺激管中加入布雷菲德菌素 A(终浓度为 10 μg/mL)。
- 在 RPMI 中制备 1 mg/mL 布雷菲德菌素 A 溶液,每 100 μL 样品体积添加 1 μL 溶液(即预混合刺激混合物 + 全血体积)。通过打开试管并在无菌工作台下移液来添加 brefeldin A。重新盖上并放回 37 °C 培养箱中,在 37 °C 下再放置 16-18 小时(总共 20-22 小时)。
- 对于细胞因子分泌测定或转录分析,不要添加布雷菲德菌素A,并将样品在37°C下连续孵育24-26小时。
注:Brefeldin A 抑制高尔基体,从而消除细胞因子分泌和蛋白质向细胞表面的转运。由于分泌或表面表达最终会导致再内化后蛋白质丢失和降解,因此胞吐作用抑制剂对于流式细胞术研究中细胞因子和一些激活标志物(例如 CD154)的细胞内积累和染色至关重要。然而,布雷菲德菌素 A 还破坏了转录组中可见的生理细胞过程,并使培养上清液的细胞因子分泌测定无效20,21,因此需要使用两个单独的试管(一个含布雷菲德菌素 A,一个不含布雷菲德菌素 A)来并行执行这些读数。
3. 流式细胞术样品的制备
- 向每个刺激管中加入 500 μL 0.5 M EDTA 溶液,并在室温下孵育样品 15 分钟,以将贴壁细胞从试管表面分离。
- 将样品转移至新的 15 mL 离心管中。用 1 mL 红细胞裂解缓冲液冲洗刺激管以收集剩余的血细胞,然后将缓冲液和细胞添加到相同的 15 mL 离心管中。
- 将 15 mL 试管以 600 x g 离心 7 分钟。小心丢弃上清液。
- 将血细胞沉淀重悬于红细胞裂解缓冲液中(图 2A)。500 μL 全血使用 5 mL 红细胞裂解缓冲液,250 μL 全血使用 3 mL。
注:需要针对所使用的特定缓冲液(内部制备或商业产品)预先评估最佳红细胞裂解条件。此处提供的说明已针对材料表中列出的红细胞裂解缓冲液进行了优化。 - 在室温下孵育样品,直到样品看起来透明(图 2B)。为防止粒细胞裂解和聚集,孵育时间不要超过 6 分钟。红细胞溶解成功的一个指标是能够通过液体看到 15 mL 试管上的数字和刻度(图 2C)。
- 将 15 mL 试管以 600 x g 离心 7 分钟。小心丢弃上清液,如果细胞沉淀仍然明显呈红色,则重复步骤 3.4-3.5。
- 将细胞沉淀重悬于 1 mL HBSS 中,并将细胞转移到 2 mL 反应管中。
- 将 2 mL 试管以 400 x g 离心 5 分钟。小心丢弃上清液。
- 根据制造商对所用细胞内染色试剂盒和抗体的说明进行流式细胞术染色。
注:用于生成代表性数据集的抗体组合总结于表 3 中。
4. 制备用于细胞因子测定的样品
- 在步骤 2.6 之后,将稀释的血液从刺激管转移到 1.5 mL 管中。
- 将 1.5 mL 试管以 2000 x g 离心 20 分钟。小心地将上清液移液到新的 1.5 mL 试管中,并立即用于细胞因子分析或将上清液在 -80 °C 下冷冻保存。
- 将上清液以 ≥ 7000 x g 的速度再次离心 5 分钟(在 1.5 mL 试管中),以去除分析前残留的细胞碎片,尤其是在解冻后。根据细胞因子检测方案,对样品进行预稀释。
- 将细胞沉淀重悬于 1 mL RNA 保护缓冲液中,并在 -80 °C 下冷冻保存,以便后续分离 RNA。或者,根据 RNA 分离试剂盒(或内部方案)的说明,将细胞沉淀重悬于裂解缓冲液中,以便立即分离 RNA。
注:如有必要,根据后续的 RNA 加工方案,可以在添加 RNA 保护缓冲液之前添加类似于 3.4-3.5 的红细胞裂解步骤。
结果
用病原体相关抗原刺激全血后抗原特异性免疫反应的多模式分析
为了生成具有代表性的数据集,选择了一名接受过 SARS-CoV-2 疫苗接种的 HSV-1 和 CMV 血清阳性的健康成年供体。除了未刺激的对照外,还如上所述使用了以下刺激物:单纯疱疹病毒 1 (HSV) 裂解物(制造商推荐,未发表的数据)、巨细胞病毒 (CMV) pp6522、严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) Prot_S 5,23、烟曲霉裂解物(一种普遍存在的环境病原体)4,24、CRX-527(一种基于脂多糖的 Toll 样受体 4 刺激,其本身不应激活 T 细胞)25,以及 CPI(由 CMV、副流感病毒和流感病毒肽组成的 CD4+ T 细胞活化的阳性对照)26。流式细胞术数据和设门策略如图 3 所示。通常,建议在靶向稀有细胞群(50,000 - 100,000 个淋巴细胞)时测量尽可能多的淋巴细胞,因为测量的精度和可靠性取决于事件总数27。未刺激的样品用于单个细胞亚群(例如 CD3+CD4+ 细胞)的门控。用于记忆 T 细胞表型的 CD45RO 和 CCR7 的门控应设置在总 CD3+CD4 + 群体上,然后转移到激活标志物阳性群体,因为后者上的低事件数通常无法明确识别不同的群体。对于单个门,可能需要进行轻微调整,例如,为了说明淋巴细胞活力的差异。CD154(或 CD40 配体)的上调被描述为一种全局、一致且快速诱导的 T 辅助细胞活化标志物28,29。IFN-γ 被认为是最突出的 1 型特异性 T 细胞活化标志物之一30,31。重要的是,该测定已经过测试并发表,其中包含各种额外的激活、耗竭和细胞因子标志物(参见表 4 和24)。
未刺激样本中激活标志物阳性群体的频率代表非特异性背景,并从抗原刺激的频率中减去。减去非特异性背景后,代表性供体分别为 0.75% (HSV) 、 0.09% (CMV )、 0.06% (SARS-CoV-2) 、 0.34% (烟曲霉) 、 0.00% (CRX-527) 和 1.21% (CPI) 特异性 CD154+/CD3+CD4+ T 辅助细胞。IFN-γ 表达可以类似地分析,产生 0.12% (HSV)、0.07% (CMV)、0.03% (SARS-CoV-2)、0.04% (烟曲霉)、0% (CRX-527) 和 0.74% (CPI) IFN-γ+/CD3+CD4+ 细胞。
T 细胞群可进一步细分为初始 T 细胞 (TN, CD45RO-CCR7+)、中枢记忆 T 细胞 (TCM, CD45RO+CCR7+)、效应记忆 T 细胞 (TEM, CD45RO+CCR7-) 和效应 T 细胞 (以及再表达 CD45RA、TE/TEMRA、CD45RO-CCR7-) 的效应记忆 T 细胞。在全球 CD3+CD4+ T 细胞中,代表性供体分别具有 38.34% TN、38.33% TCM、20.77% TEM 和 2.56% TE/TEMRA,使用未刺激样品测定(图 3A)。然而,在抗原特异性反应性辅助性 T 细胞 (CD154+IFN-γ+) 中,TCM 和 TEM 是迄今为止最突出的亚群,分别为 22.14% 和 73.97%。
以前已使用这种方法发表了有关其他白细胞群的数据24。使用的抗体组合见 表 4 以供进一步参考。
此外,为了显示该方法的全部潜力,对第二组刺激样品进行了 IFN-γ ELISA(不添加布雷菲德菌素 A)。为防止超出 IFN-γ ELISA 试剂盒的检测范围,将 CPI 刺激样品的血浆以 1:4 的比例预稀释。测量受试者每毫升血容量的以下 IFN-γ 浓度并归一化,即在刺激管和 ELISA 前稀释液中校正稀释度:0 pg/mL(未刺激)、69.4 pg/mL (HSV)、471 pg/mL (CMV)、17.8 pg/mL (SARS-CoV-2)、61.9 pg/mL(烟曲霉)、34.0 pg/mL (CRX-527) 和 1958 pg/mL (CPI)。
最后,从相同的样品中分离 RNA,结果一致。平均产量为 719 ng,260 nm/280 nm 的平均吸光度比为 1.98。
总而言之,该数据集表明,所提出的方案允许使用最小血容量(即对于多种刺激和读出模式的总 8 mL)对各种感染相关抗原进行多方面的读出光谱和伴随分析。
用于转录分析的代表性数据集,以使用抗原刺激的全血跟踪疫苗接种反应
作为对抗原刺激的全血进行的转录研究的原理验证,在最初的两剂疫苗系列后 7-9 个月,在第一次加强接种 BNT162b2(SARS-CoV-2 mRNA 疫苗)之前和之后 1 个月从 9 名健康成年受试者中采集血液。500 μL 未刺激和Prot_S刺激全血的平均 RNA 产量为 1.1 μg 高纯度 RNA,平均 260/280 吸收比为 1.99。在 nCounter 分析之后,将 RNA 计数标准化为面板的 12 个看家基因(几何平均值)。此后,确定每个受试者和基因的 Prot_S刺激样本与未刺激背景对照中归一化 mRNA 计数的比率。确定了疫苗接种后与疫苗接种前测量值的中位数与中位数比率,并使用材料表中列出的软件包进行通路富集分析。在绝对 z 评分值为 1.25 且 Benjamini-Hochberg 校正 p 值≥< 0.05 时,经典途径的富集被认为是显着的。图 4A 总结了显着不同的富集途径,图 4B 显示了疫苗接种后与疫苗接种前对 Prot_S 反应的背景调整变化的简化网络。此外,加强疫苗接种后与抗原呈递细胞成熟和 Prot_S 诱导的 T 细胞活化相关的代表性基因的更强背景调整诱导如图 4C 所示(p < 0.01-0.03)。最后,使用第二组刺激管(p = 0.03,图 4D)的流式细胞术证实,大多数供体接种疫苗后背景调整的 Prot_S 特异性 1 型 T 辅助细胞 (CD69+IFN-γ+) 增加。
基于全血和小体积的免疫测定方案中病毒反应性 T 细胞反应的比较
接下来,使用全尺寸(500 μL,WB)和小体积(250 μL,WBS)全血抗原刺激方案(图 5)比较健康志愿者中病毒反应性 CD154+IFN-γ+ T 辅助细胞(CD3+CD4+ 细胞)的频率。如前所述34,尽管有双重共刺激,但两种方案都观察到 CD154 + IFN-γ + 细胞的最小非特异性背景频率(平均值,WB 和 WBS 分别为 0.010% 和 0.011%)。值得注意的是,尽管从抗原特异性反应中减去了非特异性背景反应,但它们仍然导致检测不精确性增加,如前所述27。升高的背景信号(即 >0.07-0.1% CD154+ Th 细胞或 >0.05% CD154+IFN-γ+ 细胞)可能表明样品污染、受试者急性感染,或者可能是分析前样品处理不当的结果。
在 WB 和 WBS 系统中,血清阳性供体 (n = 5) 的平均 HSV 裂解物反应性 T 细胞频率分别为 0.151% 和 0.107%,而血清阴性供体 (n = 4) 分别为 0.012% 和 0.004%。使用 CMV pp65 肽库,血清阳性供体 (n = 4) 具有 0.041% 和 0.049% 的反应性 T 细胞,而血清阴性供体 (n = 5) 具有 0.001% 和 0.004% 的反应性 T 细胞。HSV 的 Lin 一致性相关系数为 0.868,CMV 为 0.985,表明存在很强的相关性(图 5A)。值得注意的是,在近期没有再激活事件的健康血清阳性受试者中,CMV 特异性 T 细胞检测可能为阴性。根据 CCR7 和 CD45RO 表达进一步区分总和抗原反应性 CD3+CD4+ T-辅助细胞库(图 5B)。令人欣慰的是,使用 WB 和 WBS 方案获得的结果对于总群体和抗原反应性群体均具有可比性。出乎意料的是,在这两种测定中,抗原反应性 T 细胞中分化程度更高的记忆 Th 细胞(即效应记忆细胞)的比例高于总 Th 细胞群中的比例。正如预期的那样,只有少数幼稚的 T 细胞被病毒兴奋剂激活(图 5B)。
此外,在另一组实验中,通过 IFN-γ ELISA 分析刺激培养上清液(图 5C)。观察到最小的非特异性背景(WB 和 WBS 方案中的平均值分别为 1.29 pg/mL 和 2.18 pg/mL)。来自 HSV 血清阳性供体的血样显示,在 WB 和 WBS 系统中,背景校正的 HSV 诱导的 IFN-γ 平均浓度分别为 111 pg/mL 和 125 pg/mL。相比之下,在两个系统中,血清阴性样品中的 IFN-γ 浓度始终低于 10 pg/mL(Lin's 一致性相关系数 = 0.972, 图 5C)。同样,在 WB 和 WBS 系统中,对 CMV 血清阳性供体血液的 pp65 刺激产生的平均 IFN-γ 浓度分别为 258 pg/mL 和 272 pg/mL,而在使用血清阴性样本的两个系统中都观察到最小的 pp65 诱导的 IFN-γ 分泌(Lin's 一致性相关系数 = 0.953, 图 5C)。
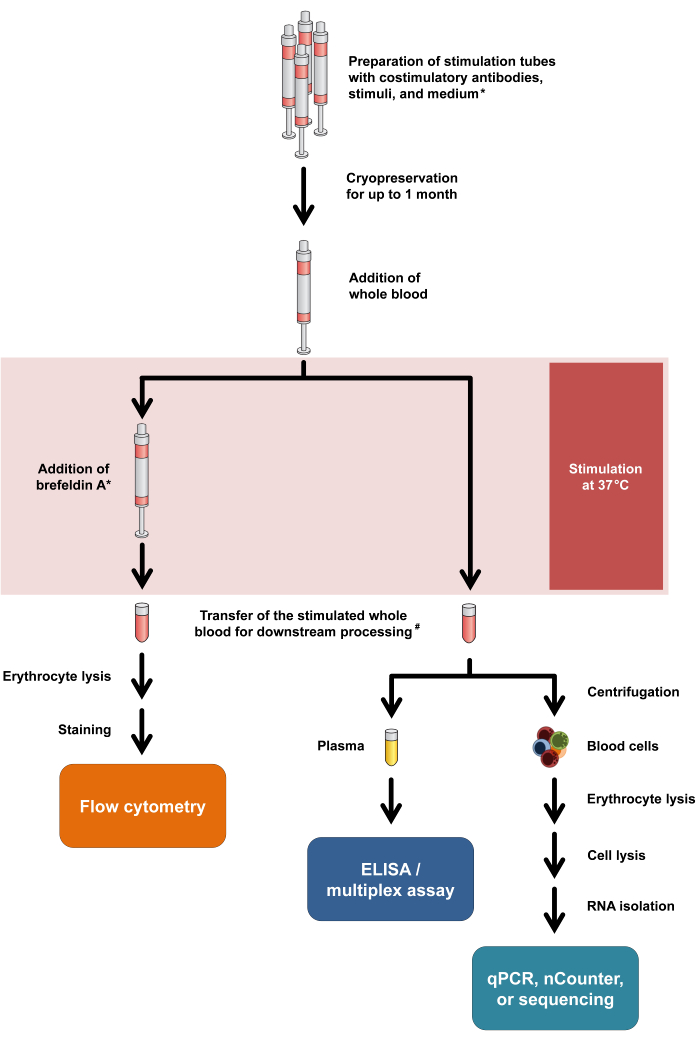
图 1:总结实验程序和读数的流程图。 星号表示某些 T 细胞活化标志物(例如 CD154)和细胞内细胞因子染色需要布雷菲德菌素 A。参见协议步骤 2.5 和 2.6。#:用于流式细胞术的血液最初转移到 15 mL 离心管中用于红细胞裂解,而用于细胞因子测定和转录组学的血液转移到 1.5 mL 微量离心管中。 请单击此处查看此图的较大版本。

图 2:红细胞溶解。 将刺激的血液重悬于 (A) 红细胞裂解缓冲液中后,将其孵育至 (B) 液体看起来透明,但不超过 6 分钟。(C) 当使用分级的 15 mL 试管时,其鳞片应通过越来越透明的样品可见。 请单击此处查看此图的较大版本。
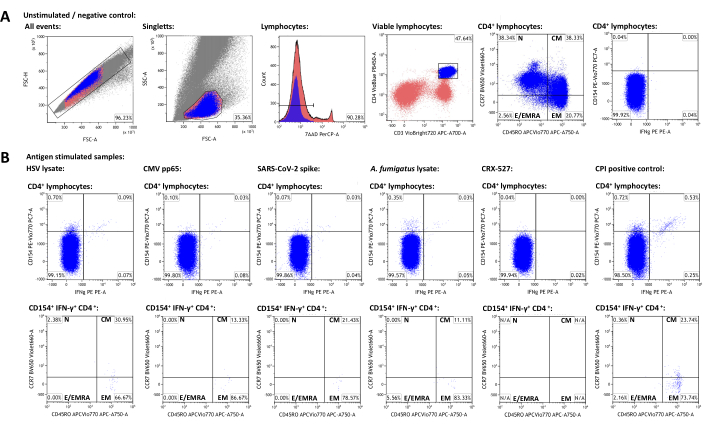
图 3:代表性数据集和流式细胞术门控示意图。(A) 单重态事件由 FSC-A 和 FSC-H 特性识别。其中,淋巴细胞使用 FSC-A 和 SSC-A 进行门控。淋巴细胞分化为 CD3+CD4+辅助性 T 细胞。CD45RO 和 CCR7 表达水平用于记忆和效应细胞群的表型分析。IFN-γ 和 CD154 用作激活标志物。根据未刺激样品中的 IFN-γ-CD154- 群体设置设门。随后将门转移到刺激的样品 (B)。通过将 CCR7/CD45RO 象限门从 CD3+CD4+ 群体转移到 IFN-γ+CD154+CD3+CD4+ 群体,实现活化 T 细胞记忆群的表征。请单击此处查看此图的较大版本。
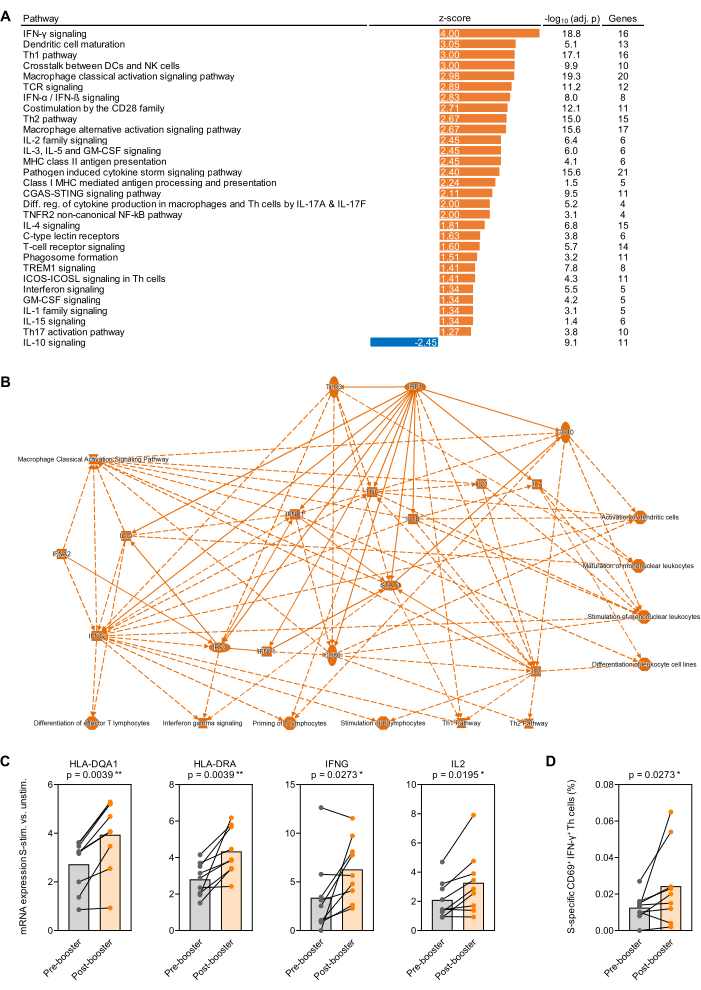
图 4:SARS-CoV-2 加强疫苗接种后抗原诱导的转录变化。 (A) 分析了 9 名健康成人受试者在接种 BNT162b2 mRNA 加强针后与之前(第一次)SARS-CoV-2 刺突蛋白 (Prot_S) 刺激的全血中转录途径的背景调整富集。显示了免疫相关经典通路,Benjamini-Hochberg 调整 (BH-adj.) p 值 <0.05 (-log10[BH-adj. p] >1.3) 和绝对 z 分数 >1.25。(B) 简化的网络总结了加强疫苗接种后与加强疫苗接种前在 S 刺激的全血中更强烈富集的基因和通路。(C) 加强疫苗接种前后 Prot_S 刺激全血中与抗原呈递和 T 细胞活化相关的代表性基因的背景调整表达水平。配对 Wilcoxon 试验。(D) 加强疫苗接种前后 Prot_S 特异性 IFN-γ+CD69+ T 细胞的背景校正频率。配对 Wilcoxon 试验。 请单击此处查看此图的较大版本。
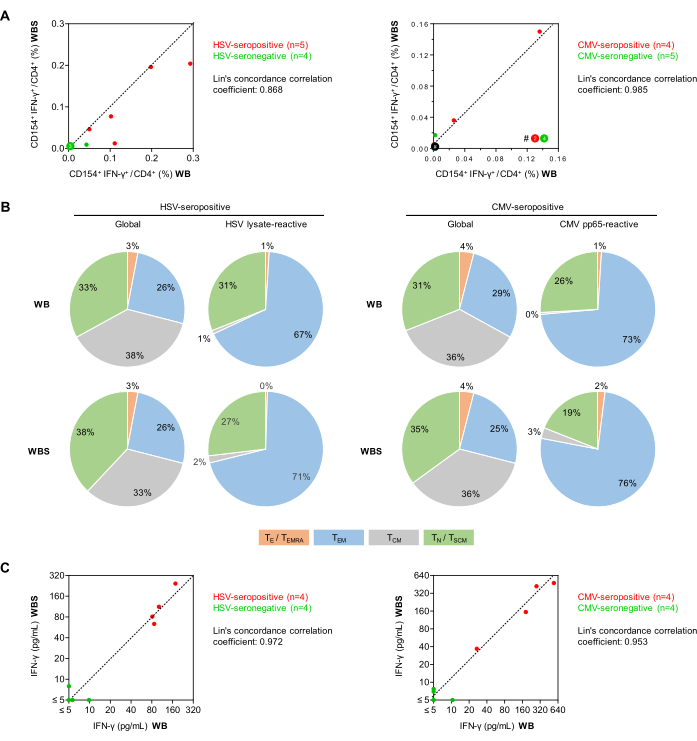
图 5:流式细胞术和 ELISA 中的抗病毒 T 细胞反应性。 (A) 显示了来自已建立的 (WB) 和小体积 (WBS) 全血测定的背景校正的 CD154+IFN-γ+/CD3+CD4+ T 细胞频率(流式细胞术)的相关图。绿点和红点分别代表检测病毒血清阴性和血清阳性的受试者。(B) 使用 CD45RO 和 CCR7 表达的流式细胞术评估,在使用血清阳性供体的血液 (分别为 n = 5 和 4) 用 HSV 裂解物或 CMV pp65 刺激后,确定整体 CD3+CD4+ T 细胞和抗原反应性 IFN-γ+CD154+CD3+CD4+ T 细胞中的记忆/效应 T 细胞表型。将显示均值分布。绿色:初始 T 细胞 (TN),CD45RO-CCR7+。灰色:中枢记忆 T 细胞 (TCM),CD45RO+CCR7+。蓝色:效应记忆 T 细胞 (TEM),CD45RO+CCR7-。橙色:效应 T 细胞和效应记忆 T 细胞再表达 CD45RA (TE/TEMRA),CD45RO-CCR7-。(C) 使用 WB 和 WBS 分析测量的背景校正 IFN-γ 释放 (ELISA) 的相关图。请单击此处查看此图的较大版本。
表 1:刺激管内容物。 总结了刺激物和溶剂的原液浓度。全尺寸全血检测 (WB) 使用 500 μL 肝素化锂全血进行,而小规模全血检测 (WBS) 仅需 250 μL 血液。对于 WBS,所有试剂体积均为 WB 体积的一半。 请点击此处下载此表格。
表 2:为生成代表性数据集而抽样的健康成人受试者的人口统计数据。请点击此处下载此表格。
表 3:用于 T 细胞分析的代表性流式细胞术组合。 该流式细胞术面板已用于生成代表性数据集。 结果如图 3 所示。 请点击此处下载此表格。
表 4:以前发表的流式细胞术 panel。 使用这些抗体组合的数据之前已由 Tappe 等人发表24。 请点击此处下载此表格。
讨论
抗原特异性免疫测定提供了对宿主-微生物相互作用的见解,对疫苗接种和免疫治疗研究至关重要,并且越来越被认为是机会性感染患者的诊断和预后方式35。该方案描述了一种简单的抗原刺激系统,该系统允许使用最小的血容量(每种抗原 250-500 μL)对抗原特异性免疫进行稳健的多模式分析。与之前建立的 500 μL 方案相比,缩小的 250 μL 方案在抗原特异性 T 细胞频率、表型和细胞因子产生方面产生了极好的相关性。尽管样本处理的某些步骤有小体积解决方案36,但据作者所知,目前没有可用的商业系统能够可靠地支持抗原刺激和通过流式细胞术、细胞因子释放测定和转录组学对 T 细胞驱动的功能性免疫反应进行多方面功能分析,血液体积为 250-500 μL。促进类似研究应用的最广泛使用的商业系统在 3 mL 刺激环境中使用 1 mL 血量,与此处介绍的方案相比,所需的抗原成本和数量要高得多 13,14,15。
尽管基于全血的抗原特异性 T 细胞流式细胞定量方案不断优化 6,37,38,但流式细胞术测量有几个缺点。特别是,由于操作员间相当大的可变性(例如,主观设门过程)以及实验室之间的设备设置、补偿协议和采集参数不同,它们本质上仍然很费力,并且难以标准化。尽管标准化报告39 以及自动分析和设门软件的使用可能会提高日益复杂的多色数据集的标准化和可比性40,41,但此处描述的刺激方案旨在适应各种非流式细胞术读出模式。
特别是,细胞因子释放测定可以使用较短的手动操作时间和相对便宜的设备进行,并且它们通常很容易标准化用于常规临床应用。此外,正如使用该方案的先前研究所表明的那样,可以使用现代多重分析从最小样品量中测量大量细胞因子反应,从而允许在研究环境中分析复杂的细胞因子特征24,42。值得注意的是,这种具有双重共刺激的稳健方案有助于可靠地定量非淋巴细胞减少患者(>800 个淋巴细胞/μL 血液)的抗原特异性细胞因子反应,即使在接受医源性免疫抑制的患者中也是如此26,34。作为细胞因子释放测定的一个缺点,尤其是在白细胞减少症患者中,分泌的细胞因子不能追溯到单个细胞群。在某些情况下,这可以通过使用细胞特异性刺激(如果可用)来缓解。然而,可能需要将细胞因子浓度与其他读数方式相结合,和/或根据临床血液学调整细胞因子反应(即全血细胞计数和白细胞分化)。值得注意的是,此处介绍的方案允许将来自同一样品的细胞因子读数和转录特征相结合,从而允许对定义明确的转录激活标志物进行一致分析,这可能会为整体细胞因子特征增加细胞背景和特异性。
迈向完全标准化甚至更好的临床实用性的未来步骤将是这些分析从样品处理到分析物读数的完全自动化。尽管已经成功建立了单个细胞群的精确自动分离43,44,但抗原特异性 T 细胞分析仍然需要实验室人员采取间歇性处理步骤。然而,省略细胞分离和处理脆弱的 PBMC 以及使用商用、自动化兼容的刺激管可能有助于实施简单、全自动的基于全血的功能性免疫测定工作流程。
总而言之,基于全血的通用方案(如本文介绍的方案)有望将抗原特异性功能免疫测定的应用扩展到新的患者群体和研究领域,包括小动物的临床前研究。抗原特异性功能性免疫测定目前在小鼠模型中基本上不可行,或者需要混合来自几只动物的血液和/或使用非标准化细胞提取物,例如脾细胞。鉴于人们对免疫治疗干预的日益增长的兴趣,以增强宿主对机会性感染(例如,免疫检查点抑制剂、造血生长因子、细胞因子等)的防御以及创新疫苗接种技术的激增,抗原特异性功能性免疫测定有望在临床前传染病研究和不同患者群体的临床应用中发挥越来越大的作用。这里介绍的稳健、廉价、易用、低容量抗原刺激系统可能有助于在未开发的区域进行全面的抗原特异性免疫分析。此外,这种简单的方案的分析前稳健性可能会为改进免疫测定应用纳入临床常规创造机会,使我们能够向个性化、生物标志物驱动的传染病管理更近一步。
披露声明
作者无需披露任何利益冲突。
致谢
我们感谢奥格斯堡大学医院检验医学和微生物学研究所的临床化学和感染血清学部门进行血清抗体测量。我们感谢 Friederike Liesche-Starnecker 博士和奥格斯堡大学医院病理学和分子诊断研究所提供转录组学设施。我们感谢奥格斯堡大学医院的 Marie Freitag 在疫苗物流和样品采集方面提供的支持。我们感谢 Olaf Kniemeyer 博士和德国耶拿的 Hans-Knoell-Institute 提供 烟曲 霉裂解物。研究倡议 Bay-VOC(资助编号 GE2-2452-200-D37666/2022)、巴伐利亚州科学与艺术部以及德国奥格斯堡大学支持了这项工作。
材料
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
参考文献
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。