Method Article
الحفاظ على النماذج الحيوية للخنازير لدراسة التشريح البشري المقارن
In This Article
Summary
تقدم هذه المقالة بروتوكولا للحفاظ على النماذج الحيوية للخنازير. تتضمن الطريقة المقترحة استخدام محلول تشيلي معدل بتركيز فورمالين منخفض. تتكون عملية الحفظ من إدارة المحلول من خلال ملء العينة وغمرها ، متبوعا بإزالة الشكل وتليين الأنسجة باستخدام الجلسرين.
Abstract
يواجه تدريس علم التشريح البشري في التعليم الطبي تحديات ، مما يستلزم بدائل فعالة للطلاب لاستكشاف التعقيد التشريحي عمليا. تقدم النماذج الحيوية للخنازير ، مع أوجه التشابه التشريحية مع البشر ، حلا واعدا. تقدم هذه المقالة بروتوكولا مفصلا للحفاظ على النماذج الحيوية للخنازير ، مما يعالج الحاجة إلى طرق يمكن الوصول إليها وفعالة في دراسات التشريح المقارنة. يقترح هذا البروتوكول استخدام حل تشيلي معدل للحفاظ على النموذج الحيوي ، باستخدام تقنيات التشكيل الرسمي من خلال الملء والغمر. بعد ذلك ، يتم تحقيق إزالة الشكل باستخدام المحلول التشيلي المعدل بدون الفورمالديهايد ، متبوعا بعملية تليين الجلسرين. نظرا لندرة الأدبيات حول تقنيات الحفظ وعدم وجود إجراء أو اختبار موحد لتقييم الحفاظ على الأنسجة ، نقترح تقييم جودة الأنسجة بناء على مقاييس المقاومة والمرونة. تشير النتائج التي توصلنا إليها إلى مستوى عال نوعيا من الحفاظ على الأنسجة في عيناتنا. علاوة على ذلك ، يتم استخدام هذه النماذج الحيوية حاليا بنجاح لدراسات التشكل وفي تدريس علم التشريح البشري المقارن لطلاب الطب.
Introduction
غالبا ما يواجه تدريس علم التشريح في كليات الطب عقبات ، مثل صعوبات الوصول إلى الأجسام البشرية للتشريح ونقص المرافق المناسبة. تؤكد هذه القيود على الحاجة إلى بدائل فعالة تمكن الطلاب من استكشاف التعقيد التشريحي عمليا وواقعيا. في هذا السياق ، برزت النماذج الحيوية للخنازير كبديل واعد نظرا لأوجه التشابه التشريحية مع البشر ، مما يوفر وسيلة سهلة الوصول وفعالة لتعلم وتعليم علمالتشريح 1.
تهدف تقنيات الحفظ التشريحي إلى الحفاظ على سلامة الأنسجة البيولوجية مع تقليل الضرر. تم استخدام هذه التقنيات للأغراض التعليمية والأكاديمية والبحثية في دراسة كل من علم التشريح البشري والبيطري. تم اختبار العديد من المواد للحفاظ على الأجسام والأعضاء والأنسجة في حالتها الطبيعية لأطول فترة ممكنة2. ومع ذلك ، فإن الحفاظ على العينات التشريحية والحفاظ عليها لا يزال يمثل تحديا ، خاصة بالنسبة لتلك المخصصة للدراسات المورفولوجية ، حيث يلزم الحفاظ على الأنسجة بشكل عال3.
على الرغم من أن الحلول المستخدمة تقليديا متاحة على نطاق واسع ، إلا أن القيود في الممارسة اليومية واضحة. الفورمالين ، أحد أكثر المواد المستخدمة شيوعا ، له العديد من العيوب الموثقة للحفاظ على الأنسجة. وتشمل هذه رائحته المهيجة ، وسميته العالية ، والمخاطر المرتبطة بالسرطان والطفرات للمعالجين ، والتغيرات الحسية التي يسببها في الأنسجة ، مثل التصلب وتغير اللون. يمكن أن تغير هذه التغييرات إدراك الخصائص الفسيولوجية للأنسجة عند دراستها بعد التثبيت ، مما قد يعيق الدراسات المورفولوجية الدقيقةوالدقيقة 4. أظهرت الدراسات أن التثبيت بتركيزات عالية من الفورمالين يؤدي إلى درجة أكبر من تصلب الأنسجة5. أظهرت البدائل ، مثل تقنية التحنيط Thiel ، نتائج واعدة مع الحفاظ على اللون الأصلي بشكل أفضل ومرونة الأنسجة6. ومع ذلك ، فإن هذه التقنية أكثر تكلفة مقارنة بالحلول الأخرى7. تقدم هذه التحديات فرصة لتصميم واختبار تقنيات حفظ جديدة وبأسعار معقولة لا تزال تمكن من تدريس علم التشريح عالي الجودة.
الهدف من هذا البروتوكول هو وصف المنهجية المستخدمة في مختبر التشريح التابع لجامعة إيسيسي في كالي ، كولومبيا ، للحفاظ على النماذج الحيوية للخنازير المستخدمة كأدوات تعليمية للدراسة المقارنة للتشريح البشري.
Protocol
تم تطوير التقنية الموصوفة بما يتوافق تماما مع المبادئ التوجيهية للجنة الأخلاقيات المؤسسية لرعاية واستخدام في التجارب (CIECUAE) التابعة لجامعة Icesi ، وفقا للقانون 84 لعام 1989 وقرار رئيس الجامعة رقم 847 (9 يوليو 2012). هذا يضمن كلا من النزاهة العلمية ورفاهية المستخدمة ، مما يقلل من معاناتها. تم استخدام ذكور خنازير Landrace ، التي يبلغ عمرها 3 أشهر وتزن 15-20 كجم ، في هذه الدراسة. الكواشف والمعدات المطلوبة مدرجة في جدول المواد.
1. النموذج الحيوي للخنازير
- تضحية
- قم بإجراء تقييم بيطري عام وقم بالحجر الصحي لعينة الخنازير المختارة لمدة 24 ساعة. إذا لم تظهر على أي أعراض خلال هذه الفترة ، فاستمر في القتل الرحيم.
- تخدير
- يتم تطبيق التخدير العضلي باستخدام الكيتامين + الزيلازين + الأتروبين بجرعات 10 ملغم / كجم و 0.5 مجم / كجم و 0.04 مجم / كجم على التوالي (باتباع البروتوكولات المعتمدة مؤسسيا).
ملاحظة: تأكد من التخدير العميق. تقييم عمق التخدير من خلال الفحص البدني. يشار إلى التخدير العميق من خلال اتساع التلميذ ومركزه ، وغياب المنعكس الجني ، وانخفاض منعكس القرنية ، وانخفاض معدل التنفس ومعدل ضربات القلب وضغط الدم.
- يتم تطبيق التخدير العضلي باستخدام الكيتامين + الزيلازين + الأتروبين بجرعات 10 ملغم / كجم و 0.5 مجم / كجم و 0.04 مجم / كجم على التوالي (باتباع البروتوكولات المعتمدة مؤسسيا).
- القتل الرحيم
- يجب تطبيق 5 مل من بنتوباربيتال الصوديوم / ثنائي فينيل هيدانتوين (390/50 مجم / مل) عن طريق الوريد. بعد إعطاء عامل القتل الرحيم ، قم بتسمع المعلمات الفسيولوجية للحيوان لأنواع Suis Scrofa : HR ، 60-90 ؛ FR ، 8-18 ؛ و T ° 37-39 °C8.
- راقب معدل ضربات القلب حتى ينخفض تدريجيا ويتوقف تماما. لاحظ التغيرات الفورية مثل استرخاء العضلة العاصرة ، والأغشية الزرقاء ، وغياب الاستجابة لمحفزات الجسم. ضع في اعتبارك إكمال القتل الرحيم بعد 5 دقائق من التسمع القلبي دون اكتشاف نبضات القلب.
- التخزين والنقل
- انقل النموذج الحيوي للخنازير من غرفة العمليات إلى مختبر التشريح في غضون نصف ساعة من القتل الرحيم لمنع التحلل والتكاثر الميكروبي ، وبالتالي تحسين الحفاظ على النموذج الحيوي.
2. محلول حافظة يعتمد على المحلول التشيلي
- تحضير الحل التشيلي المعدل
- استخدم محلولا تشيليا معدلا يحتوي على الإيثانول والجلسرين والفورمالديهايد وكلوريد البنزالكونيوم وجوهر القهوة العطري والماء المقطر. تأكد من أن المحلول يحتوي على درجة حموضة 7.0.
- تحضير المحلول الحافظ في خزان سعة 50 لترا. أولا ، أضف 10.6 لتر من الماء المقطر إلى الخزان. بعد ذلك ، أضف 7.6 لتر من 96٪ إيثانول ، و 5 لتر من الجلسرين ، و 0.5 لتر من 50٪ كلوريد البنزالكونيوم ، و 0.1 لتر من جوهر القهوة العطري.
ملاحظة: يرجى الرجوع إلى الجدول 1 للاطلاع على التركيزات والأحجام المطلوبة لكل مكون اللازم لتحضير 25 لترا من المحلول التشيلي المعدل.
3. إعطاء محلول التحافظة التشيلي المعدل
ملاحظة: بمجرد تحضير المحلول الحافظ ، قم بإدارته من خلال الملء والغمر.
- الإعطاء عن طريق ملء محلول الحافظة التشيلي المعدل
ملاحظة: استخدم ملابس السلامة الحيوية لهذا الإجراء: قناع نصف قابل لإعادة الاستخدام مع مرشحات A1P2 ، ونظارات واقية للسلامة الحيوية ، وثوب جراحي بأكمام طويلة يمكن التخلص منه ، وقبعة جراحية ، وطماق ، وقفازات النتريل.- النهج الجراحي
- قم بعمل شق على طول الخط ألبا (باستخدام مقبض مشرط 4 ، الشفرة 22) من عملية الخنجري إلى منطقة العانة.
- تحديد الأنسجة الخلوية تحت الجلد والألياف العضلية للعضلة المستقيمة البطنية.
ملاحظة: في لحظة الشق ، حدد الأنسجة الدهنية الضئيلة الملتصقة بالجلد ، والمعروفة باسم الأنسجة الخلوية تحت الجلد ، والألياف العضلية للعضلة المستقيمة البطانية الموجودة بشكل أعمق9. - قطع بعناية للوصول إلى الصفاق ، مما يضمن فتحه على تجويف البطن دون إصابة الكبد والأمعاء ، والتي سيتم الكشف عنها على الفور.
- اسحب الحلقات المعوية إلى الجانب الأيمن من تجويف البطن. تحديد الصفاق الجداري الذي يغطي الكلية اليسرى والأوعية الكلوية. استخدم هذه الهياكل الوعائية لتحديد موقع الشريان الأورطي البطني.
- ابحث عن ظهور السنيقة الكلوية اليسرى. إزالة الصفاق الذي يغطي الشريان الأورطي 5 سم فوق الشريان الكلوي.
- عند تعريض عنيق الكلى الأيسر ، قم بتعبئة الحلقات المعوية وشق الصفاق الذي يغطي النقير. تشريح الأمامي الخلفي لتحديد الوريد الكلوي أولا ، وهو أكبر ويقع في الأمام.
- حدد موقع الشريان الكلوي للخلف ، باتباع مساره إلى أصله في الشريان الأورطي البطني. أخيرا ، حدد الحوض الكلوي ، وهو الهيكل الخلفي للنقير9.
- قم بتشريح الجزء الخلفي من الشريان الأورطي بعناية. استخدم 0/0 حرير لربط الشريان الأورطي بعقدة أعلى من مستوى الشريان الكلوي وعقدة أخرى 5 سم فوقها.
- قم بتثبيت الشريان الأورطي على الفور باستخدام مشابك كيلي على طرفي الجزء الأبهري المعزول.
- قم بشق جدار الأبهر بطرف مقص Metzembaum ، مع إجراء قطع بحوالي 0.3 سم في الجدار الأمامي للشريان الأورطي ، مع الحرص على عدم ثقبه.
- اربط الطرف البعيد أثناء إزالة مشبك كيلي لإدخال إبرة غير حادة على شكل حرف L مقاس 3.2 مم في التجويف الشرياني. قم بإزالة مشبك كيلي القريب وابدأ في نضح محلول الحفظ التشيلي المعدل.
- نضح الأبهر لمحلول الحفظ التشيلي المعدل
- استمر في نضح محلول الحفظ التشيلي المعدل.
ملاحظة: قم بإدارة 0.25 لتر / كجم بضغط 10 أرطال باستخدام مضخة التروية. - نهاية التروية
- بمجرد اكتمال نضح محلول الحفظ ، قم بإزالة قنية التروية وعقد موقع الإدخال بحرير 0/0 لمنع ارتجاع محلول الحفظ. أغلق البطن عن طريق خياطة الشق في الخط ألبا ب 0/0 حرير.
ملاحظة: لتقييم ما إذا كان قد تم تحقيق التروية الكافية ، تحقق من المؤشرات الحادة للتشبع: تمديد الأطراف العلوية والسفلية ، وتعدد عنق الرحم والصدر ، والجريان السطحي للمحلول عبر الخياشيم. وقت التروية التقريبي هو 2 ساعة.
- بمجرد اكتمال نضح محلول الحفظ ، قم بإزالة قنية التروية وعقد موقع الإدخال بحرير 0/0 لمنع ارتجاع محلول الحفظ. أغلق البطن عن طريق خياطة الشق في الخط ألبا ب 0/0 حرير.
- النهج الجراحي
- الإدارة عن طريق الانغماس
ملاحظة: استخدم ملابس السلامة الحيوية لهذا الإجراء: قناع نصف قابل لإعادة الاستخدام مع مرشحات A1P2 ، ونظارات واقية للسلامة الحيوية ، وثوب جراحي بأكمام طويلة يمكن التخلص منه ، وقبعة جراحية ، وطماق ، وقفازات النتريل.- الإدارة عن طريق غمر محلول الحفظ التشيلي المعدل
- قم بتخزين عينة الخنازير في خزان سعة 300 لتر مملوء بنفس محلول الحماية الموضح في الخطوة 2.
ملاحظة: تأكد من غمر النموذج الحيوي بالكامل باستخدام ما يقرب من 150 لترا من المحلول. بعد الغمر ، قم بتخزين النموذج الحيوي عند 20 درجة مئوية لمدة 6 أشهر. تشمل مؤشرات الحفظ الكافي عدم وجود علامات تحلل (على سبيل المثال ، وذمة الجسم ، والتورم ، والرائحة الكريهة ، والشحوم ، وتفتيت الأنسجة).
- قم بتخزين عينة الخنازير في خزان سعة 300 لتر مملوء بنفس محلول الحماية الموضح في الخطوة 2.
- الإدارة عن طريق غمر محلول الحفظ التشيلي المعدل
4. حل إزالة الشكل على أساس الحل التشيلي
- تحضير محلول إزالة الشكل
- استخدم محلولا تشيليا معدلا يحتوي على الإيثانول والجلسرين وكلوريد البنزالكونيوم وجوهر القهوة العطري والماء المقطر. تأكد من أن المحلول يحتوي على درجة حموضة 7.0.
- تحضير محلول إزالة الشكل في خزان سعة 50 لترا. أولا ، أضف 11.1 لترا من الماء المقطر ، ثم 7.8 لتر من الإيثانول بنسبة 96٪ ، و 5 لتر من الجلسرين ، و 1 لتر من كلوريد البنزالكونيوم بنسبة 50٪ ، و 0.1 لتر من جوهر القهوة العطري.
ملاحظة: يرجى الرجوع إلى الجدول 2 للاطلاع على التركيزات والأحجام المطلوبة لكل مكون لازم لتحضير 25 لترا من المحلول التشيلي المعدل الخالي من الفورمالديهايد.
5. إزالة الشكل
ملاحظة: استخدم ملابس السلامة الحيوية لهذا الإجراء: قناع نصف قابل لإعادة الاستخدام مع مرشحات A1P2 ، ونظارات واقية للسلامة الحيوية ، وثوب جراحي بأكمام طويلة يمكن التخلص منه ، وقبعة جراحية ، وطماق ، وقفازات النتريل.
- الإعطاء عن طريق غمر محلول الحفظ التشيلي المعدل الخالي من الفورمالديهايد
- في نهاية فترة الحفظ بالغمر لمدة 6 أشهر ، انقل النموذج الحيوي إلى خزان سعة 300 لتر مملوء بمحلول حفظ تشيلي معدل خال من الفورمالديهايد. قم بتخزين النموذج الحيوي لمدة 4 أسابيع.
ملاحظة: تأكد من غمر النموذج الحيوي بالكامل باستخدام ما يقرب من 150 لترا من المحلول.
- في نهاية فترة الحفظ بالغمر لمدة 6 أشهر ، انقل النموذج الحيوي إلى خزان سعة 300 لتر مملوء بمحلول حفظ تشيلي معدل خال من الفورمالديهايد. قم بتخزين النموذج الحيوي لمدة 4 أسابيع.
6. تليين الجلسرين
- مباشرة بعد عملية إزالة الشكل ، اغمر النموذج الحيوي في المحاليل ذات تركيزات متزايدة من الجلسرين المخفف في الماء: 50٪ و 70٪ و 90٪ من الجلسرين. حافظ على النموذج الحيوي في كل تركيز لمدة أسبوع واحد.
النتائج
الهدف من هذا البروتوكول هو تقديم تقنية فعالة وقابلة للتطبيق تسمح بالحفاظ على النماذج الحيوية للخنازير لتدريس التشريح البشري المقارن. لا توجد حاليا طرق أو اختبارات موحدة لتقييم الحفاظ على النموذج. لذلك ، تم تقييم الحفظ الكلي للنموذج باستخدام مؤشرات امتلاء المحاليل وعلامات التحلل بعد اكتمال البروتوكول على العينات. علاوة على ذلك ، لتقييم جدوى النماذج الحيوية بشكل موضوعي للتدريس والبحث ، تم التخطيط لمقارنة خصائص الأنسجة للهياكل التشريحية المختارة ، مثل المقاومة والمرونة ، قبل وبعد الحفظ. كانت الهياكل التشريحية المختارة هي العصب المبهم والشريان الأبهري والوريد الأجوف. تم اختيار هذه الهياكل لأن الأعصاب والشرايين والأوردة أساسية في تعليم وتعلم التشريح الإجمالي. وبالتالي ، تم عزل 4 أعصاب مبهمة و 4 شرايين أورطي و 3 أوردة أجوف من عينات طازجة غير محفوظة.
وفقا لذلك ، باستخدام البروتوكول المقدم ، تم الحفاظ على جثث 12 عينة من الخنازير. تم تقييم النماذج الحيوية للخنازير المحفوظة للتأكد من كفاية الحفظ باستخدام مؤشرات الامتلاء ، مثل امتداد الأطراف الأمامية والدم والمحلول الحافظ الذي يتدفق عبر فتحتي الأنف (الشكل 1) ، والوذمة ، وزيادة محيط الصدر وعنق الرحم (الشكل 2 والشكل 3) ، بالإضافة إلى ظهور نمط أبيض مرقش في الكبد (الشكل 4) وشحوب الحلقات المعوية (الشكل 5). أظهرت جميع النماذج الحيوية مؤشرات ناجحة للامتلاء. بعد الانتهاء من البروتوكول ، لم يظهر أي من النماذج الحيوية تغييرات مرتبطة بالتحلل ، مثل انتفاخ الحلقات المعوية أو الرائحة الكريهة أو تفتيت الأنسجة.
بعد فحص النماذج الحيوية ، كان من الواضح أن هذه التقنية نجحت في الحفاظ على الأنسجة للتلاعب والتشريح. تشمل الأمثلة العضلات وآثارها (الشكل 6) ، والصفاق (الشكل 7) ، والمعدة والأمعاء (الشكل 8). تم تقييم ذلك بشكل شخصي ، حيث حافظت جميع هذه الأعضاء على مرونة عالية أثناء التلاعب. سمح تناسق الكبد ، على الرغم من ثباته ، بتحديد القنوات داخل الكبد والأوعية الدموية المرتبطة بها بعد التشريح (الشكل 9 والشكل 10).
ومع ذلك ، لم تكن النتائج واعدة دائما. قبل تطوير البروتوكول ، كان الاستعمار الفطري للنماذج الحيوية مشكلة متكررة. ربما يعزى ذلك إلى استخدام تقنية غير موحدة للملء والإعطاء عن طريق غمر المحلول الحافظ. يوضح الشكل 6 نموذجا حيويا تأثر بالاستعمار.
بالإضافة إلى ذلك ، لتقييم الحفاظ على الأنسجة بشكل موضوعي ، تم قياس الخصائص المحددة ذات الأهمية في كل من الهياكل غير المحفوظة والمحفوظة. تم عزل أربعة أعصاب مبهمة وأربعة شرايين أورطي وثلاثة أوردة جوف من النماذج الحيوية المحفوظة. كانت الخصائص المقاسة هي مقاومة الأنسجة (مقاسة كميا على أنها النيوتن المطلوبة لتمزيق الهيكل) ومرونة الأنسجة (مقاسة باستخدام معامل يونغ)10،11. يتم عرض النتائج كمتوسط ± الانحراف المعياري (SD) في الجدول 3.
تم إجراء الاستخراج الجراحي لهذه الهياكل وتقييم مرونتها ومقاومتها لتوفير تقريب كمي لدرجة الحفاظ على النموذج الحيوي بأكمله ومدى احتفاظه بخصائصه الميكانيكية الأصلية. استند اختيار هذه الهياكل التشريحية المحددة إلى حقيقة أن المعلمين والطلاب يتم التلاعب بالهياكل الوعائية والعصبية بشكل متكرر أثناء التشريح ، مما يشكل خطرا أكبر للتمزق.
لتقييم الخواص الميكانيكية للأنسجة البيولوجية الحيوانية ، تم تصميم طريقة تتضمن تعليق العينة بين مشابك ، مع توصيل أحد طرفيه بمحول قوة والآخر يتعرض لحمل متزايد من خلال التدفق المستمر للمياه. تم حساب القوة المبذولة مع الأخذ في الاعتبار كثافة الماء والجاذبية ، بينما تم قياس استطالة العينة مع زيادة الحمل. سهلت هذه القياسات تحديد معامل يونغ ، الذي يمثل تصلب الأنسجة ، بالإضافة إلى تحديد المقاومة القصوى لتطبيق قوة معينة ، مما يعكس قدرة الأنسجة على تحمل الأحمال قبل التمزق. توفر هذه الطريقة تقييما دقيقا للخصائص المرنة والقوة للأنسجة البيولوجية ، وهو أمر أساسي لفهم سلوكها الميكانيكي.
أظهرت الأعصاب المبهمة المحفوظة زيادة كبيرة في المقاومة والمرونة مقارنة بالعينات غير المحفوظة. على عكس التوقعات ، أظهر الشريان الأبهري المحفوظ مقاومة أقل قليلا ولكن زيادة معتدلة في المرونة مقارنة بالعينات غير المحفوظة. أدى الحفاظ على الوريد الأجوف إلى زيادة ملحوظة في كل من المقاومة والمرونة. تشير هذه النتائج إلى أن عملية الحفظ لها تأثير ملحوظ على الخواص الميكانيكية للأنسجة التي تم تقييمها ، مما يوفر رؤى قيمة لتطبيق هذه الأنسجة المحفوظة في الدراسات التشريحية.
يمتلك فريق أبحاث التشكل الذي طور هذا البروتوكول خبرة واسعة في الحفاظ على النماذج الحيوية للخنازير. لوحظ تحسن نوعي في نتائج الحفظ من حيث الخصائص الحسية للأنسجة بسبب التعديلات وتحسين التقنيات التقليدية المستخدمة سابقا ، مثل الحفظ بالفورمالين بنسبة 10٪. تستخدم النماذج الحيوية المحفوظة حاليا بنجاح في Universidad Icesi لدراسات التشكل وتدريس التشريح البشري المقارن لطلاب الطب. وصل النموذج ذو العمر الأطول في المختبر إلى 7 سنوات في درجة حرارة الغرفة دون الحاجة إلى غمر جديد أو عمليات إضافية. أظهرت تجربة التدريس أنه على الرغم من المستويات العالية من التلاعب من قبل الطلاب ، فإن النماذج الحيوية تحافظ على سلامة الهياكل التشريحية لمدة تصل إلى 4 سنوات بعد الحفظ.

الشكل 1: تدفق الدم والمحلول الحافظ عبر فتحتي الأنف. (أ) التدفق قبل التروية. (ب) التدفق أثناء التروية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: محيط الصدر قبل وبعد نضح محلول حافظة. (أ) محيط الصدر قبل التروية. (ب) محيط الصدر بعد التروية. لوحظت زيادة قدرها 4 سم في محيط الصدر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
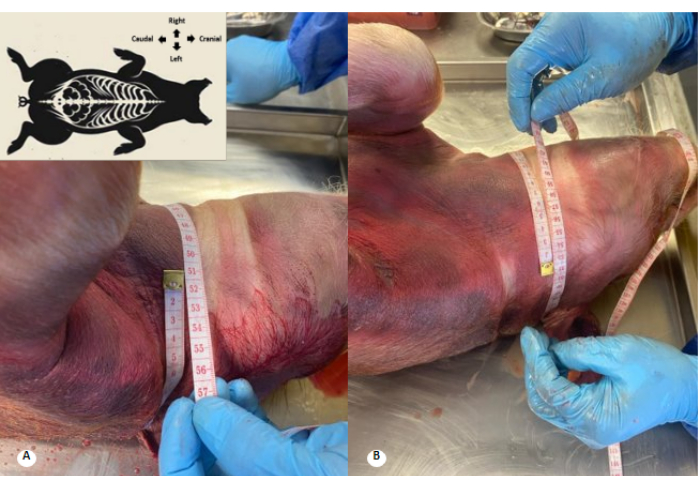
الشكل 3: محيط عنق الرحم قبل وبعد تروية محلول حافظة. (أ) محيط عنق الرحم قبل التروية. (ب) محيط عنق الرحم بعد التروية. لوحظت زيادة قدرها 1 سم في محيط عنق الرحم ومحو طيات عنق الرحم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
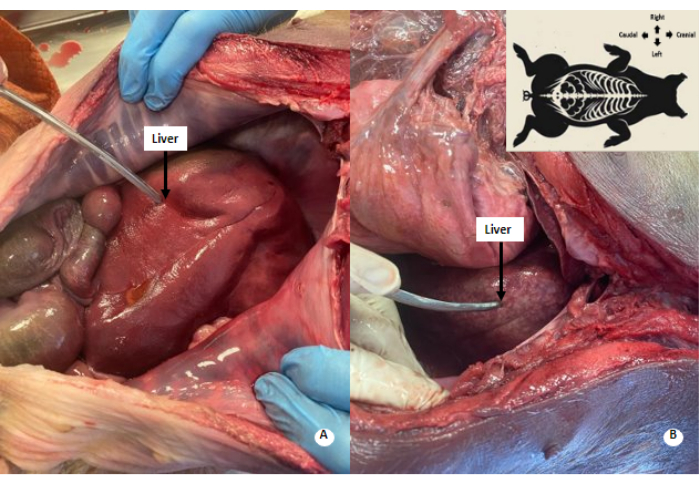
الشكل 4: نمط مرقش أبيض في الكبد. (أ) الكبد قبل التروية. (ب) الكبد بعد التروية. لوحظ نمط أبيض مرقش في الكبد المنفع. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: شحوب الحلقات المعوية. (أ) الأمعاء الدقيقة قبل التروية. (ب) الأمعاء الدقيقة بعد التروية. لوحظ شحوب الحلقات المعوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: النموذج الحيوي المستعمر بالفطريات. يظهر الجر البطني للوريد الأجوف السفلي استعمارا فطريا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: عضلة البطن المستعرضة ومرض الشلل الدماغي. (1) عضلة البطن المستعرضة. (2) سكتة الدماغية في عضلة البطن المستعرضة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: الصفاق الجداري للنموذج الحيوي للخنازير المحفوظة. (1) الصفاق الجدري. (2) الفص الأيسر من الكبد المقطع. (3) المعدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
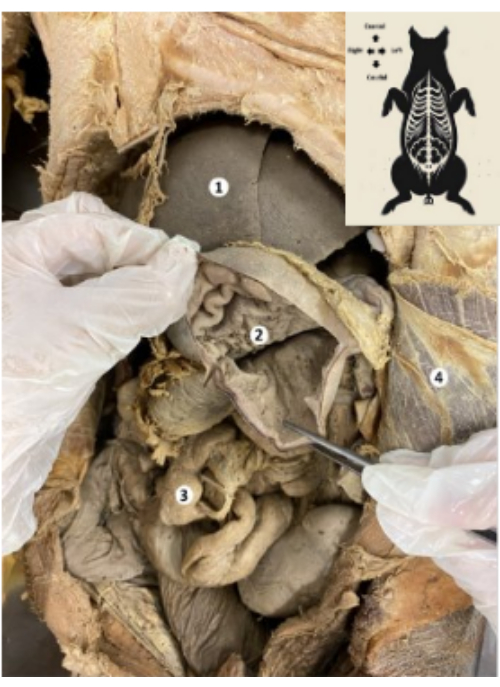
الشكل 9: معدة النموذج الحيوي للخنازير المحفوظة. (1) الكبد. (2) الغشاء المخاطي في المعدة. (3) الأمعاء. (4) عضلة البطن المستعرضة والصفاق الجداري الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
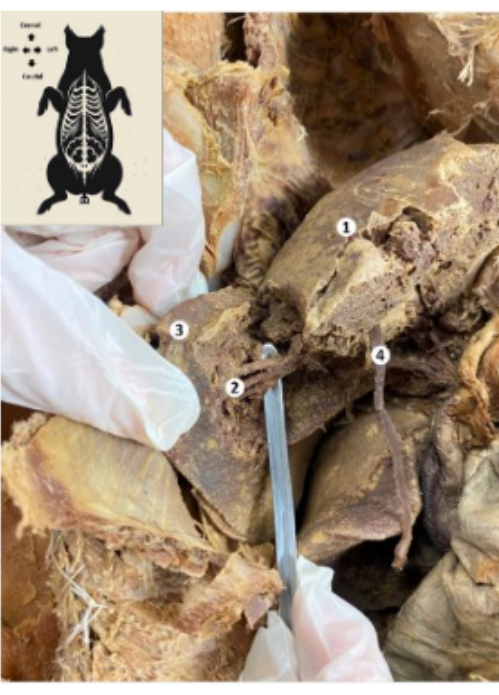
الشكل 10: كبد النموذج الحيوي للخنازير المحفوظة. (1) وجه الحجاب الحاجز للكبد. (2) الجزء الخلفي السفلي من الكبد (الشريان الكبدي ، القناة الصفراوية ، الفرع الخلفي السفلي للوريد البابي). (3) الفص الأيمن للكبد. (4) رباط الكبد المستدير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| رد الفعل | التركيز النهائي | كم | المجلد النهائي |
| الإيثانول 96٪ | 30% | 7.8 لتر | 25 لتر |
| الجليسرين | 20% | 5 لتر | |
| الفورمالديهايد 40٪ | 2% | 0.5 لتر | |
| كلوريد البنزالكونيوم 50٪ | 2% | 1 لتر | |
| جوهر عطري (قهوة) | 0.40% | 0.1 لتر | |
| ماء مقطر | غير أ | 10.6 لتر |
الجدول 1: محلول حافظة يعتمد على محلول تشيلي معدل.
| رد الفعل | التركيز النهائي | كم | المجلد النهائي |
| الإيثانول 96٪ | 30% | 7.8 لتر | 25 لتر |
| الجليسرين | 20% | 5 لتر | |
| كلوريد البنزالكونيوم 50٪ | 2% | 1 لتر | |
| جوهر عطري (قهوة) | 0.40% | 0.1 لتر | |
| ماء مقطر | غير أ | 11.1 لتر |
الجدول 2: محلول حافظ خال من الفورمالديهايد يعتمد على محلول تشيلي معدل.
| نسيج | غير محفوظة | الحفاظ | ||
| نيوتن ± SD* | معامل يونغ ± SD* | نيوتن ± SD* | معامل يونغ ± SD* | |
| العصب المبهم | 4.92 ± 0.98 | 879.5 ± 427.02 | 8.59 ± 0.83 | 1392.21 ± 729.6 |
| الشريان الأبهري | 9.33 ± 1.5 | 325.89 ± 176.15 | 8.48 ± 1.26 | 417.16 ± 379.95 |
| الوريد الأجوف | 5.73 ± 2.3 | 145.5 ± 40.89 | 8.92 ± 3.97 | 264.69 ± 188.72 |
الجدول 3: خصائص الأنسجة للعينات غير المحفوظة والمحفوظة من الهياكل التشريحية. * SD: الانحراف المعياري.
Discussion
تقليديا ، اعتمدت الدراسات التشريحية على الجثث البشرية. ومع ذلك ، أدت التحديات في الحصول على هذه العينات إلى استكشاف طرق بديلة. أثبتت النماذج الحيوية للخنازير أنها أدوات قيمة لدراسة علم التشريح البشري ، حيث تقدم أوجه تشابه تشريحية تسهل التعلم واستقراءه للتطبيقات الطبية في البشر12،13،14،15. على الرغم من أن تقنيات الحفاظ على الجثث قد تم وصفها تقليديا نوعيا ، إلا أن قياس قوة ومرونة الأنسجة المحفوظة باستخدام معامل يونغ يمكن أن يوفر دليلا كميا على درجة الحفظ. يستجيب البحث عن مناهج مبتكرة في الحفاظ على الأنسجة البيولوجية للحاجة إلى تسهيل استكشاف التعقيد التشريحي في النماذج الواقعية. لذلك ، يتم تقديم بروتوكول الحفاظ على النماذج الحيوية للخنازير التي تم تطويرها واستخدامها في مختبر التشريح التابع لجامعة Icesi كبديل قابل للتطبيق للحفاظ على الأنسجة والدراسة التشريحية اللاحقة.
بناء على التجربة ، يعد الاقتراب من دوران العينة من خلال الشريان الأورطي البطني في النماذج الحيوية للخنازير بديلا أكثر فاعلية مقارنة بالقنية الشريانية الفخذية ، والتي يتم إجراؤها بشكل شائع في الجثث البشرية16. دفعت الطبيعة الهشة لجدران الشرايين الفخذية الخنازير إلى تفضيل نهج البطن ، حيث أن هذه الجدران عرضة للتمزق من الضغط الذي تمارسه مضخة التروية. يعد تأمين نقطة دخول قابلة للحياة أمرا بالغ الأهمية ، حيث أن خطوة الملء في البروتوكول أمر بالغ الأهمية للحفاظ على العينة بأكملها بشكل مناسب. يشكل الامتلاء دون المستوى الأمثل خطرا كبيرا للتحلل. لذلك ، يجب تقييم علامات الامتلاء الناجحة قبل متابعة البروتوكول. تشمل هذه العلامات امتداد الأطراف العلوية والسفلية ، وتعدد عنق الرحم والصدر ، وجريان المحلول عبر الخياشيم بسبب نضح محلول الحفظ. التحدي الشائع الذي قد ينشأ أثناء تنفيذ هذا البروتوكول هو تمزق الشريان الأبهري أثناء تسريب المحلول الحافظ. في مثل هذه الحالات ، ينصح بربط الشريان والمضي قدما في تشريح الجزء العلوي لتسهيل القنية الثانوية واستئناف خطوة الامتلاء. بالإضافة إلى ذلك ، إذا ظهرت علامات التحلل في أي وقت أثناء البروتوكول ، فيجب التخلص من العينة بأكملها.
يتضمن المحلول الحافظ المستخدم في هذا البروتوكول اختلافات مقارنة بالمحلول التشيلي التقليدي ، مثل عدم وجود كلوريد الصوديوم ، وزيادة تركيز الإيثانول من 24٪ إلى 30٪ ، وزيادة تركيز الجلسرين من 16٪ إلى 20٪ ، وانخفاض في تركيز الفورمالديهايد من 3.7٪ إلى 2٪ ، واستبدال خلاصة الأوكالبتوس بخلاصة القهوة17.
تعد عملية إزالة الشكل خطوة حاسمة أخرى في البروتوكول ، حيث يقلل التشويه المناسب من تعرض الأفراد للفورمالديهايد ، بما في ذلك المعلمين والمختبرات والطلاب. بالإضافة إلى ذلك ، فإن عملية التليين بالجلسرين ضرورية للحصول على قوام مشابه لنسيج الأنسجة الطازجة. ينتج عن الحفظ التقليدي بالفورمالديهايد 10٪ أنسجة متيبسة تفقد مرونتها وتصبح أكثر عرضة للتمزق أثناء المناولة. ومع ذلك ، فإن استخدام المحلول التشيلي المعدل بتركيز منخفض للفورمالديهايد بنسبة 2٪ ، متبوعا بإزالة الشكل والتليين بالجلسرين ، يخفف من هذه المشكلة.
باتباع هذا البروتوكول ، تم تحقيق درجة عالية من المرونة عند التلاعب ، بينما أظهرت الأعضاء الصلبة ، مثل الكبد ، اتساقا ، على الرغم من ثباته ، يسمح بتشريح وتحديد هياكلها. ومع ذلك ، من الضروري إجراء مزيد من الدراسات الكمية لمقارنة جودة حفظ الأنسجة عبر تقنيات الحفظ المختلفة.
يجب مراعاة العديد من القيود المحتملة عند إجراء هذا البروتوكول. أولا ، يجب إيلاء اهتمام دقيق لحجم العينة ، مع نطاق موصى به من 15 إلى 20 كجم. قد تمثل الكبيرة تحديات في تنفيذ بروتوكول الحفظ وإدارة التخلص من النموذج الحيوي. ثانيا ، يجب أن يكون المختبر المخصص مجهزا بنظام مناسب لاستخراج البخار ومصيدة نفايات في نظام الصرف الصحي. يهدف هذا الاحتياط إلى التخفيف من تعرض الكوادر الفنية للأبخرة العضوية وتقليل التلوث البيئي الناتج عن المخلفات الناتجة أثناء عملية الحفظ. ثالثا ، يجب الاعتراف بالوجود المحتمل للمتغيرات التشريحية في النماذج الحيوية. بالإضافة إلى ذلك ، في حين أن عينات الخنازير تشترك في أوجه التشابه التشريحية مع البشر ، إلا أنها تظهر أيضا اختلافات. لذلك ، هناك ما يبرر النظر الدقيق في هذه الاختلافات في الدراسات التشريحية المقارنة.
تم التعامل مع تقييم الخصائص الحسية للأنسجة تقليديا نوعيا ، مع التركيز على خصائص مثل الرائحة واللون والصلابة والهشاشة وسهولة التعامل18. ومع ذلك ، هناك ندرة ملحوظة في الدراسات التي تهدف إلى تحديد هذه المعلمات بموضوعية. أحد الأمثلة على ذلك هو عمل HP Theeuwes ، الذي قارن حركة مفاصل الأطراف العلوية في الجثث المحفوظة بنسبة 11٪ من الفورمالين ، والأنسجة الطازجة ، وطريقة معدلة تجلد المفاصل لقياس القوة المطلوبة للثني5. في هذا السياق ، يقوم فريق البحث بتطوير طرق لتقييم الخصائص الميكانيكية للأنسجة بشكل موضوعي ، سعيا للتغلب على قيود التقييمات النوعية الحالية.
فيما يتعلق بالحفاظ على الجثث ، على الرغم من أن الفورمالين هو العامل الأكثر استخداما ، فقد تم أيضا استخدام العديد من المواد البديلة بنجاح. تشمل هذه المواد الجلوتارالديهايد ، أحادي إيثيلين جلايكول ، ثنائي إيثيلين جلايكول ، محاليل الإيثانول والجلسرين ، والأملاح المشبعة. يعكس تنوع طرق الحفظ السعي المستمر لتحسين الحفاظ على الأنسجة لأغراض البحث الطبي أو التعليم أو المعارض3،19. تسلط هذه التطورات الضوء على أهمية البحث في تطوير تقنيات حفظ أكثر فعالية للحفاظ على الخصائص الهيكلية والوظيفية للأنسجة البشرية على النحو الأمثل لفترات طويلة.
بالنسبة للتطبيقات المستقبلية ، فإن المستوى العالي الملحوظ من الحفاظ على الأنسجة باستخدام هذا البروتوكول يحمل وعدا كبيرا لتطوير البحث التشريحي والتعليم. تمتد إمكانات هذه الطريقة إلى الدراسات التشريحية المتقدمة ، مما يوفر نماذج واقعية للتدريب الجراحي ويساهم في تطوير المحاكاة الطبية الغامرة. بالإضافة إلى ذلك ، فإن قدرة البروتوكول على التكيف تفتح طرقا للاستكشاف في العينات التشريحية المتنوعة ، وبالتالي توسيع فائدته في مختلف السياقات الطبية والعلمية.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نعرب عن امتناننا لقسم العلوم الطبية الأساسية ومكتب البحوث في جامعة إيسيسي لدعمهم في هذا البحث.
Materials
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
References
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved