Method Article
Preservação de biomodelos suínos para o estudo da anatomia humana comparada
Neste Artigo
Resumo
Este artigo apresenta um protocolo para preservação de biomodelos suínos. O método proposto envolve a utilização de uma solução chilena modificada com concentração reduzida de formalina. O processo de preservação consiste na administração da solução por meio de repleção e imersão do espécime, seguida de deformolização e amolecimento dos tecidos com glicerina.
Resumo
O ensino da anatomia humana na educação médica enfrenta desafios, necessitando de alternativas eficazes para que os alunos explorem praticamente a complexidade anatômica. Os biomodelos suínos, com suas semelhanças anatômicas com os humanos, oferecem uma solução promissora. Este artigo apresenta um protocolo detalhado para preservação de biomodelos suínos, abordando a necessidade de métodos acessíveis e eficientes em estudos de anatomia comparada. Este protocolo propõe o uso de uma solução chilena modificada para preservação do biomodelo, empregando técnicas de formalização por repleção e imersão. Posteriormente, a desformalização é realizada usando a solução chilena modificada sem formaldeído, seguida por um processo de amolecimento da glicerina. Dada a escassez de literatura sobre técnicas de preservação e a ausência de um procedimento ou teste padronizado para avaliar a conservação dos tecidos, sugerimos avaliar a qualidade dos tecidos com base em medidas de resistência e elasticidade. Nossos achados indicam um nível qualitativamente alto de preservação de tecidos em nossos espécimes. Além disso, esses biomodelos são atualmente utilizados com sucesso para estudos de morfologia e no ensino de anatomia humana comparada para estudantes de medicina.
Introdução
O ensino de anatomia nas escolas médicas muitas vezes encontra obstáculos, como dificuldades de acesso a corpos humanos para dissecação e falta de instalações adequadas. Essas limitações ressaltam a necessidade de alternativas eficazes que permitam aos alunos explorar a complexidade anatômica de forma prática e realista. Nesse contexto, os biomodelos suínos têm surgido como uma alternativa promissora devido às suas semelhanças anatômicas com os humanos, oferecendo um meio acessível e eficiente de aprender e ensinar anatomia1.
As técnicas de preservação anatômica visam manter a integridade dos tecidos biológicos, minimizando os danos. Essas técnicas têm sido empregadas para fins educacionais, acadêmicos e de pesquisa no estudo da anatomia humana e veterinária. Numerosas substâncias foram testadas para preservar corpos, órgãos e tecidos em seu estado natural pelo maior tempo possível2. No entanto, preservar e conservar espécimes anatômicos permanece um desafio, principalmente para aqueles destinados a estudos morfológicos, onde é necessária alta preservação tecidual3.
Embora as soluções tradicionalmente utilizadas estejam amplamente disponíveis, as limitações na prática do dia-a-dia são evidentes. A formalina, uma das substâncias mais comumente usadas, tem várias desvantagens documentadas para a preservação do tecido. Isso inclui seu odor irritante, alta toxicidade, riscos associados de câncer e mutagenicidade para manipuladores e as alterações organolépticas que induz nos tecidos, como rigidez e descoloração. Essas alterações podem alterar a percepção das propriedades fisiológicas dos tecidos quando estudadas após a fixação, potencialmente dificultando estudos morfológicos precisos e acurados4. Estudos têm demonstrado que a fixação com altas concentrações de formalina resulta em maior grau de rigidez tecidual5. Alternativas, como a técnica de embalsamamento de Thiel, têm demonstrado resultados promissores com melhor conservação da coloração original e flexibilidade dos tecidos6. No entanto, essa técnica é mais cara em comparação com outras soluções7. Esses desafios apresentam uma oportunidade de projetar e testar técnicas de preservação novas e acessíveis que ainda permitem o ensino de anatomia de alta qualidade.
O objetivo deste protocolo é descrever a metodologia empregada no Laboratório de Anatomia da Universidad Icesi em Cali, Colômbia, para a preservação de biomodelos suínos utilizados como ferramentas educacionais para o estudo comparativo da anatomia humana.
Protocolo
A técnica descrita foi desenvolvida em total conformidade com as diretrizes do Comitê de Ética Institucional para o Cuidado e Uso de Animais em Experimentação (CIECUAE) da Universidad Icesi, de acordo com a Lei 84 de 1989 e a Resolução do Reitor nº 847 (9 de julho de 2012). Isso garante a integridade científica e o bem-estar dos animais utilizados, minimizando seu sofrimento. Suínos Landrace machos, com 3 meses de idade e pesando 15-20 kg, foram utilizados para este estudo. Os reagentes e equipamentos necessários estão listados na Tabela de Materiais.
1. Biomodelo suíno
- Sacrifício do animal
- Realize uma avaliação veterinária geral e coloque em quarentena o espécime de porco selecionado por 24 horas. Se o animal não apresentar nenhum sintoma durante este período, prossiga com a eutanásia.
- Anestesia
- Administrar anestesia por via intramuscular usando cetamina + xilazina + atropina nas doses de 10 mg/kg, 0,5 mg/kg e 0,04 mg/kg, respectivamente (seguindo protocolos aprovados institucionalmente).
NOTA: Garanta anestesia profunda. Avalie a profundidade da anestesia por meio do exame físico. A anestesia profunda é indicada por pupila dilatada e centrada, ausência do reflexo palpebral, depressão do reflexo corneano e diminuição da frequência respiratória, frequência cardíaca e pressão arterial.
- Administrar anestesia por via intramuscular usando cetamina + xilazina + atropina nas doses de 10 mg/kg, 0,5 mg/kg e 0,04 mg/kg, respectivamente (seguindo protocolos aprovados institucionalmente).
- Eutanásia
- Administre 5 mL de Pentobarbital / Difenilhidantoína de Sódio (390/50 mg / mL) por via intravenosa. Após a administração do agente de eutanásia, auscultar os parâmetros fisiológicos do animal para a espécie Suis Scrofa : HR, 60-90; FR, 8-18; e T° 37-39°C8.
- Monitore a frequência cardíaca até que ela diminua gradualmente e pare completamente. Observe mudanças imediatas, como relaxamento do esfíncter, membranas cianóticas e ausência de resposta a estímulos corporais. Considere a eutanásia completa após 5 minutos de ausculta cardíaca sem detectar batimentos cardíacos.
- Armazenamento e transporte
- Transporte o biomodelo suíno da sala de procedimentos para o laboratório de anatomia dentro de meia hora após a eutanásia para evitar a decomposição e proliferação microbiana, otimizando assim a conservação do biomodelo.
2. Solução conservante à base de solução chilena
- Preparação da solução chilena modificada
- Use uma solução chilena modificada contendo etanol, glicerina, formaldeído, cloreto de benzalcônio, essência aromática de café e água destilada. Certifique-se de que a solução tenha um pH de 7,0.
- Prepare a solução conservante em um tanque de 50 L. Primeiro, adicione 10,6 L de água destilada ao tanque. Em seguida, adicione 7,6 L de etanol a 96%, 5 L de glicerina, 0,5 L de cloreto de benzalcônio a 50% e 0,1 L de essência aromática de café.
NOTA: Consulte a Tabela 1 para obter as concentrações e volumes necessários de cada componente necessário para preparar 25 L da solução chilena modificada.
3. Administração da solução conservante chilena modificada
NOTA: Uma vez preparada a solução conservante, administre-a por meio de reposição e imersão.
- Administração por repleção da solução conservante chilena modificada
NOTA: Use roupas de biossegurança para este procedimento: meia máscara reutilizável com filtros A1P2, óculos de biossegurança, avental cirúrgico descartável de manga comprida, touca cirúrgica, leggings e luvas de nitrilo.- Abordagem cirúrgica
- Faça uma incisão ao longo da linha alba (usando um cabo de bisturi 4, lâmina 22) do processo xifóide até a região púbica.
- Identifique o tecido celular subcutâneo e as fibras musculares do músculo reto abdominal.
NOTA: No momento da incisão, identifique o escasso tecido adiposo aderido à pele, conhecido como tecido celular subcutâneo, e as fibras musculares do músculo reto abdominal localizadas maisprofundamente9. - Corte cuidadosamente para acessar o peritônio, garantindo sua abertura para a cavidade abdominal sem ferir o fígado e os intestinos, que serão expostos imediatamente.
- Retraia as alças intestinais para o lado direito da cavidade abdominal. Identifique o peritônio parietal que recobre o rim esquerdo e os vasos renais. Use essas estruturas vasculares para localizar a aorta abdominal.
- Encontre a emergência do pedículo renal esquerdo. Remova o peritônio que cobre a aorta 5 cm acima da artéria renal.
- Ao expor o pedículo renal esquerdo, mobilizar as alças intestinais e incisar o peritônio que cobre o hilo. Dissecar ântero-posteriormente para identificar primeiro a veia renal, que é maior e localizada anteriormente.
- Localize a artéria renal posteriormente, seguindo seu trajeto até sua origem na aorta abdominal. Por fim, identifique a pelve renal, a estrutura mais posterior do hilo9.
- Disseque cuidadosamente a parte posterior da aorta. Use seda 0/0 para ligar a aorta com um nó acima do nível da artéria renal e outro nó 5 cm acima.
- Clampeie a aorta imediatamente com dois grampos Kelly em ambas as extremidades do segmento aórtico isolado.
- Incisar a parede da aorta com a ponta de uma tesoura de Metzembaum, fazendo um corte de aproximadamente 0,3 cm na parede anterior da aorta, tomando cuidado para não perfurá-la.
- Dê um nó na extremidade distal enquanto remove o grampo de Kelly para inserir uma agulha em forma de L rombo de 3.2 mm no lúmen arterial. Remova a pinça de Kelly proximal e inicie a perfusão da solução de preservação chilena modificada.
- Perfusão aórtica da solução conservadora chilena modificada
- Proceder à perfusão da solução conservada chilena modificada.
NOTA: Administre 0.25 L/kg com uma pressão de 10 libras usando uma bomba de perfusão. - Fim da perfusão
- Quando a perfusão da solução conservante estiver completa, remova a cânula de perfusão e dê um nó no local de inserção com seda 0/0 para evitar o refluxo da solução conservante. Feche o abdômen suturando a incisão na linha alba com seda 0/0.
NOTA: Para avaliar se a perfusão adequada foi alcançada, verificar os indicadores agudos de saturação: extensão dos membros superiores e inferiores, pletora cervical e torácica e escoamento da solução pelas narinas. O tempo aproximado de perfusão é de 2 h.
- Quando a perfusão da solução conservante estiver completa, remova a cânula de perfusão e dê um nó no local de inserção com seda 0/0 para evitar o refluxo da solução conservante. Feche o abdômen suturando a incisão na linha alba com seda 0/0.
- Abordagem cirúrgica
- Administração por imersão
NOTA: Use roupas de biossegurança para este procedimento: meia máscara reutilizável com filtros A1P2, óculos de biossegurança, avental cirúrgico descartável de manga comprida, touca cirúrgica, leggings e luvas de nitrilo.- Administração por imersão da solução conservada chilena modificada
- Conservar a amostra de suíno num depósito de 300 L cheio da mesma solução conservante descrita no passo 2.
NOTA: Certifique-se de que o biomodelo esteja completamente imerso usando aproximadamente 150 L da solução. Após a imersão, armazenar o biomodelo a 20 °C durante 6 meses. Os indicadores de preservação adequada incluem a ausência de sinais de decomposição (por exemplo, edema corporal, inchaço, odor desagradável, lividez e friabilidade dos tecidos).
- Conservar a amostra de suíno num depósito de 300 L cheio da mesma solução conservante descrita no passo 2.
- Administração por imersão da solução conservada chilena modificada
4. Solução de deformolização baseada em solução chilena
- Preparação da solução de deformolização
- Use uma solução chilena modificada contendo etanol, glicerina, cloreto de benzalcônio, essência aromática de café e água destilada. Certifique-se de que a solução tenha um pH de 7,0.
- Preparar a solução de deformolização num depósito de 50 L. Primeiro, adicione 11,1 L de água destilada, depois 7,8 L de etanol a 96%, 5 L de glicerina, 1 L de cloreto de benzalcônio a 50% e 0,1 L de essência aromática de café.
NOTA: Consulte a Tabela 2 para obter as concentrações e volumes necessários de cada componente necessário para preparar 25 L da solução chilena modificada sem formaldeído.
5. Deformolização
NOTA: Use roupas de biossegurança para este procedimento: meia máscara reutilizável com filtros A1P2, óculos de biossegurança, avental cirúrgico descartável de manga comprida, touca cirúrgica, leggings e luvas de nitrilo.
- Administração por imersão da solução de conservação chilena modificada sem formaldeído
- Ao final do período de preservação por imersão de 6 meses, transfira o biomodelo para um tanque de 300 L cheio de solução de preservação chilena modificada sem formaldeído. Armazene o biomodelo por 4 semanas.
NOTA: Certifique-se de que o biomodelo esteja completamente imerso usando aproximadamente 150 L da solução.
- Ao final do período de preservação por imersão de 6 meses, transfira o biomodelo para um tanque de 300 L cheio de solução de preservação chilena modificada sem formaldeído. Armazene o biomodelo por 4 semanas.
6. Amolecimento da glicerina
- Imediatamente após o processo de deformolização, imergir o biomodelo em soluções com concentrações crescentes de glicerina diluída em água: 50%, 70% e 90% de glicerina. Manter o biomodelo em cada concentração durante uma semana.
Resultados
O objetivo deste protocolo é apresentar uma técnica eficaz e viável que permita a preservação de biomodelos suínos para o ensino de anatomia humana comparada. Atualmente, não existem métodos ou testes padronizados para avaliar a preservação do modelo. Portanto, a preservação geral do modelo foi avaliada por meio de indicadores de repleção da solução e sinais de decomposição após a conclusão do protocolo nos espécimes. Além disso, para avaliar objetivamente a viabilidade dos biomodelos para ensino e pesquisa, foi planejada uma comparação das características teciduais de estruturas anatômicas selecionadas, como resistência e elasticidade, antes e após a preservação. As estruturas anatômicas selecionadas foram o nervo vago, a artéria aórtica e a veia cava. Essas estruturas foram escolhidas porque nervos, artérias e veias são fundamentais no ensino e aprendizagem da anatomia macroscópica. Consequentemente, 4 nervos vagos, 4 artérias aórticas e 3 veias cava foram isolados de espécimes frescos e não preservados.
Assim, usando o protocolo apresentado, os corpos de 12 espécimes suínos foram preservados. Os biomodelos suínos preservados foram avaliados quanto à adequação da preservação por meio de indicadores de repleção, como extensão dos membros torácicos, sangue e saída de solução conservante pelas narinas (Figura 1), edema e aumento do perímetro torácico e cervical (Figura 2 e Figura 3), bem como o aparecimento de padrão mosqueado esbranquiçado no fígado (Figura 4) e palidez das alças intestinais (Figura 5). Todos os biomodelos exibiram indicadores bem-sucedidos de repleção. Após a conclusão do protocolo, nenhum dos biomodelos apresentou alterações associadas à decomposição, como distensão das alças intestinais, odor fétido ou friabilidade tecidual.
Após a inspeção dos biomodelos, ficou evidente que essa técnica preservou com sucesso os tecidos para manipulação e dissecção. Exemplos incluem músculos e suas aponeuroses (Figura 6), peritônio (Figura 7) e estômago e intestinos (Figura 8). Isso foi avaliado subjetivamente, pois todos esses órgãos mantiveram alta flexibilidade durante a manipulação. A consistência hepática, embora firme, permitiu a identificação dos ductos intra-hepáticos e sua vascularização associada após a dissecção (Figura 9 e Figura 10).
No entanto, os resultados nem sempre foram tão promissores. Antes do desenvolvimento do protocolo, a colonização fúngica dos biomodelos era um problema frequente. Isso possivelmente foi atribuído ao uso de uma técnica não padronizada para repleção e administração por imersão da solução conservante. A Figura 6 mostra um biomodelo que foi afetado pela colonização.
Além disso, para avaliar objetivamente a preservação dos tecidos, características específicas de interesse foram medidas em estruturas não preservadas e preservadas. Quatro nervos vagos, quatro artérias aórticas e três veias cava foram isolados de biomodelos preservados. As características medidas foram a resistência do tecido (quantificada como os newtons necessários para rasgar a estrutura) e a flexibilidade do tecido (medida pelo módulo de Young)10,11. Os resultados são apresentados como média ± desvio padrão (DP) na Tabela 3.
A extração cirúrgica dessas estruturas e a avaliação de sua elasticidade e resistência foram conduzidas para fornecer uma aproximação quantitativa do grau de preservação de todo o biomodelo e quão bem ele manteve suas propriedades mecânicas originais. A seleção dessas estruturas anatômicas específicas foi baseada no fato de que as estruturas vasculares e nervosas são mais frequentemente manipuladas por professores e alunos durante a dissecção, apresentando maior risco de ruptura.
Para avaliar as propriedades mecânicas dos tecidos biológicos animais, foi projetado um método que envolvia a suspensão da amostra entre dois grampos, com uma extremidade conectada a um transdutor de força e a outra extremidade submetida a uma carga crescente por meio de um fluxo constante de água. A força exercida foi calculada considerando a densidade da água e a gravidade, enquanto o alongamento da amostra foi medido com o aumento da carga. Essas medidas facilitaram a determinação do módulo de Young, representando a rigidez tecidual, bem como a identificação da resistência máxima à aplicação de uma força específica, refletindo a capacidade do tecido de suportar cargas antes da ruptura. Este método fornece uma avaliação precisa das propriedades elásticas e de resistência dos tecidos biológicos, o que é fundamental para a compreensão de seu comportamento mecânico.
Os nervos vagos preservados demonstraram um aumento significativo na resistência e elasticidade em comparação com os espécimes não preservados. Ao contrário do esperado, a artéria aórtica preservada exibiu resistência ligeiramente menor, mas um aumento moderado na elasticidade em comparação com espécimes não preservados. A preservação da veia cava resultou em um aumento notável na resistência e elasticidade. Esses achados indicam que o processo de preservação tem um impacto perceptível nas propriedades mecânicas dos tecidos avaliados, fornecendo informações valiosas para a aplicação desses tecidos preservados em estudos anatômicos.
A equipe de pesquisa em morfologia que desenvolveu este protocolo possui ampla experiência na preservação de biomodelos suínos. Observou-se uma melhora qualitativa nos resultados de preservação em termos das propriedades organolépticas dos tecidos devido a modificações e otimização de técnicas convencionais anteriormente utilizadas, como a preservação com formalina a 10%. Os biomodelos preservados são atualmente usados com sucesso na Universidad Icesi para estudos de morfologia e ensino de anatomia humana comparada para estudantes de medicina. O modelo com maior vida útil em laboratório atingiu 7 anos em temperatura ambiente sem exigir novas imersões ou processos adicionais. A experiência de ensino mostrou que, apesar dos altos níveis de manipulação pelos alunos, os biomodelos mantêm a integridade das estruturas anatômicas por até 4 anos após a preservação.

Figura 1: Fluxo de sangue e solução conservante pelas narinas. (A) Fluxo de saída antes da perfusão. (B) Fluxo de saída durante a perfusão. Clique aqui para ver uma versão maior desta figura.

Figura 2: Perímetro torácico antes e após a perfusão da solução conservante. (A) Perímetro torácico antes da perfusão. (B) Perímetro torácico após perfusão. Observa-se um aumento de 4 cm no perímetro torácico. Clique aqui para ver uma versão maior desta figura.
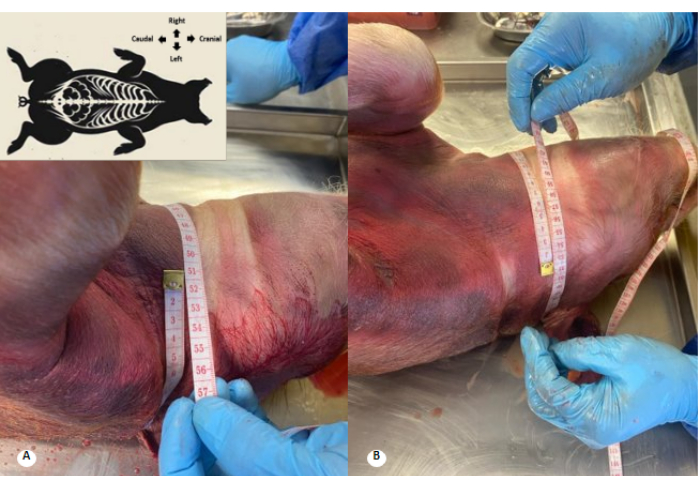
Figura 3: Perímetro cervical antes e após a perfusão da solução conservante. (A) Perímetro cervical antes da perfusão. (B) Perímetro cervical após a perfusão. Observa-se um aumento de 1 cm no perímetro cervical e apagamento das pregas cervicais. Clique aqui para ver uma versão maior desta figura.
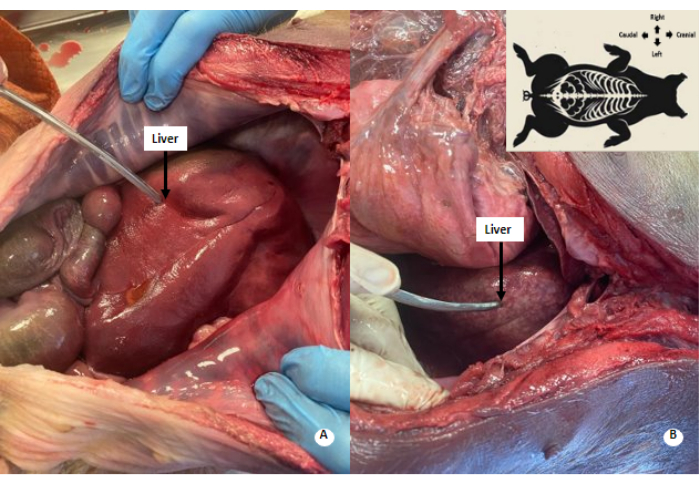
Figura 4: Padrão esbranquiçado manchado no fígado. (A) Fígado antes da perfusão. (B) Fígado após perfusão. Um padrão esbranquiçado-mosqueado é observado no fígado perfundido. Clique aqui para ver uma versão maior desta figura.

Figura 5: Palidez das alças intestinais. (A) Intestino delgado antes da perfusão. (B) Intestino delgado após perfusão. Observa-se palidez das alças intestinais. Clique aqui para ver uma versão maior desta figura.

Figura 6: Biomodelo colonizado por fungo. A tração ventral da veia cava inferior mostra colonização fúngica. Clique aqui para ver uma versão maior desta figura.

Figura 7: Músculo transverso do abdome e sua aponeurose. (1) Músculo transverso do abdome. (2) Aponeurose do músculo transverso do abdome. Clique aqui para ver uma versão maior desta figura.

Figura 8: Peritônio parietal do biomodelo suíno preservado. (1) Peritônio parietal. (2) Lobo esquerdo do fígado seccionado. (3) Estômago. Clique aqui para ver uma versão maior desta figura.
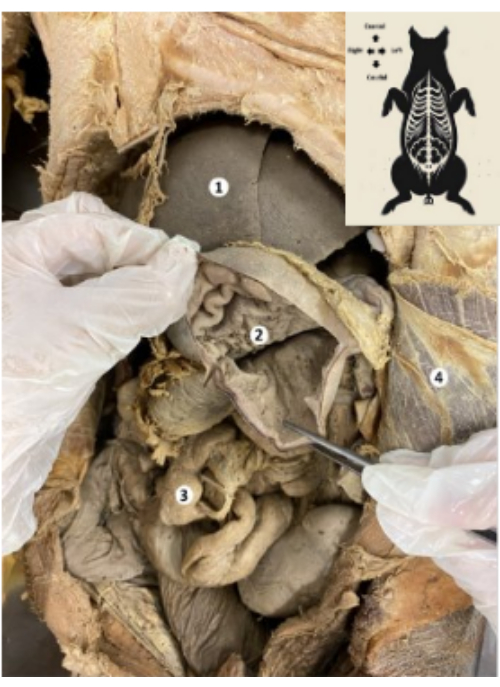
Figura 9: Estômago do biomodelo suíno preservado. (1) Fígado. (2) Mucosa gástrica. (3) Intestinos. (4) Músculo transverso do abdome e peritônio parietal. Clique aqui para ver uma versão maior desta figura.
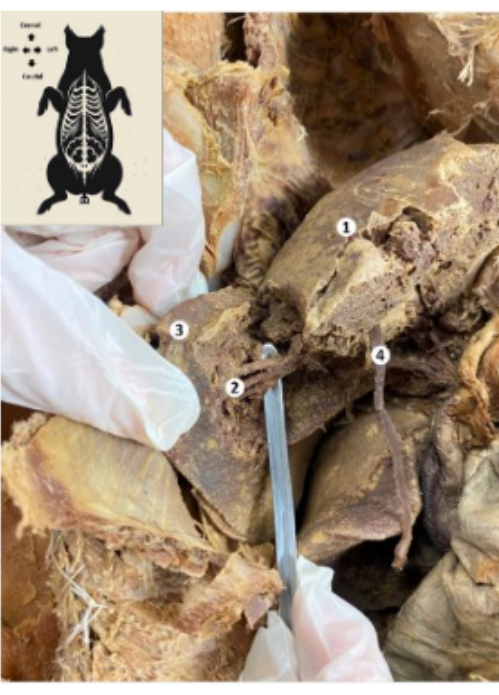
Figura 10: Fígado do biomodelo suíno preservado. (1) Face diafragmática do fígado. (2) Segmento posterior inferior do fígado (artéria hepática, ducto biliar, ramo posterior inferior da veia porta). (3) Lobo direito do fígado. (4) Ligamento redondo do fígado. Clique aqui para ver uma versão maior desta figura.
| Reativo | Concentração final | Quantidade | Volume final |
| Etanol 96% | 30% | 7,8 L | 25 L |
| Glicerina | 20% | 5L | |
| Formaldeído 40% | 2% | 0,5 L | |
| Cloreto de benzalcônio 50% | 2% | 1 L | |
| Essência aromática (Café) | 0.40% | 0,1 L | |
| Água destilada | NA | 10,6 L |
Tabela 1: Solução conservante à base de uma solução chilena modificada.
| Reativo | Concentração final | Quantidade | Volume final |
| Etanol 96% | 30% | 7,8 L | 25 L |
| Glicerina | 20% | 5L | |
| Cloreto de benzalcônio 50% | 2% | 1 L | |
| Essência aromática (Café) | 0.40% | 0,1 L | |
| Água destilada | NA | 11,1 L |
Tabela 2: Solução conservante sem formaldeído à base de uma solução chilena modificada.
| Tecido | Não preservado | Preservado | ||
| Newton ± SD* | Módulo de Young ± SD* | Newton ± SD* | Módulo de Young ± SD* | |
| Nervo vago | 4,92 ± 0,98 | 879,5 ± 427,02 | 8,59 ± 0,83 | 1392,21 ± 729,6 |
| Artéria aórtica | 9,33 ± 1,5 | 325,89 ± 176,15 | 8,48 ± 1,26 | 417,16 ± 379,95 |
| Veia cava | 5,73 ± 2,3 | 145,5 ± 40,89 | 8,92 ± 3,97 | 264,69 ± 188,72 |
Tabela 3: Características teciduais de espécimes não preservados e preservados de estruturas anatômicas. *DP: Desvio padrão.
Discussão
Tradicionalmente, os estudos anatômicos se baseiam em cadáveres humanos; no entanto, os desafios na aquisição desses espécimes levaram à exploração de métodos alternativos. Os biomodelos suínos provaram ser ferramentas valiosas para o estudo da anatomia humana, oferecendo semelhanças anatômicas que facilitam o aprendizado e sua extrapolação para aplicações médicas em humanos 12,13,14,15. Embora as técnicas de preservação de cadáveres tenham sido tradicionalmente descritas qualitativamente, medir a força e a elasticidade dos tecidos preservados usando o módulo de Young pode fornecer evidências quantitativas do grau de preservação. A busca por abordagens inovadoras na preservação de tecidos biológicos responde à necessidade de facilitar a exploração da complexidade anatômica em modelos realistas. Portanto, o protocolo de preservação de biomodelos suínos desenvolvido e utilizado no Laboratório de Anatomia da Universidad Icesi apresenta-se como uma alternativa viável para preservação tecidual e posterior estudo anatômico.
Com base na experiência, abordar a circulação do espécime através da aorta abdominal em biomodelos suínos é uma alternativa mais eficaz em comparação com a canulação arterial femoral, que é comumente realizada em cadáveres humanos16. A natureza frágil das paredes arteriais femorais porcinas tem levado a uma preferência pela abordagem abdominal, pois essas paredes são suscetíveis à ruptura devido à pressão exercida pela bomba de perfusão. Garantir um ponto de entrada viável é crucial, pois a etapa de repleção no protocolo é crítica para a preservação adequada de todo o espécime. A reposição abaixo do ideal representa um alto risco de decomposição. Portanto, os sinais de reposição bem-sucedidos devem ser avaliados antes de continuar com o protocolo. Esses sinais incluem a extensão dos membros superiores e inferiores, pletora cervical e torácica e escoamento da solução pelas narinas devido à perfusão da solução preservadora. Um desafio comum que pode surgir durante a execução deste protocolo é a ruptura da artéria aórtica durante a infusão da solução preservadora. Nesses casos, é aconselhável ligar a artéria e proceder à dissecção de um segmento superior para facilitar a canulação secundária e retomar a etapa de repleção. Além disso, se sinais de decomposição se tornarem aparentes em qualquer ponto durante o protocolo, todo o espécime deve ser descartado.
A solução conservante utilizada neste protocolo inclui variações em relação à solução convencional chilena, como a ausência de cloreto de sódio, aumento da concentração de etanol de 24% para 30%, aumento da concentração de glicerina de 16% para 20%, diminuição da concentração de formaldeído de 3,7% para 2% e substituição da essência de eucalipto por essência de café17.
O processo de deformolização é outra etapa crucial do protocolo, pois a deformolização adequada reduz a exposição do pessoal ao formaldeído, incluindo professores, laboratórios e alunos. Além disso, o processo de amolecimento com glicerina é essencial para obter uma textura semelhante à dos tecidos frescos. A preservação convencional com 10% de formaldeído resulta em tecidos rígidos que perdem elasticidade e se tornam mais propensos a rasgar durante o manuseio. No entanto, o uso da solução chilena modificada com uma concentração reduzida de formaldeído de 2%, seguida de deformolização e amolecimento com glicerina, atenua esse problema.
Seguindo esse protocolo, um alto grau de flexibilidade foi alcançado na manipulação, enquanto órgãos sólidos, como o fígado, exibiram uma consistência que, embora firme, permitiu a dissecção e identificação de suas estruturas. No entanto, mais estudos quantitativos são necessários para comparar a qualidade de preservação dos tecidos em diferentes técnicas de preservação.
Várias limitações potenciais devem ser consideradas ao conduzir este protocolo. Em primeiro lugar, atenção meticulosa deve ser dada ao tamanho da amostra, com uma faixa recomendada de 15-20 kg. Animais maiores podem apresentar desafios na execução do protocolo de preservação e no gerenciamento da disposição do biomodelo. Em segundo lugar, o laboratório designado deve estar equipado com um sistema de extracção de vapor adequado e um coletor de resíduos no sistema de esgotos. Essa precaução visa mitigar a exposição do pessoal técnico aos vapores orgânicos e minimizar a contaminação ambiental decorrente dos resíduos produzidos durante o processo de preservação. Em terceiro lugar, a presença potencial de variantes anatômicas nos biomodelos deve ser reconhecida. Além disso, embora os espécimes suínos compartilhem semelhanças anatômicas com os humanos, eles também exibem diferenças. Portanto, a consideração cuidadosa de tais variações é necessária em estudos anatômicos comparativos.
A avaliação das propriedades organolépticas dos tecidos tem sido tradicionalmente abordada qualitativamente, com foco em características como odor, cor, rigidez, fragilidade e facilidade de manuseio18. No entanto, há uma notável escassez de estudos com o objetivo de determinar esses parâmetros de forma objetiva. Um exemplo é o trabalho de HP Theeuwes, que comparou a mobilidade das articulações dos membros superiores em cadáveres preservados com formol a 11%, tecido fresco e um método modificado que imobilizou as articulações para medir a força necessária para a flexão5. Nesse contexto, a equipe de pesquisa está desenvolvendo métodos para avaliar objetivamente as propriedades mecânicas dos tecidos, buscando superar as limitações das avaliações qualitativas existentes.
Em termos de preservação de cadáveres, embora a formalina seja o agente mais comumente usado, várias substâncias alternativas também têm sido usadas com sucesso. Essas substâncias incluem glutaraldeído, monoetilenoglicol, dietilenoglicol, soluções de etanol-glicerina e sais saturados. A diversidade de métodos de preservação reflete a busca contínua para otimizar a preservação de tecidos para fins de pesquisa médica, educacional ou de exposição 3,19. Esses avanços destacam a importância da pesquisa no desenvolvimento de técnicas de preservação mais eficazes para manter as propriedades estruturais e funcionais dos tecidos humanos de maneira ideal por longos períodos.
Para aplicações futuras, o alto nível observado de preservação de tecidos com este protocolo é uma promessa significativa para o avanço da pesquisa e educação anatômica. O potencial deste método se estende a estudos anatômicos avançados, fornecendo modelos realistas para treinamento cirúrgico e contribuindo para o desenvolvimento de simulações médicas imersivas. Além disso, a adaptabilidade do protocolo abre caminhos para a exploração em diversos espécimes anatômicos, expandindo assim sua utilidade em vários contextos médicos e científicos.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
A gratidão é estendida ao Departamento de Ciências Médicas Básicas e ao Escritório de Pesquisa da Universidad Icesi por seu apoio nesta pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
Referências
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados