Method Article
保存猪生物模型用于比较人体解剖学研究
摘要
本文提出了一种保存猪生物模型的方案。所提出的方法涉及使用福尔马林浓度降低的改性智利溶液。保存过程包括通过填充和浸泡标本来施用溶液,然后使用甘油进行变形和组织软化。
摘要
医学教育中的人体解剖学教学面临挑战,需要有效的替代方案让学生实际探索解剖学的复杂性。猪生物模型在解剖学上与人类相似,提供了一个很有前途的解决方案。本文提出了保存猪生物模型的详细方案,解决了比较解剖学研究中对可访问和有效方法的需求。该协议建议使用改良的智利解决方案进行生物模型保存,通过填充和浸泡采用形式化技术。随后,使用不含甲醛的改性智利溶液实现变形,然后进行甘油软化过程。鉴于关于保存技术的文献稀缺,并且缺乏评估组织保存的标准化程序或测试,我们建议根据阻力和弹性的测量来评估组织质量。我们的研究结果表明,我们的标本中的组织保存质量很高。此外,这些生物模型目前已成功用于形态学研究和向医学生教授人体比较解剖学。
引言
医学院的解剖学教学经常遇到障碍,例如难以进入人体进行解剖和缺乏合适的设施。这些限制强调了对有效替代方案的需求,使学生能够实际和现实地探索解剖复杂性。在这种情况下,猪生物模型因其解剖学与人类的相似性而成为一种很有前途的替代品,提供了一种可访问且有效的学习和教授解剖学1 的方法。
解剖保存技术旨在保持生物组织的完整性,同时最大限度地减少损伤。这些技术已用于人体和兽医解剖学研究的教育、学术和研究目的。许多物质已经过测试,可以尽可能长时间地保持身体、器官和组织的自然状态2。然而,保存和保存解剖标本仍然具有挑战性,特别是对于那些用于形态学研究的标本,其中需要高度组织保存3。
尽管传统使用的解决方案已广泛使用,但日常实践中的局限性是显而易见的。福尔马林是最常用的物质之一,在组织保存方面有几个记录的缺点。这些包括其刺激性气味、高毒性、处理者的相关癌症和致突变性风险,以及它在组织中引起的感官变化,例如僵硬和变色。固定后研究时,这些变化会改变对组织生理特性的感知,从而可能阻碍精确和准确的形态学研究4。研究表明,用高浓度的福尔马林固定会导致更大程度的组织僵硬5。替代方案,例如 Thiel 防腐技术,已经显示出有希望的结果,可以更好地保留原始颜色和组织的柔韧性6。但是,与其他解决方案相比,这种技术的成本更高7。这些挑战为设计和测试新的、经济实惠的保存技术提供了机会,这些技术仍然能够实现高质量的解剖学教学。
该协议的目的是描述哥伦比亚卡利 Universidad Icesi 解剖学实验室采用的方法,用于保存用作人体解剖学比较研究教育工具的猪生物模型。
研究方案
所述技术是根据 1989 年第 84 号法律和校长第 847 号决议(2012 年 7 月 9 日)完全按照 Icesi 大学实验动物护理和使用机构伦理委员会 (CIECUAE) 的指导方针开发的。这既确保了科学的完整性,又保证了所用动物的福利,最大限度地减少了它们的痛苦。本研究使用 3 个月大、体重 15-20 公斤的雄性长白猪。所需的试剂和设备列在 材料表中。
1. 猪生物模型
- 动物的牺牲
- 进行一般兽医评估并将选定的猪标本隔离 24 小时。如果动物在此期间没有出现任何症状,请继续进行安乐死。
- 麻醉
- 使用氯胺酮 + 甲苯噻嗪 + 阿托品肌肉注射麻醉,剂量分别为 10 mg/kg、0.5 mg/kg 和 0.04 mg/kg(遵循机构批准的方案)。
注意:确保深度麻醉。通过体格检查评估麻醉深度。深度麻醉表现为瞳孔放大和居中、睑瓣反射消失、角膜反射抑制以及呼吸频率、心率和血压降低。
- 使用氯胺酮 + 甲苯噻嗪 + 阿托品肌肉注射麻醉,剂量分别为 10 mg/kg、0.5 mg/kg 和 0.04 mg/kg(遵循机构批准的方案)。
- 安乐死
- 静脉注射 5 mL 戊巴比妥钠/二苯乙内酰脲 (390/50 mg/mL)。施用安乐死剂后,听诊动物的 Suis Scrofa 物种生理参数:HR,60-90;FR,8-18;和 T° 37-39°C8.
- 监测心率,直到心率逐渐降低并完全停止。观察到即时变化,例如括约肌松弛、紫绀膜和对身体刺激无反应。考虑在心脏听诊 5 分钟后完成安乐死,未检测到心跳。
- 储运
- 在安乐死后半小时内将猪生物模型从手术室运送到解剖实验室,以防止分解和微生物增殖,从而优化生物模型的保存。
2. 基于智利溶液的防腐剂溶液
- 改性智利溶液的制备
- 使用含有乙醇、甘油、甲醛、苯扎氯铵、咖啡芳香精和蒸馏水的改性智利溶液。确保溶液的 pH 值为 7.0。
- 在 50 L 罐中制备保存溶液。首先,向水箱中加入 10.6 L 蒸馏水。接下来,加入 7.6 L 96% 乙醇、5 L 甘油、0.5 L 50% 苯扎氯铵和 0.1 L 咖啡芳香精。
注:有关制备 25 L 改性智利溶液所需的每种组分的浓度和体积,请参阅 表 1 。
3. 改性智利防腐剂溶液的给药
注意:准备好防腐剂溶液后,通过填充和浸泡进行给药。
- 通过补充改性智利防腐剂溶液给药
注意:在此过程中使用生物安全服:带有 A1P2 过滤器的可重复使用的半面罩、生物安全护目镜、一次性长袖手术衣、手术帽、绑腿和丁腈手套。- 手术方法
- 沿着白线(使用手术刀手柄 4,刀片 22)从剑突到耻骨区域切开。
- 识别腹直肌的皮下细胞组织和肌纤维。
注意:在切口的那一刻,识别粘附在皮肤上的少量脂肪组织,称为皮下细胞组织,以及位于更深处的腹直肌肌纤维9. - 小心切割以进入腹膜,确保其通向腹腔开口,而不会伤害肝脏和肠道,肝脏和肠道将立即暴露出来。
- 将肠袢缩回腹腔右侧。识别覆盖在左肾和肾血管上的壁层腹膜。使用这些血管结构来定位腹主动脉。
- 找到左肾蒂的出现。去除覆盖肾动脉上方 5 cm 的主动脉的腹膜。
- 暴露左肾蒂后,动员肠袢并切开覆盖肺门的腹膜。前后解剖,首先识别肾静脉,肾静脉更大且位于前部。
- 沿着其轨迹到腹主动脉的起点,将肾动脉向后定位。最后,确定肾盂,这是9 号肺门的最后部结构。
- 仔细解剖主动脉的后部。使用 0/0 丝结扎主动脉,在肾动脉水平上方打一个结,在肾动脉上方打一个结,在肾动脉上方打一个结。
- 立即在隔离的主动脉段的两端用两个凯利夹夹住主动脉。
- 用 Metzembaum 剪刀的尖端切开主动脉壁,在主动脉前壁上切开约 0.3 厘米,注意不要穿孔。
- 在取下凯利夹的同时打结远端,将 3.2 毫米钝的 L 形针插入动脉管腔。取下近端凯利夹,开始灌注改良的智利保存液。
- 改良智利保留液的主动脉灌注
- 继续灌注改性的智利保存液。
注:使用灌注泵以 0.25 磅的压力施用 10 L/kg。 - 灌注结束
- 保存液灌注完成后,取出灌注套管并用 0/0 丝打结插入部位,以防止保存液回流。用 0/0 丝缝合白线的切口,闭合腹部。
注意:要评估是否达到足够的灌注,请检查急性饱和度指标:上肢和下肢的伸展、宫颈和胸部多血以及溶液通过鼻孔的流出。大约灌注时间为 2 小时。
- 保存液灌注完成后,取出灌注套管并用 0/0 丝打结插入部位,以防止保存液回流。用 0/0 丝缝合白线的切口,闭合腹部。
- 手术方法
- 浸泡给药
注意:在此过程中使用生物安全服:带有 A1P2 过滤器的可重复使用的半面罩、生物安全护目镜、一次性长袖手术衣、手术帽、绑腿和丁腈手套。- 通过浸泡改性智利保存液给药
- 将猪标本储存在装满步骤 2 中描述的相同防腐剂溶液的 300 L 水箱中。
注意:确保使用大约 150 L 的溶液将生物模型完全浸入。浸泡后,将生物模型在 20 °C 下储存 6 个月。充分保存的指标包括无分解迹象(例如,体水肿、肿胀、恶臭、组织模糊和易碎)。
- 将猪标本储存在装满步骤 2 中描述的相同防腐剂溶液的 300 L 水箱中。
- 通过浸泡改性智利保存液给药
4. 基于智利解决方案的变形解决方案
- 脱模液的制备
- 使用含有乙醇、甘油、苯扎氯铵、咖啡芳香精和蒸馏水的改性智利溶液。确保溶液的 pH 值为 7.0。
- 在 50 L 罐中准备变形溶液。首先,加入 11.1 升蒸馏水,然后加入 7.8 升 96% 乙醇、5 升甘油、1 升 50% 苯扎氯铵和 0.1 升咖啡芳香精。
注:有关制备 2 L 无甲醛改性智利溶液所需的每种组分的所需浓度和体积,请参阅 表 25 。
5. 变形
注意:在此过程中使用生物安全服:带有 A1P2 过滤器的可重复使用的半面罩、生物安全护目镜、一次性长袖手术衣、手术帽、绑腿和丁腈手套。
- 通过浸泡无甲醛改性智利保存液给药
- 在 6 个月的浸泡保存期结束时,将生物模型转移到装满无甲醛改性智利保存液的 300 L 水箱中。将生物模型储存 4 周。
注意:确保使用大约 150 L 的溶液将生物模型完全浸入。
- 在 6 个月的浸泡保存期结束时,将生物模型转移到装满无甲醛改性智利保存液的 300 L 水箱中。将生物模型储存 4 周。
6. 甘油软化
- 脱模过程后,立即将生物模型浸入水中稀释的甘油浓度增加的溶液中:50%、70% 和 90% 甘油。将生物模型保持在每种浓度中一周。
结果
该协议的目标是提出一种有效且可行的技术,该技术允许保存猪生物模型用于比较人体解剖学教学。目前没有标准化的方法或测试来评估模型保留。因此,在对标本完成方案后,使用溶液填充指标和分解迹象来评估模型的整体保存情况。此外,为了客观评估生物模型在教学和研究方面的可行性,计划在保存前后比较选定解剖结构的组织特征,例如阻力和弹性。选定的解剖结构是迷走神经、主动脉和腔静脉。选择这些结构是因为神经、动脉和静脉是大体解剖学教学和学习的基础。因此,从新鲜、未保存的标本中分离出 4 条迷走神经、4 条主动脉和 3 条腔静脉。
因此,使用提出的方案,保存了 12 个猪标本的尸体。使用补充指标评估保存的猪生物模型的保存充分性,例如前肢的伸展、血液和从鼻孔流出的防腐剂溶液(图 1)、水肿以及胸部和宫颈周边的增加(图 2 和 图 3),以及肝脏中出现白色斑驳图案(图 4)和肠袢苍白(图 5).所有生物模型都表现出成功的补充指标。完成方案后,没有一个生物模型显示出与分解相关的变化,例如肠袢膨胀、恶臭或组织脆性。
在检查生物模型后,很明显这项技术成功地保存了用于作和解剖的组织。例子包括肌肉及其腱膜(图 6)、腹膜(图 7)以及胃和肠道(图 8)。这是主观评估的,因为所有这些器官在作过程中都保持了高度的灵活性。肝脏的一致性虽然坚硬,但允许在解剖后识别肝内导管及其相关的血管形成(图 9 和 图10)。
然而,结果并不总是那么有希望。在制定方案之前,生物模型的真菌定植是一个常见的问题。这可能是由于使用非标准化技术通过浸泡保存溶液进行填充和给药。 图 6 显示了受定植影响的生物模型。
此外,为了客观地评估组织的保存情况,在未保存和保存的结构中测量了感兴趣的特定特征。从保存的生物模型中分离出 4 条迷走神经、4 条主动脉和 3 条腔静脉。测量的特性是组织的电阻(量化为撕裂结构所需的牛顿)和组织的柔韧性(使用 Young 模量测量)10,11。结果在表 3 中以平均值±标准差 (SD) 表示。
对这些结构进行手术提取并评估其弹性和阻力,以提供整个生物模型的保存程度及其保持其原始机械性能的程度的定量近似值。选择这些特定的解剖结构是基于这样一个事实,即血管和神经结构在解剖过程中最常被老师和学生纵,因此具有更大的破裂风险。
为了评估动物生物组织的机械性能,设计了一种方法,该方法涉及将样品悬浮在两个夹具之间,一端连接到力传感器,另一端通过恒定的水流承受增加的负载。施加的力是考虑水的密度和重力计算的,而样品的伸长率是随着载荷的增加而测量的。这些测量有助于确定杨氏模量(代表组织刚度),以及确定对施加特定力的最大阻力,这反映了组织在破裂前承受负荷的能力。这种方法提供了对生物组织的弹性和强度特性的准确评估,这对于理解其机械行为至关重要。
与未保存的标本相比,保存的迷走神经表现出阻力和弹性的显着增加。与预期相反,与未保存的标本相比,保存的主动脉的阻力略低,但弹性适度增加。腔静脉的保留导致阻力和弹性显着增加。这些发现表明,保存过程对评估组织的机械性能有明显的影响,为这些保存的组织在解剖学研究中的应用提供了有价值的见解。
开发该方案的形态学研究团队在猪生物模型的保存方面拥有丰富的经验。由于对以前使用的常规技术的修改和优化,例如使用 10% 福尔马林进行保存,在组织的感官特性方面观察到保存结果的质量改善。保存的生物模型目前在 Universidad Icesi 成功用于医学生的形态学研究和人体比较解剖学教学。实验室中使用寿命最长的型号在室温下已达到 7 年,无需新的浸泡或额外的过程。教学经验表明,尽管学生进行了高水平的作,但生物模型在保存后仍能保持解剖结构的完整性长达 4 年。

图 1:血液和防腐剂溶液通过鼻孔流出。 (A) 灌注前的流出。(B) 灌注过程中的流出。 请单击此处查看此图的较大版本。

图 2:防腐剂溶液灌注前后的胸椎周长。 (A) 灌注前的胸椎周长。(B) 灌注后的胸椎周边。观察到胸椎周长增加 4 cm。 请单击此处查看此图的较大版本。
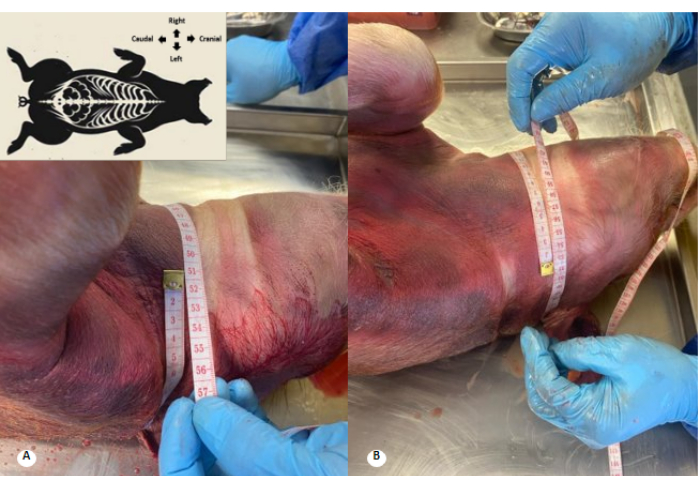
图 3:防腐剂溶液灌注前后的宫颈周长。 (A) 灌注前的宫颈周长。(B) 灌注后的宫颈周长。观察到颈椎周长增加 1 cm 和颈椎皱襞消失。 请单击此处查看此图的较大版本。
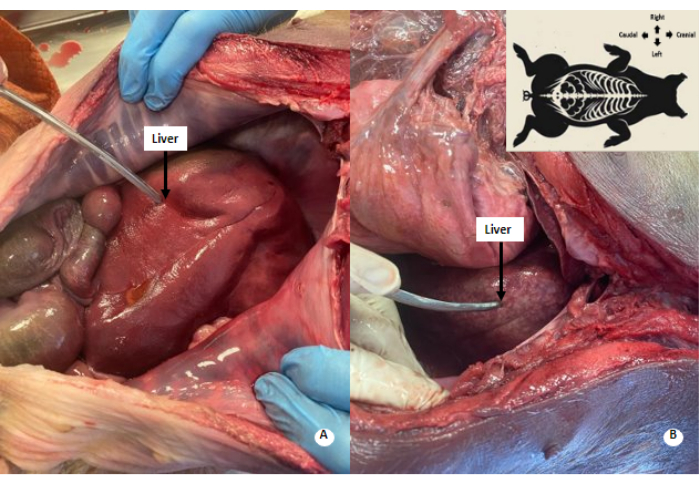
图 4:肝脏中的白色斑驳图案。 (A) 灌注前的肝脏。(B) 灌注后的肝脏。在灌注的肝脏中观察到白色斑驳的模式。 请单击此处查看此图的较大版本。

图 5:肠袢苍白。 (A) 灌注前的小肠。(B) 灌注后的小肠。观察到肠袢苍白。 请单击此处查看此图的较大版本。

图 6:真菌定植的生物模型。 下腔静脉的腹侧牵引显示真菌定植。 请单击此处查看此图的较大版本。

图 7:腹横肌及其腱膜。 (1) 腹横肌。(2) 腹横肌 Aponeurosis 关节动乱。 请单击此处查看此图的较大版本。

图 8:保存的猪生物模型的壁层腹膜。 (1) 壁层腹膜。(2) 切片肝脏的左叶。(3) 胃。 请单击此处查看此图的较大版本。
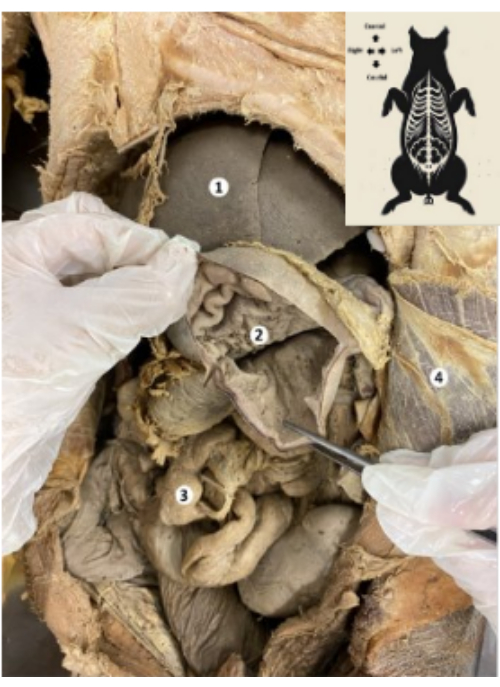
图 9:保存的猪生物模型的胃。 (1) 肝脏。(2) 胃粘膜。(3) 肠道。(4) 腹横肌和壁层腹膜。 请单击此处查看此图的较大版本。
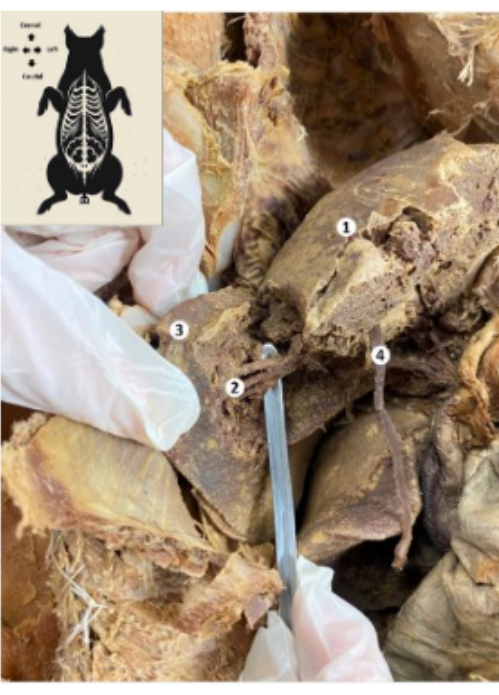
图 10:保存的猪生物模型的肝脏。 (1) 肝脏的膈面。(2) 肝脏后下段(肝动脉、胆管、门静脉后下支)。(3) 肝右叶。(4) 肝圆韧带。 请单击此处查看此图的较大版本。
| 反应性的 | 最终浓度 | 数量 | 最终卷 |
| 乙醇 96% | 30% | 7.8 升 | 25 升 |
| 甘油 | 20% | 5升 | |
| 甲醛 40% | 2% | 0.5 升 | |
| 苯扎氯铵 50% | 2% | 1 升 | |
| 芳香精华 (咖啡) | 0.40% | 0.1 升 | |
| 蒸馏水 | 那 | 10.6 升 |
表 1:基于改性智利溶液的防腐剂溶液。
| 反应性的 | 最终浓度 | 数量 | 最终卷 |
| 乙醇 96% | 30% | 7.8 升 | 25 升 |
| 甘油 | 20% | 5升 | |
| 苯扎氯铵 50% | 2% | 1 升 | |
| 芳香精华 (咖啡) | 0.40% | 0.1 升 | |
| 蒸馏水 | 那 | 11.1 升 |
表 2:基于改性智利溶液的无甲醛防腐剂溶液。
| 组织 | 未保存 | 保存 | ||
| 牛顿 ± SD * | 杨氏模量 ± SD* | 牛顿 ± SD * | 杨氏模量 ± SD* | |
| 迷走神经 | 4.92 ± 0.98 | 879.5 ± 427.02 | 8.59 ± 0.83 | 1392.21 ± 729.6 |
| 主动脉 | 9.33 ± 1.5 | 325.89 ± 176.15 | 8.48 ± 1.26 | 417.16 ± 379.95 |
| 卡瓦静脉 | 5.73 ± 2.3 | 145.5 ± 40.89 | 8.92 ± 3.97 | 264.69 ± 188.72 |
表 3:解剖结构的未保存和保存标本的组织特征。 *SD:标准差。
讨论
传统上,解剖学研究依赖于人类尸体;然而,获取这些标本的挑战导致了对替代方法的探索。猪生物模型已被证明是研究人体解剖学的宝贵工具,提供解剖学相似性,有助于学习及其外推到人类的医学应用 12,13,14,15。尽管尸体保存技术传统上是定性描述的,但使用 Young 模量测量保存组织的强度和弹性可以提供保存程度的定量证据。寻找生物组织保存的创新方法响应了促进在现实模型中探索解剖复杂性的需求。因此,在 Universidad Icesi 解剖学实验室开发和使用的保存猪生物模型的方案被提出为组织保存和随后的解剖学研究的可行替代方案。
根据经验,与通常在人类尸体中进行的股动脉插管相比,在猪生物模型中通过腹主动脉接近标本循环是一种更有效的替代方案16。猪股动脉壁的脆弱性促使人们倾向于腹部入路,因为这些壁容易受到灌注泵施加的压力而破裂。确保可行的切入点至关重要,因为方案中的填充步骤对于充分保存整个标本至关重要。次优补充具有很高的分解风险。因此,在继续方案之前,必须评估成功的补充体征。这些体征包括上肢和下肢的伸展、颈椎和胸腔充血,以及由于保存溶液的灌注而使溶液通过鼻孔流出。在执行该方案期间可能出现的一个常见挑战是在输注保留溶液期间主动脉撕裂。在这种情况下,建议结扎动脉并继续解剖上段,以促进二次插管并恢复充盈步骤。此外,如果在实验方案中的任何时候出现明显的分解迹象,则必须丢弃整个样本。
该方案中使用的防腐剂溶液包括与传统智利溶液相比的变化,例如不含氯化钠、乙醇浓度从 24% 增加到 30%、甘油浓度从 16% 增加到 20%、甲醛浓度从 3.7% 降低到 2%,以及用咖啡精代替桉树精华17。
脱模过程是协议中的另一个关键步骤,因为适当的脱模可以减少人员接触甲醛,包括教师、实验室人员和学生。此外,甘油的软化过程对于获得类似于新鲜组织的质地至关重要。使用 10% 甲醛的传统保存会导致僵硬的组织失去弹性,并且在处理过程中更容易撕裂。然而,使用甲醛浓度降低 2% 的改性智利溶液,然后用甘油变形和软化,可以缓解这个问题。
按照该方案,作时实现了高度的灵活性,而实体器官(如肝脏)表现出一种一致性,虽然坚硬,但允许解剖和识别其结构。然而,需要进一步的定量研究来比较不同保存技术中组织的保存质量。
在执行此协议时应考虑几个潜在的限制。首先,必须仔细注意试样的大小,建议范围为 15-20 公斤。较大的动物可能在执行保存方案和管理生物模型的处置方面带来挑战。其次,指定实验室应在污水系统中配备适当的蒸汽抽取系统和废物收集器。此预防措施旨在减少技术人员接触有机蒸气的情况,并最大限度地减少保存过程中产生的残留物造成的环境污染。第三,必须承认生物模型中可能存在解剖变异。此外,虽然猪标本在解剖学上与人类相似,但它们也表现出差异。因此,在比较解剖学研究中有必要仔细考虑这些变化。
传统上,对组织感官特性的评估是定性的,侧重于气味、颜色、刚度、脆性和易处理性等特性18。然而,旨在客观确定这些参数的研究明显缺乏。一个例子是 HP Theeuwes 的工作,它比较了用 11% 福尔马林、新鲜组织和一种固定关节以测量屈曲所需力的改良方法保存的尸体中上肢关节的活动度5。在此背景下,研究团队正在开发客观评估组织机械性能的方法,以寻求克服现有定性评估的局限性。
在尸体保存方面,虽然福尔马林是最常用的试剂,但几种替代物质也已成功使用。这些物质包括戊二醛、单乙二醇、二甘醇、乙醇-甘油溶液和饱和盐。保存方法的多样性反映了人们不断寻求优化组织保存以用于医学研究、教育或展览目的 3,19。这些进展凸显了研究在开发更有效的保存技术以长期保持人体组织的结构和功能特性方面的重要性。
对于未来的应用,使用该方案观察到的高水平组织保存为推进解剖学研究和教育具有重要前景。这种方法的潜力延伸到高级解剖学研究,为手术训练提供逼真的模型,并有助于沉浸式医学模拟的开发。此外,该协议的适应性为在不同解剖标本中进行探索开辟了途径,从而扩大了其在各种医学和科学环境中的实用性。
披露声明
作者声明没有利益冲突。
致谢
感谢 Universidad Icesi 基础医学科学系和研究办公室对这项研究的支持。
材料
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
参考文献
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。