Method Article
Сохранение биомоделей свиней для изучения сравнительной анатомии человека
В этой статье
Резюме
В данной статье представлен протокол сохранения биомоделей свиней. Предлагаемый метод предполагает использование модифицированного чилийского раствора с пониженной концентрацией формалина. Процесс консервации заключается во введении раствора путем восполнения и погружения образца с последующей деформолизацией и размягчением тканей с помощью глицерина.
Аннотация
Преподавание анатомии человека в медицинском образовании сталкивается с трудностями, требующими эффективных альтернатив для практического изучения анатомической сложности. Биомодели свиней, с их анатомическим сходством с человеком, предлагают многообещающее решение. В данной статье представлен подробный протокол сохранения биомоделей свиней, учитывающий потребность в доступных и эффективных методах в сравнительных анатомических исследованиях. Этот протокол предлагает использовать модифицированное чилийское решение для сохранения биомоделей с использованием методов формализации через восполнение и погружение. В последующем деформализация достигается с помощью модифицированного чилийского раствора без формальдегида с последующим процессом размягчения глицерина. Учитывая нехватку литературы по методам консервации и отсутствие стандартизированной процедуры или теста для оценки сохранности тканей, мы предлагаем оценивать качество тканей на основе показателей устойчивости и эластичности. Полученные нами данные свидетельствуют о качественно высоком уровне сохранности тканей в наших образцах. Кроме того, эти биомодели в настоящее время успешно используются для морфологических исследований и преподавания сравнительной анатомии человека студентам-медикам.
Введение
Преподавание анатомии в медицинских школах часто сталкивается с препятствиями, такими как трудности с доступом к человеческим телам для вскрытия и отсутствие подходящих помещений. Эти ограничения подчеркивают потребность в эффективных альтернативах, которые позволяют студентам исследовать анатомическую сложность практически и реалистично. В этом контексте биомодели свиней стали многообещающей альтернативой из-за их анатомического сходства с человеком, предлагая доступные и эффективные средства обучения и преподавания анатомии1.
Методы анатомического консервирования направлены на поддержание целостности биологических тканей при минимизации повреждений. Эти методы использовались в образовательных, академических и исследовательских целях при изучении анатомии человека и ветеринарии. Было протестировано множество веществ, которые сохраняют тела, органы и ткани в их естественном состоянии как можно дольше2. Тем не менее, сохранение и консервация анатомических образцов остается сложной задачей, особенно для тех, которые предназначены для морфологических исследований, где требуется высокая сохранность тканей3.
Несмотря на то, что традиционно используемые решения широко доступны, ограничения в повседневной практике очевидны. Формалин, одно из наиболее распространенных используемых веществ, имеет несколько документально подтвержденных недостатков для сохранения тканей. К ним относятся его раздражающий запах, высокая токсичность, связанные с ним риски развития рака и мутагенность для дрессировщиков, а также органолептические изменения, которые он вызывает в тканях, такие как жесткость и обесцвечивание. Эти изменения могут изменить восприятие физиологических свойств тканей при изучении после фиксации, что потенциально препятствует точным и аккуратным морфологическим исследованиям4. Исследования показали, что фиксация высокими концентрациями формалина приводит к большей степени жесткости тканей5. Альтернативы, такие как метод бальзамирования по Тилю, продемонстрировали многообещающие результаты с лучшим сохранением исходной окраски и податливостью тканей6. Однако этот метод является более затратным по сравнению с другими решениями7. Эти проблемы дают возможность разработать и протестировать новые, доступные методы сохранения, которые по-прежнему обеспечивают высокое качество преподавания анатомии.
Целью данного протокола является описание методологии, используемой в анатомической лаборатории Университета Исеси в Кали, Колумбия, для сохранения биомоделей свиней, используемых в качестве образовательных инструментов для сравнительного изучения анатомии человека.
протокол
Описанная методика была разработана в полном соответствии с руководящими принципами Комитета по институциональной этике по уходу и использованию животных в экспериментах (CIECUAE) Университета Исеси, в соответствии с Законом 84 от 1989 года и Постановлением ректора No 847 от 9 июля 2012 года. Это обеспечивает как научную честность, так и благополучие используемых животных, сводя к минимуму их страдания. Для этого исследования были использованы самцы свиней породы ландрас в возрасте 3 месяцев и весом 15-20 кг. Необходимые реагенты и оборудование перечислены в Таблице материалов.
1. Биомодель свиньи
- Жертвоприношение животного
- Проведите общую ветеринарную оценку и карантин отобранной особи свиньи в течение 24 ч. Если у животного в этот период не проявляется никаких симптомов, приступайте к эвтаназии.
- Анестезия
- Вводите внутримышечную анестезию с использованием кетамин + ксилазин + атропин в дозах 10 мг/кг, 0,5 мг/кг и 0,04 мг/кг соответственно (в соответствии с институционально утвержденными протоколами).
ПРИМЕЧАНИЕ: Обеспечьте глубокую анестезию. Оцените глубину анестезии с помощью физического осмотра. Глубокая анестезия проявляется в расширении и центрировании зрачка, отсутствии глазного рефлекса, угнетении роговичного рефлекса, а также снижении частоты дыхания, частоты сердечных сокращений и артериального давления.
- Вводите внутримышечную анестезию с использованием кетамин + ксилазин + атропин в дозах 10 мг/кг, 0,5 мг/кг и 0,04 мг/кг соответственно (в соответствии с институционально утвержденными протоколами).
- Эвтаназия
- Введите 5 мл натрия пентобарбитала/дифенилгидантоина (390/50 мг/мл) внутривенно. После введения средства для эвтаназии аускультировать физиологические параметры животного для вида Suis Scrofa : HR, 60-90; FR, 8-18; и T° 37-39°C8.
- Следите за частотой сердечных сокращений до тех пор, пока она постепенно не снизится и не прекратится полностью. Наблюдайте немедленные изменения, такие как расслабление сфинктера, цианотические мембраны и отсутствие реакции на раздражители тела. Считайте, что эвтаназия завершена через 5 минут аускультации сердца без обнаружения сердцебиения.
- Хранение и транспортировка
- Транспортируйте биомодель свиньи из процедурного кабинета в анатомическую лабораторию в течение получаса после эвтаназии, чтобы предотвратить разложение и размножение микроорганизмов, тем самым оптимизируя сохранность биомодели.
2. Консервирующий раствор на основе чилийского раствора
- Приготовление модифицированного чилийского раствора
- Используйте модифицированный чилийский раствор, содержащий этанол, глицерин, формальдегид, хлорид бензалкония, ароматическую эссенцию кофе и дистиллированную воду. Убедитесь, что pH раствора составляет 7,0.
- Приготовьте раствор консерванта в баке объемом 50 л. Сначала добавьте в бак 10,6 л дистиллированной воды. Далее добавьте 7,6 л 96% этанола, 5 л глицерина, 0,5 л 50% бензалкония хлорида и 0,1 л ароматической эссенции кофе.
ПРИМЕЧАНИЕ: В таблице 1 приведены требуемые концентрации и объемы каждого компонента, необходимые для приготовления 25 л модифицированного чилийского раствора.
3. Введение модифицированного чилийского консервирующего раствора
ПРИМЕЧАНИЕ: Как только раствор консерванта будет приготовлен, введите его путем восполнения и погружения.
- Применение путем восполнения модифицированного чилийского консервирующего раствора
ПРИМЕЧАНИЕ: Используйте для этой процедуры одежду для биозащиты: многоразовую полумаску с фильтрами A1P2, очки биобезопасности, одноразовый хирургический халат с длинными рукавами, хирургическую шапочку, леггинсы и нитриловые перчатки.- Хирургический подход
- Сделайте надрез по белой линии (с помощью рукоятки скальпеля 4, лезвие 22) от мечевидного отростка к лобковой области.
- Определите подкожную клеточную ткань и мышечные волокна прямой мышцы живота.
ПРИМЕЧАНИЕ: В момент разреза определите скудную жировую ткань, прилипшую к коже, известную как подкожная клеточная ткань, и мышечные волокна прямой мышцы живота, расположенные глубже9. - Аккуратно разрежьте так, чтобы получить доступ к брюшине, обеспечив ее выход в брюшную полость без травмирования печени и кишечника, которые будут обнажены сразу.
- Втяните петли кишечника в правую сторону брюшной полости. Определите париетальную брюшину, расположенную над левой почкой и почечными сосудами. Используйте эти сосудистые структуры для определения местоположения брюшной аорты.
- Обнаружить появление левой почечной ножки. Удалите брюшину, покрывающую аорту на 5 см выше почечной артерии.
- Обнажив левую ножку почки, мобилизуйте петли кишечника и надрежьте брюшину, покрывающую воротник. Рассекайте переднезаднюю часть, чтобы сначала определить почечную вену, которая больше и расположена спереди.
- Располагайте почечную артерию сзади, следуя ее траектории до начала в брюшной аорте. Наконец, определите почечную лоханку, самую заднюю структуру ворот9.
- Тщательно рассеките заднюю часть аорты. С помощью шелка 0/0 перевязать аорту узлом выше уровня почечной артерии и еще одним узлом на 5 см выше.
- Немедленно зажмите аорту двумя зажимами Келли на обоих концах изолированного сегмента аорты.
- Надрежьте стенку аорты кончиком ножниц Метзембаума, сделав надрез примерно на 0,3 см в передней стенке аорты, стараясь не проколоть ее.
- Завяжите узел на дистальном конце при снятии зажима Келли, чтобы ввести тупую L-образную иглу диаметром 3,2 мм в просвет артерии. Снимите проксимальный зажим Келли и начните перфузию модифицированного чилийского консервирующего раствора.
- Перфузия аорты модифицированным чилийским консервирующим раствором
- Приступайте к перфузии модифицированного чилийского консервирующего раствора.
ПРИМЕЧАНИЕ: Введите 0,25 л/кг под давлением 10 фунтов с помощью перфузионного насоса. - Окончание перфузии
- После того, как перфузия консервирующего раствора будет завершена, удалите перфузионную канюлю и завяжите место введения шелком 0/0, чтобы предотвратить рефлюкс консервирующего раствора. Закройте живот, зашивая разрез по белой линии шелком 0/0.
ПРИМЕЧАНИЕ: Чтобы оценить, была ли достигнута адекватная перфузия, проверьте острые показатели сатурации: расширение верхних и нижних конечностей, шейное и грудное изобилие, а также сток раствора через ноздри. Ориентировочное время перфузии составляет 2 ч.
- После того, как перфузия консервирующего раствора будет завершена, удалите перфузионную канюлю и завяжите место введения шелком 0/0, чтобы предотвратить рефлюкс консервирующего раствора. Закройте живот, зашивая разрез по белой линии шелком 0/0.
- Хирургический подход
- Администрирование методом погружения
ПРИМЕЧАНИЕ: Используйте для этой процедуры одежду для биозащиты: многоразовую полумаску с фильтрами A1P2, очки биобезопасности, одноразовый хирургический халат с длинными рукавами, хирургическую шапочку, леггинсы и нитриловые перчатки.- Введение путем погружения модифицированного чилийского консервирующего раствора
- Храните образец свинины в резервуаре объемом 300 л, наполненном тем же раствором консерванта, который описан в шаге 2.
ПРИМЕЧАНИЕ: Убедитесь, что биомодель полностью погружена, используя примерно 150 л раствора. После погружения биомодель хранить при температуре 20 °C в течение 6 месяцев. К показателям адекватной сохранности относятся отсутствие признаков разложения (например, отека тела, отека, неприятного запаха, бледности и рыхлости тканей).
- Храните образец свинины в резервуаре объемом 300 л, наполненном тем же раствором консерванта, который описан в шаге 2.
- Введение путем погружения модифицированного чилийского консервирующего раствора
4. Раствор для деформолизации на основе чилийского раствора
- Приготовление раствора для деформолизации
- Используйте модифицированный чилийский раствор, содержащий этанол, глицерин, хлорид бензалкония, ароматическую эссенцию кофе и дистиллированную воду. Убедитесь, что pH раствора составляет 7,0.
- Приготовьте раствор для деформолизации в баке объемом 50 л. Сначала добавьте 11,1 л дистиллированной воды, затем 7,8 л 96% этанола, 5 л глицерина, 1 л 50% бензалкония хлорида и 0,1 л ароматической эссенции кофе.
Примечание: В таблице 2 приведены требуемые концентрации и объемы каждого компонента, необходимые для приготовления 25 л модифицированного чилийского раствора, не содержащего формальдегида.
5. Деформолизация
ПРИМЕЧАНИЕ: Используйте для этой процедуры одежду для биозащиты: многоразовую полумаску с фильтрами A1P2, очки биобезопасности, одноразовый хирургический халат с длинными рукавами, хирургическую шапочку, леггинсы и нитриловые перчатки.
- Применение путем погружения в безформальдегидный модифицированный чилийский консервирующий раствор
- По окончании 6-месячного периода иммерсионного хранения перенесите биомодель в резервуар объемом 300 л, наполненный модифицированным чилийским консервирующим раствором, не содержащим формальдегида. Храните биомодель в течение 4 недель.
ПРИМЕЧАНИЕ: Убедитесь, что биомодель полностью погружена, используя примерно 150 л раствора.
- По окончании 6-месячного периода иммерсионного хранения перенесите биомодель в резервуар объемом 300 л, наполненный модифицированным чилийским консервирующим раствором, не содержащим формальдегида. Храните биомодель в течение 4 недель.
6. Размягчение глицерина
- Сразу после процесса деформолизации погрузить биомодель в растворы с возрастающими концентрациями разведенного в воде глицерина: 50%, 70% и 90% глицерина. Поддерживайте биомодель в каждой концентрации в течение одной недели.
Результаты
Цель данного протокола состоит в том, чтобы представить эффективную и жизнеспособную методику, позволяющую сохранить биомодели свиней для сравнительного преподавания анатомии человека. В настоящее время не существует стандартизированных методов или тестов для оценки сохранности модели. Поэтому общую сохранность модели оценивали с помощью показателей наполнения раствора и признаков разложения после составления протокола на образцах. Кроме того, для объективной оценки жизнеспособности биомоделей для преподавания и исследований было запланировано сравнение характеристик тканей выбранных анатомических структур, таких как прочность и эластичность, до и после сохранения. Выбранными анатомическими структурами были блуждающий нерв, аортальная артерия и кава-вена. Эти структуры были выбраны потому, что нервы, артерии и вены имеют основополагающее значение в преподавании и изучении общей анатомии. Следовательно, 4 блуждающих нерва, 4 аортальные артерии и 3 кава вены были выделены из свежих, несохранившихся образцов.
Соответственно, с использованием представленного протокола были сохранены тела 12 экземпляров свиней. Сохраненные биомодели свиней оценивали на адекватность сохранности по таким показателям восполнения, как удлинение передних конечностей, отток крови и раствора консерванта через ноздри (рис. 1), отек и увеличение грудного и шейного периметра (рис. 2 и рис. 3), а также появление белесого пятнистого рисунка в печени (рис. 4) и побледнение петель кишечника (рис. 5). Все биомодели продемонстрировали успешные показатели насыщения. После завершения протокола ни у одной из биомоделей не было обнаружено изменений, связанных с разложением, таких как растяжение петель кишечника, неприятный запах или рыхлость тканей.
После осмотра биомоделей стало очевидно, что эта методика успешно сохраняет ткани для манипуляций и вскрытия. Примерами могут служить мышцы и их апоневрозы (рисунок 6), брюшина (рисунок 7), а также желудок и кишечник (рисунок 8). Это оценивалось субъективно, так как все эти органы сохраняли высокую гибкость во время манипуляций. Консистенция печени, хотя и твердая, позволила идентифицировать внутрипеченочные протоки и связанную с ними васкуляризацию после диссекции (рис. 9 и рис. 10).
Однако результаты не всегда были такими многообещающими. До разработки протокола грибковая колонизация биомоделей была частой проблемой. Возможно, это связано с использованием нестандартизированного метода восполнения и введения путем погружения консервирующего раствора. На рисунке 6 показана биомодель, на которую повлияла колонизация.
Кроме того, для объективной оценки сохранности тканей были измерены специфические характеристики, представляющие интерес как в несохранившихся, так и в сохранившихся структурах. Четыре блуждающих нерва, четыре аортальные артерии и три кава-вены были выделены из сохранившихся биомоделей. Измерялись такие характеристики, как сопротивление ткани (количественно выраженное в ньютонах, необходимых для разрыва структуры) и гибкость ткани (измеренная с использованием модуля Юнга)10,11. Результаты представлены в виде среднего ± стандартного отклонения (SD) в таблице 3.
Хирургическое извлечение этих структур и оценка их эластичности и прочности были проведены для количественной аппроксимации степени сохранности всей биомодели и того, насколько хорошо она сохранила свои первоначальные механические свойства. Выбор этих специфических анатомических структур был основан на том факте, что учителя и студенты чаще всего манипулируют сосудистыми и нервными структурами во время вскрытия, что создает больший риск разрыва.
Для оценки механических свойств биологических тканей животных был разработан метод, который заключался в подвешивании образца между двумя зажимами, один конец которых был соединен с преобразователем силы, а другой конец подвергался возрастающей нагрузке за счет постоянного потока воды. Приложенная сила рассчитывалась с учетом плотности воды и силы тяжести, в то время как относительное удлинение образца измерялось с возрастающей нагрузкой. Эти измерения способствовали определению модуля Юнга, представляющего жесткость тканей, а также выявлению максимального сопротивления приложению определенной силы, отражающей способность ткани выдерживать нагрузки до разрыва. Этот метод обеспечивает точную оценку упругих и прочностных свойств биологических тканей, что имеет основополагающее значение для понимания их механического поведения.
Сохранившиеся блуждающие нервы продемонстрировали значительное увеличение сопротивления и эластичности по сравнению с несохранившимися экземплярами. Вопреки ожиданиям, сохраненная аортальная артерия продемонстрировала несколько более низкое сопротивление, но умеренное увеличение эластичности по сравнению с несохранившимися образцами. Сохранение вены кавы привело к заметному увеличению как прочности, так и эластичности. Эти результаты указывают на то, что процесс консервации оказывает заметное влияние на механические свойства оцениваемых тканей, предоставляя ценную информацию для применения этих сохраненных тканей в анатомических исследованиях.
Исследовательская группа по морфологии, разработавшая этот протокол, обладает обширным опытом в области сохранения биомоделей свиней. Отмечено качественное улучшение результатов консервации с точки зрения органолептических свойств тканей за счет модификации и оптимизации ранее применявшихся традиционных методик, таких как консервация 10% формалином. Сохраненные биомодели в настоящее время успешно используются в Университете Исези для морфологических исследований и преподавания сравнительной анатомии человека студентам-медикам. Модель с наибольшим сроком службы в лаборатории достигла 7 лет при комнатной температуре, не требуя новых погружений или дополнительных процессов. Опыт преподавания показал, что, несмотря на высокий уровень манипуляций со стороны студентов, биомодели сохраняют целостность анатомических структур до 4 лет после сохранения.

Рисунок 1: Отток крови и раствора консерванта через ноздри. (А) Отток перед перфузией. (Б) Отток во время перфузии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Периметр грудной клетки до и после перфузии раствора консерванта. (A) Периметр грудной клетки до перфузии. (Б) Периметр грудной клетки после перфузии. Наблюдается увеличение на 4 см в грудном периметре. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
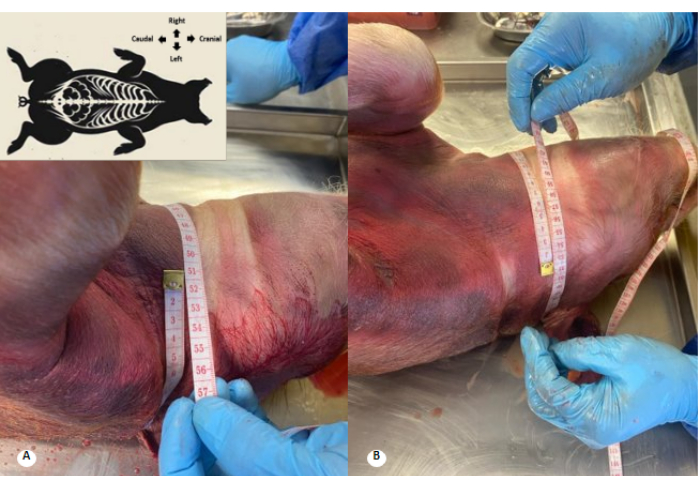
Рисунок 3: Периметр шейки матки до и после перфузии консервирующего раствора. (А) Периметр шейки матки до перфузии. (Б) Периметр шейки матки после перфузии. Наблюдается увеличение на 1 см в шейном периметре и стирание шейных складок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
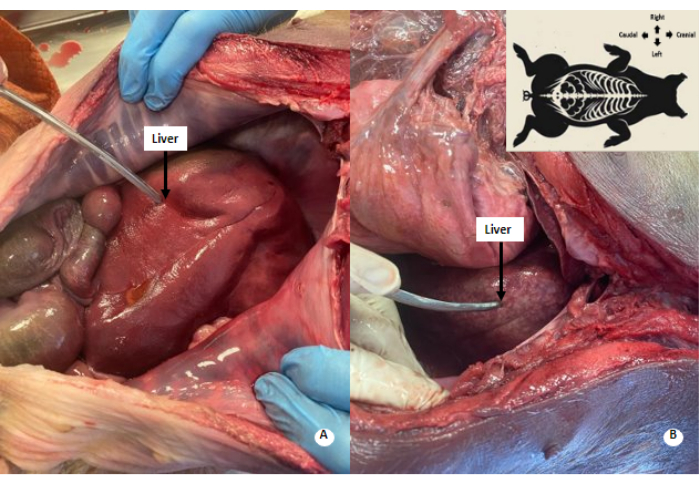
Рисунок 4: Белесый пятнистый узор в печени. (А) Печень до перфузии. (Б) Печень после перфузии. В перфузированной печени наблюдается беловато-пятнистый рисунок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Бледность петель кишечника. (A) Тонкая кишка до перфузии. (Б) Тонкая кишка после перфузии. Наблюдается бледность петлей кишечника. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Биомодель, колонизированная грибком. Вентральное вытяжение нижней кава показывает грибковую колонизацию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Поперечная мышца живота и ее апоневроз. (1) Поперечная мышца живота. (2) Апоневроз поперечной мышцы живота. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8: Теменная брюшина сохранившейся биомодели свиньи. (1) Теменная брюшина. (2) Левая доля разрезанной печени. (3) Желудок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
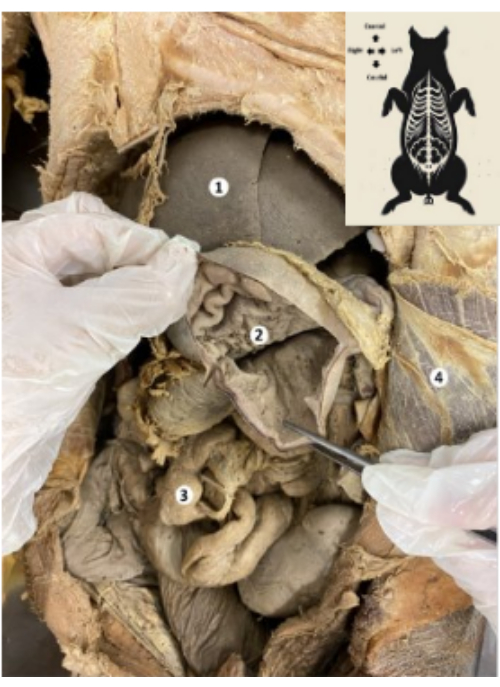
Рисунок 9: Желудок консервированной биомодели свиньи. (1) Печень. (2) Слизистая оболочка желудка. (3) Кишечник. (4) Поперечная мышца живота и теменная брюшина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
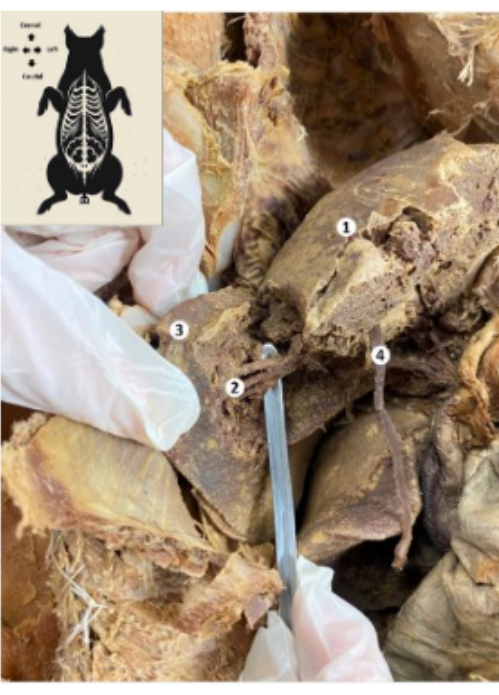
Рисунок 10: Печень сохранившейся биомодели свиньи. (1) Диафрагмальное лицо печени. (2) Нижний задний сегмент печени (печеночная артерия, желчный проток, нижняя задняя ветвь воротной вены). (3) Правая доля печени. (4) Круглая связка печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Реактивный | Конечная концентрация | Количество | Итоговый объем |
| Этанол 96% | 30% | 7.8 л | 25 л |
| Глицерин | 20% | 5 л | |
| Формальдегид 40% | 2% | 0,5 л | |
| Бензалкония хлорид 50% | 2% | 1 л | |
| Ароматическая эссенция (Кофе) | 0.40% | 0,1 л | |
| Дистиллированная вода | NA | 10.6 л |
Таблица 1: Консервирующий раствор на основе модифицированного чилийского раствора.
| Реактивный | Конечная концентрация | Количество | Итоговый объем |
| Этанол 96% | 30% | 7.8 л | 25 л |
| Глицерин | 20% | 5 л | |
| Бензалкония хлорид 50% | 2% | 1 л | |
| Ароматическая эссенция (Кофе) | 0.40% | 0,1 л | |
| Дистиллированная вода | NA | 11.1 л |
Таблица 2: Бесформальдегидный консервантный раствор на основе модифицированного чилийского раствора.
| Ткань | Несохранившийся | Консервированный | ||
| Newton ± SD* | Модуль Юнга ± SD* | Newton ± SD* | Модуль Юнга ± SD* | |
| Блуждающий нерв | 4,92 ± 0,98 | 879,5 ± 427,02 | 8,59 ± 0,83 | 1392.21 ± 729.6 |
| Аортальная артерия | 9.33 ± 1.5 | 325,89 ± 176,15 | 8.48 ± 1.26 | 417,16 ± 379,95 |
| Кава | 5.73 ± 2.3 | 145,5 ± 40,89 | 8.92 ± 3.97 | 264,69 ± 188,72 |
Таблица 3: Характеристики тканей несохранившихся и сохранившихся образцов анатомических структур. *SD: Стандартное отклонение.
Обсуждение
Традиционно анатомические исследования основывались на человеческих трупах; Тем не менее, трудности с получением этих образцов привели к изучению альтернативных методов. Биомодели свиней оказались ценными инструментами для изучения анатомии человека, предлагая анатомические сходства, которые облегчают обучение и его экстраполяцию на медицинские приложения у людей 12,13,14,15. Несмотря на то, что методы сохранения трупов традиционно описываются качественно, измерение прочности и эластичности консервированных тканей с использованием модуля Юнга может предоставить количественные доказательства степени сохранности. Поиск инновационных подходов к сохранению биологических тканей отвечает потребности в облегчении исследования анатомической сложности в реалистичных моделях. Таким образом, протокол сохранения биомоделей свиней, разработанный и используемый в анатомической лаборатории Университета Исези, представлен как жизнеспособная альтернатива для сохранения тканей и последующего анатомического исследования.
Основываясь на опыте, подход к кровообращению образца через брюшную аорту у биомоделей свиней является более эффективной альтернативой по сравнению с канюляцией бедренной артерии, которая обычно выполняется у трупов человека16. Хрупкий характер стенок бедренных артерий свиньи побудил отдать предпочтение абдоминальному доступу, поскольку эти стенки подвержены разрыву под давлением, оказываемым перфузионным насосом. Обеспечение жизнеспособной точки входа имеет решающее значение, поскольку этап пополнения в протоколе имеет решающее значение для адекватной сохранности всего образца. Неоптимальное наполнение создает высокий риск разложения. Поэтому признаки успешного пополнения должны быть оценены до продолжения протокола. К таким признакам относятся расширение верхних и нижних конечностей, шейное и грудное изобилие, а также отток раствора через ноздри из-за перфузии консервирующего раствора. Распространенной проблемой, которая может возникнуть во время выполнения этого протокола, является разрыв аортальной артерии во время инфузии консервирующего раствора. В таких случаях целесообразно перевязать артерию и приступить к рассечению верхнего сегмента, чтобы облегчить вторичную канюляцию и возобновить стадию восполнения. Кроме того, если признаки разложения становятся очевидными в любой момент протокола, весь образец должен быть выброшен.
Раствор консерванта, используемый в этом протоколе, включает вариации по сравнению с обычным чилийским раствором, такие как отсутствие хлорида натрия, увеличение концентрации этанола с 24% до 30%, увеличение концентрации глицерина с 16% до 20%, снижение концентрации формальдегида с 3,7% до 2% и замена эссенции эвкалипта на эссенцию кофе17.
Процесс деформолизации является еще одним важным этапом в протоколе, поскольку надлежащая деформолизация снижает воздействие формальдегида на персонал, включая учителей, лаборантов и студентов. Кроме того, процесс размягчения глицерином необходим для получения текстуры, аналогичной текстуре свежих тканей. Традиционная консервация с использованием 10% формальдегида приводит к образованию жестких тканей, которые теряют эластичность и становятся более склонными к разрыву во время обработки. Однако использование модифицированного чилийского раствора с пониженной концентрацией формальдегида на 2% с последующей деформолизацией и размягчением глицерином смягчает эту проблему.
Следуя этому протоколу, была достигнута высокая степень гибкости при манипуляциях, в то время как солидные органы, такие как печень, демонстрировали консистенцию, которая, хотя и была твердой, позволяла препарировать и идентифицировать их структуры. Тем не менее, необходимы дальнейшие количественные исследования для сравнения качества сохранности тканей при различных методах консервации.
При проведении этого протокола следует учитывать несколько потенциальных ограничений. Во-первых, тщательное внимание необходимо уделить размеру экземпляра, с рекомендуемым диапазоном 15-20 кг. Более крупные животные могут представлять проблемы при выполнении протокола сохранения и управлении размещением биомодели. Во-вторых, назначенная лаборатория должна быть оборудована соответствующей системой вытяжки паров и ловушкой для отходов в канализационной системе. Эта мера предосторожности направлена на снижение воздействия органических паров на технический персонал и минимизацию загрязнения окружающей среды в результате остатков, образующихся в процессе консервации. В-третьих, необходимо признать потенциальное присутствие анатомических вариантов у биомоделей. Кроме того, хотя образцы свиней имеют анатомическое сходство с людьми, они также демонстрируют различия. Поэтому тщательное рассмотрение таких вариаций оправдано в сравнительных анатомических исследованиях.
К оценке органолептических свойств тканей традиционно подходили качественно, ориентируясь на такие характеристики, как запах, цвет, жесткость, хрупкость илегкость в обращении. Тем не менее, существует заметная нехватка исследований, направленных на объективное определение этих параметров. Одним из примеров является работа HP Theeuwes, в которой сравнивалась подвижность суставов верхних конечностей у трупов, сохраненных с помощью 11% формалина, свежей ткани и модифицированного метода, который иммобилизовал суставы, чтобы измерить силу, необходимую длясгибания. В этом контексте исследовательская группа разрабатывает методы объективной оценки механических свойств тканей, стремясь преодолеть ограничения существующих качественных оценок.
С точки зрения сохранения трупов, хотя формалин является наиболее часто используемым средством, несколько альтернативных веществ также были успешно использованы. К таким веществам относятся глутаральдегид, моноэтиленгликоль, диэтиленгликоль, растворы этанола-глицерина и насыщенные соли. Разнообразие методов консервации отражает постоянное стремление к оптимизации сохранения тканей для медицинских исследований, образовательных или выставочных целей 3,19. Эти достижения подчеркивают важность исследований в разработке более эффективных методов консервации для оптимального поддержания структурных и функциональных свойств тканей человека в течение длительных периодов времени.
Для будущих применений наблюдаемый высокий уровень сохранности тканей с помощью этого протокола имеет значительные перспективы для развития анатомических исследований и образования. Потенциал этого метода распространяется на передовые анатомические исследования, обеспечивая реалистичные модели для хирургического обучения и способствуя разработке иммерсивных медицинских симуляций. Кроме того, адаптивность протокола открывает возможности для исследований на различных анатомических образцах, тем самым расширяя его полезность в различных медицинских и научных контекстах.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Выражаем благодарность Департаменту фундаментальных медицинских наук и Исследовательскому офису Университета Исези за их поддержку в этом исследовании.
Материалы
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
Ссылки
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены