Method Article
Conservazione di biomodelli suini per lo studio dell'anatomia umana comparata
In questo articolo
Riepilogo
Questo articolo presenta un protocollo per la conservazione dei biomodelli suini. Il metodo proposto prevede l'utilizzo di una soluzione cilena modificata con una concentrazione ridotta di formalina. Il processo di conservazione consiste nella somministrazione della soluzione attraverso il repletion e l'immersione del campione, seguita dalla deformolizzazione e dall'ammorbidimento dei tessuti con glicerina.
Abstract
L'insegnamento dell'anatomia umana nell'educazione medica deve affrontare sfide, che richiedono alternative efficaci per gli studenti per esplorare praticamente la complessità anatomica. I biomodelli suini, con le loro somiglianze anatomiche con gli esseri umani, offrono una soluzione promettente. Questo articolo presenta un protocollo dettagliato per la conservazione dei biomodelli suini, rispondendo alla necessità di metodi accessibili ed efficienti negli studi di anatomia comparata. Questo protocollo propone l'uso di una soluzione cilena modificata per la conservazione di biomodelli, impiegando tecniche di formalizzazione attraverso il repletion e l'immersione. Successivamente, la deformalizzazione si ottiene utilizzando la soluzione cilena modificata senza formaldeide, seguita da un processo di ammorbidimento della glicerina. Data la scarsità di letteratura sulle tecniche di conservazione e l'assenza di una procedura o di un test standardizzato per valutare la conservazione dei tessuti, suggeriamo di valutare la qualità dei tessuti in base a misure di resistenza ed elasticità. I nostri risultati indicano un livello qualitativamente elevato di conservazione dei tessuti nei nostri campioni. Inoltre, questi biomodelli sono attualmente utilizzati con successo per studi di morfologia e nell'insegnamento dell'anatomia umana comparata agli studenti di medicina.
Introduzione
L'insegnamento dell'anatomia nelle scuole di medicina incontra spesso ostacoli, come le difficoltà di accesso ai corpi umani per la dissezione e la mancanza di strutture adeguate. Queste limitazioni sottolineano la necessità di alternative efficaci che consentano agli studenti di esplorare la complessità anatomica in modo pratico e realistico. In questo contesto, i biomodelli suini sono emersi come un'alternativa promettente grazie alle loro somiglianze anatomiche con gli esseri umani, offrendo un mezzo accessibile ed efficiente per l'apprendimento e l'insegnamento dell'anatomia1.
Le tecniche di conservazione anatomica mirano a mantenere l'integrità dei tessuti biologici riducendo al minimo i danni. Queste tecniche sono state impiegate per scopi educativi, accademici e di ricerca nello studio dell'anatomia umana e veterinaria. Numerose sostanze sono state testate per preservare il più a lungo possibile corpi, organi e tessuti nel loro stato naturale2. Tuttavia, la conservazione e la conservazione dei campioni anatomici rimane impegnativa, in particolare per quelli destinati agli studi morfologici, dove è richiesta un'elevata conservazione dei tessuti3.
Anche se le soluzioni tradizionalmente utilizzate sono ampiamente disponibili, i limiti nella pratica quotidiana sono evidenti. La formalina, una delle sostanze più comunemente utilizzate, presenta diversi svantaggi documentati per la conservazione dei tessuti. Questi includono il suo odore irritante, l'elevata tossicità, i rischi associati di cancro e mutagenicità per i conduttori e i cambiamenti organolettici che induce nei tessuti, come rigidità e scolorimento. Questi cambiamenti possono alterare la percezione delle proprietà fisiologiche dei tessuti quando studiati dopo la fissazione, ostacolando potenzialmente studi morfologici precisi e accurati4. Gli studi hanno dimostrato che la fissazione con alte concentrazioni di formalina determina un maggiore grado di rigidità tissutale5. Alternative, come la tecnica di imbalsamazione di Thiel, hanno dimostrato risultati promettenti con una migliore conservazione della colorazione originale e flessibilità dei tessuti6. Tuttavia, questa tecnica è più costosa rispetto ad altre soluzioni7. Queste sfide rappresentano un'opportunità per progettare e testare nuove tecniche di conservazione a prezzi accessibili che consentano comunque un insegnamento dell'anatomia di alta qualità.
Lo scopo di questo protocollo è quello di descrivere la metodologia impiegata presso il Laboratorio di Anatomia dell'Universidad Icesi di Cali, Colombia, per la conservazione di biomodelli suini utilizzati come strumenti educativi per lo studio comparativo dell'anatomia umana.
Protocollo
La tecnica descritta è stata sviluppata nel pieno rispetto delle linee guida del Comitato Etico Istituzionale per la Cura e l'Uso degli Animali in Sperimentazione (CIECUAE) dell'Universidad Icesi, in conformità alla Legge 84 del 1989 e alla Delibera del Rettoratore n. 847 del 9 luglio 2012. Ciò garantisce sia l'integrità scientifica che il benessere degli animali utilizzati, riducendo al minimo la loro sofferenza. Per questo studio sono stati utilizzati suini Landrace maschi, di 3 mesi di età e del peso di 15-20 kg. I reagenti e le attrezzature necessarie sono elencati nella Tabella dei Materiali.
1. Biomodello suino
- Sacrificio dell'animale
- Condurre una valutazione veterinaria generale e mettere in quarantena l'esemplare di suino selezionato per 24 ore. Se l'animale non presenta alcun sintomo durante questo periodo, procedere con l'eutanasia.
- Anestesia
- Somministrare l'anestesia per via intramuscolare utilizzando ketamina + xilazina + atropina a dosi di 10 mg/kg, 0,5 mg/kg e 0,04 mg/kg, rispettivamente (seguendo protocolli istituzionalmente approvati).
NOTA: Garantire un'anestesia profonda. Valutare la profondità dell'anestesia attraverso l'esame fisico. L'anestesia profonda è indicata da una pupilla dilatata e centrata, assenza del riflesso palpebrale, depressione del riflesso corneale e diminuzione della frequenza respiratoria, della frequenza cardiaca e della pressione sanguigna.
- Somministrare l'anestesia per via intramuscolare utilizzando ketamina + xilazina + atropina a dosi di 10 mg/kg, 0,5 mg/kg e 0,04 mg/kg, rispettivamente (seguendo protocolli istituzionalmente approvati).
- Eutanasia
- Somministrare 5 mL di Pentobarbital/Difenilidantoina sodica (390/50 mg/mL) per via endovenosa. Dopo aver somministrato l'agente per l'eutanasia, auscultare i parametri fisiologici dell'animale per la specie Suis Scrofa : HR, 60-90; FR, 8-18; e T° 37-39°C8.
- Monitorare la frequenza cardiaca fino a quando non diminuisce gradualmente e si ferma completamente. Osservare cambiamenti immediati come il rilassamento dello sfintere, le membrane cianotiche e l'assenza di risposta agli stimoli corporei. Considerare l'eutanasia completa dopo 5 minuti di auscultazione cardiaca senza rilevare un battito cardiaco.
- Stoccaggio e trasporto
- Trasporta il biomodello suino dalla sala operatoria al laboratorio di anatomia entro mezz'ora dall'eutanasia per prevenire la decomposizione e la proliferazione microbica, ottimizzando così la conservazione del biomodello.
2. Soluzione conservante a base di soluzione cilena
- Preparazione della soluzione cilena modificata
- Utilizzare una soluzione cilena modificata contenente etanolo, glicerina, formaldeide, cloruro di benzalconio, essenza aromatica di caffè e acqua distillata. Assicurarsi che la soluzione abbia un pH di 7,0.
- Preparare la soluzione conservante in un serbatoio da 50 L. Per prima cosa, aggiungere 10,6 L di acqua distillata al serbatoio. Successivamente, aggiungi 7,6 L di etanolo al 96%, 5 L di glicerina, 0,5 L di cloruro di benzalconio al 50% e 0,1 L di essenza aromatica di caffè.
NOTA: Fare riferimento alla Tabella 1 per le concentrazioni e i volumi richiesti di ciascun componente necessari per preparare 25 L della soluzione cilena modificata.
3. Somministrazione della soluzione conservante cilena modificata
NOTA: Una volta preparata la soluzione conservante, somministrarla attraverso il rifornimento e l'immersione.
- Somministrazione mediante repletion della soluzione conservante cilena modificata
NOTA: Per questa procedura utilizzare indumenti di biosicurezza: una semimaschera riutilizzabile con filtri A1P2, occhiali di biosicurezza, un camice chirurgico monouso a maniche lunghe, un berretto chirurgico, leggings e guanti in nitrile.- Approccio chirurgico
- Praticare un'incisione lungo la linea alba (utilizzando un manico di bisturi 4, lama 22) dal processo xifoideo alla regione pubica.
- Identificare il tessuto cellulare sottocutaneo e le fibre muscolari del muscolo retto dell'addome.
NOTA: Al momento dell'incisione, identificare lo scarso tessuto adiposo aderente alla pelle, noto come tessuto cellulare sottocutaneo, e le fibre muscolari del muscolo retto dell'addome situate più in profondità9. - Tagliare con cura per accedere al peritoneo, assicurandone l'apertura alla cavità addominale senza ferire il fegato e l'intestino, che saranno esposti immediatamente.
- Ritrarre le anse intestinali sul lato destro della cavità addominale. Identificare il peritoneo parietale sovrastante il rene sinistro e i vasi renali. Usa queste strutture vascolari per localizzare l'aorta addominale.
- Trova l'emergere del peduncolo renale sinistro. Rimuovere il peritoneo che copre l'aorta 5 cm sopra l'arteria renale.
- Dopo aver esposto il peduncolo renale sinistro, mobilizzare le anse intestinali e incidere il peritoneo che copre l'ilo. Sezionare anteroposteriormente per identificare prima la vena renale, che è più grande e situata anteriormente.
- Localizzare l'arteria renale posteriormente, seguendo la sua traiettoria fino alla sua origine nell'aorta addominale. Infine, identificare la pelvi renale, la struttura più posteriore dell'ilo9.
- Sezionare con cura la parte posteriore dell'aorta. Utilizzare seta 0/0 per legare l'aorta con un nodo sopra il livello dell'arteria renale e un altro nodo 5 cm sopra.
- Bloccare immediatamente l'aorta con due pinze Kelly su entrambe le estremità del segmento aortico isolato.
- Incidere la parete aortica con la punta delle forbici Metzembaum, praticando un taglio di circa 0,3 cm nella parete anteriore dell'aorta, facendo attenzione a non perforarla.
- Annodare l'estremità distale mentre si rimuove il morsetto Kelly per inserire un ago smussato a forma di L da 3,2 mm nel lume arterioso. Rimuovere il morsetto Kelly prossimale e avviare la perfusione della soluzione conservante cilena modificata.
- Perfusione aortica della soluzione conservante cilena modificata
- Procedere con la perfusione della soluzione conservante cilena modificata.
NOTA: Somministrare 0,25 L/kg con una pressione di 10 libbre utilizzando una pompa di perfusione. - Fine della perfusione
- Una volta completata la perfusione della soluzione conservante, rimuovere la cannula di perfusione e annodare il sito di inserimento con seta 0/0 per prevenire il reflusso della soluzione conservante. Chiudere l'addome suturando l'incisione in corrispondenza della linea alba con seta 0/0.
NOTA: Per valutare se è stata raggiunta un'adeguata perfusione, controllare gli indicatori acuti di saturazione: estensione degli arti superiori e inferiori, pletora cervicale e toracica e deflusso della soluzione attraverso le narici. Il tempo di perfusione approssimativo è di 2 ore.
- Una volta completata la perfusione della soluzione conservante, rimuovere la cannula di perfusione e annodare il sito di inserimento con seta 0/0 per prevenire il reflusso della soluzione conservante. Chiudere l'addome suturando l'incisione in corrispondenza della linea alba con seta 0/0.
- Approccio chirurgico
- Somministrazione per immersione
NOTA: Per questa procedura utilizzare indumenti di biosicurezza: una semimaschera riutilizzabile con filtri A1P2, occhiali di biosicurezza, un camice chirurgico monouso a maniche lunghe, un berretto chirurgico, leggings e guanti in nitrile.- Somministrazione per immersione della soluzione conservante cilena modificata
- Conservare il campione suino in un serbatoio da 300 L riempito con la stessa soluzione conservante descritta nella fase 2.
NOTA: Assicurarsi che il biomodello sia completamente immerso utilizzando circa 150 L di soluzione. Dopo l'immersione, conservare il biomodello a 20 °C per 6 mesi. Gli indicatori di un'adeguata conservazione includono l'assenza di segni di decomposizione (ad esempio, edema corporeo, gonfiore, cattivo odore, lividità e friabilità dei tessuti).
- Conservare il campione suino in un serbatoio da 300 L riempito con la stessa soluzione conservante descritta nella fase 2.
- Somministrazione per immersione della soluzione conservante cilena modificata
4. Soluzione di deformazione, basata su soluzione cilena
- Preparazione della soluzione di deformolizzazione
- Utilizzare una soluzione cilena modificata contenente etanolo, glicerina, cloruro di benzalconio, essenza aromatica di caffè e acqua distillata. Assicurarsi che la soluzione abbia un pH di 7,0.
- Preparare la soluzione di deformazione, in un serbatoio da 50 L. Per prima cosa, aggiungi 11,1 L di acqua distillata, poi 7,8 L di etanolo al 96%, 5 L di glicerina, 1 L di cloruro di benzalconio al 50% e 0,1 L di essenza aromatica di caffè.
NOTA: Fare riferimento alla Tabella 2 per le concentrazioni e i volumi richiesti di ciascun componente necessari per preparare 25 L della soluzione cilena modificata priva di formaldeide.
5. Deformatizzazione
NOTA: Per questa procedura utilizzare indumenti di biosicurezza: una semimaschera riutilizzabile con filtri A1P2, occhiali di biosicurezza, un camice chirurgico monouso a maniche lunghe, un berretto chirurgico, leggings e guanti in nitrile.
- Somministrazione per immersione della soluzione conservante cilena modificata esente da formaldeide
- Al termine del periodo di conservazione in immersione di 6 mesi, trasferire il biomodello in un serbatoio da 300 L riempito con soluzione conservante cilena modificata priva di formaldeide. Conservare il biomodello per 4 settimane.
NOTA: Assicurarsi che il biomodello sia completamente immerso utilizzando circa 150 L di soluzione.
- Al termine del periodo di conservazione in immersione di 6 mesi, trasferire il biomodello in un serbatoio da 300 L riempito con soluzione conservante cilena modificata priva di formaldeide. Conservare il biomodello per 4 settimane.
6. Ammorbidente della glicerina
- Subito dopo il processo di deformazione, immergere il biomodello in soluzioni con concentrazioni crescenti di glicerina diluita in acqua: 50%, 70% e 90% glicerina. Mantenere il biomodello in ogni concentrazione per una settimana.
Risultati
L'obiettivo di questo protocollo è quello di presentare una tecnica efficace e praticabile che consenta la conservazione di biomodelli suini per l'insegnamento comparativo dell'anatomia umana. Attualmente non esistono metodi o test standardizzati per valutare la conservazione del modello. Pertanto, la conservazione complessiva del modello è stata valutata utilizzando indicatori di replezione della soluzione e segni di decomposizione dopo il completamento del protocollo sui campioni. Inoltre, per valutare oggettivamente la fattibilità dei biomodelli per l'insegnamento e la ricerca, è stato pianificato un confronto delle caratteristiche tissutali di strutture anatomiche selezionate, come la resistenza e l'elasticità, prima e dopo la conservazione. Le strutture anatomiche selezionate erano il nervo vago, l'arteria aortica e la vena cava. Queste strutture sono state scelte perché i nervi, le arterie e le vene sono fondamentali nell'insegnamento e nell'apprendimento dell'anatomia macroscopica. Di conseguenza, 4 nervi vaghi, 4 arterie aortiche e 3 vene cava sono stati isolati da campioni freschi e non conservati.
Di conseguenza, utilizzando il protocollo presentato, sono stati conservati i corpi di 12 esemplari suini. I biomodelli suini conservati sono stati valutati per l'adeguatezza della conservazione utilizzando indicatori di replicità, come l'estensione degli arti anteriori, il sangue e la soluzione conservante che fuoriesce attraverso le narici (Figura 1), l'edema e un aumento del perimetro toracico e cervicale (Figura 2 e Figura 3), nonché la comparsa di un pattern screziato biancastro nel fegato (Figura 4) e l'impallidimento delle anse intestinali (Figura 5). Tutti i biomodelli hanno mostrato indicatori di repletion. Dopo aver completato il protocollo, nessuno dei biomodelli ha mostrato cambiamenti associati alla decomposizione, come la distensione delle anse intestinali, il cattivo odore o la friabilità dei tessuti.
Dopo l'ispezione dei biomodelli, è stato evidente che questa tecnica ha preservato con successo i tessuti per la manipolazione e la dissezione. Gli esempi includono i muscoli e le loro aponeurosi (Figura 6), il peritoneo (Figura 7) e lo stomaco e l'intestino (Figura 8). Questo è stato valutato soggettivamente, poiché tutti questi organi hanno mantenuto un'elevata flessibilità durante la manipolazione. La consistenza del fegato, sebbene solida, ha permesso l'identificazione dei dotti intraepatici e la loro vascolarizzazione associata dopo la dissezione (Figura 9 e Figura 10).
Tuttavia, i risultati non sono stati sempre così promettenti. Prima dello sviluppo del protocollo, la colonizzazione fungina dei biomodelli era un problema frequente. Ciò è stato probabilmente attribuito all'uso di una tecnica non standardizzata per il riempimento e la somministrazione per immersione della soluzione conservante. La Figura 6 mostra un biomodello che è stato colpito dalla colonizzazione.
Inoltre, per valutare oggettivamente la conservazione dei tessuti, sono state misurate specifiche caratteristiche di interesse sia nelle strutture non conservate che in quelle conservate. Quattro nervi vaghi, quattro arterie aortiche e tre vene cava sono stati isolati da modelli biologici conservati. Le caratteristiche misurate erano la resistenza del tessuto (quantificata come i newton necessari per lacerare la struttura) e la flessibilità del tessuto (misurata utilizzando il modulo di Young)10,11. I risultati sono presentati come media ± deviazione standard (SD) nella Tabella 3.
L'estrazione chirurgica di queste strutture e la valutazione della loro elasticità e resistenza sono state condotte per fornire un'approssimazione quantitativa del grado di conservazione dell'intero biomodello e di quanto bene abbia mantenuto le sue proprietà meccaniche originali. La selezione di queste specifiche strutture anatomiche si è basata sul fatto che le strutture vascolari e nervose sono più frequentemente manipolate da insegnanti e studenti durante la dissezione, ponendo così un maggiore rischio di rottura.
Per valutare le proprietà meccaniche dei tessuti biologici animali, è stato progettato un metodo che prevedeva la sospensione del campione tra due pinze, con un'estremità collegata a un trasduttore di forza e l'altra estremità sottoposta a un carico crescente attraverso un flusso costante di acqua. La forza esercitata è stata calcolata considerando la densità dell'acqua e la gravità, mentre l'allungamento del campione è stato misurato con l'aumentare del carico. Queste misurazioni hanno facilitato la determinazione del modulo di Young, che rappresenta la rigidità del tessuto, nonché l'identificazione della massima resistenza all'applicazione di una forza specifica, che riflette la capacità del tessuto di sopportare carichi prima della rottura. Questo metodo fornisce una valutazione accurata delle proprietà elastiche e di resistenza dei tessuti biologici, fondamentale per comprendere il loro comportamento meccanico.
I nervi vaghi conservati hanno dimostrato un aumento significativo della resistenza e dell'elasticità rispetto ai campioni non conservati. Contrariamente alle aspettative, l'arteria aortica conservata ha mostrato una resistenza leggermente inferiore ma un moderato aumento dell'elasticità rispetto agli esemplari non conservati. La conservazione della vena cava ha comportato un notevole aumento sia della resistenza che dell'elasticità. Questi risultati indicano che il processo di conservazione ha un impatto percepibile sulle proprietà meccaniche dei tessuti valutati, fornendo preziose informazioni per l'applicazione di questi tessuti conservati negli studi anatomici.
Il team di ricerca morfologica che ha sviluppato questo protocollo possiede una vasta esperienza nella conservazione di biomodelli suini. È stato osservato un miglioramento qualitativo dei risultati di conservazione in termini di proprietà organolettiche dei tessuti grazie a modifiche e ottimizzazioni delle tecniche convenzionali precedentemente utilizzate, come la conservazione con formalina al 10%. I biomodelli conservati sono attualmente utilizzati con successo presso l'Universidad Icesi per studi di morfologia e insegnamento di anatomia comparata umana per studenti di medicina. Il modello con la durata di vita più lunga in laboratorio ha raggiunto i 7 anni a temperatura ambiente senza richiedere nuove immersioni o processi aggiuntivi. L'esperienza didattica ha dimostrato che, nonostante gli alti livelli di manipolazione da parte degli studenti, i biomodelli mantengono l'integrità delle strutture anatomiche fino a 4 anni dopo la conservazione.

Figura 1: Il sangue e la soluzione conservante defluiscono attraverso le narici. (A) Deflusso prima della perfusione. (B) Deflusso durante la perfusione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Perimetro toracico prima e dopo la perfusione con soluzione conservante. (A) Perimetro toracico prima della perfusione. (B) Perimetro toracico dopo perfusione. Si osserva un aumento di 4 cm del perimetro toracico. Clicca qui per visualizzare una versione più grande di questa figura.
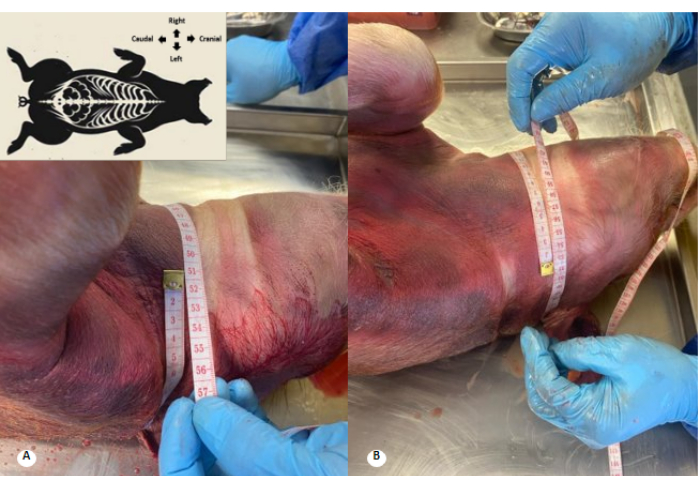
Figura 3: Perimetro cervicale prima e dopo la perfusione della soluzione conservante. (A) Perimetro cervicale prima della perfusione. (B) Perimetro cervicale dopo perfusione. Si osserva un aumento di 1 cm del perimetro cervicale e l'eliminazione delle pieghe cervicali. Clicca qui per visualizzare una versione più grande di questa figura.
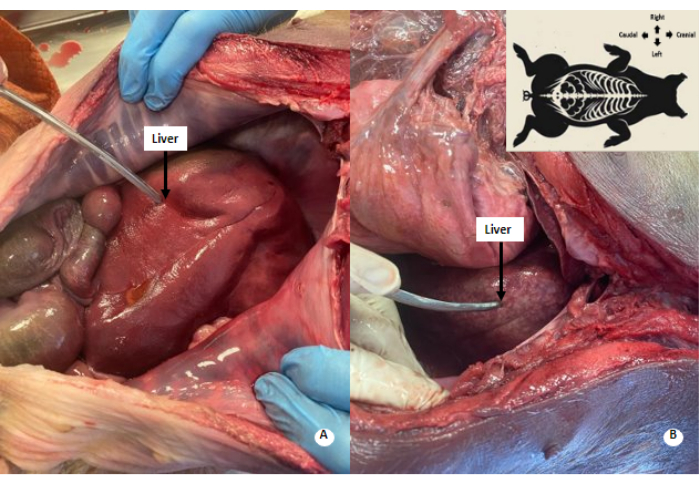
Figura 4: Disegno screziato biancastro nel fegato. (A) Fegato prima della perfusione. (B) Fegato dopo perfusione. Nel fegato perfuso si osserva un pattern biancastro-screziato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Pallore delle anse intestinali. (A) Intestino tenue prima della perfusione. (B) Intestino tenue dopo perfusione. Si osserva pallore delle anse intestinali. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Biomodello colonizzato da funghi. La trazione ventrale della vena cava inferiore mostra colonizzazione fungina. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Muscolo trasverso dell'addome e sua aponeurosi. (1) Muscolo trasverso dell'addome. (2) Aponeurosi del muscolo trasverso dell'addome. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Peritoneo parietale del biomodello suino conservato. (1) Peritoneo parietale. (2) Lobo sinistro del fegato sezionato. (3) Stomaco. Clicca qui per visualizzare una versione più grande di questa figura.
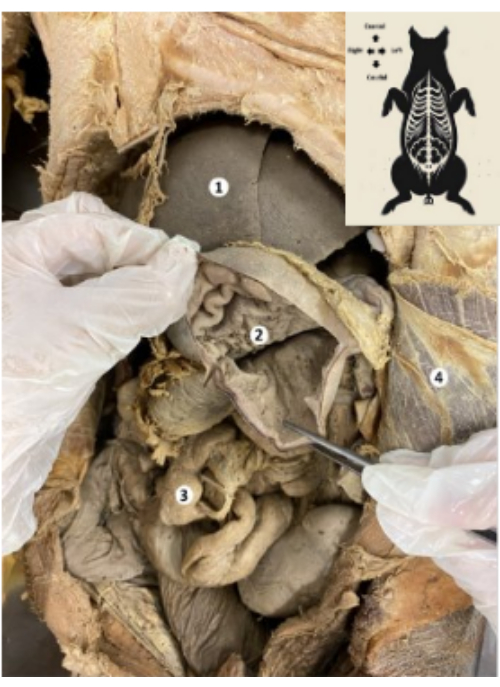
Figura 9: Stomaco del biomodello suino conservato. (1) Fegato. (2) Mucosa gastrica. (3) Intestino. (4) Muscolo trasverso dell'addome e peritoneo parietale. Clicca qui per visualizzare una versione più grande di questa figura.
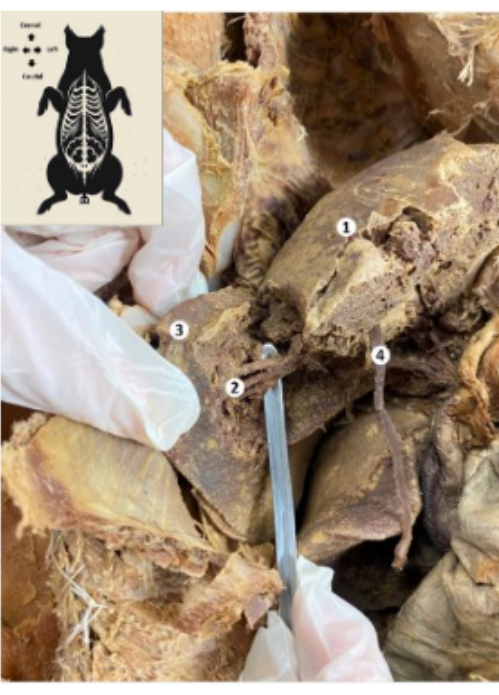
Figura 10: Fegato del biomodello suino conservato. (1) Faccia diaframmatica del fegato. (2) Segmento posteriore inferiore del fegato (arteria epatica, dotto biliare, ramo posteriore inferiore della vena porta). (3) Lobo destro del fegato. (4) Legamento rotondo del fegato. Clicca qui per visualizzare una versione più grande di questa figura.
| Reattivo | Concentrazione finale | Quantità | Volume finale |
| Etanolo 96% | 30% | 7,8 L | 25 L |
| Glicerina | 20% | 5L | |
| Formaldeide 40% | 2% | 0,5 L | |
| Cloruro di benzalconio 50% | 2% | 1 litro | |
| Essenza aromatica (Caffè) | 0.40% | 0,1 L | |
| Acqua distillata | NA | 10,6 L |
Tabella 1: Soluzione conservante a base di una soluzione cilena modificata.
| Reattivo | Concentrazione finale | Quantità | Volume finale |
| Etanolo 96% | 30% | 7,8 L | 25 L |
| Glicerina | 20% | 5L | |
| Cloruro di benzalconio 50% | 2% | 1 litro | |
| Essenza aromatica (Caffè) | 0.40% | 0,1 L | |
| Acqua distillata | NA | 11,1 L |
Tabella 2: Soluzione conservante priva di formaldeide a base di una soluzione cilena modificata.
| Fazzoletto | Non conservato | Preservato | ||
| Newton ± SD* | Modulo di Young ± SD* | Newton ± SD* | Modulo di Young ± SD* | |
| Nervo vago | 4,92 ± 0,98 | 879,5 ± 427,02 | 8.59 ± 0.83 | 1392,21 ± 729,6 |
| Arteria aortica | 9.33 ± 1.5 | 325,89 ± 176,15 | 8.48 ± 1.26 | 417,16 ± 379,95 |
| Vena cava | 5.73 ± 2.3 | 145,5 ± 40,89 | 8.92 ± 3.97 | 264,69 ± 188,72 |
Tabella 3: Caratteristiche tissutali di campioni di strutture anatomiche non conservate e conservate. *SD: Deviazione standard.
Discussione
Tradizionalmente, gli studi anatomici si sono basati su cadaveri umani; Tuttavia, le sfide nell'acquisizione di questi campioni hanno portato all'esplorazione di metodi alternativi. I biomodelli suini si sono dimostrati strumenti preziosi per lo studio dell'anatomia umana, offrendo somiglianze anatomiche che facilitano l'apprendimento e la sua estrapolazione alle applicazioni mediche nell'uomo 12,13,14,15. Sebbene le tecniche di conservazione dei cadaveri siano state tradizionalmente descritte qualitativamente, la misurazione della forza e dell'elasticità dei tessuti conservati utilizzando il modulo di Young potrebbe fornire prove quantitative del grado di conservazione. La ricerca di approcci innovativi nella conservazione dei tessuti biologici risponde all'esigenza di facilitare l'esplorazione della complessità anatomica in modelli realistici. Pertanto, il protocollo per la conservazione dei biomodelli suini sviluppato e utilizzato nel Laboratorio di Anatomia dell'Universidad Icesi si presenta come una valida alternativa per la conservazione dei tessuti e il successivo studio anatomico.
Sulla base dell'esperienza, l'approccio alla circolazione del campione attraverso l'aorta addominale nei biomodelli suini è un'alternativa più efficace rispetto all'incannulamento arterioso femorale, che viene comunemente eseguito nei cadaveri umani16. La natura fragile delle pareti arteriose femorali suine ha spinto a preferire l'approccio addominale, poiché queste pareti sono suscettibili di rottura a causa della pressione esercitata dalla pompa di perfusione. Garantire un punto di ingresso praticabile è fondamentale, poiché la fase di repletion nel protocollo è fondamentale per l'adeguata conservazione dell'intero campione. Una replezione non ottimale comporta un alto rischio di decomposizione. Pertanto, i segnali di repletio riusciti devono essere valutati prima di continuare con il protocollo. Questi segni includono l'estensione degli arti superiori e inferiori, la pletora cervicale e toracica e il deflusso della soluzione attraverso le narici a causa della perfusione della soluzione conservante. Una sfida comune che può sorgere durante l'esecuzione di questo protocollo è la lacerazione dell'arteria aortica durante l'infusione della soluzione conservante. In tali casi, è consigliabile legare l'arteria e procedere con la dissezione di un segmento superiore per facilitare l'incannulamento secondario e riprendere la fase di replezione. Inoltre, se si notano segni di decomposizione in qualsiasi momento durante il protocollo, l'intero campione deve essere scartato.
La soluzione conservante utilizzata in questo protocollo include variazioni rispetto alla soluzione cilena convenzionale, come l'assenza di cloruro di sodio, un aumento della concentrazione di etanolo dal 24% al 30%, un aumento della concentrazione di glicerina dal 16% al 20%, una diminuzione della concentrazione di formaldeide dal 3,7% al 2% e la sostituzione dell'essenza di eucalipto con l'essenza di caffè17.
Il processo di deformazione, un altro passaggio cruciale del protocollo, in quanto una corretta deformatizzazione riduce l'esposizione del personale alla formaldeide, compresi insegnanti, laboratoristi e studenti. Inoltre, il processo di ammorbidimento con glicerina è essenziale per ottenere una consistenza simile a quella dei tessuti freschi. La conservazione convenzionale con il 10% di formaldeide provoca tessuti rigidi che perdono elasticità e diventano più inclini a lacerarsi durante la manipolazione. Tuttavia, l'utilizzo della soluzione cilena modificata con una concentrazione ridotta di formaldeide del 2%, seguita da deformatizzazione e ammorbidimento con glicerina, mitiga questo problema.
Seguendo questo protocollo, è stato raggiunto un alto grado di flessibilità durante la manipolazione, mentre gli organi solidi, come il fegato, hanno mostrato una consistenza che, sebbene solida, ha permesso la dissezione e l'identificazione delle loro strutture. Tuttavia, sono necessari ulteriori studi quantitativi per confrontare la qualità di conservazione dei tessuti tra diverse tecniche di conservazione.
Nell'esecuzione di questo protocollo è necessario considerare diverse potenziali limitazioni. In primo luogo, bisogna prestare una meticolosa attenzione alle dimensioni dell'esemplare, con un range consigliato di 15-20 kg. Gli animali più grandi possono presentare sfide nell'esecuzione del protocollo di conservazione e nella gestione della disposizione del biomodello. In secondo luogo, il laboratorio designato dovrebbe essere dotato di un adeguato sistema di estrazione dei vapori e di un sifone per i rifiuti nel sistema fognario. Questa precauzione ha lo scopo di mitigare l'esposizione del personale tecnico ai vapori organici e ridurre al minimo la contaminazione ambientale derivante dai residui prodotti durante il processo di conservazione. In terzo luogo, deve essere riconosciuta la potenziale presenza di varianti anatomiche nei biomodelli. Inoltre, mentre gli esemplari suini condividono somiglianze anatomiche con gli esseri umani, mostrano anche differenze. Pertanto, un'attenta considerazione di tali variazioni è giustificata negli studi anatomici comparativi.
La valutazione delle proprietà organolettiche dei tessuti è stata tradizionalmente affrontata in modo qualitativo, concentrandosi su caratteristiche quali odore, colore, rigidità, fragilità e facilità di manipolazione18. Tuttavia, c'è una notevole scarsità di studi che mirano a determinare oggettivamente questi parametri. Un esempio è il lavoro di HP Theeuwes, che ha confrontato la mobilità delle articolazioni degli arti superiori in cadaveri conservati con l'11% di formalina, tessuto fresco e un metodo modificato che immobilizzava le articolazioni per misurare la forza richiesta per la flessione5. In questo contesto, il team di ricerca sta sviluppando metodi per valutare oggettivamente le proprietà meccaniche dei tessuti, cercando di superare i limiti delle valutazioni qualitative esistenti.
In termini di conservazione dei cadaveri, sebbene la formalina sia l'agente più comunemente usato, sono state utilizzate con successo anche diverse sostanze alternative. Queste sostanze includono glutaraldeide, glicole monoetilenico, glicole dietilenico, soluzioni di etanolo-glicerina e sali saturi. La diversità dei metodi di conservazione riflette la continua ricerca di ottimizzare la conservazione dei tessuti per scopi di ricerca medica, educativi o espositivi 3,19. Questi progressi evidenziano l'importanza della ricerca nello sviluppo di tecniche di conservazione più efficaci per mantenere le proprietà strutturali e funzionali dei tessuti umani in modo ottimale per periodi prolungati.
Per le applicazioni future, l'elevato livello di conservazione dei tessuti osservato con questo protocollo è molto promettente per il progresso della ricerca anatomica e dell'istruzione. Il potenziale di questo metodo si estende agli studi anatomici avanzati, fornendo modelli realistici per la formazione chirurgica e contribuendo allo sviluppo di simulazioni mediche immersive. Inoltre, l'adattabilità del protocollo apre strade per l'esplorazione di diversi campioni anatomici, ampliando così la sua utilità in vari contesti medici e scientifici.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
La gratitudine va al Dipartimento di Scienze Mediche di Base e all'Ufficio Ricerca dell'Universidad Icesi per il loro sostegno in questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
Riferimenti
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon