Method Article
Conservation de biomodèles porcins pour l’étude de l’anatomie humaine comparée
Dans cet article
Résumé
Cet article présente un protocole de préservation des biomodèles porcins. La méthode proposée consiste à utiliser une solution chilienne modifiée avec une concentration réduite de formol. Le processus de conservation consiste à administrer la solution à la fois par réplétion et immersion de l’échantillon, suivie d’une déformolisation et d’un adoucissement des tissus à l’aide de glycérine.
Résumé
L’enseignement de l’anatomie humaine dans l’enseignement médical est confronté à des défis, nécessitant des alternatives efficaces pour que les étudiants puissent explorer concrètement la complexité anatomique. Les biomodèles porcins, avec leurs similitudes anatomiques avec les humains, offrent une solution prometteuse. Cet article présente un protocole détaillé pour la préservation des biomodèles porcins, répondant au besoin de méthodes accessibles et efficaces dans les études d’anatomie comparative. Ce protocole propose l’utilisation d’une solution chilienne modifiée pour la préservation des biomodèles, en utilisant des techniques de formalisation par réplétion et immersion. Par la suite, la déformalisation est réalisée à l’aide de la solution chilienne modifiée sans formaldéhyde, suivie d’un processus d’adoucissement à la glycérine. Étant donné la rareté de la littérature sur les techniques de conservation et l’absence d’une procédure ou d’un test standardisé pour évaluer la conservation des tissus, nous suggérons d’évaluer la qualité des tissus en fonction des mesures de résistance et d’élasticité. Nos résultats indiquent un niveau qualitativement élevé de préservation des tissus dans nos échantillons. De plus, ces biomodèles sont actuellement utilisés avec succès pour les études morphologiques et dans l’enseignement de l’anatomie comparée humaine aux étudiants en médecine.
Introduction
L’enseignement de l’anatomie dans les facultés de médecine se heurte souvent à des obstacles, tels que des difficultés d’accès aux corps humains pour la dissection et le manque d’installations adaptées. Ces limites soulignent la nécessité de trouver des alternatives efficaces qui permettent aux étudiants d’explorer la complexité anatomique de manière pratique et réaliste. Dans ce contexte, les biomodèles porcins sont apparus comme une alternative prometteuse en raison de leurs similitudes anatomiques avec l’homme, offrant un moyen accessible et efficace d’apprendre et d’enseigner l’anatomie1.
Les techniques de préservation anatomique visent à maintenir l’intégrité des tissus biologiques tout en minimisant les dommages. Ces techniques ont été utilisées à des fins éducatives, académiques et de recherche dans l’étude de l’anatomie humaine et vétérinaire. De nombreuses substances ont été testées pour préserver le corps, les organes et les tissus dans leur état naturel le plus longtemps possible2. Cependant, la préservation et la conservation des échantillons anatomiques restent difficiles, en particulier pour ceux destinés aux études morphologiques, où une préservation élevée des tissus estrequise3.
Même si les solutions utilisées traditionnellement sont largement disponibles, les limites de la pratique quotidienne sont évidentes. Le formol, l’une des substances les plus couramment utilisées, présente plusieurs inconvénients documentés pour la préservation des tissus. Il s’agit notamment de son odeur irritante, de sa toxicité élevée, des risques associés de cancer et de mutagénicité pour les manipulateurs, et des changements organoleptiques qu’il induit dans les tissus, tels que la rigidité et la décoloration. Ces changements peuvent altérer la perception des propriétés physiologiques des tissus lorsqu’ils sont étudiés après fixation, ce qui peut entraver des études morphologiques précises et exactes4. Des études ont montré que la fixation avec de fortes concentrations de formol entraîne un plus grand degré de rigidité tissulaire5. Des alternatives, telles que la technique d’embaumement Thiel, ont démontré des résultats prometteurs avec une meilleure conservation de la coloration d’origine et une meilleure souplesse des tissus6. Cependant, cette technique est plus coûteuse par rapport à d’autres solutions7. Ces défis offrent l’occasion de concevoir et de tester de nouvelles techniques de préservation abordables qui permettent toujours un enseignement de l’anatomie de haute qualité.
L’objectif de ce protocole est de décrire la méthodologie employée au Laboratoire d’anatomie de l’Universidad Icesi de Cali, en Colombie, pour la préservation des biomodèles porcins utilisés comme outils pédagogiques pour l’étude comparative de l’anatomie humaine.
Protocole
La technique décrite a été développée dans le plein respect des directives du Comité d’éthique institutionnel pour le soin et l’utilisation des animaux en expérimentation (CIECUAE) de l’Universidad Icesi, conformément à la loi 84 de 1989 et à la résolution n° 847 du recteur (9 juillet 2012). Cela garantit à la fois l’intégrité scientifique et le bien-être des animaux utilisés, en minimisant leurs souffrances. Des porcs Landrace mâles, âgés de 3 mois et pesant de 15 à 20 kg, ont été utilisés pour cette étude. Les réactifs et l’équipement requis sont répertoriés dans la table des matériaux.
1. Biomodèle porcin
- Sacrifice de l’animal
- Procéder à une évaluation vétérinaire générale et mettre en quarantaine l’échantillon de porc sélectionné pendant 24 h. Si l’animal ne présente aucun symptôme pendant cette période, procédez à l’euthanasie.
- Anesthésie
- Administrer l’anesthésie par voie intramusculaire à l’aide de kétamine + xylazine + atropine à des doses de 10 mg/kg, 0,5 mg/kg et 0,04 mg/kg, respectivement (selon les protocoles approuvés par l’établissement).
REMARQUE : Assurez-vous d’une anesthésie profonde. Évaluez la profondeur de l’anesthésie par l’examen physique. L’anesthésie profonde est indiquée par une pupille dilatée et centrée, l’absence de réflexe palpébral, une dépression du réflexe cornéen et une diminution de la fréquence respiratoire, de la fréquence cardiaque et de la pression artérielle.
- Administrer l’anesthésie par voie intramusculaire à l’aide de kétamine + xylazine + atropine à des doses de 10 mg/kg, 0,5 mg/kg et 0,04 mg/kg, respectivement (selon les protocoles approuvés par l’établissement).
- Euthanasie
- Administrer 5 mL de pentobarbital/diphénylhydantoïne de sodium (390/50 mg/mL) par voie intraveineuse. Après l’administration de l’agent d’euthanasie, auscultez les paramètres physiologiques de l’animal pour l’espèce Suis Scrofa : HR, 60-90 ; FR, 8-18 ; et T° 37-39°C8.
- Surveillez la fréquence cardiaque jusqu’à ce qu’elle diminue progressivement et s’arrête complètement. Observez les changements immédiats tels que le relâchement du sphincter, les membranes cyanosiques et l’absence de réponse aux stimuli corporels. Considérez l’euthanasie comme complète après 5 minutes d’auscultation cardiaque sans détecter de battement cardiaque.
- Stockage et transport
- Transporter le biomodèle porcin de la salle d’intervention au laboratoire d’anatomie dans la demi-heure suivant l’euthanasie afin d’éviter la décomposition et la prolifération microbienne, optimisant ainsi la conservation du biomodèle.
2. Solution de préservation à base de solution chilienne
- Préparation de la solution chilienne modifiée
- Utilisez une solution chilienne modifiée contenant de l’éthanol, de la glycérine, du formaldéhyde, du chlorure de benzalkonium, de l’essence aromatique de café et de l’eau distillée. Assurez-vous que la solution a un pH de 7,0.
- Préparez la solution de préservation dans un réservoir de 50 L. Tout d’abord, ajoutez 10,6 L d’eau distillée dans le réservoir. Ensuite, ajoutez 7,6 L d’éthanol à 96 %, 5 L de glycérine, 0,5 L de chlorure de benzalkonium à 50 % et 0,1 L d’essence aromatique de café.
REMARQUE : Voir le tableau 1 pour connaître les concentrations et les volumes requis de chaque composant nécessaire à la préparation de 25 L de la solution chilienne modifiée.
3. Administration de la solution de préservation chilienne modifiée
REMARQUE : Une fois la solution de conservation préparée, administrez-la par réplétion et immersion.
- Administration par réplétion de la solution de préservation chilienne modifiée
REMARQUE : Utilisez des vêtements de biosécurité pour cette procédure : un demi-masque réutilisable avec des filtres A1P2, des lunettes de biosécurité, une blouse chirurgicale jetable à manches longues, un bonnet chirurgical, des jambières et des gants en nitrile.- Approche chirurgicale
- Faites une incision le long de la linea alba (à l’aide d’un manche de scalpel 4, lame 22) de l’apophyse xiphoïde à la région pubienne.
- Identifier le tissu cellulaire sous-cutané et les fibres musculaires du muscle droit de l’abdomen.
REMARQUE : Au moment de l’incision, identifiez le peu de tissu adipeux adhérant à la peau, connu sous le nom de tissu cellulaire sous-cutané, et les fibres musculaires du muscle droit de l’abdomen situées plus profondément9. - Soigneusement coupé pour accéder au péritoine, assurant son ouverture à la cavité abdominale sans blesser le foie et les intestins, qui seront exposés immédiatement.
- Rétractez les anses intestinales vers le côté droit de la cavité abdominale. Identifiez le péritoine pariétal recouvrant les vaisseaux rénaux et rénaux gauches. Utilisez ces structures vasculaires pour localiser l’aorte abdominale.
- Trouver l’émergence du pédicule rénal gauche. Retirez le péritoine qui recouvre l’aorte à 5 cm au-dessus de l’artère rénale.
- Lors de l’exposition du pédicule rénal gauche, mobiliser les anses intestinales et inciser le péritoine recouvrant le hile. Disséquer antéropostérieurement pour identifier d’abord la veine rénale, qui est plus grande et située antérieurement.
- Localiser l’artère rénale vers l’arrière, en suivant sa trajectoire jusqu’à son origine dans l’aorte abdominale. Enfin, identifiez le bassinet du rein, la structure la plus postérieure du hile9.
- Disséquez soigneusement la partie postérieure de l’aorte. Utilisez de la soie 0/0 pour ligaturer l’aorte avec un nœud au-dessus du niveau de l’artère rénale et un autre nœud à 5 cm au-dessus.
- Clampez immédiatement l’aorte à l’aide de deux pinces Kelly aux deux extrémités du segment aortique isolé.
- Incisez la paroi aortique avec la pointe des ciseaux Metzembaum, en faisant une incision d’environ 0,3 cm dans la paroi antérieure de l’aorte, en prenant soin de ne pas la perforer.
- Noeudez l’extrémité distale tout en retirant la pince Kelly pour insérer une aiguille émoussée en forme de L de 3,2 mm dans la lumière artérielle. Retirez la pince de Kelly proximale et commencez la perfusion de la solution conservante chilienne modifiée.
- Perfusion aortique de la solution conservatrice chilienne modifiée
- Procéder à la perfusion de la solution conservative chilienne modifiée.
REMARQUE : Administrer 0,25 L/kg avec une pression de 10 livres à l’aide d’une pompe à perfusion. - Fin de la perfusion
- Une fois la perfusion de la solution de conservation terminée, retirez la canule de perfusion et nouez le site d’insertion avec de la soie 0/0 pour éviter le reflux de la solution de conservation. Fermez l’abdomen en suturant l’incision au niveau de la linea alba avec de la soie 0/0.
REMARQUE : Pour évaluer si une perfusion adéquate a été obtenue, vérifiez les indicateurs aigus de saturation : extension des membres supérieurs et inférieurs, pléthore cervicale et thoracique et écoulement de la solution par les narines. Le temps de perfusion approximatif est de 2 h.
- Une fois la perfusion de la solution de conservation terminée, retirez la canule de perfusion et nouez le site d’insertion avec de la soie 0/0 pour éviter le reflux de la solution de conservation. Fermez l’abdomen en suturant l’incision au niveau de la linea alba avec de la soie 0/0.
- Approche chirurgicale
- Administration par immersion
REMARQUE : Utilisez des vêtements de biosécurité pour cette procédure : un demi-masque réutilisable avec des filtres A1P2, des lunettes de biosécurité, une blouse chirurgicale jetable à manches longues, un bonnet chirurgical, des jambières et des gants en nitrile.- Administration par immersion de la solution conservative chilienne modifiée
- Conservez l’échantillon porcin dans un réservoir de 300 L rempli de la même solution de préservation que celle décrite à l’étape 2.
REMARQUE : Assurez-vous que le biomodèle est complètement immergé en utilisant environ 150 L de solution. Après l’immersion, conservez le biomodèle à 20 °C pendant 6 mois. L’absence de signes de décomposition (par exemple, œdème corporel, gonflement, odeur nauséabonde, lividité et friabilité des tissus) est un indicateur d’une conservation adéquate.
- Conservez l’échantillon porcin dans un réservoir de 300 L rempli de la même solution de préservation que celle décrite à l’étape 2.
- Administration par immersion de la solution conservative chilienne modifiée
4. Solution de déformolisation basée sur la solution chilienne
- Préparation de la solution de déformolisation
- Utilisez une solution chilienne modifiée contenant de l’éthanol, de la glycérine, du chlorure de benzalkonium, de l’essence aromatique de café et de l’eau distillée. Assurez-vous que la solution a un pH de 7,0.
- Préparez la solution de déformmolisation dans un réservoir de 50 L. Ajoutez d’abord 11,1 L d’eau distillée, puis 7,8 L d’éthanol à 96 %, 5 L de glycérine, 1 L de chlorure de benzalkonium à 50 % et 0,1 L d’essence aromatique de café.
REMARQUE : Se reporter au tableau 2 pour connaître les concentrations et les volumes requis de chaque composant nécessaire à la préparation de 25 L de la solution chilienne modifiée sans formaldéhyde.
5. Déformolisation
REMARQUE : Utilisez des vêtements de biosécurité pour cette procédure : un demi-masque réutilisable avec des filtres A1P2, des lunettes de biosécurité, une blouse chirurgicale jetable à manches longues, un bonnet chirurgical, des jambières et des gants en nitrile.
- Administration par immersion de la solution conservatrice chilienne modifiée sans formaldéhyde
- À la fin de la période de conservation par immersion de 6 mois, transférez le biomodèle dans un réservoir de 300 L rempli d’une solution de conservation chilienne modifiée sans formaldéhyde. Conservez le biomodèle pendant 4 semaines.
REMARQUE : Assurez-vous que le biomodèle est complètement immergé en utilisant environ 150 L de solution.
- À la fin de la période de conservation par immersion de 6 mois, transférez le biomodèle dans un réservoir de 300 L rempli d’une solution de conservation chilienne modifiée sans formaldéhyde. Conservez le biomodèle pendant 4 semaines.
6. Adoucissant la glycérine
- Immédiatement après le processus de déformolisation, immergez le biomodèle dans des solutions avec des concentrations croissantes de glycérine diluée dans l’eau : 50 %, 70 % et 90 % de glycérine. Maintenez le biomodèle dans chaque concentration pendant une semaine.
Résultats
L’objectif de ce protocole est de présenter une technique efficace et viable qui permet de préserver les biomodèles porcins pour l’enseignement de l’anatomie humaine comparée. Il n’existe actuellement aucune méthode ou test normalisé pour évaluer la préservation des modèles. Par conséquent, la préservation globale du modèle a été évaluée à l’aide d’indicateurs de réplétion de la solution et de signes de décomposition après l’achèvement du protocole sur les échantillons. De plus, afin d’évaluer objectivement la viabilité des biomodèles pour l’enseignement et la recherche, une comparaison des caractéristiques tissulaires de structures anatomiques sélectionnées, telles que la résistance et l’élasticité, a été planifiée avant et après la conservation. Les structures anatomiques sélectionnées étaient le nerf vague, l’artère aortique et la veine cave. Ces structures ont été choisies parce que les nerfs, les artères et les veines sont fondamentaux dans l’enseignement et l’apprentissage de l’anatomie générale. Par conséquent, 4 nerfs vagues, 4 artères aortiques et 3 veines cavales ont été isolés à partir de spécimens frais et non conservés.
En conséquence, en utilisant le protocole présenté, les corps de 12 spécimens de porcs ont été préservés. Les biomodèles porcins préservés ont été évalués pour déterminer la pertinence de la conservation à l’aide d’indicateurs de réplétion, tels que l’extension des membres antérieurs, le sang et la solution de préservation s’écoulant par les narines (figure 1), l’œdème et une augmentation du périmètre thoracique et cervical (figure 2 et figure 3), ainsi que l’apparition d’un motif marbré blanchâtre dans le foie (figure 4) et la pâleur des anses intestinales (figure 5). Tous les biomodèles ont montré des indicateurs de réussite de la réplétion. Après avoir terminé le protocole, aucun des biomodèles n’a montré de changements associés à la décomposition, tels que la distension des anses intestinales, une odeur nauséabonde ou la friabilité des tissus.
Après inspection des biomodèles, il était évident que cette technique avait réussi à préserver les tissus pour la manipulation et la dissection. Les exemples incluent les muscles et leurs aponévroses (Figure 6), le péritoine (Figure 7) et l’estomac et les intestins (Figure 8). Cela a été évalué subjectivement, car tous ces organes maintenaient une grande flexibilité pendant la manipulation. La consistance du foie, bien que ferme, a permis d’identifier les canaux intrahépatiques et leur vascularisation associée après dissection (Figure 9 et Figure 10).
Cependant, les résultats n’étaient pas toujours aussi prometteurs. Avant l’élaboration du protocole, la colonisation fongique des biomodèles était un problème fréquent. Cela est peut-être attribuable à l’utilisation d’une technique non normalisée pour la réplétion et l’administration par immersion de la solution de préservation. La figure 6 montre un biomodèle qui a été affecté par la colonisation.
De plus, afin d’évaluer objectivement la préservation des tissus, des caractéristiques spécifiques d’intérêt ont été mesurées dans des structures non préservées et préservées. Quatre nerfs vagues, quatre artères aortiques et trois veines cava ont été isolés à partir de biomodèles préservés. Les caractéristiques mesurées étaient la résistance du tissu (quantifiée comme les newtons nécessaires pour déchirer la structure) et la flexibilité du tissu (mesurée à l’aide du module de Young)10,11. Les résultats sont présentés sous forme de moyenne ± d’écart-type (ET) dans le tableau 3.
L’extraction chirurgicale de ces structures et l’évaluation de leur élasticité et de leur résistance ont été menées afin de fournir une approximation quantitative du degré de conservation de l’ensemble du biomodèle et de la façon dont il a conservé ses propriétés mécaniques d’origine. La sélection de ces structures anatomiques spécifiques a été basée sur le fait que les structures vasculaires et nerveuses sont le plus souvent manipulées par les enseignants et les élèves lors de la dissection, ce qui présente un risque accru de rupture.
Pour évaluer les propriétés mécaniques des tissus biologiques animaux, une méthode a été conçue qui consistait à suspendre l’échantillon entre deux pinces, dont l’une des extrémités était reliée à un capteur de force et l’autre extrémité soumise à une charge croissante par un flux constant d’eau. La force exercée a été calculée en tenant compte de la densité de l’eau et de la gravité, tandis que l’allongement de l’échantillon a été mesuré avec une charge croissante. Ces mesures ont permis de déterminer le module de Young, représentant la rigidité du tissu, ainsi que d’identifier la résistance maximale à l’application d’une force spécifique, reflétant la capacité du tissu à résister aux charges avant la rupture. Cette méthode fournit une évaluation précise des propriétés élastiques et de résistance des tissus biologiques, ce qui est fondamental pour comprendre leur comportement mécanique.
Les nerfs vagues préservés ont montré une augmentation significative de la résistance et de l’élasticité par rapport aux spécimens non conservés. Contrairement aux attentes, l’artère aortique préservée a montré une résistance légèrement plus faible mais une augmentation modérée de l’élasticité par rapport aux spécimens non conservés. La préservation de la veine cave a entraîné une augmentation notable de la résistance et de l’élasticité. Ces résultats indiquent que le processus de préservation a un impact perceptible sur les propriétés mécaniques des tissus évalués, fournissant des informations précieuses pour l’application de ces tissus préservés dans des études anatomiques.
L’équipe de recherche en morphologie qui a développé ce protocole possède une grande expérience dans la préservation de biomodèles porcins. Une amélioration qualitative des résultats de conservation a été observée en termes de propriétés organoleptiques des tissus en raison des modifications et de l’optimisation des techniques conventionnelles précédemment utilisées, telles que la conservation avec 10 % de formol. Les biomodèles préservés sont actuellement utilisés avec succès à l’Universidad Icesi pour les études morphologiques et l’enseignement de l’anatomie humaine comparée pour les étudiants en médecine. Le modèle avec la plus longue durée de vie en laboratoire a atteint 7 ans à température ambiante sans nécessiter de nouvelles immersions ou de processus supplémentaires. L’expérience de l’enseignement a montré que, malgré des niveaux élevés de manipulation par les étudiants, les biomodèles maintiennent l’intégrité des structures anatomiques jusqu’à 4 ans après leur conservation.

Figure 1 : Écoulement du sang et de la solution de conservation par les narines. (A) Écoulement avant la perfusion. (B) Écoulement pendant la perfusion. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Périmètre thoracique avant et après la perfusion de la solution de conservation. (A) Périmètre thoracique avant la perfusion. (B) Périmètre thoracique après perfusion. Une augmentation de 4 cm du périmètre thoracique est observée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
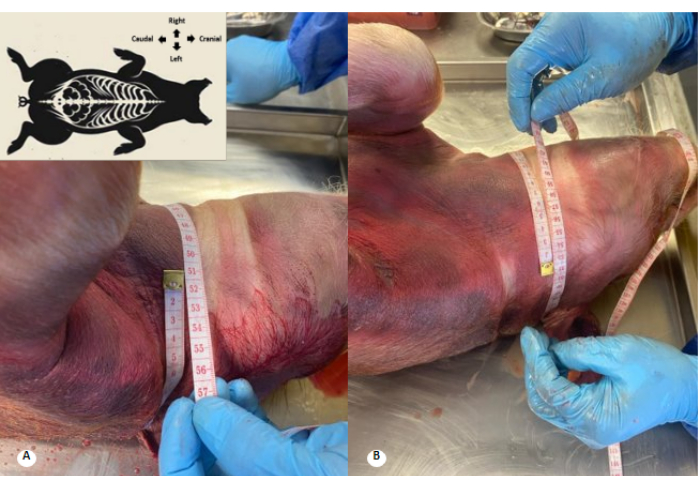
Figure 3 : Périmètre cervical avant et après la perfusion d’une solution de conservation. (A) Périmètre cervical avant la perfusion. (B) Périmètre cervical après perfusion. Une augmentation de 1 cm du périmètre cervical et un effacement des plis cervicaux sont observés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
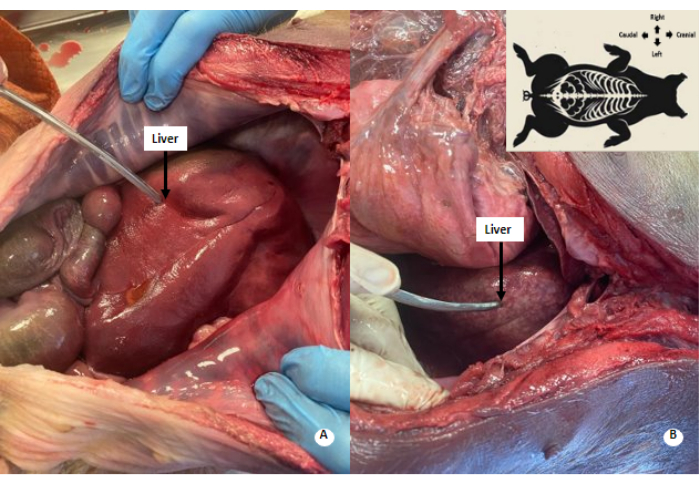
Figure 4 : Motif marbré blanchâtre dans le foie. (A) Foie avant la perfusion. (B) Foie après perfusion. Un motif tacheté blanchâtre est observé dans le foie perfusé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Pâleur des anses intestinales. (A) Intestin grêle avant la perfusion. (B) Intestin grêle après perfusion. Une pâleur des anses intestinales est observée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Biomodèle colonisé par un champignon. La traction ventrale de la veine cave inférieure montre une colonisation fongique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Muscle transverse de l’abdomen et son aponévrose. (1) Muscle transverse de l’abdomen. (2) Aponévrose du muscle transverse de l’abdomen. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Péritoine pariétal du biomodèle porcin préservé. (1) Péritoine pariétal. (2) Lobe gauche du foie sectionné. (3) Estomac. Veuillez cliquer ici pour voir une version agrandie de cette figure.
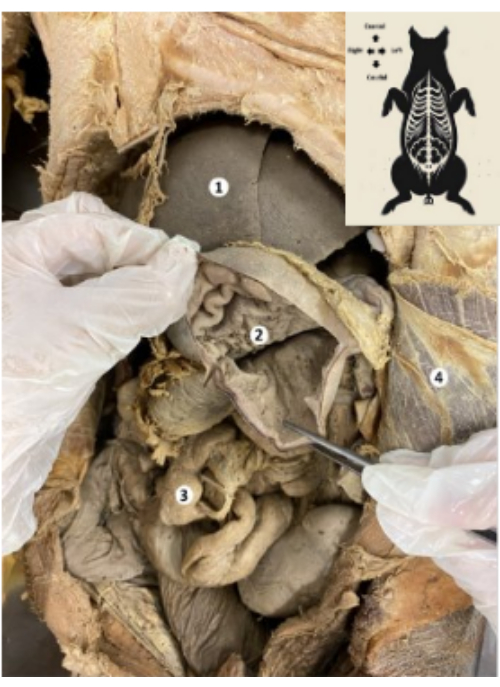
Figure 9 : Estomac du biomodèle porcin conservé. (1) Foie. (2) Muqueuse gastrique. (3) Intestins. (4) Muscle transverse de l’abdomen et péritoine pariétal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
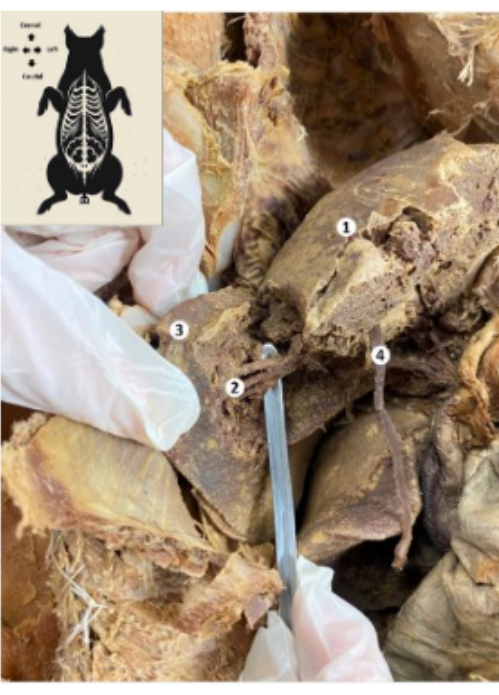
Figure 10 : Foie du biomodèle porcin conservé. (1) Face diaphragmatique du foie. (2) Segment postérieur inférieur du foie (artère hépatique, canal biliaire, branche postérieure inférieure de la veine porte). (3) Lobe droit du foie. (4) Ligament rond du foie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Réactif | Concentration finale | Quantité | Volume final |
| Éthanol 96 % | 30% | 7,8 L | 25 L |
| Glycérine | 20% | 5L | |
| Formaldéhyde 40 % | 2% | 0,5 L | |
| Chlorure de benzalkonium 50 % | 2% | 1 L | |
| Essence aromatique (Café) | 0.40% | 0,1 L | |
| Eau distillée | NA | 10,6 L |
Tableau 1 : Solution de préservation à base d’une solution chilienne modifiée.
| Réactif | Concentration finale | Quantité | Volume final |
| Éthanol 96 % | 30% | 7,8 L | 25 L |
| Glycérine | 20% | 5L | |
| Chlorure de benzalkonium 50 % | 2% | 1 L | |
| Essence aromatique (Café) | 0.40% | 0,1 L | |
| Eau distillée | NA | 11,1 L |
Tableau 2 : Solution de préservation sans formaldéhyde à base d’une solution chilienne modifiée.
| Tissu | Non conservé | Confit | ||
| Newton ± SD* | Module de Young ± SD* | Newton ± SD* | Module de Young ± SD* | |
| Nerf vague | 4,92 ± 0,98 | 879.5 ± 427.02 | 8,59 ± 0,83 | 1392.21 ± 729.6 |
| Artère aortique | 9,33 ± 1,5 | 325.89 ± 176.15 | 8,48 ± 1,26 | 417.16 ± 379.95 |
| Veine cava | 5,73 ± 2,3 | 145,5 ± 40,89 | 8,92 ± 3,97 | 264,69 ± 188,72 |
Tableau 3 : Caractéristiques tissulaires des spécimens non conservés et préservés de structures anatomiques. *SD : Écart-type.
Discussion
Traditionnellement, les études anatomiques se sont appuyées sur des cadavres humains ; Cependant, les difficultés rencontrées lors de l’acquisition de ces spécimens ont conduit à l’exploration de méthodes alternatives. Les biomodèles porcins se sont avérés être des outils précieux pour l’étude de l’anatomie humaine, offrant des similitudes anatomiques qui facilitent l’apprentissage et son extrapolation à des applications médicales chez l’homme 12,13,14,15. Bien que les techniques de conservation cadavérique aient traditionnellement été décrites de manière qualitative, la mesure de la résistance et de l’élasticité des tissus préservés à l’aide du module de Young pourrait fournir des preuves quantitatives du degré de préservation. La recherche d’approches innovantes en matière de préservation des tissus biologiques répond à la nécessité de faciliter l’exploration de la complexité anatomique dans des modèles réalistes. Par conséquent, le protocole de préservation des biomodèles porcins développé et utilisé dans le laboratoire d’anatomie de l’Universidad Icesi est présenté comme une alternative viable pour la préservation des tissus et l’étude anatomique ultérieure.
D’après l’expérience, l’approche de la circulation de l’échantillon à travers l’aorte abdominale dans les biomodèles porcins est une alternative plus efficace par rapport à la canulation artérielle fémorale, qui est couramment pratiquée chez les cadavres humains16. La fragilité des parois artérielles fémorales porcines a incité à préférer l’approche abdominale, car ces parois sont susceptibles de se rompre sous l’effet de la pression exercée par la pompe de perfusion. Il est crucial de garantir un point d’entrée viable, car l’étape de réapprovisionnement du protocole est essentielle à la conservation adéquate de l’ensemble de l’échantillon. Une réplétion sous-optimale présente un risque élevé de décomposition. Par conséquent, les signes de réussite de la réplétion doivent être évalués avant de poursuivre le protocole. Ces signes comprennent l’extension des membres supérieurs et inférieurs, la pléthore cervicale et thoracique et l’écoulement de la solution par les narines en raison de la perfusion de la solution de conservation. Un défi courant qui peut survenir lors de l’exécution de ce protocole est la déchirure de l’artère aortique lors de la perfusion de la solution de conservation. Dans de tels cas, il est conseillé de ligaturer l’artère et de procéder à la dissection d’un segment supérieur pour faciliter la canulation secondaire et reprendre l’étape de réplétion. De plus, si des signes de décomposition apparaissent à un moment quelconque du protocole, l’échantillon entier doit être jeté.
La solution de conservation utilisée dans ce protocole comprend des variations par rapport à la solution chilienne conventionnelle, telles que l’absence de chlorure de sodium, une augmentation de la concentration d’éthanol de 24 % à 30 %, une augmentation de la concentration de glycérine de 16 % à 20 %, une diminution de la concentration de formaldéhyde de 3,7 % à 2 % et le remplacement de l’essence d’eucalyptus par de l’essence de café17.
Le processus de déformolisation est une autre étape cruciale du protocole, car une déformolisation appropriée réduit l’exposition du personnel au formaldéhyde, y compris les enseignants, les laboratoriens et les étudiants. De plus, le processus d’adoucissement à la glycérine est essentiel pour obtenir une texture similaire à celle des tissus frais. La conservation conventionnelle avec 10 % de formaldéhyde entraîne des tissus rigides qui perdent de leur élasticité et deviennent plus susceptibles de se déchirer lors de la manipulation. Cependant, l’utilisation de la solution chilienne modifiée avec une concentration réduite de formaldéhyde de 2 %, suivie d’une déformolisation et d’un adoucissement à la glycérine, atténue ce problème.
Selon ce protocole, un haut degré de flexibilité a été atteint lors de la manipulation, tandis que les organes solides, tels que le foie, présentaient une consistance qui, bien que ferme, permettait la dissection et l’identification de leurs structures. Néanmoins, d’autres études quantitatives sont nécessaires pour comparer la qualité de conservation des tissus entre différentes techniques de conservation.
Plusieurs limites potentielles doivent être prises en compte lors de la mise en œuvre de ce protocole. Tout d’abord, une attention méticuleuse doit être accordée à la taille de l’échantillon, avec une plage recommandée de 15 à 20 kg. Les animaux de plus grande taille peuvent présenter des défis dans l’exécution du protocole de préservation et la gestion de l’élimination du biomodèle. Deuxièmement, le laboratoire désigné devrait être équipé d’un système d’extraction de vapeur approprié et d’un piège à déchets dans le système d’égouts. Cette précaution vise à atténuer l’exposition du personnel technique aux vapeurs organiques et à minimiser la contamination de l’environnement résultant des résidus produits pendant le processus de conservation. Troisièmement, la présence potentielle de variantes anatomiques dans les biomodèles doit être reconnue. De plus, bien que les spécimens porcins partagent des similitudes anatomiques avec les humains, ils présentent également des différences. Par conséquent, il est justifié d’examiner attentivement ces variations dans les études anatomiques comparatives.
L’évaluation des propriétés organoleptiques des tissus a traditionnellement été abordée de manière qualitative, en se concentrant sur des caractéristiques telles que l’odeur, la couleur, la rigidité, la fragilité et la facilité de manipulation18. Cependant, il y a une pénurie notable d’études visant à déterminer objectivement ces paramètres. Un exemple est le travail de HP Theeuwes, qui a comparé la mobilité des articulations des membres supérieurs dans des cadavres conservés avec 11 % de formol, de tissu frais et une méthode modifiée qui immobilisait les articulations pour mesurer la force requise pour la flexion5. Dans ce contexte, l’équipe de recherche développe des méthodes pour évaluer objectivement les propriétés mécaniques des tissus, en cherchant à surmonter les limites des évaluations qualitatives existantes.
En termes de conservation des cadavres, bien que le formol soit l’agent le plus couramment utilisé, plusieurs substances alternatives ont également été utilisées avec succès. Ces substances comprennent le glutaraldéhyde, le monoéthylène glycol, le diéthylène glycol, les solutions d’éthanol et de glycérine et les sels saturés. La diversité des méthodes de conservation reflète la quête continue d’optimiser la préservation des tissus à des fins de recherche médicale, d’éducation ou d’exposition 3,19. Ces avancées soulignent l’importance de la recherche dans le développement de techniques de conservation plus efficaces pour maintenir les propriétés structurelles et fonctionnelles des tissus humains de manière optimale pendant de longues périodes.
Pour les applications futures, le niveau élevé de préservation des tissus observé avec ce protocole est très prometteur pour l’avancement de la recherche et de l’éducation anatomiques. Le potentiel de cette méthode s’étend aux études anatomiques avancées, fournissant des modèles réalistes pour la formation chirurgicale et contribuant au développement de simulations médicales immersives. De plus, l’adaptabilité du protocole ouvre des voies d’exploration dans divers spécimens anatomiques, élargissant ainsi son utilité dans divers contextes médicaux et scientifiques.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous exprimons notre gratitude au Département des sciences médicales fondamentales et au Bureau de recherche de l’Universidad Icesi pour leur soutien dans cette recherche.
matériels
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
Références
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon