Method Article
Konservierung von Schweine-Biomodellen für die Erforschung der vergleichenden menschlichen Anatomie
In diesem Artikel
Zusammenfassung
In diesem Artikel wird ein Protokoll zur Konservierung von Schweine-Biomodellen vorgestellt. Bei der vorgeschlagenen Methode wird eine modifizierte chilenische Lösung mit einer reduzierten Formalinkonzentration verwendet. Der Konservierungsprozess besteht aus der Verabreichung der Lösung sowohl durch Auffüllen als auch durch Eintauchen der Probe, gefolgt von Deformolisierung und Gewebeerweichung mit Glycerin.
Zusammenfassung
Die Lehre der menschlichen Anatomie in der medizinischen Ausbildung steht vor Herausforderungen, die effektive Alternativen für die Studierenden erfordern, um die anatomische Komplexität praktisch zu erforschen. Schweine-Biomodelle mit ihren anatomischen Ähnlichkeiten mit dem Menschen bieten eine vielversprechende Lösung. In diesem Artikel wird ein detailliertes Protokoll zur Konservierung von Schweine-Biomodellen vorgestellt, das dem Bedarf an zugänglichen und effizienten Methoden in vergleichenden Anatomiestudien gerecht wird. Dieses Protokoll schlägt die Verwendung einer modifizierten chilenischen Lösung für die Konservierung von Biomodellen vor, wobei Formalisierungstechniken durch Füllung und Eintauchen eingesetzt werden. Anschließend erfolgt die Deformalisierung mit der modifizierten chilenischen Lösung ohne Formaldehyd, gefolgt von einem Glycerin-Erweichungsprozess. Angesichts des Mangels an Literatur zu Konservierungstechniken und des Fehlens eines standardisierten Verfahrens oder Tests zur Bewertung der Gewebekonservierung empfehlen wir, die Gewebequalität anhand von Messungen der Widerstandsfähigkeit und Elastizität zu bewerten. Unsere Ergebnisse deuten auf einen qualitativ hohen Grad an Gewebeerhaltung in unseren Proben hin. Darüber hinaus werden diese Biomodelle derzeit erfolgreich für morphologische Studien und in der Lehre der humanvergleichenden Anatomie für Medizinstudenten eingesetzt.
Einleitung
Die Lehre der Anatomie an medizinischen Fakultäten stößt oft auf Hindernisse, wie z.B. Schwierigkeiten beim Zugang zu menschlichen Körpern zum Sezieren und den Mangel an geeigneten Einrichtungen. Diese Einschränkungen unterstreichen die Notwendigkeit effektiver Alternativen, die es den Studierenden ermöglichen, anatomische Komplexität praktisch und realistisch zu erforschen. In diesem Zusammenhang haben sich Schweine-Biomodelle aufgrund ihrer anatomischen Ähnlichkeit mit dem Menschen als vielversprechende Alternative herausgestellt und bieten ein zugängliches und effizientes Mittel zum Lernen und Lehren von Anatomie1.
Anatomische Konservierungstechniken zielen darauf ab, die Integrität biologischer Gewebe zu erhalten und gleichzeitig Schäden zu minimieren. Diese Techniken wurden zu Bildungs-, Wissenschafts- und Forschungszwecken sowohl bei der Erforschung der menschlichen als auch der veterinärmedizinischen Anatomie eingesetzt. Zahlreiche Substanzen wurden getestet, um Körper, Organe und Gewebe so lange wie möglich in ihrem natürlichen Zustand zu erhalten2. Die Konservierung und Konservierung anatomischer Präparate bleibt jedoch eine Herausforderung, insbesondere für solche, die für morphologische Studien bestimmt sind, bei denen eine hohe Gewebekonservierung erforderlich ist3.
Auch wenn traditionell verwendete Lösungen weit verbreitet sind, zeigen sich Grenzen in der täglichen Praxis. Formalin, eine der am häufigsten verwendeten Substanzen, hat mehrere dokumentierte Nachteile für die Gewebekonservierung. Dazu gehören der irritierende Geruch, die hohe Toxizität, die damit verbundenen Krebs- und Mutagenitätsrisiken für die Handler sowie die organoleptischen Veränderungen, die es im Gewebe hervorruft, wie z. B. Steifheit und Verfärbung. Diese Veränderungen können die Wahrnehmung der physiologischen Eigenschaften des Gewebes verändern, wenn sie nach der Fixation untersucht werden, was möglicherweise präzise und genaue morphologische Studien behindert4. Studien haben gezeigt, dass die Fixierung mit hohen Formalinkonzentrationen zu einer höheren Gewebesteifigkeit führt5. Alternativen, wie z. B. die Thiel-Einbalsamierungstechnik, haben vielversprechende Ergebnisse mit einer besseren Erhaltung der ursprünglichen Färbung und Biegsamkeit des Gewebes gezeigt6. Diese Technik ist jedoch im Vergleich zu anderen Lösungen teurer7. Diese Herausforderungen bieten die Möglichkeit, neue, erschwingliche Konservierungstechniken zu entwerfen und zu testen, die dennoch einen qualitativ hochwertigen Anatomieunterricht ermöglichen.
Das Ziel dieses Protokolls ist es, die Methodik zu beschreiben, die am Anatomielabor der Universidad Icesi in Cali, Kolumbien, zur Konservierung von Schweine-Biomodellen verwendet wird, die als Lehrmittel für die vergleichende Untersuchung der menschlichen Anatomie verwendet werden.
Protokoll
Die beschriebene Technik wurde in voller Übereinstimmung mit den Richtlinien der Institutionellen Ethikkommission für die Pflege und Verwendung von Tieren im Experiment (CIECUAE) der Universidad Icesi in Übereinstimmung mit dem Gesetz 84 von 1989 und dem Beschluss des Rektors Nr. 847 vom 9. Juli 2012 entwickelt. Dies gewährleistet sowohl die wissenschaftliche Integrität als auch das Wohlergehen der verwendeten Tiere und minimiert ihr Leiden. Für diese Studie wurden männliche Landrasseschweine im Alter von 3 Monaten und einem Gewicht von 15-20 kg verwendet. Die erforderlichen Reagenzien und Geräte sind in der Materialtabelle aufgeführt.
1. Biomodell des Schweins
- Opferung des Tieres
- Führen Sie eine allgemeine tierärztliche Untersuchung durch und stellen Sie das ausgewählte Schweineexemplar für 24 Stunden unter Quarantäne. Wenn das Tier während dieser Zeit keine Symptome zeigt, ist mit der Euthanasie fortzufahren.
- Anästhesie
- Verabreichen Sie intramuskulär eine Anästhesie mit Ketamin + Xylazin + Atropin in Dosen von 10 mg/kg, 0,5 mg/kg bzw. 0,04 mg/kg (gemäß den institutionell anerkannten Protokollen).
HINWEIS: Stellen Sie eine tiefe Anästhesie sicher. Beurteilen Sie die Tiefe der Anästhesie durch körperliche Untersuchung. Eine tiefe Anästhesie wird durch eine erweiterte und zentrierte Pupille, das Fehlen des Lidreflexes, eine Depression des Hornhautreflexes und eine verminderte Atemfrequenz, Herzfrequenz und Blutdruck angezeigt.
- Verabreichen Sie intramuskulär eine Anästhesie mit Ketamin + Xylazin + Atropin in Dosen von 10 mg/kg, 0,5 mg/kg bzw. 0,04 mg/kg (gemäß den institutionell anerkannten Protokollen).
- Euthanasie
- Verabreichen Sie 5 ml Natrium-Pentobarbital/Diphenylhydantoin (390/50 mg/ml) intravenös. Nach Verabreichung des Euthanasiemittels werden die physiologischen Parameter des Tieres für die Spezies Suis Scrofa auskultiert: HR, 60-90; FR, 8-18; und T° 37-39°C8.
- Überwachen Sie die Herzfrequenz, bis sie allmählich abnimmt und ganz stoppt. Beobachten Sie unmittelbare Veränderungen wie Schließmuskelentspannung, zyanotische Membranen und das Fehlen einer Reaktion auf Körperreize. Betrachten Sie die Euthanasie als abgeschlossen, nachdem Sie 5 Minuten Herzauskultation durchgeführt haben, ohne einen Herzschlag zu erkennen.
- Lagerung und Transport
- Transportieren Sie das Schweine-Biomodell innerhalb einer halben Stunde nach der Euthanasie vom Eingriffsraum in das Anatomielabor, um Zersetzung und mikrobielle Vermehrung zu verhindern und so die Konservierung des Biomodells zu optimieren.
2. Konservierungslösung auf Basis chilenischer Lösung
- Zubereitung der modifizierten chilenischen Lösung
- Verwenden Sie eine modifizierte chilenische Lösung, die Ethanol, Glycerin, Formaldehyd, Benzalkoniumchlorid, aromatische Kaffeeessenz und destilliertes Wasser enthält. Stellen Sie sicher, dass die Lösung einen pH-Wert von 7,0 hat.
- Bereiten Sie die Konservierungslösung in einem 50-Liter-Tank vor. Geben Sie zunächst 10,6 l destilliertes Wasser in den Tank. Fügen Sie anschließend 7,6 l 96 % Ethanol, 5 l Glycerin, 0,5 l 50 % Benzalkoniumchlorid und 0,1 l aromatische Kaffeeessenz hinzu.
HINWEIS: In Tabelle 1 sind die erforderlichen Konzentrationen und Volumina jeder Komponente aufgeführt, die zur Herstellung von 25 l der modifizierten chilenischen Lösung erforderlich sind.
3. Verabreichung der modifizierten chilenischen Konservierungslösung
HINWEIS: Sobald die Konservierungslösung hergestellt ist, verabreichen Sie sie durch Auffüllen und Eintauchen.
- Verabreichung durch Auffüllen der modifizierten chilenischen Konservierungslösung
HINWEIS: Verwenden Sie für dieses Verfahren Biosicherheitskleidung: eine wiederverwendbare Halbmaske mit A1P2-Filtern, eine Bioschutzbrille, einen langärmeligen Einweg-OP-Kittel, eine OP-Kappe, Leggings und Nitrilhandschuhe.- Chirurgischer Ansatz
- Machen Sie einen Schnitt entlang der Linea alba (mit einem Skalpellgriff 4, Klinge 22) vom Processus xiphoideus bis zur Schamregion.
- Identifizieren Sie das subkutane Zellgewebe und die Muskelfasern des Musculus rectus abdominis.
HINWEIS: Identifizieren Sie zum Zeitpunkt des Schnitts das spärliche Fettgewebe, das an der Haut haftet, das als subkutane Zellgewebe bezeichnet wird, und die Muskelfasern des Musculus rectus abdominis, die tiefer liegen9. - Vorsichtig schneiden, um Zugang zum Bauchfell zu erhalten, um sicherzustellen, dass es sich zur Bauchhöhle öffnet, ohne Leber und Darm zu verletzen, die sofort freigelegt werden.
- Ziehen Sie die Darmschlingen auf die rechte Seite der Bauchhöhle zurück. Identifizieren Sie das parietale Peritoneum, das über der linken Niere und den Nierengefäßen liegt. Nutzen Sie diese Gefäßstrukturen, um die Bauchschlagader zu lokalisieren.
- Finden Sie das Auftauchen des linken Nierenstiels. Entfernen Sie das Bauchfell, das die Aorta 5 cm oberhalb der Nierenarterie bedeckt.
- Nach Freilegung des linken Nierenstiels werden die Darmschlingen mobilisiert und das Peritoneum, das den Hilum bedeckt, eingeschnitten. Präparieren Sie anteroposterior, um zuerst die Nierenvene zu identifizieren, die größer ist und sich anterior befindet.
- Lokalisieren Sie die Nierenarterie nach hinten und folgen Sie ihrer Flugbahn bis zu ihrem Ursprung in der Bauchaorta. Identifizieren Sie schließlich das Nierenbecken, die hinterste Struktur des Hilums9.
- Präpariere vorsichtig den hinteren Teil der Aorta. Verwenden Sie 0/0 Seide, um die Aorta mit einem Knoten über dem Niveau der Nierenarterie und einem weiteren Knoten 5 cm darüber zu ligieren.
- Klemmen Sie die Aorta sofort mit zwei Kelly-Klemmen an beiden Enden des isolierten Aortensegments.
- Die Aortenwand mit der Spitze einer Metzembaum-Schere einschneiden, dabei einen Schnitt von ca. 0,3 cm in die Vorderwand der Aorta machen, dabei darauf achten, dass sie nicht perforiert wird.
- Verknoten Sie das distale Ende, während Sie die Kelly-Klemme entfernen, um eine 3,2 mm stumpfe L-förmige Nadel in das arterielle Lumen einzuführen. Entfernen Sie die proximale Kelly-Klemme und beginnen Sie mit der Perfusion der modifizierten chilenischen Konservierungslösung.
- Aortenperfusion der modifizierten chilenischen Konservierungslösung
- Fahren Sie mit der Perfusion der modifizierten chilenischen Konservierungslösung fort.
HINWEIS: Verabreichen Sie 0,25 l/kg mit einem Druck von 10 Pfund mit einer Perfusionspumpe. - Ende der Perfusion
- Sobald die Perfusion der Konservierungslösung abgeschlossen ist, entfernen Sie die Perfusionskanüle und verknoten Sie die Einstichstelle mit 0/0 Seide, um einen Rückfluss der Konservierungslösung zu verhindern. Verschließen Sie den Bauch, indem Sie den Schnitt an der Linea alba mit 0/0 Seide vernähen.
HINWEIS: Um zu beurteilen, ob eine ausreichende Perfusion erreicht wurde, überprüfen Sie die akuten Sättigungsindikatoren: Ausdehnung der oberen und unteren Extremitäten, zervikale und thorakale Fülle und Abfluss der Lösung durch die Nasenlöcher. Die ungefähre Perfusionszeit beträgt 2 h.
- Sobald die Perfusion der Konservierungslösung abgeschlossen ist, entfernen Sie die Perfusionskanüle und verknoten Sie die Einstichstelle mit 0/0 Seide, um einen Rückfluss der Konservierungslösung zu verhindern. Verschließen Sie den Bauch, indem Sie den Schnitt an der Linea alba mit 0/0 Seide vernähen.
- Chirurgischer Ansatz
- Verabreichung durch Immersion
HINWEIS: Verwenden Sie für dieses Verfahren Biosicherheitskleidung: eine wiederverwendbare Halbmaske mit A1P2-Filtern, eine Bioschutzbrille, einen langärmeligen Einweg-OP-Kittel, eine OP-Kappe, Leggings und Nitrilhandschuhe.- Verabreichung durch Eintauchen der modifizierten chilenischen Konservierungslösung
- Lagern Sie die Schweineprobe in einem 300-l-Tank, der mit der gleichen Konservierungslösung wie in Schritt 2 beschrieben gefüllt ist.
HINWEIS: Stellen Sie sicher, dass das Biomodell vollständig mit ca. 150 l der Lösung eingetaucht ist. Lagern Sie das Biomodell nach dem Eintauchen 6 Monate lang bei 20 °C. Zu den Indikatoren für eine adäquate Konservierung gehört das Fehlen von Zersetzungszeichen (z. B. Körperödem, Schwellung, übler Geruch, Lividität und Brüchigkeit des Gewebes).
- Lagern Sie die Schweineprobe in einem 300-l-Tank, der mit der gleichen Konservierungslösung wie in Schritt 2 beschrieben gefüllt ist.
- Verabreichung durch Eintauchen der modifizierten chilenischen Konservierungslösung
4. Deformolisierungslösung auf Basis chilenischer Lösung
- Herstellung der Deformolisierungslösung
- Verwenden Sie eine modifizierte chilenische Lösung, die Ethanol, Glycerin, Benzalkoniumchlorid, aromatische Kaffeeessenz und destilliertes Wasser enthält. Stellen Sie sicher, dass die Lösung einen pH-Wert von 7,0 hat.
- Bereiten Sie die Deformolisierungslösung in einem 50-Liter-Tank vor. Zuerst 11,1 l destilliertes Wasser, dann 7,8 l 96 % Ethanol, 5 l Glycerin, 1 l 50 % Benzalkoniumchlorid und 0,1 l aromatische Kaffeeessenz hinzufügen.
HINWEIS: In Tabelle 2 finden Sie die erforderlichen Konzentrationen und Volumina jeder Komponente, die zur Herstellung von 25 l der formaldehydfreien modifizierten chilenischen Lösung erforderlich sind.
5. Deformolisierung
HINWEIS: Verwenden Sie für dieses Verfahren Biosicherheitskleidung: eine wiederverwendbare Halbmaske mit A1P2-Filtern, eine Bioschutzbrille, einen langärmeligen Einweg-OP-Kittel, eine OP-Kappe, Leggings und Nitrilhandschuhe.
- Verabreichung durch Eintauchen der formaldehydfreien modifizierten chilenischen Konservierungslösung
- Am Ende der 6-monatigen Konservierungszeit wird das Biomodell in einen 300-Liter-Tank überführt, der mit formaldehydfreier, modifizierter chilenischer Konservierungslösung gefüllt ist. Lagern Sie das Biomodell für 4 Wochen.
HINWEIS: Stellen Sie sicher, dass das Biomodell vollständig mit ca. 150 l der Lösung eingetaucht ist.
- Am Ende der 6-monatigen Konservierungszeit wird das Biomodell in einen 300-Liter-Tank überführt, der mit formaldehydfreier, modifizierter chilenischer Konservierungslösung gefüllt ist. Lagern Sie das Biomodell für 4 Wochen.
6. Erweichung von Glycerin
- Tauchen Sie das Biomodell unmittelbar nach dem Deformolisierungsprozess in Lösungen mit steigenden Konzentrationen von in Wasser verdünntem Glycerin: 50 %, 70 % und 90 % Glycerin. Pflegen Sie das Biomodell in jeder Konzentration eine Woche lang.
Ergebnisse
Das Ziel dieses Protokolls ist es, eine effektive und praktikable Technik vorzustellen, die es ermöglicht, Schweine-Biomodelle für den vergleichenden Unterricht in der menschlichen Anatomie zu erhalten. Derzeit gibt es keine standardisierten Methoden oder Tests zur Bewertung der Modellerhaltung. Daher wurde die Gesamtkonservierung des Modells anhand von Indikatoren für die Lösungsfüllung und Anzeichen von Zersetzung bewertet, nachdem das Protokoll an den Proben abgeschlossen worden war. Um die Eignung der Biomodelle für Lehre und Forschung objektiv beurteilen zu können, war darüber hinaus ein Vergleich der Gewebeeigenschaften ausgewählter anatomischer Strukturen, wie z.B. Widerstandsfähigkeit und Elastizität, vor und nach der Konservierung geplant. Bei den ausgewählten anatomischen Strukturen handelte es sich um den Nervus vagus, die Aortenarterie und die Vena cava. Diese Strukturen wurden ausgewählt, weil Nerven, Arterien und Venen für das Lehren und Lernen der groben Anatomie von grundlegender Bedeutung sind. Folglich wurden 4 Vagusnerven, 4 Aortenarterien und 3 Cavavenen aus frischen, nicht konservierten Proben isoliert.
Dementsprechend wurden unter Verwendung des vorgestellten Protokolls die Körper von 12 Schweineproben konserviert. Die konservierten Schweine-Biomodelle wurden anhand von Indikatoren für die Repletion, wie z. B. die Ausdehnung der Vordergliedmaßen, das Blut und die Konservierungslösung, die durch die Nasenlöcher ausströmt (Abbildung 1), Ödeme und eine Zunahme des thorakalen und zervikalen Umfangs (Abbildung 2 und Abbildung 3) sowie das Auftreten eines weißlich gesprenkelten Musters in der Leber (Abbildung 4) und der Pale der Darmschlingen (Abbildung 5) auf ihre Angemessenheit der Konservierung untersucht). Alle Biomodelle zeigten erfolgreiche Indikatoren für die Repletion. Nach Abschluss des Protokolls zeigte keines der Biomodelle Veränderungen, die mit der Zersetzung verbunden sind, wie z. B. Dehnung der Darmschlingen, übler Geruch oder Gewebebrüchigkeit.
Nach der Inspektion der Biomodelle zeigte sich, dass diese Technik das Gewebe erfolgreich für die Manipulation und Dissektion konservierte. Beispiele hierfür sind die Muskeln und ihre Aponeurosen (Abbildung 6), das Peritoneum (Abbildung 7) sowie der Magen und Darm (Abbildung 8). Dies wurde subjektiv beurteilt, da alle diese Organe während der Manipulation eine hohe Flexibilität behielten. Die Konsistenz der Leber war zwar fest, ermöglichte aber die Identifizierung der intrahepatischen Gänge und der damit verbundenen Vaskularisation nach der Dissektion (Abbildung 9 und Abbildung 10).
Die Ergebnisse waren jedoch nicht immer so vielversprechend. Vor der Entwicklung des Protokolls war die Pilzbesiedlung der Biomodelle ein häufiges Problem. Dies war möglicherweise auf die Verwendung einer nicht standardisierten Technik zur Auffüllung und Verabreichung durch Eintauchen der Konservierungslösung zurückzuführen. Abbildung 6 zeigt ein Biomodell, das von der Besiedlung betroffen war.
Um die Konservierung der Gewebe objektiv beurteilen zu können, wurden zusätzlich spezifische Merkmale von Interesse sowohl in unkonservierten als auch in konservierten Strukturen gemessen. Vier Vagusnerven, vier Aortenarterien und drei Cavavenen wurden aus konservierten Biomodellen isoliert. Die gemessenen Merkmale waren die Widerstandsfähigkeit des Gewebes (quantifiziert als die Newton, die zum Zerreißen der Struktur erforderlich sind) und die Flexibilität des Gewebes (gemessen mit dem Elastizitätsmodul)10,11. Die Ergebnisse sind in Tabelle 3 als Mittelwert ± Standardabweichung (SD) dargestellt.
Die chirurgische Extraktion dieser Strukturen und die Bewertung ihrer Elastizität und Widerstandsfähigkeit wurden durchgeführt, um eine quantitative Annäherung an den Konservierungsgrad des gesamten Biomodells und die Beibehaltung seiner ursprünglichen mechanischen Eigenschaften zu erhalten. Die Auswahl dieser spezifischen anatomischen Strukturen basierte auf der Tatsache, dass vaskuläre und nervöse Strukturen am häufigsten von Lehrern und Schülern während der Dissektion manipuliert werden, wodurch ein erhöhtes Risiko für einen Riss besteht.
Um die mechanischen Eigenschaften von tierischen biologischen Geweben zu bewerten, wurde ein Verfahren entwickelt, bei dem die Probe zwischen zwei Klemmen aufgehängt wird, wobei ein Ende mit einem Kraftaufnehmer verbunden ist und das andere Ende durch einen konstanten Wasserfluss einer zunehmenden Belastung ausgesetzt wird. Die ausgeübte Kraft wurde unter Berücksichtigung der Dichte des Wassers und der Schwerkraft berechnet, während die Dehnung der Probe mit zunehmender Belastung gemessen wurde. Diese Messungen erleichterten die Bestimmung des Elastizitätsmoduls, der die Gewebesteifigkeit darstellt, sowie die Identifizierung des maximalen Widerstands gegen die Anwendung einer bestimmten Kraft, die die Fähigkeit des Gewebes widerspiegelt, Belastungen vor dem Bruch standzuhalten. Diese Methode ermöglicht eine genaue Beurteilung der Elastizitäts- und Festigkeitseigenschaften biologischer Gewebe, was für das Verständnis ihres mechanischen Verhaltens von grundlegender Bedeutung ist.
Die konservierten Vagusnerven zeigten eine signifikante Steigerung der Widerstandsfähigkeit und Elastizität im Vergleich zu den unkonservierten Exemplaren. Entgegen den Erwartungen zeigte die konservierte Aortenarterie einen etwas geringeren Widerstand, aber eine moderate Zunahme der Elastizität im Vergleich zu unkonservierten Exemplaren. Der Erhalt der Vena cava führte zu einer deutlichen Steigerung sowohl der Widerstandsfähigkeit als auch der Elastizität. Diese Ergebnisse deuten darauf hin, dass der Konservierungsprozess einen erkennbaren Einfluss auf die mechanischen Eigenschaften der untersuchten Gewebe hat, was wertvolle Erkenntnisse für die Anwendung dieser konservierten Gewebe in anatomischen Studien liefert.
Das Morphologie-Forschungsteam, das dieses Protokoll entwickelt hat, verfügt über umfangreiche Erfahrung in der Konservierung von Schweine-Biomodellen. Eine qualitative Verbesserung der Konservierungsergebnisse wurde in Bezug auf die organoleptischen Eigenschaften des Gewebes aufgrund von Modifikationen und Optimierungen der zuvor verwendeten konventionellen Techniken, wie z. B. der Konservierung mit 10 % Formalin, beobachtet. Die konservierten Biomodelle werden derzeit an der Universidad Icesi erfolgreich für morphologische Studien und die Lehre in humanvergleichender Anatomie für Medizinstudenten eingesetzt. Das Modell mit der längsten Lebensdauer im Labor hat bei Raumtemperatur 7 Jahre erreicht, ohne dass neue Tauchgänge oder zusätzliche Prozesse erforderlich sind. Die Lehrerfahrung hat gezeigt, dass die Biomodelle trotz hoher Manipulation durch die Studierenden die Integrität der anatomischen Strukturen bis zu 4 Jahre nach der Konservierung bewahren.

Abbildung 1: Abfluss von Blut und Konservierungslösung durch die Nasenlöcher. (A) Abfluss vor der Perfusion. (B) Abfluss während der Perfusion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Thoraxperimeter vor und nach der Perfusion der Konservierungslösung. (A) Thoraxperimeter vor der Perfusion. (B) Thoraxumfang nach der Perfusion. Es wird eine Zunahme des Brustumfangs um 4 cm beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
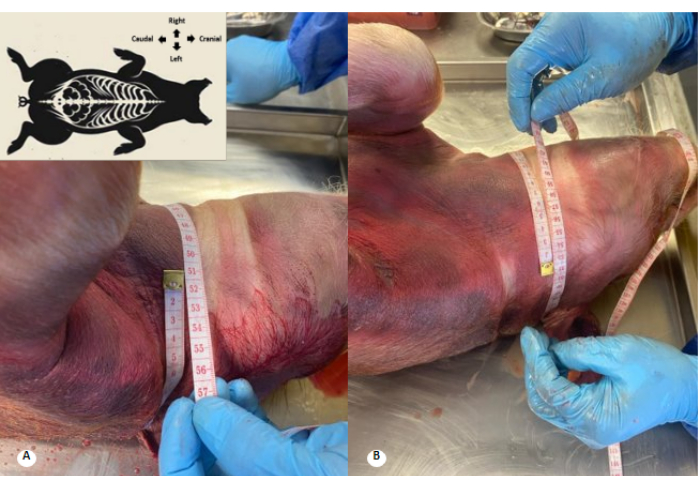
Abbildung 3: Zervikaler Umfang vor und nach der Perfusion der Konservierungslösung. (A) Zervikaler Umfang vor der Perfusion. (B) Zervikaler Umfang nach der Perfusion. Es wird eine Zunahme des Gebärmutterhalsumfangs um 1 cm und eine Auslöschung der Gebärmutterhalsfalten beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
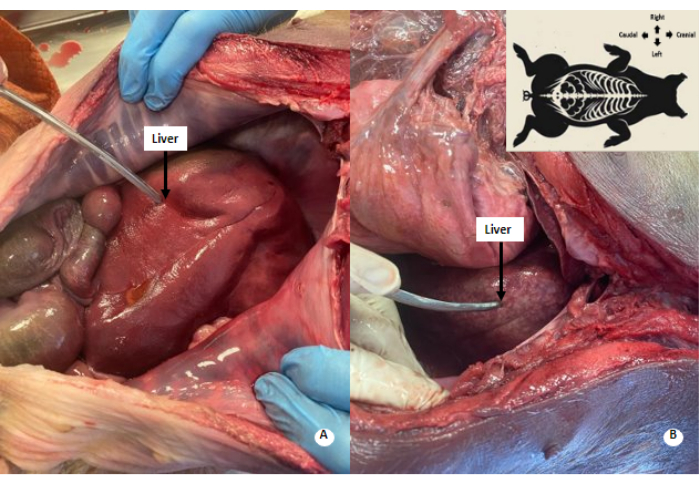
Abbildung 4: Weißlich gesprenkeltes Muster in der Leber. (A) Leber vor der Perfusion. (B) Leber nach der Perfusion. In der perfundierten Leber ist ein weißlich-gesprenkeltes Muster zu beobachten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Blässe der Darmschlingen. (A) Dünndarm vor der Perfusion. (B) Dünndarm nach der Perfusion. Es wird eine Blässe der Darmschlingen beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Biomodell, das von Pilzen besiedelt ist. Die ventrale Traktion der Vena cava inferior zeigt eine Pilzbesiedlung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Musculus transversus abdominis und seine Aponeurose. (1) Musculus transversus abdominis. (2) Aponeurose des Musculus transversus abdominis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Parietales Peritoneum des konservierten Schweine-Biomodells. (1) Parietales Peritoneum. (2) Linker Lappen der durchtrennten Leber. (3) Magen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
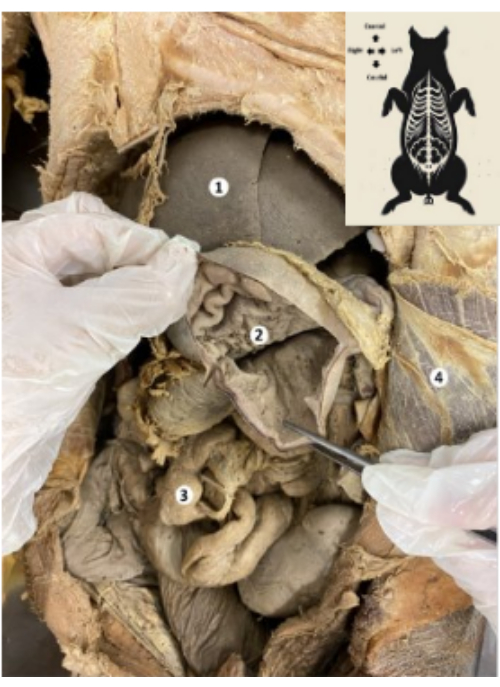
Abbildung 9: Magen des konservierten Schweine-Biomodells. (1) Leber. (2) Magenschleimhaut. (3) Darm. (4) Musculus abdominis transversum und parietales Peritoneum. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
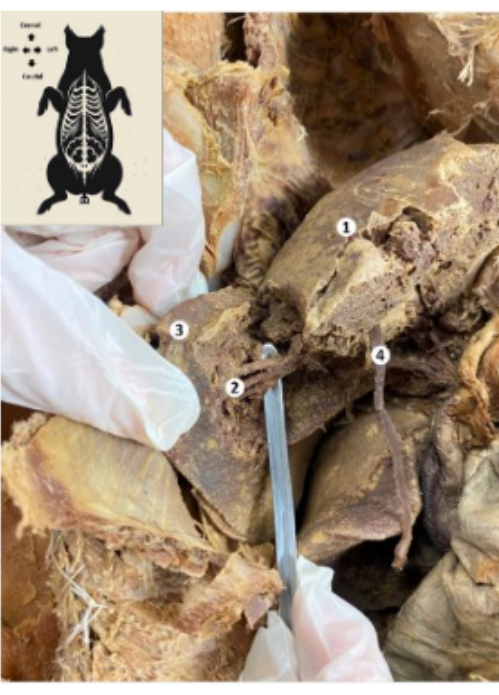
Abbildung 10: Leber des konservierten Schweine-Biomodells. (1) Zwerchfellfläche der Leber. (2) Unterer hinterer Leberabschnitt (Leberarterie, Gallengang, unterer hinterer Ast der Pfortader). (3) Rechter Leberlappen. (4) Rundband der Leber. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Reaktiv | Endkonzentration | Menge | Letzter Band |
| Ethanol 96% | 30% | 7,8 l | 25 L |
| Glyzerin | 20% | 5L | |
| Formaldehyd 40% | 2% | 0,5 L | |
| Benzalkoniumchlorid 50% | 2% | 1 L | |
| Aromatische Essenz (Kaffee) | 0.40% | 0,1 L | |
| Destilliertes Wasser | NA | 10,6 l |
Tabelle 1: Konservierungslösung auf der Basis einer modifizierten chilenischen Lösung.
| Reaktiv | Endkonzentration | Menge | Letzter Band |
| Ethanol 96% | 30% | 7,8 l | 25 L |
| Glyzerin | 20% | 5L | |
| Benzalkoniumchlorid 50% | 2% | 1 L | |
| Aromatische Essenz (Kaffee) | 0.40% | 0,1 L | |
| Destilliertes Wasser | NA | 11,1 L |
Tabelle 2: Formaldehydfreie Konservierungslösung auf Basis einer modifizierten chilenischen Lösung.
| Gewebe | Nicht konserviert | Konserviert | ||
| Newton ± SD* | Elastizitätsmodul ± SD* | Newton ± SD* | Elastizitätsmodul ± SD* | |
| Vagusnerv | 4,92 ± 0,98 | 879,5 ± 427,02 | 8,59 ± 0,83 | 1392,21 ± 729,6 |
| Aortenarterie | 9,33 ± 1,5 | 325,89 ± 176,15 | 8.48 ± 1.26 | 417,16 ± 379,95 |
| Ader Cava | 5,73 ± 2,3 | 145,5 ± 40,89 | 8,92 ± 3,97 | 264,69 ± 188,72 |
Tabelle 3: Gewebeeigenschaften von nicht konservierten und konservierten Exemplaren anatomischer Strukturen. *SD: Standardabweichung.
Diskussion
Traditionell haben sich anatomische Studien auf menschliche Leichen gestützt; Schwierigkeiten bei der Beschaffung dieser Proben haben jedoch dazu geführt, dass alternative Methoden erforscht wurden. Schweine-Biomodelle haben sich als wertvolle Werkzeuge für die Untersuchung der menschlichen Anatomie erwiesen und bieten anatomische Ähnlichkeiten, die das Lernen und seine Extrapolation auf medizinische Anwendungen beim Menschen erleichtern 12,13,14,15. Obwohl Techniken zur Konservierung von Leichen traditionell qualitativ beschrieben wurden, könnte die Messung der Festigkeit und Elastizität konservierter Gewebe mit Hilfe des Young-Moduls einen quantitativen Beweis für den Grad der Konservierung liefern. Die Suche nach innovativen Ansätzen in der biologischen Gewebekonservierung entspricht dem Bedürfnis, die Erforschung anatomischer Komplexität in realistischen Modellen zu erleichtern. Daher wird das Protokoll zur Konservierung von Schweine-Biomodellen, das im Anatomielabor der Universidad Icesi entwickelt und verwendet wird, als praktikable Alternative für die Gewebekonservierung und die anschließende anatomische Untersuchung vorgestellt.
Erfahrungsgemäß ist die Annäherung an die Probenzirkulation durch die Bauchaorta in Schweinebiomodellen eine effektivere Alternative im Vergleich zur venmoralen arteriellen Kanülierung, die üblicherweise bei menschlichen Kadavern durchgeführt wird16. Die Zerbrechlichkeit der femoralen Arterienwände des Schweins hat dazu geführt, dass der abdominale Zugang bevorzugt wird, da diese Wände durch den von der Perfusionspumpe ausgeübten Druck anfällig für einen Riss sind. Die Sicherung eines praktikablen Eintrittspunkts ist von entscheidender Bedeutung, da der Auffüllungsschritt im Protokoll für die angemessene Konservierung des gesamten Exemplars entscheidend ist. Eine suboptimale Füllung birgt ein hohes Risiko der Zersetzung. Daher müssen die Anzeichen für eine erfolgreiche Repletion ausgewertet werden, bevor mit dem Protokoll fortgefahren wird. Zu diesen Anzeichen gehören die Verlängerung der oberen und unteren Extremitäten, die zervikale und thorakale Plethora und das Abfließen der Lösung durch die Nasenlöcher aufgrund der Perfusion der Konservierungslösung. Eine häufige Herausforderung, die bei der Durchführung dieses Protokolls auftreten kann, ist das Reißen der Aortenarterie während der Infusion der Konservierungslösung. In solchen Fällen ist es ratsam, die Arterie zu ligieren und mit der Dissektion eines oberen Segments fortzufahren, um die sekundäre Kanülierung zu erleichtern und den Repletionsschritt fortzusetzen. Wenn zu irgendeinem Zeitpunkt während des Protokolls Anzeichen einer Zersetzung erkennbar werden, muss die gesamte Probe verworfen werden.
Die in diesem Protokoll verwendete Konservierungslösung enthält Variationen im Vergleich zur herkömmlichen chilenischen Lösung, wie z. B. das Fehlen von Natriumchlorid, eine Erhöhung der Ethanolkonzentration von 24 % auf 30 %, eine Erhöhung der Glycerinkonzentration von 16 % auf 20 %, eine Abnahme der Formaldehydkonzentration von 3,7 % auf 2 % und den Ersatz von Eukalyptusessenz durch Kaffeeessenz17.
Der Deformolisierungsprozess ist ein weiterer entscheidender Schritt im Protokoll, da eine ordnungsgemäße Deformolisierung die Exposition des Personals gegenüber Formaldehyd reduziert, einschließlich Lehrern, Labormitarbeitern und Schülern. Darüber hinaus ist der Erweichungsprozess mit Glycerin unerlässlich, um eine Textur zu erzielen, die der von frischem Gewebe ähnelt. Die herkömmliche Konservierung mit 10 % Formaldehyd führt zu steifem Gewebe, das an Elastizität verliert und bei der Handhabung anfälliger für Risse wird. Die Verwendung der modifizierten chilenischen Lösung mit einer reduzierten Formaldehydkonzentration von 2 %, gefolgt von einer Deformolisierung und Erweichung mit Glycerin, mildert dieses Problem.
Nach diesem Protokoll wurde ein hohes Maß an Flexibilität bei der Manipulation erreicht, während feste Organe, wie z. B. die Leber, eine Konsistenz aufwiesen, die zwar fest war, aber eine Dissektion und Identifizierung ihrer Strukturen ermöglichte. Nichtsdestotrotz sind weitere quantitative Studien notwendig, um die Konservierungsqualität von Geweben über verschiedene Konservierungstechniken hinweg zu vergleichen.
Bei der Durchführung dieses Protokolls sollten mehrere mögliche Einschränkungen berücksichtigt werden. Zunächst muss die Größe der Probe mit einem empfohlenen Bereich von 15-20 kg sorgfältig geprüft werden. Größere Tiere können bei der Durchführung des Konservierungsprotokolls und der Entsorgung des Biomodells eine Herausforderung darstellen. Zweitens sollte das vorgesehene Labor mit einem geeigneten Dampfabsaugsystem und einem Abfallabscheider in der Kanalisation ausgestattet sein. Diese Vorsichtsmaßnahme zielt darauf ab, die Exposition des technischen Personals gegenüber organischen Dämpfen zu verringern und die Umweltkontamination durch Rückstände, die während des Konservierungsprozesses entstehen, zu minimieren. Drittens muss das potenzielle Vorhandensein anatomischer Varianten in den Biomodellen anerkannt werden. Darüber hinaus weisen Schweineexemplare zwar anatomische Ähnlichkeiten mit dem Menschen auf, aber auch Unterschiede. Daher ist eine sorgfältige Berücksichtigung solcher Variationen in vergleichenden anatomischen Studien gerechtfertigt.
Die Bewertung der organoleptischen Eigenschaften von Geweben wurde traditionell qualitativ angegangen, wobei der Schwerpunkt auf Eigenschaften wie Geruch, Farbe, Steifigkeit, Sprödigkeit und einfacher Handhabung lag18. Es gibt jedoch einen bemerkenswerten Mangel an Studien, die darauf abzielen, diese Parameter objektiv zu bestimmen. Ein Beispiel ist die Arbeit von HP Theeuwes, die die Beweglichkeit der Gelenke der oberen Gliedmaßen in Leichen verglich, die mit 11 % Formalin, frischem Gewebe und einer modifizierten Methode konserviert wurden, die die Gelenke immobilisierte, um die für die Flexionerforderliche Kraft zu messen 5. In diesem Zusammenhang entwickelt das Forschungsteam Methoden, um die mechanischen Eigenschaften von Geweben objektiv zu bewerten und dabei die Grenzen bestehender qualitativer Bewertungen zu überwinden.
Was die Konservierung von Kadavern betrifft, so ist Formalin zwar das am häufigsten verwendete Mittel, aber auch mehrere alternative Substanzen wurden erfolgreich eingesetzt. Zu diesen Substanzen gehören Glutaraldehyd, Monoethylenglykol, Diethylenglykol, Ethanol-Glycerin-Lösungen und gesättigte Salze. Die Vielfalt der Konservierungsmethoden spiegelt das anhaltende Bestreben wider, die Gewebekonservierung für medizinische Forschung, Bildung oder Ausstellungszwecke zu optimieren 3,19. Diese Fortschritte unterstreichen die Bedeutung der Forschung bei der Entwicklung effektiverer Konservierungstechniken, um die strukturellen und funktionellen Eigenschaften des menschlichen Gewebes über längere Zeiträume optimal zu erhalten.
Für zukünftige Anwendungen ist das beobachtete hohe Maß an Gewebekonservierung mit diesem Protokoll vielversprechend für die Förderung der anatomischen Forschung und Ausbildung. Das Potenzial dieser Methode erstreckt sich auch auf fortgeschrittene anatomische Studien, liefert realistische Modelle für die chirurgische Ausbildung und trägt zur Entwicklung immersiver medizinischer Simulationen bei. Darüber hinaus eröffnet die Anpassungsfähigkeit des Protokolls Möglichkeiten für die Erforschung verschiedener anatomischer Präparate, wodurch sein Nutzen in verschiedenen medizinischen und wissenschaftlichen Kontexten erweitert wird.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir danken dem Departement für medizinische Grundlagenwissenschaften und dem Forschungsbüro der Universidad Icesi für ihre Unterstützung bei dieser Forschung.
Materialien
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
Referenzen
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten