Method Article
Preservación de biomodelos porcinos para el estudio de la anatomía humana comparada
En este artículo
Resumen
En este artículo se presenta un protocolo para la conservación de biomodelos porcinos. El método propuesto consiste en utilizar una solución chilena modificada con una concentración reducida de formalina. El proceso de conservación consiste en administrar la solución mediante repleción e inmersión de la muestra, seguida de deformolización y ablandamiento de los tejidos mediante glicerina.
Resumen
La enseñanza de la anatomía humana en la educación médica enfrenta desafíos, lo que requiere alternativas efectivas para que los estudiantes exploren en la práctica la complejidad anatómica. Los biomodelos porcinos, con sus similitudes anatómicas con los humanos, ofrecen una solución prometedora. Este artículo presenta un protocolo detallado para la preservación de biomodelos porcinos, abordando la necesidad de métodos accesibles y eficientes en los estudios de anatomía comparada. Este protocolo propone el uso de una solución chilena modificada para la preservación de biomodelos, empleando técnicas de formalización a través de repleción e inmersión. Posteriormente, se logra la desformalización utilizando la solución chilena modificada sin formaldehído, seguida de un proceso de ablandamiento con glicerina. Dada la escasez de literatura sobre técnicas de preservación y la ausencia de un procedimiento o prueba estandarizada para evaluar la conservación de los tejidos, sugerimos evaluar la calidad de los tejidos en función de medidas de resistencia y elasticidad. Nuestros hallazgos indican un nivel cualitativamente alto de preservación de tejidos en nuestros especímenes. Además, estos biomodelos se utilizan actualmente con éxito para estudios de morfología y en la enseñanza de la anatomía comparada humana a los estudiantes de medicina.
Introducción
La enseñanza de la anatomía en las facultades de medicina a menudo encuentra obstáculos, como las dificultades para acceder a los cuerpos humanos para la disección y la falta de instalaciones adecuadas. Estas limitaciones subrayan la necesidad de alternativas efectivas que permitan a los estudiantes explorar la complejidad anatómica de manera práctica y realista. En este contexto, los biomodelos porcinos han surgido como una alternativa prometedora debido a sus similitudes anatómicas con los humanos, ofreciendo un medio accesible y eficiente para el aprendizaje y la enseñanza de la anatomía1.
Las técnicas de conservación anatómica tienen como objetivo mantener la integridad de los tejidos biológicos al tiempo que minimizan el daño. Estas técnicas se han empleado con fines educativos, académicos y de investigación en el estudio de la anatomía humana y veterinaria. Se han probado numerosas sustancias para preservar cuerpos, órganos y tejidos en su estado natural durante el mayor tiempo posible. Sin embargo, la preservación y conservación de los especímenes anatómicos sigue siendo un desafío, especialmente para aquellos destinados a estudios morfológicos, donde se requiere una alta preservación de tejidos3.
A pesar de que las soluciones utilizadas tradicionalmente están ampliamente disponibles, las limitaciones en la práctica diaria son evidentes. La formalina, una de las sustancias más comunes utilizadas, tiene varias desventajas documentadas para la conservación de tejidos. Estos incluyen su olor irritante, alta toxicidad, riesgos asociados de cáncer y mutagenicidad para los manipuladores, y los cambios organolépticos que induce en los tejidos, como rigidez y decoloración. Estos cambios pueden alterar la percepción de las propiedades fisiológicas de los tejidos cuando se estudian después de la fijación, lo que puede dificultar estudios morfológicos precisos y precisos4. Los estudios han demostrado que la fijación con altas concentraciones de formalina da lugar a un mayor grado de rigidez del tejido5. Alternativas, como la técnica de embalsamamiento de Thiel, han demostrado resultados prometedores con una mejor conservación de la coloración original y la flexibilidad de los tejidos6. Sin embargo, esta técnica es más costosa en comparación con otras soluciones7. Estos desafíos presentan una oportunidad para diseñar y probar técnicas de preservación nuevas y asequibles que aún permitan la enseñanza de anatomía de alta calidad.
El objetivo de este protocolo es describir la metodología empleada en el Laboratorio de Anatomía de la Universidad Icesi en Cali, Colombia, para la preservación de biomodelos porcinos utilizados como herramientas educativas para el estudio comparativo de la anatomía humana.
Protocolo
La técnica descrita fue desarrollada en total cumplimiento de los lineamientos del Comité Institucional de Ética para el Cuidado y Uso de Animales en Experimentación (CIECUAE) de la Universidad Icesi, de acuerdo con la Ley 84 de 1989 y la Resolución Rectoral N° 847 (9 de julio de 2012). Esto garantiza tanto la integridad científica como el bienestar de los animales utilizados, minimizando su sufrimiento. Para este estudio se utilizaron cerdos machos Landrace, de 3 meses de edad y con un peso de 15-20 kg. Los reactivos y el equipo necesarios se enumeran en la Tabla de Materiales.
1. Biomodelo porcino
- Sacrificio del animal
- Realizar una evaluación veterinaria general y poner en cuarentena el ejemplar de cerdo seleccionado durante 24 h. Si el animal no presenta ningún síntoma durante este período, se procede a la eutanasia.
- Anestesia
- Administrar anestesia por vía intramuscular con Ketamina + Xilacina + Atropina a dosis de 10 mg/kg, 0,5 mg/kg y 0,04 mg/kg, respectivamente (siguiendo protocolos aprobados institucionalmente).
NOTA: Asegure la anestesia profunda. Evalúe la profundidad de la anestesia a través del examen físico. La anestesia profunda está indicada por una pupila dilatada y centrada, ausencia del reflejo palpebral, depresión del reflejo corneal y disminución de la frecuencia respiratoria, la frecuencia cardíaca y la presión arterial.
- Administrar anestesia por vía intramuscular con Ketamina + Xilacina + Atropina a dosis de 10 mg/kg, 0,5 mg/kg y 0,04 mg/kg, respectivamente (siguiendo protocolos aprobados institucionalmente).
- Eutanasia
- Administrar 5 mL de Pentobarbital Sódico/Difenilhidantoína (390/50 mg/mL) por vía intravenosa. Después de administrar el agente de eutanasia, auscultar los parámetros fisiológicos del animal para la especie Suis Scrofa : HR, 60-90; FR, 8-18; y T° 37-39°C8.
- Controle la frecuencia cardíaca hasta que disminuya gradualmente y se detenga por completo. Observe cambios inmediatos como relajación del esfínter, membranas cianóticas y ausencia de respuesta a los estímulos corporales. Considere la eutanasia completa después de 5 minutos de auscultación cardíaca sin detectar latidos cardíacos.
- Almacenamiento y transporte
- Transportar el biomodelo porcino desde la sala de procedimientos hasta el laboratorio de anatomía dentro de la media hora posterior a la eutanasia para evitar la descomposición y la proliferación microbiana, optimizando así la conservación del biomodelo.
2. Solución conservante a base de solución chilena
- Preparación de la solución chilena modificada
- Use una solución chilena modificada que contenga etanol, glicerina, formaldehído, cloruro de benzalconio, esencia aromática de café y agua destilada. Asegúrese de que la solución tenga un pH de 7,0.
- Prepare la solución conservante en un tanque de 50 L. En primer lugar, añade 10,6 L de agua destilada al depósito. A continuación, agregue 7,6 L de etanol al 96%, 5 L de glicerina, 0,5 L de cloruro de benzalconio al 50% y 0,1 L de esencia aromática de café.
NOTA: Consulte la Tabla 1 para conocer las concentraciones y volúmenes requeridos de cada componente necesarios para preparar 25 L de la solución chilena modificada.
3. Administración de la solución conservante chilena modificada
NOTA: Una vez preparada la solución conservante, adminístrela por repleción e inmersión.
- Administración por repleción de la solución conservante chilena modificada
NOTA: Use ropa de bioseguridad para este procedimiento: una media mascarilla reutilizable con filtros A1P2, gafas de bioseguridad, una bata quirúrgica desechable de manga larga, un gorro quirúrgico, mallas y guantes de nitrilo.- Abordaje quirúrgico
- Haga una incisión a lo largo de la línea alba (usando un mango de bisturí 4, hoja 22) desde la apófisis xifoides hasta la región púbica.
- Identificar el tejido celular subcutáneo y las fibras musculares del músculo recto abdominal.
NOTA: En el momento de la incisión, identifique el escaso tejido graso adherido a la piel, conocido como tejido celular subcutáneo, y las fibras musculares del músculo recto abdominal ubicadas más profundas9. - Cortar con cuidado para acceder al peritoneo, asegurando su apertura a la cavidad abdominal sin lesionar el hígado y los intestinos, que quedarán expuestos de inmediato.
- Retraiga las asas intestinales hacia el lado derecho de la cavidad abdominal. Identificar el peritoneo parietal que recubre el riñón izquierdo y los vasos renales. Utilice estas estructuras vasculares para localizar la aorta abdominal.
- Encontramos la aparición del pedículo renal izquierdo. Retirar el peritoneo que cubre la aorta 5 cm por encima de la arteria renal.
- Al exponer el pedículo renal izquierdo, movilizar las asas intestinales e incidir el peritoneo que cubre el hilio. Diseccionar anteroposterior para identificar primero la vena renal, que es más grande y se localiza anteriormente.
- Localiza la arteria renal posteriormente, siguiendo su trayectoria hasta su origen en la aorta abdominal. Por último, identificar la pelvis renal, la estructura más posterior del hilio9.
- Disecciona cuidadosamente la parte posterior de la aorta. Utilice seda 0/0 para ligar la aorta con un nudo por encima del nivel de la arteria renal y otro nudo 5 cm por encima.
- Pinza la aorta inmediatamente con dos pinzas de Kelly en ambos extremos del segmento aórtico aislado.
- Incidir la pared aórtica con la punta de las tijeras Metzembaum, haciendo un corte de aproximadamente 0,3 cm en la pared anterior de la aorta, teniendo cuidado de no perforarla.
- Anudar el extremo distal mientras se retira la pinza Kelly para insertar una aguja roma en forma de L de 3,2 mm en la luz arterial. Retire la pinza Kelly proximal e inicie la perfusión de la solución conservante chilena modificada.
- Perfusión aórtica de la solución conservante chilena modificada
- Proceda con la perfusión de la solución conservante chilena modificada.
NOTA: Administrar 0,25 L/kg con una presión de 10 libras utilizando una bomba de perfusión. - Fin de la perfusión
- Una vez completada la perfusión de la solución conservante, retire la cánula de perfusión y anude el sitio de inserción con seda 0/0 para evitar el reflujo de la solución conservante. Cerrar el abdomen suturando la incisión en la línea alba con seda 0/0.
NOTA: Para evaluar si se logró una perfusión adecuada, verifique los indicadores agudos de saturación: extensión de las extremidades superiores e inferiores, plétora cervical y torácica, y escurrimiento de la solución a través de las fosas nasales. El tiempo aproximado de perfusión es de 2 h.
- Una vez completada la perfusión de la solución conservante, retire la cánula de perfusión y anude el sitio de inserción con seda 0/0 para evitar el reflujo de la solución conservante. Cerrar el abdomen suturando la incisión en la línea alba con seda 0/0.
- Abordaje quirúrgico
- Administración por inmersión
NOTA: Use ropa de bioseguridad para este procedimiento: una media mascarilla reutilizable con filtros A1P2, gafas de bioseguridad, una bata quirúrgica desechable de manga larga, un gorro quirúrgico, mallas y guantes de nitrilo.- Administración por inmersión de la solución conservante chilena modificada
- Almacene la muestra de cerdo en un tanque de 300 L lleno con la misma solución conservante descrita en el paso 2.
NOTA: Asegúrese de que el biomodelo esté completamente sumergido utilizando aproximadamente 150 L de la solución. Después de la inmersión, almacene el biomodelo a 20 °C durante 6 meses. Los indicadores de conservación adecuada incluyen la ausencia de signos de descomposición (por ejemplo, edema corporal, hinchazón, mal olor, lividez y friabilidad de los tejidos).
- Almacene la muestra de cerdo en un tanque de 300 L lleno con la misma solución conservante descrita en el paso 2.
- Administración por inmersión de la solución conservante chilena modificada
4. Solución de deformolización basada en solución chilena
- Preparación de la solución de deformolización
- Utilice una solución chilena modificada que contenga etanol, glicerina, cloruro de benzalconio, esencia aromática de café y agua destilada. Asegúrese de que la solución tenga un pH de 7,0.
- Prepare la solución de deformolización en un tanque de 50 L. Primero, agregue 11,1 L de agua destilada, luego 7,8 L de etanol al 96%, 5 L de glicerina, 1 L de cloruro de benzalconio al 50% y 0,1 L de esencia aromática de café.
NOTA: Consulte la Tabla 2 para conocer las concentraciones y volúmenes requeridos de cada componente necesarios para preparar 25 L de la solución chilena modificada sin formaldehído.
5. Deformolización
NOTA: Use ropa de bioseguridad para este procedimiento: una media mascarilla reutilizable con filtros A1P2, gafas de bioseguridad, una bata quirúrgica desechable de manga larga, un gorro quirúrgico, mallas y guantes de nitrilo.
- Administración por inmersión de la solución conservante chilena modificada sin formaldehído
- Al final del período de conservación por inmersión de 6 meses, transfiera el biomodelo a un tanque de 300 L lleno de solución de conservación chilena modificada sin formaldehído. Guarde el biomodelo durante 4 semanas.
NOTA: Asegúrese de que el biomodelo esté completamente sumergido utilizando aproximadamente 150 L de la solución.
- Al final del período de conservación por inmersión de 6 meses, transfiera el biomodelo a un tanque de 300 L lleno de solución de conservación chilena modificada sin formaldehído. Guarde el biomodelo durante 4 semanas.
6. Ablandador de glicerina
- Inmediatamente después del proceso de deformolización, sumerja el biomodelo en soluciones con concentraciones crecientes de glicerina diluida en agua: 50%, 70% y 90% de glicerina. Mantenga el biomodelo en cada concentración durante una semana.
Resultados
El objetivo de este protocolo es presentar una técnica eficaz y viable que permita la preservación de biomodelos porcinos para la enseñanza de la anatomía humana comparada. Actualmente no existen métodos o pruebas estandarizadas para evaluar la preservación del modelo. Por lo tanto, la preservación general del modelo se evaluó utilizando indicadores de repleción de solución y signos de descomposición después de que se completó el protocolo en los especímenes. Además, para evaluar objetivamente la viabilidad de los biomodelos para la enseñanza y la investigación, se planificó una comparación de las características tisulares de las estructuras anatómicas seleccionadas, como la resistencia y la elasticidad, antes y después de la preservación. Las estructuras anatómicas seleccionadas fueron el nervio vago, la arteria aórtica y la vena cava. Estas estructuras se eligieron porque los nervios, las arterias y las venas son fundamentales en la enseñanza y el aprendizaje de la anatomía macroscópica. En consecuencia, se aislaron 4 nervios vagos, 4 arterias aórticas y 3 venas cavas de especímenes frescos no conservados.
En consecuencia, utilizando el protocolo presentado, se preservaron los cuerpos de 12 ejemplares porcinos. Los biomodelos porcinos conservados se evaluaron para determinar la idoneidad de la conservación utilizando indicadores de repleción, como la extensión de las extremidades anteriores, la sangre y la solución conservante que fluyen a través de las fosas nasales (Figura 1), el edema y el aumento del perímetro torácico y cervical (Figura 2 y Figura 3), así como la aparición de un patrón moteado blanquecino en el hígado (Figura 4) y la palidez de las asas intestinales (Figura 5). Todos los biomodelos mostraron indicadores exitosos de repleción. Después de completar el protocolo, ninguno de los biomodelos mostró cambios asociados con la descomposición, como distensión de las asas intestinales, mal olor o friabilidad de los tejidos.
Después de la inspección de los biomodelos, se evidenció que esta técnica preservaba con éxito los tejidos para su manipulación y disección. Algunos ejemplos son los músculos y sus aponeurosis (Figura 6), el peritoneo (Figura 7) y el estómago y los intestinos (Figura 8). Esto se evaluó subjetivamente, ya que todos estos órganos mantuvieron una alta flexibilidad durante la manipulación. La consistencia del hígado, aunque firme, permitió la identificación de los conductos intrahepáticos y su vascularización asociada después de la disección (Figura 9 y Figura 10).
Sin embargo, los resultados no siempre fueron tan prometedores. Antes del desarrollo del protocolo, la colonización fúngica de los biomodelos era un problema frecuente. Esto posiblemente se atribuyó al uso de una técnica no estandarizada para la repleción y administración por inmersión de la solución conservante. En la Figura 6 se muestra un biomodelo que fue afectado por la colonización.
Además, para evaluar objetivamente la preservación de los tejidos, se midieron características específicas de interés tanto en estructuras no preservadas como preservadas. Se aislaron cuatro nervios vagos, cuatro arterias aórticas y tres venas cavas a partir de biomodelos conservados. Las características medidas fueron la resistencia del tejido (cuantificada como los newtons necesarios para desgarrar la estructura) y la flexibilidad del tejido (medida mediante el módulo de Young)10,11. Los resultados se presentan como media ± desviación estándar (DE) en la Tabla 3.
La extracción quirúrgica de estas estructuras y la evaluación de su elasticidad y resistencia se llevaron a cabo para proporcionar una aproximación cuantitativa del grado de conservación de todo el biomodelo y qué tan bien conservó sus propiedades mecánicas originales. La selección de estas estructuras anatómicas específicas se basó en el hecho de que las estructuras vasculares y nerviosas son manipuladas con mayor frecuencia por profesores y estudiantes durante la disección, lo que representa un mayor riesgo de ruptura.
Para evaluar las propiedades mecánicas de los tejidos biológicos animales, se diseñó un método que consistía en suspender la muestra entre dos pinzas, con un extremo conectado a un transductor de fuerza y el otro extremo sometido a una carga creciente a través de un flujo constante de agua. La fuerza ejercida se calculó considerando la densidad del agua y la gravedad, mientras que la elongación de la muestra se midió con carga creciente. Estas mediciones facilitaron la determinación del módulo de Young, que representa la rigidez del tejido, así como la identificación de la resistencia máxima a la aplicación de una fuerza específica, lo que refleja la capacidad del tejido para soportar cargas antes de la ruptura. Este método proporciona una evaluación precisa de las propiedades elásticas y de resistencia de los tejidos biológicos, lo cual es fundamental para comprender su comportamiento mecánico.
Los nervios vagos conservados demostraron un aumento significativo de la resistencia y la elasticidad en comparación con los especímenes no conservados. Contrariamente a lo esperado, la arteria aórtica preservada mostró una resistencia ligeramente menor, pero un aumento moderado en la elasticidad en comparación con los especímenes no conservados. La conservación de la veta del cava se tradujo en un notable aumento tanto de la resistencia como de la elasticidad. Estos hallazgos indican que el proceso de preservación tiene un impacto perceptible en las propiedades mecánicas de los tejidos evaluados, proporcionando información valiosa para la aplicación de estos tejidos preservados en estudios anatómicos.
El equipo de investigación en morfología que desarrolló este protocolo posee una amplia experiencia en la preservación de biomodelos porcinos. Se ha observado una mejora cualitativa en los resultados de conservación en cuanto a las propiedades organolépticas de los tejidos debido a las modificaciones y optimización de técnicas convencionales utilizadas anteriormente, como la conservación con formalina al 10%. Los biomodelos preservados se utilizan actualmente con éxito en la Universidad Icesi para estudios de morfología y enseñanza de anatomía humana comparada para estudiantes de medicina. El modelo con mayor vida útil en el laboratorio ha alcanzado los 7 años a temperatura ambiente sin necesidad de nuevas inmersiones ni procesos adicionales. La experiencia docente ha demostrado que, a pesar de los altos niveles de manipulación por parte de los estudiantes, los biomodelos mantienen la integridad de las estructuras anatómicas hasta 4 años después de su preservación.

Figura 1: Salida de la sangre y de la solución conservante a través de las fosas nasales. (A) Salida antes de la perfusión. (B) Salida durante la perfusión. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Perímetro torácico antes y después de la perfusión de la solución conservante. (A) Perímetro torácico antes de la perfusión. (B) Perímetro torácico después de la perfusión. Se observa un aumento de 4 cm en el perímetro torácico. Haga clic aquí para ver una versión más grande de esta figura.
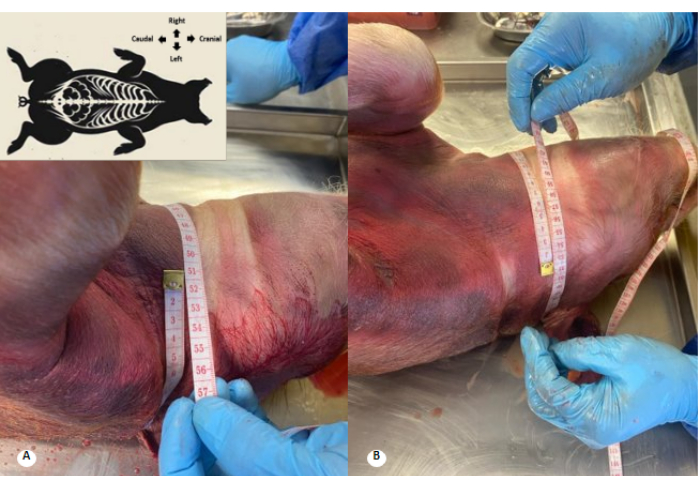
Figura 3: Perímetro cervical antes y después de la perfusión de la solución conservante. (A) Perímetro cervical antes de la perfusión. (B) Perímetro cervical después de la perfusión. Se observa un aumento de 1 cm en el perímetro cervical y borramiento de los pliegues cervicales. Haga clic aquí para ver una versión más grande de esta figura.
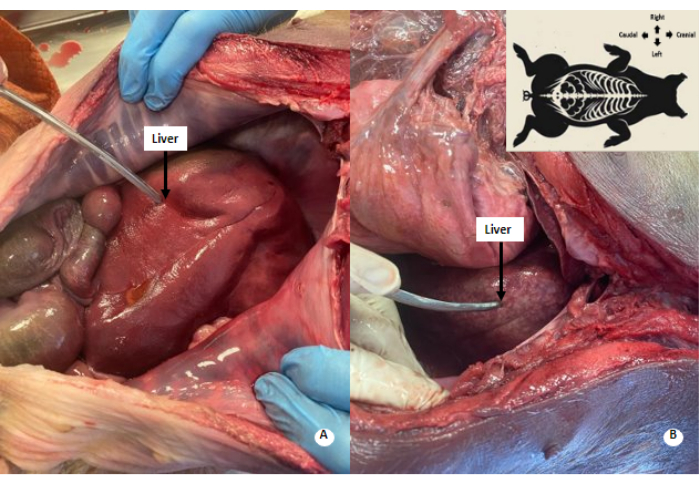
Figura 4: Patrón moteado blanquecino en el hígado. (A) Hígado antes de la perfusión. (B) Hígado después de la perfusión. Se observa un patrón blanquecino-moteado en el hígado perfundido. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Palidez de las asas intestinales. (A) Intestino delgado antes de la perfusión. (B) Intestino delgado después de la perfusión. Se observa palidez de las asas intestinales. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Biomodelo colonizado por hongos. La tracción ventral de la vena cava inferior muestra colonización fúngica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Músculo transverso del abdomen y su aponeurosis. (1) Músculo transverso del abdomen. (2) Aponeurosis del músculo transverso del abdomen. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Peritoneo parietal del biomodelo porcino conservado. (1) Peritoneo parietal. (2) Lóbulo izquierdo del hígado seccionado. (3) Estómago. Haga clic aquí para ver una versión más grande de esta figura.
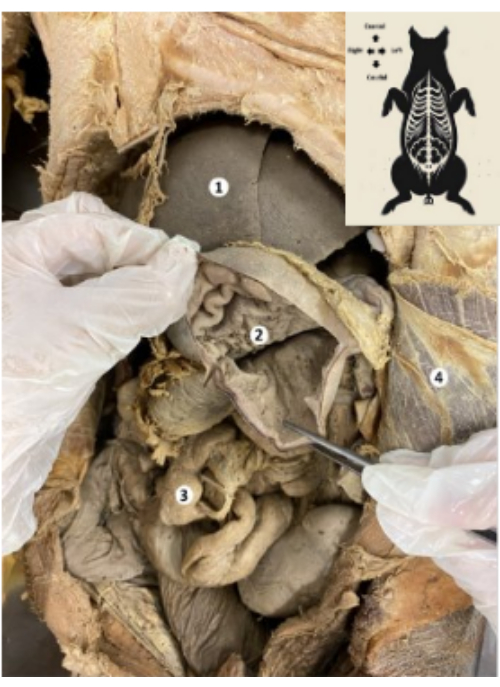
Figura 9: Estómago del biomodelo porcino conservado. (1) Hígado. (2) Mucosa gástrica. (3) Intestinos. (4) Músculo transverso del abdomen y peritoneo parietal. Haga clic aquí para ver una versión más grande de esta figura.
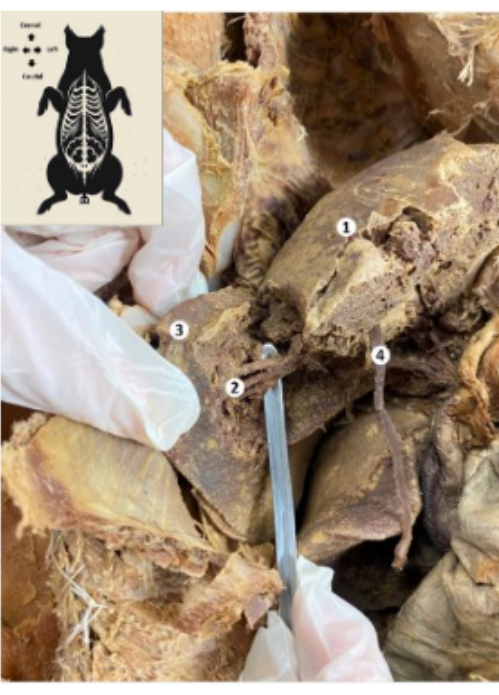
Figura 10: Hígado del biomodelo porcino conservado. (1) Cara diafragmática del hígado. (2) Segmento posterior inferior del hígado (arteria hepática, conducto biliar, rama posterior inferior de la vena porta). (3) Lóbulo derecho del hígado. (4) Ligamento redondo hepático. Haga clic aquí para ver una versión más grande de esta figura.
| Reactivo | Concentración final | Cantidad | Volumen final |
| Etanol 96% | 30% | 7.8 L | 25 L |
| Glicerina | 20% | 5L | |
| Formaldehído 40% | 2% | 0,5 L | |
| Cloruro de benzalconio 50% | 2% | 1 L | |
| Esencia aromática (Café) | 0.40% | 0,1 L | |
| Agua destilada | NA | 10,6 L |
Tabla 1: Solución conservante a base de una solución chilena modificada.
| Reactivo | Concentración final | Cantidad | Volumen final |
| Etanol 96% | 30% | 7.8 L | 25 L |
| Glicerina | 20% | 5L | |
| Cloruro de benzalconio 50% | 2% | 1 L | |
| Esencia aromática (Café) | 0.40% | 0,1 L | |
| Agua destilada | NA | 11.1 L |
Tabla 2: Solución conservante libre de formaldehído a base de una solución chilena modificada.
| Tejido | Sin conservar | Preservado | ||
| Newton ± SD* | Módulo de Young ± SD* | Newton ± SD* | Módulo de Young ± SD* | |
| Nervio vago | 4,92 ± 0,98 | 879,5 ± 427,02 | 8,59 ± 0,83 | 1392,21 ± 729,6 |
| Arteria aórtica | 9,33 ± 1,5 | 325,89 ± 176,15 | 8,48 ± 1,26 | 417,16 ± 379,95 |
| Caña de cava | 5,73 ± 2,3 | 145,5 ± 40,89 | 8,92 ± 3,97 | 264,69 ± 188,72 |
Tabla 3: Características tisulares de especímenes no conservados y preservados de estructuras anatómicas. *DE: Desviación estándar.
Discusión
Tradicionalmente, los estudios anatómicos se han basado en cadáveres humanos; Sin embargo, los desafíos para adquirir estos especímenes han llevado a la exploración de métodos alternativos. Los biomodelos porcinos han demostrado ser herramientas valiosas para el estudio de la anatomía humana, ofreciendo similitudes anatómicas que facilitan el aprendizaje y su extrapolación a aplicaciones médicas en humanos 12,13,14,15. Aunque las técnicas de preservación cadavérica se han descrito tradicionalmente de manera cualitativa, la medición de la fuerza y elasticidad de los tejidos preservados utilizando el módulo de Young podría proporcionar evidencia cuantitativa del grado de preservación. La búsqueda de enfoques innovadores en la preservación biológica de tejidos responde a la necesidad de facilitar la exploración de la complejidad anatómica en modelos realistas. Por lo anterior, se presenta como una alternativa viable para la preservación de tejidos y posterior estudio anatómico el protocolo de preservación de biomodelos porcinos desarrollado y utilizado en el Laboratorio de Anatomía de la Universidad Icesi.
Con base en la experiencia, el abordaje de la circulación de la muestra a través de la aorta abdominal en biomodelos porcinos es una alternativa más efectiva en comparación con la canulación arterial femoral, que se realiza comúnmente en cadáveres humanos16. La fragilidad de las paredes arteriales femorales porcinas ha motivado la preferencia por el abordaje abdominal, ya que estas paredes son susceptibles de romperse por la presión ejercida por la bomba de perfusión. Asegurar un punto de entrada viable es crucial, ya que el paso de repleción en el protocolo es crítico para la preservación adecuada de todo el espécimen. La repleción subóptima presenta un alto riesgo de descomposición. Por lo tanto, los signos de repleción exitosos deben evaluarse antes de continuar con el protocolo. Estos signos incluyen la extensión de las extremidades superiores e inferiores, la plétora cervical y torácica, y el escurrimiento de la solución a través de las fosas nasales debido a la perfusión de la solución conservante. Un desafío común que puede surgir durante la ejecución de este protocolo es el desgarro de la arteria aórtica durante la infusión de la solución conservante. En estos casos, es aconsejable ligar la arteria y proceder a la disección de un segmento superior para facilitar la canulación secundaria y reanudar la etapa de repleción. Además, si se hacen evidentes signos de descomposición en cualquier momento durante el protocolo, se debe descartar la muestra completa.
La solución conservante utilizada en este protocolo incluye variaciones en comparación con la solución convencional chilena, como la ausencia de cloruro de sodio, un aumento en la concentración de etanol de 24% a 30%, un aumento en la concentración de glicerina de 16% a 20%, una disminución en la concentración de formaldehído de 3,7% a 2%, y el reemplazo de la esencia de eucalipto por esencia de café17.
El proceso de deformolización es otro paso crucial en el protocolo, ya que la deformolización adecuada reduce la exposición del personal al formaldehído, incluidos maestros, laboratoristas y estudiantes. Además, el proceso de ablandamiento con glicerina es fundamental para conseguir una textura similar a la de los tejidos frescos. La conservación convencional con un 10% de formaldehído da como resultado tejidos rígidos que pierden elasticidad y se vuelven más propensos a desgarrarse durante la manipulación. Sin embargo, el uso de la solución chilena modificada con una concentración reducida de formaldehído del 2%, seguida de deformolización y ablandamiento con glicerina, mitiga este problema.
Siguiendo este protocolo, se logró un alto grado de flexibilidad en la manipulación, mientras que los órganos sólidos, como el hígado, exhibieron una consistencia que, aunque firme, permitió la disección e identificación de sus estructuras. Sin embargo, se necesitan más estudios cuantitativos para comparar la calidad de conservación de los tejidos a través de diferentes técnicas de conservación.
Se deben tener en cuenta varias limitaciones potenciales al llevar a cabo este protocolo. En primer lugar, se debe prestar mucha atención al tamaño del espécimen, con un rango recomendado de 15-20 kg. Los animales más grandes pueden presentar desafíos en la ejecución del protocolo de preservación y la gestión de la disposición del biomodelo. En segundo lugar, el laboratorio designado debe estar equipado con un sistema de extracción de vapor adecuado y una trampa de residuos en el sistema de alcantarillado. Esta precaución tiene como objetivo mitigar la exposición del personal técnico a los vapores orgánicos y minimizar la contaminación ambiental resultante de los residuos producidos durante el proceso de conservación. En tercer lugar, hay que reconocer la posible presencia de variantes anatómicas en los biomodelos. Además, aunque los especímenes porcinos comparten similitudes anatómicas con los humanos, también presentan diferencias. Por lo tanto, se justifica una consideración cuidadosa de tales variaciones en los estudios anatómicos comparativos.
La evaluación de las propiedades organolépticas de los tejidos se ha abordado tradicionalmente de manera cualitativa, centrándose en características como el olor, el color, la rigidez, la fragilidad y la facilidad de manejo18. Sin embargo, existe una notable escasez de estudios que apunten a determinar estos parámetros de manera objetiva. Un ejemplo es el trabajo de HP Theeuwes, que comparó la movilidad de las articulaciones de las extremidades superiores en cadáveres conservados con un 11% de formalina, tejido fresco y un método modificado que inmovilizaba las articulaciones para medir la fuerza requerida para la flexión5. En este contexto, el equipo de investigación está desarrollando métodos para evaluar objetivamente las propiedades mecánicas de los tejidos, buscando superar las limitaciones de las evaluaciones cualitativas existentes.
En cuanto a la conservación de cadáveres, aunque la formalina es el agente más utilizado, también se han utilizado con éxito varias sustancias alternativas. Estas sustancias incluyen glutaraldehído, monoetilenglicol, dietilenglicol, soluciones de etanol-glicerina y sales saturadas. La diversidad de métodos de preservación refleja la búsqueda continua de optimizar la preservación de tejidos con fines de investigación médica, educativos o de exhibición 3,19. Estos avances ponen de manifiesto la importancia de la investigación en el desarrollo de técnicas de conservación más eficaces para mantener las propiedades estructurales y funcionales de los tejidos humanos de forma óptima durante períodos prolongados.
Para aplicaciones futuras, el alto nivel de preservación de tejidos observado con este protocolo es muy prometedor para el avance de la investigación y la educación anatómica. El potencial de este método se extiende a los estudios anatómicos avanzados, proporcionando modelos realistas para el entrenamiento quirúrgico y contribuyendo al desarrollo de simulaciones médicas inmersivas. Además, la adaptabilidad del protocolo abre vías para la exploración en diversos especímenes anatómicos, ampliando así su utilidad en diversos contextos médicos y científicos.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Agradecemos al Departamento de Ciencias Médicas Básicas y a la Oficina de Investigación de la Universidad Icesi por su apoyo en esta investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
Referencias
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados