Method Article
比較人体解剖学の研究のためのブタバイオモデルの保存
要約
この記事では、ブタのバイオモデルを保存するためのプロトコルを紹介します。提案された方法は、ホルマリン濃度が低下した改質チリ溶液を利用することを含む。保存プロセスは、試料の充満と浸漬の両方を通じて溶液を投与し、続いてグリセリンを使用して変形除去と組織軟化を行うことで構成されます。
要約
医学教育における人体解剖学の教育は課題に直面しており、学生が解剖学的複雑さを実際に探求するための効果的な代替手段が必要です。ブタのバイオモデルは、解剖学的にヒトと類似しており、有望な解決策を提供します。この記事では、ブタのバイオモデルを保存するための詳細なプロトコルを提示し、比較解剖学研究におけるアクセス可能で効率的な方法の必要性に対処します。このプロトコルは、バイオモデルの保存のために、補充と浸漬によるホルマリン化技術を採用して、改変されたチリの溶液を使用することを提案しています。その後、ホルムアルデヒドを含まないチリの変性溶液を使用して脱フォーマル化が達成され、続いてグリセリン軟化プロセスが続きます。保存技術に関する文献が不足しており、組織の保存を評価するための標準化された手順やテストがないことを考えると、抵抗性と弾力性の尺度に基づいて組織の品質を評価することをお勧めします。私たちの調査結果は、私たちの標本における質的に高いレベルの組織保存を示しています。さらに、これらのバイオモデルは現在、形態学の研究や医学生に人体比較解剖学を教えることに成功しています。
概要
医学部での解剖学の教育は、解剖のために人体にアクセスするのが難しい、適切な施設がないなどの障害に遭遇することがよくあります。これらの制限は、学生が解剖学的複雑さを実用的かつ現実的に探求できるようにする効果的な代替手段の必要性を強調しています。これに関連して、ブタのバイオモデルは、解剖学的に人間と類似しているため、有望な代替手段として浮上しており、解剖学を学び教えるためのアクセス可能で効率的な手段を提供しています1。
解剖学的保存技術は、損傷を最小限に抑えながら生体組織の完全性を維持することを目的としています。これらの技術は、人間と獣医の両方の解剖学の研究において、教育、学術、および研究目的で採用されてきました。体、臓器、組織をできるだけ長く自然な状態に保つために、数多くの物質がテストされています2。しかし、解剖学的標本の保存と保存は依然として困難であり、特に形態学的研究を目的とした解剖学的標本では、高い組織保存が必要です3。
従来から利用されてきたソリューションは広く利用されていますが、日々の実践には限界があることは明らかです。ホルマリンは、最もよく使用される物質の1つですが、組織の保存にはいくつかの欠点が文書化されています。これには、刺激臭、高い毒性、それに伴うがんのリスク、ハンドラーの変異原性、組織に誘発する官能的変化(硬直や変色など)が含まれます。これらの変化は、固定後に研究されたときに組織の生理学的特性の知覚を変える可能性があり、正確で正確な形態学的研究を妨げる可能性があります4。研究によると、高濃度のホルマリンで固定すると、組織の硬さが大きくなることが示されています5。ティールエンバーミング技術などの代替手段は、元の色と組織の柔軟性のより良い保存により有望な結果を示しています6。ただし、この手法は他のソリューションと比較してコストがかかります7。これらの課題は、高品質の解剖学教育を可能にする新しい手頃な価格の保存技術を設計し、テストする機会を提供します。
このプロトコルの目的は、コロンビアのカリにあるイセシ大学の解剖学研究室で、人体解剖学の比較研究のための教育ツールとして使用されるブタのバイオモデルを保存するために採用されている方法論を説明することです。
プロトコル
記載されている技術は、1989年の法律84および学長の決議第847号(2012年7月9日)に従って、イケシ大学の実験における動物のケアと使用のための施設倫理委員会(CIECUAE)のガイドラインに完全に準拠して開発されました。これにより、科学的な完全性と使用される動物の福祉の両方が確保され、彼らの苦しみが最小限に抑えられます。この研究では、生後3か月、体重15〜20 kgのオスのランドレース豚を利用しました。必要な試薬と機器は 、材料表に記載されています。
1. ブタのバイオモデル
- 動物の犠牲
- 一般的な獣医学的評価を実施し、選択したブタ標本を24時間隔離します。この期間中に動物が症状を示さない場合は、安楽死を進めてください。
- 麻酔
- ケタミン+キシラジン+アトロピンを使用して、それぞれ10 mg / kg、0.5 mg / kg、および0.04 mg / kgの用量で筋肉内麻酔を投与します(施設で承認されたプロトコルに従います)。
注:深い麻酔を確保してください。身体検査を通じて麻酔の深さを評価します。深い麻酔は、瞳孔が拡張して中心に立たされていること、眼瞼反射の欠如、角膜反射の低下、および呼吸数、心拍数、および血圧の低下によって示されます。
- ケタミン+キシラジン+アトロピンを使用して、それぞれ10 mg / kg、0.5 mg / kg、および0.04 mg / kgの用量で筋肉内麻酔を投与します(施設で承認されたプロトコルに従います)。
- 安楽死
- 5 mLのペントバルビタールナトリウム/ジフェニルヒダントイン(390/50 mg / mL)を静脈内投与します。.安楽死剤を投与した後、 Suis Scrofa 種の動物の生理学的パラメーターを聴診します:HR、60-90;FR、8-18;T°37-39°C8.
- 心拍数が徐々に減少して完全に停止するまで、心拍数を監視します。括約筋の弛緩、チアノーゼ膜、身体刺激に対する反応の欠如などの即時の変化を観察します。心拍を検出せずに心臓聴診の5分後に安楽死が完了したと考えてください。
- 保管と輸送
- 安楽死後30分以内にブタのバイオモデルを処置室から解剖学研究室に輸送することで、分解や微生物の増殖を防ぎ、バイオモデルの保存を最適化します。
2.チリの溶液に基づく防腐剤溶液
- 修飾チリ溶液の調製
- エタノール、グリセリン、ホルムアルデヒド、塩化ベンザルコニウム、コーヒー芳香族エッセンス、蒸留水を含む改質チリの溶液を使用してください。溶液のpHが7.0であることを確認してください。
- 50Lタンクに保存料溶液を調製します。まず、タンクに10.6Lの蒸留水を加えます。次に、7.6Lの96%エタノール、5Lのグリセリン、0.5Lの50%塩化ベンザルコニウム、および0.1Lのコーヒーアロマエッセンスを追加します。
注:25 Lの改変チリ溶液を調製するために必要な各成分の必要な濃度と容量については、 表1 を参照してください。
3.改変チリ防腐剤溶液の投与
注:防腐剤溶液を調製したら、充満と浸漬で投与します。
- 改変チリ防腐剤溶液の補充による投与
注:この手順には、A1P2フィルター付きの再利用可能なハーフマスク、バイオセーフティゴーグル、長袖の使い捨て手術用ガウン、手術用キャップ、レギンス、ニトリル手袋などのバイオセーフティ服を使用してください。- 外科的アプローチ
- 剣状突起から恥骨領域まで、linea albaに沿って(メスのハンドル4、ブレード22を使用)切開を行います。
- 皮下細胞組織と腹直筋の筋線維を特定します。
注:切開の瞬間に、皮下細胞組織として知られる皮膚に付着した乏しい脂肪組織、およびより深く位置する腹直筋の筋線維を特定します9。 - 腹膜にアクセスするために慎重にカットし、肝臓や腸を傷つけることなく腹腔への開口部を確保します。
- 腸ループを腹腔の右側に引っ込めます。左の腎臓と腎血管を覆う頭頂腹膜を特定します。これらの血管構造を使用して、腹部大動脈を特定します。
- 左腎茎の出現を見つけます。腎動脈の5cm上にある大動脈を覆っている腹膜を切除します。
- 左腎茎を露出させたら、腸ループを動員し、門を覆う腹膜を切開します。前後に解剖して、最初に腎静脈を特定しますが、これは大きく、前方にあります。
- 腹部大動脈の起点までの軌跡をたどって、腎動脈を後方に配置します。最後に、門の最も後部の構造である腎盂を特定します9。
- 大動脈の後部を注意深く解剖します。0/0シルクを使用して、腎動脈のレベルより上の結び目と5 cm上の別の結び目で大動脈を結紮します。
- 孤立した大動脈セグメントの両端にある2つのケリークランプで大動脈をすぐにクランプします。
- Metzembaumハサミの先端で大動脈壁を切開し、大動脈の前壁に約0.3cmの切り込みを入れ、穿孔しないように注意します。
- ケリークランプを取り外しながら遠位端を結び、3.2mmの鈍いL字型の針を動脈内腔に挿入します。近位のケリークランプを取り外し、修飾されたチリの保存溶液の ?? 流を開始します。.
- 修飾チリ保存溶液の大動脈灌流
- 修飾されたチリの保存溶液の灌流を進める。
注:灌流ポンプを使用して、0.25ポンドの圧力で10L / kgを投与します。 - 灌流終了
- 保存液の灌流が完了したら、灌流カニューレを取り外し、挿入部位を0/0シルクで結び、保存液の逆流を防ぎます。0/0シルクでlinea albaの切開部を縫合して腹部を閉じます。
注:適切な灌流が達成されたかどうかを評価するには、飽和度の急性指標を確認します:上肢と下肢の伸展、頸部と胸部の過多、および鼻孔からの溶液の流出。おおよその灌流時間は2時間です。
- 保存液の灌流が完了したら、灌流カニューレを取り外し、挿入部位を0/0シルクで結び、保存液の逆流を防ぎます。0/0シルクでlinea albaの切開部を縫合して腹部を閉じます。
- 外科的アプローチ
- 浸漬による投与
注:この手順には、A1P2フィルター付きの再利用可能なハーフマスク、バイオセーフティゴーグル、長袖の使い捨て手術用ガウン、手術用キャップ、レギンス、ニトリル手袋などのバイオセーフティ服を使用してください。- 改変チリ保存溶液の浸漬による投与
- ブタの標本は、ステップ2で説明したのと同じ保存料溶液で満たされた300Lのタンクに保管します。
注:バイオモデルが約150Lの溶液を使用して完全に浸されていることを確認してください。浸漬後、バイオモデルを20°Cで6ヶ月間保存します。適切な保存の指標には、分解の兆候がないことが含まれます(例:.、体の浮腫、腫れ、悪臭、脂質、組織のもろさ)。
- ブタの標本は、ステップ2で説明したのと同じ保存料溶液で満たされた300Lのタンクに保管します。
- 改変チリ保存溶液の浸漬による投与
4. チリの溶液に基づく変形解
- 変形解除液の調製
- エタノール、グリセリン、塩化ベンザルコニウム、コーヒー芳香族エッセンス、蒸留水を含む改質チリの溶液を使用してください。溶液のpHが7.0であることを確認してください。
- 変形液を50Lタンクで調製します。まず、11.1 Lの蒸留水を加え、次に7.8 Lの96%エタノール、5 Lのグリセリン、1 Lの50%塩化ベンザルコニウム、0.1 Lのコーヒーアロマエッセンスを加えます。
注:ホルムアルデヒドを含まない修飾チリ溶液25 Lを調製するために必要な各成分の必要な濃度と容量については、 表2 を参照してください。
5. 変形解除
注:この手順には、A1P2フィルター付きの再利用可能なハーフマスク、バイオセーフティゴーグル、長袖の使い捨て手術用ガウン、手術用キャップ、レギンス、ニトリル手袋などのバイオセーフティ服を使用してください。
- ホルムアルデヒドを含まないチリの改変溶液の浸漬による投与
- 6ヶ月間の浸漬保存期間の終了時に、ホルムアルデヒドを含まないチリの改変保存溶液で満たされた300 Lタンクにバイオモデルを移します。バイオモデルは4週間保存します。
注:バイオモデルが約150Lの溶液を使用して完全に浸されていることを確認してください。
- 6ヶ月間の浸漬保存期間の終了時に、ホルムアルデヒドを含まないチリの改変保存溶液で満たされた300 Lタンクにバイオモデルを移します。バイオモデルは4週間保存します。
6.グリセリン軟化
- 変形プロセスの直後に、水で希釈したグリセリンの濃度を上げた溶液(50%、70%、90%のグリセリン)にバイオモデルを浸します。バイオモデルを各濃度で1週間維持します。
結果
このプロトコルの目標は、比較人体解剖学の教育のためにブタのバイオモデルの保存を可能にする効果的で実行可能な技術を提示することです。現在、モデルの保存を評価するための標準化された方法やテストはありません。したがって、モデルの全体的な保存は、試料のプロトコルが完了した後の溶液の補充と分解の兆候の指標を使用して評価されました。さらに、バイオモデルの教育や研究への生存率を客観的に評価するために、選択した解剖学的構造の組織特性(抵抗性や弾力性など)の保存前と保存後の比較を計画しました。選択された解剖学的構造は、迷走神経、大動脈、およびカバ静脈でした。これらの構造が選ばれたのは、神経、動脈、静脈が肉眼解剖学の教育と学習の基本であるためです。その結果、4つの迷走神経、4つの大動脈、および3つのカバ静脈が、新鮮で保存されていない標本から分離されました。
したがって、提示されたプロトコルを使用して、12個のブタ標本の体を保存しました。保存されたブタのバイオモデルは、前肢の伸展、血液、鼻孔から流出する保存液(図1)、浮腫、胸部および頸部周囲の増加(図2 および 図3)、肝臓の白っぽい斑点模様の出現(図4)、腸ループの淡白化(図5)などの補充の指標を使用して、保存の妥当性について評価されました).すべてのバイオモデルは、補充の成功した指標を示しました。プロトコールの完了後、どのバイオモデルも、腸ループの膨張、悪臭、組織のもろさなど、分解に関連する変化を示しませんでした。
バイオモデルの検査後、この技術が操作と解剖のために組織をうまく保存したことは明らかでした。例としては、筋肉とその腱膜(図6)、腹膜(図7)、胃と腸(図8)などがあります。これは主観的に評価されましたが、これらすべての臓器は操作中に高い柔軟性を維持していました。肝臓の粘稠度は固いものの、解剖後の肝内管とそれに関連する血管新生の同定を可能にしました(図9 および 図10)。
しかし、結果は必ずしも有望ではありませんでした。プロトコールが開発される前は、バイオモデルの真菌のコロニー形成が頻繁に問題となっていました。これは、防腐剤溶液の浸漬による補充および投与のための標準化されていない技術の使用に起因する可能性があります。 図6 は、コロニー形成の影響を受けたバイオモデルを示しています。
さらに、組織の保存を客観的に評価するために、保存されていない構造と保存された構造の両方で、関心のある特定の特性が測定されました。保存されたバイオモデルから、4つの迷走神経、4つの大動脈、および3つのカバ静脈が単離されました。測定された特性は、組織の抵抗(構造を引き裂くのに必要なニュートンとして定量化)と組織の柔軟性(ヤング率を使用して測定)10,11でした。結果を平均±標準偏差(SD)として表3に示します。
これらの構造の外科的抽出とそれらの弾力性と耐性の評価は、バイオモデル全体の保存度とそれが元の機械的特性をどの程度保持しているかの定量的近似を提供するために行われました。これらの特定の解剖学的構造の選択は、血管構造と神経構造が解剖中に教師と学生によって最も頻繁に操作されるため、破裂のリスクが高くなるという事実に基づいていました。
動物の生体組織の機械的特性を評価するために、サンプルを2つのクランプの間に吊り下げ、一方の端を力変換器に接続し、もう一方の端を一定の水の流れを通じて増加する負荷を受ける方法を設計しました。加えられる力は、水の密度と重力を考慮して計算され、サンプルの伸びは負荷が増加すると測定されました。これらの測定により、組織の硬さを表すヤング率の決定や、破裂前の荷重に耐える組織の能力を反映した特定の力の適用に対する最大抵抗の特定が容易になりました。この方法は、生体組織の弾性特性と強度特性を正確に評価し、生体組織の機械的挙動を理解するための基本となります。
保存された迷走神経は、保存されていない標本と比較して、抵抗と弾力性の有意な増加を示しました。予想に反して、保存された大動脈は、保存されていない標本と比較してわずかに低い抵抗を示しましたが、弾力性は適度に増加しました。カバ静脈の保存により、抵抗力と弾力性の両方が顕著に増加しました。これらの知見は、保存プロセスが評価された組織の機械的特性に明らかな影響を与えることを示しており、これらの保存された組織を解剖学的研究に応用するための貴重な洞察を提供します。
このプロトコルを開発した形態学研究チームは、ブタのバイオモデルの保存に豊富な経験を持っています。10%ホルマリンによる保存など、以前に使用されていた従来の技術の変更と最適化により、組織の官能特性に関して、保存結果の質的な改善が観察されています。保存されたバイオモデルは、現在、イセシ大学での形態学研究や医学生のヒト比較解剖学の教育に使用されています。実験室で最も寿命が長いモデルは、新たな浸漬や追加プロセスを必要とせずに、室温で7年に達しました。教育経験から、学生による高レベルの操作にもかかわらず、バイオモデルは保存後最大4年間、解剖学的構造の完全性を維持することがわかっています。

図1:鼻孔からの血液と保存液の流出( A)灌流前の流出。(B)灌流中の流出。 この図の拡大版を表示するには、ここをクリックしてください。

図2:保存液灌流前後の胸部周囲 (A)灌流前の胸部周囲。(B)灌流後の胸部周囲。胸部周囲で4cmの増加が観察されます。 この図の拡大版を表示するには、ここをクリックしてください。
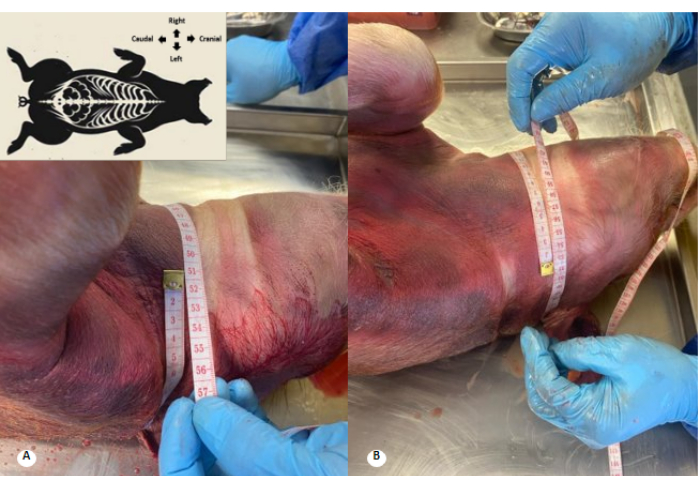
図3:防腐剤溶液灌流前後の頸部周囲。 (A)灌流前の頸部周囲。(B)灌流後の頸部周囲。頸部周囲部で1cmの増加と頸部襞の衰退が観察されます。 この図の拡大版を表示するには、ここをクリックしてください。
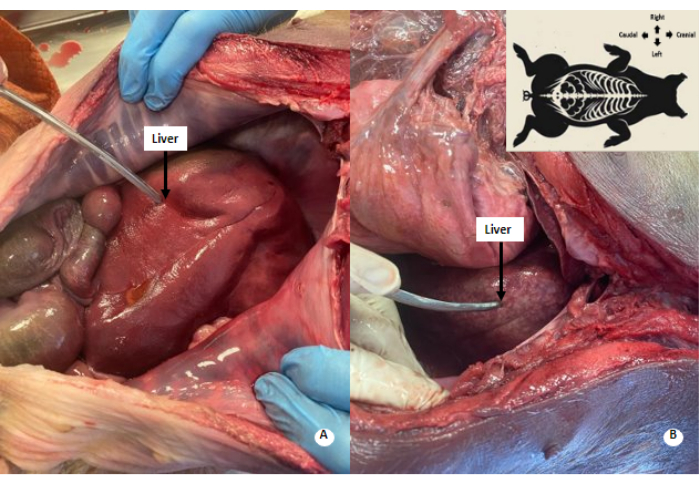
図4:肝臓の白っぽいまだら模様。 (A)灌流前の肝臓。(B)灌流後の肝臓。灌流された肝臓には白っぽいまだら模様が観察されます。 この図の拡大版を表示するには、ここをクリックしてください。

図5:腸ループの蒼白性(A)灌流前の小腸。(B)灌流後の小腸。腸ループの蒼白が観察されます。この図の拡大版を表示するには、ここをクリックしてください。

図6:真菌がコロニーを形成したバイオモデル。 下カバ静脈の腹側牽引は、真菌のコロニー形成を示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図7:腹横筋とその腱膜 (1)腹横筋。(2) 腹横筋の腱膜症。 この図の拡大版を表示するには、ここをクリックしてください。

図8:保存されたブタバイオモデルの頭頂腹 膜 (1)頭頂腹膜。(2)切片化された肝臓の左葉。(3)胃。 この図の拡大版を表示するには、ここをクリックしてください。
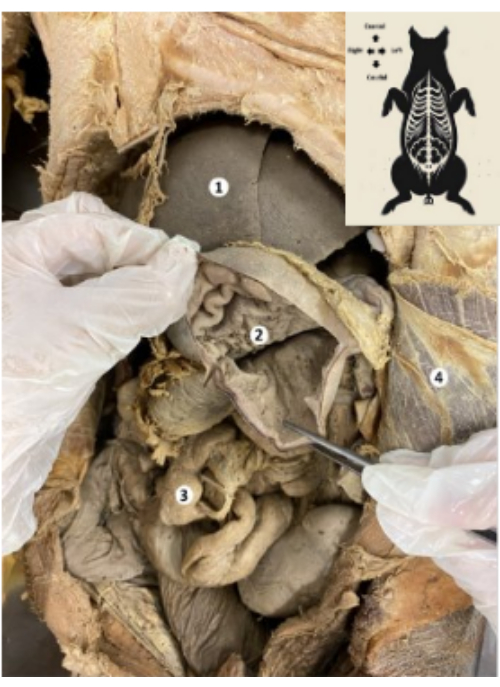
図9:保存されたブタのバイオモデルの胃 (1)肝臓。(2) 胃粘膜。(3)腸。(4)腹横筋と頭頂腹膜。 この図の拡大版を表示するには、ここをクリックしてください。
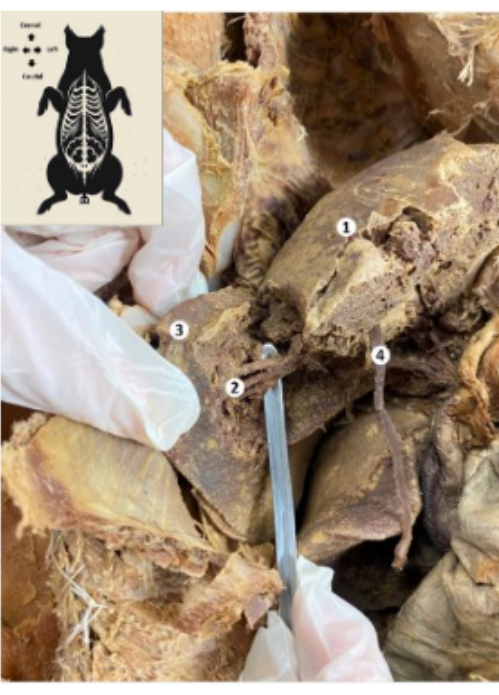
図10:保存されたブタのバイオモデルの肝臓( 1)肝臓の横隔膜面。(2)肝臓の下部後部(肝動脈、胆管、門脈下部後枝)。(3)肝臓の右葉。(4)肝臓の丸い靭帯。 この図の拡大版を表示するには、ここをクリックしてください。
| 反応 | 最終濃度 | 量 | 最終巻数 |
| エタノール 96% | 30% | 7.8リットル | 25リットル |
| グリセリン | 20% | 5Lの | |
| ホルムアルデヒド 40% | 2% | 0.5リットル | |
| 塩化ベンザルコニウム 50% | 2% | 1リットル | |
| アロマティックエッセンス(コーヒー) | 0.40% | 0.1リットル | |
| 蒸留水 | NAの | 10.6リットル |
表1:チリの改変溶液に基づく防腐剤溶液。
| 反応 | 最終濃度 | 量 | 最終巻数 |
| エタノール 96% | 30% | 7.8リットル | 25リットル |
| グリセリン | 20% | 5Lの | |
| 塩化ベンザルコニウム 50% | 2% | 1リットル | |
| アロマティックエッセンス(コーヒー) | 0.40% | 0.1リットル | |
| 蒸留水 | NAの | 11.1リットル |
表2:改質チリ溶液に基づくホルムアルデヒドフリー防腐剤溶液。
| 組織 | 未保存 | 保存 | ||
| ニュートン±SD* | ヤング率 ± SD* | ニュートン±SD* | ヤング率 ± SD* | |
| 迷走神経 | 4.92 ± 0.98 | 879.5±427.02 | 8.59 ± 0.83 | 1392.21±729.6 |
| 大動脈動脈 | 9.33 ± 1.5 | 325.89±176.15 | 8.48 ± 1.26 | 417.16±379.95 |
| カバ静脈 | 5.73 ± 2.3 | 145.5±40.89 | 8.92±3.97 | 264.69±188.72 |
表3:解剖学的構造の未保存標本および保存標本の組織特性。 ※SD:標準偏差。
ディスカッション
伝統的に、解剖学的研究は人間の死体に依存してきました。しかし、これらの標本の入手に課題が生じ、代替方法の検討が進められています。ブタのバイオモデルは、ヒトの解剖学を研究するための貴重なツールであることが証明されており、学習とそのヒトの医療応用への外挿を容易にする解剖学的類似性を提供している12,13,14,15。死体保存技術は伝統的に定性的に分類されてきましたが、ヤング率を使用して保存された組織の強度と弾力性を測定することで、保存の程度の定量的な証拠が得られる可能性があります。生体組織の保存における革新的なアプローチの探求は、現実的なモデルにおける解剖学的複雑さの探求を促進する必要性に応えています。したがって、Universidad Icesiの解剖学研究室で開発および使用されているブタバイオモデルを保存するためのプロトコルは、組織の保存とその後の解剖学的研究の実行可能な代替手段として提示されています。
経験に基づくと、ブタのバイオモデルでは、腹部大動脈を通じて標本循環にアプローチすることが、ヒトの死体で一般的に行われる大腿動脈カニューレ挿入術と比較して、より効果的な代替手段である16。ブタの大腿動脈壁の壊れやすい性質は、これらの壁が灌流ポンプによって加えられる圧力によって破裂しやすいため、腹部アプローチの好まれを促しました。プロトコールの補充ステップは、標本全体の適切な保存にとって重要であるため、実行可能なエントリーポイントを確保することは非常に重要です。最適でない補充は、分解のリスクが高くなります。したがって、プロトコルを続行する前に、成功した補充サインを評価する必要があります。これらの徴候には、上肢と下肢の伸展、頸椎と胸部の過多、および保存溶液の灌流による鼻孔からの溶液の流出が含まれます。このプロトコルの実行中に発生する可能性のある一般的な課題は、保存溶液の注入中の大動脈の裂傷です。このような場合は、動脈を結紮し、上セグメントの解剖を進めて二次カニューレ挿入を促進し、補充ステップを再開することをお勧めします。さらに、プロトコール中のいずれかの時点で分解の兆候が明らかになった場合は、検体全体を廃棄する必要があります。
このプロトコルで使用される防腐剤溶液は、塩化ナトリウムの不在、エタノール濃度の24%から30%への増加、グリセリン濃度の16%から20%への増加、ホルムアルデヒド濃度の3.7%から2%への減少、およびユーカリエッセンスとコーヒーエッセンスの置換など、従来のチリの溶液と比較したバリエーションが含まれています17。
適切な変形化により、教師、研究室、学生などの人員がホルムアルデヒドにさらされることを減らすため、変形化プロセスはプロトコルのもう一つの重要なステップです。さらに、グリセリンによる軟化プロセスは、新鮮な組織と同様のテクスチャーを達成するために不可欠です。従来の10%ホルムアルデヒドによる保存では、組織が硬くなり、弾力性が失われ、取り扱い中に裂けやすくなります。しかし、ホルムアルデヒド濃度を2%に低減した改質チリ溶液を使用し、続いてグリセリンによる変形除去と軟化を行うことで、この問題を軽減することができます。
このプロトコルに従って、操作時に高度な柔軟性が達成されましたが、肝臓などの固形臓器は、固いものの、その構造の解剖と同定を可能にする一貫性を示しました。それにもかかわらず、さまざまな保存技術間で組織の保存品質を比較するには、さらなる定量的研究が必要です。
このプロトコルを実施する際には、いくつかの潜在的な制限を考慮する必要があります。まず、標本のサイズには細心の注意を払う必要があり、推奨範囲は15〜20 kgです。より大きな動物は、保存プロトコルの実行とバイオモデルの処分の管理に課題を提示する可能性があります。第二に、指定された研究所には、適切な蒸気抽出システムと下水システムの廃棄物トラップを装備する必要があります。この予防措置は、技術者の有機蒸気への曝露を軽減し、保存プロセス中に生成される残留物に起因する環境汚染を最小限に抑えることを目的としています。第三に、バイオモデルに解剖学的変異が存在する可能性を認識する必要があります。さらに、ブタの標本は人間と解剖学的に類似していますが、違いも示しています。したがって、比較解剖学的研究では、このようなバリエーションを慎重に検討する必要があります。
組織の官能特性の評価は、伝統的に定性的にアプローチされ、臭気、色、硬さ、脆性、取り扱いの容易さなどの特性に焦点を当ててきました18。しかし、これらのパラメータを客観的に決定することを目的とした研究は著しく不足しています。その一例がHP Theeuwesの研究で、11%ホルマリン、新鮮な組織で保存された死体の上肢関節の可動性、および関節を固定して屈曲に必要な力を測定する修正方法を比較しました5。これに関連して、研究チームは、組織の機械的特性を客観的に評価する方法を開発し、既存の定性的評価の限界を克服することを目指しています。
死体保存に関しては、ホルマリンが最も一般的に使用される薬剤ですが、いくつかの代替物質も成功裏に使用されています。これらの物質には、グルタルアルデヒド、モノエチレングリコール、ジエチレングリコール、エタノール-グリセリン溶液、および飽和塩が含まれます。保存方法の多様性は、医学研究、教育、または展示目的で組織保存を最適化するための継続的な探求を反映しています3,19。これらの進歩は、ヒト組織の構造的および機能的特性を長期間最適に維持するための、より効果的な保存技術を開発するための研究の重要性を浮き彫りにしています。
将来のアプリケーションでは、このプロトコルで観察された高レベルの組織保存は、解剖学的研究と教育を前進させる上で大きな期待を寄せています。この方法の可能性は、高度な解剖学的研究にまで及び、外科トレーニングのための現実的なモデルを提供し、没入型医療シミュレーションの開発に貢献します。さらに、このプロトコルの適応性は、多様な解剖学的標本での探索への道を開き、それによってさまざまな医学的および科学的文脈での有用性を拡大します。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究へのご支援をいただいた基礎医学科とイセシ大学研究室に感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
参考文献
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved