Method Article
שימור מודלים ביולוגיים של חזירים לחקר אנטומיה אנושית השוואתית
In This Article
Summary
מאמר זה מציג פרוטוקול לשימור מודלים ביולוגיים של חזירים. השיטה המוצעת כוללת שימוש בתמיסה צ'יליאנית שונה עם ריכוז פורמלין מופחת. תהליך השימור מורכב ממתן התמיסה הן באמצעות מילוי והן באמצעות טבילה של הדגימה, ולאחר מכן דפורמוליזציה וריכוך רקמות באמצעות גליצרין.
Abstract
הוראת האנטומיה האנושית בחינוך הרפואי עומדת בפני אתגרים, המחייבים חלופות יעילות לתלמידים לחקור באופן מעשי את המורכבות האנטומית. מודלים ביולוגיים של חזירים, עם הדמיון האנטומי שלהם לבני אדם, מציעים פתרון מבטיח. מאמר זה מציג פרוטוקול מפורט לשימור מודלים ביולוגיים של חזירים, המתייחס לצורך בשיטות נגישות ויעילות במחקרי אנטומיה השוואתיים. פרוטוקול זה מציע שימוש בפתרון צ'יליאני מותאם לשימור מודלים ביולוגיים, תוך שימוש בטכניקות פורמליניזציה באמצעות מילוי וטבילה. לאחר מכן, דה-פורמליזציה מושגת באמצעות התמיסה הצ'יליאנית המעודכנת ללא פורמלדהיד, ואחריה תהליך ריכוך גליצרין. בהתחשב במיעוט הספרות על טכניקות שימור והיעדר הליך או בדיקה סטנדרטיים להערכת שימור רקמות, אנו מציעים להעריך את איכות הרקמות על סמך מדדים של עמידות וגמישות. הממצאים שלנו מצביעים על רמה גבוהה מבחינה איכותית של שימור רקמות בדגימות שלנו. יתר על כן, מודלים ביולוגיים אלה משמשים כיום בהצלחה למחקרי מורפולוגיה ולהוראת אנטומיה השוואתית אנושית לסטודנטים לרפואה.
Introduction
הוראת האנטומיה בבתי הספר לרפואה נתקלת לעתים קרובות במכשולים, כגון קשיים בגישה לגופות אנושיות לנתיחה והיעדר מתקנים מתאימים. מגבלות אלו מדגישות את הצורך בחלופות יעילות המאפשרות לתלמידים לחקור מורכבות אנטומית באופן מעשי ומציאותי. בהקשר זה, מודלים ביולוגיים של חזירים התגלו כחלופה מבטיחה בשל הדמיון האנטומי שלהם לבני אדם, המציעים אמצעי נגיש ויעיל ללמידה והוראת אנטומיה1.
טכניקות שימור אנטומיות שואפות לשמור על שלמות הרקמות הביולוגיות תוך מזעור הנזק. טכניקות אלו שימשו למטרות חינוכיות, אקדמיות ומחקריות בחקר האנטומיה האנושית והווטרינרית כאחד. חומרים רבים נבדקו כדי לשמר גופים, איברים ורקמות במצבם הטבעי זמן רב ככל האפשר2. עם זאת, שימור ושימור דגימות אנטומיות נותר מאתגר, במיוחד עבור אלה המיועדים למחקרים מורפולוגיים, שבהם נדרש שימור רקמות גבוה3.
למרות שפתרונות בשימוש מסורתי זמינים באופן נרחב, ניכרות מגבלות בתרגול היומיומי. לפורמלין, אחד החומרים הנפוצים ביותר בשימוש, יש מספר חסרונות מתועדים לשימור רקמות. אלה כוללים את הריח המגרה, הרעילות הגבוהה, הסיכונים הנלווים לסרטן ומוטגניות למטפלים, והשינויים האורגנולפטיים שהוא גורם ברקמות, כגון נוקשות ושינוי צבע. שינויים אלה יכולים לשנות את תפיסת התכונות הפיזיולוגיות של הרקמות כאשר הם נחקרים לאחר קיבוע, מה שעלול לעכב מחקרים מורפולוגיים מדויקיםומדויקים 4. מחקרים הראו כי קיבוע עם ריכוזים גבוהים של פורמלין מביא לדרגה גבוהה יותר של נוקשות רקמות5. חלופות, כגון טכניקת החניטה של תיל, הראו תוצאות מבטיחות עם שימור טוב יותר של הצבע המקורי וגמישות הרקמות6. עם זאת, טכניקה זו יקרה יותר בהשוואה לפתרונות אחרים7. אתגרים אלה מהווים הזדמנות לתכנן ולבדוק טכניקות שימור חדשות ובמחיר סביר שעדיין מאפשרות הוראת אנטומיה באיכות גבוהה.
מטרת פרוטוקול זה היא לתאר את המתודולוגיה המופעלת במעבדת האנטומיה של אוניברסיטת Icesi בקאלי, קולומביה, לשימור מודלים ביולוגיים של חזירים המשמשים ככלים חינוכיים למחקר השוואתי של האנטומיה האנושית.
Protocol
הטכניקה המתוארת פותחה תוך התאמה מלאה להנחיות ועדת האתיקה המוסדית לטיפול ושימוש בבעלי חיים בניסויים (CIECUAE) של אוניברסיטת ICESI, בהתאם לחוק 84 משנת 1989 והחלטת הרקטור מס' 847 (9 ביולי 2012). זה מבטיח הן את היושרה המדעית והן את רווחת בעלי החיים המשמשים, וממזער את סבלם. חזירים זכרים, בני 3 חודשים ובמשקל 15-20 ק"ג, שימשו למחקר זה. הריאגנטים והציוד הנדרשים מפורטים בטבלת החומרים.
1. מודל ביולוגי של חזיר
- הקרבת הבהמה
- ערכו הערכה וטרינרית כללית והסגר את דגימת החזיר הנבחרת למשך 24 שעות. אם החיה אינה מציגה תסמינים כלשהם בתקופה זו, המשך בהמתת חסד.
- הרדמה
- יש לתת הרדמה תוך שרירית באמצעות קטמין + קסילזין + אטרופין במינונים של 10 מ"ג/ק"ג, 0.5 מ"ג/ק"ג ו-0.04 מ"ג/ק"ג, בהתאמה (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
הערה: הקפידו על הרדמה עמוקה. העריכו את עומק ההרדמה באמצעות בדיקה גופנית. הרדמה עמוקה מסומנת על ידי אישון מורחב וממורכז, היעדר רפלקס פלפברלי, דיכוי של רפלקס הקרנית וירידה בקצב הנשימה, קצב הלב ולחץ הדם.
- יש לתת הרדמה תוך שרירית באמצעות קטמין + קסילזין + אטרופין במינונים של 10 מ"ג/ק"ג, 0.5 מ"ג/ק"ג ו-0.04 מ"ג/ק"ג, בהתאמה (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
- המתת חסד
- יש לתת 5 מ"ל של נתרן פנטוברביטל/דיפנילהידנטואין (390/50 מ"ג/מ"ל) תוך ורידי. לאחר מתן חומר המתת החסד, יש להאזין לפרמטרים הפיזיולוגיים של החיה עבור המין Suis Scrofa : HR, 60-90; FR, 8-18; ו-T° 37-39 מעלות צלזיוס8.
- עקוב אחר הדופק עד שהוא יורד בהדרגה ומפסיק לחלוטין. שימו לב לשינויים מיידיים כגון הרפיית הסוגרים, ממברנות ציאנוטיות והיעדר תגובה לגירויים בגוף. שקול המתת חסד מלאה לאחר 5 דקות של האזנה ללב מבלי לזהות דופק.
- אחסון והובלה
- העבר את הביו-מודל החזירי מחדר ההליכים למעבדת האנטומיה תוך חצי שעה מהמתת החסד כדי למנוע פירוק והתפשטות חיידקים, ובכך לייעל את שימור הביומודל.
2. תמיסה משמרת המבוססת על תמיסה צ'יליאנית
- הכנת הפתרון הצ'יליאני השונה
- השתמש בתמיסה צ'יליאנית שונה המכילה אתנול, גליצרין, פורמלדהיד, בנזלקוניום כלוריד, תמצית ארומטית של קפה ומים מזוקקים. ודא שלתמיסה יש pH של 7.0.
- הכן את תמיסת השימור במיכל 50 ליטר. ראשית, הוסף למיכל 10.6 ליטר מים מזוקקים. לאחר מכן, הוסף 7.6 ליטר של 96% אתנול, 5 ליטר גליצרין, 0.5 ליטר של 50% בנזלקוניום כלוריד ו-0.1 ליטר תמצית ארומטית קפה.
הערה: עיין בטבלה 1 לריכוזים ולנפחים הנדרשים של כל רכיב הדרוש להכנת 25 ליטר של התמיסה הצ'יליאנית ששונה.
3. מתן התמיסה המשמרת הצ'יליאנית המותאמת
הערה: לאחר הכנת התמיסה המשמרת, יש לתת אותה באמצעות מילוי וטבילה.
- מתן על ידי השלמת התמיסה המשמרת הצ'יליאנית המותאמת
הערה: השתמש בביגוד בטיחות ביולוגית להליך זה: חצי מסכה לשימוש חוזר עם מסנני A1P2, משקפי בטיחות ביולוגית, חלוק כירורגי חד פעמי עם שרוולים ארוכים, כובע כירורגי, חותלות וכפפות ניטריל.- גישה כירורגית
- בצע חתך לאורך הלינאה אלבה (באמצעות ידית אזמל 4, להב 22) מתהליך ה- xiphoid לאזור הערווה.
- זהה את רקמת התא התת עורית ואת סיבי השריר של שריר הבטן הישר.
הערה: ברגע החתך, זהה את רקמת השומן הדלה המודבקת לעור, המכונה רקמת תא תת עורית, ואת סיבי השריר של שריר הבטן הישר הממוקמים עמוק יותר9. - חותכים בזהירות כדי לגשת לצפק, ומבטיחים את פתיחתו לחלל הבטן מבלי לפגוע בכבד ובמעיים, שייחשפו מיד.
- החזר את לולאות המעי לצד ימין של חלל הבטן. זהה את הצפק הקודקודי המכסה את הכליה השמאלית וכלי הכליה. השתמש במבני כלי הדם הללו כדי לאתר את אבי העורקים הבטני.
- מצא את הופעת עוקץ הכליה השמאלי. הסר את הצפק המכסה את אבי העורקים 5 ס"מ מעל עורק הכליה.
- עם חשיפת עוקץ הכליה השמאלי, יש לגייס את לולאות המעי ולחתוך את הצפק המכסה את ההילום. נתח אנטרופוסטריור כדי לזהות תחילה את וריד הכליה, שהוא גדול יותר וממוקם מלפנים.
- אתר את עורק הכליה מאחור, בעקבות מסלולו למקורו באבי העורקים הבטני. לבסוף, זהה את אגן הכליה, המבנה האחורי ביותר של הילום9.
- נתח בזהירות את החלק האחורי של אבי העורקים. השתמש במשי 0/0 כדי לקשור את אבי העורקים עם קשר מעל גובה עורק הכליה וקשר נוסף 5 ס"מ מעל.
- מהדקים את אבי העורקים מיד עם שני מהדקי קלי בשני קצוות מקטע אבי העורקים המבודד.
- חותכים את דופן אבי העורקים בקצה מספריים של Metzembaum, תוך ביצוע חתך של כ- 0.3 ס"מ בדופן הקדמית של אבי העורקים, תוך הקפדה לא לנקב אותו.
- קשרו את הקצה הדיסטלי תוך הסרת קלי clamp כדי להכניס מחט קהה בצורת L בגודל 3.2 מ"מ ללומן העורקי. הסר את מהדק קלי הפרוקסימלי והתחל את הזלוף של תמיסת השימור הצ'יליאנית שונה.
- זלוף אבי העורקים של תמיסת השימור הצ'יליאנית השונה
- המשך עם הזלוף של תמיסת השימור הצ'יליאנית המותאמת.
הערה: יש לתת 0.25 ליטר/ק"ג בלחץ של 10 פאונד באמצעות משאבת זלוף. - סוף הזלוף
- לאחר השלמת הזלוף של תמיסת השימור, הסר את צינורית הזלוף וקשר את מקום ההחדרה עם משי 0/0 כדי למנוע ריפלוקס של תמיסת השימור. סגור את הבטן על ידי תפירת החתך בלינאה אלבה עם משי 0/0.
הערה: כדי להעריך אם הושג זלוף מספק, בדוק את האינדיקטורים החריפים לרוויה: הרחבת הגפיים העליונות והתחתונות, שפע צוואר הרחם ובית החזה, ונגר של התמיסה דרך הנחיריים. זמן הזלוף המשוער הוא שעתיים.
- לאחר השלמת הזלוף של תמיסת השימור, הסר את צינורית הזלוף וקשר את מקום ההחדרה עם משי 0/0 כדי למנוע ריפלוקס של תמיסת השימור. סגור את הבטן על ידי תפירת החתך בלינאה אלבה עם משי 0/0.
- גישה כירורגית
- מתן בטבילה
הערה: השתמש בביגוד בטיחות ביולוגית להליך זה: חצי מסכה לשימוש חוזר עם מסנני A1P2, משקפי בטיחות ביולוגית, חלוק כירורגי חד פעמי עם שרוולים ארוכים, כובע כירורגי, חותלות וכפפות ניטריל.- ניהול על ידי טבילה של פתרון השימור הצ'יליאני המותאם
- אחסן את דגימת החזיר במיכל של 300 ליטר מלא באותה תמיסת שימור המתוארת בשלב 2.
הערה: ודא שהביומודל שקוע לחלוטין באמצעות כ-150 ליטר של התמיסה. לאחר הטבילה, אחסן את המודל הביולוגי בטמפרטורה של 20 מעלות צלזיוס למשך 6 חודשים. אינדיקטורים לשימור הולם כוללים היעדר סימני ריקבון (למשל, בצקת בגוף, נפיחות, ריח רע, שבריריות ושבריריות של הרקמות).
- אחסן את דגימת החזיר במיכל של 300 ליטר מלא באותה תמיסת שימור המתוארת בשלב 2.
- ניהול על ידי טבילה של פתרון השימור הצ'יליאני המותאם
4. פתרון דפורמוליזציה המבוסס על תמיסה צ'יליאנית
- הכנת תמיסת הדפורמוליזציה
- השתמש בתמיסה צ'יליאנית שונה המכילה אתנול, גליצרין, בנזלקוניום כלוריד, תמצית ארומטית של קפה ומים מזוקקים. ודא שלתמיסה יש pH של 7.0.
- הכן את תמיסת הדפורמוליזציה במיכל של 50 ליטר. ראשית, הוסיפו 11.1 ליטר מים מזוקקים, לאחר מכן 7.8 ליטר אתנול 96%, 5 ליטר גליצרין, 1 ליטר 50% בנזלקוניום כלוריד ו-0.1 ליטר תמצית ארומטית קפה.
הערה: עיין בטבלה 2 לריכוזים ולנפחים הנדרשים של כל רכיב הדרוש להכנת 25 ליטר של התמיסה הצ'יליאנית השונה ללא פורמלדהיד.
5. דפורמוליזציה
הערה: השתמש בביגוד בטיחות ביולוגית להליך זה: חצי מסכה לשימוש חוזר עם מסנני A1P2, משקפי בטיחות ביולוגית, חלוק כירורגי חד פעמי עם שרוולים ארוכים, כובע כירורגי, חותלות וכפפות ניטריל.
- מתן על ידי טבילה של תמיסת השימור הצ'יליאנית המותאמת ללא פורמלדהיד
- בתום תקופת שימור הטבילה של 6 חודשים, העבירו את הביומודל למיכל של 300 ליטר מלא בתמיסת שימור צ'יליאנית שונה ללא פורמלדהיד. אחסן את המודל הביולוגי למשך 4 שבועות.
הערה: ודא שהביומודל שקוע לחלוטין באמצעות כ-150 ליטר של התמיסה.
- בתום תקופת שימור הטבילה של 6 חודשים, העבירו את הביומודל למיכל של 300 ליטר מלא בתמיסת שימור צ'יליאנית שונה ללא פורמלדהיד. אחסן את המודל הביולוגי למשך 4 שבועות.
6. ריכוך גליצרין
- מיד לאחר תהליך הדפורמוליזציה, טבלו את הביומודל בתמיסות עם ריכוזים הולכים וגדלים של גליצרין מדולל במים: 50%, 70% ו-90% גליצרין. שמור על המודל הביולוגי בכל ריכוז למשך שבוע.
תוצאות
מטרת פרוטוקול זה היא להציג טכניקה יעילה ובת קיימא המאפשרת שימור של מודלים ביולוגיים של חזירים להוראת אנטומיה אנושית השוואתית. אין כיום שיטות או בדיקות סטנדרטיות להערכת שימור המודל. לכן, השימור הכולל של המודל הוערך באמצעות אינדיקטורים של מילוי תמיסה וסימני פירוק לאחר השלמת הפרוטוקול על הדגימות. יתר על כן, כדי להעריך באופן אובייקטיבי את הכדאיות של המודלים הביולוגיים להוראה ולמחקר, תוכננה השוואה של מאפייני הרקמה של מבנים אנטומיים נבחרים, כגון עמידות וגמישות, לפני ואחרי השימור. המבנים האנטומיים שנבחרו היו עצב התועה, עורק אבי העורקים ווריד הקאווה. מבנים אלה נבחרו מכיוון שעצבים, עורקים וורידים הם בסיסיים בהוראה ולמידה של אנטומיה גסה. כתוצאה מכך, 4 עצבים תועים, 4 עורקי אבי העורקים ו-3 ורידי קאווה בודדו מדגימות טריות שלא השתמרו.
בהתאם לכך, באמצעות הפרוטוקול שהוצג, גופותיהם של 12 דגימות חזיר נשמרו. המודלים הביולוגיים של החזירים שהשתמרו הוערכו לשימור הולם באמצעות אינדיקטורים של מילוי, כגון הארכת הגפיים הקדמיות, דם ותמיסת שימור היוצאת דרך הנחיריים (איור 1), בצקת ועלייה בהיקף בית החזה וצוואר הרחם (איור 2 ואיור 3), כמו גם הופעת תבנית מנומרת לבנבן בכבד (איור 4) וחיוור של לולאות המעי (איור 5). כל המודלים הביולוגיים הראו אינדיקטורים מוצלחים של השלמה. לאחר השלמת הפרוטוקול, אף אחד מהמודלים הביולוגיים לא הראה שינויים הקשורים לפירוק, כגון התנפחות של לולאות המעי, ריח רע או פריכות רקמות.
לאחר בדיקת המודלים הביולוגיים, ניכר כי טכניקה זו שימרה בהצלחה את הרקמות לצורך מניפולציה ודיסקציה. דוגמאות לכך כוללות שרירים והאפונורוזות שלהם (איור 6), הצפק (איור 7), הקיבה והמעיים (איור 8). זה הוערך באופן סובייקטיבי, שכן כל האיברים הללו שמרו על גמישות גבוהה במהלך המניפולציה. עקביות הכבד, למרות שהיא יציבה, אפשרה לזהות את הצינורות התוך-כבדיים ואת כלי הדם הקשורים אליהם לאחר דיסקציה (איור 9 ואיור 10).
עם זאת, התוצאות לא תמיד היו מבטיחות. לפני פיתוח הפרוטוקול, קולוניזציה פטרייתית של המודלים הביולוגיים הייתה בעיה תכופה. ייתכן שניתן לייחס זאת לשימוש בטכניקה לא סטנדרטית למילוי ומתן על ידי טבילה של תמיסת השימור. איור 6 מציג מודל ביולוגי שהושפע מהקולוניזציה.
בנוסף, כדי להעריך באופן אובייקטיבי את שימור הרקמות, נמדדו מאפיינים ספציפיים מעניינים הן במבנים שלא השתמרו והן במבנים שהשתמרו. ארבעה עצבים תועים, ארבעה עורקי אבי העורקים ושלושה ורידי קאווה בודדו ממודלים ביולוגיים משומרים. המאפיינים שנמדדו היו התנגדות הרקמה (כומתה כניוטון הנדרש כדי לקרוע את המבנה) וגמישות הרקמה (נמדדה באמצעות מודול יאנג)10,11. התוצאות מוצגות כממוצע ± סטיית תקן (SD) בטבלה 3.
המיצוי הכירורגי של מבנים אלה והערכת האלסטיות והעמידות שלהם נערכו כדי לספק קירוב כמותי של מידת השימור של הביומודל כולו ועד כמה הוא שמר על תכונותיו המכניות המקוריות. הבחירה במבנים אנטומיים ספציפיים אלה התבססה על העובדה שמבני כלי הדם והעצבים מנוהלים בתדירות הגבוהה ביותר על ידי מורים ותלמידים במהלך הדיסקציה, ובכך מהווים סיכון גדול יותר לקרע.
כדי להעריך את התכונות המכניות של רקמות ביולוגיות של בעלי חיים, תוכננה שיטה שכללה השעיית הדגימה בין שני מהדקים, כאשר קצה אחד מחובר למתמר כוח והקצה השני נתון לעומס הולך וגובר באמצעות זרימה מתמדת של מים. הכוח המופעל חושב בהתחשב בצפיפות המים וכוח הכבידה, בעוד שהתארכות הדגימה נמדדה בעומס הולך וגובר. מדידות אלו הקלו על קביעת המודול של יאנג, המייצג את נוקשות הרקמות, כמו גם את זיהוי ההתנגדות המקסימלית להפעלת כוח ספציפי, המשקף את יכולתה של הרקמה לעמוד בעומסים לפני הקרע. שיטה זו מספקת הערכה מדויקת של תכונות האלסטיות והחוזק של רקמות ביולוגיות, שהיא בסיסית להבנת ההתנהגות המכנית שלהן.
עצבי הנרתיק שהשתמרו הראו עלייה משמעותית בעמידות ובגמישות בהשוואה לדגימות שלא השתמרו. בניגוד לציפיות, עורק אבי העורקים המשומר הפגין התנגדות מעט נמוכה יותר אך עלייה מתונה בגמישות בהשוואה לדגימות שלא השתמרו. שימור וריד הקאווה הביא לעלייה ניכרת הן בעמידות והן בגמישות. ממצאים אלה מצביעים על כך שלתהליך השימור יש השפעה ניכרת על התכונות המכניות של הרקמות המוערכות, ומספקים תובנות חשובות ליישום רקמות משומרות אלה במחקרים אנטומיים.
צוות המחקר המורפולוגיה שפיתח פרוטוקול זה הוא בעל ניסיון רב בשימור מודלים ביולוגיים של חזירים. שיפור איכותי בתוצאות השימור נצפה מבחינת התכונות האורגנולפטיות של הרקמות עקב שינויים ואופטימיזציה של טכניקות קונבנציונליות ששימשו בעבר, כגון שימור עם פורמלין 10%. המודלים הביולוגיים המשומרים משמשים כיום בהצלחה באוניברסיטת Icesi למחקרי מורפולוגיה והוראת אנטומיה השוואתית אנושית לסטודנטים לרפואה. הדגם בעל תוחלת החיים הארוכה ביותר במעבדה הגיע ל-7 שנים בטמפרטורת החדר ללא צורך בטבילות חדשות או בתהליכים נוספים. ניסיון ההוראה הראה שלמרות רמות גבוהות של מניפולציה על ידי תלמידים, המודלים הביולוגיים שומרים על שלמות המבנים האנטומיים עד 4 שנים לאחר השימור.

איור 1: זרימת דם ותמיסות משמרות דרך הנחיריים. (A) זרימה לפני זלוף. (B) זרימה החוצה במהלך הזלוף. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: היקף בית החזה לפני ואחרי זלוף תמיסת שימור. (A) היקף בית החזה לפני זלוף. (B) היקף בית החזה לאחר זלוף. נצפתה עלייה של 4 ס"מ בהיקף בית החזה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
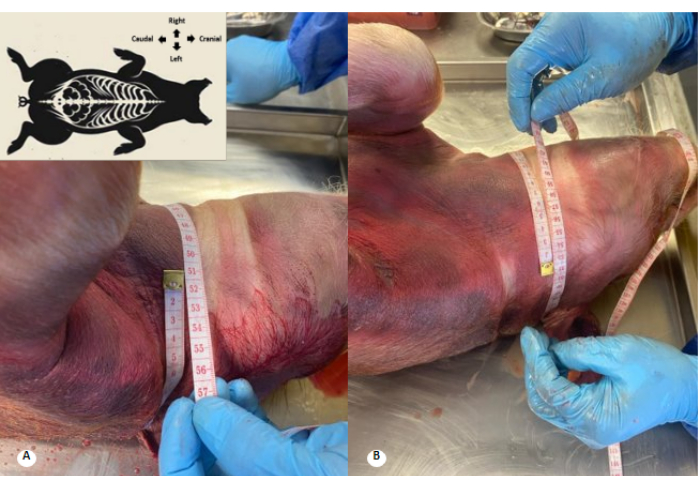
איור 3: היקף צוואר הרחם לפני ואחרי זלוף תמיסה משמרת. (A) היקף צוואר הרחם לפני זלוף. (B) היקף צוואר הרחם לאחר זלוף. נצפתה עלייה של 1 ס"מ בהיקף צוואר הרחם ומחיקה של קפלי צוואר הרחם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
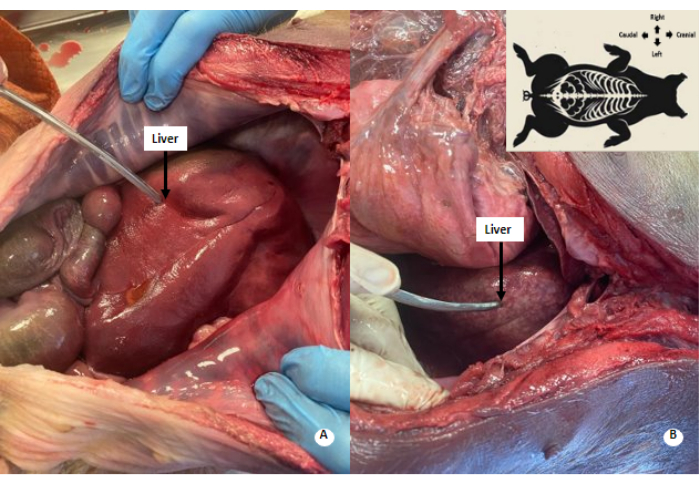
איור 4: דפוס מנומר לבנבן בכבד. (A) כבד לפני זלוף. (B) כבד לאחר זלוף. דפוס מנומר לבנבן נצפה בכבד המנומר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: חיוורון של לולאות המעי. (A) מעי דק לפני זלוף. (B) מעי דק אחרי זלוף. נצפתה חיוורון של לולאות המעי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: מודל ביולוגי מיושב על ידי פטריות. מתיחת הגחון של וריד הקאווה התחתון מראה קולוניזציה פטרייתית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: שריר הבטן הרוחבי והאפונורוזיס שלו. (1) שריר הבטן הרוחבי. (2) אפונורוזיס של שריר הבטן הרוחבי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 8: הצפק הקודקודי של המודל הביולוגי החזירי המשומר. (1) הצפק הקודקודי. (2) האונה השמאלית של הכבד החתוך. (3) קיבה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
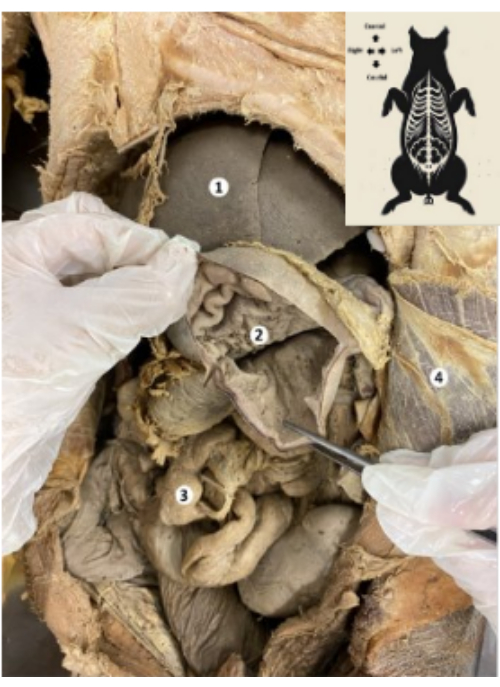
איור 9: הקיבה של המודל הביולוגי החזירי המשומר. (1) כבד. (2) רירית הקיבה. (3) מעיים. (4) שריר בטן רוחבי וצפק פריאטלי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
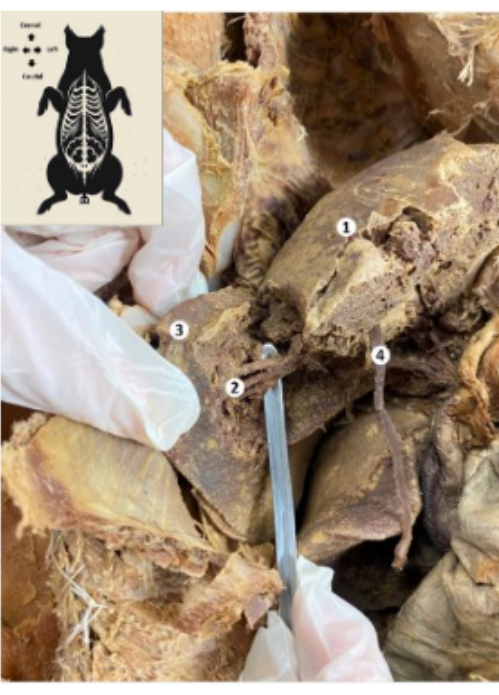
איור 10: הכבד של הביו-מודל החזירי המשומר. (1) הפנים הסרעפתיות של הכבד. (2) מקטע אחורי תחתון של הכבד (עורק הכבד, צינור המרה, הענף האחורי התחתון של וריד הפורטל). (3) האונה הימנית של הכבד. (4) רצועה עגולה בכבד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מגיב | ריכוז סופי | כמות | כרך סופי |
| אתנול 96% | 30% | 7.8 ליטר | 25 ליטר |
| גליצרין | 20% | 5 ליטר | |
| פורמלדהיד 40% | 2% | 0.5 ליטר | |
| בנזלקוניום כלוריד 50% | 2% | 1 ליטר | |
| תמצית ארומטית (קפה) | 0.40% | 0.1 ליטר | |
| מים מזוקקים | נה | 10.6 ליטר |
טבלה 1: תמיסה משמרת המבוססת על תמיסה צ'יליאנית שונה.
| מגיב | ריכוז סופי | כמות | כרך סופי |
| אתנול 96% | 30% | 7.8 ליטר | 25 ליטר |
| גליצרין | 20% | 5 ליטר | |
| בנזלקוניום כלוריד 50% | 2% | 1 ליטר | |
| תמצית ארומטית (קפה) | 0.40% | 0.1 ליטר | |
| מים מזוקקים | נה | 11.1 ליטר |
טבלה 2: תמיסה משמרת נטולת פורמלדהיד המבוססת על תמיסה צ'יליאנית שונה.
| טישו | לא השתמר | משומר | ||
| ניוטון ± SD* | המודול של יאנג ± SD* | ניוטון ± SD* | המודול של יאנג ± SD* | |
| עצב תועה | 4.92 ± 0.98 | 879.5 ± 427.02 | 8.59 ± 0.83 | 1392.21 ± 729.6 |
| עורק אבי העורקים | 9.33 ± 1.5 | 325.89 ± 176.15 | 8.48 ± 1.26 | 417.16 ± 379.95 |
| וריד קאווה | 5.73 ± 2.3 | 145.5 ± 40.89 | 8.92 ± 3.97 | 264.69 ± 188.72 |
טבלה 3: מאפייני רקמות של דגימות לא שמורות ומשומרות של מבנים אנטומיים. *SD: סטיית תקן.
Discussion
באופן מסורתי, מחקרים אנטומיים הסתמכו על גופות אנושיות; עם זאת, אתגרים ברכישת דגימות אלה הובילו לחקר שיטות חלופיות. מודלים ביולוגיים של חזירים הוכיחו את עצמם ככלים בעלי ערך לחקר האנטומיה האנושית, ומציעים קווי דמיון אנטומיים המאפשרים למידה ואקסטרפולציה שלה ליישומים רפואיים בבני אדם 12,13,14,15. למרות שטכניקות שימור גופות תוארו באופן מסורתי באופן איכותי, מדידת החוזק והגמישות של רקמות משומרות באמצעות מודול יאנג יכולה לספק ראיות כמותיות למידת השימור. החיפוש אחר גישות חדשניות בשימור רקמות ביולוגיות עונה על הצורך להקל על חקר המורכבות האנטומית במודלים מציאותיים. לכן, הפרוטוקול לשימור מודלים ביולוגיים של חזירים שפותח ומשמש במעבדת האנטומיה של אוניברסיטת Icesi מוצג כחלופה בת קיימא לשימור רקמות ולמחקר אנטומי לאחר מכן.
בהתבסס על ניסיון, התקרבות למחזור הדגימה דרך אבי העורקים הבטני במודלים ביולוגיים של חזירים היא אלטרנטיבה יעילה יותר בהשוואה לקנולציה של עורקי הירך, המבוצעת בדרך כלל בגופות אנושיות16. האופי השברירי של דפנות עורקי הירך החזיריים גרם להעדפה לגישה הבטנית, מכיוון שקירות אלה רגישים להיקרע מהלחץ שמפעילה משאבת הזילוף. הבטחת נקודת כניסה בת קיימא היא קריטית, שכן שלב המילוי בפרוטוקול הוא קריטי לשימור הולם של הדגימה כולה. מילוי לא אופטימלי מהווה סיכון גבוה לפירוק. לכן, יש להעריך סימני השלמה מוצלחים לפני שתמשיך בפרוטוקול. סימנים אלה כוללים הרחבה של הגפיים העליונות והתחתונות, שפע צוואר הרחם ובית החזה, ונגר של התמיסה דרך הנחיריים עקב זלוף תמיסת השימור. אתגר נפוץ שעלול להתעורר במהלך ביצוע פרוטוקול זה הוא קרע של עורק אבי העורקים במהלך עירוי תמיסת השימור. במקרים כאלה, רצוי לקשור את העורק ולהמשיך בדיסקציה של קטע עליון כדי להקל על קנולציה משנית ולחדש את שלב המילוי. בנוסף, אם מופיעים סימני ריקבון בשלב כלשהו במהלך הפרוטוקול, יש להשליך את הדגימה כולה.
התמיסה המשמרת המשמשת בפרוטוקול זה כוללת וריאציות בהשוואה לתמיסה הצ'יליאנית הקונבנציונלית, כגון היעדר נתרן כלורי, עלייה בריכוז האתנול מ-24% ל-30%, עלייה בריכוז הגליצרין מ-16% ל-20%, ירידה בריכוז הפורמלדהיד מ-3.7% ל-2%, והחלפת תמצית האקליפטוס בתמצית קפה17.
תהליך הדפורמוליזציה הוא שלב מכריע נוסף בפרוטוקול, שכן דפורמוליזציה נכונה מפחיתה את חשיפת כוח האדם לפורמלדהיד, כולל מורים, מעבדות ותלמידים. בנוסף, תהליך הריכוך עם גליצרין חיוני להשגת מרקם דומה לזה של רקמות טריות. שימור קונבנציונלי עם 10% פורמלדהיד גורם לרקמות נוקשות שמאבדות מגמישות והופכות מועדות יותר לקריעה במהלך הטיפול. עם זאת, שימוש בתמיסה הצ'יליאנית המותאמת עם ריכוז פורמלדהיד מופחת של 2%, ואחריו דפורמוליזציה וריכוך עם גליצרין, מקל על בעיה זו.
בעקבות פרוטוקול זה, הושגה רמה גבוהה של גמישות במניפולציה, בעוד שאיברים מוצקים, כמו הכבד, הפגינו עקביות שלמרות שהיא יציבה, אפשרה דיסקציה וזיהוי של המבנה שלהם. עם זאת, יש צורך במחקרים כמותיים נוספים כדי להשוות את איכות השימור של רקמות על פני טכניקות שימור שונות.
יש לקחת בחשבון מספר מגבלות פוטנציאליות בעת ביצוע פרוטוקול זה. ראשית, יש להקדיש תשומת לב קפדנית לגודל הדגימה, עם טווח מומלץ של 15-20 ק"ג. בעלי חיים גדולים יותר עשויים להוות אתגרים בביצוע פרוטוקול השימור ובניהול סילוק המודל. שנית, המעבדה הייעודית צריכה להיות מצוידת במערכת שאיבת אדים מתאימה ובמלכודת פסולת במערכת הביוב. אמצעי זהירות זה נועד להפחית את חשיפת הצוות הטכני לאדים אורגניים ולמזער את הזיהום הסביבתי הנובע משאריות הנוצרות בתהליך השימור. שלישית, יש להכיר בנוכחות הפוטנציאלית של וריאנטים אנטומיים בביומודלים. בנוסף, בעוד שדגימות חזיר חולקות קווי דמיון אנטומיים עם בני אדם, הן גם מציגות הבדלים. לכן, יש צורך בבחינה מדוקדקת של וריאציות כאלה במחקרים אנטומיים השוואתיים.
הערכת התכונות האורגנולפטיות של רקמות ניגשה באופן מסורתי באופן איכותי, תוך התמקדות במאפיינים כמו ריח, צבע, נוקשות, שבירות וקלות טיפול18. עם זאת, קיים מחסור ניכר במחקרים שמטרתם לקבוע פרמטרים אלה באופן אובייקטיבי. דוגמה אחת היא עבודתו של HP Theeuwes, שהשוותה את הניידות של מפרקי הגפיים העליונות בגופות שנשמרו עם 11% פורמלין, רקמה טרייה, ושיטה שונה ששיתקה את המפרקים כדי למדוד את הכוח הנדרש לכיפוף5. בהקשר זה, צוות המחקר מפתח שיטות להערכה אובייקטיבית של התכונות המכניות של רקמות, המבקשות להתגבר על מגבלות ההערכות האיכותיות הקיימות.
מבחינת שימור גופות, למרות שפורמלין הוא החומר הנפוץ ביותר, נעשה שימוש מוצלח גם במספר חומרים חלופיים. חומרים אלה כוללים גלוטראלדהיד, מונואתילן גליקול, דיאתילן גליקול, תמיסות אתנול-גליצרין ומלחים רוויים. מגוון שיטות השימור משקף את החיפוש המתמשך אחר אופטימיזציה של שימור רקמות למטרות מחקר רפואי, חינוך או תערוכה 3,19. התקדמות זו מדגישה את חשיבות המחקר בפיתוח טכניקות שימור יעילות יותר לשמירה על התכונות המבניות והתפקודיות של רקמות אנושיות בצורה אופטימלית לתקופות ממושכות.
עבור יישומים עתידיים, הרמה הגבוהה שנצפתה של שימור רקמות עם פרוטוקול זה טומנת בחובה הבטחה משמעותית לקידום המחקר והחינוך האנטומי. הפוטנציאל של שיטה זו משתרע על מחקרים אנטומיים מתקדמים, המספקים מודלים מציאותיים לאימון כירורגי ותורמים לפיתוח סימולציות רפואיות סוחפות. בנוסף, יכולת ההסתגלות של הפרוטוקול פותחת דרכים לחקירה בדגימות אנטומיות מגוונות, ובכך מרחיבה את התועלת שלו בהקשרים רפואיים ומדעיים שונים.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
הכרת תודה למחלקה למדעי הרפואה הבסיסיים ולמשרד המחקר של אוניברסיטת אייסי על תמיכתם במחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
References
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved