Method Article
Karşılaştırmalı İnsan Anatomisi Çalışması için Domuz Biyomodellerinin Korunması
Bu Makalede
Özet
Bu makale, domuz biyomodellerini korumak için bir protokol sunmaktadır. Önerilen yöntem, azaltılmış formalin konsantrasyonuna sahip modifiye edilmiş bir Şili çözeltisinin kullanılmasını içerir. Koruma işlemi, numunenin hem doldurulması hem de daldırılması yoluyla çözeltinin uygulanmasından, ardından gliserin kullanılarak deformolizasyon ve doku yumuşatılmasından oluşur.
Özet
Tıp eğitiminde insan anatomisi öğretimi, öğrencilerin anatomik karmaşıklığı pratik olarak keşfetmeleri için etkili alternatifler gerektiren zorluklarla karşı karşıyadır. Domuz biyomodelleri, insanlara anatomik benzerlikleri ile umut verici bir çözüm sunuyor. Bu makale, karşılaştırmalı anatomi çalışmalarında erişilebilir ve verimli yöntemlere olan ihtiyacı ele alarak, domuz biyomodellerinin korunması için ayrıntılı bir protokol sunmaktadır. Bu protokol, biyomodel koruması için modifiye edilmiş bir Şili çözümünün kullanılmasını önermekte ve doldurma ve daldırma yoluyla formalinizasyon tekniklerini kullanmaktadır. Daha sonra, formaldehit içermeyen modifiye edilmiş Şili çözeltisi ve ardından bir gliserin yumuşatma işlemi kullanılarak deformalizasyon elde edilir. Koruma teknikleriyle ilgili literatürün azlığı ve doku korumayı değerlendirmek için standart bir prosedür veya testin olmaması göz önüne alındığında, doku kalitesini direnç ve elastikiyet ölçümlerine dayalı olarak değerlendirmeyi öneriyoruz. Bulgularımız, örneklerimizde kalitatif olarak yüksek düzeyde doku korunduğunu göstermektedir. Ayrıca, bu biyomodeller şu anda morfoloji çalışmaları için ve tıp öğrencilerine insan karşılaştırmalı anatomisi öğretiminde başarıyla kullanılmaktadır.
Giriş
Tıp fakültelerinde anatomi öğretimi genellikle diseksiyon için insan vücuduna erişimde zorluklar ve uygun tesislerin olmaması gibi engellerle karşılaşmaktadır. Bu sınırlamalar, öğrencilerin anatomik karmaşıklığı pratik ve gerçekçi bir şekilde keşfetmelerini sağlayan etkili alternatiflere olan ihtiyacın altını çizmektedir. Bu bağlamda, domuz biyomodelleri, anatomik olarak insanlara benzerlikleri nedeniyle umut verici bir alternatif olarak ortaya çıkmış, anatomi öğrenme ve öğretme için erişilebilir ve verimli bir araç sunmaktadır1.
Anatomik koruma teknikleri, hasarı en aza indirirken biyolojik dokuların bütünlüğünü korumayı amaçlar. Bu teknikler hem insan hem de veteriner anatomisi çalışmalarında eğitim, akademik ve araştırma amaçlı kullanılmıştır. Vücutları, organları ve dokuları doğal hallerinde mümkün olduğu kadar uzun süre korumak için çok sayıda madde test edilmiştir2. Bununla birlikte, anatomik örneklerin korunması ve muhafaza edilmesi, özellikle yüksek doku korumasının gerekli olduğu morfolojik çalışmalara yönelik olanlar için zor olmaya devam etmektedir3.
Geleneksel olarak kullanılan çözümler yaygın olarak mevcut olsa da, günlük uygulamadaki sınırlamalar belirgindir. Kullanılan en yaygın maddelerden biri olan formalin, doku koruması için belgelenmiş birkaç dezavantajı vardır. Bunlar arasında tahriş edici kokusu, yüksek toksisitesi, işleyiciler için ilişkili kanser ve mutajenite riskleri ve dokularda indüklediği sertlik ve renk değişikliği gibi organoleptik değişiklikler yer alır. Bu değişiklikler, fiksasyondan sonra incelendiğinde dokuların fizyolojik özelliklerinin algılanmasını değiştirebilir ve potansiyel olarak kesin ve doğru morfolojik çalışmaları engelleyebilir4. Çalışmalar, yüksek konsantrasyonlarda formalin ile fiksasyonun daha yüksek derecede doku sertliği ile sonuçlandığını göstermiştir5. Thiel mumyalama tekniği gibi alternatifler, orijinal renklenmenin ve dokuların esnekliğinin daha iyi korunması ile umut verici sonuçlar göstermiştir6. Ancak bu teknik diğer çözümlere göre daha maliyetlidir7. Bu zorluklar, hala yüksek kaliteli anatomi öğretimini mümkün kılan yeni, uygun fiyatlı koruma tekniklerini tasarlama ve test etme fırsatı sunmaktadır.
Bu protokolün amacı, Kolombiya'nın Cali kentindeki Universidad Icesi'nin Anatomi Laboratuvarı'nda, insan anatomisinin karşılaştırmalı çalışması için eğitim araçları olarak kullanılan domuz biyomodellerinin korunması için kullanılan metodolojiyi tanımlamaktır.
Protokol
Açıklanan teknik, 1989 tarihli 84 sayılı Kanun ve 847 sayılı Rektör Kararı (9 Temmuz 2012) uyarınca, Universidad Icesi Deneyde Hayvanların Bakımı ve Kullanımı için Kurumsal Etik Komitesi'nin (CIECUAE) yönergelerine tam olarak uygun olarak geliştirilmiştir. Bu, hem bilimsel bütünlüğü hem de kullanılan hayvanların refahını sağlayarak acılarını en aza indirir. Bu çalışma için 3 aylık ve 15-20 kg ağırlığındaki erkek Landrace domuzları kullanıldı. Gerekli reaktifler ve ekipman Malzeme Tablosunda listelenmiştir.
1. Domuz biyomodeli
- Hayvanın kurban edilmesi
- Genel bir veteriner değerlendirmesi yapın ve seçilen domuz örneğini 24 saat karantinaya alın. Hayvan bu süre zarfında herhangi bir semptom göstermezse, ötenazi ile devam edin.
- Anestezi
- Anesteziyi sırasıyla 10 mg / kg, 0.5 mg / kg ve 0.04 mg / kg dozlarında Ketamin + Ksilazin + Atropin kullanarak intramüsküler olarak uygulayın (kurumsal olarak onaylanmış protokolleri izleyerek).
NOT: Derin anestezi sağlayın. Fizik muayene ile anestezi derinliğini değerlendirin. Derin anestezi, genişlemiş ve merkezlenmiş bir göz bebeği, palpebral refleksin olmaması, kornea refleksinin depresyonu ve solunum hızının, kalp hızının ve kan basıncının azalması ile gösterilir.
- Anesteziyi sırasıyla 10 mg / kg, 0.5 mg / kg ve 0.04 mg / kg dozlarında Ketamin + Ksilazin + Atropin kullanarak intramüsküler olarak uygulayın (kurumsal olarak onaylanmış protokolleri izleyerek).
- Ötanazi
- İntravenöz olarak 5 mL Sodyum Pentobarbital / Difenilhidantoin (390/50 mg / mL) uygulayın. Ötenazi ajanını uyguladıktan sonra, Suis Scrofa türleri için hayvanın fizyolojik parametrelerini oskültasyon: HR, 60-90; FR, 8-18; ve T° 37-39°C8.
- Kalp atış hızını yavaş yavaş azalana ve tamamen durana kadar izleyin. Sfinkter gevşemesi, siyanotik membranlar ve vücut uyaranlarına yanıt vermeme gibi ani değişiklikleri gözlemleyin. Kalp atışı tespit etmeden 5 dakikalık kardiyak oskültasyondan sonra ötenaziyi tamamlayın.
- Depolama ve nakliye
- Ayrışmayı ve mikrobiyal çoğalmayı önlemek için domuz biyomodelini ötenaziden sonraki yarım saat içinde prosedür odasından anatomi laboratuvarına taşıyın, böylece biyomodelin korunmasını optimize edin.
2. Şili çözeltisine dayalı koruyucu çözelti
- Modifiye edilmiş Şili çözeltisinin hazırlanması
- Etanol, Gliserin, Formaldehit, Benzalkonyum Klorür, kahve aromatik özü ve damıtılmış su içeren modifiye edilmiş bir Şili çözeltisi kullanın. Çözeltinin pH'ının 7.0 olduğundan emin olun.
- Koruyucu solüsyonu 50 L'lik bir tankta hazırlayın. İlk olarak, tanka 10,6 L damıtılmış su ekleyin. Daha sonra 7,6 L %96 etanol, 5 L gliserin, 0,5 L %50 benzalkonyum klorür ve 0,1 L kahve aromatik özü ekleyin.
NOT: 1 L modifiye edilmiş Şili çözeltisi hazırlamak için gereken her bir bileşenin gerekli konsantrasyonları ve hacimleri için Tablo 25'e bakın.
3. Modifiye edilmiş Şili koruyucu çözeltisinin uygulanması
NOT: Koruyucu çözelti hazırlandıktan sonra, doldurma ve daldırma yoluyla uygulayın.
- Modifiye edilmiş Şili koruyucu çözeltisinin doldurulmasıyla uygulama
NOT: Bu prosedür için biyogüvenlik giysisi kullanın: A1P2 filtreli yeniden kullanılabilir bir yarım maske, biyogüvenlik gözlükleri, uzun kollu tek kullanımlık cerrahi önlük, cerrahi başlık, tozluk ve nitril eldivenler.- Cerrahi yaklaşım
- Ksifoid işleminden kasık bölgesine kadar linea alba boyunca (bir neşter sapı 4, bıçak 22 kullanarak) bir kesi yapın.
- Rektus abdominis kasının deri altı hücresel dokusunu ve kas liflerini tanımlayın.
NOT: Kesi anında, deri altı hücresel doku olarak bilinen cilde yapışan yetersiz yağ dokusunu ve daha derinde bulunan rektus abdominis kasının kas liflerini tanımlayın9. - Peritona erişmek için dikkatlice kesin, karaciğer ve bağırsaklara zarar vermeden karın boşluğuna açılmasını sağlayın, bu da hemen açığa çıkacaktır.
- Bağırsak halkalarını karın boşluğunun sağ tarafına geri çekin. Sol böbrek ve böbrek damarlarının üzerindeki parietal peritonu tanımlayın. Abdominal aortu bulmak için bu vasküler yapıları kullanın.
- Sol renal pedikülün ortaya çıkışını bulun. Aortu kaplayan karın zarını renal arterin 5 cm yukarısından çıkarın.
- Sol renal pedikülü açığa çıkardıktan sonra, bağırsak halkalarını harekete geçirin ve hilumu kaplayan peritonu kesin. Önce daha büyük ve önde bulunan renal veni tanımlamak için anteroposterior olarak diseksiyon yapın.
- Renal arterior olarak, yörüngesini abdominal aorttaki kökenine kadar takip ederek posterior olarak yerleştirin. Son olarak, hilum9'un en arka yapısı olan renal pelvisi tanımlayın.
- Aortun arka kısmını dikkatlice inceleyin. Aortu renal arter seviyesinin üzerinde bir düğüm ve 5 cm yukarıda başka bir düğüm ile bağlamak için 0/0 ipek kullanın.
- İzole aort segmentinin her iki ucunda iki Kelly klempi ile aortu hemen klempleyin.
- Aort duvarını Metzembaum makasının ucuyla kesin, aort damarının ön duvarında yaklaşık 0,3 cm'lik bir kesi yapın, delmemesine dikkat edin.
- Arteriyel lümene 3,2 mm künt L şeklinde bir iğne sokmak için Kelly kelepçesini çıkarırken distal ucu düğümleyin. Proksimal Kelly kelepçesini çıkarın ve modifiye edilmiş Şili koruma solüsyonunun perfüzyonunu başlatın.
- Modifiye edilmiş Şili koruma solüsyonunun aort perfüzyonu
- Modifiye edilmiş Şili koruma çözeltisinin perfüzyonu ile devam edin.
NOT: Bir perfüzyon pompası kullanarak 0.25 pound'luk bir basınçla 10 L / kg uygulayın. - Perfüzyonun sonu
- Koruyucu solüsyonun perfüzyonu tamamlandıktan sonra, perfüzyon kanülünü çıkarın ve koruyucu solüsyonun geri akışını önlemek için yerleştirme bölgesini 0/0 ipek ile düğümleyin. Linea alba'daki kesiyi 0/0 ipek ile dikerek karnı kapatın.
NOT: Yeterli perfüzyonun sağlanıp sağlanmadığını değerlendirmek için, akut doygunluk göstergelerini kontrol edin: üst ve alt ekstremitelerin uzaması, servikal ve torasik plethora ve solüsyonun burun deliklerinden akması. Yaklaşık perfüzyon süresi 2 saattir.
- Koruyucu solüsyonun perfüzyonu tamamlandıktan sonra, perfüzyon kanülünü çıkarın ve koruyucu solüsyonun geri akışını önlemek için yerleştirme bölgesini 0/0 ipek ile düğümleyin. Linea alba'daki kesiyi 0/0 ipek ile dikerek karnı kapatın.
- Cerrahi yaklaşım
- Daldırma ile yönetim
NOT: Bu prosedür için biyogüvenlik giysisi kullanın: A1P2 filtreli yeniden kullanılabilir bir yarım maske, biyogüvenlik gözlükleri, uzun kollu tek kullanımlık cerrahi önlük, cerrahi başlık, tozluk ve nitril eldivenler.- Modifiye edilmiş Şili koruma çözeltisinin daldırılmasıyla uygulama
- Domuz örneğini, 2. adımda açıklanan aynı koruyucu solüsyonla doldurulmuş 300 L'lik bir tankta saklayın.
NOT: Biyomodelin yaklaşık 150 L çözelti kullanılarak tamamen daldırıldığından emin olun. Daldırdıktan sonra biyomodeli 6 ay boyunca 20 °C'de saklayın. Yeterli korumanın göstergeleri arasında ayrışma belirtilerinin olmaması yer alır (ör., vücut ödemi, şişme, kötü koku, canlılık ve dokuların gevrekliği).
- Domuz örneğini, 2. adımda açıklanan aynı koruyucu solüsyonla doldurulmuş 300 L'lik bir tankta saklayın.
- Modifiye edilmiş Şili koruma çözeltisinin daldırılmasıyla uygulama
4. Şili çözeltisine dayalı deformolizasyon çözümü
- Deformolizasyon çözeltisinin hazırlanması
- Etanol, Gliserin, Benzalkonyum Klorür, kahve aromatik özü ve damıtılmış su içeren modifiye edilmiş bir Şili çözeltisi kullanın. Çözeltinin pH'ının 7.0 olduğundan emin olun.
- Deformolizasyon solüsyonunu 50 L'lik bir tankta hazırlayın. Önce 11,1 L damıtılmış su, ardından 7,8 L %96 etanol, 5 L gliserin, 1 L %50 benzalkonyum klorür ve 0,1 L kahve aromatik özü ekleyin.
NOT: 2 L formaldehit içermeyen modifiye Şili çözeltisi hazırlamak için gereken her bir bileşenin gerekli konsantrasyonları ve hacimleri için Tablo 25'ye bakın.
5. Deformolizasyon
NOT: Bu prosedür için biyogüvenlik giysisi kullanın: A1P2 filtreli yeniden kullanılabilir bir yarım maske, biyogüvenlik gözlükleri, uzun kollu tek kullanımlık cerrahi önlük, cerrahi başlık, tozluk ve nitril eldivenler.
- Formaldehit içermeyen modifiye edilmiş Şili koruma çözeltisinin daldırılarak uygulanması
- 6 aylık daldırma koruma süresinin sonunda, biyomodeli formaldehit içermeyen modifiye Şili koruma solüsyonu ile doldurulmuş 300 L'lik bir tanka aktarın. Biyomodeli 4 hafta boyunca saklayın.
NOT: Biyomodelin yaklaşık 150 L çözelti kullanılarak tamamen daldırıldığından emin olun.
- 6 aylık daldırma koruma süresinin sonunda, biyomodeli formaldehit içermeyen modifiye Şili koruma solüsyonu ile doldurulmuş 300 L'lik bir tanka aktarın. Biyomodeli 4 hafta boyunca saklayın.
6. Gliserin yumuşatma
- Deformolizasyon işleminden hemen sonra, biyomodeli suda seyreltilmiş artan konsantrasyonlarda gliserin içeren çözeltilere daldırın: %50, %70 ve %90 gliserin. Biyomodeli bir hafta boyunca her konsantrasyonda tutun.
Sonuçlar
Bu protokolün amacı, karşılaştırmalı insan anatomisi öğretimi için domuz biyomodellerinin korunmasına izin veren etkili ve uygulanabilir bir teknik sunmaktır. Şu anda model korumasını değerlendirmek için standartlaştırılmış yöntemler veya testler bulunmamaktadır. Bu nedenle, modelin genel korunması, numuneler üzerinde protokol tamamlandıktan sonra çözelti tamamlama göstergeleri ve ayrışma belirtileri kullanılarak değerlendirildi. Ayrıca, biyomodellerin öğretim ve araştırma için uygulanabilirliğini objektif olarak değerlendirmek için, koruma öncesi ve sonrası direnç ve elastikiyet gibi seçilen anatomik yapıların doku özelliklerinin karşılaştırılması planlanmıştır. Seçilen anatomik yapılar vagus siniri, aort arteri ve kava veni idi. Bu yapılar seçilmiştir çünkü sinirler, arterler ve damarlar kaba anatomi öğretimi ve öğreniminde temeldir. Sonuç olarak, 4 vagus siniri, 4 aort arteri ve 3 kava veni taze, korunmamış örneklerden izole edildi.
Buna göre, sunulan protokol kullanılarak, 12 domuz örneğinin cesetleri korunmuştur. Korunmuş domuz biyomodelleri, ön ayakların uzaması, kan ve burun deliklerinden dışarı akan koruyucu solüsyon (Şekil 1), ödem ve torasik ve servikal çevrede artış (Şekil 2 ve Şekil 3) gibi dolgunluk göstergeleri kullanılarak koruma yeterliliği açısından değerlendirildi.). Tüm biyomodeller başarılı bir tamamlanma göstergesi sergiledi. Protokolü tamamladıktan sonra, biyomodellerin hiçbiri bağırsak döngülerinin şişmesi, kötü koku veya doku gevrekliği gibi ayrışma ile ilişkili değişiklikler göstermedi.
Biyomodellerin incelenmesinden sonra, bu tekniğin dokuları manipülasyon ve diseksiyon için başarılı bir şekilde koruduğu açıktı. Örnekler arasında kaslar ve aponevrozları (Şekil 6), periton (Şekil 7) ve mide ve bağırsaklar (Şekil 8) bulunur. Bu, tüm bu organların manipülasyon sırasında yüksek esnekliği koruduğu için öznel olarak değerlendirildi. Karaciğerin kıvamı, sağlam olmasına rağmen, diseksiyon sonrası intrahepatik kanalların tanımlanmasına ve bunlarla ilişkili vaskülarizasyona izin verdi (Şekil 9 ve Şekil 10).
Ancak, sonuçlar her zaman bu kadar umut verici değildi. Protokolün geliştirilmesinden önce, biyomodellerin mantar kolonizasyonu sık görülen bir sorundu. Bu muhtemelen, koruyucu çözeltinin daldırılmasıyla doldurma ve uygulama için standartlaştırılmamış bir tekniğin kullanılmasına atfedilebilirdi. Şekil 6 , kolonizasyondan etkilenen bir biyomodeli göstermektedir.
Ek olarak, dokuların korunmasını objektif olarak değerlendirmek için, hem korunmamış hem de korunmuş yapılarda ilgilenilen spesifik özellikler ölçülmüştür. Dört vagus siniri, dört aort arteri ve üç kava veni korunmuş biyomodellerden izole edildi. Ölçülen özellikler, dokunun direnci (yapıyı yırtmak için gereken Newton olarak ölçülür) ve dokunun esnekliği (Young modülü kullanılarak ölçülür) idi.10,11. Sonuçlar Tablo 3'te ortalama ± standart sapma (SD) olarak sunulmuştur.
Bu yapıların cerrahi olarak çıkarılması ve elastikiyetlerinin ve dirençlerinin değerlendirilmesi, tüm biyomodelin koruma derecesinin ve orijinal mekanik özelliklerini ne kadar iyi koruduğunun nicel bir yaklaşımını sağlamak için gerçekleştirildi. Bu spesifik anatomik yapıların seçimi, vasküler ve sinirsel yapıların diseksiyon sırasında öğretmenler ve öğrenciler tarafından en sık manipüle edildiği ve bu nedenle daha büyük bir yırtılma riski oluşturduğu gerçeğine dayanıyordu.
Hayvan biyolojik dokularının mekanik özelliklerini değerlendirmek için, numunenin iki kelepçe arasında asılmasını içeren, bir ucu bir kuvvet dönüştürücüsüne bağlı ve diğer ucu sabit bir su akışı yoluyla artan bir yüke maruz kalan bir yöntem tasarlanmıştır. Uygulanan kuvvet, suyun yoğunluğu ve yerçekimi dikkate alınarak hesaplanırken, numunenin uzaması artan yük ile ölçülmüştür. Bu ölçümler, doku sertliğini temsil eden Young modülünün belirlenmesinin yanı sıra, dokunun yırtılmadan önce yüklere dayanma kabiliyetini yansıtan belirli bir kuvvetin uygulanmasına karşı maksimum direncin tanımlanmasını kolaylaştırdı. Bu yöntem, mekanik davranışlarını anlamak için temel olan biyolojik dokuların elastik ve mukavemet özelliklerinin doğru bir değerlendirmesini sağlar.
Korunmuş vagus sinirleri, korunmamış örneklere kıyasla direnç ve elastikiyette önemli bir artış göstermiştir. Beklentilerin aksine, korunmuş aort arteri, korunmamış örneklere kıyasla biraz daha düşük direnç sergiledi, ancak elastikiyette orta derecede bir artış gösterdi. Kava veninin korunması, hem direnç hem de elastikiyette kayda değer bir artışa neden oldu. Bu bulgular, koruma sürecinin, değerlendirilen dokuların mekanik özellikleri üzerinde fark edilebilir bir etkiye sahip olduğunu ve bu korunmuş dokuların anatomik çalışmalarda uygulanması için değerli bilgiler sağladığını göstermektedir.
Bu protokolü geliştiren morfoloji araştırma ekibi, domuz biyomodellerinin korunmasında geniş deneyime sahiptir. % 10 formalin ile koruma gibi daha önce kullanılan geleneksel tekniklerin modifikasyonları ve optimizasyonu nedeniyle dokuların organoleptik özellikleri açısından koruma sonuçlarında kalitatif bir iyileşme gözlenmiştir. Korunmuş biyomodeller şu anda Universidad Icesi'de morfoloji çalışmaları ve tıp öğrencileri için insan karşılaştırmalı anatomi öğretimi için başarıyla kullanılmaktadır. Laboratuvarda en uzun kullanım ömrüne sahip model, yeni daldırmalar veya ek işlemler gerektirmeden oda sıcaklığında 7 yıla ulaşmıştır. Öğretim deneyimi, öğrenciler tarafından yüksek düzeyde manipülasyona rağmen, biyomodellerin korunduktan sonra 4 yıla kadar anatomik yapıların bütünlüğünü koruduğunu göstermiştir.

Şekil 1: Burun deliklerinden kan ve koruyucu solüsyon çıkışı. (A) Perfüzyondan önce çıkış. (B) Perfüzyon sırasında çıkış. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Koruyucu solüsyon perfüzyonu öncesi ve sonrası torasik çevre. (A) Perfüzyon öncesi torasik çevre. (B) Perfüzyon sonrası torasik çevre. Göğüs çevresinde 4 cm'lik bir artış gözlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
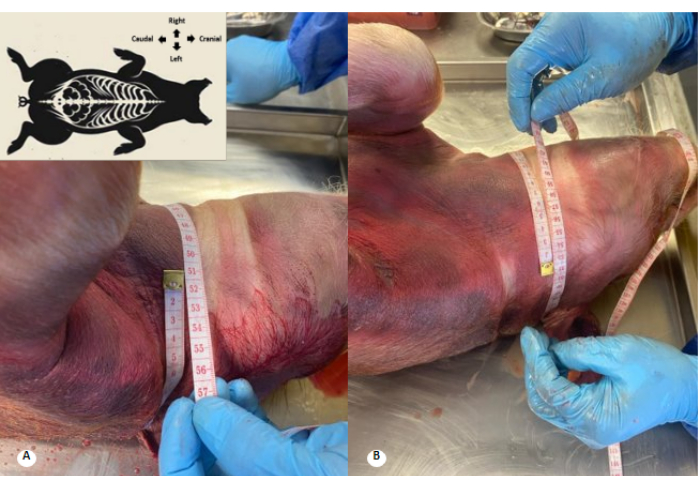
Şekil 3: Koruyucu solüsyon perfüzyonu öncesi ve sonrası servikal çevre. (A) Perfüzyondan önce servikal çevre. (B) Perfüzyondan sonra servikal çevre. Servikal perimetrede 1 cm'lik bir artış ve servikal kıvrımların silinmesi gözlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
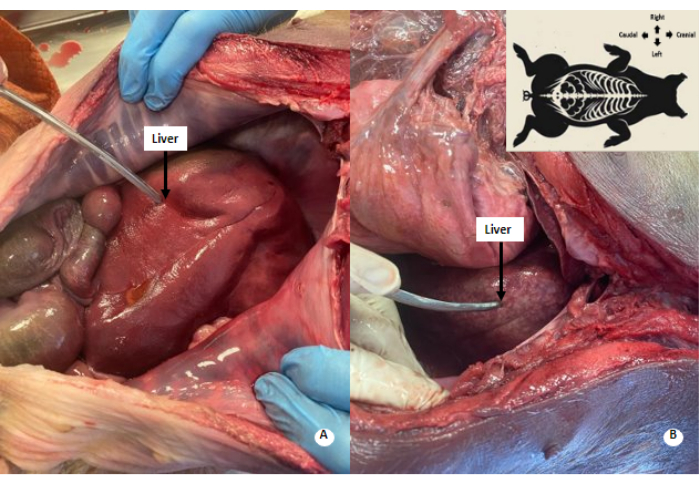
Şekil 4: Karaciğerde beyazımsı benekli desen. (A) Perfüzyondan önce karaciğer. (B) Perfüzyon sonrası karaciğer. Perfüze karaciğerde beyazımsı benekli bir desen gözlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Bağırsak döngülerinin solukluğu. (A) Perfüzyondan önce ince bağırsak. (B) Perfüzyondan sonra ince bağırsak. Bağırsak döngülerinin solukluğu gözlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Mantar tarafından kolonize edilen biyomodel. İnferior kava venin ventral traksiyonu mantar kolonizasyonunu gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: Transversus abdominis kası ve aponevrozu. (1) Transversus abdominis kası. (2) Transversus abdominis kasının aponevrozu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

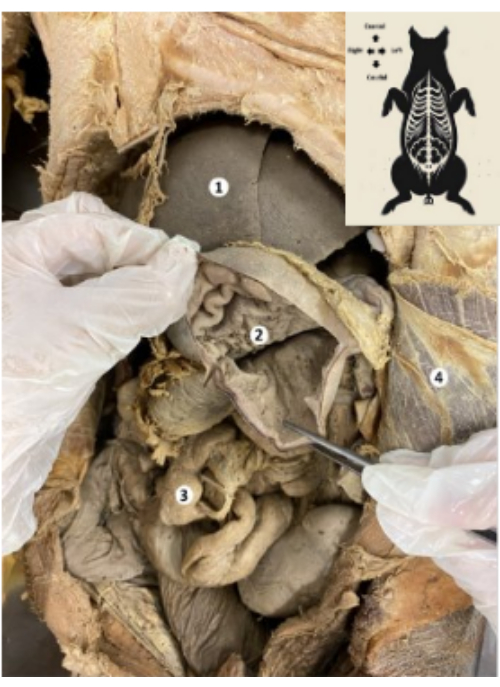
Şekil 8: Korunmuş domuz biyomodelinin parietal peritonu. (1) Parietal periton. (2) Seksiyonel karaciğerin sol lobu. (3) Mide. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 9: Korunmuş domuz biyomodelinin midesi. (1) Karaciğer. (2) Mide mukozası. (3) Bağırsaklar. (4) Transvers abdominis kası ve parietal periton. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
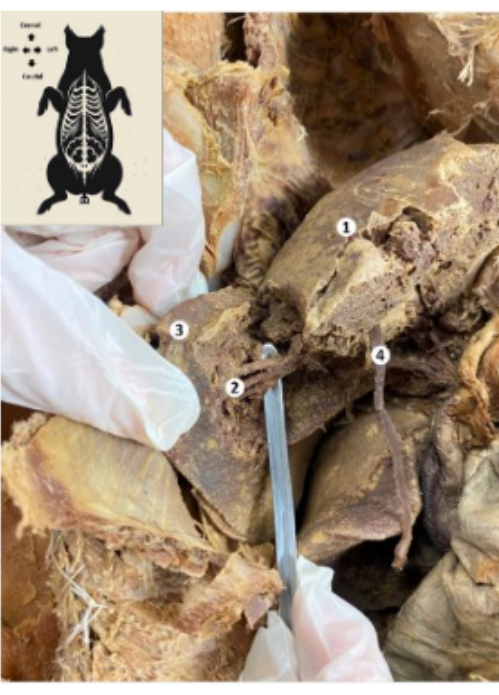
Şekil 10: Korunmuş domuz biyomodelinin karaciğeri. (1) Karaciğerin diyafragma yüzü. (2) Karaciğerin alt arka segmenti (hepatik arter, safra kanalı, portal venin alt arka dalı). (3) Karaciğerin sağ lobu. (4) Karaciğer yuvarlak ligament. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Tepkisel | Son konsantrasyon | Miktar | Son cilt |
| Etanol %96 | 30% | 7,8 L | 25 L |
| Gliserin | 20% | 5 litre | |
| Formaldehit %40 | 2% | 0,5 L | |
| Benzalkonyum Klorür %50 | 2% | 1 L | |
| Aromatik esans (Kahve) | 0.40% | 0,1 L | |
| Damıtılmış su | NA | 10,6 L |
Tablo 1: Modifiye edilmiş bir Şili çözeltisine dayalı koruyucu çözelti.
| Tepkisel | Son konsantrasyon | Miktar | Son cilt |
| Etanol %96 | 30% | 7,8 L | 25 L |
| Gliserin | 20% | 5 litre | |
| Benzalkonyum Klorür %50 | 2% | 1 L | |
| Aromatik esans (Kahve) | 0.40% | 0,1 L | |
| Damıtılmış su | NA | 11,1 L |
Tablo 2: Modifiye edilmiş bir Şili çözeltisine dayalı formaldehit içermeyen koruyucu çözelti.
| Doku | Korunmamış | Korunmuş | ||
| Newton ± SD* | Genç Modülü ± SD* | Newton ± SD* | Genç Modülü ± SD* | |
| Vagus siniri | 4,92 ± 0,98 | 879,5 ± 427,02 | 8,59 ± 0,83 | 1392,21 ± 729,6 |
| Aort arteri | 9,33 ± 1,5 | 325,89 ± 176,15 | 8,48 ± 1,26 | 417,16 ± 379,95 |
| Kava damarı | 5,73 ± 2,3 | 145,5 ± 40,89 | 8,92 ± 3,97 | 264,69 ± 188,72 |
Tablo 3: Anatomik yapıların korunmamış ve korunmuş örneklerinin doku özellikleri. *SD: Standart sapma.
Tartışmalar
Geleneksel olarak, anatomik çalışmalar insan kadavralarına dayanıyordu; Bununla birlikte, bu örneklerin elde edilmesindeki zorluklar, alternatif yöntemlerin araştırılmasına yol açmıştır. Domuz biyomodellerinin insan anatomisini incelemek için değerli araçlar olduğu kanıtlanmıştır ve öğrenmeyi ve insanlardaki tıbbi uygulamalara ekstrapolasyonunu kolaylaştıran anatomik benzerlikler sunar 12,13,14,15. Kadavra koruma teknikleri geleneksel olarak kalitatif olarak tanımlanmış olsa da, Young modülünü kullanarak korunmuş dokuların gücünü ve elastikiyetini ölçmek, koruma derecesinin nicel kanıtını sağlayabilir. Biyolojik doku korumada yenilikçi yaklaşımlar arayışı, gerçekçi modellerde anatomik karmaşıklığın araştırılmasını kolaylaştırma ihtiyacına cevap vermektedir. Bu nedenle, Universidad Icesi Anatomi Laboratuvarı'nda geliştirilen ve kullanılan domuz biyomodellerinin korunmasına yönelik protokol, doku koruma ve müteakip anatomik çalışma için uygun bir alternatif olarak sunulmaktadır.
Deneyime dayanarak, domuz biyomodellerinde abdominal aort yoluyla örnek dolaşımına yaklaşmak, insan kadavralarında yaygın olarak gerçekleştirilen femoral arteriyel kanülasyona kıyasla daha etkili bir alternatiftir16. Domuz femoral arter duvarlarının kırılgan doğası, bu duvarlar perfüzyon pompasının uyguladığı basınçtan yırtılmaya duyarlı olduğundan, abdominal yaklaşımın tercih edilmesine neden olmuştur. Protokoldeki tamamlama adımı, tüm numunenin yeterli şekilde korunması için kritik öneme sahip olduğundan, uygun bir giriş noktasının güvence altına alınması çok önemlidir. Optimal olmayan dolgunluk, yüksek ayrışma riski oluşturur. Bu nedenle, protokole devam etmeden önce başarılı tamamlama işaretleri değerlendirilmelidir. Bu belirtiler arasında üst ve alt ekstremitelerin uzaması, servikal ve torasik bolluk ve koruyucu solüsyonun perfüzyonu nedeniyle solüsyonun burun deliklerinden akması yer alır. Bu protokolün uygulanması sırasında ortaya çıkabilecek yaygın bir zorluk, koruyucu solüsyonun infüzyonu sırasında aort arterinin yırtılmasıdır. Bu gibi durumlarda, ikincil kanülasyonu kolaylaştırmak ve tamamlama adımına devam etmek için arterin bağlanması ve üst segmentin diseksiyonuna devam edilmesi tavsiye edilir. Ek olarak, protokol sırasında herhangi bir noktada ayrışma belirtileri ortaya çıkarsa, numunenin tamamı atılmalıdır.
Bu protokolde kullanılan koruyucu çözelti, sodyum klorür yokluğu, etanol konsantrasyonunda %24'ten %30'a bir artış, gliserin konsantrasyonunda %16'dan %20'ye bir artış, formaldehit konsantrasyonunda %3.7'den %2'ye bir azalma ve okaliptüs özünün kahve özü17 ile değiştirilmesi gibi geleneksel Şili çözeltisine kıyasla varyasyonlar içerir.
Deformolizasyon işlemi, protokoldeki bir diğer önemli adımdır, çünkü uygun deformolizasyon, öğretmenler, laborantlar ve öğrenciler dahil olmak üzere personelin formaldehite maruz kalmasını azaltır. Ek olarak, gliserinle yumuşatma işlemi, taze dokularınkine benzer bir doku elde etmek için gereklidir. %10 formaldehit ile geleneksel koruma, elastikiyetini kaybeden ve kullanım sırasında yırtılmaya daha yatkın hale gelen sert dokulara neden olur. Bununla birlikte, %2'lik bir formaldehit konsantrasyonuna indirgenmiş modifiye edilmiş Şili çözeltisinin kullanılması, ardından deformolizasyon ve gliserinle yumuşatma bu sorunu hafifletir.
Bu protokolü takiben, manipülasyon üzerine yüksek derecede esneklik elde edilirken, karaciğer gibi katı organlar, sağlam olmasına rağmen, yapılarının diseksiyonuna ve tanımlanmasına izin veren bir tutarlılık sergiledi. Bununla birlikte, dokuların koruma kalitesini farklı koruma teknikleri arasında karşılaştırmak için daha fazla kantitatif çalışmaya ihtiyaç vardır.
Bu protokol yürütülürken birkaç olası sınırlama göz önünde bulundurulmalıdır. İlk olarak, önerilen 15-20 kg aralığında numunenin boyutuna titiz bir şekilde dikkat edilmelidir. Daha büyük hayvanlar, koruma protokolünün uygulanmasında ve biyomodelin elden çıkarılmasının yönetilmesinde zorluklar ortaya çıkarabilir. İkinci olarak, belirlenen laboratuvar uygun bir buhar ekstraksiyon sistemi ve kanalizasyon sisteminde bir atık tutucu ile donatılmalıdır. Bu önlem, teknik personelin organik buharlara maruz kalmasını azaltmayı ve koruma işlemi sırasında üretilen kalıntılardan kaynaklanan çevresel kirlenmeyi en aza indirmeyi amaçlamaktadır. Üçüncü olarak, biyomodellerde anatomik varyantların potansiyel varlığı kabul edilmelidir. Ek olarak, domuz örnekleri insanlarla anatomik benzerlikler paylaşırken, aynı zamanda farklılıklar da sergilerler. Bu nedenle, karşılaştırmalı anatomik çalışmalarda bu tür varyasyonların dikkatli bir şekilde değerlendirilmesi gerekmektedir.
Dokuların organoleptik özelliklerinin değerlendirilmesine geleneksel olarak koku, renk, sertlik, kırılganlık ve kullanım kolaylığı gibi özelliklere odaklanarak kalitatif olarak yaklaşılmıştır18. Bununla birlikte, bu parametrelerin objektif olarak belirlenmesini amaçlayan çalışmaların sayısı oldukça azdır. Bir örnek, %11 formalin, taze doku ve fleksiyon5 için gereken kuvveti ölçmek için eklemleri hareketsiz hale getiren modifiye edilmiş bir yöntemle korunmuş kadavralarda üst ekstremite eklemlerinin hareketliliğini karşılaştıran HP Theeuwes'in çalışmasıdır. Bu bağlamda, araştırma ekibi, mevcut kalitatif değerlendirmelerin sınırlamalarının üstesinden gelmeye çalışarak, dokuların mekanik özelliklerini objektif olarak değerlendirmek için yöntemler geliştirmektedir.
Kadavraların korunması açısından, formalin en yaygın kullanılan ajan olmasına rağmen, birçok alternatif madde de başarıyla kullanılmıştır. Bu maddeler arasında glutaraldehit, monoetilen glikol, dietilen glikol, etanol-gliserin çözeltileri ve doymuş tuzlar bulunur. Koruma yöntemlerinin çeşitliliği, tıbbi araştırma, eğitim veya sergi amaçları için doku korumasını optimize etmeye yönelik devam eden arayışı yansıtmaktadır 3,19. Bu ilerlemeler, insan dokularının yapısal ve fonksiyonel özelliklerini uzun süreler boyunca en iyi şekilde korumak için daha etkili koruma teknikleri geliştirmede araştırmanın önemini vurgulamaktadır.
Gelecekteki uygulamalar için, bu protokol ile gözlenen yüksek doku koruma seviyesi, anatomik araştırma ve eğitimi ilerletmek için önemli bir umut vaat etmektedir. Bu yöntemin potansiyeli, cerrahi eğitim için gerçekçi modeller sağlayan ve sürükleyici tıbbi simülasyonların geliştirilmesine katkıda bulunan ileri anatomik çalışmalara kadar uzanır. Ek olarak, protokolün uyarlanabilirliği, çeşitli anatomik örneklerde keşif için yollar açar ve böylece çeşitli tıbbi ve bilimsel bağlamlarda faydasını genişletir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu araştırmadaki destekleri için Temel Tıp Bilimleri Bölümü'ne ve Universidad Icesi Araştırma Ofisi'ne teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
Referanslar
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır