Method Article
비교 인체 해부학 연구를 위한 돼지 바이오모델 보존
요약
이 논문은 돼지 바이오모델을 보존하기 위한 프로토콜을 제시합니다. 제안된 방법은 포르말린 농도가 감소된 변형된 칠레 용액을 사용하는 것입니다. 보존 과정은 검체의 보충 및 침지를 통해 용액을 투여한 후 글리세린을 사용하여 탈형태화 및 조직 연화로 구성됩니다.
초록
의학 교육에서 인체 해부학을 가르치는 것은 도전에 직면해 있으며, 학생들이 해부학적 복잡성을 실질적으로 탐구할 수 있는 효과적인 대안이 필요합니다. 인간과 해부학적으로 유사한 돼지 바이오 모델은 유망한 해결책을 제공합니다. 이 논문은 돼지 바이오모델을 보존하기 위한 자세한 프로토콜을 제시하며, 비교 해부학 연구에서 접근 가능하고 효율적인 방법의 필요성을 해결합니다. 이 프로토콜은 바이오모델 보존을 위해 변형된 칠레 용액의 사용을 제안하며, 충류 및 침지를 통한 공식화 기술을 사용합니다. 그 후, 포름알데히드가 없는 변형된 칠레 용액을 사용하여 탈포름화가 이루어지고, 그 후 글리세린 연화 공정이 이루어집니다. 보존 기술에 대한 문헌이 부족하고 조직 보존을 평가하기 위한 표준화된 절차나 검사가 없다는 점을 감안할 때, 저항성과 탄력성의 척도를 기반으로 조직의 질을 평가할 것을 제안합니다. 우리의 발견은 우리의 표본에서 질적으로 높은 수준의 조직 보존을 나타냅니다. 또한, 이러한 바이오 모델은 현재 형태학 연구 및 의대생에게 인체 비교 해부학을 가르치는 데 성공적으로 활용되고 있습니다.
서문
의과대학에서 해부학을 가르치는 것은 종종 해부를 위해 인체에 접근하는 데 어려움이 있고 적절한 시설이 부족한 것과 같은 장애물에 부딪힙니다. 이러한 한계는 학생들이 해부학적 복잡성을 실용적이고 현실적으로 탐구할 수 있도록 하는 효과적인 대안의 필요성을 강조합니다. 이러한 맥락에서 돼지 바이오모델은 인간과 해부학적으로 유사하기 때문에 유망한 대안으로 부상했으며, 해부학1을 학습하고 가르치는 접근 가능하고 효율적인 수단을 제공합니다.
해부학적 보존 기술은 손상을 최소화하면서 생물학적 조직의 무결성을 유지하는 것을 목표로 합니다. 이러한 기술은 인체 및 수의학 해부학 연구에서 교육, 학술 및 연구 목적으로 사용되었습니다. 신체, 장기 및 조직을 가능한 한 오랫동안 자연 상태로 보존하기 위해 수많은 물질이 테스트되었습니다2. 그러나 해부학적 표본을 보존하고 보존하는 것은 여전히 어려운 일이며, 특히 높은 조직 보존이 필요한 형태학적 연구를 목적으로 하는 표본의 경우 더욱 그러하다3.
전통적으로 사용되던 솔루션이 널리 사용되고 있지만, 일상적인 관행의 한계는 분명합니다. 가장 일반적으로 사용되는 물질 중 하나인 포르말린은 조직 보존에 대한 몇 가지 문서화된 단점이 있습니다. 여기에는 자극적인 냄새, 높은 독성, 취급자에 대한 암 및 돌연변이 유발 위험, 뻣뻣함 및 변색과 같은 조직에 유발하는 관능적 변화가 포함됩니다. 이러한 변화는 고정 후 연구할 때 조직의 생리학적 특성에 대한 인식을 변화시킬 수 있으며, 잠재적으로 정확하고 정확한 형태학적 연구를 방해할 수 있습니다4. 연구에 따르면 고농도의 포르말린을 고정하면 조직의 경직도가 높아진다5. 틸(Thiel) 방부 처리 기법과 같은 대안은 원래의 착색과 조직의 유연성을 더 잘 보존하는 유망한 결과를 보여주었다6. 그러나 이 기술은 다른 솔루션에 비해 비용이 많이 듭니다7. 이러한 과제는 고품질 해부학 교육을 가능하게 하는 새롭고 저렴한 보존 기술을 설계하고 테스트할 수 있는 기회를 제공합니다.
이 프로토콜의 목적은 콜롬비아 칼리에 있는 Universidad Icesi의 해부학 실험실에서 인체 해부학의 비교 연구를 위한 교육 도구로 사용되는 돼지 바이오 모델의 보존을 위해 사용하는 방법론을 설명하는 것입니다.
프로토콜
설명된 기술은 1989년 법률 84 및 총장 결의안 No. 847(2012년 7월 9일)에 따라 Universidad Icesi의 CIECUAE(Institutional Ethics Committee for the Care and Use of Animals in Experimentation)의 지침을 완전히 준수하여 개발되었습니다. 이것은 과학적 무결성과 사용 된 동물의 복지를 모두 보장하여 고통을 최소화합니다. 이 연구에는 생후 3개월, 체중 15-20kg의 수컷 재래돼지가 활용되었습니다. 필요한 시약 및 장비는 재료 표에 나열되어 있습니다.
1. 돼지 바이오모델
- 동물의 희생
- 일반적인 수의학 평가를 실시하고 선택한 돼지 표본을 24시간 동안 격리합니다. 이 기간 동안 동물이 아무런 증상을 보이지 않으면 안락사를 진행하십시오.
- 마취
- 케타민 + 자일라진 + 아트로핀을 각각 10mg/kg, 0.5mg/kg 및 0.04mg/kg의 용량으로 사용하여 근육 주사로 마취를 시행합니다(기관에서 승인한 프로토콜에 따름).
참고: 깊은 마취를 확인하십시오. 신체 검사를 통해 마취의 깊이를 평가합니다. 깊은 마취는 동공이 확장되고 중심이 잡히고, 손바닥 반사가 없고, 각막 반사가 저하되고, 호흡수, 심박수 및 혈압이 감소하는 것으로 나타납니다.
- 케타민 + 자일라진 + 아트로핀을 각각 10mg/kg, 0.5mg/kg 및 0.04mg/kg의 용량으로 사용하여 근육 주사로 마취를 시행합니다(기관에서 승인한 프로토콜에 따름).
- 안락사
- 펜토바르비탈/디페닐히단토인 나트륨 5mL(390/50mg/mL)를 정맥 투여합니다. 안락사제를 투여한 후, Suis Scrofa 종에 대한 동물의 생리학적 매개변수를 청진한다: HR, 60-90; 금, 8-18; 및 T° 37-39°C8.
- 심박수가 점차 감소하고 완전히 멈출 때까지 심박수를 모니터링하십시오. 괄약근 이완, 청색막, 신체 자극에 대한 반응 부재와 같은 즉각적인 변화를 관찰합니다. 심장 박동을 감지하지 않고 심장 청진 5분 후 안락사가 완료되는 것을 고려하십시오.
- 보관 및 운송
- 안락사 후 30분 이내에 시술실에서 해부학 실험실로 돼지 바이오모델을 운반하여 분해 및 미생물 증식을 방지함으로써 바이오모델 보존을 최적화합니다.
2. 칠레 솔루션을 기반으로 한 방부제 솔루션
- 변형 된 칠레 용액의 준비
- 에탄올, 글리세린, 포름알데히드, 염화벤잘코늄, 커피 방향족 에센스 및 증류수를 함유한 변형된 칠레 용액을 사용하십시오. 용액의 pH가 7.0인지 확인하십시오.
- 50L 탱크에 방부액을 준비합니다. 먼저 탱크에 증류수 10.6L를 추가합니다. 다음으로 96% 에탄올 7.6L, 글리세린 5L, 50% 벤잘코늄 클로라이드 0.5L, 커피 아로마 에센스 0.1L를 추가합니다.
알림: 수정된 칠레 용액 1L를 준비하는 데 필요한 각 구성 요소의 필요한 농도 및 부피는 25을 참조하십시오.
3. 변형 칠레 방부액의 투여
알림: 방부액이 준비되면 보충과 침지를 통해 투여하십시오.
- 변형된 칠레 방부제 용액의 충진에 의한 투여
참고: 이 절차를 위해 생물 안전복을 사용하십시오: A1P2 필터가 있는 재사용 가능한 하프 마스크, 생물 안전 고글, 긴팔 일회용 수술 가운, 수술 모자, 레깅스 및 니트릴 장갑.- 외과적 접근법
- xiphoid process에서 linea alba(메스 손잡이 4, 블레이드 22 사용)를 따라 치골 부위까지 절개합니다.
- 피하 세포 조직과 복직근의 근육 섬유를 확인합니다.
참고: 절개 순간에 피하 세포 조직으로 알려진 피부에 부착된 부족한 지방 조직과 더 깊은 곳에 위치한 복직근의 근섬유를 확인합니다9. - 복막에 접근할 수 있도록 조심스럽게 절단하여 즉시 노출되는 간과 장을 손상시키지 않고 복강으로 개방되도록 합니다.
- 장 루프를 복강 오른쪽으로 후퇴시킵니다. 왼쪽 신장과 신장 혈관 위에 있는 두정(parietal peritoneum)을 확인합니다. 이 혈관 구조를 사용하여 복부 대동맥을 찾습니다.
- 왼쪽 신장 척추경의 출현을 찾으십시오. 신장 동맥 위 5cm 대동맥을 덮고 있는 복막을 제거합니다.
- 왼쪽 신장 척추경을 노출시키면 장 루프를 움직이고 고막을 덮고 있는 복막을 절개합니다. 먼저 더 크고 전방에 위치한 신장 정맥을 확인하기 위해 전후로 절개합니다.
- 신장 동맥을 후방으로 배치하고 복부 대동맥에서 기원까지의 궤적을 따라 이동합니다. 마지막으로, hilum9의 가장 뒤쪽 구조인 신장 골반을 확인합니다.
- 대동맥의 뒤쪽 부분을 조심스럽게 절개합니다. 0/0 실크를 사용하여 신장 동맥 높이보다 높은 매듭으로 대동맥을 결찰하고 5cm 위에 또 다른 매듭을 만듭니다.
- 분리된 대동맥 분절의 양쪽 끝에 있는 두 개의 Kelly 클램프로 대동맥을 즉시 고정합니다.
- Metzembaum 가위의 끝으로 대동맥 벽을 절개하여 대동맥 전벽을 약 0.3cm 정도 자르고 천공하지 않도록주의하십시오.
- 켈리 클램프를 제거하면서 말단부를 매듭짓습니다.amp 3.2mm의 뭉툭한 L자형 바늘을 동맥 내강에 삽입합니다. 근위 켈리 클램프를 제거하고 변형된 칠레 보존 용액의 관류를 시작합니다.
- 변형된 칠레 보존 용액의 대동맥 관류
- 변형된 칠레 보존 용액의 관류를 진행합니다.
알림: 관류 펌프를 사용하여 0.25파운드의 압력으로 10L/kg을 투여합니다. - 관류의 끝
- 보존 용액의 관류가 완료되면 관류 캐뉼라를 제거하고 삽입 부위를 0/0 실크로 매듭을 지어 보존 용액의 역류를 방지합니다. 0/0 실크로 linea alba의 절개 부위를 봉합하여 복부를 닫습니다.
참고: 적절한 관류가 이루어졌는지 평가하려면 포화도의 급성 지표를 확인하십시오: 상지 및 하지의 확장, 경추 및 흉부 분열, 콧구멍을 통한 용액의 유출. 대략적인 관류 시간은 2 시간입니다.
- 보존 용액의 관류가 완료되면 관류 캐뉼라를 제거하고 삽입 부위를 0/0 실크로 매듭을 지어 보존 용액의 역류를 방지합니다. 0/0 실크로 linea alba의 절개 부위를 봉합하여 복부를 닫습니다.
- 외과적 접근법
- 몰입에 의한 투여
참고: 이 절차를 위해 생물 안전복을 사용하십시오: A1P2 필터가 있는 재사용 가능한 하프 마스크, 생물 안전 고글, 긴팔 일회용 수술 가운, 수술 모자, 레깅스 및 니트릴 장갑.- 변형된 칠레 보존 용액의 침지에 의한 투여
- 돼지 표본을 300단계에서 설명한 것과 동일한 방부제로 채워진 2L 탱크에 보관하십시오.
알림: 약 150L의 용액을 사용하여 바이오모델이 완전히 잠겼는지 확인하십시오. 침지 후 바이오모델을 20°C에서 6개월 동안 보관합니다. 적절한 보존의 지표에는 부패 징후(예: 신체 부종, 부기, 악취, 독성 및 조직의 부서짐)가 없는 것이 포함됩니다.
- 돼지 표본을 300단계에서 설명한 것과 동일한 방부제로 채워진 2L 탱크에 보관하십시오.
- 변형된 칠레 보존 용액의 침지에 의한 투여
4. 칠레 용액을 기반으로 한 Deformolization 용액
- 탈형태화 용액의 준비
- 에탄올, 글리세린, 염화벤잘코늄, 커피 방향족 에센스, 증류수를 함유한 변형된 칠레 용액을 사용하십시오. 용액의 pH가 7.0인지 확인하십시오.
- 50L 탱크에서 변형 용액을 준비합니다. 먼저 증류수 11.1L, 96% 에탄올 7.8L, 글리세린 5L, 50% 벤잘코늄 클로라이드 1L, 커피 아로마 에센스 0.1L를 추가합니다.
알림: 포름알데히드가 없는 변성 칠레 용액 25L를 준비하는 데 필요한 각 구성 요소의 필요한 농도 및 부피는 표 2 를 참조하십시오.
5. 탈변형
참고: 이 절차를 위해 생물 안전복을 사용하십시오: A1P2 필터가 있는 재사용 가능한 하프 마스크, 생물 안전 고글, 긴팔 일회용 수술 가운, 수술 모자, 레깅스 및 니트릴 장갑.
- 포름알데히드가 없는 변질된 칠레 보존 용액의 침지에 의한 투여
- 6개월의 침지 보존 기간이 끝나면 포름알데히드가 없는 칠레산 변성 보존 용액으로 채워진 300L 탱크로 바이오모델을 옮깁니다. 바이오 모델을 4 주 동안 보관하십시오.
알림: 약 150L의 용액을 사용하여 바이오모델이 완전히 잠겼는지 확인하십시오.
- 6개월의 침지 보존 기간이 끝나면 포름알데히드가 없는 칠레산 변성 보존 용액으로 채워진 300L 탱크로 바이오모델을 옮깁니다. 바이오 모델을 4 주 동안 보관하십시오.
6. 글리세린 연화
- 탈형태화 과정 직후, 물에 희석된 글리세린 농도가 증가하는 용액(50%, 70% 및 90% 글리세린)에 바이오모델을 담그십시오. 일주일 동안 각 농도의 바이오모델을 유지합니다.
결과
이 프로토콜의 목표는 비교 인체 해부학 교육을 위해 돼지 바이오모델을 보존할 수 있는 효과적이고 실행 가능한 기술을 제시하는 것입니다. 현재 모델 보존을 평가하기 위한 표준화된 방법이나 테스트는 없습니다. 따라서 표본에 대한 프로토콜이 완료된 후 용액 보충 및 분해 징후 지표를 사용하여 모델의 전반적인 보존을 평가했습니다. 또한, 교육 및 연구를 위한 바이오 모델의 생존 가능성을 객관적으로 평가하기 위해 저항성 및 탄력성과 같은 선택된 해부학적 구조의 조직 특성을 보존 전후에 비교하는 계획이 계획되었습니다. 선택된 해부학적 구조는 미주신경(vagus nerve), 대동맥동맥(aortic artery), 강정맥(cava vein)이었다. 이러한 구조는 신경, 동맥 및 정맥이 전체 해부학 교육 및 학습의 기본이기 때문에 선택되었습니다. 결과적으로, 4개의 미주신경, 4개의 대동맥 동맥 및 3개의 동굴 정맥이 보존되지 않은 신선한 표본에서 분리되었습니다.
따라서, 제시된 프로토콜을 사용하여 12개의 돼지 표본의 사체를 보존했습니다. 보존된 돼지 바이오모델은 앞다리의 확장, 혈액 및 콧구멍을 통해 유출되는 방부제(그림 1), 부종, 흉부 및 경추 둘레의 증가(그림 2 및 그림 3), 간의 희끄무레한 얼룩덜룩한 패턴의 출현(그림 4) 및 장 루프의 창백함(그림 5)과 같은 충만 지표를 사용하여 보존의 적절성을 평가했습니다). 모든 바이오 모델은 성공적인 충만 지표를 보여주었습니다. 프로토콜을 완료한 후, 어떤 바이오모델도 장 루프의 팽창, 악취 또는 조직 부서짐과 같은 분해와 관련된 변화를 보이지 않았습니다.
생물 모델을 조사한 후 이 기술이 조작 및 해부를 위해 조직을 성공적으로 보존한 것이 분명했습니다. 예를 들어 근육과 근육의 건막증(그림 6), 복막(그림 7), 위와 장(그림 8)이 있습니다. 이것은 이 모든 기관이 조작하는 동안 높은 유연성을 유지했기 때문에 주관적으로 평가되었습니다. 간의 일관성은 견고하기는 했지만, 해부 후 간내 관과 관련 혈관 형성을 확인할 수 있게 해주었습니다(그림 9 및 그림 10).
그러나 결과가 항상 유망한 것만은 아니었습니다. 프로토콜이 개발되기 전에는 바이오 모델의 곰팡이 집락화가 빈번한 문제였습니다. 이것은 아마도 방부제 용액의 침지에 의한 보충 및 투여를 위한 비표준화 기술의 사용에 기인했을 수 있습니다. 그림 6 은 집락화의 영향을 받은 바이오모델을 보여줍니다.
또한, 조직의 보존을 객관적으로 평가하기 위해, 보존되지 않은 구조와 보존된 구조 모두에서 관심의 특정 특성을 측정했습니다. 4개의 미주신경, 4개의 대동맥 동맥 및 3개의 강정맥을 보존된 생물 모델로부터 분리했습니다. 측정된 특성은 조직의 저항(구조를 찢는 데 필요한 뉴턴으로 정량화됨)과 조직의 유연성(Young's modulus를 사용하여 측정)10,11이었습니다. 결과는 표 3에서 평균 ± 표준 편차(SD)로 표시됩니다.
이러한 구조의 외과적 추출과 탄성 및 저항 평가는 전체 바이오 모델의 보존 정도와 원래의 기계적 특성을 얼마나 잘 유지하는지에 대한 정량적 근사치를 제공하기 위해 수행되었습니다. 이러한 특정 해부학적 구조의 선택은 혈관 및 신경 구조가 해부 중에 교사와 학생에 의해 가장 자주 조작되어 파열의 위험이 더 크다는 사실에 근거했습니다.
동물 생체 조직의 기계적 특성을 평가하기 위해 한쪽 끝은 힘 변환기에 연결하고 다른 쪽 끝은 일정한 물의 흐름을 통해 증가하는 하중을 받는 두 클램프 사이에 샘플을 매달아 놓는 방법을 고안했습니다. 가해지는 힘은 물의 밀도와 중력을 고려하여 계산하고, 샘플의 연신율은 하중을 증가시켜 측정했습니다. 이러한 측정은 조직 강성을 나타내는 Young's modulus의 결정을 용이하게 했을 뿐만 아니라 파열 전에 하중을 견딜 수 있는 조직의 능력을 반영하는 특정 힘의 적용에 대한 최대 저항의 식별을 용이하게 했습니다. 이 방법은 생물학적 조직의 탄성 및 강도 특성에 대한 정확한 평가를 제공하며, 이는 기계적 거동을 이해하는 데 기본이 됩니다.
보존된 미주신경은 보존되지 않은 표본에 비해 저항력과 탄력성이 크게 증가한 것으로 나타났습니다. 예상과 달리 보존된 대동맥은 보존되지 않은 표본에 비해 저항이 약간 낮았지만 탄력성은 완만하게 증가했습니다. cava vein의 보존은 저항력과 탄력성을 모두 현저하게 증가시키는 결과를 낳았습니다. 이러한 발견은 보존 과정이 평가된 조직의 기계적 특성에 눈에 띄는 영향을 미친다는 것을 나타내며, 해부학 연구에서 이러한 보존 조직의 적용에 대한 귀중한 통찰력을 제공합니다.
이 프로토콜을 개발한 형태학 연구팀은 돼지 바이오모델 보존에 대한 광범위한 경험을 보유하고 있습니다. 보존 결과의 질적 개선은 10% 포르말린을 사용한 보존과 같이 이전에 사용된 기존 기술의 수정 및 최적화로 인한 조직의 관능적 특성 측면에서 관찰되었습니다. 보존된 바이오 모델은 현재 Universidad Icesi에서 의대생을 위한 형태학 연구 및 인체 비교 해부학 교육에 성공적으로 사용되고 있습니다. 실험실에서 수명이 가장 긴 모델은 새로운 침수나 추가 공정 없이 실온에서 7년에 도달했습니다. 교육 경험에 따르면 학생들의 높은 수준의 조작에도 불구하고 바이오 모델은 보존 후 최대 4년 동안 해부학적 구조의 무결성을 유지합니다.

그림 1: 콧구멍을 통한 혈액 및 방부액 유출. (A) 관류 전 유출. (B) 관류 중 유출. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 방부제 용액 관류 전과 후의 흉부 둘레. (A) 관류 전의 흉부 둘레. (B) 관류 후 흉부 둘레. 흉부 둘레가 4cm 증가하는 것이 관찰됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
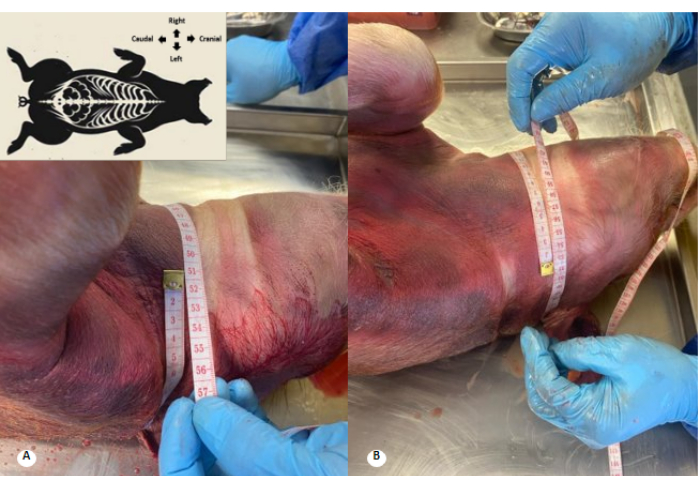
그림 3: 방부제 용액 관류 전후 경추 둘레. (A) 관류 전 경추 둘레. (B) 관류 후 경추 둘레. 경추 둘레가 1cm 증가하고 경추 주름이 사라지는 것이 관찰됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
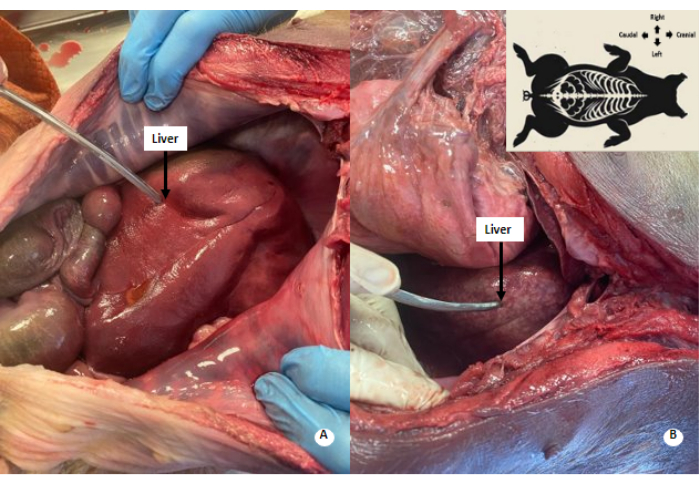
그림 4: 간의 희끄무레한 얼룩덜룩한 패턴. (A) 관류 전 간. (B) 관류 후 간. 관류된 간에서 희끄무레한 얼룩덜룩한 패턴이 관찰됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 장 루프의 창백함. (A) 관류 전의 소장. (B) 관류 후 소장. 장 루프의 창백함이 관찰됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 곰팡이에 의해 군집화된 바이오모델. 하부 cava vein의 복부 견인은 곰팡이 군집화를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 횡단 복부 근육 및 그 종근증. (1) 횡단 복부 근육. (2) 횡복근의 건막신경증(Aponeurosis). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 보존된 돼지 바이오모델의 두정 복막.(1) 두정복막. (2) 절편화된 간의 좌엽. (3) 위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
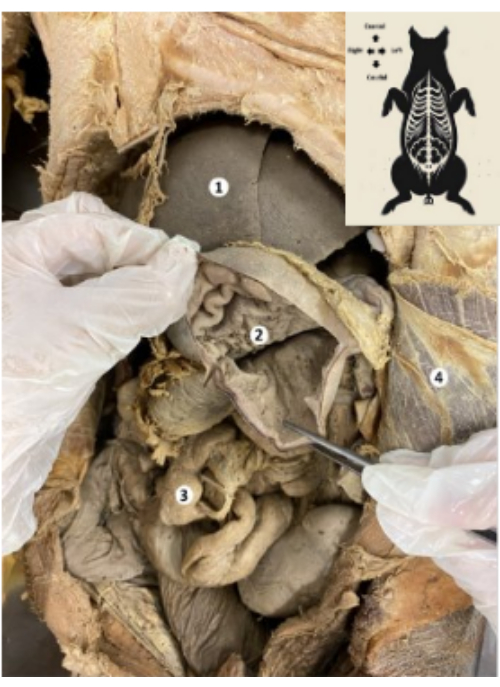
그림 9: 보존된 돼지 바이오모델의 위. (1) 간. (2) 위 점막. (3) 창자. (4) 횡복부 근육 및 두정복막. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
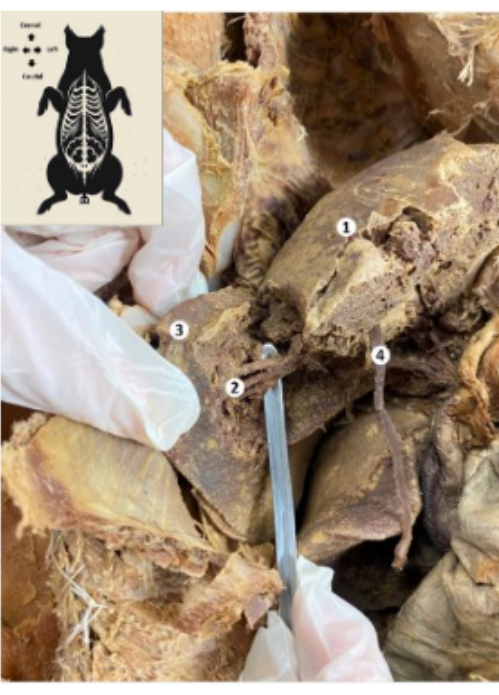
그림 10: 보존된 돼지 바이오모델의 간. (1) 간의 횡격막면. (2) 간의 하부 후방 분절(간동맥, 담관, 문맥의 하부 후방 분지). (3) 간의 우엽. (4) 간 원형 인대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 반응 | 최종 집중 | 양 | 최종 볼륨 |
| 에탄올 96% | 30% | 7.8 패 | 25리터 |
| 글리세린 | 20% | 5리터 | |
| 포름알데히드 40% | 2% | 0.5 리터 | |
| 염화벤잘코늄 50% | 2% | 1리터 | |
| 아로마 에센스 (커피) | 0.40% | 0.1 리터 | |
| 증류수 | 해당 없음 | 10.6 리터 |
표 1: 수정된 칠레 용액을 기반으로 한 방부제 용액.
| 반응 | 최종 집중 | 양 | 최종 볼륨 |
| 에탄올 96% | 30% | 7.8 패 | 25리터 |
| 글리세린 | 20% | 5리터 | |
| 염화벤잘코늄 50% | 2% | 1리터 | |
| 아로마 에센스 (커피) | 0.40% | 0.1 리터 | |
| 증류수 | 해당 없음 | 11.1 패 |
표 2: 변형된 칠레 용액을 기반으로 한 포름알데히드가 없는 방부제 용액.
| 조직 | 보존되지 않음 | 보존 | ||
| 뉴턴 ± SD* | 영률(Young's Modulus) ± SD* | 뉴턴 ± SD* | 영률(Young's Modulus) ± SD* | |
| 미주신경 | 4.92 ± 0.98 | 879.5 ± 427.02 | 8.59 ± 0.83 | 1392.21 ± 729.6 |
| 대동맥 동맥 | 9.33 ± 1.5 | 325.89 ± 176.15 | 8.48 ± 1.26 | 417.16 ± 379.95 |
| 카바 정맥 | 5.73 ± 2.3 | 145.5 ± 40.89 | 8.92 ± 3.97 | 264.69 ± 188.72 |
표 3: 해부학적 구조의 보존되지 않은 표본과 보존된 표본의 조직 특성. *SD: 표준 편차.
토론
전통적으로 해부학 연구는 인간의 시체에 의존했습니다. 그러나 이러한 표본을 획득하는 데 어려움이 있어 대체 방법을 모색하게 되었습니다. 돼지 바이오 모델은 인체 해부학을 연구하기위한 귀중한 도구로 입증되었으며, 인간의 의료 응용에 대한 학습 및 외삽을 용이하게하는 해부학 적 유사성을 제공합니다12 , 13 , 14 , 15. 사체 보존 기술은 전통적으로 정성적으로 설명되어 왔지만, Young's modulus를 사용하여 보존된 조직의 강도와 탄력성을 측정하면 보존 정도에 대한 정량적 증거를 제공할 수 있습니다. 생물학적 조직 보존에 대한 혁신적인 접근 방식에 대한 탐색은 사실적인 모델에서 해부학적 복잡성을 쉽게 탐구할 수 있어야 할 필요성에 부응합니다. 따라서 Universidad Icesi의 해부학 실험실에서 개발 및 사용되는 돼지 바이오 모델을 보존하기 위한 프로토콜은 조직 보존 및 후속 해부학 연구를 위한 실행 가능한 대안으로 제시됩니다.
경험에 비추어 볼 때, 돼지 바이오모델에서 복부 대동맥을 통해 표본 순환에 접근하는 것은 인간 사체에서 일반적으로 수행되는 대퇴 동맥 삽관술에 비해 더 효과적인 대안이다16. 돼지 대퇴 동맥 벽의 취약한 특성으로 인해 복부 접근 방식이 선호되는데, 이러한 벽은 관류 펌프에 의해 가해지는 압력으로 인해 파열되기 쉽기 때문입니다. 실행 가능한 진입점을 확보하는 것은 프로토콜의 보충 단계가 전체 표본의 적절한 보존에 중요하기 때문에 매우 중요합니다. 차선의 보충은 분해 위험이 높습니다. 따라서 프로토콜을 계속하기 전에 성공적인 보충 징후를 평가해야 합니다. 이러한 징후에는 상지와 하지의 확장, 경추 및 흉부 흉막, 보존 용액의 관류로 인한 콧구멍을 통한 용액의 유출이 포함됩니다. 이 프로토콜을 실행하는 동안 발생할 수 있는 일반적인 문제는 보존 용액을 주입하는 동안 대동맥 동맥이 찢어지는 것입니다. 이러한 경우, 동맥을 결찰하고 상분절의 절개를 진행하여 2차 캐뉼레이션을 용이하게 하고 보충 단계를 재개하는 것이 좋습니다. 또한, 프로토콜 중 어느 시점에서든 부패의 징후가 명백해지면 전체 검체를 폐기해야 합니다.
이 프로토콜에 사용된 방부제 용액은 염화나트륨 부재, 에탄올 농도 24%에서 30% 증가, 글리세린 농도 16%에서 20% 증가, 포름알데히드 농도 3.7%에서 2%로 감소, 유칼립투스 에센스를 커피 에센스로 대체17.
탈형태화 공정은 프로토콜의 또 다른 중요한 단계로, 적절한 탈형태화는 교사, 연구자 및 학생을 포함한 인력이 포름알데히드에 노출되는 것을 줄이기 때문입니다. 또한 글리세린을 사용한 연화 과정은 신선한 조직과 유사한 질감을 얻는 데 필수적입니다. 10%의 포름알데히드를 사용한 기존의 보존은 뻣뻣한 조직이 탄력을 잃고 취급 중에 찢어지기 쉬워집니다. 그러나 포름알데히드 농도가 2% 감소된 변형된 칠레 용액을 사용한 다음 글리세린으로 탈형태화 및 연화하면 이 문제를 완화할 수 있습니다.
이 프로토콜에 따라 조작 시 높은 수준의 유연성이 달성되었으며, 간과 같은 단단한 장기는 견고하지만 구조를 해부하고 식별할 수 있는 일관성을 보였습니다. 그럼에도 불구하고 다양한 보존 기술에 걸쳐 조직의 보존 품질을 비교하기 위해 추가적인 정량적 연구가 필요합니다.
이 프로토콜을 수행할 때 몇 가지 잠재적인 제한 사항을 고려해야 합니다. 첫째, 권장 범위는 15-20kg으로 시편의 크기에 세심한 주의를 기울여야 합니다. 더 큰 동물은 보존 프로토콜을 실행하고 바이오 모델의 배치를 관리하는 데 어려움을 겪을 수 있습니다. 둘째, 지정된 실험실에는 적절한 증기 추출 시스템과 하수 시스템에 폐기물 트랩이 설치되어 있어야 합니다. 이 예방 조치는 기술 인력이 유기 증기에 노출되는 것을 완화하고 보존 과정에서 생성된 잔류물로 인한 환경 오염을 최소화하는 것을 목표로 합니다. 셋째, 바이오 모델에 해부학적 변이체가 존재할 가능성을 인정해야 합니다. 또한 돼지 표본은 인간과 해부학적으로 유사하지만 차이점도 있습니다. 따라서 비교 해부학 연구에서 이러한 변형에 대한 신중한 고려가 필요합니다.
조직의 관능적 특성에 대한 평가는 전통적으로 냄새, 색, 뻣뻣함, 취성, 취급 용이성과 같은 특성에 중점을 두고 질적으로 접근해 왔다18. 그러나 이러한 매개변수를 객관적으로 결정하는 것을 목표로 하는 연구가 현저히 부족합니다. 한 가지 예로, HP Theeuwes의 연구는 11%의 포르말린과 신선한 조직으로 보존된 시체에서 상지 관절의 이동성을 비교하고, 굴곡에 필요한 힘을 측정하기 위해 관절을 고정하는 수정된 방법을 비교했습니다5. 이러한 맥락에서 연구팀은 조직의 기계적 물성을 객관적으로 평가할 수 있는 방법을 개발하여 기존 정성적 평가의 한계를 극복하기 위해 노력하고 있습니다.
시신 보존 측면에서는 포르말린이 가장 일반적으로 사용되는 약제이지만 몇 가지 대체 물질도 성공적으로 사용되었습니다. 이러한 물질에는 글루타르알데히드, 모노에틸렌 글리콜, 디에틸렌 글리콜, 에탄올-글리세린 용액 및 포화염이 포함됩니다. 보존 방법의 다양성은 의학 연구, 교육 또는 전시 목적을 위해 조직 보존을 최적화하기 위한 지속적인 탐구를 반영합니다 3,19. 이러한 발전은 인체 조직의 구조적 및 기능적 특성을 장기간 최적으로 유지하기 위해 보다 효과적인 보존 기술을 개발하는 연구의 중요성을 강조합니다.
향후 응용 분야에서 이 프로토콜로 관찰된 높은 수준의 조직 보존은 해부학 연구 및 교육을 발전시키는 데 중요한 약속을 합니다. 이 방법의 잠재력은 고급 해부학 연구로 확장되어 수술 훈련을 위한 사실적인 모델을 제공하고 몰입형 의료 시뮬레이션 개발에 기여합니다. 또한 프로토콜의 적응성은 다양한 해부학적 표본을 탐구할 수 있는 길을 열어 다양한 의료 및 과학적 맥락에서 유용성을 확장합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구에 대한 지원에 대해 기초 의학부와 Universidad Icesi의 연구 사무소에 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| Benzalkonium Chloride | Protécnica Ingeniería | PROQUAT BC 50/80 | CAS Number. 68424-85-1 |
| Ethanol | Not applicable | Not applicable | Ethanol 96% |
| Formaldehyde | Albor químicos | Not applicable | Formaldehyde |
| Glycerin | Not applicable | Not applicable | Glycerin |
| Injection pump | Disánchez | Special Injector YA-02 | Injection pump |
| Kelly forceps | Not applicable | Not applicable | Kelly forceps |
| Metzembaum scissors | Not applicable | Not applicable | Metzembaum scissors |
| Needle | Disánchez | L canule | L canule |
| Scalpel | Not applicable | Not applicable | Scalpel handle 4/ Scalpel blade 22 |
| Suture Silk | Not applicable | Not applicable | Suture Silk 0/0 |
참고문헌
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Guerra, J. A. B. Historia de la preservación de cadáveres humanos. Morfolia. 1, 3(2009).
- Balta, J. Y., Cronin, M., Cryan, J. F., O'Mahony, S. M. Human preservation techniques in anatomy: A 21st century medical education perspective. Clin Anat. 28 (6), 725-734 (2015).
- Bernardini, L., Barbosa, E., Charão, M. F., Brucker, N. Formaldehyde toxicity reports from in vitro and in vivo studies: A review and updated data. Drug Chem Toxicol. 45 (3), 972-984 (2022).
- Theeuwes, H. P., van Riel, M., Lange, J. F., Kleinrensink, G. J. A new model for training on human specimens in surgical-anatomical skills labs. Anat Physiol Biochem Int J. 3 (1), 0013-0017 (2017).
- Rakuša, M., Šaherl, L. K. Thiel embalming method used for anatomy dissection as an educational tool in teaching human anatomy, in research, and in training in comparison of different methods for long term preservation. Folia Morphol. 82 (3), 449-456 (2023).
- Hammer, N., et al. Comparison of modified Thiel embalming and ethanol-glycerin fixation in an anatomy environment: Potentials and limitations of two complementary techniques. Anat Sci Educ. 8 (1), 74-85 (2015).
- Jackson, P. G. G., Cockcroft, P. D., Elmhurst, S. Clinical examination of farm animals: Wiley Online Library. , (2002).
- Delaney, C. P. Netter's surgical anatomy and approaches. E-Book: Netter's Surgical Anatomy and Approaches E-Book. , Elsevier Health Sciences. (2020).
- Agache, P. G., Monneur, C., Leveque, J. L., De Rigal, J. Mechanical properties and Young's modulus of human skin in vivo. Arch Dermatol Res. 269, 221-232 (1980).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Eng Part B Rev. 17 (3), 155-164 (2011).
- Echarte, O. Z. Evaluación del nuevo dispositivo Surgicric para cricotiroidotomía de emergencia en un modelo porcino. Rev Electr AnestesiaR. 8 (12), 2(2016).
- Vargas, D., et al. Caracterización de las arterias coronarias en corazón de porcino como modelo anatómico didáctico en estudiantes del área de la salud. Morfolia. 12 (1), 56-74 (2020).
- Fernández-Trujillo, L., et al. El biomodelo porcino en la investigación médica traslacional: del biomodelo al humano en trasplante pulmonar. Biomédica. 39 (2), 300-313 (2019).
- Villate, M. A. M., Méndez, J. D. B., Echeverry, J. E. P. Anatomía quirúrgica del ojo: Revisión anatómica del ojo humano y comparación con el ojo porcino. Morfolia. 8 (3), 21-44 (2016).
- Kocbek, L., Rakuša, M. Thiel's embalming method: Review of the literature and our institute's experience. Acta Med Biotechnol. 10 (2), 34-42 (2017).
- Guerrero Guzmán, C. C., et al. Restoration and conservation of anatomic pieces. Anat Cell Biol. 52 (3), 255-261 (2019).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anat Sci Educ. 8 (1), 86-91 (2015).
- Hayashi, S., et al. History and future of human cadaver preservation for surgical training: From formalin to saturated salt solution method. Anat Sci Int. 91, 1-7 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유