A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الحقن داخل الكاميرا في الفئران ذات المخاطر المنخفضة للآثار الضارة
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول تقنية للحقن داخل الكاميرا في الفئران باستخدام شق مركزي في القرنية ونفق طويل في الغرفة الأمامية. تقلل طريقة الحقن هذه من خطر إحداث تلف غير مقصود للأنسجة وبالتالي تحسن الدقة والتكاثر.
Abstract
الحقن داخل الكاميرا هو روتين قياسي للإدارة في طب العيون. يعد تطبيق الحقن داخل الكاميرا في القوارض للبحث أمرا صعبا بسبب الأبعاد المحدودة وتشريح العين ، بما في ذلك حجم الخلط المائي الصغير وانحناء العدسة وسمك العدسة. يؤدي الضرر المحتمل أثناء الحقن داخل الكاميرا إلى آثار ضارة وتباين تجريبي. يصف هذا البروتوكول إجراء الحقن داخل الكاميرا في الفئران ، مما يسمح بالدقة والتكاثر.
تم استخدام فئران Sprague-Dawley كنماذج تجريبية. نظرا لأن موضع العدسة في الفئران يبرز في الغرفة الأمامية ، فإن الحقن من المحيط ، كما هو الحال في البشر ، أمر غير موات. لذلك ، يتم إنشاء شق في منطقة القرنية المركزية باستخدام شفرة خنجر مقاس 31 مقاس 0.8 مم لتشكيل نفق ذاتي الغلق في الغرفة الأمامية. يسمح الشق بزاوية قريبة من الشقة بإنشاء نفق طويل ، مما يقلل من فقدان الخلط المائي وضحلة الغرفة الأمامية. يتم إدخال إبرة نانوية عيار 34 في النفق للحقن. يتيح ذلك الاختراق بأقل قدر من مقاومة الاحتكاك ويتجنب لمس العدسة. يسمح حقن التريبان الأزرق بالتصور عن طريق المجهر الشقي لوجود الصبغة في الغرفة الأمامية واستبعاد التسرب. يتضح التوافر البيولوجي للطبقة البطانية للقرنية عن طريق حقن صبغة Hoechst ، التي تلطخ نوى الخلايا البطانية للقرنية بعد الحقن.
في الختام ، ينفذ هذا البروتوكول إجراء للحقن الدقيق داخل الكاميرا في الفئران. يمكن استخدام هذا الإجراء لتوصيل الأدوية والمركبات المختلفة داخل الكاميرا في نماذج الفئران التجريبية ، مما يزيد من كفاءة وقابلية استنساخ أبحاث العيون.
Introduction
التوافر البيولوجي للمركبات التي يتم توصيلها عن طريق الإعطاء الموضعي إلى سطح العين محدود إلى حد كبير ، وعادة ما يكون <5٪ 1. يتم التخلص من المركبات التي تديرها قطرات العين بشكل أساسي عن طريق التصريف والتمزق المستحث ودوران السوائل المسيلة للدموع وامتصاص الملتحمة. بالإضافة إلى ذلك ، فإن تغلغل المركبات عبر سطح العين مقيد بشدة بواسطة حاجز القرنية والملتحمة1،2،3. تتكون القرنية من ثلاث طبقات رئيسية: الظهارة الخارجية ، والسدى الوسيط ، والبطانة الداخلية. ترتبط ظهارة القرنية السطحية ببعضها البعض من خلال تقاطعات ضيقة قوية وتخلق مقاومة عالية للخلايا ، وهي العائق الرئيسي أمام نفاذية المادة. تحد طبقات الظهارة المتعددة من تغلغل الجزيئات المحبة للماء والكبيرة من خلال الفراغات بين الخلايا لظهارة القرنية. بعد الظهارة ، تتكون السدى من ألياف الكولاجين وتحتوي على مسام مائية. على عكس ظهارة القرنية ، تسمح السدى بحركة الأدوية المحبة للماء. ومع ذلك ، فهي غير منفذة إلى حد كبير للمركبات المحبة للدهون1،2،3. تمثل ظهارة القرنية والطبقات اللحمية معا حواجز رئيسية للأنسجة تحد من امتصاص الدواء. لا يعتبر بطانة القرنية تقييد نقل المخدرات.
بديل لطريق توصيل القرنية هو طريق الملتحمة. الملتحمة هي طبقة متعددة الظهارة تغطي الجانب الداخلي للجفون والجزء الأمامي من الصلبة. تتميز الملتحمة بتقاطعات ضيقة أقل من ظهارة القرنية ، مما يسمح بنفاذية أفضل للأدوية المحبة للماء. ومع ذلك ، فإن الأوعية الدموية للملتحمة تؤدي إلى امتصاص جهازي لجزء كبير من الجزيئات المعطاة ، مما يحد بشكل كبير من التوافر البيولوجي للمركبات التي يتم تسليمها إلى الغرفة الأمامية1،2. طريقة فعالة لتجاوز حواجز نفاذية العين الخارجية هي توصيل الدواء مباشرة إلى المنطقة ذات الاهتمام. على سبيل المثال ، يعد الحقن داخل الجسم الزجاجي أمرا شائعا للتسليم في الخلط الزجاجي4. وبالمثل ، يتم استخدام الحقن داخل الكاميرا للتسليم إلى الغرفة الأمامية5. يعد إنشاء تركيز فعال في الغرفة الأمامية أمرا بالغ الأهمية لمختلف الحالات السريرية ، مثل علاج العدوى عن طريق الحقن داخل الأنسجة للمضادات الحيوية والعلاجات المضادة للالتهابات بعد الجراحة في جراحات إعتام عدسة العين. على الرغم من ميزة التوافر البيولوجي المحسن للمادة الممنوحة عن طريق الحقن داخل الكاميرا ، إلا أن هناك مخاوف كبيرة تتعلق بالسلامة يجب أخذها في الاعتبار. على سبيل المثال ، قد يؤدي حقن الدواء داخل الكاميرا إلى زيادة ضغط العين ، ومتلازمة الجزء الأمامي السمي ، ومتلازمة تدمير الخلايا البطانية السمية5،6. لذلك ، من الضروري إجراء تقييم دقيق في الدراسات قبل السريرية لفعالية وسلامة الأدوية التي يتم تسليمها عن طريق الحقن داخل الكاميرا لزيادة كفاءة العلاج وتقليل الآثار الضارة المحتملة لدى المرضى.
لا غنى عن النماذج الحيوانية التجريبية في الدراسات قبل السريرية للتحقيق في العلاجات الجديدة. القوارض الصغيرة ، مثل الفئران والجرذان ، هي المختبر الأكثر استخداما لهذه الأغراض. تظهر هذه العديد من أوجه التشابه مع علم التشريح البشري وعلم وظائف الأعضاء ، مما يوفر رؤى قيمة. علاوة على ذلك ، فإن استخدامها مفيد اقتصاديا نظرا لصغر حجمها ، وسهولة صيانتها ، وسرعة الحمل ، وقدرتها على إنتاج أعداد كبيرة من النسل7.
على الرغم من الاستخدام الواسع النطاق للقوارض الصغيرة في نماذج أمراض العيون ، إلا أن أبعادها الفريدة للعين وتشريحها يشكلان تحديات كبيرة أثناء التلاعب التجريبي. على سبيل المثال ، تصبح إجراءات مثل الحقن داخل الكاميرا ، والتي تكون مباشرة نسبيا في البشر ، متطلبة تقنيا في الفئران والجرذان. تنبع التحديات من عوامل مثل الحجم الصغير للخلط المائي ، والعدسة الكبيرة نسبيا وغير المرنة ، ووضع العدسة الانسدادية وانحناء العدسة داخل عيون القوارض (الشكل 1) 8. تزيد هذه التحديات من خطر التلف أثناء الحقن داخل الكاميرا في القوارض ، مما يؤدي إلى آثار ضارة محتملة وإدخال تباين تجريبي يمكن أن يؤثر على صحة استنتاجات الدراسة. في بحثنا ، نجحنا في تطوير إجراء للحقن الآمن داخل الكاميرا في الفئران. تتضمن هذه التقنية إنشاء نفق طويل ومسطح وذاتي الغلق في القرنية في الغرفة الأمامية. لا تضمن هذه الطريقة الدقة فحسب ، بل تعزز أيضا قابلية التكاثر التجريبي ، وتعالج المشكلات المرتبطة بتقنيات الحقن في القوارض الصغيرة.
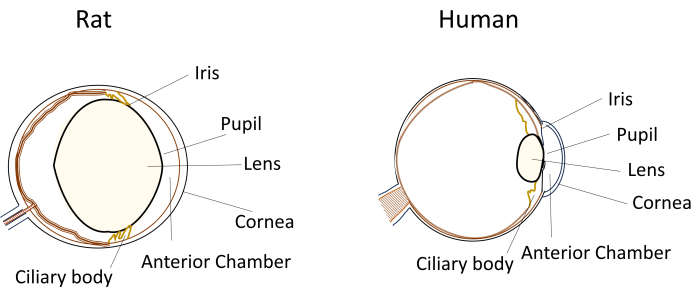
الشكل 1: تمثيل تخطيطي لميزات الجزء الأمامي التشريحي للفئران وعيون الإنسان. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
تمت الموافقة على التجارب في البروتوكول من قبل لجنة التصاريح الوطنية - لعلوم وتتوافق مع بيان ARVO لاستخدام في أبحاث طب العيون والرؤية. تم استخدام إناث فئران Sprague-Dawley ، التي تتراوح أعمارها بين 8-10 أسابيع ، في الدراسة الحالية وتعرضت لدورات الضوء والظلام لمدة 12/12 ساعة. تم الحصول على من مصدر تجاري (انظر جدول المواد).
1. تحضير
- تحضير خليط مخدر من الكيتامين (80 ملغ/كغ من وزن الجسم في 0.8 مل) والزيلازين (4 ملغ/كغ من وزن الجسم في 0.2 مل) وحقنها داخل الصفاق في حقنة واحدة لتخدير الفئران.
- حقن البوبرينورفين المسكن (0.03 ملغ/كغ) داخل الصفاق في حقنة واحدة.
- ضعي مخدر العين الموضعي 0.4٪ أوكسي بوبروكائين على كلتا العينين.
2. إنشاء نفق قرنية ذاتي الختم
- قم بتثبيت العين عن طريق تثبيت الصلبة العلوية عند خط الوسط الرأسي بجوار تقاطع الصلبة القرنية باستخدام ملقط العيون الجراحي.
- تحت المجهر الجراحي ، ضع شفرة خنجر معقمة 0.8 مم ، 31 جم في منطقة القرنية شبه المركزية في خط الوسط الرأسي (فوق مركز التلميذ) في وضع مسطح بزاوية أقرب ما يمكن إلى الأفقي (الشكل 2).
- في هذا الوضع ، قم بثقب القرنية لعمل شق وإنشاء نفق طويل (2-3 مم) حتى تخترق المنطقة المركزية من الغرفة الأمامية. تجنب لمس العدسة (الشكل 2).
ملاحظة: لن يؤدي النفق الناجح إلى تسرب الخلط المائي والضحلة في الغرفة الأمامية. - ضعي 0.3٪ أوفلوكساسين و 0.1٪ ديكساميثازون الموضعي على العين المحقونة.
- افحص تحت الفحص المجهري الشقي على النحو التالي.
- راقب عمق الغرفة الأمامية للعين المحقونة مقارنة بالعين غير المحقونة.
ملاحظة: يجب أن يكون العمق متشابها. - راقب عدسة العين المحقونة مقارنة بالعين غير المحقونة.
ملاحظة: يجب أن تكون العدسة واضحة. قد يعكس التعتيم تلف العدسة أثناء العملية الجراحية.
- راقب عمق الغرفة الأمامية للعين المحقونة مقارنة بالعين غير المحقونة.
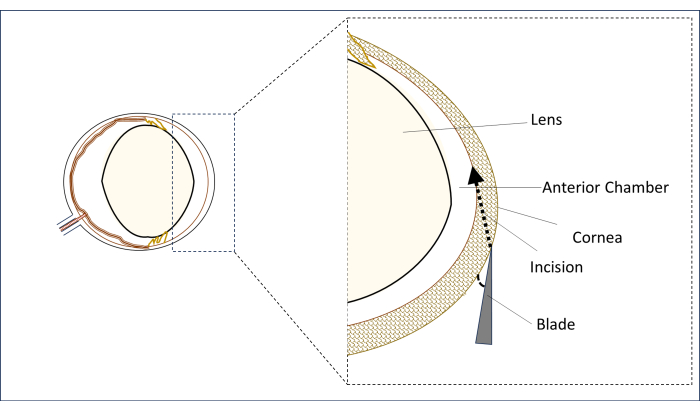
الشكل 2: تمثيل تخطيطي للشفرة وزاوية الشق وموضعه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
3. الخيار 1: الحقن داخل الكاميرا من التربان الأزرق لتقييم الحقن الناجح في الغرفة الأمامية
- قم بتحميل 5 ميكرولتر من التريبان الأزرق في حقنة هاميلتون زجاجية معقمة سعة 10 ميكرولتر بإبرة حادة 34 جراما.
ملاحظة: يوصف حقن التريبان الأزرق بأنه وسيلة لتقييم نجاح الحقن أثناء معايرة النموذج أو مراحل الإعداد. في الإعدادات التجريبية ، يمكن تحميل المحقنة بمحلول من المركب المفضل. - أدخل إبرة المحقنة المحملة من خلال النفق الذي تم إنشاؤه في القسم 2 في الغرفة الأمامية.
- حقن الإبرة وثبتها في مكانها بعد الحقن لمدة 2-3 ثوان حتى يزول كل السوائل.
- قم بإزالة الإبرة عن طريق سحبها برفق وببطء لتجنب التسرب من نفق القرنية.
- فحص تحت المجهر الشقي. قم بتقييم عمق الغرفة الأمامية لاستبعاد الضحل والتحقق من وجود التريبان الأزرق في الغرفة الأمامية.
- كرر فحص الشق بعد 24 ساعة و 48 ساعة و 72 ساعة.
4. الخيار 2: الحقن داخل الكاميرا ل Hoechst لتقييم التوافر البيولوجي للمواد المحقونة في طبقة الخلية البطانية
- قم بتحميل 5 ميكرولتر من Hoechst في حقنة هاميلتون زجاجية معقمة سعة 10 ميكرولتر بإبرة حادة 34 جرام.
ملاحظة: يوصف حقن Hoechst بأنه وسيلة لتقييم التوافر البيولوجي للمواد المحقونة عن طريق امتصاصها في طبقة الخلية البطانية وهو مفيد أثناء مراحل معايرة النموذج أو إعداده. في الإعدادات التجريبية ، يمكن تحميل المحقنة بمحلول من المركب المفضل. - أدخل إبرة المحقنة المحملة من خلال النفق الذي تم إنشاؤه في القسم 2 في الغرفة الأمامية.
- حقن الإبرة وثبتها في مكانها بعد الحقن لمدة 2-3 ثوان حتى يزول كل السوائل.
- قم بإزالة الإبرة عن طريق سحبها برفق وببطء لتجنب التسرب من شق نفق القرنية.
- بعد حوالي 15-20 دقيقة من الحقن ، قم بالقتل الرحيم للفئران عن طريق الحقن داخل الصفاق بمقدار 500 مجم / كجم من بنتوباربيتون الصوديوم.
- استئصال كلتا العينين وعزل القرنية. اجمع القرنية غير المحقونة كعنصر تحكم.
- تلطيخ كلتا القرنية ب 0.5٪ Alizarin Red S وفقا لتعليمات الشركة المصنعة لتحديد الخلايا البطانية.
- افحص تحت المجهر الضوئي لتصوير تلطيخ الأيزارين الأحمر للخلايا البطانية وتحت المجهر الفلوري لمراقبة تلطيخ Hoechst ، مقارنة بالقرنية غير المحقونة كمراقبة.
النتائج
تم حقن فئران Sprague Dawley داخل الكاميرا ب 5 ميكرولتر من التربان الأزرق وفقا للبروتوكول الموضح أعلاه. أظهر فحص المصباح الشقي مباشرة بعد الحقن أن الغرفة كانت ملطخة باللون الأزرق ، مما يشير إلى أن المادة المحقونة وصلت إلى الغرفة الأمامية (الشكل 3). علاوة على ذلك ، ...
Discussion
يجب أن توفر نماذج البحث قبل السريري بيئة خاضعة للرقابة وقابلة للتكرار لضمان موثوقية النتائج وقابليتها للتطبيق. في أبحاث طب العيون ، تستخدم نماذج حقن العين بشكل شائع في جوانب بحثية متنوعة تتراوح من إنشاء نماذج المرض واختبار علاجات جديدة وتقييم تفاعلات الأنسجة والآثار ا?...
Disclosures
يحمل Marcovich A. L. براءات اختراع في Steba Biotech و Yeda Weizmann و EyeYon Medical و Mor Isum وهو مستشار لشركة EyeYon Medical و Johnson & Johnson. جميع المؤلفين الآخرين ليس لديهم مصالح متنافسة.
Acknowledgements
تم دعم هذا البحث من قبل منحة مؤسسة العلوم الإسرائيلية 2670/23 و 1304/20.
Materials
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
References
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. . Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269 (2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. . The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574 (2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416 (2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved