JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
부작용 위험이 낮은 쥐에 대한 카메라내 주사
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 중앙 각막 절개와 전방으로의 긴 터널을 사용하여 쥐에서 안내 주사 기술을 설명합니다. 이 주입 방법은 부주의한 조직 손상을 유발할 위험을 최소화하여 정밀도와 재현성을 향상시킵니다.
초록
카메라내 주사는 안과에서 표준 투여 루틴입니다. 연구를 위해 설치류에 대한 카메라 내 주입을 적용하는 것은 작은 수성 체액 부피, 수정체 곡률 및 수정체 두께를 포함하여 눈의 제한된 치수와 해부학적 구조로 인해 도전적입니다. 카메라내 주입 중 잠재적인 손상은 부작용과 실험적 변동성을 유발합니다. 이 프로토콜은 쥐의 카메라내 주입 절차를 설명하여 정밀도와 재현성을 허용합니다.
Sprague-Dawley 쥐를 실험 모델로 사용했습니다. 쥐의 수정체 위치가 전방으로 돌출되어 있기 때문에 인간에서와 같이 주변부에서 주입하는 것은 바람직하지 않습니다. 따라서 31 게이지 0.8mm 스틸레토 블레이드를 사용하여 중앙 각막 부위를 절개하여 전방으로 자체 밀봉 터널을 형성합니다. 평면에 가까운 각도로 절개하면 긴 터널을 만들 수 있어 수액의 손실과 전방의 얕은 느낌을 최소화할 수 있습니다. 34 게이지 나노 바늘을 주입하기 위해 터널에 삽입합니다. 이를 통해 마찰 저항을 최소화하면서 침투할 수 있으며 렌즈를 건드리는 것을 방지할 수 있습니다. trypan-blue를 주입하면 슬릿 현미경으로 전방 챔버에 염료의 존재를 시각화하고 누출을 배제할 수 있습니다. 각막 내피층에 대한 생체이용률은 주입 후 각막 내피 세포의 핵을 염색한 Hoechst 염료의 주입으로 입증되었습니다.
결론적으로, 이 프로토콜은 쥐에서 정확한 카메라 내 주입을 위한 절차를 구현합니다. 이 절차는 실험용 쥐 모델에서 다양한 약물 및 화합물의 안내 전달에 사용되어 안과 연구의 효율성과 재현성을 높일 수 있습니다.
서문
국소 투여를 통해 눈 표면으로 전달되는 화합물의 생체이용률은 일반적으로 <5%로 매우 제한적입니다1. 점안액에 의해 투여되는 화합물은 주로 배액, 유도 눈물 흘림, 눈물액 회전 및 결막 흡수에 의해 제거됩니다. 또한, 안구 표면을 통한 화합물의 투과는 각막-결막 장벽 1,2,3에 의해 크게 제한됩니다. 각막은 세 개의 주요 층으로 구성되어 있습니다: 가장 바깥쪽 상피, 중간 기질, 가장 안쪽 내피. 표재성 각막 상피는 강하고 단단한 접합부로 상호 연결되어 있으며 물질 투과성에 대한 주요 장벽인 높은 세포주위 저항을 생성합니다. 다중 상피층은 각막 상피의 세포 간 공간을 통한 친수성 및 대형 분자의 투과를 더욱 제한합니다. 상피를 계승하는 기질은 콜라겐 섬유로 구성되어 있으며 수성 기공을 포함하고 있습니다. 각막 상피와 대조적으로, 기질은 친수성 약물의 이동을 허용합니다. 그러나 친유성 화합물 1,2,3에는 크게 불침투성입니다. 각막 상피와 기질층은 함께 약물 흡수를 제한하는 주요 조직 장벽을 존재합니다. 각막 내피는 약물 수송을 제한하는 것으로 간주되지 않습니다.
각막 전달 경로의 대안은 결막 경로입니다. 결막은 눈꺼풀의 안쪽과 공막의 앞쪽을 덮고 있는 다상피층입니다. 결막은 각막 상피보다 단단한 연접이 적어 친수성 약물의 투과성이 우수하다는 특징이 있습니다. 그러나, 결막의 혈관화는 투여된 분자의 많은 부분이 전신적으로 흡수되는 결과를 초래하며, 다시 전방(anterior chamber)1,2으로 전달된 화합물의 생체이용률을 크게 제한한다. 외부 안구 투과성 장벽을 우회하는 효율적인 방법은 약물을 관심 영역으로 직접 전달하는 것입니다. 예를 들어, 유리체강내 주입은 유리체액으로의 전달을 위해 일반적이다4. 마찬가지로, 전방(anterior chamber)5으로의 전달을 위해 카메라내 주사가 이용된다. 전방에서 효율적인 농도를 확립하는 것은 항생제의 안내 주입에 의한 감염 치료 및 백내장 수술에서 수술 후 항염증 치료와 같은 다양한 임상 상황에서 매우 중요합니다. 카메라내 주사에 의해 부여되는 향상된 물질 생체이용률의 이점에도 불구하고, 고려해야 할 주요 안전성 문제가 있습니다. 예를 들어, 카메라내 약물 주입은 안압 상승, 독성 전안부 증후군 및 독성 내피 세포 파괴 증후군을 유발할 수 있다 5,6. 따라서 전임상 연구에서 혈관 내 주사로 전달되는 약물의 효능과 안전성을 신중하게 평가하여 치료 효율성을 극대화하고 환자에 대한 잠재적 부작용을 최소화하는 것이 중요합니다.
실험 동물 모델은 새로운 치료법을 연구하기 위한 전임상 연구에서 필수적입니다. 생쥐 및 쥐와 같은 작은 설치류는 이러한 목적으로 가장 일반적으로 사용되는 실험실 동물입니다. 이 동물들은 인간의 해부학 및 생리학과 많은 유사점을 보여 귀중한 통찰력을 제공합니다. 더욱이, 그들의 사용은 작은 크기, 유지 관리의 용이성, 빠른 임신 및 많은 수의 자손을 생산할 수 있는 능력으로 인해 경제적으로 유리하다7.
안과 질환 모델에서 작은 설치류가 널리 사용됨에도 불구하고, 그들의 독특한 눈 치수와 해부학적 구조는 실험적 조작 중에 상당한 문제를 제기합니다. 예를 들어, 인간에게는 비교적 간단하지만 생쥐와 쥐에서는 기술적으로 까다로워지는 카메라 내 주사와 같은 시술이 가능합니다. 이러한 문제는 수액의 작은 부피, 상대적으로 크고 유연하지 않은 수정체, 설치류의 눈 안에서 수정체의 폐쇄적인 위치 및 곡률과 같은 요인에서 비롯됩니다(그림 1)8. 이러한 문제는 설치류에서 카메라내 주사 중 손상 위험을 증가시켜 잠재적인 부작용을 초래하고 연구 결론의 타당성에 영향을 줄 수 있는 실험적 변동성을 유발합니다. 우리의 연구에서, 우리는 쥐에 있는 안전한 intracameral 주입을 위한 절차를 성공적으로 개발했습니다. 이 기술은 각막에 전방으로 들어가는 길고 평평한 자체 밀봉 터널을 만드는 것을 포함합니다. 이 방법은 정밀도를 보장할 뿐만 아니라 실험 재현성을 향상시켜 작은 설치류의 주입 기술과 관련된 문제를 해결합니다.
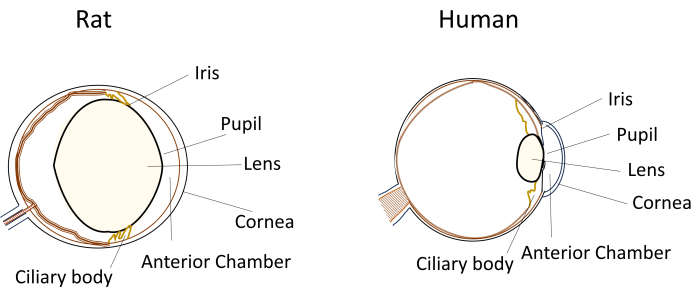
그림 1: 쥐와 사람 눈의 해부학적 전방 분절 특징의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
프로토콜의 실험은 동물 과학에 대한 국가 허가 위원회(National Permit Committee)의 승인을 받았으며 안과 및 시력 연구에서 동물 사용에 대한 ARVO 성명을 준수합니다. 8-10 주 된 암컷 Sprague-Dawley 쥐는 본 연구에 사용되었으며 12/12 h 밝음-어두운주기에 노출되었습니다. 동물은 상업적 출처에서 얻었다( 재료 표 참조).
1. 동물 준비
- 케타민(0.8mL에 체중 80mg/kg)과 자일라진(0.2mL에 체중 4mg/kg)의 마취 혼합물을 준비하고 1회 주사로 복강내로 주입하여 쥐를 마취합니다.
- 진통제인 부프레노르핀(0.03mg/kg)을 1회 주사로 복강내에 주입합니다.
- 국소 안과 마취제 0.4% 옥시부프로카인을 양쪽 눈에 바릅니다.
2. 자가 밀봉 각막 터널 만들기
- 외과용 안과 겸자로 각막 공막 접합부 옆의 수직 정중선에서 우수한 공막을 잡고 눈을 안정시킵니다.
- 수술용 현미경으로 멸균된 0.8mm, 31G 스틸레토 블레이드를 수직 정중선(동공 중앙 위)의 중심 각막 영역에 수평에 가능한 한 가까운 각도로 평평한 위치에 놓습니다(그림 2).
- 이 위치에서 각막을 뚫어 절개하고 전방의 중앙 영역으로 침투할 때까지 긴 터널(2-3mm)을 만듭니다. 렌즈를 만지지 마십시오(그림 2).
알림: 성공적인 터널은 수액의 누출과 전방의 얕음을 유발하지 않습니다. - 주사한 눈에 국소 0.3% 오플록사신과 0.1% 덱사메타손을 바릅니다.
- 다음과 같이 슬릿 현미경으로 검사하십시오.
- 주입된 눈의 전방 깊이를 주입되지 않은 눈과 비교하여 관찰합니다.
참고: 깊이는 비슷해야 합니다. - 주입된 눈의 수정체와 주입되지 않은 눈의 수정체를 비교하여 관찰합니다.
알림: 렌즈는 깨끗해야 합니다. 혼탁도는 수술 중 렌즈 손상을 반영할 수 있습니다.
- 주입된 눈의 전방 깊이를 주입되지 않은 눈과 비교하여 관찰합니다.
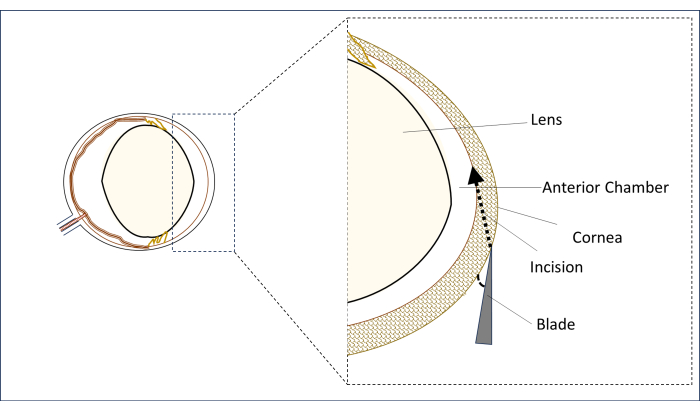
그림 2: 칼날과 절개 각도 및 위치의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 옵션 1: 전방으로의 성공적인 주입을 평가하기 위한 trypan blue의 차내 주입
- 34G의 뭉툭한 바늘이 있는 멸균 10μL 유리 Hamilton 주사기에 트리판 블루 5μL를 넣습니다.
참고: trypan blue 주입은 모델 보정 또는 설정 단계에서 주입의 성공을 평가하는 수단으로 설명됩니다. 실험 설정에서 주사기에는 선택한 화합물의 용액이 로드될 수 있습니다. - 장전된 주사기 바늘을 섹션 2에서 만든 터널을 통해 전방으로 삽입합니다.
- 주입 후 모든 액체가 맑아질 때까지 2-3초 동안 바늘을 주입하고 제자리에 유지합니다.
- 각막 터널에서 누출을 방지하기 위해 바늘을 부드럽고 천천히 당겨 제거합니다.
- 슬릿 현미경으로 검사하십시오. 전방의 깊이를 평가하여 얕은 곳을 배제하고 전방에 트리판 블루가 있는지 확인합니다.
- 24시간, 48시간, 72시간 후에 슬릿 검사를 반복합니다.
4. 옵션 2: 내피 세포층에 주입된 물질의 생체이용률을 평가하기 위한 Hoechst의 카메라내 주입
- 34G의 뭉툭한 바늘이 있는 멸균 10μL 유리 Hamilton 주사기에 5μL의 Hoechst를 로드합니다.
참고: Hoechst 주입은 내피 세포층으로의 흡수를 통해 주입된 물질의 생체이용률을 평가하는 수단으로 설명되며 모델 보정 또는 설정 단계에서 유용합니다. 실험 설정에서 주사기에는 선택한 화합물의 용액이 로드될 수 있습니다. - 장전된 주사기 바늘을 섹션 2에서 만든 터널을 통해 전방으로 삽입합니다.
- 주입 후 모든 액체가 맑아질 때까지 2-3초 동안 바늘을 주입하고 제자리에 유지합니다.
- 각막관 절개부에서 누출을 방지하기 위해 바늘을 부드럽고 천천히 당겨 제거합니다.
- 주사 후 약 15-20분 후에 500mg/kg 나트륨 펜토바르비톤의 복강 내 주사로 쥐를 안락사시킵니다.
- 양쪽 눈을 절삭하고 각막을 분리합니다. 주사되지 않은 각막을 대조군으로 채취합니다.
- 내피 세포를 식별하기 위해 제조업체 지침에 따라 0.5% Alizarin Red S로 양쪽 각막을 염색합니다.
- 광학 현미경으로 검사하여 내피 세포의 alizarin-red 염색을 이미지화하고 형광 현미경으로 Hoechst 염색을 관찰하기 위해 대조군으로 주입되지 않은 각막과 비교합니다.
결과
Sprague Dawley 랫트는 위에서 설명한 프로토콜에 따라 5μL의 트리판 블루를 카메론내 주입했습니다. 주입 직후 세극등 검사에서 챔버가 트리판 블루로 염색된 것으로 나타났으며, 이는 주입된 물질이 전방 챔버에 도달했음을 나타냅니다(그림 3). 또한, 전방 깊이는 온전했는데, 이는 주사가 수액의 누출을 일으키지 않고 챔버의 얕음을 유발하지 않았음?...
토론
전임상 연구 모델은 연구 결과의 신뢰성과 적용 가능성을 보장하기 위해 통제되고 재현 가능한 환경을 제공해야 합니다. 안과 연구에서 안구 주입 모델은 질병 모델 확립, 새로운 치료법 테스트, 조직 반응 및 잠재적 부작용 평가에 이르기까지 다양한 연구 측면에서 일반적으로 사용됩니다.
카메라내 주사는 실험적 안과학에서 흔한 기법으로, 바깥쪽...
공개
Marcovich A. L.은 Steba Biotech, Yeda Weizmann, EyeYon Medical 및 Mor Isum의 특허를 보유하고 있으며 EyeYon Medical 및 Johnson & Johnson의 컨설턴트입니다. 다른 모든 저자는 경쟁 관심사가 없습니다.
감사의 말
이 연구는 이스라엘 과학 재단 보조금 2670/23 및 1304/20의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
참고문헌
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. . Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269 (2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. . The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574 (2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416 (2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유