Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Intrakamerale Injektion bei Ratten mit geringem Risiko für Nebenwirkungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Technik zur intrakameralen Injektion bei Ratten unter Verwendung eines zentralen Hornhautschnitts und eines langen Tunnels in die Vorderkammer. Diese Injektionsmethode minimiert das Risiko einer versehentlichen Gewebeschädigung und verbessert dadurch die Präzision und Reproduzierbarkeit.
Zusammenfassung
Die intrakamerale Injektion ist eine Standardverabreichungsroutine in der Augenheilkunde. Die Anwendung der intrakameralen Injektion bei Nagetieren zu Forschungszwecken ist aufgrund der begrenzten Abmessungen und der Anatomie des Auges, einschließlich des kleinen Kammerwasservolumens, der Linsenkrümmung und der Linsendicke, eine Herausforderung. Mögliche Schäden während intrakameraler Injektionen führen zu unerwünschten Wirkungen und experimenteller Variabilität. Dieses Protokoll beschreibt ein Verfahren zur intrakameralen Injektion bei Ratten, das Präzision und Reproduzierbarkeit ermöglicht.
Als Versuchsmodelle wurden Sprague-Dawley-Ratten verwendet. Da die Linsenposition bei Ratten in die Vorderkammer hineinragt, ist eine Injektion aus der Peripherie, wie sie beim Menschen erfolgt, ungünstig. Daher wird mit einer 31 Gauge 0,8 mm Stilettoklinge ein Schnitt im zentralen Hornhautbereich erstellt, um einen selbstdichtenden Tunnel in die Vorderkammer zu bilden. Ein Schnitt in einem flachen Winkel ermöglicht es, einen langen Tunnel zu schaffen, der den Verlust des Kammerwassers und die Flachheit der Vorderkammer minimiert. Eine 34-Gauge-Nanonadel wird zur Injektion in den Tunnel eingeführt. Dies ermöglicht eine Durchdringung mit minimalem Reibungswiderstand und vermeidet das Berühren der Linse. Die Injektion von Trypanblau ermöglicht die Visualisierung des Vorhandenseins des Farbstoffs in der Vorderkammer durch Schlitzmikroskopie und schließt Leckagen aus. Die Bioverfügbarkeit in der Hornhautendothelschicht wird durch die Injektion von Hoechst-Farbstoff nachgewiesen, der die Kerne der Hornhautendothelzellen nach der Injektion färbte.
Zusammenfassend lässt sich sagen, dass dieses Protokoll ein Verfahren zur genauen intrakameralen Injektion bei Ratten implementiert. Dieses Verfahren kann für die intrakamerale Verabreichung verschiedener Medikamente und Verbindungen in experimentellen Rattenmodellen verwendet werden, wodurch die Effizienz und Reproduzierbarkeit der ophthalmologischen Forschung erhöht wird.
Einleitung
Die Bioverfügbarkeit von Verbindungen, die durch topische Verabreichung an die Augenoberfläche abgegeben werden, ist stark begrenzt und liegt in der Regel <5 %1. Verbindungen, die durch Augentropfen verabreicht werden, werden hauptsächlich durch Drainage, induzierte Tränenfluss, Tränenflüssigkeitsumsatz und Bindehautabsorption ausgeschieden. Darüber hinaus wird die Permeation von Verbindungen durch die Augenoberfläche durch die Hornhaut-Konjunktiva-Barriere stark eingeschränkt 1,2,3. Die Hornhaut besteht aus drei Hauptschichten: dem äußersten Epithel, dem intermediären Stroma und dem innersten Endothel. Das oberflächliche Hornhautepithel ist durch starke Tight Junctions miteinander verbunden und erzeugt einen hohen parazellulären Widerstand, der die Hauptbarriere für die Durchlässigkeit der Substanz darstellt. Mehrere Epithelschichten begrenzen zusätzlich die Permeation von hydrophilen und großen Molekülen durch die Interzellularräume des Hornhautepithels. Das Stroma, das dem Epithel folgt, besteht aus Kollagenfasern und enthält wässrige Poren. Im Gegensatz zum Hornhautepithel ermöglicht das Stroma die Bewegung von hydrophilen Arzneimitteln; Es ist jedoch sehr undurchlässig für lipophile Verbindungen 1,2,3. Zusammen stellen das Hornhautepithel und die Stromaschichten wichtige Gewebebarrieren dar, die die Absorption von Arzneimitteln begrenzen. Es wird nicht davon ausgegangen, dass das Hornhautendothel den Medikamententransport einschränkt.
Eine Alternative zur Hornhautverabreichung ist die Bindehaut. Die Bindehaut ist eine Multiepithelschicht, die die Innenseite der Augenlider und den vorderen Teil der Sklera bedeckt. Die Bindehaut zeichnet sich durch weniger Tight Junctions als das Hornhautepithel aus, was eine bessere Permeabilität von hydrophilen Arzneimitteln ermöglicht. Die Vaskularisierung der Bindehaut führt jedoch zu einer systemischen Resorption eines großen Teils der verabreichten Moleküle, was wiederum die Bioverfügbarkeit der in die Vorderkammer abgegebenen Verbindungen stark einschränkt 1,2. Eine effiziente Möglichkeit, die Barrieren der äußeren Augenpermeabilität zu umgehen, besteht darin, das Medikament direkt in den interessierenden Bereich zu verabreichen. Zum Beispiel ist die intravitreale Injektion für die Verabreichung in den Glaskörperüblich 4. Ebenso wird die intrakamerale Injektion für die Verabreichung in die Vorderkammer5 verwendet. Die Etablierung einer effizienten Konzentration in der Vorderkammer ist entscheidend für verschiedene klinische Situationen, wie z. B. die Behandlung von Infektionen durch intrakamerale Injektion von Antibiotika und postoperative entzündungshemmende Behandlungen bei Kataraktoperationen. Trotz des Vorteils der verbesserten Bioverfügbarkeit der Substanz, die durch die intrakamerale Injektion gewährt wird, gibt es große Sicherheitsbedenken, die berücksichtigt werden sollten. Zum Beispiel kann die intrakamerale Injektion von Medikamenten einen erhöhten Augeninnendruck, ein toxisches Vordersegmentsyndrom und ein toxisches Endothelzellzerstörungssyndrom induzieren 5,6. Daher ist es wichtig, in präklinischen Studien die Wirksamkeit und Sicherheit von Arzneimitteln, die durch intrakamerale Injektionen verabreicht werden, sorgfältig zu bewerten, um die Behandlungseffizienz zu maximieren und mögliche Nebenwirkungen bei Patienten zu minimieren.
Experimentelle Tiermodelle sind in präklinischen Studien unverzichtbar, um neue Therapien zu untersuchen. Kleine Nagetiere wie Mäuse und Ratten sind die am häufigsten verwendeten Versuchstiere für solche Zwecke. Diese Tiere weisen zahlreiche Ähnlichkeiten mit der menschlichen Anatomie und Physiologie auf und liefern wertvolle Erkenntnisse. Darüber hinaus ist ihr Einsatz aufgrund ihrer geringen Größe, der einfachen Wartung, der schnellen Trächtigkeit und der Fähigkeit, eine große Anzahl von Nachkommen zu produzieren, wirtschaftlich vorteilhaft7.
Trotz der weit verbreiteten Verwendung kleiner Nagetiere in Modellen für Augenkrankheiten stellen ihre einzigartigen Augenabmessungen und ihre Anatomie erhebliche Herausforderungen bei experimentellen Manipulationen dar. So werden beispielsweise Verfahren wie intrakamerale Injektionen, die beim Menschen relativ einfach sind, bei Mäusen und Ratten technisch anspruchsvoll. Die Herausforderungen ergeben sich aus Faktoren wie dem geringen Volumen des Kammerwassers, der relativ großen und unflexiblen Linse und der obstruktiven Positionierung und Krümmung der Linse in den Augen der Nagetiere (Abbildung 1)8. Diese Herausforderungen erhöhen das Risiko von Schäden bei intrakameralen Injektionen bei Nagetieren, was zu potenziellen Nebenwirkungen führt und zu experimenteller Variabilität führt, die sich auf die Gültigkeit der Studienschlussfolgerungen auswirken kann. In unserer Forschung ist es uns gelungen, ein Verfahren zur sicheren intrakameralen Injektion bei Ratten zu entwickeln. Bei dieser Technik wird ein langer, flacher, selbstdichtender Tunnel in der Hornhaut in die Vorderkammer geschaffen. Diese Methode gewährleistet nicht nur die Präzision, sondern verbessert auch die experimentelle Reproduzierbarkeit und löst die Probleme, die mit Injektionstechniken bei kleinen Nagetieren verbunden sind.
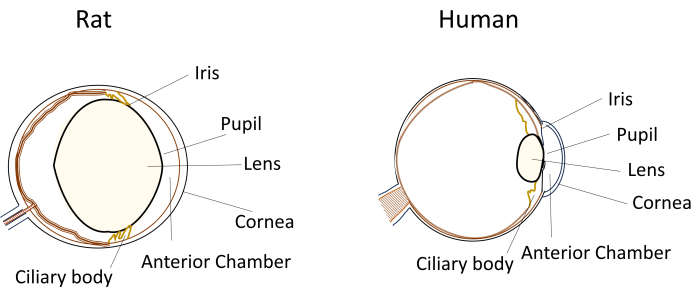
Abbildung 1: Schematische Darstellung der anatomischen Merkmale des vorderen Augenabschnitts des Auges von Ratte und Mensch. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Die Versuche im Protokoll wurden vom Nationalen Genehmigungsausschuss für Tierwissenschaften genehmigt und entsprechen der ARVO-Erklärung zur Verwendung von Tieren in der Augen- und Sehforschung. Weibliche Sprague-Dawley-Ratten im Alter von 8-10 Wochen wurden für die vorliegende Studie verwendet und 12/12 h Hell-Dunkel-Zyklen ausgesetzt. Die Tiere wurden aus einer kommerziellen Quelle gewonnen (siehe Materialtabelle).
1. Vorbereitung der Tiere
- Bereiten Sie eine Anästhesiemischung aus Ketamin (80 mg/kg Körpergewicht in 0,8 ml) und Xylazin (4 mg/kg Körpergewicht in 0,2 ml) vor und injizieren Sie es intraperitoneal in einer einzigen Injektion, um die Ratten zu betäuben.
- Injizieren Sie das Analgetikum Buprenorphin (0,03 mg/kg) intraperitoneal in einer einzigen Injektion.
- Tragen Sie ein topisches Augenanästhetikum 0,4% Oxybuprocain auf beide Augen auf.
2. Erstellen eines selbstdichtenden Hornhauttunnels
- Stabilisieren Sie das Auge, indem Sie die obere Sklera mit einer chirurgischen Augenzange an der vertikalen Mittellinie neben dem hornhautnahen Übergang halten.
- Unter einem Operationsmikroskop wird eine sterile Stilettoklinge von 0,8 mm und 31 g in der parazentralen Hornhautregion in der vertikalen Mittellinie (über der Mitte der Pupille) in einer flachen Position in einem Winkel platziert, der so nah wie möglich an der Horizontalen liegt (Abbildung 2).
- In dieser Position punktieren Sie die Hornhaut, um einen Schnitt zu machen und einen langen Tunnel (2-3 mm) zu schaffen, bis er in den zentralen Bereich der Vorderkammer eindringt. Vermeiden Sie es, das Objektiv zu berühren (Abbildung 2).
HINWEIS: Ein erfolgreicher Tunnel führt nicht zum Austreten des Kammerwassers und zur Flachheit der Vorderkammer. - Tragen Sie topische 0,3 % Loxocinsäure und 0,1 % Dexamethason auf das injizierte Auge auf.
- Untersuchen Sie unter Schlitzmikroskopie wie folgt.
- Beobachten Sie die Tiefe der vorderen Kammer des injizierten Auges im Vergleich zum nicht injizierten Auge.
HINWEIS: Die Tiefe sollte ähnlich sein. - Beobachten Sie die Linse des injizierten Auges im Vergleich zum nicht injizierten Auge.
HINWEIS: Das Objektiv sollte klar sein. Die Opazität kann auf eine Beschädigung der Linse während des chirurgischen Eingriffs hinweisen.
- Beobachten Sie die Tiefe der vorderen Kammer des injizierten Auges im Vergleich zum nicht injizierten Auge.
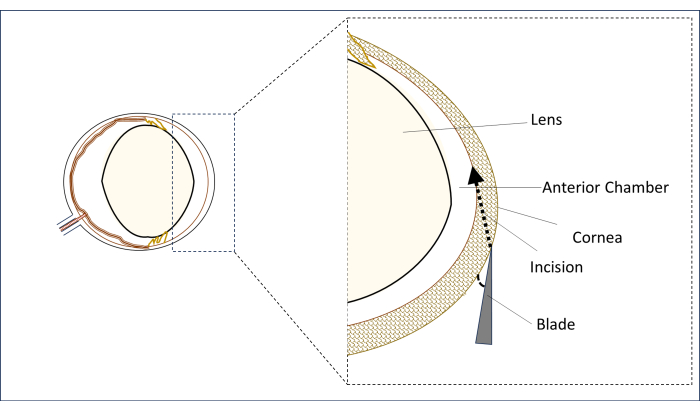
Abbildung 2: Schematische Darstellung der Klinge sowie des Schnittwinkels und der Schnittposition. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Option 1: Intrakamerale Injektion von Trypanblau zur Beurteilung der erfolgreichen Injektion in die Vorderkammer
- Laden Sie 5 μl Trypanblau in eine sterile 10 μl Glasspritze von Hamilton mit einer stumpfen 34-G-Nadel.
HINWEIS: Die Injektion von Trypanblau wird als Mittel zur Bewertung des Erfolgs der Injektion während der Modellkalibrierung oder der Einrichtungsphase beschrieben. In den Versuchsanordnungen kann die Spritze mit einer Lösung der Verbindung der Wahl beladen werden. - Führen Sie die geladene Spritzennadel durch den in Abschnitt 2 geschaffenen Tunnel in die Vorderkammer ein.
- Injizieren Sie und halten Sie die Nadel nach der Injektion 2-3 Sekunden lang an Ort und Stelle, bis die gesamte Flüssigkeit verschwunden ist.
- Entfernen Sie die Nadel, indem Sie sie vorsichtig und langsam herausziehen, um ein Auslaufen aus dem Hornhauttunnel zu vermeiden.
- Unter Schlitzmikroskopie untersuchen. Bewerten Sie die Tiefe der Vorderkammer, um eine Flachheit auszuschließen, und überprüfen Sie das Vorhandensein von Trypanblau in der Vorderkammer.
- Wiederholen Sie die Schlitzuntersuchung nach 24 h, 48 h und 72 h.
4. Option 2: Intrakamerale Injektion von Hoechst zur Beurteilung der Bioverfügbarkeit von injiziertem Material in die Endothelzellschicht
- Geben Sie 5 μl Hoechst in eine sterile 10-μl-Glasspritze von Hamilton mit einer stumpfen 34-G-Nadel.
HINWEIS: Die Injektion von Hoechst wird als Mittel zur Bewertung der Bioverfügbarkeit von injiziertem Material durch Aufnahme in die Endothelzellschicht beschrieben und ist während der Modellkalibrierung oder der Einrichtung nützlich. In den Versuchsanordnungen kann die Spritze mit einer Lösung der Verbindung der Wahl beladen werden. - Führen Sie die geladene Spritzennadel durch den in Abschnitt 2 geschaffenen Tunnel in die Vorderkammer ein.
- Injizieren Sie und halten Sie die Nadel nach der Injektion 2-3 Sekunden lang an Ort und Stelle, bis die gesamte Flüssigkeit verschwunden ist.
- Entfernen Sie die Nadel, indem Sie sie vorsichtig und langsam herausziehen, um ein Auslaufen aus dem Schnitt des Hornhauttunnels zu vermeiden.
- Etwa 15-20 Minuten nach der Injektion euthanasieren Sie die Ratten durch intraperitoneale Injektion von 500 mg/kg Natriumpentobarbiton.
- Enukleieren Sie beide Augen und isolieren Sie die Hornhaut. Sammeln Sie die nicht injizierte Hornhaut als Kontrolle.
- Färben Sie beide Hornhäute mit 0,5 % Alizarin Rot S gemäß den Anweisungen des Herstellers, um Endothelzellen zu identifizieren.
- Untersuchen Sie unter einem Lichtmikroskop, um die Alizarinrot-Färbung von Endothelzellen abzubilden, und unter einem Fluoreszenzmikroskop, um die Hoechst-Färbung im Vergleich zur nicht injizierten Hornhaut als Kontrolle zu beobachten.
Ergebnisse
Sprague Dawley-Ratten wurden intracameral mit 5 μl Trypanblau gemäß dem oben beschriebenen Protokoll injiziert. Die Spaltlampenuntersuchung unmittelbar nach der Injektion zeigte, dass die Kammer mit Trypanblau gefärbt war, was darauf hindeutet, dass das injizierte Material die Vorderkammer erreicht hatte (Abbildung 3). Darüber hinaus war die Tiefe der vorderen Kammer intakt, was darauf hindeutet, dass die Injektion kein Austreten des Kammerwassers und k...
Diskussion
Präklinische Forschungsmodelle sollten eine kontrollierte und reproduzierbare Umgebung bieten, um die Zuverlässigkeit und Anwendbarkeit der Ergebnisse zu gewährleisten. In der ophthalmologischen Forschung werden Augeninjektionsmodelle häufig in verschiedenen Forschungsbereichen eingesetzt, die von der Erstellung von Krankheitsmodellen über das Testen neuer Behandlungen bis hin zur Bewertung von Gewebereaktionen und potenziellen Nebenwirkungen reichen.
Int...
Offenlegungen
Marcovich A. L. hält Patente in Steba Biotech, Yeda Weizmann, EyeYon Medical und Mor Isum und ist Berater für EyeYon Medical und Johnson & Johnson. Alle anderen Autoren haben keine konkurrierenden Interessen.
Danksagungen
Diese Forschung wurde durch die Stipendien 2670/23 und 1304/20 der Israel Science Foundation unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
Referenzen
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. . Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269 (2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. . The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574 (2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416 (2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten