需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
不良反应风险低的大鼠前房内注射
* 这些作者具有相同的贡献
摘要
该方案描述了一种使用中央角膜切口和进入前房的长隧道对大鼠进行前房内注射的技术。这种注射方法将诱导意外组织损伤的风险降至最低,从而提高了精度和可重复性。
摘要
前房内注射是眼科的标准给药程序。由于眼睛的尺寸和解剖结构有限,包括房水体积小、晶状体曲率和晶状体厚度,因此在啮齿动物中前房内注射的研究应用具有挑战性。前房内注射过程中的潜在损伤会引入不良反应和实验变异性。该协议描述了大鼠前房内注射的程序,可实现精度和可重复性。
使用 Sprague-Dawley 大鼠作为实验模型。由于大鼠的晶状体位置突出到前房,因此从外围注射,就像在人类中所做的那样,是不利的。因此,使用 31 号 0.8 毫米细高跟刀片在角膜中央区域创建一个切口,以形成进入前房的自密封隧道。在靠近平面的角度切开可以形成一条长隧道,从而最大限度地减少房水的损失和前房的浅层。将 34 号纳米针插入隧道进行注射。这使得穿透阻力最小,并避免接触镜头。注射台盼蓝可以通过狭缝显微镜观察前房中染料的存在并排除泄漏。通过注射 Hoechst 染料证明了角膜内皮层的生物利用度,该染料在注射后对角膜内皮细胞的细胞核进行染色。
总之,该协议实现了对大鼠进行精确前房内注射的程序。该程序可用于实验大鼠模型中各种药物和化合物的前房内递送,从而提高眼科研究的效率和可重复性。
引言
通过局部给药输送到眼睛表面的化合物的生物利用度非常有限,通常为 <5%1。滴眼液给药的化合物主要通过引流、诱导流泪、泪液周转和结膜吸收来消除。此外,化合物通过眼表的渗透受到角膜结膜屏障的高度限制 1,2,3。角膜由三个主要层组成:最外层的上皮、中间基质和最内层的内皮。浅表角膜上皮通过牢固的紧密连接相互连接并产生高细胞旁抗性,这是物质通透性的主要屏障。多个上皮层进一步限制了亲水性和大分子通过角膜上皮细胞间隙的渗透。继上皮之后,基质由胶原纤维组成并包含房水孔。与角膜上皮相比,基质允许亲水性药物的运动;然而,它对亲脂性化合物 1,2,3 具有极强的渗透性。角膜上皮和基质层共同构成了限制药物吸收的主要组织屏障。角膜内皮被认为不会限制药物运输。
角膜输送途径的替代途径是结膜途径。结膜是一个多上皮层,覆盖眼睑内侧和巩膜前部。结膜的特征是比角膜上皮少的紧密连接,允许更好的亲水药物渗透性。然而,结膜的血管化导致大部分给药分子的全身吸收,再次大大限制了递送到前房的化合物的生物利用度 1,2。绕过眼外通透性屏障的一种有效方法是将药物直接输送到感兴趣的区域。例如,玻璃体内注射通常用于输送到玻璃体液4。同样,前房内注射用于输送到前房5。在前房建立有效的浓度对于各种临床情况至关重要,例如通过前房内注射抗生素治疗感染和白内障手术中的术后抗炎治疗。尽管前房内注射可以提高物质的生物利用度,但仍应考虑重大的安全问题。例如,前房内药物注射可诱导眼压升高、中毒性眼前节综合征和中毒性内皮细胞破坏综合征 5,6。因此,在临床前研究中仔细评估前房内注射给药药物的疗效和安全性,以最大限度地提高治疗效率并最大限度地减少对患者的潜在不良反应。
实验动物模型在临床前研究中是必不可少的,以研究新的治疗方法。小型啮齿动物,如老鼠和老鼠,是最常用于此类目的的实验动物。这些动物与人体解剖学和生理学有许多相似之处,提供了有价值的见解。此外,由于它们的体积小、易于维护、妊娠快以及能够产生大量后代7,它们的使用在经济上是有利的。
尽管小型啮齿动物在眼病模型中被广泛使用,但它们独特的眼睛尺寸和解剖结构在实验操作过程中构成了重大挑战。例如,像前房内注射这样的程序,在人类中相对简单,但在小鼠和大鼠中却在技术上变得要求很高。挑战源于诸如房水体积小、晶状体相对较大且不灵活以及晶状体在啮齿动物眼睛内的阻塞位置和弯曲等因素(图 1)8。这些挑战增加了啮齿动物前房内注射过程中损伤的风险,导致潜在的不良反应并引入可能影响研究结论有效性的实验可变性。在我们的研究中,我们成功开发了一种对大鼠进行安全前房内注射的程序。该技术包括在角膜中创建一个长而扁平的自密封隧道,通向前房。这种方法不仅可以确保精度,还可以提高实验可重复性,解决了与小型啮齿动物注射技术相关的问题。
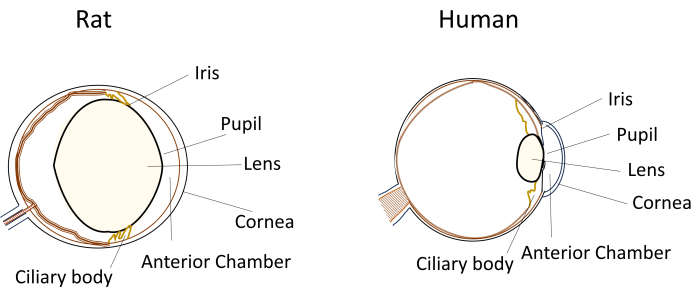
图 1:大鼠和人眼解剖眼前节特征的示意图。 请单击此处查看此图的较大版本。
研究方案
该协议中的实验得到了国家许可委员会的批准 - 用于动物科学,并符合 ARVO 声明,即在眼科和视觉研究中使用动物。本研究使用 8-10 周龄的雌性 Sprague-Dawley 大鼠,并暴露于 12/12 小时的明暗循环中。这些动物是从商业来源获得的(见 材料表)。
1. 动物准备
- 制备氯胺酮(0.8 mL 中 80 mg/kg 体重)和甲苯噻嗪(0.2 mL 中 4 mg/kg 体重)的麻醉混合物,并在单次注射中腹膜内注射以麻醉大鼠。
- 单次注射腹膜内注射镇痛药丁丙诺啡 (0.03 mg/kg)。
- 将 0.4% 羟布卡因局部眼药涂抹在双眼上。
2. 创建自密封角膜隧道
- 用手术眼用镊子将上巩膜固定在角膜缝膜交界处旁边的垂直中线,以稳定眼睛。
- 在手术显微镜下,将无菌的 0.8 毫米、31 G 细高跟刀片放置在垂直中线(瞳孔中心上方)的中央旁角膜区域,以尽可能接近水平的角度平坦放置(图 2)。
- 在这个位置,刺穿角膜做一个切口,并形成一个长隧道(2-3 毫米),直到它穿透到前房的中央区域。避免触摸镜头(图 2)。
注意:成功的隧道不会引起房水渗漏和前房浅。 - 将 0.3% 氧氟沙星和 0.1% 地塞米松局部涂抹在注射的眼睛上。
- 在狭缝显微镜下检查如下。
- 观察注射眼与未注射眼相比前房的深度。
注意:深度应相似。 - 观察注射眼与未注射眼的晶状体比较。
注意:镜头应该是透明的。混浊可能反映了手术过程中晶状体损伤。
- 观察注射眼与未注射眼相比前房的深度。
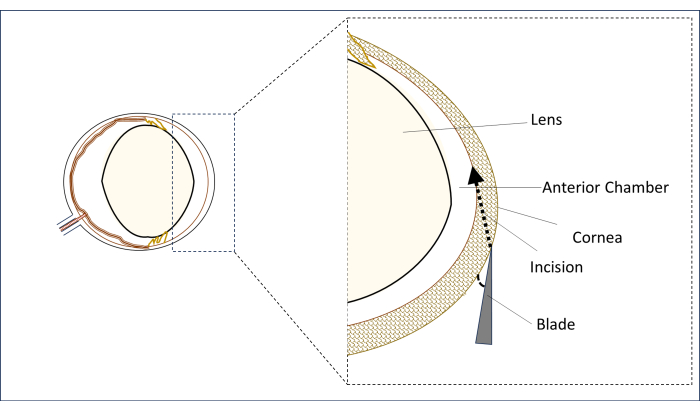
图 2:叶片和切口角度和位置的示意图。请单击此处查看此图的较大版本。
3. 选项 1:前房内注射台盼蓝,以评估前房注射成功
- 将 5 μL 台盼蓝装入带有 34 G 平针的无菌 10 μL 玻璃 Hamilton 注射器中。
注意:台盼蓝的注射被描述为在模型校准或设置阶段评估注射成功的一种方法。在实验设置中,注射器可以加载所选化合物的溶液。 - 将加载的注射器针头穿过第 2 部分中创建的隧道插入前房。
- 注射后注射并保持针头 2-3 秒,直到所有液体清除。
- 轻轻缓慢地将针头拉出,以避免从角膜隧道泄漏。
- 在狭缝显微镜下检查。评估前房的深度以排除浅层,并验证前房中是否存在台盼蓝。
- 24 小时、 48 小时和 72 小时后重复狭缝检查。
4. 选项 2:前房内注射 Hoechst,用于评估注射材料对内皮细胞层的生物利用度
- 将 5 μL Hoechst 装入带有 34 G 钝针的无菌 10 μL 玻璃 Hamilton 注射器中。
注意:注射 Hoechst 被描述为一种通过摄取到内皮细胞层来评估注射材料的生物利用度的方法,并且在模型校准或设置阶段很有用。在实验设置中,注射器可以加载所选化合物的溶液。 - 将加载的注射器针头穿过第 2 部分中创建的隧道插入前房。
- 注射后注射并保持针头 2-3 秒,直到所有液体清除。
- 轻轻缓慢地将针头拉出,以避免角膜隧道切口渗漏。
- 注射后约 15-20 分钟,通过腹膜内注射 500 mg/kg 戊巴比妥钠对大鼠实施安乐死。
- 摘除双眼并隔离角膜。收集未注射的角膜作为对照。
- 根据制造商的说明,用 0.5% 茜素红 S 对两个角膜进行染色,以鉴定内皮细胞。
- 与未注射的角膜相比,在光学显微镜下检查以对内皮细胞的茜素红染色进行成像,并在荧光显微镜下观察 Hoechst 染色。
结果
根据上述方案,将 Sprague Dawley 大鼠前房内注射 5 μL 台盼蓝。注射后立即进行裂隙灯检查表明腔室被台盼蓝染色,表明注射的材料到达前房(图 3)。此外,前房深度完好无损,表明注射未导致房水渗漏和房浅。
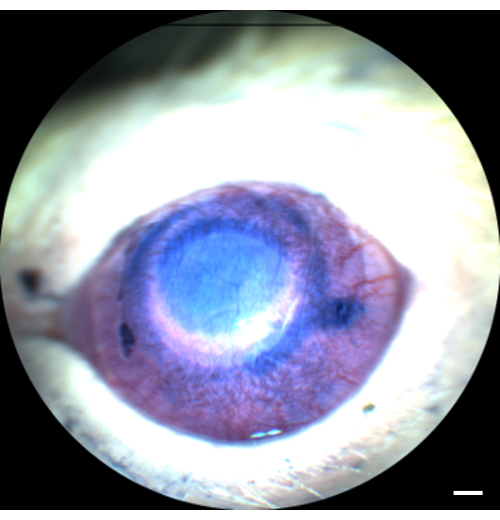
图 3
讨论
临床前研究模型应提供受控且可重复的环境,以确保研究结果的可靠性和适用性。在眼科研究中,眼部注射模型通常用于不同的研究方面,包括建立疾病模型、测试新疗法以及评估组织反应和潜在不良反应。
前房内注射是实验性眼科中的一种常用技术,可促进化合物直接递送至房水,同时绕过眼外组织屏障5。这种通过前房内注射的...
披露声明
Marcovich A. L. 在Steba Biotech、Yeda Weizmann、EyeYon Medical和Mor Isum中拥有专利,并且是EyeYon Medical和Johnson & Johnson的顾问。所有其他作者都没有利益冲突。
致谢
这项研究得到了以色列科学基金会拨款 2670/23 和 1304/20 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
参考文献
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. . Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269 (2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. . The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574 (2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416 (2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。