A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طريقة الطباعة الحيوية عالية الإنتاجية لنمذجة نفاذية الأوعية الدموية في الألواح القياسية ذات الستة آبار مع مرونة الحجم والنمط
In This Article
Summary
نقدم بروتوكولا للإنتاج عالي الإنتاجية للقنوات الوعائية ذات الأحجام المرنة والأنماط المرغوبة على لوحة قياسية من ستة آبار باستخدام تقنية الطباعة الحيوية 3D ، والتي يشار إليها باسم الأوعية على لوحة (VOP). هذه المنصة لديها القدرة على تعزيز تطوير العلاجات للاضطرابات المرتبطة بالبطانة المعرضة للخطر.
Abstract
تعد نفاذية الأوعية الدموية عاملا رئيسيا في تطوير علاجات للاضطرابات المرتبطة بالبطانة المعرضة للخطر ، مثل الخلل البطاني في الشرايين التاجية وضعف وظيفة الحاجز الدموي الدماغي. تقنيات التصنيع الحالية لا تكرر بشكل كاف التباين الهندسي في شبكات الأوعية الدموية في جسم الإنسان ، مما يؤثر بشكل كبير على تطور المرض. علاوة على ذلك ، غالبا ما تتضمن هذه التقنيات إجراءات تصنيع متعددة الخطوات تعيق الإنتاج عالي الإنتاجية اللازم للاختبار الدوائي. تقدم هذه الورقة بروتوكول الطباعة الحيوية لإنشاء أنسجة وعائية متعددة بأنماط وأحجام مرغوبة مباشرة على ألواح قياسية من ستة آبار ، والتغلب على تحديات الدقة والإنتاجية الحالية في تكنولوجيا الطباعة الحيوية. تم إنشاء نهج تصنيع مبسط لبناء ست قنوات مجوفة قابلة للاختراق داخل هيدروجيل ، والتي تم تبطينها لاحقا بالخلايا البطانية للوريد السري البشري لتشكيل بطانة وظيفية وناضجة. تضمن الطبيعة التي يتم التحكم فيها بواسطة الكمبيوتر للطباعة الحيوية 3D قابلية عالية للتكرار وتتطلب خطوات تصنيع يدوية أقل من الطرق التقليدية. هذا يسلط الضوء على إمكانات VOP كمنصة فعالة عالية الإنتاجية لنمذجة نفاذية الأوعية الدموية وتعزيز اكتشاف الأدوية.
Introduction
تعمل شبكة الأوعية الدموية في جميع أنحاء جسم الإنسان كحاجز نقل حاسم من خلال التنظيم الديناميكي لتبادل الجزيئات والخلايا بين الدم والأنسجة المحيطة. هذا التنظيم ضروري لمنع وذمة الأنسجة وتمكين التبادل الانتقائي للمغذيات والخلايا ، وبالتالي دعم استقلاب الأنسجة والتوازن1. تؤثر نفاذية البطانة المتغيرة ، وهي عامل في العديد من الحالات الصحية ، على كل من شدة المرض وفعالية العلاج2. تعمل البطانة الوعائية كحاجز انتقائي ، مما يسهل النقل بين الأوعية والأنسجة والأعضاء. يتضمن هذا التنظيم عدة آليات ، مثل الترشيح الأساسي للمواد المذابة والجزيئات الصغيرة ، والتعطيل المتعمد للحاجز الوعائي ، وتأثير الجزيئات مثل البروستاجلاندين وعوامل النمو على مستويات النفاذية3.
تشمل العوامل الرئيسية في هذا التنظيم تقاطعات الخلايا البطانية ، وهجرة الكريات البيض ، ووظائف الحاجز الدمويالدماغي 4. نظرا لتعقيدها ، تختلف العملية عبر بيئات مختلفة ، وتشمل أنواعا مختلفة من الأوعية الدموية وتستخدم مسارات تشريحية متميزة. يعد فهم الأسس البيولوجية لنفاذية الأوعية الدموية أمرا بالغ الأهمية لابتكار مناهج علاجية لعلاج الحالات المرتبطة بنفاذية الأوعية الدموية غير الطبيعية. الحفاظ على نفاذية الأوعية الدموية أمر بالغ الأهمية لصحة نظام الأوعية الدموية والأنسجة المحيطة بها. وبالتالي ، يؤدي ضعف هذه الوظيفة إلى خلل وظيفي في البطانة ، وهي حالة تفقد فيها البطانة وظائفها الطبيعية.
الخلل البطاني هو مقدمة للعديد من الأمراض البشرية السائدة ، بما في ذلك ارتفاع ضغط الدم ومرض الشريان التاجي والسكري والسرطان5،6،7. يمكن أن تظهر هذه الحالة بعدة طرق ، بما في ذلك انخفاض توسع الأوعية ، وزيادة نفاذية الأوعية الدموية ، والميل نحو حالة مؤيدة للالتهابات. هذه الحالة المرضية هي المرحلة الأولى من العديد من مشاكل القلب والأوعية الدموية الحرجة ، مثل مرض الشريان التاجي والسكتة الدماغية ومرض الشريان المحيطي8 ، والتي لا تزال الأسباب الرئيسية للوفيات في الولايات المتحدة1. يؤثر الخلل البطاني على صحة القلب والأوعية الدموية وكذلك الحاجز الدموي الدماغي (BBB) ويلعب دورا رئيسيا في تطور الاضطرابات العصبية المختلفة. يمكن أن يؤدي الخلل الوظيفي إلى زيادة نفاذية BBB ، مما يسمح للسموم ومسببات الأمراض والخلايا المناعية بالتسلل إلى الجهاز العصبي المركزي والمساهمة في الاضطرابات العصبية مثل السكتة الدماغية ومرض الزهايمر والتصلب المتعدد والتهابات الدماغ9.
يتميز الخلل البطاني في مرض السكري بضعف قدرة البطانة على تنظيم نغمة الأوعية الدموية وإنتاج وسطاء موسع للأوعية ، مثل أكسيد النيتريك ، مما يؤدي إلى ضعف توسع الأوعية10. تتفاقم هذه الحالة بسبب المسارات التي يسببها ارتفاع السكر في الدم مثل تنشيط بروتين كيناز C والإجهاد التأكسدي ، مما يساهم بشكل كبير في تطور مرض الأوعية الدموية السكري11. علاوة على ذلك ، تم العثور على بيئة التهابية لتعزيز التصاق الخلايا السرطانية بالخلايا البطانية الوعائية الدقيقة في الدماغ بينما تم الإبلاغ عن أن البطانة المتسربة هي عامل رئيسي في ورم خبيث للسرطان12,13. تم العثور على هندسة الأوعية الدموية للتأثير بشكل مباشر على ورم خبيث سرطان الدماغ. ترتبط الخلايا السرطانية بشكل تفضيلي بمناطق انحناء الأوعية الدمويةالأكبر 7. تؤكد هذه النتيجة على أهمية هندسة الأوعية الدموية في ورم خبيث للسرطان. والأهم من ذلك ، في حالات مثل التليف والسرطان ، لا يلعب تعطيل وظيفة الحاجز البطاني دورا في تطور المرض فحسب ، بل يعيق أيضا فعالية العلاج من خلال إعاقة توصيل الدواء الكافي14. يعد البحث في نفاذية الأوعية الدموية أمرا بالغ الأهمية لتطوير علاج أمراض القلب والأوعية الدموية وتقديم رؤى حول إدارة الأمراض الأخرى التي تنطوي على ضعف وظيفة الأوعية الدموية.
نظرا للدور الحاسم لنفاذية الأوعية الدموية في الصحة والمرض ، ركزت أبحاث كبيرة على فحص الطبيعة الانتقائية للحاجز البطاني للتطوير العلاجي باستخدام النماذج الحيوانية ، جنبا إلى جنب مع منصات الاختبار التقليدية 2D و 3D في المختبر. ومع ذلك ، فإن النماذج الحيوانية لها قيود بسبب الاختلافات الخاصة بالأنواع والقضايا الأخلاقية ، فضلا عن ارتفاع التكاليف 15,16. على سبيل المثال ، ذكرت شركة Pfizer ، في عام 2004 ، أنه على مدى السنوات العشر الماضية ، أنفقت أكثر من 2 مليار دولار على تطوير الأدوية التي أظهرت آثارا واعدة في النماذج الحيوانية ولكنها فشلت في النهاية في مراحل الاختبار البشريالمتقدمة 17. علاوة على ذلك ، لا تحاكي نماذج 2D التقليدية بدقة البنية ثلاثية الأبعاد (3D) والبنية الهندسية المعقدة للقنوات الوعائية.
مع التقدم في تقنيات التصنيع الحيوي ، كانت الجهود المكثفة تهدف إلى تصنيع قنوات الأوعية الدموية مع تلخيص بنية 3D. يمكن تصنيع القنوات الوعائية المجهرية بشكل فعال داخل رقائق الموائع الدقيقة باستخدام الطباعة الحجرية الناعمة ، مما يوفر ميزة التحليل في الوقت الفعلي18,19. يمكن استخدام طرق بديلة ، مثل صب الهيدروجيل أو لف صفائح الخلايا حول قالب أو مغزل ، لإنشاء هياكل أنبوبية قائمة بذاتها بالقطر المطلوب20,21. ومع ذلك ، فإن هذه الأساليب لها قيود. على سبيل المثال ، تقتصر رقائق الموائع الدقيقة على تكوينات القنوات الدقيقة ، ولا يؤدي صب الهيدروجيل حول القالب إلى تكرار الأشكال الهندسية المتعددة بشكل فعال.
مع ظهور تقنية الطباعة الحيوية ثلاثية الأبعاد22 ، أصبح تكرار الأشكال الهندسية المعقدة عن طريق إيداع مختلف مواد الهيدروجيل القائمة على المصفوفة خارج الخلية (ECM) ممكنا23,24. بعض طرق الطباعة الحيوية ، مثل تلك التي تستخدم فوهات مرتبة مركزيا ، على سبيل المثال ، متحد المحوروثلاثي المحاور 25,26 ، لا يمكنها إنشاء أنابيب متشعبة ؛ ومع ذلك ، يمكن تحقيق الهياكل المعقدة بطرق الزخرفة القربانية27. لم يتم إثبات أي من طرق الطباعة الحيوية هذه لتمكين النمذجة عالية الإنتاجية في المختبر - وهو مطلب حاسم للبحث الدوائي في اكتشاف الأدوية. هنا ، نقدم طريقة لتصنيع قنوات الأوعية الدموية البطانية بكفاءة مع التحكم الفعال في الأبعاد.
لقد أنشأنا نهجا مباشرا باستخدام ألواح الآبار الستة المتاحة تجاريا ، جنبا إلى جنب مع طريقة الزخرفة القربانية التي تقوم فيها الطابعة الحيوية بتصنيع قنوات الأوعية الدموية ذات الأحجام والأنماط المرغوبة داخل هيدروجيل ECM. تم زرع الخلايا البطانية للوريد السري البشري (HUVECs) لبطانة هذه القنوات وتقييم وظائف البطانة من خلال مقايسة النفاذية. يتيح هذا التصميم التروية بدون ضخ من خلال إنشاء خزانات وسائط على جانبي القناة ويستخدم التدفق المدفوع بالجاذبية بمساعدة الروك 2D شائع الاستخدام لتقليد الثقافة الديناميكية. يلغي هذا النهج الحاجة إلى المضخات التمعجية ويسهل قابلية تطوير هذه المنصة للتطبيقات عالية الإنتاجية. كما أن الطبيعة التي يتحكم فيها الكمبيوتر لتكنولوجيا الطباعة الحيوية 3D تبسط عملية التصنيع ، وبالتالي تقلل من احتمالية حدوث أخطاء أثناء التصنيع. يظهر نموذج VOP الوعد كأداة قيمة للاختبار الدوائي في اكتشاف الأدوية.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. توليد G-code للطابعة الحيوية
- لإنشاء مسار الطباعة وتصوره ، قم بزيارة أداة محاكاة G-code عبر الإنترنت (على سبيل المثال ، NCviewer).
- انقر على ملف جديد على الواجهة لإنشاء ملف G-code جديد.
- قم بإنشاء مسار طباعة عن طريق كتابة أوامر G-code يدويا للقناة القربانية وغرفة السيليكون. استخدم أبعاد لوحة قياسية من ستة آبار كمرجع لإنشاء الهندسة.
ملاحظة: يعتمد رمز G المستخدم هنا على رمز التحكم العددي بالكمبيوتر (CNC). يتم توفير وظائف كل أمر في الجدول التكميلي S1. وقد اختير شكل الصفائح ذات الستة آبار بسبب توافقها مع قارئات الصفائح الدقيقة التجارية وإعدادات الفحص المجهري وقدرتها على استيعاب كميات كافية من الوسائط لدعم نضوج البطانة، مما يقلل إلى أدنى حد من الحاجة إلى تغييرات متكررة في الوسائط. يمكن أيضا تكييف بروتوكول التصنيع هذا للاستخدام مع ألواح الآبار القياسية الأخرى. - بمجرد اكتمال رمز G ، انقر فوق حفظ ملف على الواجهة لتنزيل الملف بامتداد .nc.
ملاحظة: يمكن استخدام أي خوارزمية أخرى متاحة لإنشاء G-code لإنشاء مسارات الطباعة. يمكن التلاعب بهندسة القناة الوعائية في رمز G هذا.
2. تحضير أحبار الأضاحي وغرف السيليكون
ملاحظة: يتم سرد مصادر جميع المواد المستخدمة في هذا البروتوكول في جدول المواد.
- اجمع بين نوعين من بوليمرات السيليكون ، SE1700 و polydimethylsiloxane (PDMS) ، بنسبة 10: 2. أضف عامل معالجة لكل بوليمر بنسبة 10: 1 ، بوليمر إلى عامل معالجة.
- استخدم خلاطا كوكبيا لخلط خليط البوليمر وتفريغه جيدا عند 2000 دورة في الدقيقة.
- باستخدام ملعقة ، انقل بوليمر السيليكون المختلط إلى حقنة سعة 10 مل يمكن التخلص منها. قم بطرد الحقنة المحملة على حرارة 400 × جم لمدة 3 دقائق عند 5 درجات مئوية لضمان اتساق موحد وتجنب الفقاعات أثناء الطباعة.
ملاحظة: يجب استخدام حبر الغرفة في غضون 2 ساعة بعد إضافة عوامل المعالجة لضمان جودة الطباعة المثلى. قم بتخزين المحقنة على حرارة 5 درجات مئوية أثناء التحضير للطباعة. تساعد هذه العملية على إبطاء معالجة الحبر ، والتي يمكن أن تغير معلمات الطباعة. - قم بوزن Pluronic F-127 (PF127) لتحضير محلول مخزون بنسبة 40٪ (وزن / حجم) من PF127 في الماء المقطر.
- امزج محلول PF127 في خلاط كوكبي لمدة 3 دقائق عند 400 × جم لتحقيق التجانس. احتفظ بالمزيج المتجانس عند 4 درجات مئوية للذوبان الكامل ل PF127.
- تحضير محلول مخزون الثرومبين من 1000 وحدة / مل في محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS).
ملاحظة: قم بتخزين محلول مخزون الثرومبين في قسمة 100 ميكرولتر لتجنب دورات التجميد والذوبان المتكررة. يجب تخزين الحصصات عند -20 درجة مئوية لمدة لا تزيد عن 6 أشهر. - قبل الطباعة، قم بإعداد الحبر القرباني عن طريق خلط الثرومبين بتخفيف 1:10 مع PF127 إلى تركيز عمل نهائي بنسبة 36٪ (وزن/حجم) ل PF127 و100 وحدة/مل للثرومبين. لتحضير 1 مل من الحبر القرباني ، امزج 100 ميكرولتر من محلول مخزون الثرومبين مع 900 ميكرولتر من محلول المخزون PF127.
ملاحظة: عند تحضير الحبر القرباني لطباعة لوحة واحدة، يكون الحجم الإجمالي البالغ 1 مل أكثر من كاف.
3. عملية التصنيع
- قبل البدء في عملية التصنيع ، قم بمعالجة صفيحة من ستة آبار ببلازما الأكسجين (O2) بقوة 100 واط لمدة دقيقة واحدة.
- اتبع الإجراء الموضح في القسم 2 لتحضير كل من أحبار الأضاحي والسيليكون ، مع التأكد من خلو الأحبار من الفقاعات وخلطها بشكل متجانس للحصول على طباعة متسقة. قم بتحميل الأحبار بعناية في رأس طباعة الطابعة الحيوية. اضبط درجة حرارة رأس الطابعة الحيوية على 37 درجة مئوية للحبر القرباني و 5 درجات مئوية لحبر السيليكون.
- قم بتوصيل فوهة مدببة ذات خيط لولبي مزدوج 22 جم بحقنة السيليكون. بالنسبة للحبر القرباني ، اختر حجم الفوهة وفقا لقطر القناة المطلوب.
ملاحظة: عرضنا هنا ثلاثة أحجام للفوهات: 18 جم و20 جم و22 جم. معلمات الطباعة المثلى بما في ذلك ضغط الطباعة وسرعة رأس الطباعة موضحة في الجدول 1. - قم بتحميل رمز G المطلوب واضغط على وظيفة المؤازرة الجاهزة على واجهة برنامج bioprinter لمدة 3 ثوان. ضع اللوحة على المسرح عند نقطة بداية G-code وانقر فوق ابدأ لبدء عملية الطباعة.
ملاحظة: عادة ، يتطلب تصنيع لوحة واحدة تحتوي على ست غرف حوالي 1 ساعة و 10 دقائق. الخطوة 3.4 ، التي تتضمن تحميل وتنفيذ رمز G ، عرضة للتغيير اعتمادا على الطابعة الحيوية المحددة المستخدمة. تأكد من الحفاظ على الظروف المعقمة أثناء استخدام الطابعة الحيوية لتجنب التلوث. - ضع غطاء فوق اللوحة وانقل اللوحة إلى حاضنة CO2 مرطبة عند 37 درجة مئوية لمدة 72 ساعة لعلاج غرف السيليكون.
ملاحظة: على الرغم من أن معالجة السيليكون قد تحدث بمعدل أبطأ داخل الحاضنة ، يجب عدم وضع اللوحة داخل فرن جاف.
4. إعداد هيدروجيل وتضمين القناة
- تحضير أنبوب مخروطي 50 مل يحتوي على 20 مل من 1x PBS. ضع 0.01 جم من فينيل الليثيوم -2،4،6-ثلاثي ميثيل بنزويل فوسفينات (LAP) في الأنبوب المخروطي لصنع محلول LAP بنسبة 0.05٪ (وزن / حجم). دوامة حتى يذوب المسحوق تماما.
ملاحظة: لف الأنبوب المخروطي بورق القصدير لمنع التعرض للضوء. قم بتخزين محلول مخزون LAP عند 4 درجات مئوية. - أضف 3 جم من ميثاكريلات الجيلاتين (GelMA) و 0.2 جم من الفيبرينوجين إلى 20 مل من محلول LAP لتحقيق تركيز نهائي قدره 15٪ GelMA و 1٪ فيبرينوجين (يشار إليه باسم GelFib). ضع الخليط في حمام مائي 37 درجة مئوية ، واخلطه بشكل دوري حتى يذوب المحلول تماما.
- بعد التصنيع كما هو موضح في القسم 3 ، أضف 300 ميكرولتر من GelFib المسخن مسبقا في كل حجرة هيدروجيل لتضمين نمط التضحية. ربط GelMA بسرعة مع الأشعة فوق البنفسجية (UV) بطول موجي 405 نانومتر بكثافة 85 ميغاواط / سم2 لمدة 120 ثانية. كرر هذا الإجراء لجميع الآبار الأخرى.
ملاحظة: يرتبط الفيبرينوجين بسرعة عند ملامسته لنمط الذبيحة الذي يحتوي على الثرومبين. نوصي بإضافة هيدروجيل وإجراء تشابك الأشعة فوق البنفسجية بشكل فردي لكل بئر لتجنب الهلام غير المرغوب فيه ل GelMA في درجة حرارة الغرفة. بالإضافة إلى ذلك ، يجب الحفاظ على الظروف المعقمة لمنع التلوث أثناء عملية المعالجة بالأشعة فوق البنفسجية. - أضف 1 مل من DPBS إلى كل جانب من قناة الأوعية الدموية في كل بئر ، واحتفظ باللوحة عند 4 درجات مئوية لمدة 15 دقيقة لتسييل PF127.
- بعد 15 دقيقة ، قم بشفط DPBS ، وكرر الخطوة 4.5 3x للغسيل الكامل ل PF127.
- قبل إدخال الخلايا في القنوات ، قم بإدخال DMEM F12 الذي يحتوي على 1٪ Matrigel لمدة 30 دقيقة من خلال القنوات لتعزيز ارتباط الخلية.
5. ثقافة HUVEC
- وسط نمو الخلايا البطانية الدافئة (ECGM) في حمام مائي 37 درجة مئوية لمدة 30 دقيقة.
- في هذه الأثناء ، استرجع قارورة من HUVECs المحفوظة بالتبريد من خزان النيتروجين ، وقم بفك غطاء القارورة برفق ، ثم أعد شدها لتحرير النيتروجين من الخيوط. قم بإذابة الخلايا على الفور عن طريق غمر القارورة في حمام مائي 37 درجة مئوية لمدة 2 دقيقة ، مع ضمان بقاء كمية صغيرة من الثلج داخل القارورة. شطف القارورة مع 70 ٪ من الإيثانول لمنع التلوث.
ملاحظة: ارتد نظارات واقية عند استرداد الخلايا من خزان النيتروجين. يجب أن يبقى غطاء القارورة فوق مستوى الماء أثناء هذه العملية. - تحضير أنبوب مخروطي سعة 15 مل يحتوي على 5 مل من مخطط كهربية القلب المسخن مسبقا. باستخدام ماصة صغيرة ، انقل الخلايا المذابة بعناية من القارورة إلى الأنبوب المخروطي. لضمان عدم ترك أي خلايا وراءها ، أضف 1 مل من الوسط المسخن مسبقا الطازج إلى المبرد ، وشطف الداخل ، ونقل أي خلايا متبقية إلى الأنبوب المخروطي.
- جهاز طرد مركزي الأنبوب المخروطي عند 200 × جم لمدة 3 دقائق للحصول على حبيبات خلوية. تخلص من المادة الطافية ، وأعد تعليق الخلايا في 10 مل من الوسط الطازج ، وانقل الخلايا إلى قارورة T75 ، وضع القارورة داخل حاضنة CO2 مرطبة 37 درجة مئوية.
ملاحظة: هذه الخطوة مهمة لإزالة ثنائي ميثيل سلفوكسيد الموجود في وسط التجميد في cryovial من خلال الطرد المركزي. - قم بتحديث الوسط كل يوم حتى تصل الخلايا إلى التقاء 80-90٪.
6. الظهارة للقنوات
- قم بتسخين ECGM و DPBS ومحلول معادلة التربسين وحمض التربسين إيثيلين ديامينيترايتيك (TE) في حمام مائي بدرجة حرارة 37 درجة مئوية لمدة 30 دقيقة.
- عند التقاء 90٪ ، اشطف الخلايا في قارورة T75 مع 10 مل من DPBS ، وأضف 1 مل من 0.25٪ TE إلى القارورة ، واحتضانها لمدة 3 دقائق.
- اضغط برفق على جوانب القارورة وأضف 5 مل من محلول معادلة التربسين لتحييد TE. انقل الخلايا إلى أنبوب مخروطي سعة 15 مل. استخدم 5 مل من ECGM الطازج لجمع الخلايا المتبقية وإضافتها إلى الأنبوب المخروطي.
- جهاز طرد مركزي الأنبوب المخروطي عند 250 × جم لمدة 3 دقائق لجمع حبيبات الخلية.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 1 مل من ECGM الطازج. عد الخلايا باستخدام مقياس الدم وكرر الخطوة 6.4 للحصول على حبيبات خلوية. إعادة تعليق 3 ملايين خلية في 90 ميكرولتر من ECGM الطازجة.
- قبل إدخال تعليق الخلية في القناة ، قم بشفط القناة بالمكنسة الكهربائية لفترة وجيزة لتنظيف التجويف.
ملاحظة: تجنب شفط القناة لفترة طويلة لتجنب الإضرار بسلامتها. - قم بتحميل القناة برفق بتعليق خلية بكثافة بذر تبلغ 0.5 مليون خلية لكل بئر. استخدم ماصة صغيرة لإضافة ~ 15 ميكرولتر من هذا التعليق لملء القناة.
ملاحظة: قد تختلف كثافة البذر حسب حجم القناة. تم تحسين هذه الكثافة لقناة مطبوعة بفوهة 20 جيجا وقطر داخلي يبلغ حوالي 900 ميكرومتر. - ضع اللوحة بشكل مسطح داخل الحاضنة لمدة 2 ساعة. بعد ذلك ، اقلب اللوحة إلى 180 درجة ، مع الحفاظ عليها في وضع مسطح لمدة 2 ساعة التالية.
- بعد 4 ساعات ، اغسل القناة باستخدام DPBS لإزالة الخلايا غير الملتصقة والميتة. أضف 2 مل من ECGM الطازج إلى كل بئر (1 مل لكل جانب من جوانب القناة). ابدأ الثقافة الديناميكية على الروك بزاوية إمالة 10 درجات و 5 دورات في الدقيقة عن طريق وضع اللوحة على الروك مع القنوات الموازية لاتجاه التأرجح. قم بتحديث وسيط النمو كل يوم.
ملاحظة: تعزز الثقافة الديناميكية التبادل الوسيط بين الخزانات والقنوات وتساعد الخلايا على التكاثر بين عشية وضحاها.
7. تقييم نضج البطانة
- قم بتسخين ECGM و DPBS في حمام مائي بدرجة حرارة 37 درجة مئوية لمدة 30 دقيقة وكاشف Cell Counting Kit-8 (CCK8) في درجة حرارة الغرفة.
- اصنع حلا عمليا ل CCK8 عن طريق خلط 100 ميكرولتر من كاشف CCK8 مع 1 مل من ECGM الطازج لكل بئر. أثناء العمل من أجل لوحة / 6 قنوات ، قم بإعداد 600 ميكرولتر من كاشف CCK8 من خلال دمجه مع 6 مل من ECGM الطازج.
- قم بإزالة وسط النمو عن طريق الشفط وشطف القنوات باستخدام DPBS. أضف 1 مل من محلول عمل CCK8 إلى كل بئر واترك اللوحة مسطحة داخل الحاضنة لمدة 30 دقيقة. بعد ذلك ، ابدأ الثقافة الديناميكية على الروك كما هو موضح في الخطوة 6.9 ، واستمر في هذه العملية لمدة 3 ساعات القادمة.
- بعد 3 ساعات ، قم بإزالة المحتويات من كل بئر عن طريق إمالة اللوحة إلى جانب واحد ، ونقلها إلى لوحة جديدة من ستة آبار. شطف القنوات مع DPBS وإضافة وسط جديد.
ملاحظة: قم بتغطية اللوحة بورق الألمنيوم حتى قياس الامتصاص. الحفاظ على حجم كواشف ثابت عبر جميع الآبار لضمان قراءات موحدة. أثناء السحب ، تجنب بعناية إدخال فقاعات الهواء ، والتي يمكن أن تعطل دقة قراءات الكثافة البصرية. - بعد هز اللوحة برفق لمدة 15 ثانية لضمان خلط متساو للألوان ، استخدم قارئ microplate لقياس الامتصاص عند 450 نانومتر.
- كرر هذا الإجراء على فترات زمنية محددة مسبقا. احسب متوسط الكثافة البصرية لكل نقطة زمنية وارسم منحنى نمو في برنامج الرسوم البيانية. يشير هذا المنحنى إلى النضج النسبي للبطانة بمرور الوقت.
8. مقايسة النفاذية
- قم بإزالة الوسيط من بئر واحد مهم.
ملاحظة: بالنسبة لفحص النفاذية ، يوصى بمعالجة كل بئر على حدة لمنع القنوات الأخرى من الجفاف ، مما قد يغير نفاذية الأوعية الدموية. - تحضير 6 مل من محلول 0.1 مجم / مل من ديكستران مقترن FITC عن طريق إذابة 70 كيلو دالتون FITC ديكستران في DPBS.
ملاحظة: قم بإعداد محلول مخزون 20 مجم / مل من FITC dextran عن طريق إذابة 100 مجم من FITC dextran في 5 مل من DPBS. بعد تحريك المحلول برفق ، قم بتحويل 500 ميكرولتر إلى أنابيب سعة 1.5 مل لتجنب دورات التجميد والذوبان المتكررة. يمكن تخزين هذه القسامات في -20 درجة مئوية لمدة أقصاها 6 أشهر. قبل إجراء الفحص ، قم بتخفيف محلول المخزون إلى تركيز عمل قدره 0.1 مجم / مل. - ضع اللوحة بإحكام على مرحلة المجهر واضبط تكبير الهدف في وضع تباين الطور لضمان رؤية واضحة لجدار القناة في منطقة الاهتمام ، جنبا إلى جنب مع الجل الموجود في مكان قريب ، داخل مجال الرؤية.
ملاحظة: لتقييم النفاذية الفعالة ، حاول تعظيم مساحة الجل المحيطة بمنطقة الاهتمام في مجال الرؤية ؛ هذا الجانب هو مفتاح الرصد الدقيق لنقل ديكستران. - بعد التركيز على المنطقة المرغوبة ، قم بالتغيير من تباين الطور إلى وضع التألق. ضمن علامة التبويب الحصول على الصور ، أضف FITC إلى قناة المجال العريض ، واحصل على صورة قبل إضافة محلول ديكستران ، لحساب شدة مضان الخلفية. بعد ذلك ، أضف 1 مل من محلول عمل FITC dextran إلى جانب واحد من القناة واترك المحلول يتدفق نحو الجانب الآخر من البئر ، مدفوعا بفرق الضغط الهيدروستاتيكي.
- احصل على الصور على فترات زمنية محددة مسبقا - بشكل متكرر أكثر للقنوات ذات النفاذية العالية وأقل تكرارا لتلك ذات النفاذية المنخفضة.
9. قياس شدة التألق في ImageJ
- في برنامج تحليل الصور ImageJ ، قم بقياس الشدة عند النقطة الزمنية الأولية (It1) ، ومتوسط الشدة التي لوحظت في النقطة الزمنية اللاحقة (It2) ، والشدة الناتجة عن ضوضاء الخلفية (Ib) ، كما هو موضح أدناه. استخدم المعادلة (1) لحساب معامل النفاذية (Pd). يشير T1 وT 2 إلى النقاط الزمنية الأولية واللاحقة لالتقاط الصور.
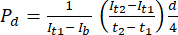 (1)
(1)- ابدأ تشغيل ImageJ، وافتح الصورة التي تم الحصول عليها في النقطة الزمنية الأولية.
- اضبط المقياس في ImageJ. انتقل إلى التحليل | تعيين مقياس. أدخل المقياس المعروف ووحدة القياس.
- حدد أداة المستطيل وارسم مستطيلا فوق مساحة الجل حيث يلزم قياس شدة التألق.
- انتقل إلى التحليل | قم بتعيين القياسات وتأكد من تحديد متوسط القيمة الرمادية .
ملاحظة: يقيس هذا الخيار متوسط الكثافة داخل المنطقة المحددة. يمكن اختيار معلمات أخرى حسب الحاجة للتحليل المحدد. - مع استمرار تحديد المنطقة، انتقل إلى تحليل | قم بالقياس أو ببساطة اضغط على M. انتظر حتى تفتح نافذة النتائج ، والتي تعرض متوسط شدة التألق وأي معلمات أخرى محددة.
- خذ ثلاثة قياسات واحسب متوسط قيمة شدة التألق في جدول بيانات.
- كرر هذا الإجراء للصور الملتقطة في النقطة الزمنية اللاحقة t2 ، وكذلك تلك التي تم التقاطها قبل إضافة محلول ديكستران لحساب شدة التألق في النقطة الزمنية اللاحقة ، لتحديد مضان الخلفية.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم تصنيع منصة VOP ، التي تتميز بالمرونة في الحجم والنمط ، بنظام طباعة حيوية متعدد الرؤوس. تم زرع القنوات ، المجوفة والقادرة على التروية ، باستخدام HUVECs لتسهيل البطانة وتم تقييمها لاحقا باستخدام مقايسة النفاذية (الشكل 1 أ). لإثبات قدرة التصنيع متعددة النطاقا?...
Access restricted. Please log in or start a trial to view this content.
Discussion
الاستفادة من الدقة والأتمتة والطبيعة التي تسيطر عليها الكمبيوتر من تكنولوجيا الطباعة الحيوية 3D ، أنشأنا طريقة مبسطة لتصنيع القنوات الوعائية في لوحات قياسية من ستة آبار ، والتي تم اختيارها لتوافقها مع قارئات الصفائح الدقيقة التجارية وإعدادات التصوير المجهري. يمكن أن ي?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن أصحاب البلاغ عدم وجود مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا العمل من خلال منح المؤسسة الوطنية للبحوث الكورية (NRF) الممولة من الحكومة الكورية (وزارة العلوم وتكنولوجيا المعلومات والاتصالات ، MSIT) [No. NRF-2019R1C1C1009606 ؛ رقم 2020R1A5A8018367; و لا. RS-2024-00423107]. تم دعم هذا البحث من قبل برنامج تطوير التكنولوجيا الحيوية والطبية لمنح NRF الممولة من MSIT [No. NRF-2022M3A9E4017151 ورقم. NRF-2022M3A9E4082654]. تم دعم هذا العمل من قبل برنامج الابتكار التكنولوجي [رقم 20015148] ومشروع الخيميائي [رقم 20012378] بتمويل من وزارة التجارة والصناعة والطاقة (MOTIE ، كوريا). ويدعم هذا العمل أيضا المعهد الكوري للتخطيط والتقييم للتكنولوجيا في الأغذية والزراعة والغابات (IPET) من خلال برنامج تكنولوجيات الزراعة وتقارب الأغذية لتنمية القوى العاملة البحثية، بتمويل من وزارة الزراعة والأغذية والشؤون الريفية (MAFRA) [No. RS-2024-00397026].
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
References
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -L., Wautier, M. -P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958(2022).
- Park, W., Lee, J. -S., Gao, G., Kim, B. S., Cho, D. -W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696(2023).
- Sun, H. -J., Wu, Z. -Y., Nie, X. -W., Bian, J. -S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568(2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778(2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771(2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267(2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Rotman, D. Can Pfizer deliver. MIT Technology Review. , Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168(2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141(2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012(2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798(2017).
- Cho, W. -W., Ahn, M., Kim, B. S., Cho, D. -W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093(2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027(2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102(2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744(2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022(2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863(2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345(2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171(2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683(2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938(2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043(2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723(2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071(2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760(2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151(2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423(2023).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved