A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטת הדפסה ביולוגית בתפוקה גבוהה למידול חדירות כלי דם בלוחות סטנדרטיים בעלי שש בארות עם גודל וגמישות דפוס
In This Article
Summary
אנו מציגים פרוטוקול לייצור תפוקה גבוהה של תעלות כלי דם עם גדלים גמישים ודפוסים רצויים על לוח סטנדרטי של שש בארות באמצעות טכנולוגיית הדפסה ביולוגית תלת-ממדית, המכונה כלי על צלחת (VOP). לפלטפורמה זו יש פוטנציאל לקדם את הפיתוח של טיפולים להפרעות הקשורות לאנדותל בסיכון.
Abstract
חדירות כלי דם היא גורם מפתח בפיתוח טיפולים להפרעות הקשורות לאנדותל פגוע, כגון תפקוד לקוי של האנדותל בעורקים הכליליים ותפקוד לקוי של מחסום הדם-מוח. טכניקות הייצור הקיימות אינן משכפלות כראוי את השונות הגיאומטרית ברשתות כלי הדם בגוף האדם, המשפיעה באופן משמעותי על התקדמות המחלה; יתר על כן, טכניקות אלה כוללות לעתים קרובות הליכי ייצור רב-שלביים המעכבים את הייצור בתפוקה גבוהה הדרושה לבדיקות פרמקולוגיות. מאמר זה מציג פרוטוקול הדפסה ביולוגית ליצירת רקמות כלי דם מרובות עם דפוסים וגדלים רצויים ישירות על לוחות סטנדרטיים של שש בארות, תוך התגברות על אתגרי הרזולוציה והפרודוקטיביות הקיימים בטכנולוגיית הדפסה ביולוגית. גישת ייצור פשוטה הוקמה כדי לבנות שש תעלות חלולות וניתנות לבודר בתוך הידרוג'ל, אשר לאחר מכן רופדו בתאי אנדותל של ורידים טבוריים אנושיים ליצירת אנדותל פונקציונלי ובשל. האופי הנשלט על ידי מחשב של הדפסה ביולוגית בתלת-ממד מבטיח יכולת שחזור גבוהה ודורש פחות שלבי ייצור ידניים בהשוואה לשיטות מסורתיות. זה מדגיש את הפוטנציאל של VOP כפלטפורמה יעילה בעלת תפוקה גבוהה למידול חדירות כלי דם וקידום גילוי תרופות.
Introduction
רשת כלי הדם בכל גוף האדם מתפקדת כמחסום תחבורה חיוני על ידי ויסות דינמי של חילופי מולקולות ותאים בין הדם והרקמות הסובבות. ויסות זה חיוני למניעת בצקת רקמות ומאפשר חילופי חומרים מזינים ותאים סלקטיביים, ובכך תומך בחילוף חומרים ברקמה והומאוסטזיס1. חדירות אנדותל משתנה, גורם במצבים בריאותיים רבים, משפיעה הן על חומרת המחלה והן על יעילות הטיפול2. אנדותל כלי הדם פועל כמחסום סלקטיבי, המאפשר את המעבר בין כלי דם, רקמות ואיברים. ויסות זה כרוך במספר מנגנונים, כגון סינון בסיסי של מומסים ומולקולות קטנות, שיבוש מכוון של מחסום כלי הדם, והשפעת מולקולות כגון פרוסטגלנדינים וגורמי גדילה על רמות חדירות3.
גורמי מפתח בוויסות זה כוללים צמתים של תאי אנדותל, נדידת לויקוציטים והתפקוד של מחסום הדם-מוח4. בהתחשב במורכבותו, התהליך משתנה בסביבות שונות, מערב סוגים שונים של כלי דם ומשתמש במסלולים אנטומיים נפרדים. הבנת היסודות הביולוגיים של חדירות כלי הדם חיונית לפיתוח גישות טיפוליות לטיפול במצבים הקשורים לחדירות כלי דם חריגה. שמירה על חדירות כלי הדם חיונית לבריאות מערכת כלי הדם והרקמות הסובבות אותה; כתוצאה מכך, פגיעה בתפקוד זה מובילה לתפקוד לקוי של האנדותל, מצב שבו האנדותל מאבד את תפקודו הרגיל.
תפקוד לקוי של אנדותל הוא קודמן למספר מחלות נפוצות בבני אדם, כולל יתר לחץ דם, מחלת עורקים כליליים, סוכרת וסרטן 5,6,7. מצב זה יכול להתבטא במספר דרכים, כולל ירידה בהרחבת כלי הדם, חדירות מוגברת של כלי הדם ונטייה למצב פרו-דלקתי. מצב פתולוגי זה הוא השלב המוקדם ביותר של מספר בעיות לב וכלי דם קריטיות, כגון מחלת לב כלילית, שבץ מוחי ומחלת עורקים היקפיים8, אשר ממשיכים להיות הגורמים המובילים לתמותה בארצות הברית1. תפקוד לקוי של אנדותל משפיע על בריאות הלב וכלי הדם, כמו גם על מחסום הדם-מוח (BBB) וממלא תפקיד מרכזי בהתקדמות של הפרעות נוירולוגיות שונות. תפקוד לקוי יכול להגביר את חדירות BBB, ובכך לאפשר לרעלנים, פתוגנים ותאי מערכת החיסון לחדור למערכת העצבים המרכזית ולתרום להפרעות נוירולוגיות כגון שבץ, מחלת אלצהיימר, טרשת נפוצה וזיהומים במוח9.
תפקוד לקוי של אנדותל בסוכרת מסומן על ידי היכולת הנפגעת של האנדותל לווסת את טונוס כלי הדם ולייצר מתווכים מרחיבי כלי דם, כגון תחמוצת החנקן, מה שמוביל לפגיעה בהרחבת כלי הדם10. מצב זה מוחמר על ידי מסלולים הנגרמים על ידי היפרגליקמיה כגון הפעלת חלבון קינאז C ועקה חמצונית, התורמים באופן משמעותי להתקדמות מחלת כלי דם סוכרתיים11. יתר על כן, סביבה דלקתית נמצאה כמגבירה את היצמדות תאי הגידול לתאי אנדותל מיקרו-וסקולריים במוח בעוד אנדותל דולף דווח כגורם מרכזי בגרורות סרטניות12,13. הגיאומטריה של כלי הדם נמצאה כמשפיעה ישירות על גרורות בסרטן המוח. תאי הגידול מתחברים באופן מועדף לאזורים בעלי עקמומיות כלי דם גדולה יותר7. ממצא זה מדגיש את חשיבותה של גיאומטריית כלי הדם בגרורות סרטניות. חשוב מכך, במצבים כגון פיברוזיס וסרטן, הפרעה בתפקוד מחסום האנדותל לא רק ממלאת תפקיד בהתפתחות המחלה, אלא גם מעכבת את יעילות הטיפול בכך שהיא מעכבת מתן תרופות נאות14. מחקר על חדירות כלי דם הוא חיוני לקידום הטיפול במחלות לב וכלי דם ומציע תובנות לניהול מחלות אחרות הקשורות לתפקוד כלי דם נפגע.
בהתחשב בתפקיד המכריע של חדירות כלי הדם בבריאות ובחולי, מחקרים רבים התמקדו בבחינת האופי הסלקטיבי של מחסום האנדותל לפיתוח טיפולי באמצעות מודלים של בעלי חיים, לצד פלטפורמות מסורתיות של בדיקות דו-ממדיות ותלת-ממדיות במבחנה. עם זאת, מודלים של בעלי חיים יש מגבלות בגלל הבדלים ספציפיים למין מסוים ובעיות אתיות, כמו גם עלויות גבוהות15,16. לדוגמה, פייזר הצהירה ב-2004 כי במהלך 10 השנים שקדמו לכך, היא הוציאה יותר מ-2 מיליארד דולר על פיתוחי תרופות שהראו השפעות מבטיחות במודלים של בעלי חיים, אך בסופו של דבר נכשלו בשלבי ניסויים מתקדמיםבבני אדם 17. יתר על כן, מודלים דו-ממדיים מסורתיים אינם מחקים במדויק את הארכיטקטורה התלת-ממדית (3D) ואת המבנה הגיאומטרי המורכב של ערוצי כלי הדם.
עם ההתקדמות בטכנולוגיות ייצור ביולוגי, מאמצים נרחבים כוונו לייצור תעלות כלי דם תוך שחזור ארכיטקטורת תלת ממד. ניתן לייצר ביעילות תעלות כלי דם מיקרוסקולריות בתוך שבבים מיקרופלואידים באמצעות ליתוגרפיה רכה, ובכך להציע יתרון של ניתוח בזמן אמת18,19. שיטות חלופיות, כגון יציקת הידרוג'ל או כריכת יריעות תאים סביב תבנית או מנדל, ניתן להשתמש כדי ליצור מבנים צינוריים עצמאיים בקוטרהרצוי 20,21. עם זאת, שיטות אלה יש מגבלות; לדוגמה, שבבים מיקרופלואידים מוגבלים לתצורות מיקרו-ערוציות, ויציקת הידרוג'ל סביב תבנית אינה משכפלת ביעילות גיאומטריות מרובות.
עם הופעתה של טכנולוגיית הדפסה ביולוגית תלת-ממדית22, שכפול גיאומטריות מורכבות על ידי הפקדה מדויקת של חומרי הידרוג'ל שונים מבוססי מטריצה חוץ-תאית (ECM) הפך לאפשרי 23,24. שיטות הדפסה ביולוגית מסוימות, כגון אלה המשתמשות בחרירים מסודרים באופן קונצנטרי, למשל, קואקסיאלי וטריאקסיאלי25,26, אינן יכולות ליצור צינורות מפוצלים; עם זאת, מבנים מורכבים ניתן להשיג עם שיטות דפוס הקרבה27. אף אחת משיטות ההדפסה הביולוגית הללו לא הוכחה כמאפשרת מידול במבחנה בתפוקה גבוהה - דרישה חיונית למחקר פרמקולוגי בגילוי תרופות. כאן אנו מציגים שיטה לייצור יעיל של תעלות כלי דם אנדותליות עם שליטה יעילה על ממדים.
ביססנו גישה פשוטה באמצעות לוחות בעלי שש בארות הזמינים באופן מסחרי, בשילוב עם שיטת דפוס הקרבה שבה מדפסת ביולוגית מייצרת תעלות כלי דם בגדלים ודפוסים רצויים בתוך הידרוג'ל ECM. תאי אנדותל של ורידים טבוריים אנושיים (HUVECs) נזרעו כדי לאנדותל תעלות אלה ולהעריך את הפונקציונליות של אנדותל באמצעות בדיקת חדירות. תכנון זה מאפשר זילוח ללא משאבה על ידי יצירת מאגרי מדיה משני צידי הערוץ ומשתמש בזרימה מונעת כבידה בעזרת נדנדה דו-ממדית נפוצה כדי לחקות את התרבות הדינמית. גישה זו מבטלת את הצורך במשאבות פריסטלטיות ומקלה על המדרגיות של פלטפורמה זו עבור יישומים בעלי תפוקה גבוהה. האופי הנשלט על ידי מחשב של טכנולוגיית הדפסה ביולוגית תלת-ממדית גם מייעל את תהליך הייצור, ובכך מקטין את הסבירות לטעויות במהלך הייצור. מודל VOP מראה הבטחה ככלי רב ערך לבדיקות פרמקולוגיות בגילוי תרופות.
Protocol
1. יצירת קוד G עבור המדפסת הביולוגית
- כדי ליצור ולהציג באופן חזותי את נתיב ההדפסה, בקר בכלי סימולציה מקוון של G-code (לדוגמה, NCviewer).
- לחץ על קובץ חדש סמל בממשק כדי ליצור קובץ G-code חדש.
- צור נתיב הדפסה על-ידי כתיבה ידנית של פקודות G-code עבור ערוץ ההקרבה ותא הסיליקון. השתמש במידות של לוח סטנדרטי בעל שש בארות כנקודת ייחוס ליצירת הגיאומטריה.
הערה: קוד G המשמש כאן מבוסס על קוד בקרה נומרית ממוחשבת (CNC). הפונקציות של כל פקודה מסופקות בטבלה משלימה S1. פורמט הלוח בעל שש הקידוחים נבחר בשל התאמתו לקוראי מיקרו-צלחות מסחריים ולמערכי מיקרוסקופיה ויכולתו להכיל נפחים מספיקים של מדיה לתמיכה בהבשלת אנדותל, ובכך למזער את הצורך בשינויי מדיה תכופים. פרוטוקול ייצור זה יכול להיות מותאם גם לשימוש עם לוחות באר סטנדרטיים אחרים. - לאחר השלמת קוד G, לחץ על שמור קובץ סמל בממשק כדי להוריד את הקובץ עם סיומת .nc.
הערה: ניתן להשתמש בכל אלגוריתם יצירת G-code זמין אחר כדי ליצור את נתיבי ההדפסה. הגיאומטריה של תעלת כלי הדם ניתנת למניפולציה בקוד G זה.
2. הכנת דיו להקרבת ותא סיליקון
הערה: מקורות עבור כל החומרים המשמשים בפרוטוקול זה מפורטים בטבלת החומרים.
- שלבו שני סוגים של פולימרי סיליקון, SE1700 ופולידימתילסילוקסאן (PDMS), ביחס של 10:2. הוסף חומר ריפוי של כל פולימר ביחס של 10:1, פולימר לחומר ריפוי.
- השתמשו במערבל פלנטרי כדי לערבב ולנטרל ביסודיות את תערובת הפולימרים ב-2,000 סל"ד.
- בעזרת מרית, מעבירים את פולימר הסיליקון המעורב למזרק חד פעמי בנפח 10 מ"ל. צנטריפוגה את המזרק הטעון ב 400 × גרם למשך 3 דקות ב 5 ° C כדי להבטיח עקביות אחידה ולמנוע בועות במהלך ההדפסה.
הערה: יש להשתמש בדיו התא תוך שעתיים לאחר הוספת חומרי הריפוי כדי להבטיח איכות הדפסה מיטבית. אחסנו את המזרק בטמפרטורה של 5°C בזמן ההכנה להדפסה. תהליך זה מסייע להאט את ריפוי הדיו, דבר שעלול לשנות את פרמטרי ההדפסה. - שקול F-127 פלורוני (PF127) להכנת תמיסת מלאי של 40% (w/v) של PF127 במים מזוקקים.
- ערבבו את תמיסת PF127 במערבל פלנטרי במשך 3 דקות ב-400 × גרם כדי להשיג הומוגניות. שמור את התערובת הומוגנית על 4 ° C להמסה מלאה של PF127.
- הכינו תמיסת מלאי טרומבין של 1,000 יחידות/מ"ל במי מלח חוצצי פוספט (DPBS) של Dulbecco.
הערה: אחסן תמיסת מלאי תרומבין ב 100 μL aliquots כדי למנוע מחזורי הקפאה-הפשרה חוזרים ונשנים. aliquots צריך להיות מאוחסן ב -20 °C במשך לא יותר מ 6 חודשים. - לפני ההדפסה, הכינו דיו להקרבה על ידי ערבוב טרומבין בדילול של 1:10 עם PF127 לריכוז עבודה סופי של 36% (w/v) עבור PF127 ו-100 יחידות למ"ל עבור טרומבין. כדי להכין 1 מ"ל של דיו הקרבה, ערבבו 100 מיקרוליטר של תמיסת מלאי טרומבין עם 900 מיקרוליטר של תמיסת מלאי PF127.
הערה: בעת הכנת דיו ההקרבה להדפסת לוח יחיד, נפח כולל של 1 מ"ל הוא די והותר.
3. תהליך הייצור
- לפני תחילת תהליך הייצור, טפל בצלחת בת שש בארות עם פלזמה חמצן (O2) בחוזק של 100 וואט למשך דקה אחת.
- בצע את ההליך המתואר בסעיף 2 כדי להכין הן את דיו ההקרבה והן את דיו הסיליקון, וודא שצבעי הדיו נקיים מבועות ומעורבבים בצורה הומוגנית להדפסה עקבית. טען בזהירות את צבעי הדיו בראש ההדפסה של המדפסת הביולוגית. הגדר את טמפרטורת ראש המדפסת הביולוגית ל- 37°C עבור דיו ההקרבה ו- 5°C עבור דיו הסיליקון.
- חבר זרבובית מחודדת חוט בורג כפול 22 G למזרק הסיליקון. עבור דיו הקרבה, בחר את גודל הזרבובית בהתאם לקוטר הערוץ הרצוי.
הערה: כאן, הדגמנו שלושה גדלים של חרירי: 18 G, 20 G ו- 22 G. פרמטרי הדפסה אופטימליים, כולל לחץ הדפסה ומהירות ראש הדפסה, מתוארים בטבלה 1. - טען את קוד ה-G הרצוי ולחץ על פונקציית סרוו מוכן בממשק התוכנה של המדפסת הביולוגית למשך 3 שניות. מקם את הלוח על הבמה בנקודת ההתחלה של G-code ולחץ על התחל כדי להתחיל בתהליך ההדפסה.
הערה: בדרך כלל, ייצור לוח אחד המכיל שישה תאים דורש כשעה ו-10 דקות. שלב 3.4, הכולל טעינה וביצוע של קוד G, כפוף לשינויים בהתאם למדפסת הביולוגית הספציפית שבה נעשה שימוש. ודא שהתנאים הסטריליים נשמרים בעת השימוש במדפסת הביולוגית כדי למנוע זיהום. - מניחים מכסה מעל הצלחת ומעבירים את הצלחת לאינקובטור CO2 לח בטמפרטורה של 37°C למשך 72 שעות כדי לרפא את תאי הסיליקון.
הערה: למרות שריפוי הסיליקון עשוי להתרחש בקצב איטי יותר בתוך האינקובטור, אין להניח את הצלחת בתוך תנור יבש.
4. הכנת הידרוג'ל והטמעת תעלה
- הכינו צינור חרוטי 50 מ"ל המכיל 20 מ"ל של 1x PBS. יש להכניס 0.01 גרם של ליתיום פניל-2,4,6-טרימתילבנזואילפוספינאט (LAP) לתוך הצינור החרוטי כדי ליצור תמיסת LAP של 0.05% (w/v). מערבבים אותו עד שהאבקה מומסת לחלוטין.
הערה: עטוף את הצינור החרוטי בנייר כסף כדי למנוע חשיפה לאור. אחסן את תמיסת מלאי LAP ב- 4 ° C. - הוסף 3 גרם של ג'לטין מתקרילט (GelMA) ו 0.2 גרם של פיברינוגן ל 20 מ"ל של תמיסת LAP כדי להשיג ריכוז סופי של 15% GelMA ו 1% פיברינוגן (המכונה GelFib). מניחים את התערובת באמבט מים של 37 מעלות צלזיוס, ומערבבים מעת לעת עד שהתמיסה מומסת במלואה.
- לאחר הייצור כמתואר בסעיף 3, הוסף 300 μL של GelFib שחומם מראש לכל תא הידרוג'ל כדי להטמיע את תבנית ההקרבה. קשר במהירות את ה- GelMA עם אור אולטרה סגול (UV) באורך גל של 405 ננומטר בעוצמה של 85 mW / cm2 למשך 120 שניות. חזור על הליך זה עבור כל הבארות האחרות.
הערה: פיברינוגן מצטלב במהירות במגע עם דפוס ההקרבה המכיל טרומבין. אנו ממליצים להוסיף הידרוג'ל ולבצע קרוסלינקינג UV בנפרד עבור כל באר כדי למנוע ג'לציה לא רצויה של GelMA בטמפרטורת החדר. בנוסף, יש לשמור על תנאים סטריליים כדי למנוע זיהום במהלך תהליך ריפוי UV. - הוסף 1 מ"ל של DPBS לכל צד של תעלת כלי הדם בכל באר, ולשמור את הצלחת ב 4 ° C במשך 15 דקות כדי לנזול את PF127.
- לאחר 15 דקות, יש לשאוב את ה-DPBS ולחזור על שלב 4.5 3x לשטיפה מלאה של PF127.
- לפני החדרת תאים לתעלות, יש לערבב DMEM F12 המכיל 1% מטריג'ל למשך 30 דקות דרך התעלות כדי לשפר את חיבור התא.
5. תרבות HUVEC
- מדיום גידול תאי אנדותל טרום חם (ECGM) באמבט מים של 37 מעלות צלזיוס למשך 30 דקות.
- בינתיים, שלפו בקבוקון של HUVECs שמורים בהקפאה ממיכל החנקן, שחררו בעדינות את מכסה הבקבוקון, ואז הדקו אותו מחדש כדי לשחרר חנקן מהחוטים. מיד להפשיר את התאים על ידי טבילת הבקבוקון באמבט מים 37 מעלות צלזיוס במשך 2 דקות, להבטיח כי כמות קטנה של קרח נשאר בתוך הבקבוקון. שטפו את הבקבוקון באתנול 70% כדי למנוע זיהום.
הערה: יש להרכיב משקפי מגן בעת שליפת תאים ממיכל החנקן. מכסה הבקבוקון חייב להישמר מעל פני המים בתהליך זה. - הכינו צינור חרוטי 15 מ"ל המכיל 5 מ"ל של ECGM שחומם מראש. בעזרת מיקרופיפטה, מעבירים בזהירות את התאים המופשרים מהבקבוקון לתוך הצינור החרוט. כדי להבטיח שלא יישארו תאים מאחור, הוסף 1 מ"ל של מדיום טרי שחומם מראש לקריוביאל, שטוף את החלק הפנימי והעבר את כל התאים הנותרים לתוך הצינור החרוט.
- צנטריפוגה את הצינור החרוטי ב 200 × גרם במשך 3 דקות כדי לקבל גלולה התא. השליכו את הסופרנטנט, השהו מחדש את התאים ב-10 מ"ל של תווך טרי, העבירו את התאים לצלוחית T75 והניחו את הבקבוק בתוך אינקובטור CO2 לח בטמפרטורה של 37 מעלות צלזיוס.
הערה: שלב זה חשוב כדי להסיר dimethyl sulfoxide נוכח בתווך ההקפאה ב cryovial באמצעות צנטריפוגה. - רעננו את המדיום אחת ליומיים עד שהתאים יגיעו למפגש של 80-90%.
6. אנדוטליזציה של ערוצים
- חימום מראש של ECGM, DPBS, תמיסה מנטרלת טריפסין וחומצה אתילאנדיאמין-טטראצטית (TE) באמבט מים של 37°C למשך 30 דקות.
- במפגש של 90%, שטפו את התאים בבקבוק T75 עם 10 מ"ל של DPBS, הוסיפו 1 מ"ל של 0.25% TE לצלוחית, ודגרו עליו במשך 3 דקות.
- טפחו בעדינות על דפנות הבקבוק והוסיפו 5 מ"ל של תמיסה מנטרלת טריפסין כדי לנטרל את TE. מעבירים את התאים לצינור חרוטי של 15 מ"ל. השתמש 5 מ"ל של ECGM טרי כדי לאסוף את התאים הנותרים ולהוסיף אותם צינור חרוט.
- צנטריפוגה את הצינור החרוטי ב 250 × גרם במשך 3 דקות כדי לאסוף את גלולת התא.
- השליכו את הסופרנאטנט והשהו מחדש את גלולת התא ב-1 מ"ל של אקג"מ טרי. ספור את התאים עם המוציטומטר וחזור על שלב 6.4 כדי לקבל גלולת תא. להשהות מחדש 3 מיליון תאים ב 90 μL של ECGM טרי.
- לפני הכנסת תרחיף התא לתעלה, יש לשאוב לזמן קצר את שאיבת התעלה כדי לנקות את הלומן.
הערה: יש להימנע מניניקה ממושכת של התעלה כדי למנוע פגיעה בשלמותה. - טוענים בעדינות את התעלה בתרחיף תאים בצפיפות זריעה של 0.5 מיליון תאים לבאר. השתמש micropipette להוסיף ~ 15 μL של השעיה זו כדי למלא את התעלה.
הערה: צפיפות הזריעה עשויה להשתנות בהתאם לגודל הערוץ. צפיפות זו מותאמת לתעלה המודפסת עם פייה של 20 G וקוטר פנימי של כ- 900 מיקרומטר. - מניחים את הצלחת שטוחה בתוך האינקובטור למשך שעתיים. לאחר מכן, הפוך את הצלחת ל- 180°, ושמור אותה במצב שטוח למשך השעתיים הבאות.
- לאחר 4 שעות, שטפו את התעלה עם DPBS כדי להסיר תאים שאינם דבקים ומתים. הוסף 2 מ"ל של ECGM טרי לכל באר (1 מ"ל לכל צד של התעלה). התחל את התרבות הדינמית על נדנדה בזווית הטיה של 10° ו- 5 סל"ד על ידי מיקום הלוח על הנדנדה כאשר התעלות מקבילות לכיוון הנדנדה. רעננו את מדיום הגידול אחת ליומיים.
הערה: תרבית דינמית משפרת את חילופי התווך בין המאגרים והתעלות ומסייעת לתאים להתרבות בן לילה.
7. הערכת הבשלת אנדותליום
- חממו מראש אקג"מ ו-DPBS באמבט מים בטמפרטורה של 37°C למשך 30 דקות ומגיב Cell Counting Kit-8 (CCK8) בטמפרטורת החדר.
- צור פתרון עבודה של CCK8 על ידי ערבוב 100 μL של מגיב CCK8 עם 1 מ"ל של ECGM טרי עבור כל באר. בזמן העבודה עבור צלחת / 6 ערוץ, להכין 600 μL של מגיב CCK8 על ידי שילוב עם 6 מ"ל של ECGM טרי.
- הסר את מדיום הגידול על ידי יניקה ושטוף את התעלות עם DPBS. הוסף 1 מ"ל של פתרון עבודה CCK8 לכל באר ואפשר לצלחת להישאר שטוחה בתוך האינקובטור למשך 30 דקות. לאחר מכן, התחל את התרבות הדינמית על נדנדה כמתואר בשלב 6.9, והמשך בתהליך זה במשך 3 השעות הבאות.
- לאחר 3 שעות, מוציאים את התכולה מכל באר על ידי הטיית הצלחת לצד אחד, ומעבירים אותם לצלחת חדשה בת שש בארות. שוטפים את התעלות עם DPBS ומוסיפים מדיום טרי.
הערה: כסו את הצלחת ברדיד אלומיניום עד למדידת הספיגה. שמור על נפח מגיב עקבי בכל הבארות כדי להבטיח קריאות אחידות. בזמן הפיפט, הימנעו בזהירות מהחדרת בועות אוויר, שעלולות לשבש את הדיוק של קריאות הצפיפות האופטית. - לאחר ניעור עדין של הצלחת במשך 15 שניות כדי להבטיח ערבוב אחיד של הצבעים, השתמש בקורא מיקרו-צלחות כדי למדוד את הספיגה ב-450 ננומטר.
- חזור על הליך זה במרווחי זמן מוגדרים מראש. חשב את הצפיפות האופטית הממוצעת עבור כל נקודת זמן והתווה עקומת צמיחה בתוכנת גרפים. עקומה זו מציינת את ההבשלה היחסית של האנדותל לאורך זמן.
8. בדיקת חדירות
- הסר את המדיום מבאר עניין אחת.
הערה: עבור בדיקת החדירות, מומלץ לעבד כל באר בנפרד כדי למנוע התייבשות של ערוצים אחרים, מה שעלול לשנות את חדירות כלי הדם שלהם. - הכן 6 מ"ל של תמיסת 0.1 מ"ג/מ"ל של דקסטרן מצומד FITC על ידי המסת דקסטרן FITC 70 kDa ב-DPBS.
הערה: הכינו תמיסת מלאי של 20 מ"ג/מ"ל של FITC dextran על ידי המסת 100 מ"ג של FITC dextran ב-5 מ"ל של DPBS. לאחר ערבול עדין של התמיסה, aliquot 500 μL לתוך צינורות 1.5 מ"ל כדי למנוע מחזורי הקפאה-הפשרה חוזרים. aliquots אלה ניתן לאחסן ב -20 °C למשך מקסימום של 6 חודשים. לפני ביצוע הבדיקה, לדלל את תמיסת המניות לריכוז עבודה של 0.1 מ"ג / מ"ל. - מקמו את הצלחת בחוזקה על במת המיקרוסקופ והתאימו את הגדלת המטרה במצב ניגודיות פאזה כדי להבטיח ראות ברורה של דופן התעלה באזור העניין, יחד עם הג'ל הממוקם בקרבת מקום, בתוך שדה הראייה.
הערה: להערכת חדירות יעילה, נסה למקסם את שטח הג'ל המקיף את אזור העניין בשדה הראייה; היבט זה הוא המפתח לניטור מדויק של תחבורה דקסטרן. - לאחר התמקדות באזור הרצוי, יש לעבור מניגוד פאזה למצב פלואורסצנטי. תחת הכרטיסייה רכישת תמונה, הוסף FITC לערוץ השדה הרחב, וקבל תמונה לפני הוספת תמיסת דקסטרן, כדי לחשב את עוצמת הפלואורסצנטיות ברקע. לאחר מכן, הוסף 1 מ"ל של פתרון עבודה FITC dextran לצד אחד של התעלה ותן לתמיסה לזרום לכיוון הצד השני של הבאר, מונע על ידי הפרש הלחץ ההידרוסטטי.
- קבל תמונות בפרקי זמן קבועים מראש - בתדירות גבוהה יותר עבור ערוצים עם חדירות גבוהה ובתדירות נמוכה יותר עבור ערוצים עם חדירות נמוכה יותר.
9. מדידת עוצמת פלואורסצנטיות ב-ImageJ
- בתוכנת ניתוח התמונה ImageJ, מדדו את העוצמה בנקודת הזמן הראשונית (It1), את העוצמה הממוצעת שנצפתה בנקודת הזמן המאוחרת יותר (It2) ואת העוצמה הנובעת מרעשי רקע (Ib), כמתואר להלן. השתמש במשוואה (1) כדי לחשב את מקדם החדירות (Pd). T1 ו- T2 מתייחסים לנקודות הזמן הראשוניות והמאוחרות יותר של רכישת תמונה.
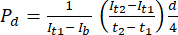 (1)
(1)- הפעל את ImageJ ופתח את התמונה שנרכשה בנקודת הזמן הראשונית.
- הגדר את קנה המידה ב- ImageJ. נווט כדי לנתח | הגדר קנה מידה. הזן את קנה המידה ויחידת המידה הידועים.
- בחרו בכלי המלבן ושרטטו מלבן על שטח הג'ל שבו נדרשת מדידת עוצמת הפלואורסצנטיות.
- נווט כדי לנתח | הגדר מדידות וודא שהערך האפור הממוצע מסומן.
הערה: אפשרות זו מודדת את העוצמה הממוצעת באזור שנבחר. ניתן לבחור פרמטרים אחרים לפי הצורך לניתוח הנתון. - כאשר האזור עדיין נבחר, נווט אל נתח | מדדו או פשוט לחצו על M. המתן עד שייפתח חלון תוצאות , המציג את עוצמת הפלואורסצנטיות הממוצעת וכל פרמטר אחר שנבחר.
- בצע שלוש מדידות וחשב את ערך עוצמת הפלואורסצנטיות הממוצעת בגיליון אלקטרוני.
- חזור על הליך זה עבור התמונות שצולמו בנקודת הזמן הבאה t2, כמו גם אלה שצולמו לפני הוספת פתרון דקסטרן לחישוב עוצמת הפלואורסצנטיות בנקודת הזמן המאוחרת יותר, כדי לקבוע את פלואורסצנטיות הרקע.
תוצאות
פלטפורמת VOP, הכוללת גמישות בגודל ובתבנית, יוצרה באמצעות מערכת הדפסה ביולוגית מרובת ראשים. תעלות, חלולות ומסוגלות זילוח, נזרעו עם HUVECs כדי להקל על אנדותליאליזציה, ולאחר מכן הוערכו באמצעות בדיקת חדירות (איור 1A). כדי להדגים את יכולת הייצור הרב-ממדית של שיטה זו,...
Discussion
תוך ניצול הדיוק, האוטומציה והאופי הנשלט על ידי מחשב של טכנולוגיית הדפסה ביולוגית תלת-ממדית, ביססנו שיטה יעילה לייצור תעלות כלי דם בלוחות סטנדרטיים בעלי שש בארות, שנבחרו בשל התאמתם לקוראי מיקרו-לוחות מסחריים ולמערכי הדמיה במיקרוסקופ. עיצוב הלוח יכול להכיל ערוצים מרובי ג?...
Disclosures
המחברים מצהירים כי אין אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענקי קרן המחקר הלאומית של קוריאה (NRF) במימון ממשלת קוריאה (משרד המדע והתקשוב, MSIT) [No. NRF-2019R1C1C1009606; מס' 2020R1A5A8018367; ולא. RS-2024-00423107]. מחקר זה נתמך על ידי התוכנית לפיתוח ביו וטכנולוגיה רפואית של מענקי NRF במימון MSIT [No. NRF-2022M3A9E4017151 ולא. NRF-2022M3A9E4082654]. עבודה זו נתמכה על ידי התוכנית לחדשנות טכנולוגית [מס' 20015148] ופרויקט האלכימאי [מס' 20012378] במימון משרד המסחר, התעשייה והאנרגיה (MOTIE, קוריאה). עבודה זו נתמכה גם על ידי המכון הקוריאני לתכנון והערכה לטכנולוגיה במזון, חקלאות וייעור (IPET) באמצעות התוכנית לטכנולוגיות חקלאות והתכנסות מזון לפיתוח כוח אדם מחקרי, במימון משרד החקלאות, המזון וענייני הכפר (MAFRA) [No. RS-2024-00397026].
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
References
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -. L., Wautier, M. -. P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958 (2022).
- Park, W., Lee, J. -. S., Gao, G., Kim, B. S., Cho, D. -. W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696 (2023).
- Sun, H. -. J., Wu, Z. -. Y., Nie, X. -. W., Bian, J. -. S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568 (2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778 (2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771 (2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267 (2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Can Pfizer deliver. MIT Technology Review Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004)
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013 (2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168 (2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141 (2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012 (2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798 (2017).
- Cho, W. -. W., Ahn, M., Kim, B. S., Cho, D. -. W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093 (2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027 (2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102 (2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744 (2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022 (2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345 (2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171 (2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683 (2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938 (2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -. J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043 (2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723 (2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071 (2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760 (2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151 (2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved