Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hochdurchsatz-Bioprinting-Verfahren zur Modellierung der Gefäßpermeabilität in Standard-Sechs-Well-Platten mit Größen- und Musterflexibilität
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll für die Hochdurchsatzproduktion von Gefäßkanälen mit flexiblen Größen und gewünschten Mustern auf einer Standard-Sechs-Well-Platte unter Verwendung der 3D-Bioprinting-Technologie vor, die als Gefäße auf einer Platte (VOP) bezeichnet wird. Diese Plattform hat das Potenzial, die Entwicklung von Therapeutika für die mit einem kompromittierten Endothel verbundenen Erkrankungen voranzutreiben.
Zusammenfassung
Die Gefäßpermeabilität ist ein Schlüsselfaktor bei der Entwicklung von Therapien für Erkrankungen, die mit einer Beeinträchtigung des Endothels verbunden sind, wie z. B. endotheliale Dysfunktion in den Herzkranzgefäßen und eine beeinträchtigte Funktion der Blut-Hirn-Schranke. Bestehende Herstellungstechniken replizieren die geometrische Variation der Gefäßnetzwerke im menschlichen Körper, die das Fortschreiten der Krankheit wesentlich beeinflusst, nicht ausreichend. Darüber hinaus beinhalten diese Techniken oft mehrstufige Herstellungsverfahren, die die für pharmakologische Tests erforderliche Hochdurchsatzproduktion behindern. In diesem Artikel wird ein Bioprinting-Protokoll für die Erstellung mehrerer Gefäßgewebe mit gewünschten Mustern und Größen direkt auf Standard-Sechs-Well-Platten vorgestellt, wodurch bestehende Auflösungs- und Produktivitätsherausforderungen in der Bioprinting-Technologie überwunden werden. Es wurde ein vereinfachter Herstellungsansatz etabliert, um sechs hohle, perfundierte Kanäle innerhalb eines Hydrogels zu konstruieren, die anschließend mit menschlichen Endothelzellen der Nabelschnurvene ausgekleidet wurden, um ein funktionsfähiges und reifes Endothel zu bilden. Die computergesteuerte Natur des 3D-Biodrucks gewährleistet eine hohe Reproduzierbarkeit und erfordert weniger manuelle Fertigungsschritte als herkömmliche Methoden. Dies unterstreicht das Potenzial von VOP als effiziente Hochdurchsatzplattform für die Modellierung der Gefäßpermeabilität und die Weiterentwicklung der Wirkstoffforschung.
Einleitung
Das Gefäßnetz im gesamten menschlichen Körper fungiert als entscheidende Transportbarriere, indem es den Austausch von Molekülen und Zellen zwischen dem Blut und dem umgebenden Gewebe dynamisch reguliert. Diese Regulation ist essentiell, um Gewebeödeme zu verhindern und einen selektiven Nährstoff- und Zellaustausch zu ermöglichen und so den Gewebestoffwechsel und die Homöostase zu unterstützen1. Eine veränderte endotheliale Permeabilität, ein Faktor bei vielen Gesundheitszuständen, beeinflusst sowohl den Schweregrad der Erkrankung als auch die Wirksamkeit der Behandlung2. Das vaskuläre Endothel wirkt als selektive Barriere und erleichtert den Transfer zwischen Gefäßen, Geweben und Organen. Diese Regulation umfasst mehrere Mechanismen, wie z. B. die grundlegende Filterung von gelösten Stoffen und kleinen Molekülen, die absichtliche Störung der Gefäßbarriere und den Einfluss von Molekülen wie Prostaglandinen und Wachstumsfaktoren auf die Permeabilitätsniveaus3.
Zu den Schlüsselfaktoren bei dieser Regulation gehören Endothelzellverbindungen, die Migration von Leukozyten und die Funktionalität der Blut-Hirn-Schranke4. Aufgrund seiner Komplexität variiert der Prozess in verschiedenen Umgebungen, wobei verschiedene Blutgefäßtypen beteiligt sind und unterschiedliche anatomische Wege verwendet werden. Das Verständnis der biologischen Grundlagen der Gefäßpermeabilität ist entscheidend für die Entwicklung therapeutischer Ansätze zur Behandlung von Erkrankungen, die mit abnormaler Gefäßpermeabilität verbunden sind. Die Aufrechterhaltung der Gefäßpermeabilität ist entscheidend für die Gesundheit des Gefäßsystems und des umgebenden Gewebes. Folglich führt eine Beeinträchtigung dieser Funktion zu einer endothelialen Dysfunktion, einem Zustand, in dem das Endothel seine normale Funktionalität verliert.
Die endotheliale Dysfunktion ist ein Vorläufer mehrerer weit verbreiteter menschlicher Krankheiten, darunter Bluthochdruck, koronare Herzkrankheit, Diabetes und Krebs 5,6,7. Dieser Zustand kann sich auf verschiedene Weise äußern, einschließlich einer verminderten Vasodilatation, einer erhöhten Gefäßpermeabilität und einer Tendenz zu einem entzündungsfördernden Zustand. Dieser pathologische Zustand ist das früheste Stadium mehrerer kritischer kardiovaskulärer Probleme, wie z. B. koronare Herzkrankheit, Schlaganfall und periphere arterielle Verschlusskrankheit8, die nach wie vor die Haupttodesursachen in den Vereinigten Staaten sind1. Die endotheliale Dysfunktion wirkt sich sowohl auf die kardiovaskuläre Gesundheit als auch auf die Blut-Hirn-Schranke (BHS) aus und spielt eine wichtige Rolle beim Fortschreiten verschiedener neurologischer Erkrankungen. Eine Dysfunktion kann die BHS-Durchlässigkeit erhöhen, wodurch Toxine, Krankheitserreger und Immunzellen in das zentrale Nervensystem eindringen können und zu neurologischen Störungen wie Schlaganfall, Alzheimer, Multipler Sklerose und Gehirninfektionen beitragen9.
Die endotheliale Dysfunktion bei Diabetes ist gekennzeichnet durch die beeinträchtigte Fähigkeit des Endothels, den Gefäßtonus zu regulieren und gefäßerweiternde Mediatoren wie Stickstoffmonoxid zu produzieren, was zu einer beeinträchtigten Vasodilatation führt10. Dieser Zustand wird durch Hyperglykämie-induzierte Signalwege wie die Aktivierung der Proteinkinase C und oxidativen Stress verschlimmert und trägt wesentlich zum Fortschreiten der diabetischen Gefäßerkrankung bei11. Darüber hinaus wurde festgestellt, dass ein entzündliches Milieu die Adhäsion von Tumorzellen an mikrovaskuläre Endothelzellen des Gehirns erhöht, während ein undichtes Endothel ein wichtiger Faktor für die Metastasierung von Krebs ist12,13. Es wurde festgestellt, dass die Geometrie der Blutgefäße einen direkten Einfluss auf die Metastasierung von Hirntumoren hat. Tumorzellen heften sich bevorzugt an Bereiche mit größerer Blutgefäßkrümmung7. Dieser Befund unterstreicht die Bedeutung der Gefäßgeometrie bei der Metastasierung von Krebs. Noch wichtiger ist, dass bei Erkrankungen wie Fibrose und Krebs eine gestörte Endothelbarrierefunktion nicht nur eine Rolle bei der Krankheitsentwicklung spielt, sondern auch die Wirksamkeit der Behandlung behindert, indem sie eine angemessene Arzneimittelabgabe behindert14. Die Erforschung der Gefäßpermeabilität ist von entscheidender Bedeutung, um die Behandlung von Herz-Kreislauf-Erkrankungen voranzutreiben und Einblicke in die Behandlung anderer Krankheiten zu gewinnen, die eine beeinträchtigte Gefäßfunktion beinhalten.
Angesichts der entscheidenden Rolle der Gefäßpermeabilität für Gesundheit und Krankheit haben sich umfangreiche Forschungsarbeiten darauf konzentriert, die selektive Natur der Endothelbarriere für die therapeutische Entwicklung unter Verwendung von Tiermodellen neben traditionellen 2D- und 3D-In-vitro-Testplattformen zu untersuchen. Tiermodelle haben jedoch aufgrund artspezifischer Unterschiede und ethischer Fragen sowie hoher Kosten Einschränkungen15,16. So gab Pfizer im Jahr 2004 an, dass es in den letzten 10 Jahren über 2 Milliarden US-Dollar für die Entwicklung von Medikamenten ausgegeben hatte, die in Tiermodellen vielversprechende Wirkungen zeigten, aber schließlich in fortgeschrittenen Testphasen am Menschen scheiterten17. Darüber hinaus ahmen herkömmliche 2D-Modelle die dreidimensionale (3D) Architektur und die komplexe geometrische Struktur von Gefäßkanälen nicht genau nach.
Mit den Fortschritten in der Biofabrikationstechnologie wurden umfangreiche Anstrengungen unternommen, um Gefäßkanäle herzustellen und gleichzeitig die 3D-Architektur zu rekapitulieren. Mikroskalige Gefäßkanäle können in mikrofluidischen Chips unter Verwendung von Softlithographie effektiv hergestellt werden, was einen Vorteil der Echtzeitanalyse bietet18,19. Alternative Methoden, wie z. B. das Gießen von Hydrogelen oder das Umwickeln von Zellfolien um eine Form oder einen Dorn, können verwendet werden, um freistehende röhrenförmige Strukturen mit dem gewünschten Durchmesser20,21 herzustellen. Diese Methoden haben jedoch Einschränkungen; Zum Beispiel sind mikrofluidische Chips auf Mikrokanalkonfigurationen beschränkt, und das Hydrogelgießen um eine Form herum repliziert nicht effektiv mehrere Geometrien.
Mit dem Aufkommen der 3D-Bioprinting-Technologie22 ist die Replikation komplexer Geometrien durch präzises Abscheiden verschiedener Hydrogelmaterialien auf Basis extrazellulärer Matrix (ECM) möglich geworden23,24. Einige Bioprinting-Verfahren, wie z. B. solche mit konzentrisch angeordneten Düsen, z. B. koaxial und triaxial25,26, können keine gegabelten Röhren erzeugen; Komplexe Strukturen können jedoch mit Opfermusterungsmethoden erreicht werden27. Keines dieser Bioprinting-Verfahren konnte nachweislich eine In-vitro-Modellierung mit hohem Durchsatz ermöglichen – eine entscheidende Voraussetzung für die pharmakologische Forschung in der Arzneimittelforschung. Hier stellen wir eine Methode zur effizienten Herstellung endothelialisierter Gefäßkanäle mit effizienter Kontrolle über die Dimensionen vor.
Wir etablierten einen unkomplizierten Ansatz unter Verwendung kommerziell erhältlicher Sechs-Well-Platten, kombiniert mit einer Opferstrukturierungsmethode, bei der ein Bioprinter Gefäßkanäle in den gewünschten Größen und Mustern innerhalb eines EZM-Hydrogels herstellt. Humane Nabelschnurvenendothelzellen (HUVECs) wurden ausgesät, um diese Kanäle zu endothelialisieren und die Funktionalität des Endothels durch einen Permeabilitätsassay zu bewerten. Dieses Design ermöglicht eine pumpenlose Perfusion, indem auf beiden Seiten des Kanals Medienreservoirs geschaffen werden, und verwendet eine schwerkraftgetriebene Strömung mit Hilfe einer häufig verwendeten 2D-Wippe, um die dynamische Kultur nachzuahmen. Dieser Ansatz macht Schlauchpumpen überflüssig und erleichtert die Skalierbarkeit dieser Plattform für Anwendungen mit hohem Durchsatz. Die computergesteuerte Natur der 3D-Bioprinting-Technologie rationalisiert auch den Herstellungsprozess und verringert so die Wahrscheinlichkeit von Fehlern während der Herstellung. Das VOP-Modell ist ein vielversprechendes Werkzeug für pharmakologische Tests in der Wirkstoffforschung.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Generierung des G-Codes für den Bioprinter
- Um den Druckpfad zu generieren und zu visualisieren, besuchen Sie ein Online-G-Code-Simulationstool (z. B. NCviewer).
- Klicken Sie auf das Symbol Neue Datei auf der Benutzeroberfläche, um eine neue G-Code-Datei zu erstellen.
- Generieren Sie einen Druckpfad, indem Sie die G-Code-Befehle für den Opferkanal und die Siliziumkammer manuell schreiben. Verwenden Sie die Abmessungen einer Standardplatte mit sechs Vertiefungen als Referenz für die Erstellung der Geometrie.
HINWEIS: Der hier verwendete G-Code basiert auf dem CNC-Code (Computer Numerical Control). Die Funktionen der einzelnen Befehle sind in der ergänzenden Tabelle S1 aufgeführt. Das Sechs-Well-Plattenformat wurde aufgrund seiner Kompatibilität mit kommerziellen Mikroplatten-Readern und Mikroskopie-Setups und seiner Fähigkeit, ausreichende Medienvolumina zur Unterstützung der Endothelreifung aufzunehmen, wodurch der Bedarf an häufigen Medienwechseln minimiert wird. Dieses Herstellungsprotokoll kann auch für die Verwendung mit anderen Standard-Well-Platten angepasst werden. - Sobald der G-Code abgeschlossen ist, klicken Sie auf der Benutzeroberfläche auf das Symbol Datei speichern , um die Datei mit der Erweiterung .nc herunterzuladen.
HINWEIS: Jeder andere verfügbare G-Code-Generierungsalgorithmus kann verwendet werden, um die Druckpfade zu generieren. Die Geometrie des Gefäßkanals kann in diesem G-Code manipuliert werden.
2. Vorbereitung von Opfer- und Silikonkammertinten
HINWEIS: Die Quellen für alle Materialien, die in diesem Protokoll verwendet werden, sind in der Materialtabelle aufgeführt.
- Kombinieren Sie zwei Arten von Silikonpolymeren, SE1700 und Polydimethylsiloxan (PDMS), in einem Verhältnis von 10:2. Fügen Sie das Härtungsmittel jedes Polymers in einem Verhältnis von 10:1 hinzu, Polymer zu Härter.
- Verwenden Sie einen Planetenmischer, um das Polymergemisch bei 2.000 U/min gründlich zu mischen und zu entgasen.
- Übertragen Sie das gemischte Silikonpolymer mit einem Spatel in eine 10-ml-Einwegspritze. Zentrifugieren Sie die geladene Spritze bei 400 × g für 3 min bei 5 °C, um eine gleichmäßige Konsistenz zu gewährleisten und Blasenbildung während des Drucks zu vermeiden.
HINWEIS: Die Kammertinte sollte innerhalb von 2 Stunden nach der Zugabe der Härter verwendet werden, um eine optimale Druckqualität zu gewährleisten. Lagern Sie die Spritze bei 5 °C, während Sie den Druck vorbereiten. Dieser Prozess trägt dazu bei, die Aushärtung der Tinte zu verlangsamen, wodurch sich sonst die Druckparameter verändern können. - Pluronic F-127 (PF127) wird gewogen, um eine 40%ige (w/v) Stammlösung von PF127 in destilliertem Wasser herzustellen.
- Mischen Sie die PF127-Lösung in einem Planetenmischer für 3 min bei 400 × g , um eine Homogenität zu erreichen. Die homogenisierte Mischung wird bei 4 °C gehalten, um PF127 vollständig aufzulösen.
- Bereiten Sie eine Thrombin-Stammlösung von 1.000 Einheiten/ml in Dulbeccos phosphatgepufferter Kochsalzlösung (DPBS) vor.
HINWEIS: Lagern Sie Thrombin-Stammlösung in 100 μl Aliquoten, um wiederholte Gefrier-Auftau-Zyklen zu vermeiden. Die Aliquote sollten nicht länger als 6 Monate bei -20 °C gelagert werden. - Bereiten Sie vor dem Drucken Opfertinte vor, indem Sie Thrombin in einer Verdünnung von 1:10 mit PF127 auf eine endgültige Arbeitskonzentration von 36 % (w/v) für PF127 und 100 Einheiten/ml für Thrombin mischen. Zur Herstellung von 1 ml Opfertinte mischen Sie 100 μl Thrombin-Stammlösung mit 900 μl PF127-Stammlösung.
HINWEIS: Bei der Vorbereitung der Opfertinte für den Druck einer einzelnen Platte ist ein Gesamtvolumen von 1 ml mehr als ausreichend.
3. Herstellungsprozess
- Bevor Sie mit dem Herstellungsprozess beginnen, behandeln Sie eine Sechs-Well-Platte 1 Minute lang mit Sauerstoffplasma (O2) mit einer Stärke von 100 Watt.
- Befolgen Sie das in Abschnitt 2 beschriebene Verfahren, um sowohl die Opfer- als auch die Silikontinte vorzubereiten, und stellen Sie sicher, dass die Tinten frei von Blasen und homogen gemischt sind, um einen konsistenten Druck zu gewährleisten. Legen Sie die Tinten vorsichtig in den Druckkopf des Biodruckers ein. Stellen Sie die Temperatur des Kopfes des Biodruckers auf 37 °C für die Opfertinte und 5 °C für die Silikontinte ein.
- Befestigen Sie eine konische Düse mit 22 G Doppelschraubgewinde an der Silikonspritze. Für die Opfertinte wählen Sie die Düsengröße entsprechend dem gewünschten Kanaldurchmesser.
HINWEIS: Hier haben wir drei Düsengrößen demonstriert: 18 G, 20 G und 22 G. Optimale Druckparameter, einschließlich Druckdruck und Druckkopfgeschwindigkeit, sind in Tabelle 1 aufgeführt. - Laden Sie den gewünschten G-Code und drücken Sie die Servo-Bereitschaftsfunktion auf der Softwareoberfläche des Biodruckers für 3 Sekunden. Positionieren Sie die Platte auf dem Tisch am Startpunkt des G-Codes und klicken Sie auf Start , um den Druckvorgang zu starten.
HINWEIS: In der Regel dauert die Herstellung einer Platte mit sechs Kammern ca. 1 h und 10 min. Schritt 3.4, der das Laden und Ausführen des G-Codes umfasst, kann je nach verwendetem Bioprinter variieren. Stellen Sie sicher, dass während der Verwendung des Biodruckers sterile Bedingungen eingehalten werden, um eine Kontamination zu vermeiden. - Setzen Sie einen Deckel über die Platte und stellen Sie die Platte für 72 Stunden in einen befeuchteten CO2 -Inkubator bei 37 °C um, um die Silikonkammern auszuhärten.
HINWEIS: Obwohl die Aushärtung des Silikons im Inkubator langsamer erfolgen kann, darf die Platte nicht in einen trockenen Ofen gestellt werden.
4. Hydrogel-Vorbereitung und Kanaleinbettung
- Bereiten Sie ein konisches 50-ml-Röhrchen mit 20 ml 1x PBS vor. 0,01 g Lithiumphenyl-2,4,6-trimethylbenzoylphosphinat (LAP) werden in das konische Röhrchen gegeben, um eine 0,05%ige (w/v) LAP-Lösung herzustellen. Strudeln Sie es, bis sich das Pulver vollständig aufgelöst hat.
HINWEIS: Wickeln Sie das konische Rohr in Folie ein, um Lichteinwirkung zu vermeiden. Die LAP-Stammlösung bei 4 °C lagern. - Fügen Sie 3 g Gelatinemethacrylat (GelMA) und 0,2 g Fibrinogen zu 20 ml LAP-Lösung hinzu, um eine Endkonzentration von 15 % GelMA und 1 % Fibrinogen (als GelFib bezeichnet) zu erreichen. Geben Sie die Mischung in ein 37 °C heißes Wasserbad und mischen Sie sie regelmäßig, bis sich die Lösung vollständig aufgelöst hat.
- Nach der Herstellung, wie in Abschnitt 3 beschrieben, fügen Sie 300 μl vorgewärmtes GelFib in jede Hydrogelkammer hinzu, um das Opfermuster einzubetten. Vernetzen Sie das GelMA schnell mit ultraviolettem (UV) Licht bei einer Wellenlänge von 405 nm und einer Intensität von 85 mW/cm2 für 120 s. Wiederholen Sie diesen Vorgang für alle anderen Vertiefungen.
HINWEIS: Fibrinogen vernetzt sich schnell bei Kontakt mit dem Thrombin enthaltenden Opfermuster. Wir empfehlen, Hydrogel hinzuzufügen und die UV-Vernetzung einzeln für jede Vertiefung durchzuführen, um eine unerwünschte Gelierung von GelMA bei Raumtemperatur zu vermeiden. Darüber hinaus sollten sterile Bedingungen eingehalten werden, um eine Kontamination während des UV-Härtungsprozesses zu vermeiden. - Geben Sie 1 ml DPBS auf jede Seite des Gefäßkanals in jeder Vertiefung und halten Sie die Platte 15 Minuten lang bei 4 °C, um das PF127 zu verflüssigen.
- Nach 15 Minuten saugen Sie das DPBS ab und wiederholen Sie Schritt 4.5 3x, um PF127 vollständig zu waschen.
- Bevor Sie Zellen in die Kanäle einführen, perfundieren Sie DMEM F12 mit 1% Matrigel für 30 Minuten durch die Kanäle, um die Zelladhäsion zu verbessern.
5. HUVEC-Kultur
- Endothelzellwachstumsmedium (EKGM) in einem 37 °C warmen Wasserbad für 30 min vorwärmen.
- Nehmen Sie in der Zwischenzeit ein Fläschchen mit kryokonservierten HUVECs aus dem Stickstofftank, lösen Sie vorsichtig die Kappe des Fläschchens und ziehen Sie sie dann wieder fest, um Stickstoff aus den Gewinden freizusetzen. Tauen Sie die Zellen sofort auf, indem Sie das Fläschchen 2 Minuten lang in ein 37 °C heißes Wasserbad tauchen, wobei Sie darauf achten, dass eine kleine Menge Eis im Fläschchen verbleibt. Spülen Sie das Fläschchen mit 70 % Ethanol aus, um eine Kontamination zu vermeiden.
HINWEIS: Tragen Sie eine Schutzbrille, wenn Sie Zellen aus dem Stickstofftank entnehmen. Die Kappe des Fläschchens muss während dieses Vorgangs über dem Wasserspiegel gehalten werden. - Bereiten Sie einen konischen 15-ml-Schlauch mit 5 ml vorgewärmtem EKGM vor. Übertragen Sie die aufgetauten Zellen vorsichtig mit einer Mikropipette aus dem Fläschchen in das konische Röhrchen. Um sicherzustellen, dass keine Zellen zurückbleiben, geben Sie 1 ml frisches, vorgewärmtes Medium in das Kryofläschchen, spülen Sie das Innere aus und geben Sie alle verbleibenden Zellen in das konische Röhrchen.
- Das konische Röhrchen wird 3 Minuten lang bei 200 × g zentrifugiert, um ein Zellpellet zu erhalten. Der Überstand wird verworfen, die Zellen in 10 ml frischem Medium resuspendiert, die Zellen in einen T75-Kolben überführt und der Kolben in einen 37 °C befeuchteten CO2 -Inkubator gestellt.
HINWEIS: Dieser Schritt ist wichtig, um das im Gefriermedium im Kryoröhrchen vorhandene Dimethylsulfoxid durch Zentrifugation zu entfernen. - Frischen Sie das Medium jeden zweiten Tag auf, bis die Zellen eine Konfluenz von 80-90 % erreicht haben.
6. Endothelisierung der Kanäle
- ECGM, DPBS, Trypsin-neutralisierende Lösung und Trypsinethylendiamintetraessigsäure (TE) in einem 37 °C warmen Wasserbad für 30 min vorwärmen.
- Bei 90 % Konfluenz spülen Sie die Zellen in einem T75-Kolben mit 10 ml DPBS, geben Sie 1 ml 0,25 % TE in den Kolben und inkubieren Sie ihn 3 Minuten lang.
- Klopfen Sie vorsichtig auf die Seiten des Kolbens und fügen Sie 5 ml Trypsin-Neutralisationslösung hinzu, um den TE zu neutralisieren. Übertragen Sie die Zellen in ein konisches 15-ml-Röhrchen. Verwenden Sie 5 ml frisches EKGM, um die verbleibenden Zellen zu sammeln und in den konischen Schlauch zu geben.
- Zentrifugieren Sie das konische Röhrchen bei 250 × g für 3 Minuten, um das Küvettenpellet aufzufangen.
- Entsorgen Sie den Überstand und resuspendieren Sie das Zellpellet in 1 ml frischem EKGM. Zählen Sie die Zellen mit einem Hämozytometer und wiederholen Sie Schritt 6.4, um ein Zellpellet zu erhalten. Resuspendieren Sie 3 Millionen Zellen in 90 μl frischem EKGM.
- Bevor Sie die Zellsuspension in den Kanal einführen, saugen Sie den Kanal kurz im Vakuum, um das Lumen zu reinigen.
HINWEIS: Vermeiden Sie ein längeres Ansaugen des Kanals, um seine Integrität nicht zu beschädigen. - Befüllen Sie den Kanal vorsichtig mit einer Zellsuspension bei einer Aussaatdichte von 0,5 Millionen Zellen pro Well. Verwenden Sie eine Mikropipette, um ~15 μl dieser Suspension hinzuzufügen, um den Kanal zu füllen.
HINWEIS: Die Aussaatdichte kann je nach Größe des Kanals variieren. Diese Dichte ist für einen Kanal optimiert, der mit einer 20-G-Düse und einem Innendurchmesser von ca. 900 μm gedruckt wird. - Legen Sie die Platte für 2 Stunden flach in den Inkubator. Drehen Sie anschließend die Platte um 180° um und halten Sie sie für die folgenden 2 Stunden in einer flachen Position.
- Waschen Sie den Kanal nach 4 Stunden mit DPBS, um nicht anhaftende und abgestorbene Zellen zu entfernen. Geben Sie 2 ml frisches ECGM in jede Vertiefung (1 mL auf jede Seite des Kanals). Starten Sie die dynamische Kultur an einer Wippe bei einem Neigungswinkel von 10° und 5 U/min, indem Sie die Platte mit den Kanälen parallel zur Schaukelrichtung auf der Wippe positionieren. Frischen Sie das Wachstumsmedium jeden zweiten Tag auf.
HINWEIS: Die dynamische Kultur verbessert den Medienaustausch zwischen den Reservoiren und Kanälen und hilft den Zellen, sich über Nacht zu vermehren.
7. Beurteilung der Endothelreifung
- EKGM und DPBS in einem 37 °C warmen Wasserbad für 30 min und das Reagenz des Cell Counting Kit-8 (CCK8) bei Raumtemperatur vorwärmen.
- Stellen Sie eine Arbeitslösung aus CCK8 her, indem Sie 100 μl CCK8-Reagenz mit 1 ml frischem ECGM für jede Vertiefung mischen. Bereiten Sie bei der Arbeit mit einer Platte/einem 6-Kanal 600 μl CCK8-Reagenz vor, indem Sie es mit 6 ml frischem EKGM kombinieren.
- Entfernen Sie das Wachstumsmedium durch Saugen und spülen Sie die Kanäle mit DPBS aus. Geben Sie 1 ml CCK8-Arbeitslösung in jede Vertiefung und lassen Sie die Platte 30 Minuten lang flach im Inkubator bleiben. Starten Sie anschließend die dynamische Kultur auf einer Wippe, wie in Schritt 6.9 beschrieben, und setzen Sie diesen Vorgang für die nächsten 3 Stunden fort.
- Entfernen Sie nach 3 Stunden den Inhalt aus jeder Vertiefung, indem Sie die Platte zur Seite kippen, und geben Sie ihn auf eine neue Platte mit sechs Vertiefungen. Spülen Sie die Kanäle mit DPBS aus und fügen Sie frisches Medium hinzu.
HINWEIS: Decken Sie die Platte bis zur Absorptionsmessung mit Alufolie ab. Halten Sie ein konsistentes Reagenzienvolumen über alle Vertiefungen aufrecht, um einheitliche Messwerte zu gewährleisten. Vermeiden Sie beim Pipettieren sorgfältig das Einbringen von Luftblasen, die die Genauigkeit der optischen Dichtemessungen beeinträchtigen können. - Nachdem Sie die Platte 15 s lang vorsichtig geschüttelt haben, um eine gleichmäßige Mischung der Farben zu gewährleisten, verwenden Sie einen Mikroplatten-Reader, um die Absorption bei 450 nm zu messen.
- Wiederholen Sie diesen Vorgang in vordefinierten Zeitintervallen. Berechnen Sie die mittlere optische Dichte für jeden Zeitpunkt und zeichnen Sie eine Wachstumskurve in einer Grafiksoftware. Diese Kurve zeigt die relative Reifung des Endothels im Laufe der Zeit.
8. Permeabilitätstest
- Entferne das Medium aus einer Vertiefung von Interesse.
HINWEIS: Für den Permeabilitätstest wird empfohlen, jede Vertiefung separat zu bearbeiten, um zu verhindern, dass andere Kanäle austrocknen, was ihre Gefäßpermeabilität verändern könnte. - Bereiten Sie 6 ml 0,1 mg/ml-Lösung von FITC-konjugiertem Dextran vor, indem Sie 70 kDa FITC-Dextran in DPBS auflösen.
HINWEIS: Bereiten Sie eine 20 mg/ml-Stammlösung von FITC-Dextran vor, indem Sie 100 mg FITC-Dextran in 5 ml DPBS auflösen. Nachdem Sie die Lösung vorsichtig vortexiert haben, aliquotieren Sie 500 μl in 1,5-ml-Röhrchen, um wiederholte Gefrier-Tau-Zyklen zu vermeiden. Diese Aliquots können maximal 6 Monate bei -20 °C gelagert werden. Vor der Durchführung des Assays verdünnen Sie die Stammlösung auf eine Arbeitskonzentration von 0,1 mg/ml. - Positionieren Sie die Platte fest auf dem Mikroskoptisch und stellen Sie die Vergrößerung des Objektivs im Phasenkontrastmodus ein, um eine klare Sichtbarkeit der Kanalwand im interessierenden Bereich zusammen mit dem in der Nähe befindlichen Gel innerhalb des Sichtfelds zu gewährleisten.
HINWEIS: Versuchen Sie für eine effektive Bewertung der Permeabilität, den Bereich des Gels zu maximieren, der den interessierenden Bereich im Sichtfeld umgibt. Dieser Aspekt ist der Schlüssel für eine genaue Überwachung des Dextrantransports. - Nachdem Sie auf den gewünschten Bereich fokussiert haben, wechseln Sie vom Phasenkontrast in den Fluoreszenzmodus. Fügen Sie auf der Registerkarte Bildaufnahme FITC in den Weitfeldkanal ein, und nehmen Sie vor der Zugabe von Dextranlösung ein Bild auf, um die Hintergrundfluoreszenzintensität zu berechnen. Geben Sie dann 1 ml FITC-Dextran-Arbeitslösung auf eine Seite des Kanals und lassen Sie die Lösung zur anderen Seite des Bohrlochs fließen, angetrieben durch die hydrostatische Druckdifferenz.
- Erfassen Sie Bilder in vorgegebenen Zeitintervallen – häufiger für Kanäle mit hoher Permeabilität und seltener für solche mit geringerer Permeabilität.
9. Messung der Fluoreszenzintensität in ImageJ
- Messen Sie in der ImageJ-Bildanalysesoftware die Intensität zum Anfangszeitpunkt (It1), die durchschnittliche Intensität, die zu einem späteren Zeitpunkt (It2) beobachtet wurde, und die Intensität aufgrund von Hintergrundrauschen (Ib), wie unten beschrieben. Verwenden Sie Gleichung (1), um den Permeabilitätskoeffizienten (Pd) zu berechnen. T1 und T2 beziehen sich auf den Anfangs- und den späteren Zeitpunkt der Bildaufnahme.
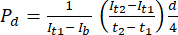 (1)
(1)- Starten Sie ImageJ und öffnen Sie das Bild, das zum ursprünglichen Zeitpunkt aufgenommen wurde.
- Stellen Sie den Maßstab in ImageJ ein. Navigieren Sie zu Analysieren | Festlegen der Skalierung. Geben Sie den bekannten Maßstab und die Maßeinheit ein.
- Wählen Sie das Rechteckwerkzeug aus und zeichnen Sie ein Rechteck über den Bereich des Gels, in dem die Fluoreszenzintensitätsmessung erforderlich ist.
- Navigieren Sie zu Analysieren | Legen Sie Messungen fest und stellen Sie sicher, dass der mittlere Grauwert aktiviert ist.
HINWEIS: Mit dieser Option wird die durchschnittliche Intensität innerhalb des ausgewählten Bereichs gemessen. Andere Parameter können je nach Bedarf für die jeweilige Analyse ausgewählt werden. - Wenn der Bereich noch ausgewählt ist, navigieren Sie zu Analysieren | Messen Sie oder drücken Sie einfach M. Warten Sie, bis sich ein Ergebnisfenster öffnet, in dem die mittlere Fluoreszenzintensität und alle anderen ausgewählten Parameter angezeigt werden.
- Führen Sie drei Messungen durch und berechnen Sie den durchschnittlichen Wert der Fluoreszenzintensität in einer Tabelle.
- Dieses Verfahren wird für die Bilder wiederholt, die zum folgenden Zeitpunkt t2 aufgenommen wurden, sowie für die Bilder, die vor der Zugabe der Dextranlösung zur Berechnung der Fluoreszenzintensität zu einem späteren Zeitpunkt aufgenommen wurden, um die Hintergrundfluoreszenz zu bestimmen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die VOP-Plattform, die sich durch Flexibilität in Größe und Muster auszeichnet, wurde mit einem Mehrkopf-Bioprinting-System hergestellt. Sowohl hohle als auch perfusionsfähige Kanäle wurden mit HUVECs besiedelt, um die Endothelisierung zu erleichtern, und anschließend mit einem Permeabilitätsassay bewertet (Abbildung 1A). Um die Multiskalen-Fertigungsfähigkeit dieser Methode zu demonstrieren, haben wir drei verschiedene Konfigurationen gedruckt: gera...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Unter Ausnutzung der Präzision, Automatisierung und computergesteuerten Natur der 3D-Bioprinting-Technologie haben wir eine optimierte Methode zur Herstellung von Gefäßkanälen in Standard-Sechs-Well-Platten entwickelt, die aufgrund ihrer Kompatibilität mit kommerziellen Mikroplatten-Readern und Mikroskop-Bildgebungseinrichtungen ausgewählt wurden. Das Design der Platte kann Kanäle mit mehreren Größen und ein ausreichendes Medienvolumen für das Wachstum größerer Kanäle aufneh...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden finanziellen Interessen bestehen.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der National Research Foundation of Korea (NRF) unterstützt, die von der koreanischen Regierung (Ministerium für Wissenschaft und IKT, MSIT) finanziert wurden [Nr. NRF-2019R1C1C1009606; Nr. 2020R1A5A8018367; und Nr. RS-2024-00423107]. Diese Forschung wurde durch das Bio- und Medizintechnik-Entwicklungsprogramm der NRF unterstützt, das vom MSIT [Nr. NRF-2022M3A9E4017151 und Nr. NRF-2022M3A9E4082654]. Diese Arbeit wurde durch das Technology Innovation Program [Nr. 20015148] und das Alchemist Project [Nr. 20012378] unterstützt, das vom Ministerium für Handel, Industrie und Energie (MOTIE, Korea) finanziert wurde. Diese Arbeit wurde auch vom Korea Institute of Planning and Evaluation for Technology in Food, Agriculture and Forestry (IPET) durch das Agriculture and Food Convergence Technologies Program for Research Manpower Development unterstützt, das vom Ministerium für Landwirtschaft, Ernährung und ländliche Angelegenheiten (MAFRA) finanziert wurde [Nr. RS-2024-00397026].
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
Referenzen
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -L., Wautier, M. -P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958(2022).
- Park, W., Lee, J. -S., Gao, G., Kim, B. S., Cho, D. -W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696(2023).
- Sun, H. -J., Wu, Z. -Y., Nie, X. -W., Bian, J. -S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568(2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778(2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771(2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267(2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Rotman, D. Can Pfizer deliver. MIT Technology Review. , Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168(2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141(2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012(2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798(2017).
- Cho, W. -W., Ahn, M., Kim, B. S., Cho, D. -W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093(2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027(2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102(2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744(2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022(2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863(2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345(2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171(2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683(2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938(2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043(2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723(2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071(2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760(2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151(2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423(2023).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten