È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metodo di bioprinting ad alta produttività per la modellazione della permeabilità vascolare in piastre standard a sei pozzetti con flessibilità di dimensioni e modelli
In questo articolo
Riepilogo
Presentiamo un protocollo per la produzione ad alta produttività di canali vascolari con dimensioni flessibili e modelli desiderati su una piastra standard a sei pozzetti utilizzando la tecnologia di bioprinting 3D, denominata vessels-on-a-plate (VOP). Questa piattaforma ha il potenziale per far progredire lo sviluppo di terapie per i disturbi associati all'endotelio compromesso.
Abstract
La permeabilità vascolare è un fattore chiave nello sviluppo di terapie per i disturbi associati alla compromissione dell'endotelio, come la disfunzione endoteliale nelle arterie coronarie e la compromissione della funzione della barriera emato-encefalica. Le tecniche di fabbricazione esistenti non replicano adeguatamente la variazione geometrica delle reti vascolari nel corpo umano, che influenza sostanzialmente la progressione della malattia; Inoltre, queste tecniche spesso comportano procedure di fabbricazione in più fasi che ostacolano la produzione ad alto rendimento necessaria per i test farmacologici. Questo articolo presenta un protocollo di bioprinting per la creazione di più tessuti vascolari con i modelli e le dimensioni desiderate direttamente su piastre standard a sei pozzetti, superando le sfide esistenti in termini di risoluzione e produttività nella tecnologia di bioprinting. È stato stabilito un approccio di fabbricazione semplificato per costruire sei canali cavi e perfusibili all'interno di un idrogel, che sono stati successivamente rivestiti con cellule endoteliali della vena ombelicale umana per formare un endotelio funzionale e maturo. La natura controllata dal computer della biostampa 3D garantisce un'elevata riproducibilità e richiede meno passaggi di fabbricazione manuale rispetto ai metodi tradizionali. Ciò evidenzia il potenziale di VOP come piattaforma efficiente ad alto rendimento per la modellazione della permeabilità vascolare e l'avanzamento della scoperta di farmaci.
Introduzione
La rete vascolare in tutto il corpo umano funziona come una barriera di trasporto cruciale regolando dinamicamente lo scambio di molecole e cellule tra il sangue e i tessuti circostanti. Questa regolazione è essenziale per prevenire l'edema tissutale e consentire lo scambio selettivo di nutrienti e cellule, supportando così il metabolismo tissutale e l'omeostasi1. L'alterata permeabilità endoteliale, un fattore in molte condizioni di salute, influisce sia sulla gravità della malattia che sull'efficacia del trattamento2. L'endotelio vascolare funge da barriera selettiva, facilitando il trasferimento tra vasi, tessuti e organi. Questa regolazione coinvolge diversi meccanismi, come il filtraggio di base di soluti e piccole molecole, la rottura intenzionale della barriera vascolare e l'influenza di molecole come le prostaglandine e i fattori di crescita sui livelli di permeabilità3.
I fattori chiave di questa regolazione includono le giunzioni delle cellule endoteliali, la migrazione dei leucociti e la funzionalità della barriera emato-encefalica4. Data la sua complessità, il processo varia tra i diversi ambienti, coinvolgendo vari tipi di vasi sanguigni e utilizzando percorsi anatomici distinti. Comprendere le basi biologiche della permeabilità vascolare è fondamentale per ideare approcci terapeutici per trattare le condizioni associate a una permeabilità vascolare anormale. Il mantenimento della permeabilità vascolare è fondamentale per la salute del sistema vascolare e dei tessuti circostanti; Di conseguenza, la compromissione di questa funzione porta alla disfunzione endoteliale, uno stato in cui l'endotelio perde la sua normale funzionalità.
La disfunzione endoteliale è un precursore di diverse malattie umane prevalenti, tra cui ipertensione, malattia coronarica, diabete e cancro 5,6,7. Questa condizione può presentarsi in diversi modi, tra cui una diminuzione della vasodilatazione, un aumento della permeabilità dei vasi e una tendenza verso uno stato pro-infiammatorio. Questo stato patologico è la fase iniziale di diversi problemi cardiovascolari critici, come la malattia coronarica, l'ictus e l'arteriopatia periferica8, che continuano ad essere le principali cause di mortalità negli Stati Uniti1. La disfunzione endoteliale influisce sulla salute cardiovascolare e sulla barriera emato-encefalica (BEE) e svolge un ruolo importante nella progressione di vari disturbi neurologici. La disfunzione può aumentare la permeabilità della BBB, consentendo così alle tossine, agli agenti patogeni e alle cellule immunitarie di infiltrarsi nel sistema nervoso centrale e contribuendo a disturbi neurologici come ictus, morbo di Alzheimer, sclerosi multipla e infezioni cerebrali9.
La disfunzione endoteliale nel diabete è caratterizzata dalla compromissione della capacità dell'endotelio di regolare il tono vascolare e produrre mediatori vasodilatatori, come l'ossido nitrico, che porta a una compromissione della vasodilatazione10. Questa condizione è esacerbata da vie indotte dall'iperglicemia, come l'attivazione della proteina chinasi C e lo stress ossidativo, che contribuiscono in modo significativo alla progressione della malattia vascolare diabetica11. Inoltre, è stato scoperto che un ambiente infiammatorio migliora l'adesione delle cellule tumorali alle cellule endoteliali microvascolari cerebrali, mentre è stato riportato che un endotelio permeabile è un fattore importante nelle metastasi del cancro12,13. È stato scoperto che la geometria dei vasi sanguigni influenza direttamente le metastasi del cancro al cervello. Le cellule tumorali si attaccano preferenzialmente alle aree di maggiore curvatura dei vasi sanguigni7. Questa scoperta sottolinea l'importanza della geometria vascolare nelle metastasi del cancro. Ancora più importante, in condizioni come la fibrosi e il cancro, l'interruzione della funzione della barriera endoteliale non solo svolge un ruolo nello sviluppo della malattia, ma ostacola anche l'efficacia del trattamento ostacolando un'adeguata somministrazione del farmaco14. La ricerca sulla permeabilità vascolare è fondamentale per far progredire il trattamento delle malattie cardiovascolari e offrire approfondimenti sulla gestione di altre malattie che coinvolgono una funzione vascolare compromessa.
Dato il ruolo cruciale della permeabilità vascolare nella salute e nella malattia, una notevole ricerca si è concentrata sull'esame della natura selettiva della barriera endoteliale per lo sviluppo terapeutico utilizzando modelli animali, accanto alle tradizionali piattaforme di test in vitro 2D e 3D. Tuttavia, i modelli animali hanno limitazioni a causa delle differenze specie-specifiche e delle questioni etiche, oltre che dei costi elevati15,16. Ad esempio, Pfizer, nel 2004, ha dichiarato che negli ultimi 10 anni aveva speso oltre 2 miliardi di dollari per lo sviluppo di farmaci che mostravano effetti promettenti in modelli animali, ma che alla fine hanno fallito nelle fasi avanzate di test sull'uomo17. Inoltre, i modelli 2D tradizionali non imitano accuratamente l'architettura tridimensionale (3D) e la complessa struttura geometrica dei canali vascolari.
Con i progressi nelle tecnologie di biofabbricazione, sono stati compiuti ampi sforzi per fabbricare canali vascolari ricapitolando l'architettura 3D. I canali vascolari su microscala possono essere efficacemente fabbricati all'interno di chip microfluidici utilizzando la litografia morbida, offrendo così un vantaggio dell'analisi in tempo reale18,19. Metodi alternativi, come la colata di idrogel o l'avvolgimento di fogli di celle attorno a uno stampo o a un mandrino, possono essere utilizzati per creare strutture tubolari autoportanti con il diametro desiderato20,21. Tuttavia, questi metodi hanno dei limiti; Ad esempio, i chip microfluidici sono limitati alle configurazioni a microcanali e la colata di idrogel attorno a uno stampo non replica efficacemente più geometrie.
Con l'emergere della tecnologia di bioprinting 3D22, è diventato possibile replicare geometrie complesse depositando con precisione vari materiali idrogel basati su matrice extracellulare (ECM)23,24. Alcuni metodi di bioprinting, come quelli che utilizzano ugelli disposti concentricamente, ad esempio coassiale e triassiale25,26, non possono creare tubi biforcati; Tuttavia, strutture complesse possono essere ottenute con metodi di patterning sacrificale27. Nessuno di questi metodi di bioprinting ha dimostrato di consentire la modellazione in vitro ad alto rendimento, un requisito cruciale per la ricerca farmacologica nella scoperta di farmaci. In questo articolo, presentiamo un metodo per fabbricare in modo efficiente canali vascolari endotelializzati con un controllo efficiente delle dimensioni.
Abbiamo stabilito un approccio semplice utilizzando piastre a sei pozzetti disponibili in commercio, combinate con un metodo di patterning sacrificale in cui un bioprinter fabbrica canali vascolari delle dimensioni e dei pattern desiderati all'interno di un idrogel ECM. Le cellule endoteliali della vena ombelicale umana (HUVECs) sono state seminate per endotelializzare questi canali e valutare la funzionalità dell'endotelio attraverso un test di permeabilità. Questo design consente la perfusione senza pompaggio creando serbatoi di terreno su entrambi i lati del canale e utilizza il flusso guidato dalla gravità con l'aiuto di un bilanciere 2D comunemente usato per imitare la coltura dinamica. Questo approccio elimina la necessità di pompe peristaltiche e facilita la scalabilità di questa piattaforma per applicazioni ad alta produttività. La natura controllata dal computer della tecnologia di bioprinting 3D semplifica anche il processo di fabbricazione, diminuendo così la probabilità di errori durante la produzione. Il modello VOP si dimostra promettente come strumento prezioso per i test farmacologici nella scoperta di farmaci.
Protocollo
1. Generazione del G-code per il bioprinter
- Per generare e visualizzare il percorso di stampa, visitare uno strumento di simulazione G-code online (ad esempio, NCviewer).
- Fare clic sull'icona Nuovo file sull'interfaccia per creare un nuovo file G-code.
- Genera un percorso di stampa scrivendo manualmente i comandi G-code per il canale sacrificale e la camera di silicio. Utilizzate le quote di una piastra standard a sei pozzetti come riferimento per la creazione della geometria.
NOTA: Il codice G utilizzato qui si basa sul codice CNC (Computer Numerical Control). Le funzioni di ciascun comando sono fornite nella tabella supplementare S1. Il formato di piastra a sei pozzetti è stato scelto per la sua compatibilità con i lettori di micropiastre e le configurazioni di microscopia commerciali e per la sua capacità di ospitare volumi adeguati di terreno per supportare la maturazione dell'endotelio, riducendo così al minimo la necessità di frequenti cambi di terreno. Questo protocollo di fabbricazione può anche essere adattato per l'uso con altre piastre a pozzetti standard. - Una volta completato il G-code, fai clic sull'icona Salva file sull'interfaccia per scaricare il file con estensione .nc.
NOTA: Qualsiasi altro algoritmo di generazione di codice G disponibile può essere utilizzato per generare i percorsi di stampa. La geometria del canale vascolare può essere manipolata in questo codice G.
2. Preparazione degli inchiostri sacrificali e della camera al silicone
NOTA: Le fonti di tutti i materiali utilizzati in questo protocollo sono elencate nella Tabella dei materiali.
- Combina due tipi di polimeri siliconici, SE1700 e polidimetilsilossano (PDMS), in un rapporto 10:2. Aggiungere l'agente indurente di ciascun polimero in un rapporto di 10:1, polimero all'agente indurente.
- Utilizzare un miscelatore planetario per miscelare e degassare accuratamente la miscela di polimeri a 2.000 giri/min.
- Con una spatola, trasferire il polimero siliconico miscelato in una siringa monouso da 10 mL. Centrifugare la siringa caricata a 400 × g per 3 minuti a 5 °C per garantire una consistenza uniforme ed evitare bolle durante la stampa.
NOTA: L'inchiostro della camera deve essere utilizzato entro 2 ore dall'aggiunta degli agenti indurenti per garantire una qualità di stampa ottimale. Conservare la siringa a 5 °C durante la preparazione per la stampa. Questo processo aiuta a rallentare l'indurimento dell'inchiostro, che altrimenti può alterare i parametri di stampa. - Pesare Pluronic F-127 (PF127) per preparare una soluzione madre al 40% (p/v) di PF127 in acqua distillata.
- Miscelare la soluzione PF127 in planetaria per 3 min a 400 × g per ottenere omogeneità. Mantenere la miscela omogeneizzata a 4 °C per la completa dissoluzione di PF127.
- Preparare una soluzione madre di trombina di 1.000 unità/mL in soluzione salina tamponata con fosfato di Dulbecco (DPBS).
NOTA: Conservare la soluzione madre di trombina in aliquote da 100 μL per evitare ripetuti cicli di gelo-scongelamento. Le aliquote devono essere conservate a -20 °C per non più di 6 mesi. - Prima di stampare, preparare l'inchiostro sacrificale mescolando la trombina a una diluizione 1:10 con PF127 a una concentrazione di lavoro finale del 36% (p/v) per PF127 e di 100 unità/mL per la trombina. Per preparare 1 mL di inchiostro sacrificale, miscelare 100 μL di soluzione madre di trombina con 900 μL di soluzione madre PF127.
NOTA: Quando si prepara l'inchiostro sacrificale per la stampa di una singola lastra, un volume totale di 1 ml è più che sufficiente.
3. Processo di fabbricazione
- Prima di iniziare il processo di fabbricazione, trattare una piastra a sei pozzetti con plasma di ossigeno (O2) a una potenza di 100 watt per 1 minuto.
- Seguire la procedura descritta nella sezione 2 per preparare sia gli inchiostri sacrificali che quelli al silicone, assicurandosi che gli inchiostri siano privi di bolle e miscelati in modo omogeneo per una stampa uniforme. Caricare con cautela gli inchiostri nella testina di stampa della biostampante. Impostare la temperatura della testina della biostampante a 37 °C per l'inchiostro sacrificale e a 5 °C per l'inchiostro siliconico.
- Collegare un ugello conico a doppia vite da 22 G alla siringa in silicone. Per l'inchiostro sacrificale, scegliere la dimensione dell'ugello in base al diametro del canale desiderato.
NOTA: Qui abbiamo dimostrato tre dimensioni di ugelli: 18 G, 20 G e 22 G. I parametri di stampa ottimali, tra cui la pressione di stampa e la velocità della testina di stampa, sono descritti nella Tabella 1. - Caricare il codice G desiderato e premere la funzione servo ready sull'interfaccia software della biostampante per 3 s. Posizionare la lastra sul tavolino al punto di partenza del codice G e fare clic su Avvia per avviare il processo di stampa.
NOTA: Tipicamente, la fabbricazione di una lastra contenente sei camere richiede circa 1 ora e 10 minuti. La fase 3.4, che prevede il caricamento e l'esecuzione del codice G, è soggetta a variazioni a seconda della specifica biostampante utilizzata. Assicurarsi che vengano mantenute le condizioni di sterilità durante l'utilizzo della biostampante per evitare contaminazioni. - Mettere un coperchio sopra la piastra e trasferire la piastra in un incubatore a CO2 umidificato a 37 °C per 72 ore per polimerizzare le camere di silicio.
NOTA: Sebbene l'indurimento del silicio possa avvenire a una velocità inferiore all'interno dell'incubatore, la piastra non deve essere posizionata all'interno di un forno asciutto.
4. Preparazione dell'idrogel e inclusione del canale
- Preparare una provetta conica da 50 mL contenente 20 mL di 1x PBS. Introdurre 0,01 g di litio fenil-2,4,6-trimetilbenzoilfosfinato (LAP) nella provetta conica per ottenere una soluzione LAP allo 0,05% (p/v). Agitare fino a quando la polvere non è completamente sciolta.
NOTA: Avvolgere il tubo conico in un foglio per evitare l'esposizione alla luce. Conservare la soluzione madre LAP a 4 °C. - Aggiungere 3 g di gelatina metacrilato (GelMA) e 0,2 g di fibrinogeno a 20 ml di soluzione LAP per ottenere una concentrazione finale del 15% di GelMA e dell'1% di fibrinogeno (indicato come GelFib). Porre la miscela in un bagnomaria a 37 °C e mescolare periodicamente a vortice fino a quando la soluzione non è completamente disciolta.
- Dopo la fabbricazione come descritto nella Sezione 3, aggiungere 300 μl di GelFib preriscaldato in ciascuna camera di idrogel per incorporare il modello sacrificale. Reticolare rapidamente il GelMA con la luce ultravioletta (UV) a una lunghezza d'onda di 405 nm con un'intensità di 85 mW/cm2 per 120 s. Ripetere questa procedura per tutti gli altri pozzetti.
NOTA: Il fibrinogeno si lega rapidamente al contatto con il modello sacrificale contenente trombina. Si consiglia di aggiungere idrogel ed eseguire la reticolazione UV individualmente per ogni pozzetto per evitare la gelificazione indesiderata di GelMA a temperatura ambiente. Inoltre, è necessario mantenere le condizioni sterili per prevenire la contaminazione durante il processo di polimerizzazione UV. - Aggiungere 1 mL di DPBS su ciascun lato del canale vascolare in ciascun pozzetto e mantenere la piastra a 4 °C per 15 minuti per liquefare il PF127.
- Dopo 15 minuti, aspirare il DPBS e ripetere il passaggio 4.5 3 volte per il lavaggio completo del PF127.
- Prima di introdurre le cellule nei canali, perfondere DMEM F12 contenente l'1% di Matrigel per 30 minuti attraverso i canali per migliorare l'adesione delle cellule.
5. Cultura HUVEC
- Preriscaldare il terreno di coltura delle cellule endoteliali (ECGM) in un bagno d'acqua a 37 °C per 30 minuti.
- Nel frattempo, recupera una fiala di HUVEC crioconservati dal serbatoio dell'azoto, allenta delicatamente il tappo della fiala e poi stringila nuovamente per rilasciare l'azoto dai fili. Scongelare immediatamente le cellule immergendo il flaconcino in un bagno d'acqua a 37 °C per 2 minuti, assicurandosi che all'interno del flaconcino rimanga una piccola quantità di ghiaccio. Sciacquare la fiala con etanolo al 70% per evitare contaminazioni.
NOTA: Indossare occhiali di sicurezza quando si prelevano le cellule dal serbatoio dell'azoto. Durante questo processo, il tappo del flaconcino deve essere tenuto al di sopra del livello dell'acqua. - Preparare una provetta conica da 15 mL contenente 5 mL di ECGM preriscaldato. Con una micropipetta, trasferire con cura le cellule scongelate dalla fiala alla provetta conica. Per assicurarsi che non rimangano cellule, aggiungere 1 mL di terreno fresco preriscaldato al crioviale, sciacquare l'interno e trasferire le cellule rimanenti nella provetta conica.
- Centrifugare la provetta conica a 200 × g per 3 minuti per ottenere un pellet cellulare. Scartare il surnatante, risospendere le cellule in 10 mL di terreno fresco, trasferire le cellule in un pallone T75 e collocare il pallone in un incubatore di CO2 umidificato a 37 °C.
NOTA: Questo passaggio è importante per rimuovere il dimetilsolfossido presente nel mezzo di congelamento nel crioviale attraverso la centrifugazione. - Rinfrescare il terreno a giorni alterni fino a quando le celle raggiungono l'80-90% di confluenza.
6. Endotelizzazione dei canali
- Preriscaldare ECGM, DPBS, soluzione neutralizzante della tripsina e acido etilendiamminotetraacetico (TE) di tripsina in un bagno d'acqua a 37 °C per 30 minuti.
- Alla confluenza del 90%, sciacquare le cellule in un pallone T75 con 10 mL di DPBS, aggiungere 1 mL di TE allo 0,25% al pallone e incubarlo per 3 minuti.
- Picchiettare delicatamente i lati del pallone e aggiungere 5 mL di soluzione neutralizzante della tripsina per neutralizzare il TE. Trasferire le cellule in una provetta conica da 15 mL. Utilizzare 5 ml di ECGM fresco per raccogliere le cellule rimanenti e aggiungerle al tubo conico.
- Centrifugare la provetta conica a 250 × g per 3 minuti per raccogliere il pellet della cella.
- Scartare il surnatante e risospendere il pellet cellulare in 1 mL di ECGM fresco. Contare le cellule con un emocitometro e ripetere il passaggio 6.4 per ottenere un pellet cellulare. Risospendere 3 milioni di cellule in 90 μL di ECGM fresco.
- Prima di introdurre la sospensione cellulare nel canale, aspirare brevemente il canale con il vuoto per liberare il lume.
NOTA: Evitare l'aspirazione prolungata del canale per evitare di danneggiarne l'integrità. - Caricare delicatamente il canale con una sospensione cellulare a una densità di semina di 0,5 milioni di cellule per pozzetto. Utilizzare una micropipetta per aggiungere ~15 μl di questa sospensione per riempire il canale.
NOTA: La densità di semina può variare a seconda delle dimensioni del canale. Questa densità è ottimizzata per un canale stampato con un ugello da 20 G e un diametro interno di circa 900 μm. - Posizionare la piastra in piano all'interno dell'incubatrice per 2 ore. Successivamente, capovolgere la piastra a 180°, mantenendola in posizione piana per le successive 2 ore.
- Dopo 4 ore, lavare il canale con DPBS per rimuovere le cellule non aderenti e morte. Aggiungere 2 mL di ECGM fresco a ciascun pozzetto (1 mL su ciascun lato del canale). Avvia la coltura dinamica su un bilanciere con un angolo di inclinazione di 10° e 5 giri/min posizionando la piastra sul bilanciere con i canali paralleli alla direzione di oscillazione. Rinfrescare il terreno di coltura a giorni alterni.
NOTA: La coltura dinamica migliora lo scambio del terreno tra i serbatoi e i canali e aiuta le cellule a proliferare durante la notte.
7. Valutazione della maturazione dell'endotelio
- Preriscaldare ECGM e DPBS in un bagno d'acqua a 37 °C per 30 minuti e il reagente Cell Counting Kit-8 (CCK8) a temperatura ambiente.
- Preparare una soluzione di lavoro di CCK8 mescolando 100 μL di reagente CCK8 con 1 mL di ECGM fresco per ogni pozzetto. Mentre si lavora per una piastra/6 canali, preparare 600 μL di reagente CCK8 combinandolo con 6 mL di ECGM fresco.
- Rimuovere il terreno di coltura mediante aspirazione e sciacquare i canali con DPBS. Aggiungere 1 mL di soluzione di lavoro CCK8 a ciascun pozzetto e lasciare che la piastra rimanga piatta all'interno dell'incubatore per 30 minuti. Successivamente, avvia la coltura dinamica su un bilanciere come descritto nel passaggio 6.9 e continua questo processo per le prossime 3 ore.
- Dopo 3 ore, rimuovere il contenuto da ciascun pozzetto inclinando la piastra su un lato e trasferirlo in una nuova piastra a sei pozzetti. Sciacquare i canali con DPBS e aggiungere terreno fresco.
NOTA: Coprire la piastra con un foglio di alluminio fino alla misurazione dell'assorbanza. Mantenere un volume di reagente costante in tutti i pozzetti per garantire letture uniformi. Durante il pipettaggio, evitare accuratamente l'introduzione di bolle d'aria, che possono compromettere l'accuratezza delle letture della densità ottica. - Dopo aver agitato delicatamente la lastra per 15 s per garantire una miscelazione uniforme dei colori, utilizzare un lettore di micropiastre per misurare l'assorbanza a 450 nm.
- Ripetere questa procedura a intervalli di tempo predefiniti. Calcola la densità ottica media per ogni punto temporale e traccia una curva di crescita nel software grafico. Questa curva indica la maturazione relativa dell'endotelio nel tempo.
8. Saggio di permeabilità
- Rimuovi il terreno da un pozzo di interesse.
NOTA: Per il test di permeabilità, si consiglia di trattare ciascun pozzetto separatamente per evitare che altri canali si secchino, il che potrebbe alterare la loro permeabilità vascolare. - Preparare 6 mL di soluzione 0,1 mg/mL di destrano coniugato FITC sciogliendo destrano FITC 70 kDa in DPBS.
NOTA: Preparare una soluzione madre da 20 mg/mL di destrano FITC sciogliendo 100 mg di destrano FITC in 5 mL di DPBS. Dopo aver agitato delicatamente la soluzione, aliquotare 500 μl in provette da 1,5 mL per evitare ripetuti cicli di congelamento-scongelamento. Queste aliquote possono essere conservate a -20 °C per un massimo di 6 mesi. Prima di eseguire il test, diluire la soluzione madre a una concentrazione di lavoro di 0,1 mg/mL. - Posizionare saldamente la piastra sul tavolino del microscopio e regolare l'ingrandimento dell'obiettivo in modalità contrasto di fase per garantire una chiara visibilità della parete del canale nella regione di interesse, insieme al gel situato nelle vicinanze, all'interno del campo visivo.
NOTA: Per un'efficace valutazione della permeabilità, cercare di massimizzare l'area del gel che circonda la regione di interesse nel campo visivo; Questo aspetto è fondamentale per un monitoraggio accurato del trasporto del destrano. - Dopo aver messo a fuoco l'area desiderata, passare dalla modalità a contrasto di fase a quella a fluorescenza. Nella scheda di acquisizione dell'immagine , aggiungere FITC nel canale widefield e acquisire un'immagine prima di aggiungere la soluzione di destrano, per calcolare l'intensità della fluorescenza di fondo. Quindi, aggiungere 1 mL di soluzione di lavoro di destrano FITC su un lato del canale e lasciare che la soluzione fluisca verso l'altro lato del pozzetto, spinta dalla differenza di pressione idrostatica.
- Acquisisci immagini a intervalli di tempo predeterminati, più frequentemente per i canali con elevata permeabilità e meno frequentemente per quelli con minore permeabilità.
9. Misura dell'intensità della fluorescenza in ImageJ
- Nel software di analisi delle immagini ImageJ, misurare l'intensità al punto temporale iniziale (It1), l'intensità media osservata al punto temporale successivo (It2) e l'intensità dovuta al rumore di fondo (Ib), come descritto di seguito. Utilizzare l'equazione (1) per calcolare il coefficiente di permeabilità (Pd). T1 e T2 si riferiscono ai punti temporali iniziale e successivo dell'acquisizione dell'immagine.
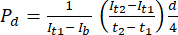 (1)
(1)- Avviare ImageJ e aprire l'immagine acquisita nel punto temporale iniziale.
- Impostare la scala in ImageJ. Passare ad Analizza | Imposta scala. Inserire la scala e l'unità di misura note.
- Seleziona lo strumento rettangolo e disegna un rettangolo sull'area del gel in cui è richiesta la misurazione dell'intensità della fluorescenza.
- Passare ad Analizza | Impostare le misure e assicurarsi che il valore medio del grigio sia selezionato.
NOTA: Questa opzione misura l'intensità media all'interno dell'area selezionata. Altri parametri possono essere selezionati in base alle esigenze per l'analisi data. - Con l'area ancora selezionata, vai su Analizza | Misura o semplicemente premi M. Attendi che si apra una finestra dei risultati , che mostri l'intensità media della fluorescenza e tutti gli altri parametri selezionati.
- Effettua tre misurazioni e calcola il valore medio dell'intensità della fluorescenza in un foglio di calcolo.
- Ripetere questa procedura per le immagini acquisite al successivo punto temporale t2, nonché per quelle acquisite prima dell'aggiunta della soluzione di destrano per il calcolo dell'intensità della fluorescenza al punto temporale successivo, per determinare la fluorescenza di fondo.
Risultati
La piattaforma VOP, caratterizzata da flessibilità nelle dimensioni e nel modello, è stata realizzata con un sistema di bioprinting multi-testa. I canali, sia cavi che in grado di perfondere, sono stati seminati con HUVEC per facilitare l'endotelizzazione e sono stati successivamente valutati con un test di permeabilità (Figura 1A). Per dimostrare la capacità di produzione multiscala di questo metodo, abbiamo stampato tre configurazioni distinte: diritta...
Discussione
Sfruttando la precisione, l'automazione e la natura controllata da computer della tecnologia di bioprinting 3D, abbiamo stabilito un metodo semplificato per la fabbricazione di canali vascolari in piastre standard a sei pozzetti, che sono state scelte per la loro compatibilità con i lettori di micropiastre commerciali e le configurazioni di imaging per microscopi. Il design della piastra può ospitare canali di più dimensioni e un volume sufficiente di fluidi per la crescita di canali ...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dalle sovvenzioni della National Research Foundation of Korea (NRF) finanziate dal governo coreano (Ministero della Scienza e delle TIC, MSIT) [No. NRF-2019R1C1C1009606; n. 2020R1A5A8018367; e n. RS-2024-00423107]. Questa ricerca è stata supportata dal Programma di Sviluppo delle Tecnologie Bio e Mediche delle sovvenzioni NRF finanziate dal MSIT [No. NRF-2022M3A9E4017151 e n. NRF-2022M3A9E4082654]. Questo lavoro è stato sostenuto dal Programma di Innovazione Tecnologica [n. 20015148] e dal Progetto Alchimista [n. 20012378] finanziato dal Ministero del Commercio, dell'Industria e dell'Energia (MOTIE, Corea). Questo lavoro è stato sostenuto anche dal Korea Institute of Planning and Evaluation for Technology in Food, Agriculture and Forestry (IPET) attraverso l'Agriculture and Food Convergence Technologies Program for Research Manpower development, finanziato dal Ministero dell'Agricoltura, dell'Alimentazione e degli Affari Rurali (MAFRA) [No. RS-2024-00397026].
Materiali
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
Riferimenti
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -. L., Wautier, M. -. P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958 (2022).
- Park, W., Lee, J. -. S., Gao, G., Kim, B. S., Cho, D. -. W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696 (2023).
- Sun, H. -. J., Wu, Z. -. Y., Nie, X. -. W., Bian, J. -. S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568 (2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778 (2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771 (2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267 (2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Can Pfizer deliver. MIT Technology Review Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004)
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013 (2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168 (2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141 (2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012 (2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798 (2017).
- Cho, W. -. W., Ahn, M., Kim, B. S., Cho, D. -. W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093 (2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027 (2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102 (2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744 (2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022 (2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345 (2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171 (2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683 (2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938 (2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -. J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043 (2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723 (2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071 (2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760 (2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151 (2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon