需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
高通量生物打印方法,用于模拟具有尺寸和图案灵活性的标准六孔板中的血管通透性
摘要
我们提出了一种使用 3D 生物打印技术在标准六孔板上高通量生产具有灵活尺寸和所需模式的血管通道的方案,称为板上血管 (VOP)。该平台有可能推动与内皮受损相关的疾病的治疗开发。
摘要
血管通透性是开发与内皮受损相关的疾病疗法的关键因素,例如冠状动脉内皮功能障碍和血脑屏障功能受损。现有的制造技术不能充分复制人体血管网络的几何变化,这会严重影响疾病进展;此外,这些技术通常涉及多步骤制造程序,阻碍了药理学测试所需的高通量生产。本文提出了一种生物打印方案,用于直接在标准六孔板上创建具有所需图案和大小的多个血管组织,克服了生物打印技术中现有的分辨率和生产率挑战。建立了一种简化的制造方法,在水凝胶内构建六个中空的可灌注通道,随后与人脐静脉内皮细胞衬里,形成功能性和成熟的内皮细胞。3D 生物打印的计算机控制特性确保了高重现性,并且比传统方法需要更少的手动制造步骤。这凸显了 VOP 作为建模血管通透性和推进药物发现的高效高通量平台的潜力。
引言
贯穿人体的血管网络通过动态调节血液与周围组织之间的分子和细胞交换,起到重要的运输屏障的作用。这种调节对于防止组织水肿和实现选择性营养物质和细胞交换至关重要,从而支持组织代谢和体内平衡1。内皮通透性改变是许多健康状况的一个因素,它会影响疾病的严重程度和治疗效果2。血管内皮起到选择性屏障的作用,促进血管、组织和器官之间的转移。这种调节涉及多种机制,例如溶质和小分子的基本过滤、血管屏障的有意破坏以及前列腺素和生长因子等分子对通透性水平的影响3。
这种调节的关键因素包括内皮细胞连接、白细胞迁移和血脑屏障的功能4。鉴于其复杂性,该过程在不同的环境中有所不同,涉及不同的血管类型并利用不同的解剖途径。理解血管通透性的生物学基础对于设计治疗方法来治疗与异常血管通透性相关的疾病至关重要。维持血管通透性对于血管系统和周围组织的健康至关重要;因此,该功能的损害会导致内皮功能障碍,即内皮失去正常功能的状态。
内皮功能障碍是几种常见人类疾病的前兆,包括高血压、冠状动脉疾病、糖尿病和癌症 5,6,7。这种情况可以以多种方式出现,包括血管舒张减少、血管通透性增加和倾向于促炎状态。这种病理状态是几个关键心血管问题的早期阶段,例如冠状动脉疾病、中风和外周动脉疾病8,这些问题仍然是美国死亡的主要原因1。内皮功能障碍影响心血管健康以及血脑屏障 (BBB),并在各种神经系统疾病的进展中起主要作用。功能障碍会增加 BBB 通透性,从而使毒素、病原体和免疫细胞渗透到中枢神经系统中,并导致神经系统疾病,如中风、阿尔茨海默病、多发性硬化症和脑部感染9。
糖尿病患者的内皮功能障碍的特点是内皮调节血管张力和产生血管扩张介质(如一氧化氮)的能力受损,导致血管舒张受损10。高血糖诱导的途径(如蛋白激酶 C 激活和氧化应激)会加剧这种情况,显着导致糖尿病血管疾病的进展11。此外,已发现炎症环境可增强肿瘤细胞与脑微血管内皮细胞的粘附,而据报道渗漏的内皮是癌症转移的主要因素12,13。已发现血管的几何形状直接影响脑癌转移。肿瘤细胞优先附着在血管弯曲度较大的区域7。这一发现强调了血管几何形状在癌症转移中的重要性。更重要的是,在纤维化和癌症等情况下,被破坏的内皮屏障功能不仅在疾病发展中发挥作用,而且还会通过阻碍充分的药物输送来阻碍治疗效果14。血管通透性研究对于推进心血管疾病治疗和为管理涉及血管功能受损的其他疾病提供见解至关重要。
鉴于血管通透性在健康和疾病中的关键作用,大量研究集中在通过使用动物模型以及传统的 2D 和 3D 体外测试平台来检查内皮屏障对治疗开发的选择性。然而,由于物种特异性的差异和伦理问题,以及高成本,动物模型存在局限性15,16。例如,辉瑞在 2004 年表示,在过去 10 年中,它花费了超过 20 亿美元用于药物开发,这些药物在动物模型中显示出有希望的效果,但最终在高级人体测试阶段失败17。此外,传统的 2D 模型无法准确模拟三维 (3D) 架构和血管通道的复杂几何结构。
随着生物制造技术的进步,人们开始做出广泛的努力,旨在制造血管通道,同时概括 3D 建筑。通过使用软光刻技术,可以在微流体芯片内有效地制造微尺度血管通道,从而提供实时分析的优势18,19。替代方法,例如水凝胶铸造或将细胞片包裹在模具或心轴上,可用于创建所需直径为20,21 的独立管状结构。但是,这些方法有局限性;例如,微流体芯片仅限于微通道配置,而模具周围的水凝胶铸造无法有效地复制多个几何形状。
随着 3D 生物打印技术的出现22,通过精确沉积各种基于细胞外基质 (ECM) 的水凝胶材料来复制复杂的几何形状已成为可能23,24。一些生物打印方法,例如使用同心排列的喷嘴的方法,例如同轴和三轴25,26,不能产生分叉管;然而,复杂的结构可以通过牺牲图案化方法来实现27。这些生物打印方法都没有被证明能够实现高通量体外建模——这是药物发现中药理学研究的关键要求。在此,我们提出了一种有效制造内皮化血管通道的方法,可有效控制尺寸。
我们建立了一种简单的方法,使用市售的六孔板,结合牺牲图案化方法,其中生物打印机在 ECM 水凝胶内制造所需尺寸和图案的血管通道。接种人脐静脉内皮细胞 (HUVECs) 以内皮化这些通道并通过通透性测定评估内皮的功能。这种设计通过在通道的两侧创建培养基储液器来实现无泵灌流,并在常用的 2D 摇杆的帮助下使用重力驱动流来模拟动态培养。这种方法消除了对蠕动泵的需求,并有助于该平台在高通量应用中的可扩展性。3D 生物打印技术的计算机控制特性还简化了制造过程,从而降低了制造过程中出错的可能性。VOP 模型有望成为药物发现中药理学测试的宝贵工具。
研究方案
1. 生成生物打印机的 G 代码
- 要生成和可视化打印路径,请访问在线 G 代码模拟工具(例如 NCviewer)。
- 点击 新文件 界面上的图标以创建新的 G 代码文件。
- 通过手动编写牺牲通道和硅腔的 G 代码命令来生成打印路径。使用标准 6 孔板的尺寸作为创建几何的参考。
注意:此处使用的 G 代码基于计算机数控 (CNC) 代码。 补充表 S1 中提供了每个命令的功能。之所以选择六孔板规格,是因为它与市售微孔板读板机和显微镜装置兼容,并且能够容纳足够体积的培养基以支持内皮成熟,从而最大限度地减少频繁更换培养基的需要。该制备方案也适用于其他标准孔板。 - G 代码完成后,单击 保存文件 界面上的图标以下载扩展名为 .nc 的文件。
注意:任何其他可用的 G 代码生成算法都可用于生成打印路径。血管通道的几何形状可以在此 G 代码中进行操作。
2. 牺牲和硅室油墨的制备
注意:本协议中使用的所有材料的来源均列在 材料表中。
- 将 SE1700 和聚二甲基硅氧烷 (PDMS) 两种有机硅聚合物以 10:2 的比例混合使用。按10:1的比例添加每种聚合物的固化剂,聚合物与固化剂。
- 使用行星式混合器以 2,000 rpm 的速度彻底混合和脱气聚合物混合物。
- 用抹刀将混合的有机硅聚合物转移到 10 mL 一次性注射器中。将加载的注射器在 5 °C 下以 400 × g 离心 3 分钟,以确保均匀的一致性并避免打印过程中出现气泡。
注意:腔室墨水应在添加固化剂后 2 小时内使用,以确保最佳打印质量。在准备打印时将注射器储存在 5 °C 下。此过程有助于减缓油墨固化,否则可能会改变打印参数。 - 称取 Pluronic F-127 (PF127) 以制备 PF127 的 40% (w/v) 蒸馏水储备液。
- 将 PF127 溶液在行星式混合器中以 400 × g 混合 3 分钟,以实现均匀性。将匀浆混合物保持在 4 °C 以使 PF127 完全溶解。
- 在 Dulbecco 磷酸盐缓冲盐水 (DPBS) 中制备 1,000 单位/mL 的凝血酶储备液。
注:以 100 μL 等分试样储存凝血酶原液,以避免重复冻融循环。等分试样应在 -20 °C 下储存不超过 6 个月。 - 打印前,通过将凝血酶与 PF127 以 1:10 稀释度混合至最终工作浓度为 36% (w/v)(PF127)和 100 单位/mL(凝血酶)来制备牺牲墨水。要制备 1 mL 牺牲墨水,请将 100 μL 凝血酶原液与 900 μL PF127 原液混合。
注:在制备用于打印单板的牺牲墨水时,1 mL 的总体积绰绰有余。
3. 制造过程
- 在开始制造过程之前,用 100 瓦强度的氧 (O2) 等离子体处理六孔板 1 分钟。
- 按照第 2 节中概述的程序准备牺牲油墨和硅油墨,确保油墨没有气泡并均匀混合以实现一致的印刷。小心地将墨水装入生物打印机的打印头中。将生物打印机头部的温度设置为 37 °C(牺牲墨水)和 5 °C(硅墨水)。
- 将 22 G 双螺纹锥形喷嘴连接到硅胶注射器上。对于牺牲墨水,请根据所需的通道直径选择喷嘴尺寸。
注意:在这里,我们展示了三种尺寸的喷嘴:18 G、20 G 和 22 G。 表 1 概述了包括打印压力和打印头速度在内的最佳打印参数。 - 加载所需的 G 代码并按下生物打印机软件界面上的 伺服就绪 功能 3 秒。将印版放在载物台上 G 代码的起点处,然后单击 start( 开始 )以启动打印过程。
注意:通常,制造一个包含六个腔室的板大约需要 1 小时 10 分钟。步骤 3.4,涉及 G 代码的加载和执行,根据所使用的特定生物打印机,可能会有所不同。确保在使用生物打印机时保持无菌条件,以避免污染。 - 盖上板盖,将板转移到 37 °C 的加湿 CO2 培养箱中 72 小时以固化硅室。
注意:尽管培养箱内的硅固化速度可能较慢,但不得将板放置在干燥的烘箱内。
4. 水凝胶制备和通道包埋
- 准备一个含有 20 mL 1x PBS 的 50 mL 锥形管。将 0.01 g 苯基-2,4,6-三甲基苯甲酰次膦酸锂 (LAP) 放入锥形管中,制成 0.05% (w/v) LAP 溶液。涡旋直到粉末完全溶解。
注意:用箔纸包裹锥形管以防止暴露在光线下。将 LAP 储备溶液储存在 4 °C。 - 将 3 g 甲基丙烯酸明胶 (GelMA) 和 0.2 g 纤维蛋白原添加到 20 mL LAP 溶液中,以达到 15% GelMA 和 1% 纤维蛋白原(称为 GelFib)的最终浓度。将混合物置于 37 °C 水浴中,定期涡旋混合,直至溶液完全溶解。
- 按照第 3 节所述进行制备后,将 300 μL 预热的 GelFib 加入每个水凝胶腔室中,以嵌入牺牲模式。将 GelMA 与波长为 405 nm、强度为 85 mW/cm2 的紫外线 (UV) 快速交联 120 秒。对所有其他孔重复此过程。
注意:纤维蛋白原在与含有凝血酶的牺牲模式接触时迅速交联。我们建议为每个孔添加水凝胶并单独进行 UV 交联,以避免 GelMA 在室温下发生不必要的凝胶化。此外,应保持无菌条件,以防止 UV 固化过程中的污染。 - 在每个孔的血管通道的每一侧加入 1 mL 的 DPBS,并将板在 4 °C 下保持 15 分钟以液化 PF127。
- 15 分钟后,吸出 DPBS,然后重复步骤 4.5 3 次以完全洗涤 PF127。
- 在将细胞引入通道之前,通过通道灌注含有 1% 基质胶的 DMEM F12 30 分钟以增强细胞附着。
5. HUVEC 培养
- 将内皮细胞生长培养基 (ECGM) 在 37 °C 水浴中预热 30 分钟。
- 同时,从氮气罐中取出一小瓶冷冻保存的 HUVEC,轻轻松开小瓶的盖子,然后重新拧紧以从螺纹中释放氮气。将样品瓶浸入 37 °C 水浴中 2 分钟,确保样品瓶内残留少量冰,立即解冻细胞。用 70% 乙醇冲洗样品瓶以防止污染。
注意: 从氮气罐中取出电池时,请佩戴护目镜。在此过程中,样品瓶的盖子必须保持在水位以上。 - 准备一根 15 mL 锥形管,其中包含 5 mL 预热的 ECGM。用微量移液器小心地将解冻的细胞从小瓶转移到锥形管中。为确保没有细胞残留,向冻存管中加入 1 mL 新鲜的预热培养基,冲洗内部,然后将剩余的细胞转移到锥形管中。
- 将锥形管以 200 × g 离心 3 分钟以获得细胞沉淀。弃去上清液,将细胞重悬于 10 mL 新鲜培养基中,将细胞转移至 T75 培养瓶中,然后将培养瓶置于 37 °C 加湿的 CO2 培养箱中。
注:此步骤对于通过离心去除冷冻管中冷冻培养基中存在的二甲基亚砜非常重要。 - 每隔一天刷新一次培养基,直到细胞达到 80-90% 汇合。
6. 通道内皮化
- 在 37 °C 水浴中预热 ECGM、DPBS、胰蛋白酶中和胰蛋白酶乙二胺四乙酸 (TE) 30 分钟。
- 在 90% 汇合度时,用 10 mL DPBS 冲洗 T75 培养瓶中的细胞,向培养瓶中加入 1 mL 0.25% TE,并孵育 3 分钟。
- 轻轻敲击培养瓶的侧面,加入 5 mL 胰蛋白酶中和溶液以中和 TE。将细胞转移至 15 mL 锥形管中。使用 5 mL 新鲜 ECGM 收集剩余细胞并将它们添加到锥形管中。
- 将锥形管以 250 × g 离心 3 分钟以收集细胞沉淀。
- 弃去上清液,将细胞沉淀重悬于 1 mL 新鲜 ECGM 中。用血细胞计数器计数细胞,然后重复步骤 6.4 以获得细胞沉淀。在 90 μL 新鲜 ECGM 中重悬 300 万个细胞。
- 在将细胞悬液引入通道之前,短暂地真空吸取通道以清除管腔。
注意: 避免长时间吸入通道,以免破坏其完整性。 - 以每孔 50 万个细胞的接种密度轻轻加载细胞悬液。使用微量移液器添加 ~15 μL 这种悬浮液以填充通道。
注意:种子密度可能因通道的大小而异。该密度针对使用 20 G 喷嘴打印且内径约为 900 μm 的通道进行了优化。 - 将板平放在培养箱内 2 小时。随后,将板倒置至 180°,在接下来的 2 小时内将其保持在平坦位置。
- 4 小时后,用 DPBS 洗涤通道以去除非粘附和死细胞。向每个孔中加入 2 mL 新鲜 ECGM(通道每侧 1 mL)。将板放在摇杆上,使通道平行于摇摆方向,以 10° 倾斜角和 5 rpm 的速度在摇杆上开始动态培养。每隔一天刷新一次生长培养基。
注:动态培养可增强储液槽和通道之间的培养基交换,并帮助细胞在夜间增殖。
7. 内皮成熟评估
- 将 ECGM 和 DPBS 在 37 °C 水浴中预热 30 分钟,并在室温下使用细胞计数试剂盒 8 (CCK8) 试剂。
- 将 100 μL CCK8 试剂与 1 mL 新鲜 ECGM 混合,制备 CCK8 的工作溶液。在使用 plate/6 通道时,将 600 μL CCK8 试剂与 6 mL 新鲜 ECGM 混合,制备 CCK8 试剂。
- 通过抽吸去除生长培养基,并用 DPBS 冲洗通道。向每个孔中加入 1 mL CCK8 工作溶液,让板在培养箱内保持平整 30 分钟。之后,如步骤 6.9 所述在摇杆上开始动态培养,并在接下来的 3 小时内继续此过程。
- 3 小时后,通过将板向一侧倾斜从每个孔中取出内容物,然后将它们转移到新的六孔板中。用 DPBS 冲洗通道并加入新鲜培养基。
注意:用铝箔盖住板,直到测量吸光度。在所有孔中保持一致的试剂体积,以确保读数均匀。移液时,请小心避免引入气泡,否则会影响光密度读数的准确性。 - 轻轻摇动板 15 秒以确保颜色均匀混合后,使用酶标仪测量 450 nm 处的吸光度。
- 按预定义的时间间隔重复此过程。计算每个时间点的平均光密度,并在绘图软件中绘制生长曲线。该曲线表示内皮随时间的相对成熟度。
8. 渗透性测定
- 从一个感兴趣的孔中取出培养基。
注:对于通透性测定,建议分别处理每个孔,以防止其他通道变干,这可能会改变其血管通透性。 - 通过将 70 kDa FITC 葡聚糖溶解在 DPBS 中,制备 6 mL 0.1 mg/mL FITC 偶联葡聚糖溶液。
注:通过将 100 mg FITC 葡聚糖溶解在 5 mL DPBS 中,制备 20 mg/mL FITC 葡聚糖储备液。轻轻涡旋溶液后,将 500 μL 分装到 1.5 mL 试管中,以避免重复冻融循环。这些等分试样可在 -20 °C 下储存最长 6 个月。在进行测定之前,将储备溶液稀释至 0.1 mg/mL 的工作浓度。 - 将板牢固地放置在显微镜载物台上,并在相差模式下调整物镜的放大倍率,以确保在视野内感兴趣区域的通道壁以及附近的凝胶清晰可见。
注意:为了进行有效的渗透性评估,请尝试在视野中最大化感兴趣区域周围的凝胶面积;这方面是准确监测葡聚糖运输的关键。 - 聚焦到所需区域后,从相差模式变为荧光模式。在 图像采集 选项卡下,将 FITC 添加到 宽场通道中,并在添加葡聚糖溶液之前采集图像,以计算背景荧光强度。然后,在通道的一侧加入 1 mL FITC 葡聚糖工作溶液,让溶液在静水压差的驱动向井的另一侧。
- 以预定的时间间隔采集图像 - 对于高渗透率的通道,频率较高,而对于渗透率较低的通道,频率较低。
9. ImageJ 中的荧光强度测量
- 在 ImageJ 图像分析软件中,测量初始时间点 (It1) 的强度、 在后期时间点观察到的平均强度 (It2) 以及背景噪声引起的强度 (Ib),如下所述。使用公式 (1) 计算磁导率系数 (Pd)。T1 和 T2 是指图像采集的初始时间点和后期时间点。
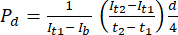 (1)
(1)- 启动 ImageJ,并打开在初始时间点采集的图像。
- 在 ImageJ 中设置比例。导航到 Analyze |设置 Scale。输入已知的比例和度量单位。
- 选择 矩形工具 ,并在需要测量荧光强度的凝胶区域上绘制一个矩形。
- 导航到 Analyze |设置 Measurements 并确保选中 Mean gray 值 。
注:此选项测量所选区域内的平均强度。可以根据给定分析的需要选择其他参数。 - 在该区域仍处于选中状态的情况下,导航到 Analyze |测量 或直接按 M。等待 结果 窗口打开,显示平均荧光强度和所选的任何其他参数。
- 进行 3 次测量,并在电子表格中计算平均荧光强度值。
- 对在随后的时间点 t2 捕获的图像以及添加葡聚糖溶液之前拍摄的图像重复此过程,以计算稍后时间点的荧光强度,以确定背景荧光。
结果
VOP 平台在尺寸和图案方面具有灵活性,采用多头生物打印系统制造。用 HUVEC 接种空心且能够灌注的通道以促进内皮化,随后通过通透性测定进行评估(图 1A)。为了证明这种方法的多尺度制造能力,我们打印了三种不同的配置:直线、分叉和波纹(图 1B)。通过一种简单的制造方法,可以在标准的六孔板内产生嵌入水凝胶基质...
讨论
利用 3D 生物打印技术的精度、自动化和计算机控制特性,我们建立了一种在标准六孔板中制造血管通道的简化方法,选择该方法是因为它们与商用酶标仪和显微镜成像装置兼容。该板的设计可以容纳多尺寸通道和足够体积的介质,以适应更大通道的增长,同时减少介质更换的必要频率。这种设计的未来改编可以适应其他市售的标准孔板,从而提高实验通量并减少材料的?...
披露声明
作者声明没有竞争性的经济利益。
致谢
这项工作得到了韩国政府(科学和信息通信技术部,MSIT)资助的韩国国家研究基金会 (NRF) 资助的支持 [No.NRF-2019R1C1C1009606;编号 2020R1A5A8018367;和否。RS-2024-00423107]。这项研究得到了 MSIT 资助的 NRF 赠款的生物和医疗技术开发计划的支持 [No.NRF-2022M3A9E4017151 和编号。NRF-2022M3A9E4082654]。这项工作得到了由贸易、工业和能源部(韩国 MOTIE)资助的技术创新计划 [第 20015148 号] 和炼金术士项目 [第 20012378 号]的支持。这项工作还得到了韩国食品、农业和林业技术规划与评估研究所 (IPET) 通过农业和食品融合技术计划的支持,该计划由农业、食品和农村事务部 (MAFRA) 资助,用于研究人力开发 [No.RS-2024-00397026]。
材料
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
参考文献
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -. L., Wautier, M. -. P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958 (2022).
- Park, W., Lee, J. -. S., Gao, G., Kim, B. S., Cho, D. -. W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696 (2023).
- Sun, H. -. J., Wu, Z. -. Y., Nie, X. -. W., Bian, J. -. S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568 (2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778 (2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771 (2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267 (2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Can Pfizer deliver. MIT Technology Review Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004)
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013 (2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168 (2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141 (2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012 (2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798 (2017).
- Cho, W. -. W., Ahn, M., Kim, B. S., Cho, D. -. W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093 (2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027 (2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102 (2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744 (2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022 (2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345 (2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171 (2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683 (2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938 (2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -. J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043 (2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723 (2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071 (2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760 (2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151 (2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。