JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
크기 및 패턴 유연성을 갖춘 표준 six-well plates의 혈관 투과성을 모델링하기 위한 High-throughput Bioprinting 방법
요약
당사는 VOP(vessels-on-a-plate)라고 하는 3D 바이오프린팅 기술을 사용하여 표준 6웰 플레이트에서 유연한 크기와 원하는 패턴을 가진 혈관 채널의 고처리량 생산을 위한 프로토콜을 제시합니다. 이 플랫폼은 손상된 내피와 관련된 질환에 대한 치료법 개발을 발전시킬 수 있는 잠재력을 가지고 있습니다.
초록
혈관 투과성은 관상 동맥의 내피 기능 장애 및 혈액-뇌 장벽의 기능 손상과 같은 손상된 내피와 관련된 질환에 대한 치료법을 개발하는 데 중요한 요소입니다. 기존의 제조 기술은 질병 진행에 상당한 영향을 미치는 인체 혈관 네트워크의 기하학적 변화를 적절하게 복제하지 못합니다. 더욱이, 이러한 기술에는 종종 약리학적 검사에 필요한 고처리량 생산을 방해하는 다단계 제조 절차가 포함됩니다. 이 논문은 표준 6웰 플레이트에서 원하는 패턴과 크기의 여러 혈관 조직을 직접 생성하여 바이오프린팅 기술의 기존 해상도 및 생산성 문제를 극복하기 위한 바이오프린팅 프로토콜을 제시합니다. 하이드로겔 내에 6개의 속이 빈 관류 가능한 채널을 구성하기 위해 단순화된 제조 접근 방식이 확립되었으며, 이후 인간 제대 정맥 내피 세포로 라이닝되어 기능적이고 성숙한 내피를 형성했습니다. 3D 바이오프린팅의 컴퓨터 제어 특성은 높은 재현성을 보장하고 기존 방법보다 더 적은 수동 제작 단계를 필요로 합니다. 이는 혈관 투과성을 모델링하고 약물 발견을 발전시키기 위한 효율적인 고처리량 플랫폼으로서의 VOP의 잠재력을 강조합니다.
서문
인체 전체의 혈관 네트워크는 혈액과 주변 조직 사이의 분자와 세포 교환을 동적으로 조절함으로써 중요한 수송 장벽으로 기능합니다. 이 조절은 조직 부종을 예방하고 선택적 영양소 및 세포 교환을 가능하게 하여 조직 대사와 항상성을 지원하는 데 필수적입니다1. 많은 건강 상태의 요인인 내피 투과성의 변화는 질병의 중증도와 치료 효능 모두에 영향을 미친다2. 혈관 내피는 선택적 장벽으로 작용하여 혈관, 조직 및 장기 간의 전달을 용이하게 합니다. 이 조절은 용질과 소분자의 기본 여과, 혈관 장벽의 의도적 파괴, 프로스타글란딘 및 성장 인자와 같은 분자가 투과성 수준에 미치는 영향과 같은 여러 메커니즘을 포함한다3.
이 조절의 핵심 요소에는 내피 세포 접합부, 백혈구의 이동, 혈액-뇌 장벽의 기능이 포함된다4. 그 복잡성을 감안할 때, 이 과정은 다양한 혈관 유형을 포함하고 고유한 해부학적 경로를 활용하면서 환경에 따라 다릅니다. 혈관 투과성의 생물학적 토대를 이해하는 것은 비정상적인 혈관 투과성과 관련된 상태를 치료하기 위한 치료 접근법을 고안하는 데 중요합니다. 혈관 투과성을 유지하는 것은 혈관 시스템과 주변 조직의 건강에 매우 중요합니다. 결과적으로, 이 기능의 손상은 내피가 정상적인 기능을 상실하는 상태인 내피 기능 장애로 이어집니다.
내피 기능 장애는 고혈압, 관상 동맥 질환, 당뇨병 및 암을 포함한 여러 만성 인간 질병의 전조 증상입니다 5,6,7. 이 상태는 혈관 확장 감소, 혈관 투과성 증가, 염증 유발 경향 등 여러 가지 방식으로 나타날 수 있습니다. 이러한 병리학적 상태는 관상동맥 질환, 뇌졸중, 말초동맥 질환8과 같은 여러 중요한 심혈관 질환의 초기 단계로, 미국에서 계속해서 주요 사망 원인이 되고 있다1. 내피 기능 장애는 심혈관 건강과 혈액-뇌 장벽(BBB)에 영향을 미치며 다양한 신경 장애의 진행에 중요한 역할을 합니다. 기능 장애는 BBB 투과성을 증가시켜 독소, 병원체 및 면역 세포가 중추 신경계에 침투하여 뇌졸중, 알츠하이머병, 다발성 경화증 및 뇌 감염과 같은 신경 장애에 기여할 수 있습니다9.
당뇨병에서 내피 기능 장애는 혈관 긴장도를 조절하고 산화질소와 같은 혈관 확장 매개체를 생성하는 내피의 능력이 손상되어 혈관 확장을 손상시키는 것이 특징이다10. 이 질환은 단백질 키나아제 C 활성화 및 산화 스트레스와 같은 고혈당증 유발 경로에 의해 악화되어 당뇨병성 혈관 질환의 진행에 크게 기여합니다11. 또한, 염증성 환경은 뇌 미세혈관 내피 세포에 대한 종양 세포의 접착력을 향상시키는 것으로 밝혀졌으며, 누출되는 내피는 암 전이의 주요 요인으로 보고되었습니다12,13. 혈관의 기하학적 구조는 뇌암 전이에 직접적인 영향을 미치는 것으로 밝혀졌습니다. 종양세포는 혈관 곡률이 큰 부위에 우선적으로 부착한다7. 이 발견은 암 전이에서 혈관 기하학의 중요성을 강조합니다. 더 중요한 것은 섬유증 및 암과 같은 질환에서 내피 장벽 기능의 붕괴는 질병 발병에 중요한 역할을 할 뿐만 아니라 적절한 약물 전달을 방해하여 치료 효과를 저해한다는 것입니다14. 혈관 투과성에 대한 연구는 심혈관 질환 치료를 발전시키고 혈관 기능 저하와 관련된 다른 질병 관리에 대한 통찰력을 제공하는 데 중요합니다.
건강 및 질병에서 혈관 투과성의 중요한 역할을 감안할 때, 상당한 연구는 기존의 2D 및 3D 체외 테스트 플랫폼과 함께 동물 모델을 사용하여 치료 개발을 위한 내피 장벽의 선택적 특성을 조사하는 데 중점을 두었습니다. 그러나 동물 모델은 종 특유의 차이와 윤리적 문제, 그리고 높은 비용으로 인해 한계가 있다15,16. 예를 들어, 2004년 화이자(Pfizer)는 지난 10년 동안 동물 모델에서 유망한 효과를 보여준 약물 개발에 20억 달러 이상을 썼지만 결국 고급 인체 실험 단계17에서 실패했다고 밝혔다. 더욱이 기존의 2D 모델은 3차원(3D) 구조와 혈관 채널의 복잡한 기하학적 구조를 정확하게 모방하지 못합니다.
생체 제조 기술의 발전으로 3D 아키텍처를 재현하면서 혈관 채널을 제작하는 데 광범위한 노력이 기울여졌습니다. 마이크로 스케일 혈관 채널은 소프트 리소그래피를 사용하여 미세유체 칩 내에서 효과적으로 제작할 수 있으며, 따라서 실시간 분석의 이점을 제공합니다18,19. 하이드로겔 주조 또는 금형 또는 맨드릴 주위에 셀 시트를 감싸는 것과 같은 대체 방법을 사용하여 원하는 직경20,21을 가진 독립형 관형 구조를 만들 수 있습니다. 그러나 이러한 방법에는 한계가 있습니다. 예를 들어, 미세유체 칩은 마이크로채널 구성으로 제한되며, 금형 주변의 하이드로겔 주조는 여러 형상을 효과적으로 복제하지 못합니다.
3D 바이오프린팅 기술(22)의 출현으로 다양한 세포외 기질(ECM) 기반 하이드로겔 물질을 정밀하게 증착하여 복잡한 형상을 복제하는 것이 가능해졌습니다23,24. 동심원으로 배열된 노즐을 사용하는 것과 같은 일부 바이오프린팅 방법, 예를 들어, 동축 및 삼축(25,26)은 분기된 튜브를 생성할 수 없습니다; 그러나, 복잡한 구조는 희생적 패터닝 방법(sacrificial patterning methods)으로 달성될 수 있다27. 이러한 바이오프린팅 방법 중 어느 것도 약물 발견의 약리학 연구에 중요한 요구 사항인 고처리량 in vitro 모델링을 가능하게 하는 것으로 입증되지 않았습니다. 여기에서, 우리는 치수에 대한 효율적인 제어를 가지고 내피화된 혈관 채널을 효율적으로 제작하는 방법을 제시한다.
우리는 상업적으로 이용 가능한 6웰 플레이트를 사용하여 간단한 접근 방식을 확립했으며, 바이오프린터가 ECM 하이드로겔 내에서 원하는 크기와 패턴의 혈관 채널을 제작하는 희생 패터닝 방법을 결합했습니다. 인간 제대 정맥 내피 세포(HUVECs)를 파종하여 이러한 채널을 내피화하고 투과성 분석을 통해 내피의 기능을 평가했습니다. 이 설계는 채널 양쪽에 미디어 저장소를 생성하여 펌프없는 관류를 가능하게 하고 일반적으로 사용되는 2D 로커의 도움으로 중력 구동 흐름을 사용하여 동적 문화를 모방합니다. 이 접근 방식은 연동 펌프의 필요성을 없애고 고처리량 애플리케이션을 위한 이 플랫폼의 확장성을 촉진합니다. 3D 바이오프린팅 기술의 컴퓨터 제어 특성은 또한 제조 공정을 간소화하여 제조 중 오류 가능성을 줄입니다. VOP 모델은 약물 발견에서 약리학적 테스트를 위한 귀중한 도구로서 가능성을 보여줍니다.
프로토콜
1. 바이오프린터용 G-code 생성
- 인쇄 경로를 생성하고 시각화하려면 온라인 G 코드 시뮬레이션 도구(예: NCviewer)를 방문하십시오.
- 인터페이스에서 새 파일 아이콘을 클릭하여 새 G 코드 파일을 만듭니다.
- 희생 채널과 실리콘 챔버에 대한 G 코드 명령을 수동으로 작성하여 인쇄 경로를 생성합니다. 표준 6웰 플레이트의 치수를 형상을 생성하기 위한 참조로 사용합니다.
참고: 여기에 사용된 G 코드는 CNC(Computer Numerical Control) 코드를 기반으로 합니다. 각 명령의 기능은 보충 표 S1에 제공되어 있습니다. 6웰 플레이트 형식은 상용 마이크로플레이트 리더 및 현미경 설정과의 호환성과 내피 성숙을 지원하기 위해 적절한 양의 배지를 수용할 수 있는 능력 때문에 선택되었으며, 이를 통해 빈번한 배지 교체의 필요성을 최소화했습니다. 이 제작 프로토콜은 다른 표준 웰 플레이트와 함께 사용하도록 조정할 수도 있습니다. - G 코드가 완료되면 파일 저장 인터페이스에서 아이콘을 클릭하여 확장자가 .nc인 파일을 다운로드합니다.
알림: 사용 가능한 다른 G 코드 생성 알고리즘을 사용하여 인쇄 경로를 생성할 수 있습니다. 혈관 채널의 기하학적 구조는 이 G 코드에서 조작할 수 있습니다.
2. 희생 및 실리콘 챔버 잉크의 준비
참고: 이 프로토콜에 사용된 모든 재료의 출처는 재료 표에 나열되어 있습니다.
- 두 가지 유형의 실리콘 폴리머인 SE1700과 폴리디메틸실록산(PDMS)을 10:2 비율로 결합합니다. 각 폴리머의 경화제를 10:1의 비율로, 폴리머 대 경화제로 추가합니다.
- 유성 믹서를 사용하여 2,000rpm에서 폴리머 혼합물을 철저히 혼합하고 가스를 제거합니다.
- 주걱으로 혼합된 실리콘 폴리머를 10mL 일회용 주사기에 옮깁니다. 로드된 주사기를 400× g 에서 5°C에서 3분 동안 원심분리하여 균일한 일관성을 보장하고 인쇄 중 기포를 방지합니다.
알림: 챔버 잉크는 최적의 인쇄 품질을 보장하기 위해 경화제를 첨가한 후 2시간 이내에 사용해야 합니다. 인쇄를 준비하는 동안 주사기를 5 °C에서 보관하십시오. 이 프로세스는 잉크 경화 속도를 늦추는 데 도움이 되며, 그렇지 않으면 인쇄 매개변수가 변경될 수 있습니다. - Pluronic F-127(PF127)의 칭량으로 증류수에 PF127의 40%(w/v) 원액을 준비합니다.
- PF127 용액을 유성 믹서에서 400× g 에서 3분 동안 혼합하여 균질성을 얻습니다. PF127의 완전한 용해를 위해 균질화된 혼합물을 4°C로 유지하십시오.
- Dulbecco의 인산염 완충 식염수(DPBS)에 1,000단위/mL의 트롬빈 원액을 준비합니다.
참고: 반복적인 동결-해동 주기를 피하기 위해 트롬빈 원액을 100μL 부분 표본에 보관하십시오. 부분 표본은 -20 °C에서 6개월 이상 보관하지 않아야 합니다. - 인쇄하기 전에 PF127과 1:10 희석하여 트롬빈을 PF127의 경우 36%(w/v), 트롬빈의 경우 100단위/mL의 최종 작업 농도로 혼합하여 희생 잉크를 준비합니다. 희생 잉크 1mL를 준비하려면 100μL의 트롬빈 원액과 900μL의 PF127 원액을 혼합합니다.
참고: 단일 플레이트를 인쇄하기 위해 희생 잉크를 준비할 때 총 부피는 1mL로 충분합니다.
3. 제작 과정
- 제조 공정을 시작하기 전에 6웰 플레이트를 100와트 강도의 산소(O2) 플라즈마로 1분 동안 처리합니다.
- 섹션 2에 설명된 절차에 따라 희생 잉크와 실리콘 잉크를 모두 준비하여 잉크에 기포가 없고 일관된 인쇄를 위해 균일하게 혼합되도록 합니다. 바이오프린터의 프린트 헤드에 잉크를 조심스럽게 로드합니다. 바이오프린터 헤드의 온도를 희생 잉크의 경우 37°C, 실리콘 잉크의 경우 5°C로 설정합니다.
- 22G 이중 나사산 테이퍼 노즐을 실리콘 주사기에 부착합니다. 희생 잉크의 경우 원하는 채널 직경에 따라 노즐 크기를 선택하십시오.
참고: 여기에서는 18G, 20G 및 22G의 세 가지 크기의 노즐을 시연했습니다. 인쇄 압력 및 프린트 헤드 속도를 포함한 최적의 인쇄 매개변수는 표 1에 요약되어 있습니다. - 원하는 G 코드를 로드하고 바이오프린터의 소프트웨어 인터페이스에서 서보 준비 기능을 3초 동안 누릅니다. 스테이지에 플레이트를 놓습니다.tage G 코드의 시작점에서 시작 을 클릭하여 인쇄 프로세스를 시작합니다.
참고: 일반적으로 6개의 챔버가 포함된 플레이트 1개를 제작하는 데 약 1시간 10분이 소요되며, G 코드 로딩 및 실행과 관련된 3.4단계는 사용하는 특정 바이오프린터에 따라 달라질 수 있습니다. 오염을 방지하기 위해 바이오프린터를 사용하는 동안 멸균 상태가 유지되는지 확인하십시오. - 플레이트 위에 뚜껑을 덮고 플레이트를 37°C에서 72시간 동안 가습된 CO2 인큐베이터로 옮겨 실리콘 챔버를 경화합니다.
알림: 실리콘 경화는 인큐베이터 내부에서 더 느린 속도로 발생할 수 있지만 플레이트를 건조 오븐 내부에 두어서는 안 됩니다.
4. 하이드로겔 준비 및 채널 임베딩
- 20mL의 1x PBS가 들어 있는 50mL 원뿔형 튜브를 준비합니다. 리튬 페닐-2,4,6-트리메틸벤조일포스피네이트(LAP) 0.01g을 원추형 튜브에 넣어 0.05%(w/v) LAP 용액을 만듭니다. 분말이 완전히 녹을 때까지 소용돌이칩니다.
알림: 빛에 노출되지 않도록 원추형 튜브를 호일로 감쌉니다. LAP 원액을 4°C에서 보관합니다. - 젤라틴 메타크릴레이트(GelMA) 3g과 피브리노겐 0.2g을 LAP 용액 20mL에 첨가하여 15% GelMA와 1% 피브리노겐(GelFib이라고 함)의 최종 농도를 얻습니다. 혼합물을 37°C 수조에 넣고 용액이 완전히 용해될 때까지 주기적으로 와류 혼합물을 혼합합니다.
- 섹션 3에 설명된 대로 제조 후 300μL의 예열된 GelFib를 각 하이드로겔 챔버에 추가하여 희생 패턴을 포함합니다. 120초 동안 85mW/cm2 의 강도로 405nm 파장의 자외선(UV)과 GelMA를 빠르게 교차 결합합니다. 다른 모든 웰에 대해 이 절차를 반복합니다.
참고: 피브리노겐은 트롬빈을 함유한 희생 패턴과 접촉하면 빠르게 교차결합합니다. 실온에서 원치 않는 GelMA 겔화를 방지하기 위해 하이드로겔을 추가하고 각 웰에 대해 개별적으로 UV 가교를 수행하는 것이 좋습니다. 또한 UV 경화 공정 중 오염을 방지하기 위해 멸균 조건을 유지해야 합니다. - 각 웰의 혈관 채널 양쪽에 1mL의 DPBS를 추가하고 플레이트를 4°C에서 15분 동안 유지하여 PF127을 액화시킵니다.
- 15분 후 DPBS를 흡입하고 4.5단계를 3번 반복하여 PF127을 완전히 세척합니다.
- 세포를 채널에 도입하기 전에 세포 부착을 강화하기 위해 채널을 통해 1% Matrigel을 함유한 DMEM F12를 30분 동안 관류합니다.
5. HUVEC 문화
- 내피 세포 성장 배지(ECGM)를 37°C 수조에서 30분 동안 예열합니다.
- 한편, 질소 탱크에서 동결 보존된 HUVEC 바이알을 꺼내 바이알의 캡을 부드럽게 풀었다가 다시 조여 나사산에서 질소를 방출합니다. 바이알을 37°C 수조에 2분 동안 담가 즉시 세포를 해동하고 바이알 내부에 소량의 얼음이 남아 있도록 합니다. 오염을 방지하기 위해 70% 에탄올로 바이알을 헹굽니다.
알림: 질소 탱크에서 세포를 회수할 때 보안경을 착용하십시오. 이 과정에서 바이알의 뚜껑은 수위보다 높아야 합니다. - 5mL의 예열된 ECGM이 들어 있는 15mL 원뿔형 튜브를 준비합니다. 마이크로피펫을 사용하여 바이알에서 해동된 세포를 원추형 튜브로 조심스럽게 옮깁니다. 세포가 남지 않도록 cryovial에 미리 데워진 신선한 배지 1mL를 추가하고 내부를 헹구고 나머지 세포를 원추형 튜브로 옮깁니다.
- 원추형 튜브를 200× g 에서 3분 동안 원심분리하여 세포 펠릿을 얻습니다. 상층액을 버리고, 10mL의 신선한 배지에 세포를 재현탁시키고, 세포를 T75 플라스크로 옮기고, 플라스크를 37°C 가습 CO2 인큐베이터 안에 넣습니다.
알림: 이 단계는 원심분리를 통해 극저온의 동결 매체에 존재하는 디메틸 설폭사이드를 제거하는 데 중요합니다. - 세포가 80-90% 밀도에 도달할 때까지 이틀에 한 번씩 배지를 새로 고칩니다.
6. 채널의 내피화
- ECGM, DPBS, 트립신 중화 용액 및 트립신 에틸렌디아민테트라아세트산(TE)을 37°C 수조에서 30분 동안 예열합니다.
- 90% 밀도에서 T75 플라스크의 세포를 10mL의 DPBS로 헹구고 플라스크에 0.25% TE 1mL를 첨가하고 3분 동안 배양합니다.
- 플라스크의 측면을 가볍게 두드리고 트립신 중화 용액 5mL를 추가하여 TE를 중화합니다. 세포를 15mL 코니컬 튜브로 옮깁니다. 5mL의 새 ECGM을 사용하여 나머지 세포를 수집하고 원추형 튜브에 추가합니다.
- 원추형 튜브를 250× g 에서 3분 동안 원심분리하여 세포 펠릿을 수집합니다.
- 상층액을 버리고 세포 펠릿을 1mL의 새 ECGM에 재현탁시킵니다. 혈구계로 세포를 세고 6.4단계를 반복하여 세포 펠릿을 얻습니다. 90μL의 새로운 ECGM에 300만 개의 세포를 재현탁시킵니다.
- 셀 현탁액을 채널에 도입하기 전에 채널을 잠시 진공 흡입하여 루멘을 청소합니다.
알림: 무결성이 손상되지 않도록 채널을 장기간 흡입하지 마십시오. - 웰당 0.5백만 개의 세포의 파종 밀도로 cell suspension로 채널을 부드럽게 로드합니다. 마이크로피펫을 사용하여 이 현탁액의 ~15μL를 추가하여 채널을 채웁니다.
참고: 시딩 밀도는 채널의 크기에 따라 달라질 수 있습니다. 이 밀도는 20G 노즐과 약 900μm의 내경으로 인쇄된 채널에 최적화되어 있습니다. - 플레이트를 인큐베이터 내부에 2시간 동안 평평하게 놓습니다. 그런 다음 플레이트를 180°로 뒤집어 다음 2시간 동안 평평한 위치에 유지합니다.
- 4시간 후 DPBS로 채널을 세척하여 부착되지 않은 세포와 죽은 세포를 제거합니다. 각 웰에 2mL의 새 ECGM을 추가합니다(채널의 각 측면에 1mL). 채널이 로킹 방향과 평행하도록 로커에 플레이트를 배치하여 10° 기울기 각도와 5rpm으로 로커에서 다이내믹 배양을 시작합니다. 이틀에 한 번씩 성장 매체를 새로 고칩니다.
참고: 동적 배양은 저장소와 채널 사이의 매체 교환을 향상시키고 세포가 밤새 증식하는 데 도움이 됩니다.
7. 내피화 성숙도 평가
- ECGM과 DPBS를 37°C 수조에서 30분 동안 예열하고 CCK8(Cell Counting Kit-8) 시약을 실온에서 예열합니다.
- 각 웰에 대해 8μL의 CCK8 시약 100mL와 1mL의 새 ECGM을 혼합하여 CCK1의 작업 용액을 만듭니다. 플레이트/6 채널에서 작업하는 동안 600mL의 새 ECGM과 결합하여 8μL의 CCK8 시약을 준비합니다.
- 흡입으로 성장 매체를 제거하고 DPBS로 채널을 헹굽니다. 각 웰에 1mL의 CCK8 작업 용액을 추가하고 플레이트가 인큐베이터 내부에서 30분 동안 평평하게 유지되도록 합니다. 그런 다음 6.9단계에 설명된 대로 로커에서 동적 문화를 시작하고 다음 3시간 동안 이 과정을 계속합니다.
- 3시간 후 플레이트를 한쪽으로 기울여 각 웰의 내용물을 제거하고 새 6웰 플레이트로 옮깁니다. DPBS로 채널을 헹구고 새 매체를 추가합니다.
알림: 흡광도가 측정될 때까지 플레이트를 알루미늄 호일로 덮습니다. 균일한 판독을 보장하기 위해 모든 웰에서 일관된 시약 부피를 유지합니다. 피펫팅하는 동안에는 optical density 판독의 정확도를 방해할 수 있는 기포가 유입되지 않도록 주의하십시오. - 색상이 균일하게 혼합되도록 플레이트를 15초 동안 부드럽게 흔든 후 마이크로플레이트 리더를 사용하여 450nm에서 흡광도를 측정합니다.
- 미리 정의된 시간 간격으로 이 절차를 반복합니다. 각 시점에 대한 평균 광학 밀도를 계산하고 그래프 소프트웨어에서 성장 곡선을 플로팅합니다. 이 곡선은 시간 경과에 따른 내피의 상대적 성숙도를 나타냅니다.
8. 투과성 분석
- 관심 웰 하나에서 배지를 제거합니다.
참고: 투과성 분석의 경우 다른 채널이 건조되어 혈관 투과성이 변경될 수 있는 것을 방지하기 위해 각 웰을 개별적으로 처리하는 것이 좋습니다. - DPBS에 70kDa FITC 덱스트란을 용해시켜 FITC 복합 덱스트란 0.1mg/mL 용액 6mL를 준비합니다.
참고: 20mg의 FITC 덱스트란을 DPBS 5mL에 100mg을 용해시켜 FITC 덱스트란 원액을 준비합니다. 용액을 부드럽게 소용돌이치게 한 후 반복적인 동결-해동 주기를 피하기 위해 500μL를 1.5mL 튜브에 분주합니다. 이 부분 표본은 -20 °C에서 최대 6개월 동안 보관할 수 있습니다. 분석을 수행하기 전에 원액을 0.1mg/mL의 작업 농도로 희석합니다. - 플레이트를 현미경 스테이지에 단단히 배치하고 위상차 모드에서 대물렌즈의 배율을 조정하여 시야 내에서 근처에 위치한 겔과 함께 관심 영역의 채널 벽을 명확하게 볼 수 있도록 합니다.
알림: 효과적인 투과성 평가를 위해 시야에서 관심 영역을 둘러싼 겔의 면적을 최대화하십시오. 이 측면은 Dextran 운송의 정확한 모니터링의 핵심입니다. - 원하는 영역에 초점을 맞춘 후 위상차에서 형광 모드로 변경합니다. 이미지 획득 탭에서 FITC 를 광시야 채널에 추가하고 dextran 솔루션을 추가하기 전에 이미지를 획득하여 배경 형광 강도를 계산합니다. 그런 다음 채널의 한쪽에 1mL의 FITC dextran 작업 용액을 추가하고 정수압 차이에 의해 용액이 웰의 다른 쪽으로 흐르도록 합니다.
- 미리 결정된 시간 간격으로 이미지를 획득합니다(투과성이 높은 채널의 경우 더 자주, 투과성이 낮은 채널의 경우 덜 자주).
9. ImageJ에서 형광 강도 측정
- ImageJ 이미지 분석 소프트웨어에서 아래에 설명된 대로 초기 시점(It1)에서의 강도, 이후 시점(It2)에서 관찰된 평균 강도 및 배경 노이즈로 인한 강도(Ib)를 측정합니다. 방정식 (1)을 사용하여 투과성 계수 (Pd)를 계산합니다. t1 및t2 는 이미지 획득의 초기 및 이후 시점을 나타냅니다.
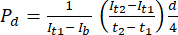 (1)
(1)- ImageJ를 시작하고 초기 시점에서 획득한 이미지를 엽니다.
- ImageJ에서 배율을 설정합니다. Analyze(분석) | 배율을 설정합니다. 알려진 눈금과 측정 단위를 입력합니다.
- 사각형 도구를 선택하고 형광 강도 측정이 필요한 겔 영역 위에 사각형을 그립니다.
- Analyze(분석) | Measurements(측정)를 설정하고 Mean gray value(평균 회색 값)가 선택되어 있는지 확인합니다.
참고: 이 옵션은 선택한 영역 내의 평균 강도를 측정합니다. 주어진 분석에 필요에 따라 다른 매개 변수를 선택할 수 있습니다. - 영역을 선택한 상태에서 Analyze(분석) | 측정 하거나 M을 누르기만 하면 됩니다. 결과 창이 열리고 평균 형광 강도 및 선택한 다른 매개변수가 표시될 때까지 기다립니다.
- 세 번의 측정을 수행하고 스프레드시트에서 평균 형광 강도 값을 계산합니다.
- 후속 시점 t2에서 캡처된 이미지뿐만 아니라 이후 시점에서의 형광 강도를 계산하기 위해 덱스트란 용액을 첨가하기 전에 촬영한 이미지에 대해 이 절차를 반복하여 배경 형광을 결정합니다.
결과
크기와 패턴의 유연성을 특징으로 하는 VOP 플랫폼은 다중 헤드 바이오프린팅 시스템으로 제작되었습니다. 속이 비어 있고 관류가 가능한 채널은 내피화를 용이하게 하기 위해 HUVEC로 파종된 후 투과성 분석으로 평가되었습니다(그림 1A). 이 방법의 멀티스케일 제조 능력을 입증하기 위해 우리는 직선, 분기, 나선의 세 가지 뚜렷한 구성을 인쇄했습니...
토론
3D 바이오프린팅 기술의 정밀성, 자동화 및 컴퓨터 제어 특성을 활용하여 당사는 상용 마이크로플레이트 리더 및 현미경 이미징 설정과의 호환성을 위해 선택된 표준 6웰 플레이트에서 혈관 채널을 제조하기 위한 간소화된 방법을 확립했습니다. 플레이트의 설계는 다중 크기 채널과 더 큰 채널의 성장을 위한 충분한 양의 미디어를 수용할 수 있는 동시에 필요한 미디어 ?...
공개
저자는 경쟁하는 재정적 이익이 없음을 선언합니다.
감사의 말
이 연구는 한국연구재단(National Research Foundation of Korea, NRF)의 지원으로 이루어졌으며, 한국 정부(과학기술정보통신부, 과학기술정보통신부)의 지원을 받았다. NRF-2019R1C1C1009606; 번호 2020R1A5A8018367; 그리고 아니오. RS-2024-00423107)을 참조하십시오. 이 연구는 과학기술정보통신부(MSIT)가 후원하는 NRF 보조금의 바이오 및 의료 기술 개발 프로그램(Bio and Medical Technology Development Program)의 지원을 받았다. NRF-2022M3A9E4017151 및 No. NRF-2022M3A9E4082654]입니다. 이 연구는 산업통상자원부(산업통상자원부)가 후원하는 기술혁신프로그램(Technology Innovation Program)[제20015148호]과 연금술사프로젝트(Alchemist Project)[제20012378호]의 지원을 받았다. 이 연구는 또한 한국식품농업농림계획평가원(IPET)의 지원을 받아 농림축산식품부(MAFRA)의 지원을 받아 연구인력 개발을 위한 농업식품융합기술사업(Agriculture and Food Convergence Technologies Program for Research Manpower Development)을 지원받았다. RS-2024-00397026]입니다.
자료
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
참고문헌
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -. L., Wautier, M. -. P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958 (2022).
- Park, W., Lee, J. -. S., Gao, G., Kim, B. S., Cho, D. -. W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696 (2023).
- Sun, H. -. J., Wu, Z. -. Y., Nie, X. -. W., Bian, J. -. S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568 (2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778 (2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771 (2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267 (2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Can Pfizer deliver. MIT Technology Review Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004)
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013 (2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168 (2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141 (2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012 (2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798 (2017).
- Cho, W. -. W., Ahn, M., Kim, B. S., Cho, D. -. W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093 (2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027 (2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102 (2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744 (2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022 (2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345 (2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171 (2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683 (2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938 (2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -. J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043 (2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723 (2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071 (2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760 (2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151 (2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유