Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высокопроизводительный метод биопечати для моделирования проницаемости сосудов в стандартных шестилуночных планшетах с гибкостью размера и рисунка
В этой статье
Резюме
Мы представляем протокол высокопроизводительного производства сосудистых каналов с гибкими размерами и желаемыми узорами на стандартном шестилуночном планшете с использованием технологии 3D-биопечати, называемой сосудами на пластине (VOP). Эта платформа обладает потенциалом для продвижения разработки терапевтических средств для лечения заболеваний, связанных с нарушенным эндотелием.
Аннотация
Проницаемость сосудов является ключевым фактором в разработке методов лечения заболеваний, связанных с нарушением эндотелия, таких как эндотелиальная дисфункция в коронарных артериях и нарушение функции гематоэнцефалического барьера. Существующие методы изготовления не позволяют адекватно воспроизвести геометрические вариации сосудистых сеток в организме человека, что существенно влияет на прогрессирование заболевания; Кроме того, эти методы часто включают в себя многоступенчатые процедуры изготовления, которые препятствуют высокопроизводительному производству, необходимому для фармакологических испытаний. В этой статье представлен протокол биопечати для создания нескольких сосудистых тканей с желаемыми узорами и размерами непосредственно на стандартных шестилуночных планшетах, преодолевая существующие проблемы разрешения и производительности в технологии биопечати. Был разработан упрощенный подход к изготовлению шести полых перфузионных каналов внутри гидрогеля, которые впоследствии были выстланы эндотелиальными клетками пупочной вены человека для формирования функционального и зрелого эндотелия. Компьютерное управление 3D-биопечатью обеспечивает высокую воспроизводимость и требует меньшего количества ручных этапов изготовления по сравнению с традиционными методами. Это подчеркивает потенциал VOP как эффективной высокопроизводительной платформы для моделирования проницаемости сосудов и ускорения разработки лекарств.
Введение
Сосудистая сеть по всему телу человека функционирует как важнейший транспортный барьер, динамически регулируя обмен молекул и клеток между кровью и окружающими тканями. Эта регуляция необходима для предотвращения отека тканей и обеспечения селективного обмена питательных веществ и клеток, тем самым поддерживая метаболизм тканей и гомеостаз1. Измененная проницаемость эндотелия, фактор многих заболеваний, влияет как на тяжесть заболевания, так и на эффективность лечения2. Эндотелий сосудов действует как селективный барьер, облегчая перенос между сосудами, тканями и органами. Эта регуляция включает в себя несколько механизмов, таких как базовая фильтрация растворенных веществ и малых молекул, преднамеренное нарушение сосудистого барьера и влияние таких молекул, как простагландины и факторы роста,на уровни проницаемости.
Ключевыми факторами в этой регуляции являются соединения эндотелиальных клеток, миграция лейкоцитов и функциональность гематоэнцефалического барьера4. Учитывая его сложность, этот процесс варьируется в зависимости от среды, затрагивая различные типы кровеносных сосудов и используя различные анатомические пути. Понимание биологических основ сосудистой проницаемости имеет решающее значение для разработки терапевтических подходов к лечению состояний, связанных с аномальной проницаемостью сосудов. Поддержание проницаемости сосудов имеет решающее значение для здоровья сосудистой системы и окружающих тканей; Следовательно, нарушение этой функции приводит к эндотелиальной дисфункции, при котором эндотелий теряет свою нормальную функциональность.
Эндотелиальная дисфункция является предшественником нескольких распространенных заболеваний человека, включая гипертонию, ишемическую болезнь сердца, диабет и рак 5,6,7. Это состояние может проявляться несколькими способами, включая снижение вазодилатации, повышенную проницаемость сосудов и тенденцию к провоспалительному состоянию. Это патологическое состояние является самой ранней стадией нескольких критических сердечно-сосудистых заболеваний, таких как ишемическая болезнь сердца, инсульти заболевание периферических артерий, которые продолжают оставаться основными причинами смертности в Соединенных Штатах1. Эндотелиальная дисфункция влияет на здоровье сердечно-сосудистой системы, а также на гематоэнцефалический барьер (ГЭБ) и играет важную роль в прогрессировании различных неврологических расстройств. Дисфункция может увеличивать проницаемость ГЭБ, тем самым позволяя токсинам, патогенам и иммунным клеткам проникать в центральную нервную систему и способствуя развитию неврологических расстройств, таких как инсульт, болезнь Альцгеймера, рассеянный склероз и инфекции головного мозга9.
Эндотелиальная дисфункция при сахарном диабете характеризуется нарушением способности эндотелия регулировать тонус сосудов и вырабатывать вазодилататорные медиаторы, такие как оксид азота, что приводит кнарушению вазодилатации. Это состояние усугубляется вызванными гипергликемией путями, такими как активация протеинкиназы С и окислительный стресс, что в значительной степени способствует прогрессированию диабетического сосудистого заболевания11. Кроме того, было обнаружено, что воспалительная среда усиливает адгезию опухолевых клеток к микрососудистым эндотелиальным клеткам головного мозга, в то время как утечка эндотелия, как сообщается, является основным фактором метастазирования рака12,13. Было обнаружено, что геометрия кровеносных сосудов напрямую влияет на метастазирование рака мозга. Опухолевые клетки преимущественно прикрепляются к областям с большей кривизной кровеносных сосудов7. Это открытие подчеркивает важность геометрии сосудов при метастазировании рака. Что еще более важно, при таких состояниях, как фиброз и рак, нарушенная функция эндотелиального барьера не только играет роль в развитии заболевания, но и препятствует эффективности лечения, препятствуя адекватной доставке лекарств14. Исследования проницаемости сосудов имеют решающее значение для продвижения лечения сердечно-сосудистых заболеваний и дают представление о лечении других заболеваний, связанных с нарушением функции сосудов.
Учитывая решающую роль проницаемости сосудов в здоровье и болезнях, значительные исследования были сосредоточены на изучении селективного характера эндотелиального барьера для разработки терапевтических препаратов с использованием животных моделей, наряду с традиционными платформами для 2D и 3D испытаний in vitro. Тем не менее, животные модели имеют ограничения из-за видовых различий и этических проблем, а также высоких затрат15,16. Например, в 2004 году компания Pfizer заявила, что за предыдущие 10 лет она потратила более 2 миллиардов долларов на разработку лекарств, которые показали многообещающие эффекты на животных моделях, но в конечном итоге потерпели неудачу на продвинутыхстадиях испытаний на людях. Более того, традиционные 2D-модели не в точности имитируют трехмерную (3D) архитектуру и сложную геометрическую структуру сосудистых каналов.
С развитием технологий биопроизводства обширные усилия были направлены на создание сосудистых каналов при одновременном повторении 3D-архитектуры. Микромасштабные сосудистые каналы могут быть эффективно изготовлены в микрофлюидных чипах с использованием мягкой литографии, что дает преимущество анализа в реальном времени18,19. Альтернативные методы, такие как литье гидрогелем или обертывание листов ячеек вокруг формы или оправки, могут быть использованы для создания отдельно стоящих трубчатых конструкций с желаемым диаметром20,21. Однако эти методы имеют ограничения; Например, микрофлюидные чипы ограничены конфигурациями микроканалов, а литье гидрогеля вокруг формы не позволяет эффективно воспроизвести несколько геометрий.
С появлением технологии 3D-биопечатистало возможным воспроизведение сложных геометрий путем точного нанесения различных гидрогелевых материалов на основе внеклеточного матрикса (ВКМ)23,24. Некоторые методы биопечати, такие как с использованием концентрически расположенных сопел, например, коаксиальные и трехосные25,26, не позволяют создать разветвленные трубки; Тем не менее, сложные структуры могут быть получены с помощью методов жертвенного моделирования27. Ни один из этих методов биопечати не продемонстрировал возможности высокопроизводительного моделирования in vitro, что является важнейшим требованием для фармакологических исследований в области разработки лекарств. В данной работе мы представляем метод эффективного изготовления эндотелизированных сосудистых каналов с эффективным контролем размеров.
Мы разработали простой подход с использованием коммерчески доступных шестилуночных планшетов в сочетании с методом жертвенного структурирования, при котором биопринтер изготавливает сосудистые каналы желаемых размеров и узоров в гидрогеле ECM. Эндотелиальные клетки пупочной вены человека (HUVECs) были засеяны для эндотелизации этих каналов и оценки функциональности эндотелия с помощью анализа проницаемости. Такая конструкция обеспечивает перфузию без насоса за счет создания резервуаров с фильтрующим материалом по обе стороны канала и использует поток под действием силы тяжести с помощью обычно используемого 2D-рокера для имитации динамической культуры. Такой подход устраняет необходимость в перистальтических насосах и облегчает масштабируемость этой платформы для приложений с высокой пропускной способностью. Компьютерное управление в технологии 3D-биопечати также оптимизирует процесс изготовления, тем самым снижая вероятность ошибок во время производства. Модель VOP является многообещающим инструментом для фармакологического тестирования при разработке лекарств.
протокол
1. Генерация G-кода для биопринтера
- Чтобы создать и визуализировать траекторию печати, посетите онлайн-инструмент моделирования G-кода (например, NCviewer).
- Нажмите на значок «Новый файл » в интерфейсе, чтобы создать новый файл G-кода.
- Сгенерируйте траекторию печати, вручную написав команды G-кода для жертвенного канала и силиконовой камеры. Используйте размеры стандартной шестилуночной пластины в качестве эталона для создания геометрии.
ПРИМЕЧАНИЕ: G-код, используемый здесь, основан на коде числового программного управления (ЧПУ). Функции каждой команды приведены в Дополнительной таблице S1. Формат шестилуночных планшетов был выбран из-за его совместимости с коммерческими микропланшетами и микроскопическими установками, а также его способности вмещать достаточные объемы сред для поддержки созревания эндотелия, тем самым сводя к минимуму необходимость частой смены среды. Этот протокол изготовления также может быть адаптирован для использования с другими стандартными луночными планшетами. - После того, как G-код будет готов, нажмите на значок «Сохранить файл » в интерфейсе, чтобы загрузить файл с расширением .nc.
ПРИМЕЧАНИЕ: Для генерации печатных путей можно использовать любой другой доступный алгоритм генерации G-кода. Геометрией сосудистого канала можно манипулировать с помощью этого G-кода.
2. Приготовление протекторных и кремниевых камерных красок
ПРИМЕЧАНИЕ: Источники для всех материалов, используемых в этом протоколе, перечислены в Таблице материалов.
- Объедините два типа силиконовых полимеров, SE1700 и полидиметилсилоксан (PDMS), в соотношении 10:2. Добавьте отвердитель каждого полимера в соотношении 10:1, полимер к отвердителю.
- Используйте планетарный миксер для тщательного перемешивания и дегазации полимерной смеси со скоростью 2 000 об/мин.
- С помощью шпателя переложите смешанный силиконовый полимер в одноразовый шприц объемом 10 мл. Центрифугируйте загруженный шприц при давлении 400 × г в течение 3 минут при температуре 5 °C, чтобы обеспечить однородную консистенцию и избежать образования пузырей во время печати.
ПРИМЕЧАНИЕ: Камерные чернила должны быть использованы в течение 2 часов после добавления отвердителей для обеспечения оптимального качества печати. Храните шприц при температуре 5 °C во время подготовки к печати. Этот процесс помогает замедлить отверждение чернил, что в противном случае может привести к изменению параметров печати. - Взвесьте Pluronic F-127 (PF127) для приготовления 40% (w/v) исходного раствора PF127 в дистиллированной воде.
- Смешайте раствор PF127 в планетарном смесителе в течение 3 минут при 400 × г для достижения однородности. Поддерживайте гомогенизированную смесь при температуре 4 °C для полного растворения PF127.
- Приготовьте стоковый раствор тромбина в концентрации 1 000 ЕД/мл в фосфатно-солевом буфере Дульбекко (DPBS).
ПРИМЕЧАНИЕ: Храните стоковый раствор тромбина в 100 мкл аликвот, чтобы избежать повторных циклов замораживания-размораживания. Аликвоты следует хранить при температуре -20 °C не более 6 месяцев. - Перед печатью приготовьте жертвенные чернила, смешав тромбин в соотношении 1:10 с PF127 до конечной рабочей концентрации 36% (масс/об) для PF127 и 100 единиц/мл для тромбина. Для приготовления 1 мл жертвенных чернил смешайте 100 мкл стокового раствора тромбина с 900 мкл стокового раствора PF127.
ПРИМЕЧАНИЕ: При подготовке жертвенных чернил для печати на одной пластине общий объем в 1 мл более чем достаточен.
3. Процесс изготовления
- Перед началом процесса изготовления обработайте шестилуночный планшет кислородной (O2) плазмой мощностью 100 Вт в течение 1 минуты.
- Следуйте процедуре, описанной в разделе 2, чтобы подготовить как жертвенные, так и силиконовые чернила, убедившись, что чернила не имеют пузырей и равномерно перемешаны для равномерной печати. Аккуратно загрузите чернила в печатающую головку биопринтера. Установите температуру головки биопринтера на 37 °C для жертвенных чернил и 5 °C для кремниевых чернил.
- Прикрепите к силиконовому шприцу коническую насадку с двухвинтовой резьбой 22 G. Для жертвенных чернил выберите размер сопла в соответствии с желаемым диаметром канала.
ПРИМЕЧАНИЕ: Здесь мы продемонстрировали три размера сопел: 18 G, 20 G и 22 G. Оптимальные параметры печати, включая давление печати и скорость печатающей головки, приведены в таблице 1. - Загрузите нужный G-код и нажмите функцию готовности сервопривода в программном интерфейсе биопринтера в течение 3 секунд. Расположите пластину на столе в начальной точке G-кода и нажмите кнопку «Пуск », чтобы начать процесс печати.
ПРИМЕЧАНИЕ: Как правило, изготовление одной пластины, содержащей шесть камер, занимает примерно 1 час 10 мин. Шаг 3.4, включающий загрузку и выполнение G-кода, может варьироваться в зависимости от конкретного используемого биопринтера. Убедитесь, что во время использования биопринтера поддерживаются стерильные условия, чтобы избежать загрязнения. - Накройте планшет крышкой и перенесите планшет в увлажненный инкубатор сCO2 при температуре 37 °C на 72 часа для отверждения силиконовых камер.
ПРИМЕЧАНИЕ: Несмотря на то, что отверждение силикона в инкубаторе может происходить медленнее, планшет не следует помещать в сухую печь.
4. Приготовление гидрогеля и встраивание канала
- Приготовьте коническую пробирку объемом 50 мл, содержащую 20 мл 1x PBS. Поместите 0,01 г фенил-2,4,6-триметилбензоилфосфината (LAP) в коническую трубку, чтобы получить 0,05% (w/v) раствор LAP. Перебивайте его вихрем до полного растворения порошка.
ПРИМЕЧАНИЕ: Оберните коническую трубку фольгой, чтобы предотвратить попадание света. Храните стоковый раствор LAP при температуре 4 °C. - Добавьте 3 г метакрилата желатина (GelMA) и 0,2 г фибриногена к 20 мл раствора LAP для достижения конечной концентрации 15% GelMA и 1% фибриногена (называемого GelFib). Поместите смесь на водяную баню при температуре 37 °C и периодически перемешивайте до полного раствора раствора.
- После изготовления, как описано в разделе 3, добавьте 300 мкл предварительно нагретого GelFib в каждую гидрогелевую камеру, чтобы внедрить жертвенный шаблон. Быстрое сшивание GelMA с ультрафиолетовым (УФ) светом на длине волны 405 нм с интенсивностью 85 мВт/см2 в течение 120 с. Повторите эту процедуру для всех остальных скважин.
ПРИМЕЧАНИЕ: Фибриноген быстро сшивается при контакте с жертвенным рисунком, содержащим тромбин. Мы рекомендуем добавлять гидрогель и выполнять УФ-сшивание индивидуально для каждой лунки, чтобы избежать нежелательного гелеобразования GelMA при комнатной температуре. Кроме того, следует поддерживать стерильные условия для предотвращения загрязнения в процессе УФ-отверждения. - Добавьте по 1 мл DPBS с каждой стороны сосудистого канала в каждой лунке и держите планшет при температуре 4 °C в течение 15 минут, чтобы разжижить PF127.
- Через 15 минут отсосите DPBS и повторите шаг 4,5 3 раза для полной промывки PF127.
- Перед введением клеток в каналы перфузируйте DMEM F12, содержащий 1% Матригеля, в течение 30 минут через каналы для усиления прикрепления клеток.
5. Культура HUVEC
- Предварительно подогрейте среду для роста эндотелиальных клеток (ЭКГ) на водяной бане при температуре 37 °C в течение 30 минут.
- Тем временем достаньте флакон с криоконсервированными HUVEC из резервуара с азотом, осторожно ослабьте крышку флакона, а затем снова затяните ее, чтобы выпустить азот из нитей. Немедленно разморозьте ячейки, погрузив флакон в водяную баню при температуре 37 °C на 2 минуты, следя за тем, чтобы внутри флакона осталось небольшое количество льда. Промойте флакон 70% этанолом, чтобы предотвратить загрязнение.
ПРИМЕЧАНИЕ: Надевайте защитные очки при извлечении элементов из азотного бака. Во время этого процесса крышка флакона должна находиться над уровнем воды. - Приготовьте коническую пробирку объемом 15 мл, содержащую 5 мл предварительно подогретого ЭКГ. С помощью микропипетки аккуратно переложите размороженные клетки из флакона в коническую пробирку. Чтобы убедиться, что не осталось ни одной клетки, добавьте 1 мл свежей предварительно подогретой среды в криовиал, промойте внутреннюю часть и перенесите оставшиеся клетки в коническую трубку.
- Центрифугируйте коническую пробирку при 200 × г в течение 3 мин для получения клеточной гранулы. Выбросьте надосадочную жидкость, повторно суспендируйте клетки в 10 мл свежей среды, переложите клетки в колбу T75 и поместите колбу в инкубатор с влажной кондициейCO2 при температуре 37 °C.
ПРИМЕЧАНИЕ: Этот шаг важен для удаления диметилсульфоксида, присутствующего в замораживающей среде в криовиальном помещении, путем центрифугирования. - Обновляйте среду через день до тех пор, пока клетки не достигнут 80-90% конфлюенции.
6. Эндотелизация каналов
- Предварительно подогрейте ЭКГ, DPBS, нейтрализующий трипсин раствор и трипсин этилендиаминтетрауксусную кислоту (ТЭ) в водяной бане при температуре 37 °C в течение 30 минут.
- При 90% конфлюенции промойте клетки в колбе T75 10 мл DPBS, добавьте в колбу 1 мл 0,25% TE и инкубируйте в течение 3 минут.
- Осторожно постучите по стенкам колбы и добавьте 5 мл раствора, нейтрализующего трипсин, чтобы нейтрализовать ТЭ. Перенесите клетки в коническую пробирку объемом 15 мл. Используйте 5 мл свежей ЭКГМ, чтобы собрать оставшиеся клетки и добавить их в коническую трубку.
- Центрифугируйте коническую трубку при 250 × г в течение 3 минут, чтобы собрать клеточную гранулу.
- Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в 1 мл свежей ЭКГМ. Подсчитайте клетки с помощью гемоцитометра и повторите шаг 6.4 для получения клеточной гранулы. Ресуспендируйте 3 миллиона клеток в 90 μл свежей ЭКГ.
- Перед введением клеточной суспензии в канал кратковременно вакуумируйте канал для очистки просвета.
ПРИМЕЧАНИЕ: Избегайте длительного всасывания канала, чтобы не повредить его целостность. - Аккуратно нагружают канал суспензией ячеек при плотности затравки 0,5 млн ячеек на лунку. С помощью микропипетки добавьте ~15 мкл этой суспензии для заполнения канала.
ПРИМЕЧАНИЕ: Плотность засева может варьироваться в зависимости от размера канала. Эта плотность оптимизирована для канала, напечатанного с помощью сопла 20 G и внутреннего диаметра около 900 мкм. - Поместите пластину в инкубатор на 2 часа. Затем переверните пластину на 180°, удерживая ее в горизонтальном положении в течение следующих 2 часов.
- Через 4 ч промойте канал DPBS для удаления неадгезивных и омертвевших клеток. Добавьте по 2 мл свежего ЭКГ в каждую лунку (по 1 мл с каждой стороны канала). Начните динамическую культуру на коромысле с углом наклона 10° и скоростью 5 об/мин, расположив пластину на коромысле каналами параллельно направлению качания. Обновляйте питательную среду через день.
ПРИМЕЧАНИЕ: Динамическое культивирование улучшает обмен среды между резервуарами и каналами и помогает клеткам размножаться в течение ночи.
7. Оценка созревания эндотелия
- Предварительно разогреть ECGM и DPBS на водяной бане при температуре 37 °C в течение 30 мин и реагент Cell Count Kit-8 (CCK8) при комнатной температуре.
- Сделайте рабочий раствор CCK8, смешав 100 мкл реагента CCK8 с 1 мл свежего ECGM для каждой лунки. Во время работы с планшетом/6 каналом приготовьте 600 мкл реагента CCK8, соединив его с 6 мл свежей ЭКГ.
- Удалите питательную среду путем отсоса и промойте каналы с помощью DPBS. Добавьте по 1 мл рабочего раствора CCK8 в каждую лунку и дайте планшету оставаться плоским внутри инкубатора в течение 30 минут. После этого запустите динамическую культуру на коромысле, как описано в шаге 6.9, и продолжайте этот процесс в течение следующих 3 часов.
- Через 3 ч удалите содержимое из каждой лунки, наклонив пластину в одну сторону, и переложите его в новую шестилуночную пластину. Промойте каналы с помощью DPBS и добавьте свежую среду.
ПРИМЕЧАНИЕ: Накройте пластину алюминиевой фольгой до измерения впитываемости. Поддерживайте постоянный объем реагента во всех скважинах для обеспечения равномерных показаний. При пипетировании тщательно избегайте попадания пузырьков воздуха, которые могут нарушить точность показаний оптической плотности. - После осторожного встряхивания пластины в течение 15 секунд, чтобы обеспечить равномерное смешивание цветов, используйте считыватель микропланшетов для измерения поглощения при длине волны 450 нм.
- Повторяйте эту процедуру через заданные промежутки времени. Рассчитайте среднюю оптическую плотность для каждой временной точки и постройте кривую роста в графическом программном обеспечении. Эта кривая показывает относительное созревание эндотелия с течением времени.
8. Анализ проницаемости
- Извлеките среду из одной интересующей лунки.
ПРИМЕЧАНИЕ: Для анализа проницаемости рекомендуется обрабатывать каждую лунку отдельно, чтобы предотвратить высыхание других каналов, которое может изменить их сосудистую проницаемость. - Приготовьте 6 мл 0,1 мг/мл раствора конъюгированного декстрана FITC путем растворения декстрана FITC с массой 70 кДа.
ПРИМЕЧАНИЕ: Приготовьте стоковый раствор FITC декстрана в дозе 20 мг/мл, растворив 100 мг декстрана FITC в 5 мл DPBS. После осторожного перемешивания раствора распределите 500 мкл в пробирки объемом 1,5 мл, чтобы избежать повторных циклов замораживания-размораживания. Эти аликвоты можно хранить при температуре -20 °C не более 6 месяцев. Перед проведением анализа исходный раствор разбавляют до рабочей концентрации 0,1 мг/мл. - Плотно расположите пластину на предметном столике микроскопа и отрегулируйте увеличение объектива в режиме фазового контраста, чтобы обеспечить четкую видимость стенки канала в интересующей области вместе с гелем, расположенным поблизости, в пределах поля зрения.
ПРИМЕЧАНИЕ: Для эффективной оценки проницаемости постарайтесь максимально увеличить площадь геля, окружающего интересующую область в поле зрения; Этот аспект является ключом к точному мониторингу транспортировки декстранов. - После фокусировки на нужной области переключитесь с фазового контраста на флуоресцентный режим. На вкладке «Получение изображения » добавьте FITC в широкопольный канал и получите изображение перед добавлением раствора декстрана, чтобы рассчитать интенсивность фоновой флуоресценции. Затем добавьте 1 мл рабочего раствора декстрана FITC на одну сторону канала и дайте раствору течь к другой стороне скважины, приводимой в движение разницей гидростатических давлений.
- Получение изображений через заданные интервалы времени — чаще для каналов с высокой проницаемостью и реже для каналов с более низкой проницаемостью.
9. Измерение интенсивности флуоресценции в ImageJ
- В программном обеспечении для анализа изображений ImageJ измерьте интенсивность в начальной точке времени (It1), среднюю интенсивность, наблюдаемую в более поздней точке времени (It2), и интенсивность из-за фонового шума (Ib), как описано ниже. Используйте уравнение (1) для расчета коэффициента проницаемости (Pd). T1 и t2 относятся к начальной и более поздней временным точкам получения изображения.
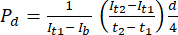 (1)
(1)- Запустите ImageJ и откройте изображение, полученное в начальной момент времени.
- Установите масштаб в ImageJ. Перейти к Анализу | Установите масштаб. Введите известный масштаб и единицу измерения.
- Выберите инструмент «Прямоугольник » и нарисуйте прямоугольник над областью геля, где требуется измерение интенсивности флуоресценции.
- Перейти к Анализу | Установите Измерения и убедитесь, что установлено значение Среднее значение серого .
ПРИМЕЧАНИЕ: Эта опция измеряет среднюю интенсивность в выбранной области. Другие параметры могут быть выбраны по мере необходимости для данного анализа. - Не снимая выделенной области, перейдите в раздел Анализ | Измерьте или просто нажмите M. Подождите, пока откроется окно результатов , показывающее среднюю интенсивность флуоресценции и любые другие выбранные параметры.
- Выполните три измерения и рассчитайте среднее значение интенсивности флуоресценции в электронной таблице.
- Повторите эту процедуру для изображений, полученных в последующий момент времени t2, а также для изображений, полученных до добавления раствора декстрана для расчета интенсивности флуоресценции в более поздний момент времени, чтобы определить фоновую флуоресценцию.
Результаты
Платформа VOP, отличающаяся гибкостью в размерах и шаблонах, была изготовлена с помощью системы биопечати с несколькими головками. Каналы, как полые, так и способные к перфузии, были засеяны HUVEC для облегчения эндотелизации и впоследствии оценены с помощью анализа прон?...
Обсуждение
Используя преимущества точности, автоматизации и компьютерного управления технологии 3D-биопечати, мы разработали оптимизированный метод изготовления сосудистых каналов в стандартных шестилуночных планшетах, которые были выбраны из-за их совместимости с коммерчес...
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана грантами Национального исследовательского фонда Кореи (NRF), финансируемыми правительством Кореи (Министерство науки и ИКТ, MSIT) [No. НРФ-2019Р1С1С1009606; No 2020R1A5A8018367; и No. RS-2024-00423107]. Это исследование было поддержано Программой развития биомедицинских и медицинских технологий грантов NRF, финансируемых MSIT [No. НРФ-2022М3А9Е4017151 и No. НРФ-2022М3А9Е4082654]. Эта работа была поддержана Программой технологических инноваций [No 20015148] и Проектом «Алхимик» [No 20012378], финансируемым Министерством торговли, промышленности и энергетики (MOTIE, Корея). Эта работа также была поддержана Корейским институтом планирования и оценки технологий в области продовольствия, сельского хозяйства и лесного хозяйства (IPET) в рамках Программы конвергенции технологий в сельском хозяйстве и пищевой промышленности для развития исследовательских кадров, финансируемой Министерством сельского хозяйства, продовольствия и сельских дел (MAFRA) [No. RS-2024-00397026].
Материалы
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
Ссылки
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -. L., Wautier, M. -. P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958 (2022).
- Park, W., Lee, J. -. S., Gao, G., Kim, B. S., Cho, D. -. W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696 (2023).
- Sun, H. -. J., Wu, Z. -. Y., Nie, X. -. W., Bian, J. -. S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568 (2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778 (2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771 (2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267 (2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Can Pfizer deliver. MIT Technology Review Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004)
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013 (2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168 (2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141 (2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012 (2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798 (2017).
- Cho, W. -. W., Ahn, M., Kim, B. S., Cho, D. -. W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093 (2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027 (2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102 (2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744 (2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022 (2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345 (2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171 (2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683 (2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938 (2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -. J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043 (2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723 (2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071 (2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760 (2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151 (2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены