Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Procédé de bio-impression à haut débit pour modéliser la perméabilité vasculaire dans des plaques standard à six puits avec flexibilité de taille et de motif
Dans cet article
Résumé
Nous présentons un protocole pour la production à haut débit de canaux vasculaires avec des tailles flexibles et des motifs souhaités sur une plaque standard à six puits en utilisant la technologie de bio-impression 3D, appelée vaisseaux sur plaque (VOP). Cette plateforme a le potentiel de faire progresser le développement de traitements pour les troubles associés à l’endothélium compromis.
Résumé
La perméabilité vasculaire est un facteur clé dans le développement de thérapies pour les troubles associés à l’endothélium compromis, tels que le dysfonctionnement endothélial dans les artères coronaires et l’altération du fonctionnement de la barrière hémato-encéphalique. Les techniques de fabrication existantes ne reproduisent pas adéquatement la variation géométrique des réseaux vasculaires dans le corps humain, ce qui influence considérablement la progression de la maladie ; De plus, ces techniques impliquent souvent des procédures de fabrication en plusieurs étapes qui entravent la production à haut débit nécessaire aux tests pharmacologiques. Cet article présente un protocole de bio-impression permettant de créer plusieurs tissus vasculaires avec des motifs et des tailles souhaités directement sur des plaques standard à six puits, surmontant ainsi les défis de résolution et de productivité existants dans la technologie de bio-impression. Une approche de fabrication simplifiée a été mise en place pour construire six canaux creux et perfusibles dans un hydrogel, qui ont ensuite été tapissés de cellules endothéliales de veine ombilicale humaine pour former un endothélium fonctionnel et mature. La nature contrôlée par ordinateur de la bio-impression 3D garantit une reproductibilité élevée et nécessite moins d’étapes de fabrication manuelle que les méthodes traditionnelles. Cela met en évidence le potentiel de VOP en tant que plate-forme efficace à haut débit pour la modélisation de la perméabilité vasculaire et l’avancement de la découverte de médicaments.
Introduction
Le réseau vasculaire dans tout le corps humain fonctionne comme une barrière de transport cruciale en régulant dynamiquement l’échange de molécules et de cellules entre le sang et les tissus environnants. Cette régulation est essentielle pour prévenir l’œdème tissulaire et permettre un échange sélectif de nutriments et de cellules, soutenant ainsi le métabolisme tissulaire et l’homéostasie1. L’altération de la perméabilité endothéliale, un facteur dans de nombreux problèmes de santé, affecte à la fois la gravité de la maladie et l’efficacité du traitement2. L’endothélium vasculaire agit comme une barrière sélective, facilitant le transfert entre les vaisseaux, les tissus et les organes. Cette régulation implique plusieurs mécanismes, tels que le filtrage de base des solutés et des petites molécules, la perturbation intentionnelle de la barrière vasculaire et l’influence de molécules telles que les prostaglandines et les facteurs de croissance sur les niveaux de perméabilité3.
Les facteurs clés de cette régulation comprennent les jonctions cellulaires endothéliales, la migration des leucocytes et la fonctionnalité de la barrière hémato-encéphalique4. Compte tenu de sa complexité, le processus varie selon les environnements, impliquant différents types de vaisseaux sanguins et utilisant des voies anatomiques distinctes. Comprendre les fondements biologiques de la perméabilité vasculaire est crucial pour concevoir des approches thérapeutiques visant à traiter les affections associées à une perméabilité vasculaire anormale. Le maintien de la perméabilité vasculaire est crucial pour la santé du système vasculaire et des tissus environnants ; Par conséquent, l’altération de cette fonction conduit à un dysfonctionnement endothélial, un état dans lequel l’endothélium perd sa fonctionnalité normale.
Le dysfonctionnement endothélial est un précurseur de plusieurs maladies humaines répandues, notamment l’hypertension, les maladies coronariennes, le diabète et le cancer 5,6,7. Cette condition peut se présenter de plusieurs façons, notamment une diminution de la vasodilatation, une augmentation de la perméabilité des vaisseaux et une tendance à un état pro-inflammatoire. Cet état pathologique est le stade précoce de plusieurs problèmes cardiovasculaires critiques, tels que les maladies coronariennes, les accidents vasculaires cérébraux et les maladies artérielles périphériques8, qui continuent d’être les principales causes de mortalité aux États-Unis1. Le dysfonctionnement endothélial affecte la santé cardiovasculaire ainsi que la barrière hémato-encéphalique (BHE) et joue un rôle majeur dans la progression de divers troubles neurologiques. Le dysfonctionnement peut augmenter la perméabilité de la BHE, permettant ainsi aux toxines, aux agents pathogènes et aux cellules immunitaires de s’infiltrer dans le système nerveux central et contribuant à des troubles neurologiques tels que les accidents vasculaires cérébraux, la maladie d’Alzheimer, la sclérose en plaques et les infections cérébrales9.
Le dysfonctionnement endothélial dans le diabète est marqué par la capacité compromise de l’endothélium à réguler le tonus vasculaire et à produire des médiateurs vasodilatateurs, tels que l’oxyde nitrique, entraînant une altération de la vasodilatation10. Cette affection est exacerbée par des voies induites par l’hyperglycémie telles que l’activation de la protéine kinase C et le stress oxydatif, contribuant de manière significative à la progression de la maladie vasculaire diabétique11. De plus, il a été constaté qu’un environnement inflammatoire améliore l’adhésion des cellules tumorales aux cellules endothéliales microvasculaires du cerveau, tandis qu’un endothélium perméable est un facteur majeur dans les métastases cancéreuses12,13. Il a été constaté que la géométrie des vaisseaux sanguins influence directement les métastases du cancer du cerveau. Les cellules tumorales se fixent préférentiellement aux zones de plus grande courbure des vaisseaux sanguins7. Cette découverte souligne l’importance de la géométrie vasculaire dans les métastases cancéreuses. Plus important encore, dans des conditions telles que la fibrose et le cancer, la perturbation de la fonction de barrière endothéliale joue non seulement un rôle dans le développement de la maladie, mais entrave également l’efficacité du traitement en entravant l’administration adéquate des médicaments14. La recherche sur la perméabilité vasculaire est cruciale pour faire progresser le traitement des maladies cardiovasculaires et offrir des informations sur la prise en charge d’autres maladies impliquant une fonction vasculaire compromise.
Compte tenu du rôle crucial de la perméabilité vasculaire dans la santé et la maladie, de nombreuses recherches ont porté sur l’examen de la nature sélective de la barrière endothéliale pour le développement thérapeutique à l’aide de modèles animaux, parallèlement aux plateformes traditionnelles de tests in vitro 2D et 3D. Cependant, les modèles animaux ont des limites en raison des différences spécifiques aux espèces et des problèmes éthiques, ainsi que des coûts élevés15,16. Par exemple, Pfizer, en 2004, a déclaré qu’au cours des 10 dernières années, elle avait dépensé plus de 2 milliards de dollars pour le développement de médicaments qui ont montré des effets prometteurs sur des modèles animaux, mais qui ont finalement échoué aux étapes avancées des essais surl’homme17. De plus, les modèles 2D traditionnels n’imitent pas fidèlement l’architecture tridimensionnelle (3D) et la structure géométrique complexe des canaux vasculaires.
Avec les progrès des technologies de biofabrication, des efforts considérables ont été déployés pour fabriquer des canaux vasculaires tout en récapitulant l’architecture 3D. Des canaux vasculaires à l’échelle microscopique peuvent être efficacement fabriqués à l’intérieur de puces microfluidiques à l’aide de la lithographie douce, offrant ainsi l’avantage de l’analyse en temps réel18,19. Des méthodes alternatives, telles que la coulée d’hydrogel ou l’enroulement de feuilles de cellules autour d’un moule ou d’un mandrin, peuvent être utilisées pour créer des structures tubulaires autoportantes du diamètre souhaité20,21. Cependant, ces méthodes ont des limites ; Par exemple, les puces microfluidiques sont limitées à des configurations de microcanaux, et la coulée d’hydrogel autour d’un moule ne reproduit pas efficacement plusieurs géométries.
Avec l’émergence de la technologie de bio-impression 3D22, il est devenu possible de reproduire des géométries complexes en déposant avec précision divers matériaux d’hydrogel à base de matrice extracellulaire (ECM)23,24. Certaines méthodes de bio-impression, telles que celles utilisant des buses disposées concentriquement, par exemple, coaxiale et triaxiale25,26, ne peuvent pas créer de tubes bifurqués ; Cependant, des structures complexes peuvent être obtenues avec des méthodes de structuration sacrificielle27. Il n’a été démontré qu’aucune de ces méthodes de bio-impression ne permet une modélisation in vitro à haut débit, une exigence cruciale pour la recherche pharmacologique dans la découverte de médicaments. Dans cet article, nous présentons une méthode de fabrication efficace de canaux vasculaires endothélialisés avec un contrôle efficace des dimensions.
Nous avons établi une approche simple en utilisant des plaques à six puits disponibles dans le commerce, combinées à une méthode de structuration sacrificielle dans laquelle une bio-imprimante fabrique des canaux vasculaires de tailles et de motifs souhaités dans un hydrogel ECM. Des cellules endothéliales de la veine ombilicale humaine (HUVEC) ont été ensemencées pour endothélialiser ces canaux et évaluer la fonctionnalité de l’endothélium grâce à un test de perméabilité. Cette conception permet une perfusion sans pompe en créant des réservoirs de média des deux côtés du canal et utilise un écoulement par gravité à l’aide d’un basculeur 2D couramment utilisé pour imiter la culture dynamique. Cette approche élimine le besoin de pompes péristaltiques et facilite l’évolutivité de cette plate-forme pour les applications à haut débit. La nature contrôlée par ordinateur de la technologie de bio-impression 3D rationalise également le processus de fabrication, réduisant ainsi le risque d’erreurs lors de la fabrication. Le modèle VOP est prometteur en tant qu’outil précieux pour les tests pharmacologiques dans la découverte de médicaments.
Protocole
1. Génération de code G pour la bio-imprimante
- Pour générer et visualiser le chemin d’impression, visitez un outil de simulation de code G en ligne (par exemple, NCviewer).
- Cliquez sur l’icône Nouveau fichier sur l’interface pour créer un nouveau fichier de code G.
- Générez un chemin d’impression en écrivant manuellement les commandes de code G pour le canal sacrificiel et la chambre de silicium. Utilisez les dimensions d’une plaque standard à six puits comme référence pour créer la géométrie.
REMARQUE : Le code G utilisé ici est basé sur le code CNC (Computer Numerical Control). Les fonctions de chaque commande sont fournies dans le tableau supplémentaire S1. Le format de plaque à six puits a été choisi en raison de sa compatibilité avec les lecteurs de microplaques et les installations de microscopie commerciaux et de sa capacité à accueillir des volumes adéquats de milieux pour favoriser la maturation de l’endothélium, minimisant ainsi la nécessité de changer fréquemment de milieu. Ce protocole de fabrication peut également être adapté pour être utilisé avec d’autres plaques de puits standard. - Une fois le code G terminé, cliquez sur l’icône Enregistrer le fichier sur l’interface pour télécharger le fichier avec une extension .nc.
REMARQUE : Tout autre algorithme de génération de code G disponible peut être utilisé pour générer les chemins d’impression. La géométrie du canal vasculaire peut être manipulée dans ce G-code.
2. Préparation des encres sacrificielles et des encres à chambre de silicium
REMARQUE : Les sources de toutes les matières utilisées dans le présent protocole sont énumérées dans le Tableau des matières.
- Combinez deux types de polymères de silicone, le SE1700 et le polydiméthylsiloxane (PDMS), dans un rapport de 10:2. Ajouter l’agent de durcissement de chaque polymère dans un rapport de 10:1, polymère à agent de durcissement.
- À l’aide d’un mélangeur planétaire, mélangez et dégazez soigneusement le mélange de polymères à 2 000 tr/min.
- À l’aide d’une spatule, transférez le polymère de silicone mélangé dans une seringue jetable de 10 ml. Centrifuger la seringue chargée à 400 × g pendant 3 min à 5 °C pour assurer une consistance uniforme et éviter les bulles lors de l’impression.
REMARQUE : L’encre de chambre doit être utilisée dans les 2 h suivant l’ajout des agents de durcissement pour assurer une qualité d’impression optimale. Rangez la seringue à 5 °C pendant la préparation de l’impression. Ce processus permet de ralentir le durcissement de l’encre, ce qui peut autrement modifier les paramètres d’impression. - Peser le Pluronic F-127 (PF127) pour préparer une solution mère à 40 % (p/v) de PF127 dans de l’eau distillée.
- Mélanger la solution PF127 dans un batteur planétaire pendant 3 min à 400 × g pour obtenir une homogénéité. Maintenir le mélange homogénéisé à 4 °C pour une dissolution complète du PF127.
- Préparez une solution mère de thrombine de 1 000 unités/mL dans une solution saline tamponnée au phosphate de Dulbecco (DPBS).
REMARQUE : Conservez la solution mère de thrombine dans des aliquotes de 100 μL pour éviter les cycles répétés de congélation-décongélation. Les aliquotes doivent être conservées à -20 °C pendant 6 mois au maximum. - Avant l’impression, préparez l’encre sacrificielle en mélangeant la thrombine à une dilution de 1:10 avec le PF127 jusqu’à une concentration de travail finale de 36 % (p/v) pour le PF127 et de 100 unités/mL pour la thrombine. Pour préparer 1 mL d’encre sacrificielle, mélangez 100 μL de solution mère de thrombine avec 900 μL de solution mère PF127.
REMARQUE : Lors de la préparation de l’encre sacrificielle pour l’impression d’une seule plaque, un volume total de 1 mL est plus que suffisant.
3. Processus de fabrication
- Avant de commencer le processus de fabrication, traitez une plaque à six puits avec du plasma d’oxygène (O2) à une intensité de 100 watts pendant 1 min.
- Suivez la procédure décrite dans la section 2 pour préparer à la fois les encres sacrificielles et silicone, en vous assurant que les encres sont exemptes de bulles et mélangées de manière homogène pour une impression cohérente. Chargez soigneusement les encres dans la tête d’impression de la bio-imprimante. Réglez la température de la tête de la bio-imprimante à 37 °C pour l’encre sacrificielle et à 5 °C pour l’encre au silicium.
- Fixez une buse conique à double filetage de 22 G à la seringue en silicone. Pour l’encre sacrificielle, choisissez la taille de la buse en fonction du diamètre de canal souhaité.
REMARQUE : Ici, nous avons présenté trois tailles de buses : 18 G, 20 G et 22 G. Les paramètres d’impression optimaux, y compris la pression d’impression et la vitesse de la tête d’impression, sont décrits dans le tableau 1. - Chargez le G-code souhaité et appuyez sur la fonction servo ready sur l’interface logicielle de la bio-imprimante pendant 3 s. Positionnez la plaque sur la platine au point de départ du G-code et cliquez sur démarrer pour lancer le processus d’impression.
REMARQUE : En règle générale, la fabrication d’une plaque contenant six chambres nécessite environ 1 h et 10 min. L’étape 3.4, impliquant le chargement et l’exécution du code G, est sujette à des variations en fonction de la bio-imprimante spécifique utilisée. Assurez-vous que des conditions stériles sont maintenues lors de l’utilisation de la bio-imprimante pour éviter toute contamination. - Placez un couvercle sur la plaque et transférez la plaque dans un incubateur de CO2 humidifié à 37 °C pendant 72 h pour durcir les chambres en silicone.
REMARQUE : Bien que le durcissement au silicium puisse se produire à un rythme plus lent à l’intérieur de l’incubateur, la plaque ne doit pas être placée à l’intérieur d’un four sec.
4. Préparation de l’hydrogel et intégration des canaux
- Préparez un tube conique de 50 mL contenant 20 mL de 1x PBS. Placez 0,01 g de phényl-2,4,6-triméthylbenzoylphosphinate de lithium (LAP) dans le tube conique pour obtenir une solution de LAP à 0,05 % (p/v). Agitez-le jusqu’à ce que la poudre soit complètement dissoute.
REMARQUE : Enveloppez le tube conique dans du papier d’aluminium pour éviter l’exposition à la lumière. Conserver la solution mère LAP à 4 °C. - Ajouter 3 g de méthacrylate de gélatine (GelMA) et 0,2 g de fibrinogène à 20 mL de solution de LAP pour obtenir une concentration finale de 15 % de GelMA et de 1 % de fibrinogène (appelé GelFib). Placez le mélange dans un bain-marie à 37 °C et mélangez périodiquement au tourbillon jusqu’à ce que la solution soit complètement dissoute.
- Après la fabrication, comme indiqué à la section 3, ajoutez 300 μL de GelFib préchauffé dans chaque chambre d’hydrogel pour intégrer le motif sacrificiel. Réticulez rapidement le GelMA avec la lumière ultraviolette (UV) à une longueur d’onde de 405 nm avec une intensité de 85 mW/cm2 pendant 120 s. Répétez cette procédure pour tous les autres puits.
REMARQUE : Le fibrinogène se réticule rapidement au contact du motif sacrificiel contenant de la thrombine. Nous vous recommandons d’ajouter de l’hydrogel et d’effectuer une réticulation UV individuellement pour chaque puits afin d’éviter la gélification indésirable de GelMA à température ambiante. De plus, des conditions stériles doivent être maintenues pour éviter la contamination pendant le processus de durcissement UV. - Ajouter 1 mL de DPBS de chaque côté du canal vasculaire dans chaque puits et maintenir la plaque à 4 °C pendant 15 minutes pour liquéfier le PF127.
- Après 15 min, aspirez le DPBS et répétez l’étape 4.5 3x pour un lavage complet du PF127.
- Avant d’introduire des cellules dans les canaux, perfuser du DMEM F12 contenant 1% de Matrigel pendant 30 min à travers les canaux pour améliorer l’attachement des cellules.
5. La culture HUVEC
- Préchauffer le milieu de croissance des cellules endothéliales (ECGM) dans un bain-marie à 37 °C pendant 30 min.
- Pendant ce temps, récupérez une fiole de HUVECs cryoconservés dans le réservoir d’azote, desserrez doucement le bouchon de la fiole, puis resserrez-le pour libérer l’azote des fils. Décongelez immédiatement les cellules en immergeant le flacon dans un bain-marie à 37 °C pendant 2 min, en veillant à ce qu’une petite quantité de glace reste à l’intérieur du flacon. Rincez le flacon avec de l’éthanol à 70 % pour éviter toute contamination.
REMARQUE : Portez des lunettes de sécurité lors de la récupération des cellules du réservoir d’azote. Le capuchon du flacon doit être maintenu au-dessus du niveau de l’eau pendant ce processus. - Préparez un tube conique de 15 mL contenant 5 mL d’ECGM préchauffé. À l’aide d’une micropipette, transférez soigneusement les cellules décongelées du flacon dans le tube conique. Pour vous assurer qu’aucune cellule n’est laissée derrière, ajoutez 1 ml de milieu frais préchauffé dans le cryoflacon, rincez l’intérieur et transférez les cellules restantes dans le tube conique.
- Centrifuger le tube conique à 200 × g pendant 3 min pour obtenir une pastille cellulaire. Jeter le surnageant, remettre les cellules en suspension dans 10 mL de milieu frais, transférer les cellules dans une fiole T75 et placer la fiole dans un incubateur de CO2 humidifié à 37 °C.
REMARQUE : Cette étape est importante pour éliminer le diméthylsulfoxyde présent dans le milieu de congélation dans le cryoflacon par centrifugation. - Rafraîchissez le milieu tous les deux jours jusqu’à ce que les cellules atteignent 80-90% de confluence.
6. Endothélialisation des canaux
- Préchauffer l’ECGM, le DPBS, la solution neutralisante de trypsine et l’acide éthylènediaminetétraacétique (TE) trypsine dans un bain-marie à 37 °C pendant 30 min.
- À 90 % de confluence, rincer les cellules dans une fiole T75 avec 10 mL de DPBS, ajouter 1 mL d’ET à 0,25 % dans la fiole et l’incuber pendant 3 min.
- Tapotez doucement les côtés du ballon et ajoutez 5 ml de solution neutralisante de trypsine pour neutraliser l’ET. Transférez les cellules dans un tube conique de 15 ml. Utilisez 5 mL d’ECGM frais pour recueillir les cellules restantes et ajoutez-les dans le tube conique.
- Centrifuger le tube conique à 250 × g pendant 3 min pour recueillir la pastille de cellule.
- Jeter le surnageant et remettre en suspension la pastille cellulaire dans 1 mL d’ECGM frais. Comptez les cellules à l’aide d’un hémocytomètre et répétez l’étape 6.4 pour obtenir une pastille cellulaire. Rémettez en suspension 3 millions de cellules dans 90 μL d’ECGM frais.
- Avant d’introduire la suspension cellulaire dans le canal, aspirez brièvement le canal sous vide pour dégager la lumière.
REMARQUE : Évitez l’aspiration prolongée du canal pour éviter d’endommager son intégrité. - Chargez doucement le canal avec une suspension cellulaire à une densité d’ensemencement de 0,5 million de cellules par puits. À l’aide d’une micropipette, ajoutez ~15 μL de cette suspension pour remplir le canal.
REMARQUE : La densité de semis peut varier en fonction de la taille du canal. Cette densité est optimisée pour un canal imprimé avec une buse de 20 G et un diamètre intérieur d’environ 900 μm. - Placez la plaque à plat à l’intérieur de l’incubateur pendant 2 h. Par la suite, retournez la plaque à 180°, en la maintenant à plat pendant les 2 heures suivantes.
- Après 4 h, lavez le canal avec du DPBS pour éliminer les cellules non adhérentes et mortes. Ajouter 2 mL d’ECGM frais dans chaque puits (1 mL de chaque côté du canal). Démarrez la culture dynamique sur un rocker à un angle d’inclinaison de 10° et 5 tr/min en positionnant la plaque sur le rocker avec les canaux parallèles à la direction du balancement. Rafraîchissez le milieu de culture tous les deux jours.
REMARQUE : La culture dynamique améliore l’échange de milieu entre les réservoirs et les canaux et aide les cellules à proliférer pendant la nuit.
7. Évaluation de la maturation de l’endothélium
- Préchauffer l’ECGM et le DPBS dans un bain-marie à 37 °C pendant 30 min et le réactif Cell Counting Kit-8 (CCK8) à température ambiante.
- Préparez une solution de travail de CCK8 en mélangeant 100 μL de réactif CCK8 avec 1 mL d’ECGM frais pour chaque puits. Pendant que vous travaillez pour une plaque/6 canaux, préparez 600 μL de réactif CCK8 en le combinant avec 6 mL d’ECGM frais.
- Retirez le milieu de croissance par aspiration et rincez les canaux avec du DPBS. Ajouter 1 mL de solution de travail CCK8 dans chaque puits et laisser la plaque à plat à l’intérieur de l’incubateur pendant 30 min. Ensuite, commencez la culture dynamique sur un rocker comme décrit à l’étape 6.9, et continuez ce processus pendant les 3 heures suivantes.
- Après 3 h, retirez le contenu de chaque puits en inclinant la plaque d’un côté et transférez-le dans une nouvelle plaque à six puits. Rincez les canaux avec du DPBS et ajoutez du milieu frais.
REMARQUE : Couvrir la plaque de papier d’aluminium jusqu’à la mesure de l’absorbance. Maintenez un volume de réactif constant dans tous les puits pour assurer des lectures uniformes. Lors du pipetage, évitez soigneusement d’introduire des bulles d’air, qui peuvent perturber la précision des lectures de densité optique. - Après avoir doucement secoué la plaque pendant 15 s pour assurer un mélange uniforme des couleurs, utilisez un lecteur de microplaques pour mesurer l’absorbance à 450 nm.
- Répétez cette procédure à des intervalles de temps prédéfinis. Calculez la densité optique moyenne pour chaque point temporel et tracez une courbe de croissance dans un logiciel graphique. Cette courbe indique la maturation relative de l’endothélium au cours du temps.
8. Dosage de la perméabilité
- Retirez le milieu d’un puits d’intérêt.
REMARQUE : Pour le test de perméabilité, il est recommandé de traiter chaque puits séparément pour éviter que d’autres canaux ne se dessèchent, ce qui pourrait altérer leur perméabilité vasculaire. - Préparez 6 mL d’une solution à 0,1 mg/mL de dextran conjugué au FITC en dissolvant 70 kDa de dextran FITC dans du DPBS.
REMARQUE : Préparez une solution mère de 20 mg/mL de FITC dextran en dissolvant 100 mg de FITC dextran dans 5 mL de DPBS. Après avoir doucement tourbillonné la solution, aliquote 500 μL dans des tubes de 1,5 mL pour éviter les cycles répétés de gel-dégel. Ces aliquotes peuvent être conservées à -20 °C pendant un maximum de 6 mois. Avant d’effectuer l’essai, diluer la solution mère à une concentration de travail de 0,1 mg/mL. - Positionnez fermement la plaque sur la platine du microscope et ajustez le grossissement de l’objectif en mode contraste de phase pour assurer une bonne visibilité de la paroi du canal dans la région d’intérêt, ainsi que du gel situé à proximité, dans le champ de vision.
REMARQUE : Pour une évaluation efficace de la perméabilité, essayez de maximiser la surface du gel entourant la région d’intérêt dans le champ de vision ; Cet aspect est essentiel pour un suivi précis du transport du dextran. - Après avoir fait la mise au point sur la zone souhaitée, passez du mode de contraste de phase au mode de fluorescence. Sous l’onglet Acquisition d’image , ajoutez FITC dans le canal grand champ et acquérez une image avant d’ajouter la solution de dextran, pour calculer l’intensité de fluorescence de fond. Ensuite, ajoutez 1 mL de solution de travail de dextran FITC d’un côté du canal et laissez la solution s’écouler vers l’autre côté du puits, entraînée par la différence de pression hydrostatique.
- Acquérez des images à des intervalles de temps prédéterminés, plus fréquemment pour les canaux à haute perméabilité et moins fréquemment pour ceux à faible perméabilité.
9. Mesure de l’intensité de fluorescence dans ImageJ
- Dans le logiciel d’analyse d’images ImageJ, mesurez l’intensité au point temporel initial (It1), l’intensité moyenne observée au point temporel ultérieur (It2) et l’intensité due au bruit de fond (Ib), comme indiqué ci-dessous. Utilisez l’équation (1) pour calculer le coefficient de perméabilité (Pd). T1 et T2 se réfèrent aux points temporels initiaux et ultérieurs de l’acquisition d’images.
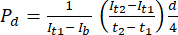 (1)
(1)- Démarrez ImageJ et ouvrez l’image acquise au point temporel initial.
- Réglez l’échelle dans ImageJ. Accédez à Analyser | Réglez l’échelle. Entrez l’échelle et l’unité de mesure connues.
- Sélectionnez l’outil rectangle et tracez un rectangle sur la zone du gel où la mesure de l’intensité de fluorescence est requise.
- Accédez à Analyser | Définissez Mesures et assurez-vous que la valeur Gray moyenne est cochée.
REMARQUE : Cette option mesure l’intensité moyenne dans la zone sélectionnée. D’autres paramètres peuvent être sélectionnés selon les besoins de l’analyse donnée. - Avec la zone toujours sélectionnée, accédez à Analyser | Mesurez ou appuyez simplement sur M. Attendez qu’une fenêtre de résultats s’ouvre, indiquant l’intensité moyenne de fluorescence et tout autre paramètre sélectionné.
- Prenez trois mesures et calculez la valeur moyenne de l’intensité de fluorescence dans une feuille de calcul.
- Répétez cette procédure pour les images capturées au point temporel t2 suivant, ainsi que pour celles prises avant l’ajout de la solution de dextran pour le calcul de l’intensité de fluorescence au point temporel ultérieur, afin de déterminer la fluorescence de fond.
Résultats
La plate-forme VOP, qui se caractérise par une flexibilité de taille et de motif, a été fabriquée à l’aide d’un système de bio-impression multi-têtes. Les canaux, à la fois creux et capables de perfusion, ont été ensemencés avec des HUVEC pour faciliter l’endothélialisation et ont ensuite été évalués à l’aide d’un test de perméabilité (Figure 1A). Pour démontrer la capacité de fabrication multi-échelle de cette méthode, nous...
Discussion
Tirant parti de la précision, de l’automatisation et de la nature contrôlée par ordinateur de la technologie de bio-impression 3D, nous avons établi une méthode rationalisée pour fabriquer des canaux vasculaires dans des plaques standard à six puits, qui ont été choisies pour leur compatibilité avec les lecteurs de microplaques commerciaux et les configurations d’imagerie au microscope. La conception de la plaque peut s’adapter à des canaux de tailles multiples et à un ...
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Ce travail a été soutenu par des subventions de la Fondation nationale de recherche de Corée (NRF) financées par le gouvernement coréen (Ministère des Sciences et des TIC, MSIT) [No. NRF-2019R1C1C1009606 ; n° 2020R1A5A8018367 ; et Non. RS-2024-00423107]. Cette recherche a été soutenue par le Programme de développement des technologies biologiques et médicales des subventions NRF financées par le MSIT [No. NRF-2022M3A9E4017151 et No. NRF-2022M3A9E4082654]. Ces travaux ont été soutenus par le Programme d’innovation technologique [n° 20015148] et le Projet Alchimiste [n° 20012378] financés par le ministère du Commerce, de l’Industrie et de l’Énergie (MOTIE, Corée). Ce travail a également été soutenu par l’Institut coréen de planification et d’évaluation de la technologie dans l’alimentation, l’agriculture et la foresterie (IPET) par le biais du Programme des technologies de convergence agricole et alimentaire pour la recherche et le développement de la main-d’œuvre, financé par le ministère de l’Agriculture, de l’Alimentation et des Affaires rurales (MAFRA) [No. RS-2024-00397026].
matériels
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
Références
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -. L., Wautier, M. -. P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958 (2022).
- Park, W., Lee, J. -. S., Gao, G., Kim, B. S., Cho, D. -. W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696 (2023).
- Sun, H. -. J., Wu, Z. -. Y., Nie, X. -. W., Bian, J. -. S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568 (2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778 (2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771 (2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267 (2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Can Pfizer deliver. MIT Technology Review Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004)
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013 (2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168 (2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141 (2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012 (2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798 (2017).
- Cho, W. -. W., Ahn, M., Kim, B. S., Cho, D. -. W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093 (2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027 (2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102 (2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744 (2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022 (2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345 (2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171 (2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683 (2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938 (2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -. J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043 (2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723 (2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071 (2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760 (2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151 (2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon