É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Método de bioimpressão de alto rendimento para modelagem da permeabilidade vascular em placas padrão de seis poços com flexibilidade de tamanho e padrão
Neste Artigo
Resumo
Apresentamos um protocolo para produção de alto rendimento de canais vasculares com tamanhos flexíveis e padrões desejados em uma placa padrão de seis poços usando a tecnologia de bioimpressão 3D, conhecida como vasos em uma placa (VOP). Esta plataforma tem o potencial de avançar no desenvolvimento de terapêuticas para os distúrbios associados ao endotélio comprometido.
Resumo
A permeabilidade vascular é um fator chave no desenvolvimento de terapias para distúrbios associados ao endotélio comprometido, como disfunção endotelial nas artérias coronárias e função prejudicada da barreira hematoencefálica. As técnicas de fabricação existentes não replicam adequadamente a variação geométrica nas redes vasculares do corpo humano, o que influencia substancialmente a progressão da doença; Além disso, essas técnicas geralmente envolvem procedimentos de fabricação em várias etapas que dificultam a produção de alto rendimento necessária para testes farmacológicos. Este artigo apresenta um protocolo de bioimpressão para a criação de múltiplos tecidos vasculares com padrões e tamanhos desejados diretamente em placas padrão de seis poços, superando os desafios existentes de resolução e produtividade na tecnologia de bioimpressão. Uma abordagem de fabricação simplificada foi estabelecida para construir seis canais ocos e perfusíveis dentro de um hidrogel, que foram posteriormente revestidos com células endoteliais da veia umbilical humana para formar um endotélio funcional e maduro. A natureza controlada por computador da bioimpressão 3D garante alta reprodutibilidade e requer menos etapas de fabricação manual do que os métodos tradicionais. Isso destaca o potencial do VOP como uma plataforma eficiente de alto rendimento para modelar a permeabilidade vascular e avançar na descoberta de medicamentos.
Introdução
A rede vascular em todo o corpo humano funciona como uma barreira de transporte crucial, regulando dinamicamente a troca de moléculas e células entre o sangue e os tecidos circundantes. Essa regulação é essencial para prevenir o edema tecidual e permitir a troca seletiva de nutrientes e células, apoiando assim o metabolismo e a homeostase tecidual1. A permeabilidade endotelial alterada, um fator em muitas condições de saúde, afeta tanto a gravidade da doença quanto a eficácia do tratamento2. O endotélio vascular atua como uma barreira seletiva, facilitando a transferência entre vasos, tecidos e órgãos. Essa regulação envolve vários mecanismos, como a filtragem básica de solutos e pequenas moléculas, a ruptura intencional da barreira vascular e a influência de moléculas como prostaglandinas e fatores de crescimento nos níveis de permeabilidade3.
Os principais fatores nessa regulação incluem as junções das células endoteliais, a migração de leucócitos e a funcionalidade da barreira hematoencefálica4. Dada a sua complexidade, o processo varia em diferentes ambientes, envolvendo vários tipos de vasos sanguíneos e utilizando vias anatômicas distintas. Compreender os fundamentos biológicos da permeabilidade vascular é crucial para a elaboração de abordagens terapêuticas para tratar condições associadas à permeabilidade vascular anormal. Manter a permeabilidade vascular é crucial para a saúde do sistema vascular e dos tecidos circundantes; Consequentemente, o comprometimento dessa função leva à disfunção endotelial, estado em que o endotélio perde sua funcionalidade normal.
A disfunção endotelial é precursora de várias doenças humanas prevalentes, incluindo hipertensão, doença arterial coronariana, diabetes e câncer 5,6,7. Essa condição pode se apresentar de várias maneiras, incluindo diminuição da vasodilatação, aumento da permeabilidade dos vasos e tendência a um estado pró-inflamatório. Esse estado patológico é o estágio inicial de vários problemas cardiovasculares críticos, como doença arterial coronariana, acidente vascular cerebral e doença arterial periférica8, que continuam a ser as principais causas de mortalidade nos Estados Unidos1. A disfunção endotelial afeta a saúde cardiovascular, bem como a barreira hematoencefálica (BHE) e desempenha um papel importante na progressão de vários distúrbios neurológicos. A disfunção pode aumentar a permeabilidade da BHE, permitindo que toxinas, patógenos e células imunes se infiltrem no sistema nervoso central e contribuindo para distúrbios neurológicos, como acidente vascular cerebral, doença de Alzheimer, esclerose múltipla e infecções cerebrais9.
A disfunção endotelial no diabetes é marcada pelo comprometimento da capacidade do endotélio de regular o tônus vascular e produzir mediadores vasodilatadores, como o óxido nítrico, levando ao comprometimento da vasodilatação10. Essa condição é exacerbada por vias induzidas pela hiperglicemia, como a ativação da proteína quinase C e o estresse oxidativo, contribuindo significativamente para a progressão da doença vascular diabética11. Além disso, descobriu-se que um ambiente inflamatório aumenta a adesão das células tumorais às células endoteliais microvasculares cerebrais, enquanto um endotélio com vazamento foi relatado como um fator importante na metástase do câncer12,13. Descobriu-se que a geometria dos vasos sanguíneos influencia diretamente a metástase do câncer cerebral. As células tumorais se ligam preferencialmente a áreas de maior curvatura dos vasos sanguíneos7. Esse achado ressalta a importância da geometria vascular na metástase do câncer. Mais importante, em condições como fibrose e câncer, a função da barreira endotelial interrompida não apenas desempenha um papel no desenvolvimento da doença, mas também dificulta a eficácia do tratamento, dificultando a administração adequada do medicamento14. A pesquisa sobre permeabilidade vascular é crucial para o avanço do tratamento de doenças cardiovasculares e oferece insights sobre o gerenciamento de outras doenças que envolvem função vascular comprometida.
Dado o papel crucial da permeabilidade vascular na saúde e na doença, pesquisas consideráveis se concentraram em examinar a natureza seletiva da barreira endotelial para o desenvolvimento terapêutico usando modelos animais, juntamente com plataformas tradicionais de teste in vitro 2D e 3D. No entanto, os modelos animais apresentam limitações devido a diferenças específicas da espécie e questões éticas, além de altos custos15,16. Por exemplo, a Pfizer, em 2004, afirmou que, nos 10 anos anteriores, gastou mais de US $ 2 bilhões em desenvolvimentos de medicamentos que mostraram efeitos promissores em modelos animais, mas acabaram falhando em estágios avançados de testes em humanos17. Além disso, os modelos 2D tradicionais não imitam com precisão a arquitetura tridimensional (3D) e a complexa estrutura geométrica dos canais vasculares.
Com os avanços nas tecnologias de biofabricação, grandes esforços têm sido direcionados para a fabricação de canais vasculares enquanto recapitulam a arquitetura 3D. Os canais vasculares em microescala podem ser efetivamente fabricados dentro de chips microfluídicos usando litografia suave, oferecendo assim uma vantagem de análise em tempo real18,19. Métodos alternativos, como fundição de hidrogel ou envolvimento de folhas de células em torno de um molde ou mandril, podem ser usados para criar estruturas tubulares independentes com o diâmetro desejado20,21. No entanto, esses métodos têm limitações; Por exemplo, chips microfluídicos são restritos a configurações de microcanais, e a fundição de hidrogel em torno de um molde não replica efetivamente várias geometrias.
Com o surgimento da tecnologia de bioimpressão 3D22, a replicação de geometrias complexas depositando com precisão vários materiais de hidrogel baseados em matriz extracelular (ECM) tornou-se possível23,24. Alguns métodos de bioimpressão, como aqueles que usam bicos dispostos concentricamente, por exemplo, coaxial e triaxial25,26, não podem criar tubos bifurcados; no entanto, estruturas complexas podem ser alcançadas com métodos de padronização sacrificial27. Nenhum desses métodos de bioimpressão demonstrou permitir modelagem in vitro de alto rendimento - um requisito crucial para a pesquisa farmacológica na descoberta de medicamentos. Aqui, apresentamos um método para fabricar eficientemente canais vasculares endotelizados com controle eficiente sobre as dimensões.
Estabelecemos uma abordagem direta usando placas de seis poços disponíveis comercialmente, combinadas com um método de padronização sacrificial no qual uma bioimpressora fabrica canais vasculares de tamanhos e padrões desejados dentro de um hidrogel ECM. Células endoteliais da veia umbilical humana (HUVECs) foram semeadas para endotelizar esses canais e avaliar a funcionalidade do endotélio por meio de um ensaio de permeabilidade. Esse design permite a perfusão sem bombeamento, criando reservatórios de mídia em ambos os lados do canal e usa o fluxo acionado por gravidade com a ajuda de um balancim 2D comumente usado para imitar a cultura dinâmica. Essa abordagem elimina a necessidade de bombas peristálticas e facilita a escalabilidade dessa plataforma para aplicações de alto rendimento. A natureza controlada por computador da tecnologia de bioimpressão 3D também agiliza o processo de fabricação, diminuindo assim a probabilidade de erros durante a fabricação. O modelo VOP mostra-se promissor como uma ferramenta valiosa para testes farmacológicos na descoberta de medicamentos.
Protocolo
1. Geração de código G para a bioimpressora
- Para gerar e visualizar o caminho de impressão, visite uma ferramenta de simulação de código G online (por exemplo, NCviewer).
- Clique no ícone Novo arquivo na interface para criar um novo arquivo de código G.
- Gere um caminho de impressão escrevendo manualmente os comandos do código G para o canal de sacrifício e a câmara de silício. Use as dimensões de uma placa padrão de seis poços como referência para criar a geometria.
NOTA: O código G usado aqui é baseado no código de Controle Numérico Computadorizado (CNC). As funções de cada comando são fornecidas na Tabela Suplementar S1. O formato de placa de seis poços foi selecionado devido à sua compatibilidade com leitores comerciais de microplacas e configurações de microscopia e sua capacidade de acomodar volumes adequados de mídia para suportar a maturação do endotélio, minimizando assim a necessidade de trocas frequentes de mídia. Este protocolo de fabricação também pode ser adaptado para uso com outras placas de poços padrão. - Quando o código G estiver concluído, clique no ícone Salvar arquivo na interface para baixar o arquivo com extensão .nc.
NOTA: Qualquer outro algoritmo de geração de código G disponível pode ser usado para gerar os caminhos de impressão. A geometria do canal vascular pode ser manipulada neste código G.
2. Preparação de tintas sacrificiais e de câmara de silício
NOTA: As fontes de todos os materiais usados neste protocolo estão listadas na Tabela de Materiais.
- Combine dois tipos de polímeros de silicone, SE1700 e polidimetilsiloxano (PDMS), na proporção de 10:2. Adicione o agente de cura de cada polímero na proporção de 10:1, polímero para agente de cura.
- Use um misturador planetário para misturar e desgaseificar completamente a mistura de polímeros a 2.000 rpm.
- Com uma espátula, transfira o polímero de silicone misturado para uma seringa descartável de 10 mL. Centrifugue a seringa carregada a 400 × g durante 3 min a 5 °C para garantir uma consistência uniforme e evitar bolhas durante a impressão.
NOTA: A tinta da câmara deve ser usada dentro de 2 h após a adição dos agentes de cura para garantir a qualidade de impressão ideal. Conservar a seringa a 5 °C enquanto prepara para a impressão. Esse processo ajuda a retardar a cura da tinta, o que pode alterar os parâmetros de impressão. - Pesar o Pluronic F-127 (PF127) para preparar uma solução-mãe a 40% (p/v) de PF127 em água destilada.
- Misturar a solução PF127 numa batedeira planetária durante 3 min a 400 × g para obter homogeneidade. Manter a mistura homogeneizada a 4 °C para a dissolução completa do PF127.
- Prepare uma solução estoque de trombina de 1.000 unidades/mL em solução salina tamponada com fosfato de Dulbecco (DPBS).
NOTA: Armazene a solução estoque de trombina em alíquotas de 100 μL para evitar ciclos repetidos de congelamento e descongelamento. As alíquotas devem ser conservadas a -20 °C durante um período máximo de 6 meses. - Antes de imprimir, prepare a tinta sacrificial misturando trombina em uma diluição de 1:10 com PF127 até uma concentração final de trabalho de 36% (p / v) para PF127 e 100 unidades / mL para trombina. Para preparar 1 mL de tinta sacrificial, misture 100 μL de solução estoque de trombina com 900 μL de solução estoque PF127.
NOTA: Ao preparar a tinta sacrificial para imprimir uma única placa, um volume total de 1 mL é mais do que suficiente.
3. Processo de fabricação
- Antes de iniciar o processo de fabricação, trate uma placa de seis poços com plasma de oxigênio (O2) a uma intensidade de 100 watts por 1 min.
- Siga o procedimento descrito na seção 2 para preparar as tintas sacrificial e de silicone, garantindo que as tintas estejam livres de bolhas e misturadas de forma homogênea para uma impressão consistente. Coloque cuidadosamente as tintas no cabeçote de impressão da bioimpressora. Defina a temperatura da cabeça da bioimpressora para 37 °C para a tinta sacrificial e 5 °C para a tinta de silicone.
- Conecte um bico cônico de rosca dupla de 22 G à seringa de silicone. Para a tinta sacrificial, escolha o tamanho do bico de acordo com o diâmetro do canal desejado.
NOTA: Aqui, demonstramos três tamanhos de bicos: 18 G, 20 G e 22 G. Os parâmetros de impressão ideais, incluindo pressão de impressão e velocidade do cabeçote de impressão, são descritos na Tabela 1. - Carregue o código G desejado e pressione a função servo ready na interface de software da bioimpressora por 3 s. Posicione a chapa no palco no ponto inicial do código G e clique em iniciar para iniciar o processo de impressão.
NOTA: Normalmente, a fabricação de uma placa contendo seis câmaras requer aproximadamente 1 h e 10 min. A etapa 3.4, envolvendo o carregamento e a execução do código G, está sujeita a variações dependendo da bioimpressora específica usada. Certifique-se de que as condições estéreis sejam mantidas durante o uso da bioimpressora para evitar contaminação. - Coloque uma tampa sobre a placa e transfira-a para uma incubadora de CO2 umidificada a 37 °C por 72 h para curar as câmaras de silício.
NOTA: Embora a cura do silício possa ocorrer em um ritmo mais lento dentro da incubadora, a placa não deve ser colocada dentro de um forno seco.
4. Preparação de hidrogel e incorporação de canais
- Prepare um tubo cônico de 50 mL contendo 20 mL de 1x PBS. Coloque 0,01 g de fenil-2,4,6-trimetilbenzoilfosfinato de lítio (LAP) no tubo cônico para fazer uma solução LAP a 0,05% (p / v). Vortex até que o pó esteja completamente dissolvido.
NOTA: Enrole o tubo cônico em papel alumínio para evitar a exposição à luz. Conservar a solução-mãe LAP a 4 °C. - Adicione 3 g de metacrilato de gelatina (GelMA) e 0,2 g de fibrinogênio a 20 mL de solução LAP para atingir uma concentração final de 15% de GelMA e 1% de fibrinogênio (referido como GelFib). Colocar a mistura num banho-maria a 37 °C e periodicamente misturar em vórtice até que a solução esteja totalmente dissolvida.
- Após a fabricação, conforme descrito na Seção 3, adicione 300 μL de GelFib pré-aquecido em cada câmara de hidrogel para incorporar o padrão de sacrifício. Reticule rapidamente o GelMA com luz ultravioleta (UV) em um comprimento de onda de 405 nm com uma intensidade de 85 mW / cm2 por 120 s. Repita este procedimento para todos os outros poços.
NOTA: O fibrinogênio se reticula rapidamente ao entrar em contato com o padrão de sacrifício contendo trombina. Recomendamos adicionar hidrogel e realizar reticulação UV individualmente para cada poço para evitar a gelificação indesejada de GelMA à temperatura ambiente. Além disso, condições estéreis devem ser mantidas para evitar contaminação durante o processo de cura UV. - Adicione 1 mL de DPBS a cada lado do canal vascular em cada poço e mantenha a placa a 4 °C por 15 min para liquefazer o PF127.
- Após 15 min, aspire o DPBS e repita o passo 4.5 3x para a lavagem completa do PF127.
- Antes de introduzir células nos canais, perfunda DMEM F12 contendo 1% de Matrigel por 30 min através dos canais para aumentar a fixação celular.
5. Cultura HUVEC
- Pré-aqueça o meio de crescimento de células endoteliais (ECGM) em banho-maria a 37 °C por 30 min.
- Enquanto isso, recupere um frasco de HUVECs criopreservados do tanque de nitrogênio, afrouxe suavemente a tampa do frasco e reaperte-o para liberar nitrogênio dos fios. Descongele imediatamente as células submergindo o frasco para injetáveis num banho-maria a 37 °C durante 2 min, garantindo que permanece uma pequena quantidade de gelo no interior do frasco. Enxágue o frasco com etanol a 70% para evitar contaminação.
NOTA: Use óculos de segurança ao recuperar células do tanque de nitrogênio. A tampa do frasco para injetáveis deve ser mantida acima do nível da água durante este processo. - Prepare um tubo cônico de 15 mL contendo 5 mL de ECGM pré-aquecido. Com uma micropipeta, transfira cuidadosamente as células descongeladas do frasco para o tubo cônico. Para garantir que nenhuma célula seja deixada para trás, adicione 1 mL de meio fresco pré-aquecido ao criogenial, enxágue o interior e transfira as células restantes para o tubo cônico.
- Centrifugar o tubo cónico a 200 × g durante 3 min para obter um sedimento celular. Rejeitar o sobrenadante, ressuspender as células em 10 ml de meio fresco, transferir as células para um balão T75 e colocar o balão dentro de uma incubadora de CO2 humidificada a 37 °C.
NOTA: Esta etapa é importante para remover o dimetilsulfóxido presente no meio de congelamento no criogênico por meio de centrifugação. - Atualize o meio a cada dois dias até que as células atinjam 80-90% de confluência.
6. Endotelização de canais
- Pré-aqueça ECGM, DPBS, solução neutralizadora de tripsina e ácido etilenodiaminotetracético (TE) de tripsina em banho-maria a 37 °C por 30 min.
- A 90% de confluência, enxágue as células em um frasco T75 com 10 mL de DPBS, adicione 1 mL de TE a 0,25% ao frasco e incube-o por 3 min.
- Bata suavemente nas laterais do frasco e adicione 5 mL de solução neutralizadora de tripsina para neutralizar o TE. Transfira as células para um tubo cônico de 15 mL. Use 5 mL de ECGM fresco para coletar as células restantes e adicioná-las ao tubo cônico.
- Centrifugue o tubo cônico a 250 × g por 3 min para coletar o pellet da célula.
- Descarte o sobrenadante e ressuspenda o sedimento celular em 1 mL de ECGM fresco. Conte as células com um hemocitômetro e repita a Etapa 6.4 para obter um pellet de células. Ressuspenda 3 milhões de células em 90 μL de ECGM fresco.
- Antes de introduzir a suspensão celular no canal, aspire brevemente o canal a vácuo para limpar o lúmen.
NOTA: Evite a sucção prolongada do canal para evitar danos à sua integridade. - Carregue suavemente o canal com uma suspensão de células a uma densidade de semeadura de 0,5 milhão de células por poço. Use uma micropipeta para adicionar ~ 15 μL desta suspensão para preencher o canal.
NOTA: A densidade de semeadura pode variar dependendo do tamanho do canal. Essa densidade é otimizada para um canal impresso com um bico de 20 G e um diâmetro interno de aproximadamente 900 μm. - Coloque a placa dentro da incubadora por 2 h. Em seguida, inverter a placa a 180°, mantendo-a em posição plana durante as 2 h seguintes.
- Após 4 h, lave o canal com DPBS para remover as células não aderentes e mortas. Adicione 2 mL de ECGM fresco a cada poço (1 mL de cada lado do canal). Inicie a cultura dinâmica em um balancim em um ângulo de inclinação de 10° e 5 rpm posicionando a placa no balancim com os canais paralelos à direção do balanço. Atualize o meio de crescimento a cada dois dias.
NOTA: A cultura dinâmica aumenta a troca de meio entre os reservatórios e canais e ajuda as células a proliferar durante a noite.
7. Avaliação da maturação do endotélio
- Pré-aqueça ECGM e DPBS em banho-maria a 37 °C por 30 min e reagente do Kit de Contagem de Células-8 (CCK8) à temperatura ambiente.
- Faça uma solução de trabalho de CCK8 misturando 100 μL de reagente CCK8 com 1 mL de ECGM fresco para cada poço. Enquanto trabalha para uma placa/6 canais, prepare 600 μL de reagente CCK8 combinando-o com 6 mL de ECGM fresco.
- Remova o meio de crescimento por sucção e enxágue os canais com DPBS. Adicione 1 mL de solução de trabalho CCK8 a cada poço e deixe a placa permanecer plana dentro da incubadora por 30 min. Depois, inicie a cultura dinâmica em um rocker conforme descrito na etapa 6.9 e continue esse processo pelas próximas 3 h.
- Após 3 h, remova o conteúdo de cada poço inclinando a placa para um lado e transfira-o para uma nova placa de seis poços. Enxágue os canais com DPBS e adicione meio fresco.
NOTA: Cubra a placa com papel alumínio até a medição da absorbância. Mantenha um volume de reagente consistente em todos os poços para garantir leituras uniformes. Durante a pipetagem, evite cuidadosamente a introdução de bolhas de ar, que podem atrapalhar a precisão das leituras de densidade óptica. - Depois de agitar suavemente a placa por 15 s para garantir uma mistura uniforme das cores, use um leitor de microplacas para medir a absorbância a 450 nm.
- Repita este procedimento em intervalos de tempo predefinidos. Calcule a densidade óptica média para cada ponto no tempo e trace uma curva de crescimento no software gráfico. Essa curva indica a maturação relativa do endotélio ao longo do tempo.
8. Ensaio de permeabilidade
- Remova o meio de um poço de interesse.
NOTA: Para o ensaio de permeabilidade, recomenda-se o processamento de cada poço separadamente para evitar que outros canais sequem, o que pode alterar sua permeabilidade vascular. - Prepare 6 mL de solução de 0,1 mg / mL de dextrano conjugado com FITC dissolvendo 70 kDa de dextrano FITC em DPBS.
NOTA: Prepare uma solução estoque de 20 mg / mL de dextrano FITC dissolvendo 100 mg de dextrano FITC em 5 mL de DPBS. Depois de agitar suavemente a solução, alíquota de 500 μL em tubos de 1,5 mL para evitar ciclos repetidos de congelamento e descongelamento. Estas alíquotas podem ser conservadas a -20 °C durante um período máximo de 6 meses. Antes de realizar o ensaio, dilua a solução estoque a uma concentração de trabalho de 0,1 mg / mL. - Posicione a placa firmemente na platina do microscópio e ajuste a ampliação da objetiva no modo de contraste de fase para garantir uma visibilidade clara da parede do canal na região de interesse, juntamente com o gel localizado nas proximidades, dentro do campo de visão.
NOTA: Para uma avaliação eficaz da permeabilidade, tente maximizar a área do gel ao redor da região de interesse no campo de visão; Este aspecto é fundamental para o monitoramento preciso do transporte de dextrano. - Depois de focar na área desejada, mude do contraste de fase para o modo de fluorescência. Na guia de aquisição de imagem , adicione FITC ao canal de campo amplo e adquira uma imagem antes de adicionar a solução de dextrana, para calcular a intensidade de fluorescência de fundo. Em seguida, adicione 1 mL de solução de trabalho de dextrana FITC em um lado do canal e deixe a solução fluir em direção ao outro lado do poço, impulsionada pela diferença de pressão hidrostática.
- Adquira imagens em intervalos de tempo predeterminados - com mais frequência para canais com alta permeabilidade e com menos frequência para aqueles com menor permeabilidade.
9. Medição da intensidade de fluorescência no ImageJ
- No software de análise de imagem ImageJ, meça a intensidade no ponto de tempo inicial (It1), a intensidade média observada no ponto de tempo posterior (It2) e a intensidade devido ao ruído de fundo (Ib), conforme descrito abaixo. Utilizar a equação (1) para calcular o coeficiente de permeabilidade (Pd). t1 e t2 referem-se aos pontos de tempo iniciais e posteriores de aquisição da imagem.
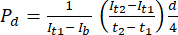 Características (1)
Características (1)- Inicie o ImageJ e abra a imagem adquirida no ponto de tempo inicial.
- Defina a escala em ImageJ. Navegue até Analisar | Definir escala. Insira a escala e a unidade de medida conhecidas.
- Selecione a ferramenta retângulo e desenhe um retângulo sobre a área do gel onde a medição da intensidade de fluorescência é necessária.
- Navegue até Analisar | Defina Medidas e certifique-se de que o valor médio de cinza esteja marcado.
NOTA: Esta opção mede a intensidade média dentro da área selecionada. Outros parâmetros podem ser selecionados conforme necessário para a análise fornecida. - Com a área ainda selecionada, navegue até Analisar | Meça ou simplesmente pressione M. Aguarde a abertura de uma janela de resultados , mostrando a intensidade média de fluorescência e quaisquer outros parâmetros selecionados.
- Faça três medições e calcule o valor médio da intensidade de fluorescência em uma planilha.
- Repita este procedimento para as imagens capturadas no ponto de tempo subsequente t2, bem como aquelas tiradas antes da adição da solução de dextrano para o cálculo da intensidade de fluorescência no ponto de tempo posterior, para determinar a fluorescência de fundo.
Resultados
A plataforma VOP, com flexibilidade de tamanho e padrão, foi fabricada com um sistema de bioimpressão de várias cabeças. Canais, ocos e capazes de perfusão, foram semeados com HUVECs para facilitar a endotelização e foram posteriormente avaliados com um ensaio de permeabilidade (Figura 1A). Para demonstrar a capacidade de fabricação multiescala desse método, imprimimos três configurações distintas: reta, bifurcada e complicada (
Discussão
Aproveitando a precisão, automação e natureza controlada por computador da tecnologia de bioimpressão 3D, estabelecemos um método simplificado para fabricar canais vasculares em placas padrão de seis poços, que foram escolhidas por sua compatibilidade com leitores comerciais de microplacas e configurações de imagens microscópicas. O design da placa pode acomodar canais de vários tamanhos e um volume suficiente de mídia para o crescimento de canais maiores, diminuindo a frequ?...
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado por subvenções da Fundação Nacional de Pesquisa da Coreia (NRF) financiadas pelo governo da Coreia (Ministério da Ciência e TIC, MSIT) [No. NRF-2019R1C1C1009606; Nº 2020R1A5A8018367; e não. RS-2024-00423107]. Esta pesquisa foi apoiada pelo Programa de Desenvolvimento de Tecnologia Médica e Biológica das bolsas da NRF financiadas pelo MSIT [No. NRF-2022M3A9E4017151 e No. NRF-2022M3A9E4082654]. Este trabalho foi apoiado pelo Programa de Inovação Tecnológica [nº 20015148] e pelo Projeto Alquimista [nº 20012378] financiado pelo Ministério do Comércio, Indústria e Energia (MOTIE, Coréia). Este trabalho também foi apoiado pelo Instituto Coreano de Planejamento e Avaliação de Tecnologia em Alimentos, Agricultura e Silvicultura (IPET) por meio do Programa de Tecnologias de Convergência Agrícola e Alimentar para Pesquisa Desenvolvimento de Mão de Obra, financiado pelo Ministério da Agricultura, Alimentação e Assuntos Rurais (MAFRA) [No. RS-2024-00397026].
Materiais
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
Referências
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -. L., Wautier, M. -. P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958 (2022).
- Park, W., Lee, J. -. S., Gao, G., Kim, B. S., Cho, D. -. W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696 (2023).
- Sun, H. -. J., Wu, Z. -. Y., Nie, X. -. W., Bian, J. -. S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568 (2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778 (2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771 (2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267 (2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Can Pfizer deliver. MIT Technology Review Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004)
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013 (2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168 (2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141 (2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012 (2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798 (2017).
- Cho, W. -. W., Ahn, M., Kim, B. S., Cho, D. -. W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093 (2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027 (2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102 (2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744 (2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022 (2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345 (2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171 (2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683 (2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938 (2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -. J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043 (2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723 (2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071 (2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760 (2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151 (2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados