Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Boyut ve Desen Esnekliği ile Standart Altı Kuyulu Plakalarda Vasküler Geçirgenliğin Modellenmesi için Yüksek Verimli Biyobaskı Yöntemi
Bu Makalede
Özet
Plaka üzerinde damar (VOP) olarak adlandırılan 3D biyobaskı teknolojisini kullanarak standart altı oyuklu bir plaka üzerinde esnek boyutlara ve istenen desenlere sahip vasküler kanalların yüksek verimli üretimi için bir protokol sunuyoruz. Bu platform, riskli endotel ile ilişkili bozukluklar için terapötiklerin geliştirilmesini ilerletme potansiyeline sahiptir.
Özet
Vasküler geçirgenlik, koroner arterlerdeki endotel disfonksiyonu ve kan-beyin bariyerinin bozulmuş fonksiyonu gibi bozulmuş endotel ile ilişkili bozukluklar için tedavilerin geliştirilmesinde anahtar bir faktördür. Mevcut üretim teknikleri, insan vücudundaki vasküler ağlardaki geometrik varyasyonu yeterince kopyalamamaktadır ve bu da hastalığın ilerlemesini önemli ölçüde etkilemektedir; Ayrıca, bu teknikler genellikle farmakolojik testler için gerekli olan yüksek verimli üretimi engelleyen çok adımlı üretim prosedürlerini içerir. Bu makale, biyo-baskı teknolojisindeki mevcut çözünürlük ve üretkenlik zorluklarının üstesinden gelerek, doğrudan standart altı oyuklu plakalar üzerinde istenen desen ve boyutlara sahip çoklu vasküler dokular oluşturmak için bir biyo-baskı protokolü sunmaktadır. Bir hidrojel içinde altı içi boş, perfüze edilebilir kanal oluşturmak için basitleştirilmiş bir üretim yaklaşımı oluşturuldu ve bunlar daha sonra fonksiyonel ve olgun bir endotel oluşturmak için insan göbek veni endotel hücreleri ile kaplandı. 3D biyobaskının bilgisayar kontrollü doğası, yüksek tekrarlanabilirlik sağlar ve geleneksel yöntemlere göre daha az manuel üretim adımı gerektirir. Bu, VOP'un vasküler geçirgenliği modellemek ve ilaç keşfini ilerletmek için verimli, yüksek verimli bir platform olarak potansiyelini vurgulamaktadır.
Giriş
İnsan vücudundaki vasküler ağ, kan ve çevre dokular arasındaki molekül ve hücre alışverişini dinamik olarak düzenleyerek çok önemli bir taşıma bariyeri olarak işlev görür. Bu düzenleme, doku ödemini önlemek ve seçici besin ve hücre alışverişini sağlamak, böylece doku metabolizmasını ve homeostazı desteklemek için gereklidir1. Birçok sağlık durumunda bir faktör olan değişmiş endotel geçirgenliği, hem hastalık şiddetini hem de tedavi etkinliğini etkiler2. Vasküler endotel, damarlar, dokular ve organlar arasındaki transferi kolaylaştıran seçici bir bariyer görevi görür. Bu düzenleme, çözünen maddelerin ve küçük moleküllerin temel filtrelenmesi, vasküler bariyerin kasıtlı olarak bozulması ve prostaglandinler ve büyüme faktörleri gibi moleküllerin geçirgenlik seviyeleri üzerindeki etkisi gibi çeşitli mekanizmaları içerir3.
Bu düzenlemedeki anahtar faktörler arasında endotel hücre bağlantıları, lökositlerin göçü ve kan-beyin bariyerininişlevselliği 4 yer alır. Karmaşıklığı göz önüne alındığında, süreç, çeşitli kan damarı tiplerini içeren ve farklı anatomik yollar kullanan farklı ortamlara göre değişir. Vasküler geçirgenliğin biyolojik temellerini anlamak, anormal vasküler geçirgenlik ile ilişkili durumları tedavi etmek için terapötik yaklaşımlar geliştirmek için çok önemlidir. Vasküler geçirgenliğin korunması, vasküler sistemin ve çevre dokuların sağlığı için çok önemlidir; Sonuç olarak, bu fonksiyonun bozulması, endotelin normal işlevselliğini kaybettiği bir durum olan endotel disfonksiyonuna yol açar.
Endotel disfonksiyonu, hipertansiyon, koroner arter hastalığı, diyabet ve kanser dahil olmak üzere birçok yaygın insan hastalığının öncüsüdür 5,6,7. Bu durum, azalmış vazodilatasyon, artmış damar geçirgenliği ve proinflamatuar bir duruma eğilim dahil olmak üzere çeşitli şekillerde ortaya çıkabilir. Bu patolojik durum, Amerika Birleşik Devletleri'nde önde gelen mortalite nedenleri olmaya devam eden koroner arter hastalığı, felç ve periferik arter hastalığı8 gibi birkaç kritik kardiyovasküler sorunun en erken aşamasıdır1. Endotel disfonksiyonu, kardiyovasküler sağlığın yanı sıra kan-beyin bariyerini (BBB) etkiler ve çeşitli nörolojik bozuklukların ilerlemesinde önemli bir rol oynar. Disfonksiyon, BBB geçirgenliğini artırabilir, böylece toksinlerin, patojenlerin ve bağışıklık hücrelerinin merkezi sinir sistemine sızmasına izin verir ve inme, Alzheimer hastalığı, multipl skleroz ve beyin enfeksiyonları gibi nörolojik bozukluklara katkıda bulunur9.
Diyabette endotel disfonksiyonu, endotelin vasküler tonusu düzenleme ve nitrik oksit gibi vazodilatör mediatörler üretme yeteneğinin bozulması ile işaretlenir ve bu da vazodilatasyonun bozulmasına yol açar10. Bu durum, protein kinaz C aktivasyonu ve oksidatif stres gibi hipergliseminin neden olduğu yollarla daha da kötüleşir ve diyabetik vasküler hastalığın ilerlemesine önemli ölçüde katkıda bulunur11. Ayrıca, enflamatuar bir ortamın tümör hücresinin beyin mikrovasküler endotel hücrelerine yapışmasını arttırdığı bulunurken, sızdıran bir endotelin kanser metastazında önemli bir faktör olduğu bildirilmiştir12,13. Kan damarlarının geometrisinin beyin kanseri metastazını doğrudan etkilediği bulunmuştur. Tümör hücreleri tercihen daha büyük kan damarı eğriliği olan bölgelerebağlanır 7. Bu bulgu kanser metastazında vasküler geometrinin önemini vurgulamaktadır. Daha da önemlisi, fibrozis ve kanser gibi durumlarda, bozulmuş endotel bariyer fonksiyonu sadece hastalık gelişiminde rol oynamakla kalmaz, aynı zamanda yeterli ilaç dağıtımını engelleyerek tedavi etkinliğini de engeller14. Vasküler geçirgenlik üzerine yapılan araştırmalar, kardiyovasküler hastalık tedavisini ilerletmek ve vasküler fonksiyonun bozulmasını içeren diğer hastalıkların yönetimine ilişkin içgörüler sunmak için çok önemlidir.
Vasküler geçirgenliğin sağlık ve hastalıktaki kritik rolü göz önüne alındığında, önemli araştırmalar, geleneksel 2D ve 3D in vitro test platformlarının yanı sıra hayvan modelleri kullanarak terapötik gelişim için endotel bariyerinin seçici doğasını incelemeye odaklanmıştır. Bununla birlikte, hayvan modellerinin, türe özgü farklılıklar ve etik sorunların yanı sıra yüksek maliyetler nedeniyle sınırlamaları vardır15,16. Örneğin, Pfizer, 2004 yılında, son 10 yılda, hayvan modellerinde umut verici etkiler gösteren ilaç geliştirmelerine 2 milyar doların üzerinde harcama yaptığını, ancak sonunda gelişmiş insan testi aşamalarındabaşarısız olduğunu belirtti 17. Ayrıca, geleneksel 2B modeller, üç boyutlu (3B) mimariyi ve vasküler kanalların karmaşık geometrik yapısını doğru bir şekilde taklit etmez.
Biyofabrikasyon teknolojilerindeki gelişmelerle birlikte, 3D mimariyi özetlerken vasküler kanalların üretilmesi için kapsamlı çabalar sarf edilmiştir. Mikro ölçekli vasküler kanallar, yumuşak litografi kullanılarak mikroakışkan çipler içinde etkili bir şekilde üretilebilir, böylece gerçek zamanlı analiz avantajı sunar18,19. İstenilen çapa20,21 sahip bağımsız boru şeklinde yapılar oluşturmak için hidrojel döküm veya hücre tabakalarının bir kalıp veya mandrel etrafına sarılması gibi alternatif yöntemler kullanılabilir. Ancak bu yöntemlerin sınırlamaları vardır; Örneğin, mikroakışkan çipler, mikrokanal konfigürasyonlarıyla sınırlıdır ve bir kalıbın etrafındaki hidrojel dökümü, birden fazla geometriyi etkili bir şekilde kopyalamaz.
3D biyo-baskı teknolojisinin22 ortaya çıkmasıyla birlikte, çeşitli hücre dışı matris (ECM) bazlı hidrojel malzemeleri hassas bir şekilde biriktirerek karmaşık geometrileri çoğaltmak mümkün hale geldi23,24. Koaksiyel ve üç eksenli25,26 gibi eşmerkezli olarak düzenlenmiş nozullar kullananlar gibi bazı biyo-baskı yöntemleri, çatallı tüpler oluşturamaz; Bununla birlikte, kurban desenleme yöntemleri ile karmaşık yapılar elde edilebilir27. Bu biyo-baskı yöntemlerinin hiçbirinin, ilaç keşfinde farmakolojik araştırmalar için çok önemli bir gereklilik olan yüksek verimli in vitro modellemeyi mümkün kıldığı gösterilmemiştir. Burada, boyutlar üzerinde etkin kontrol ile endotelyalize vasküler kanalların verimli bir şekilde üretilmesi için bir yöntem sunuyoruz.
Ticari olarak temin edilebilen altı oyuklu plakaları, bir biyoyazıcının bir ECM hidrojeli içinde istenen boyut ve desenlerde vasküler kanallar ürettiği kurban modelleme yöntemiyle birleştirerek basit bir yaklaşım oluşturduk. İnsan göbek damarı endotel hücreleri (HUVEC'ler), bu kanalları endotelyalize etmek ve bir geçirgenlik testi ile endotelin işlevselliğini değerlendirmek için tohumlandı. Bu tasarım, kanalın her iki tarafında medya rezervuarları oluşturarak pompasız perfüzyonu mümkün kılar ve dinamik kültürü taklit etmek için yaygın olarak kullanılan bir 2D rocker yardımıyla yerçekimi güdümlü akışı kullanır. Bu yaklaşım, peristaltik pompalara olan ihtiyacı ortadan kaldırır ve yüksek verimli uygulamalar için bu platformun ölçeklenebilirliğini kolaylaştırır. 3D biyo-baskı teknolojisinin bilgisayar kontrollü doğası, üretim sürecini de kolaylaştırarak üretim sırasında hata olasılığını azaltır. VOP modeli, ilaç keşfinde farmakolojik testler için değerli bir araç olarak umut vaat etmektedir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Biyoyazıcı için G kodunun oluşturulması
- Yazdırma yolunu oluşturmak ve görselleştirmek için çevrimiçi bir G kodu simülasyon aracını (ör. NCviewer) ziyaret edin.
- Tıkla Yeni dosya Yeni bir G kodu dosyası oluşturmak için arayüzdeki simge.
- Kurban kanalı ve silikon odası için G kodu komutlarını manuel olarak yazarak bir yazdırma yolu oluşturun. Geometriyi oluşturmak için referans olarak standart altı kuyulu bir plakanın boyutlarını kullanın.
NOT: Burada kullanılan G kodu, Bilgisayarlı Sayısal Kontrol (CNC) kodunu temel alır. Her komutun işlevleri Ek Tablo S1'de verilmiştir. Altı kuyulu plaka formatı, ticari mikroplaka okuyucular ve mikroskopi kurulumları ile uyumluluğu ve endotel olgunlaşmasını desteklemek için yeterli hacimde ortamı barındırması ve böylece sık sık ortam değişikliği ihtiyacını en aza indirmesi nedeniyle seçilmiştir. Bu üretim protokolü, diğer standart kuyu plakaları ile kullanım için de uyarlanabilir. - G kodu tamamlandıktan sonra, .nc uzantılı dosyayı indirmek için arayüzdeki Dosyayı Kaydet simgesine tıklayın.
NOT: Yazdırma yollarını oluşturmak için mevcut başka herhangi bir G kodu oluşturma algoritması kullanılabilir. Vasküler kanalın geometrisi bu G kodunda manipüle edilebilir.
2. Kurban ve silikon hazne mürekkeplerinin hazırlanması
NOT: Bu protokolde kullanılan tüm materyaller için kaynaklar Malzeme Tablosunda listelenmiştir.
- SE1700 ve polidimetilsiloksan (PDMS) olmak üzere iki tür silikon polimerini 10:2 oranında birleştirin. Her polimerin sertleştirici maddesini 10:1 oranında, polimeri sertleştirici maddeye ekleyin.
- Polimer karışımını 2.000 rpm'de iyice karıştırmak ve gazını almak için bir planet karıştırıcı kullanın.
- Bir spatula ile karışık silikon polimeri 10 mL'lik tek kullanımlık bir şırıngaya aktarın. Düzgün bir tutarlılık sağlamak ve baskı sırasında kabarcıkları önlemek için yüklü şırıngayı 400 × g'da 5 °C'de 3 dakika santrifüjleyin.
NOT: Hazne mürekkebi, optimum baskı kalitesini sağlamak için kürleme maddelerinin eklenmesinden sonraki 2 saat içinde kullanılmalıdır. Baskıya hazırlanırken şırıngayı 5 °C'de saklayın. Bu işlem, mürekkebin yavaş kürlenmesine yardımcı olur, aksi takdirde baskı parametrelerini değiştirebilir. - Damıtılmış suda %40 (a/h) PF127 stok çözeltisi hazırlamak için Pluronic F-127'yi (PF127) tartın.
- Homojenlik elde etmek için PF127 çözeltisini planet mikserde 400 × g'da 3 dakika karıştırın. PF127'nin tamamen çözünmesi için homojenize karışımı 4 °C'de tutun.
- Dulbecco'nun fosfat tamponlu salininde (DPBS) 1.000 birim / mL'lik bir trombin stok çözeltisi hazırlayın.
NOT: Tekrarlanan donma-çözülme döngülerini önlemek için trombin stok solüsyonunu 100 μL'lik alikotlarda saklayın. Alikotlar -20 ° C'de 6 aydan fazla saklanmamalıdır. - Yazdırmadan önce, trombini PF127 ile 1:10 seyreltmede PF127 için %36 (a/h) ve trombin için 100 birim/mL'lik bir nihai çalışma konsantrasyonuna karıştırarak kurban mürekkebi hazırlayın. 1 mL kurban mürekkebi hazırlamak için, 100 μL trombin stok çözeltisini 900 μL PF127 stok çözeltisi ile karıştırın.
NOT: Kurban mürekkebini tek bir klişe basmak için hazırlarken, toplam 1 mL'lik bir hacim fazlasıyla yeterlidir.
3. İmalat süreci
- Üretim işlemine başlamadan önce, altı oyuklu bir plakayı 1 dakika boyunca 100 watt gücünde oksijen (O2) plazması ile işlemden geçirin.
- Hem kurban hem de silikon mürekkepleri hazırlamak için bölüm 2'de özetlenen prosedürü izleyin, mürekkeplerin kabarcık içermediğinden ve tutarlı baskı için homojen bir şekilde karıştırıldığından emin olun. Mürekkepleri biyoyazıcının yazıcı kafasına dikkatlice yerleştirin. Biyoyazıcının kafasının sıcaklığını kurban mürekkebi için 37 °C'ye ve silikon mürekkep için 5 °C'ye ayarlayın.
- Silikon şırıngaya 22 G çift vidalı dişli konik bir nozul takın. Kurban mürekkebi için, istenen kanal çapına göre nozul boyutunu seçin.
NOT: Burada, üç boyutta nozul gösterdik: 18 G, 20 G ve 22 G. Baskı basıncı ve yazıcı kafası hızı dahil olmak üzere optimum baskı parametreleri Tablo 1'de özetlenmiştir. - İstenen G kodunu yükleyin ve biyoyazıcının yazılım arayüzündeki servo hazır fonksiyonuna 3 saniye boyunca basın. Kalıbı G kodunun başlangıç noktasındaki sahneye yerleştirin ve yazdırma işlemini başlatmak için başlat'a tıklayın.
NOT: Tipik olarak, altı hazne içeren bir plakanın imalatı yaklaşık 1 saat ve 10 dakika gerektirir. G kodunun yüklenmesini ve yürütülmesini içeren Adım 3.4, kullanılan spesifik biyoyazıcıya bağlı olarak değişebilir. Kontaminasyonu önlemek için biyoyazıcıyı kullanırken steril koşulların korunduğundan emin olun. - Plakanın üzerine bir kapak yerleştirin ve silikon odalarını sertleştirmek için plakayı 72 saat boyunca 37 ° C'de nemlendirilmiş bir CO2 inkübatöre aktarın.
NOT: Silikon kürleme inkübatörün içinde daha yavaş bir hızda gerçekleşebilse de, plaka kuru bir fırının içine yerleştirilmemelidir.
4. Hidrojel hazırlama ve kanal gömme
- 20 mL 1x PBS içeren 50 mL'lik bir konik tüp hazırlayın. % 0.05 (a / h) LAP çözeltisi yapmak için 0.01 g lityum fenil-2,4,6-trimetilbenzoilfosfinat (LAP) konik tüpe yerleştirin. Toz tamamen eriyene kadar girdaplayın.
NOT: Işığa maruz kalmayı önlemek için konik boruyu folyoya sarın. LAP stok çözeltisini 4 °C'de saklayın. - %15 GelMA ve %1 fibrinojen (GelFib olarak adlandırılır) nihai konsantrasyonunu elde etmek için 20 mL LAP çözeltisine 3 g jelatin metakrilat (GelMA) ve 0.2 g fibrinojen ekleyin. Karışımı 37 ° C'lik bir su banyosuna koyun ve çözelti tamamen eriyene kadar periyodik olarak karıştırın.
- Bölüm 3'te belirtildiği gibi imalattan sonra, kurban desenini gömmek için her bir hidrojel odasına 300 μL önceden ısıtılmış GelFib ekleyin. GelMA'yı 120 s boyunca 85 mW/cm2 yoğunlukta 405 nm dalga boyunda ultraviyole (UV) ışıkla hızla çapraz bağlayın. Bu işlemi diğer tüm kuyucuklar için tekrarlayın.
NOT: Fibrinojen, trombin içeren kurban paterni ile temas ettiğinde hızla çapraz bağlanır. GelMA'nın oda sıcaklığında istenmeyen jelleşmesini önlemek için hidrojel eklemenizi ve her kuyucuk için ayrı ayrı UV çapraz bağlama yapmanızı öneririz. Ek olarak, UV kürleme işlemi sırasında kontaminasyonu önlemek için steril koşullar korunmalıdır. - Her oyukta vasküler kanalın her iki tarafına 1 mL DPBS ekleyin ve PF127'yi sıvılaştırmak için plakayı 15 dakika boyunca 4 ° C'de tutun.
- 15 dakika sonra DPBS'yi emdirin ve PF4.5'nin tamamen yıkanması için adım 3 127x'i tekrarlayın.
- Hücreleri kanallara sokmadan önce, hücre bağlanmasını arttırmak için kanallardan 30 dakika boyunca %1 Matrigel içeren DMEM F12'yi perfüze edin.
5. HUVEC kültürü
- Endotel hücre büyüme ortamını (EKGM) 37 ° C'lik bir su banyosunda 30 dakika önceden ısıtın.
- Bu arada, nitrojen tankından bir şişe dondurularak saklanmış HUVEC alın, şişenin kapağını nazikçe gevşetin ve ardından dişlerden nitrojeni serbest bırakmak için yeniden sıkın. Şişeyi 37 ° C'lik bir su banyosunda 2 dakika bekleterek hücreleri hemen çözün ve şişenin içinde az miktarda buz kalmasını sağlayın. Kontaminasyonu önlemek için şişeyi% 70 etanol ile durulayın.
NOT: Nitrojen tankından hücreleri alırken koruyucu gözlük takın. Bu işlem sırasında şişenin kapağı su seviyesinin üzerinde tutulmalıdır. - 5 mL önceden ısıtılmış EKGM içeren 15 mL'lik bir konik tüp hazırlayın. Bir mikropipet ile, çözülmüş hücreleri flakondan konik tüpe dikkatlice aktarın. Geride hiçbir hücre kalmadığından emin olmak için, kriyoviyal için 1 mL taze önceden ısıtılmış ortam ekleyin, içini durulayın ve kalan hücreleri konik tüpe aktarın.
- Bir hücre peleti elde etmek için konik tüpü 200 × g'da 3 dakika santrifüjleyin. Süpernatanı atın, hücreleri 10 mL taze ortamda yeniden süspanse edin, hücreleri bir T75 şişesine aktarın ve şişeyi 37 °C nemlendirilmiş bir CO2 inkübatörüne yerleştirin.
NOT: Bu adım, kriyoviyaldeki dondurma ortamında bulunan dimetil sülfoksitin santrifüjleme yoluyla uzaklaştırılması için önemlidir. - Hücreler% 80-90 birleşmeye ulaşana kadar ortamı her gün yenileyin.
6. Kanalların endotelizasyonu
- EKGM, DPBS, tripsin nötralize edici solüsyon ve tripsin etilendiamintetraasetik asidi (TE) 37 ° C'lik bir su banyosunda 30 dakika önceden ısıtın.
- % 90 birleşmede, hücreleri 10 mL DPBS ile bir T75 şişesinde durulayın, şişeye 1 mL %0.25 TE ekleyin ve 3 dakika inkübe edin.
- Şişenin kenarlarına hafifçe vurun ve TE'yi nötralize etmek için 5 mL tripsin nötralize edici çözelti ekleyin. Hücreleri 15 mL'lik konik bir tüpe aktarın. Kalan hücreleri toplamak ve bunları konik tüpe eklemek için 5 mL taze EKGM kullanın.
- Hücre peletini toplamak için konik tüpü 250 × g'da 3 dakika santrifüjleyin.
- Süpernatanı atın ve hücre peletini 1 mL taze EKGM'de yeniden süspanse edin. Hücreleri bir hemositometre ile sayın ve bir hücre peleti elde etmek için Adım 6.4'ü tekrarlayın. 90 μL taze EKGM'de 3 milyon hücreyi yeniden süspanse edin.
- Hücre süspansiyonunu kanala sokmadan önce, lümeni temizlemek için kanalı kısa bir süre vakumla emin.
NOT: Bütünlüğüne zarar vermemek için kanalın uzun süre emilmesinden kaçının. - Kanalı, kuyu başına 0,5 milyon hücre tohumlama yoğunluğunda bir hücre süspansiyonu ile yavaşça yükleyin. Kanalı doldurmak için bu süspansiyondan ~ 15 μL eklemek için bir mikropipet kullanın.
NOT: Tohumlama yoğunluğu kanalın büyüklüğüne göre değişiklik gösterebilir. Bu yoğunluk, 20 G nozul ve yaklaşık 900 μm iç çap ile basılmış bir kanal için optimize edilmiştir. - Plakayı 2 saat boyunca inkübatörün içine düz bir şekilde yerleştirin. Ardından, plakayı 180°'ye ters çevirin ve sonraki 2 saat boyunca düz bir konumda tutun.
- 4 saat sonra, yapışmayan ve ölü hücreleri çıkarmak için kanalı DPBS ile yıkayın. Her oyuğa 2 mL taze EKGM ekleyin (kanalın her iki tarafına 1 mL). Plakayı, kanallar sallanma yönüne paralel olacak şekilde külbütör üzerine yerleştirerek 10° eğim açısında ve 5 rpm'de bir külbütör üzerinde dinamik kültürü başlatın. Büyüme ortamını her gün yenileyin.
NOT: Dinamik kültür, rezervuarlar ve kanallar arasındaki ortam alışverişini artırır ve hücrelerin gece boyunca çoğalmasına yardımcı olur.
7. Endotel olgunlaşma değerlendirmesi
- EKGM ve DPBS'yi 37 °C su banyosunda 30 dakika ve Hücre Sayma Kiti-8 (CCK8) reaktifini oda sıcaklığında önceden ısıtın.
- Her kuyucuk için 100 μL CCK8 reaktifini 1 mL taze EKGM ile karıştırarak çalışan bir CCK8 çözeltisi yapın. Bir plaka / 6 kanalı için çalışırken, 6 μL CCK8 reaktifini 6 mL taze EKGM ile birleştirerek hazırlayın.
- Büyüme ortamını emerek çıkarın ve kanalları DPBS ile durulayın. Her oyuğa 1 mL CCK8 çalışma solüsyonu ekleyin ve plakanın inkübatörün içinde 30 dakika boyunca düz kalmasına izin verin. Daha sonra, dinamik kültürü adım 6.9'da açıklandığı gibi bir rocker'da başlatın ve bu işleme sonraki 3 saat boyunca devam edin.
- 3 saat sonra, plakayı bir tarafa eğerek içeriği her bir kuyucuktan çıkarın ve bunları yeni bir altı kuyulu plakaya aktarın. Kanalları DPBS ile durulayın ve taze ortam ekleyin.
NOT: Absorbans ölçümüne kadar plakayı alüminyum folyo ile örtün. Tek tip okumalar sağlamak için tüm kuyucuklarda tutarlı bir reaktif hacmini koruyun. Pipetleme sırasında, optik yoğunluk okumalarının doğruluğunu bozabilecek hava kabarcıkları oluşturmaktan dikkatli bir şekilde kaçının. - Renklerin eşit şekilde karışmasını sağlamak için plakayı 15 saniye boyunca hafifçe salladıktan sonra, 450 nm'de emiciliği ölçmek için bir mikroplaka okuyucu kullanın.
- Bu prosedürü önceden tanımlanmış zaman aralıklarında tekrarlayın. Her zaman noktası için ortalama optik yoğunluğu hesaplayın ve grafik yazılımında bir büyüme eğrisi çizin. Bu eğri, endotelin zaman içinde nispi olgunlaşmasını gösterir.
8. Geçirgenlik deneyi
- Ortamı ilgilendiğiniz bir kuyudan çıkarın.
NOT: Geçirgenlik testi için, vasküler geçirgenliklerini değiştirebilecek diğer kanalların kurumasını önlemek için her bir kuyucuğun ayrı ayrı işlenmesi önerilir. - 70 kDa FITC dekstranı DPBS'de çözerek 6 mL 0.1 mg / mL FITC konjuge dekstran çözeltisi hazırlayın.
NOT: 100 mg FITC dekstranı 5 mL DPBS içinde çözerek 20 mg / mL'lik bir FITC dekstran stok çözeltisi hazırlayın. Çözeltiyi nazikçe girdapladıktan sonra, tekrarlanan donma-çözülme döngülerini önlemek için 500 μL'yi 1.5 mL'lik tüplere alikotlayın. Bu alikotlar -20 °C'de en fazla 6 ay saklanabilir. Tahlili gerçekleştirmeden önce, stok çözeltisini 0.1 mg / mL'lik bir çalışma konsantrasyonuna seyreltin. - Plakayı mikroskop tablasına sıkıca yerleştirin ve görüş alanı içinde yakınlarda bulunan jel ile birlikte ilgili bölgedeki kanal duvarının net bir şekilde görünmesini sağlamak için objektifin büyütmesini faz kontrast modunda ayarlayın.
NOT: Etkili geçirgenlik değerlendirmesi için, görüş alanındaki ilgili bölgeyi çevreleyen jel alanını en üst düzeye çıkarmaya çalışın; Bu husus, dekstran taşımacılığının doğru bir şekilde izlenmesinin anahtarıdır. - İstenilen alana odaklandıktan sonra, faz kontrastından floresan moduna geçin. Görüntü alma sekmesi altında, geniş alan kanalına FITC ekleyin ve arka plan floresan yoğunluğunu hesaplamak için dekstran çözeltisi eklemeden önce bir görüntü elde edin. Daha sonra, kanalın bir tarafına 1 mL FITC dekstran çalışma çözeltisi ekleyin ve çözeltinin hidrostatik basınç farkı tarafından yönlendirilen kuyunun diğer tarafına doğru akmasına izin verin.
- Görüntüleri önceden belirlenmiş zaman aralıklarında elde edin - yüksek geçirgenliğe sahip kanallar için daha sık ve daha düşük geçirgenliğe sahip olanlar için daha az sıklıkta.
9. ImageJ'de floresan yoğunluğu ölçümü
- ImageJ görüntü analiz yazılımında, aşağıda belirtildiği gibi ilk zaman noktasındaki yoğunluğu (It1), daha sonraki zaman noktasında gözlemlenen ortalama yoğunluğu (It2) ve arka plan gürültüsünden kaynaklanan yoğunluğu (Ib) ölçün. Geçirgenlik katsayısını (Pd) hesaplamak için denklemi (1) kullanın. T1 ve T2, görüntü alımının ilk ve sonraki zaman noktalarını ifade eder.
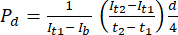 (1)
(1)- ImageJ'yi başlatın ve ilk zaman noktasında alınan görüntüyü açın.
- ImageJ'de ölçeği ayarlayın. Analize gidin | Ölçeği ayarlayın. Bilinen ölçeği ve ölçü birimini girin.
- Dikdörtgen aracını seçin ve floresan yoğunluğu ölçümünün gerekli olduğu jel alanı üzerine bir dikdörtgen çizin.
- Analize gidin | Ölçümler'i ayarlayın ve Ortalama gri değerinin işaretli olduğundan emin olun.
NOT: Bu seçenek, seçilen alandaki ortalama yoğunluğu ölçer. Verilen analiz için gerektiği gibi diğer parametreler de seçilebilir. - Alan seçili durumdayken Analiz | Ölçün veya sadece M'ye basın. Ortalama floresan yoğunluğunu ve seçilen diğer parametreleri gösteren bir sonuç penceresinin açılmasını bekleyin.
- Üç ölçüm yapın ve bir elektronik tablodaki ortalama floresan yoğunluğu değerini hesaplayın.
- Arka plan floresansını belirlemek için, sonraki zaman noktası t2'de yakalanan görüntüler ve daha sonraki zaman noktasında floresan yoğunluğunun hesaplanması için dekstran çözeltisinin eklenmesinden önce çekilen görüntüler için bu prosedürü tekrarlayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Boyut ve desen esnekliğine sahip VOP platformu, çok kafalı bir biyo-baskı sistemi ile üretildi. Hem içi boş hem de perfüzyon yapabilen kanallar, endotelizasyonu kolaylaştırmak için HUVEC'lerle tohumlandı ve daha sonra bir geçirgenlik testi ile değerlendirildi (Şekil 1A). Bu yöntemin çok ölçekli üretim kapasitesini göstermek için üç farklı konfigürasyon yazdırdık: düz, çatallı ve kıvrımlı (Şekil 1B
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
3D biyo-baskı teknolojisinin hassasiyeti, otomasyonu ve bilgisayar kontrollü doğasından yararlanarak, ticari mikroplaka okuyucuları ve mikroskop görüntüleme kurulumları ile uyumlulukları nedeniyle seçilen standart altı oyuklu plakalarda vasküler kanallar üretmek için aerodinamik bir yöntem oluşturduk. Plakanın tasarımı, gerekli medya değiştirme sıklığını azaltırken daha büyük kanalların büyümesi için çok boyutlu kanalları ve yeterli miktarda medyayı b...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar rekabet eden hiçbir mali çıkar beyan etmemektedir.
Teşekkürler
Bu çalışma, Kore hükümeti (Bilim ve BİT Bakanlığı, MSIT) tarafından finanse edilen Kore Ulusal Araştırma Vakfı (NRF) hibeleri tarafından desteklenmiştir. NRF-2019R1C1C1009606; Hayır. 2020R1A5A8018367; ve Hayır. RS-2024-00423107]. Bu araştırma, MSIT tarafından finanse edilen NRF hibelerinin Biyo ve Tıbbi Teknoloji Geliştirme Programı tarafından desteklenmiştir [No. NRF-2022M3A9E4017151 ve No. NRF-2022M3A9E4082654]. Bu çalışma, Ticaret, Sanayi ve Enerji Bakanlığı (MOTIE, Kore) tarafından finanse edilen Teknoloji İnovasyon Programı [No. 20015148] ve Simyacı Projesi [No. 20012378] tarafından desteklenmiştir. Bu çalışma aynı zamanda Kore Gıda, Tarım ve Ormancılıkta Teknoloji Planlama ve Değerlendirme Enstitüsü (IPET) tarafından, Tarım, Gıda ve Köy İşleri Bakanlığı (MAFRA) tarafından finanse edilen Araştırma İnsan Gücü Geliştirme için Tarım ve Gıda Yakınsama Teknolojileri Programı aracılığıyla desteklenmiştir. RS-2024-00397026].
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 mL Serological Pipette | SPL | SPL 91010 | |
| 10 mL syringe | Shinchang Medical | ||
| 15 mL conical tube | SPL | 50015 | |
| 3D Bioprinter | T&R Biofab | 3DX-Printer | |
| 6-well plate | SPL | 37206 | |
| Biological Safety Cabinets | CHC LAB | PCHC-777A2-04, | |
| Brightfield Inverted Microscopes | Leica | DMi1 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Counting Kit (CCK8) | GlpBio | GK10001 | |
| Cell Culture Flask 75T | SPL | 70075 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354230 | |
| Distilled water | |||
| DMEM/F12 | Gibco | 11320033 | |
| DMSO, Cell Culture Grade | Sigma aldrich | D2438 | |
| Dow-Corning, PDMS-Sylgard 184a Kit | DOW | DC-184 | |
| DOWSIL SE 1700 Clear W/C 1.1 KG Kit | DOW | 2924404 | |
| D-PBS - 1x | Welgene | LB001-01 | |
| Endothelial Cell Growth Medium MV 2 (Ready to use) | Promocell | C-22022 | |
| Eppendorf Micro pipette(1000,200,100,20,10) | eppendorf | ||
| Ethyl Alcohol 99.9% | Duksan | D5 | |
| Excel | Microsoft | ||
| Fibrinogen from bovine plasma | Sigma Aldrich | F8630-1G | |
| FITC Dextran 70 kDa | Sigma Aldrich | 46945-100MG-F | |
| Fluorescent beads (1.0 μm, green) | Sigma Aldrich | L1030-1ML | |
| GelMA-powder (Gelatin methacrylate) 50 g | 3D Materials | 20JT29 | |
| Gibco, Recovery Cell Culture Freezing Medium, 50 mL | Gibco | ||
| HUVECs (Human Umbillical Vein Endothelial Cells) | Promocell | ||
| ImageJ software | NIH | ||
| Incubator | Thermo SCIENTIFIC | Forma STERI-CYCLE i160 CO2 Incubator | |
| Invitrogen, Live/dead viability/cytotoxicity Kit (for mammalian cells) | Thermo Fisher | L3224 | |
| Lithium Phenyl (2,4,6-trimethylbenzoyl) phosphate powder | Tokoyo Chemical Industry CO. | 85073-19-4 | |
| Marienfeld Superior, Counting chamber cover | Marienfeld Superior | ||
| Marienfeld Superior, Hemocytometer, cell counting chamber | Marienfeld Superior | HSU-0650030 | |
| Microcentrifuge | eppendorf | Centrifuge 5920 R | |
| NCViewer.com | |||
| Nitrogen tank | WORTHINGTON INDUSTRIES | LS750 | |
| Omnicure UV Laser | EXCELITAS | SERIES 1500 | |
| Parafilm M | amcor | PM-996 | |
| Penicillin-Streptomycin Solution (100x) | GenDEPOT | CA005-010 | |
| Planetary Mixer | THINKY CORPORATION, japan | ARE-310 | |
| Plasma treatment machine | FEMTO SCIENCE | CUTE-1MPR | |
| Pluronic F-127 | Sigma aldrich | P2443-250G | |
| Pre-made buffer, (P2007-1) 10x PBS | Biosesang | PR4007-100-00 | |
| Reagent storage cabinet | ZIO FILTER TECH | SC2-30F-1306D1-BC | |
| Real time Live cell Imaging Microscope | Carl ZEISS | ||
| Refrigerator | SAMSUNG | RT50K6035SL | |
| ROCKER 2D digital | IKA | 4003000 | |
| Scoop-Spatula | CacheBy | SL-SCO7001-EA | |
| sigma,Trypsin-EDTA solition, 0.25% | Sigma aldrich | T4049-100ML | |
| Sodium Dodecyl Sulfate (SDS) | Thermo Fisher scientific | 151-21-3 | |
| Syringe Barrel Tip Cap | FISNAR | 3051806 | |
| Tally counter | Control Company | C23-147-050 | |
| Tapered Nozzle (18 G) | Mushashi | TPND-18G-U | |
| Tapered Nozzle (22 G) | Mushashi | TPND-22G-U | |
| Tapered nozzle 20 G | Musashi | TPND-20G-U | |
| Thrombin from bovine plasma | Sigma Aldrich | T7326-1KU | |
| Timer, 4-channel | ETL | SL.Tim3005 | |
| Trypan Blue Solution 0.4% | Gibco | 15250061 | |
| Trypsin Neutralizing Solution | Promocell | C-41120 | |
| UG 24 mL UG ointment jar | Yamayu | No. 3-53 | |
| UG 58 mL UG ointment jar | Yamayu | No. 3-55 | |
| Water Bath | DAIHAN Scientific | WB-11 | |
| Weight machine | Sartorius | bce2241-1skr |
Referanslar
- O'Connor, C., Brady, E., Zheng, Y., Moore, E., Stevens, K. R. Engineering the multiscale complexity of vascular networks. Nat Rev Mater. 7 (9), 702-716 (2022).
- Claesson-Welsh, L., Dejana, E., McDonald, D. M. Permeability of the Endothelial Barrier: Identifying and Reconciling Controversies. Trends Mol Med. 27 (4), 314-331 (2021).
- Claesson-Welsh, L. Vascular permeability-the essentials. Ups J Med Sci. 120 (3), (2015).
- Wautier, J. -L., Wautier, M. -P. Vascular Permeability in Diseases. Int. J. Mol. Sci. 23 (7), (2022).
- Higashi, Y., Kihara, Y., Noma, K. Endothelial dysfunction and hypertension in aging. Hypertens Res. 35 (11), (2012).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: current concepts and clinical implications. Front Med (Lausanne). 8, 798958(2022).
- Park, W., Lee, J. -S., Gao, G., Kim, B. S., Cho, D. -W. 3D bioprinted multilayered cerebrovascular conduits to study cancer extravasation mechanism related with vascular geometry. Nat Commun. 14 (1), 7696(2023).
- Sun, H. -J., Wu, Z. -Y., Nie, X. -W., Bian, J. -S. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front Pharmacol. 10, 1568(2020).
- Yuan, Y., Sun, J., Dong, Q., Cui, M. Blood-brain barrier endothelial cells in neurodegenerative diseases: Signals from the "barrier.". Front Neurosci. 17, 1047778(2023).
- Hadi, H. A., Suwaidi, J. A. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag. 3 (6), 853-876 (2007).
- De Vriese, A. S., Verbeuren, T. J., Van de Voorde, J., Lameire, N. H., Vanhoutte, P. M. Endothelial dysfunction in diabetes. Br J Pharmacol. 130 (5), 963-974 (2000).
- Wang, K., et al. Inflammatory environment promotes the adhesion of tumor cells to brain microvascular endothelial cells. Front Oncol. 11, 691771(2021).
- Tiwary, S., et al. Metastatic brain tumors disrupt the blood-brain barrier and alter lipid metabolism by inhibiting expression of the endothelial cell fatty acid transporter Mfsd2a. Sci Rep. 8 (1), 8267(2018).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annu Rev Chem Biomol Eng. 2 (1), 281-298 (2011).
- Van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: Is it time to rethink our current approach. JACC Basic Transl Sci. 4 (7), 845-854 (2019).
- Morgan, S. J., et al. Use of animal models of human disease for nonclinical safety assessment of novel pharmaceuticals. Toxicol Pathol. 41 (3), 508-518 (2013).
- Rotman, D. Can Pfizer deliver. MIT Technology Review. , Available from: https://www.technologyreview.com/2004/02/01/233321/can-pfizer-deliver/ (2004).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Xu, Z., et al. Design and construction of a multi-organ microfluidic chip mimicking the in vivo microenvironment of lung cancer metastasis. ACS Appl Mater Interfaces. 8 (39), 25840-25847 (2016).
- Strobel, H. A., et al. Assembly of tissue-engineered blood vessels with spatially controlled heterogeneities. Tissue Eng Part A. 24 (19-20), 1492-1503 (2018).
- Atchison, L., Zhang, H., Cao, K., Truskey, G. A. A Tissue engineered blood vessel model of Hutchinson-Gilford Progeria Syndrome using human iPSC-derived smooth muscle sells. Sci Rep. 7 (1), 8168(2017).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Gold, K. A., et al. 3D bioprinted multicellular vascular models. Adv Healthc Mater. 10 (21), 2101141(2021).
- Tabriz, A. G., Hermida, M. A., Leslie, N. R., Shu, W. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. 7 (4), 045012(2015).
- Gao, G., et al. Tissue engineered bio-blood-vessels constructed using a tissue-specific bioink and 3D coaxial cell printing technique: a novel therapy for ischemic disease. Adv. Funct. Mater. 27 (33), 1700798(2017).
- Cho, W. -W., Ahn, M., Kim, B. S., Cho, D. -W. Blood-lymphatic integrated system with heterogeneous melanoma spheroids via in-bath three-dimensional bioprinting for modelling of combinational targeted therapy. Adv Sci (Weinh). 9 (29), 2202093(2022).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Polacheck, W. J., Kutys, M. L., Tefft, J. B., Chen, C. S. Microfabricated blood vessels for modeling the vascular transport barrier. Nat Protoc. 14 (5), 1425-1454 (2019).
- Li, H., et al. Expanding sacrificially printed microfluidic channel-embedded paper devices for construction of volumetric tissue models in vitro. Biofabrication. 12 (4), 045027(2020).
- Gao, G., Park, J. Y., Kim, B. S., Jang, J., Cho, D. Coaxial cell printing of freestanding, perfusable, and functional in vitro vascular models for recapitulation of native vascular endothelium pathophysiology. Adv Healthc Mater. 7 (23), 1801102(2018).
- Farasatkia, A., Kharaziha, M., Ashrafizadeh, F., Salehi, S. Transparent silk/gelatin methacrylate (GelMA) fibrillar film for corneal regeneration. Mater Sci Eng C Mater Biol Appl. 120, 111744(2021).
- Duong, V. T., et al. Double-layered blood vessels over 3 mm in diameter extruded by the inverse-gravity technique. Biofabrication. 15 (4), 045022(2023).
- Luo, L., et al. Application of bioactive hydrogels combined with dental pulp stem cells for the repair of large gap peripheral nerve injuries. Bioact Mater. 6 (3), 638-654 (2021).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863(2019).
- Wang, Y., et al. Development of a photo-crosslinking, biodegradable GelMA/PEGDA hydrogel for guided bone regeneration materials. Materials. 11 (8), 1345(2018).
- Han, Y., et al. Biomimetic injectable hydrogel microspheres with enhanced lubrication and controllable drug release for the treatment of osteoarthritis. Bioact Mater. 6 (10), 3596-3607 (2021).
- Bupphathong, S., et al. Gelatin methacrylate hydrogel for tissue engineering applications-a review on material modifications. Pharmaceuticals. 15 (2), 171(2022).
- Wu, Z., et al. Microfluidic printing of tunable hollow microfibers for vascular tissue engineering. Adv Mater Technol. 6 (8), 2000683(2021).
- Medina-Leyte, D. J., Domínguez-Pérez, M., Mercado, I., Villarreal-Molina, M. T., Jacobo-Albavera, L. Use of human umbilical vein endothelial cells (HUVEC) as a model to study cardiovascular disease: a review. Appl. Sci. 10 (3), 938(2020).
- Khattak, S. F., Bhatia, S. R., Roberts, S. C. Pluronic F127 as a cell encapsulation material: utilization of membrane-stabilizing agents. Tissue Eng. 11 (5-6), 974-983 (2005).
- Jia, W., et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 106, 58-68 (2016).
- Kim, S. -J., et al. Bioprinting methods for fabricating in vitro tubular blood vessel models. Cyborg Bionic Syst. 4, 0043(2023).
- Maji, S., Lee, M., Lee, J., Lee, J., Lee, H. Development of lumen-based perfusable 3D liver in vitro model using single-step bioprinting with composite bioinks. Mater Today Bio. 21, 100723(2023).
- Pauty, J., et al. A vascular permeability assay using an in vitro human microvessel model mimicking the inflammatory condition. Nanotheranostics. 1 (1), 103-113 (2017).
- van Duinen, V., et al. 96 perfusable blood vessels to study vascular permeability in vitro. Sci Rep. 7 (1), 18071(2017).
- Pink, D. B. S., Schulte, W., Parseghian, M. H., Zijlstra, A., Lewis, J. D. Real-time visualization and quantitation of vascular permeability in vivo: implications for drug delivery. PLoS ONE. 7 (3), e33760(2012).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. AAdv Healthc Mater. 12 (18), 2300151(2023).
- Zhang, F., Lin, D. S. Y., Rajasekar, S., Sotra, A., Zhang, B. Pump-less platform enables long-term recirculating perfusion of 3D printed tubular tissues. Adv Healthc Mater. 12 (27), 2300423(2023).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır