A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج الحمض النووي والمقارنة بين عينات الذباب الميت القديمة والطازجة
* These authors contributed equally
In This Article
Erratum Notice
Summary
توضح هذه المقالة بروتوكولا لاستخراج الحمض النووي للذبابة الميتة حديثا وقديما باستخدام مجموعة استخراج الحمض النووي الشائعة المعدلة.
Abstract
تم اختيار ما مجموعه خمس عينات من عينات Chrysomya megacephala - ثلاث عينات جديدة ، وعينة واحدة مخزنة في الكحول لمدة 2 سنوات ، وعينة واحدة مخزنة في تخزين جاف مختوم لمدة 2 سنوات محمية من الضوء فقط - للتحقيق فيما إذا كانت مجموعة استخراج الحمض النووي في الدم يمكن أن تستخرج الحمض النووي من الذباب الميت ولتحديد ما إذا كان الكحول يمكن أن يطيل الحفاظ على الحمض النووي للذباب الميت. أولا ، تم استخدام مجموعة استخراج الحمض النووي في الدم لاستخراج الحمض النووي من أنسجة الصدر. بعد ذلك ، تم فحص نقاء الحمض النووي وتركيزه باستخدام قارئ الصفائح الدقيقة ومقياس الفلور. أخيرا ، تم إجراء تضخيم تفاعل البوليميراز المتسلسل والرحلان الكهربائي للحمض النووي المستخرج باستخدام بادئات خاصة بالذباب الميتوفيلي الموجودة في تسلسل جين CO I للميتوكوندريا. أظهرت النتائج أن نقاء الحمض النووي لجميع العينات كان أكبر من 2.0. لوحظ أن تركيز الحمض النووي بالترتيب التالي: عينات جديدة > عينات قديمة محفوظة بالكحول > عينات قديمة غير معالجة. كان لجميع العينات نطاقات كهربائية محددة بعد تضخيم تفاعل البوليميراز المتسلسل. في الختام ، يمكن استخدام مجموعة استخراج الحمض النووي للدم لاستخراج الحمض النووي من الذباب الميت بنجاح ، وتركيز الحمض النووي لعينات الذباب الطازجة أكبر من تركيز عينات الذباب القديمة. يمكن تخزين الذباب في الكحول لفترة طويلة.
Introduction
لطالما كان الاستدلال على وقت الوفاة أحد القضايا الرئيسية والصعبة التي يجب حلها في الممارسة القضائية. في ممارسة علم الطب الشرعي ، بالنسبة للقضية الجنائية ، يلعب تحديد فترة ما بعد الوفاة دورا حاسما في استنتاج وقت الجريمة ، وحبس المشتبه به ، وتضييق نطاق التحقيق. تعتمد الطرق التقليدية للاستدلال على وقت الوفاة في المقام الأول على ظواهر ما بعد الوفاة المبكرة ، والتي لا يمكن استخدامها بشكل عام إلا لاستنتاج وقت الوفاة في غضون 24 ساعة. ومع ذلك ، لا يمكن تحديد وقت الوفاة الطويل من خلال ظواهر ما بعد الوفاة. من المسلم به الآن بشكل عام في مجتمع علوم الطب الشرعي أن علم الحشرات الشرعي لديه القدرة على أن يكون وسيلة فعالة للاستدلال على وقت أطول من الوفاة.
سميت الحشرات Necrophagous ليرقاتها التي تتغذى على الجثث. من بينها ، كلما كانت هناك جثة ، سيكون الذباب الميت البالغ أول من يصل إلى الجثة ويضع بيضه أو يرقاته. تتغذى اليرقات على أنسجة الجثة وتنضج إلى الشرانق ، والتي تنتقل إلى البالغين. يلعب الذباب الميت دورا كبيرا في ممارسة علم الطب الشرعي بسبب دورة حياته المنتظمة وتوزيعه الجغرافي ، على سبيل المثال ، خصم وقت الوفاة وتحديد مكان الوفاة 1,2. ومع ذلك ، فإن العائق أمام استخدام الذباب الميت في ممارسة الطب الشرعي هو تحديد الأنواع. لا تزال الطرق المورفولوجية تستخدم كطريقة موثوقة لتحديد أنواع الذباب الميت. ومع ذلك ، يتطلب تحديد الأنواع المورفولوجية درجة عالية من سلامة الحشرات. إذا كان الذباب في مراحل نمو مختلفة ، أو بسبب التغيرات المورفولوجية الناجمة عن الخيارات البيئية ، فإن كل ذلك يجعل الفحص المورفولوجي أكثر صعوبة. على وجه الخصوص ، بالكاد يمكن التعرف على مورفولوجيا الشرانق وقذائف العذراء ، والتي توجد غالبا في مسرح الجريمة. هذا ، إلى جانب ندرة الخبراء المورفولوجيين ، يجعل صعوبة كبيرة في تحديد الأنواع من الناحية المورفولوجية. لذلك ، ظهر تطبيق طرق البيولوجيا الجزيئية لتحديد أنواع الذباب ، مما يقلل من صعوبة التعرف المورفولوجي وهو مستقل عن مرحلة النمو3،4،5،6،7.
تتمثل الخطوة الأولى في تحديد أنواع الذباب الميت بناء على طرق البيولوجيا الجزيئية في الاستخراج الفعال للحمض النووي ، في حين أن المجموعات المتخصصة لاستخراج الحمض النووي للحشرات ليست متاحة بشكل شائع حاليا. وكيفية استخدام مجموعات الدم الشائعة لاستخراج الحمض النووي للذباب الميت تصبح أكثر أهمية من الناحية الجنائية. غالبا ما يتم تشويه الذباب الميت الموجود في مسرح الجريمة أو خضع للتحلل وتدهور الحمض النووي. عينات الذباب ليست متاحة على الفور لاستخراج الحمض النووي بعد الحصول عليها ، أو إذا أمكن ، يجب الاحتفاظ بعينات كاملة بسبب متطلبات الحفاظ على الأدلة. بناء على المتطلبات المذكورة أعلاه ، في هذه الدراسة ، قمنا بتطبيق مجموعة الحمض النووي للدم بناء على هضم البروتيناز K ، واخترنا ثلاث عينات Chrysomya megacephala طازجة (Diptera ، Lepidoptera) (الشكل 1) ، وعينة قديمة من C. megacephala وضعت في الكحول لمدة عامين ، وعينة واحدة من C. megacephala وضعت في مخزن محمي من الضوء لمدة عامين ، وزنت كل عينة من العينات الخمس ، انتخب أنسجة الصدر الحشرية لاستخراج الحمض النووي. بمقارنة جودة ونقاء الحمض النووي المستخرج من العينات القديمة والجديدة ، تم إجراء تضخيم تفاعل البوليميراز المتسلسل والرحلان الكهربائي للحمض النووي المستخرج باستخدام بادئات خاصة بالذباب الميتوفيلي الموجودة في تسلسل جين ثاني أكسيد الكربون 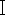 الميتوكوندريا.
الميتوكوندريا.
Protocol
ملاحظة: تم استخدام ما مجموعه خمس عينات من عينات C. megacephala في هذا البروتوكول - ثلاث عينات طازجة (طازجة 1 ، طازجة 2 ، وطازجة 3) ، وعينة واحدة مخزنة في الكحول لمدة عامين (قديم 1) ، وعينة واحدة مخزنة في تخزين جاف مغلق لمدة عامين محميين من الضوء فقط (قديم 2). يجب تسمية العينات وفقا للمتطلبات التجريبية.
1. تخزين العينات العامة والمستحضرات
- اختيار العينة وإعدادها
ملاحظة: تأكد من العمل في غطاء الدخان عند تطبيق أسيتات الإيثيل لتنفيذ الذباب الميت. أخرج السائل من سطح الذبابة قبل الوزن.- عينات طازجة: ضع ثلاث عينات ذباب مجمعة في قوارير الغاز بعد قتلها بأسيتات الإيثيل. قم بوزن العينات وتسميتها باسم Fresh 1 و Fresh 2 و Fresh 3 واستخدمها على الفور في التجارب.
ملاحظة: كانت عينات الذباب الطازجة في هذا البروتوكول تحتوي على كتل 56.8 مجم و 49.3 مجم و 52.1 مجم. - العينة القديمة 1: أخرج عينات الذباب التي قتلتها أسيتات الإيثيل وتخزينها في أنابيب طرد مركزي مملوءة بالكحول لمدة عامين في احتواء محكم الإغلاق ، محمي من الضوء في درجة حرارة الغرفة. وزن العينة بعد امتصاص السائل السطحي بورق الترشيح ؛ نسميها القديمة 1.
ملاحظة: كانت كتلة Old 1 42.3 mg في هذا البروتوكول. - العينة القديمة 2: أخرج عينة الذباب التي قتلتها أسيتات الإيثيل وتخزينها في أنبوب طرد مركزي لمدة عامين في احتواء محكم الإغلاق ، محمي من الضوء في درجة حرارة الغرفة. وزنها ونسميها القديمة 2.
- عينات طازجة: ضع ثلاث عينات ذباب مجمعة في قوارير الغاز بعد قتلها بأسيتات الإيثيل. قم بوزن العينات وتسميتها باسم Fresh 1 و Fresh 2 و Fresh 3 واستخدمها على الفور في التجارب.
- التحضير قبل الاستخراج
- أضف كمية صغيرة من النيتروجين السائل لتبريد وعاء من الفولاذ المقاوم للصدأ ؛ انتظر حتى يتبخر كل النيتروجين السائل.
- ضع عينة ذبابة في الحاوية ؛ صب النيتروجين السائل ببطء لمنع النيتروجين السائل من التناثر والتأثير على عينة الحشرات.
- تجميد العينات في النيتروجين السائل. قم بإزالة العينات بعد تبخر النيتروجين السائل.
- افصل الصدر بشكل فردي ، وضعه في أنبوب طرد مركزي سعة 2 مل ، وقطعه إلى أصغر شرائح ممكنة.
ملاحظة: قطع العينة إلى قطع صغيرة بحيث يمكن شقها بالكامل ، ويمكن إطلاق الحمض النووي بكميات كبيرة. - كرر الخطوات المذكورة أعلاه لكل ذبابة ، وقم بتجميدها بشكل فردي ، ثم قم بإزالتها إلى أنبوب طرد مركزي جديد لمنع التلوث المتبادل للحمض النووي.
2. استخراج الحمض النووي
ملاحظة: يجب تنفيذ جميع خطوات الطرد المركزي في درجة حرارة الغرفة (15-25 درجة مئوية) في جهاز طرد مركزي دقيق. يجب تنفيذ جميع الخطوات مع الالتزام الصارم بمبادئ التعقيم وتجنب التلوث المتبادل.
- تحلل الأنسجة
- أضف 180 ميكرولتر من محلول تحلل الأنسجة إلى أنبوب طرد مركزي سعة 2 مل يحتوي على عينة مقطوعة.
- أضف 20 ميكرولتر من البروتيناز K. تخلط جيدا عن طريق الدوامة عند 3000 دورة في الدقيقة لمدة 10 ثوان وتحتضن عند 56 درجة مئوية حتى تتحلل أنسجة الحشرات تماما.
ملاحظة: إضافة المزيد من Proteinase K يجب أن يكون إذا لم يتم هضم الأنسجة بالكامل. عادة ما يكتمل التحلل في 1-3 ساعات ، كما يمكن أن يمدد وقت التحلل بين عشية وضحاها.
- ترسيب الحمض النووي
- دوامة عند 3000 دورة في الدقيقة لمدة 15 ثانية. أضف 200 ميكرولتر من محلول التحلل إلى العينة ، واخلطها جيدا عن طريق الدوامة عند 3000 دورة في الدقيقة لمدة 15 ثانية.
- أضف 200 ميكرولتر من الإيثانول (96-100٪) واخلطه جيدا مرة أخرى عن طريق الدوامة عند 3000 دورة في الدقيقة لمدة 15 ثانية.
ملاحظة: يمكن إضافة المخزن المؤقت للتحلل والإيثانول معا في خطوة واحدة لتوفير الوقت. قد يتكون راسب أبيض عند إضافة مخزن التحلل والإيثانول.
- ماصة الخليط في عمود امتزاز الحمض النووي يوضع في أنبوب تجميع 2 مل. أجهزة الطرد المركزي في 6000 × غرام لمدة 1 دقيقة. تجاهل التدفق وأنبوب التجميع.
- ضع عمود امتزاز الحمض النووي من الخطوة السابقة في أنبوب تجميع جديد سعة 2 مل ، وأضف 500 ميكرولتر من المخزن المؤقت لإزالة البروتين ، وأجهزة طرد مركزي عند 6000 × جم لمدة 1 دقيقة. تجاهل التدفق وأنبوب التجميع.
- انقل عمود امتزاز الحمض النووي إلى أنبوب تجميع جديد سعة 2 مل ، وأضف 500 ميكرولتر من محلول تحلية المياه ، وأجهزة طرد مركزي عند 20000 × جم لمدة 3 دقائق لتجفيف غشاء عمود امتزاز الحمض النووي. تجاهل التدفق وأنبوب التجميع.
ملاحظة: تضمن خطوة الطرد المركزي هذه إزالة أي إيثانول متبقي قبل الشطف التالي. إذا كان هناك أي ترحيل للإيثانول ، أجهزة الطرد المركزي مرة أخرى عند 20000 × غرام لمدة 1 دقيقة. - ضع عمود امتزاز الحمض النووي في أنبوب طرد مركزي صغير نظيف سعة 2 مل ، وقم بسحب 100 ميكرولتر مباشرة من محلول شطف الحمض النووي على غشاء العمود ، واحتضانه في درجة حرارة الغرفة لمدة دقيقة واحدة ، ثم جهاز الطرد المركزي عند 6000 × جم لمدة 1 دقيقة للإذاعة.
ملاحظة: الشطف مع 100 ميكرولتر (بدلا من 200 ميكرولتر) يزيد من تركيز الحمض النووي النهائي في الشطف ولكنه يقلل أيضا من إجمالي إنتاج الحمض النووي. لزيادة إنتاجية الحمض النووي إلى أقصى حد ، كرر الشطف مرة واحدة كما هو موضح في الخطوة 2.8. - قم بتخزين عينات الحمض النووي في 4 درجة مئوية (حتى 1 أسبوع) أو -80 درجة مئوية للتخزين طويل الأجل.
3. الكشف عن تركيز الحمض النووي
- تحديد قيم OD 260 و OD 280 لمقارنة نقاء الحمض النووي وتركيز الحمض النووي بواسطة قارئ الصفيحة الدقيقة. كرر ثلاث مرات على كل عينة.
- حدد تركيز الحمض النووي المستخرج بواسطة مقياس الفلورومتر باستخدام المجموعة المصاحبة له ، مع ثلاث نسخ متماثلة لكل عينة.
- خذ 190 ميكرولتر من محلول العمل في أنبوبي طرد مركزي سعة 0.5 مل ، وخذ 10 ميكرولتر لكل من المعيار # 1 والمعيار # 2 ، وأضفهما إلى حلول العمل ، واحفظهما بعيدا عن الضوء لمدة لا تقل عن 15 دقيقة.
ملاحظة: يتم معايرة المعيار #1 والمعيار #2 بدقة لتركيز معين من الحمض النووي. يجب تكوين الحلول القياسية بدقة لضمان تشكيل منحنى قياسي دقيق. المعيار # 1 هو عينة من الحمض النووي المزدوج (dsDNA) 0.2 نانوغرام / ميكرولتر ؛ المعيار # 2 هو 2,000 نانوغرام / ميكرولتر. حل العمل هو صبغة ترتبط على وجه التحديد ب dsDNA. - خذ 2 ميكرولتر من اختبار الحمض النووي واخلطه مع 198 ميكرولتر من محلول العمل في أنبوب طرد مركزي سعة 0.5 مل ، واحفظه بعيدا عن الضوء لمدة لا تقل عن 15 دقيقة.
ملاحظة: إذا كان تركيز الحمض النووي منخفضا ، أضف 5 ميكرولتر من اختبار الحمض النووي مع 195 ميكرولتر من محلول العمل. - بعد 15 دقيقة ، قم بتشغيل الجهاز وحدد قياس تركيز dsDNA | بعيد المدى. أولا ، اختبر المعيار # 1 ، ثم المعيار # 2 للحصول على المنحنى القياسي.
ملاحظة: يجب استخدام الحل القياسي في نفس اليوم بعد تكوينه ؛ سيؤدي تركه لفترة طويلة جدا إلى حدوث خطأ كبير في المنحنى القياسي. - ضع العينات المراد اختبارها في آبار الفحص واحدة تلو الأخرى ، واضبط حجم ارتفاع الحمض النووي إلى 2 ميكرولتر ، وكرر القياس ثلاث مرات ، وخذ متوسط القيمة ، وسجل.
- خذ 190 ميكرولتر من محلول العمل في أنبوبي طرد مركزي سعة 0.5 مل ، وخذ 10 ميكرولتر لكل من المعيار # 1 والمعيار # 2 ، وأضفهما إلى حلول العمل ، واحفظهما بعيدا عن الضوء لمدة لا تقل عن 15 دقيقة.
4. PCR والكشف الكهربائي
ملاحظة: تم أخذ تسلسل جين ثاني أكسيد الكربون 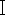 الميتوكوندريا بطول 278 bp لتضخيم تفاعل البوليميراز المتسلسل مع التمهيدي الأمامي C1-J-2495: CAGCTACTTTATGAGCTTTAGG ، والتمهيدي العكسي C1-N-2800: CATTTCAAGCTGTGTAAGCATC8 ، ثم تم التحقق من الرحلان الكهربائي لهلام الأغاروز بنسبة 2٪ للتحقق من تأثير التضخيم وتم التحقق من طول منتجات التضخيم.
الميتوكوندريا بطول 278 bp لتضخيم تفاعل البوليميراز المتسلسل مع التمهيدي الأمامي C1-J-2495: CAGCTACTTTATGAGCTTTAGG ، والتمهيدي العكسي C1-N-2800: CATTTCAAGCTGTGTAAGCATC8 ، ثم تم التحقق من الرحلان الكهربائي لهلام الأغاروز بنسبة 2٪ للتحقق من تأثير التضخيم وتم التحقق من طول منتجات التضخيم.
- إعداد 20 ميكرولتر من نظام تضخيم PCR عن طريق إضافة 10 ميكرولتر من مزيج 2x Taq ، و 1 ميكرولتر من كل برايمر ، و 5 ميكرولتر من ddH2O ، و 3 ميكرولتر من قالب الحمض النووي ؛ تخلط جيدا لمدة 10 ثوان في جهاز طرد مركزي.
- استخدم معلمات ركوب الدراجات PCR التالية: التمسخ 95 درجة مئوية لمدة 10 دقائق ؛ تمسخ 95 درجة مئوية لمدة 30 ثانية ، تلدين 48 درجة مئوية لمدة 30 ثانية ، تمديد 72 درجة مئوية لمدة 45 ثانية لما مجموعه 40 دورة ؛ والتمديد النهائي 72 درجة مئوية لمدة 10 دقائق.
- قم بإخضاع المنتجات بعد PCR إلى 2٪ من الرحلان الكهربائي لهلام الأغاروز ، وبعد الرحلان الكهربائي ، ضعها على نظام تصوير جل لتحليل الصور.
النتائج
استخدمنا قارئ الصفائح الدقيقة لقياس قيم OD260 و OD280 لمحلول الحمض النووي المستخرج ثم حصلنا على قيم OD260 / OD280 لتقييم نقاء الحمض النووي. كان OD260 / OD280 لجميع العينات الطازجة والعينة القديمة 1 أكبر من 2. كان ل OD260 / OD280 للعينة القديمة 2 قيمة قصوى تبلغ 2.187 على الرغم من أن المتوسط كان 1.753 ، وتذبذبت قياساتها ا?...
Discussion
استخراج الحمض النووي هو الرابط الأكثر أهمية في التحديد الجزيئي للذباب الميت ، وتؤثر طريقة استخراجه وجودة الحمض النووي المستخرج بشكل مباشر على الكشف اللاحق. في هذه التجربة ، نجحنا في استخراج الحمض النووي من الذباب الميت باستخدام مجموعة دم شائعة ، دون الحاجة إلى شراء مجموعة خاصة لاستخراج ا...
Disclosures
ويعلن صاحبا البلاغ أنه ليس لهما مصالح مالية متنافسة.
Acknowledgements
يتم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (82060341،81560304) ومشروع البحث العلمي لمنصة الابتكار الأكاديمي في مقاطعة هاينان (YSPTZX202134).
Materials
| Name | Company | Catalog Number | Comments |
| Buffer AE | Qiagen | 172026832 | DNA elution buffer |
| Buffer AL | Qiagen | 172028374 | lysis buffer |
| Buffer ATL | Qiagen | 172028162 | tissue lysis buffer |
| Buffer AW1 | Qiagen | 172028760 | protein removal buffer |
| Buffer AW2 | Qiagen | 57203108 | desalination buffer |
| C1-J-2495 | Taihe Biotechnology | TW21109216 | forword primer |
| C1-N-2800 | Taihe Biotechnology | TW21109217 | reverse primer |
| D2000 DNA ladder | Real-Times(Beijing) Biotechnology | RTM415 | Measure the position of electrophoretic bands |
| DNeasy Mini spin column | Qiagen | 166050343 | DNA adsorption column |
| Dry Bath Incubator | Miulab | DKT200-2D | used for heating |
| MIX-30S Mini Mixer | Miulab | MUC881206 | oscillatory action |
| Proteinase K | Qiagen | 172026218 | Inactivation of intracellular nucleases and other proteins |
| Qubit 3.0 Fluorometer | Thermo Fisher Scientific | 2321611188 | |
| Speed Micro-Centrifuge | Scilogex | 9013001121 | centrifuge |
| Standard#1 | Thermo Fisher Scientific | 2342797 | |
| Standard#2 | Thermo Fisher Scientific | 2342797 | |
| Tanon 3500R Gel Imager | Tanon | 16T5553R-455 | gel imaging |
| Taq Mix Pro | Monad | 00007808-140534 | PCR Mix |
| Taq Mix Pro | Monad | 00007808-140534 | PCR Mix |
| Thermo Cycler | Zhuhai Hema | VRB020A | ordinary PCR |
| Working Solution | Thermo Fisher Scientific | 2342797 |
References
- Amendt, J., Richards, C. S., Campobasso, C. P., Zehner, R., Hall, M. J. Forensic entomology: applications and limitations. Forensic Sci Med Pathol. 7 (4), 379-392 (2011).
- Wydra, J., Matuszewski, S. The optimal post-eclosion interval while estimating the post-mortem interval based on an empty puparium. Forensic Sci Med Pathol. 17 (2), 192-198 (2021).
- Mazzanti, M., Alessandrini, F., Tagliabracci, A., Wells, J. D., Campobasso, C. P. DNA degradation and genetic analysis of empty puparia: genetic identification limits in forensic entomology. Forensic Sci Int. 195 (1-3), 99-102 (2010).
- Odeniran, P. O., et al. molecular identification and distribution of Trypanosome-transmitting Dipterans from cattle settlements in Southwest Nigeria. Acta Parasitol. 66 (1), 116-128 (2021).
- Wells, J. D., Stevens, J. R. Application of DNA-based methods in forensic entomology. Annu Rev Entomol. 53, 103-120 (2008).
- Kotrba, M., et al. DNA barcoding in forensic entomology-establishing a DNA reference library of potentially forensic relevant arthropod species. J Forensic Sci. 64 (2), 593-601 (2019).
- Weedon, M. N., et al. Use of SNP chips to detect rare pathogenic variants: Retrospective, population based diagnostic evaluation. BMJ. 372, 214 (2021).
- Cai, J. -. F., et al. The availability of mitochondrial DNA cytochrome oxidasegene for the distinction of forensically important flies in China. Acta Entomologica Sinica. 48 (3), 380-385 (2005).
- Khayrova, A., Lopatin, S., Varlamov, V. Obtaining chitin, chitosan and their melanin complexes from insects. Int J Biol Macromol. 167, 1319-1328 (2021).
- Guo, Y. Q., et al. Comparison of three DNA extracting methods from different parts of common necrophagous flies. J Henan Univ Sci Tech (Med Sci). 36 (02), 130-133 (2018).
- Du, H., Xie, H., Ma, M., Igarashi, Y., Luo, F. Modified methods obtain high-quality DNA and RNA from anaerobic activated sludge at a wide range of temperatures. J Microbiol Methods. 199, 106532 (2022).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J Vis Exp. (48), e2699 (2011).
- Masago, K., et al. Comparison between fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of DNA and RNA extracted from frozen and FFPE tissues from lung cancer patients: A real-world use of genomic tests. Medicina (Kaunas). 57 (12), 1375 (2021).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clin Chim Acta. 479, 14-19 (2018).
- Adams, Z. J., Hall, M. J. Methods used for the killing and preservation of blowfly larvae, and their effect on post-mortem larval length. Forensic Sci Int. 138 (1-3), 50-61 (2003).
- Fliegerova, K., et al. Effect of DNA extraction and sample preservation method on rumen bacterial population. Anaerobe. 29, 80-84 (2014).
- Rodrigues, B. L., Galati, E. A. B. Molecular taxonomy of phlebotomine sand flies (Diptera, Psychodidae) with emphasis on DNA barcoding: A review. Acta Trop. 238, 106778 (2023).
Erratum
Formal Correction: Erratum: DNA Extraction and Comparison Between Old and Fresh Necrophilic Fly Samples
Posted by JoVE Editors on 8/12/2024. Citeable Link.
This corrects the article 10.3791/66737
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved