Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
DNA Ekstraksiyonu ve Eski ve Taze Nekrofilik Sinek Örnekleri Arasında Karşılaştırma
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Erratum Notice
Özet
Bu makale, modifiye edilmiş bir ortak DNA ekstraksiyon kiti kullanılarak taze ve eski nekrofilik sinek DNA ekstraksiyonu için bir protokolü açıklamaktadır.
Özet
Chrysomya megacephala örneklerinin toplam beş örneği - üç taze örnek, 2 yıl boyunca alkolde saklanan bir örnek ve 2 yıl boyunca sadece ışıktan korunan kuru kapalı depoda saklanan bir örnek - bir kan DNA ekstraksiyon kitinin nekrofilik sineklerden DNA çıkarıp çıkaramayacağını araştırmak ve alkolün nekrofilik sineklerin DNA'sının korunmasını uzatıp uzatamayacağını belirlemek için seçildi. İlk olarak, göğüs dokularından DNA'yı çıkarmak için kan DNA ekstraksiyon kiti kullanıldı. Daha sonra, DNA saflığı ve konsantrasyonu bir mikroplaka okuyucu ve bir florometre kullanılarak incelendi. Son olarak, ekstrakte edilen DNA'nın PCR amplifikasyonu ve elektroforezi, mitokondriyal CO I gen dizisinde bulunan nekrofilik sinek spesifik primerler ile yapıldı. Sonuçlar, tüm örneklerin DNA saflığının 2.0'dan büyük olduğunu gösterdi. DNA konsantrasyonunun şu sırada olduğu gözlendi: taze numuneler > alkolle korunmuş eski numuneler > işlenmemiş, eski numuneler. PCR amplifikasyonundan sonra tüm örneklerde spesifik elektroforetik bantlar vardı. Sonuç olarak, nekrofilik sineklerden DNA'yı başarılı bir şekilde çıkarmak için bir kan DNA ekstraksiyon kiti kullanılabilir ve taze sinek örneklerinin DNA konsantrasyonu eski sinek örneklerinden daha fazladır. Sinekler uzun süre alkolde saklanabilir.
Giriş
Ölüm zamanının çıkarımı, yargı pratiğinde her zaman çözülmesi gereken kilit ve zor konulardan biri olmuştur. Adli tıp pratiğinde, bir ceza davası için, ölüm sonrası aralığın belirlenmesi, suçun zamanının çıkarılmasında, şüphelinin kilitlenmesinde ve soruşturmanın kapsamının daraltılmasında çok önemli bir rol oynar. Ölüm zamanını belirlemenin geleneksel yöntemleri, esas olarak, genellikle yalnızca 24 saat içindeki ölüm zamanını çıkarmak için kullanılabilen erken ölüm sonrası olaylara dayanır. Bununla birlikte, uzun ölüm süresi ölüm sonrası olaylarla belirlenemez. Artık adli bilim camiasında, adli entomolojinin daha uzun bir ölüm süresini çıkarmada etkili bir yöntem olma potansiyeline sahip olduğu genel olarak kabul edilmektedir.
Nekrofag böcekler, cesetlerle beslenen larvaları için adlandırılır. Bunların arasında, bir ceset mevcut olduğunda, yetişkin nekrofil sinekler cesede ilk ulaşan ve yumurtalarını veya larvalarını bırakan ilk sinekler olacaktır. Larvalar ceset dokusuyla beslenir ve olgunlaşarak yetişkinlere dönüşen pupalara dönüşür. Nekrofilik sinekler, düzenli yaşam döngüleri ve coğrafi dağılımları nedeniyle adli bilimlerin uygulanmasında büyük bir rol oynamaktadır, örneğin, ölüm zamanının düşülmesi ve ölüm yerininbelirlenmesi 1,2. Bununla birlikte, adli uygulamada nekrofil sineklerin kullanılmasının önündeki engel tür tanımlamasıdır. Morfolojik yöntemler, nekrofilik sineklerin tür tanımlaması için yetkili yöntem olarak hala kullanılmaktadır. Bununla birlikte, morfolojik türlerin tanımlanması, yüksek derecede böcek bütünlüğü gerektirir. Sinekler farklı gelişim aşamalarındaysa veya çevresel seçimlerin neden olduğu morfolojik değişiklikler nedeniyle, bunların hepsi morfolojik incelemeyi daha zor hale getirir. Özellikle, suç mahallinde en sık bulunan pupa ve pupa kabuklarının morfolojisi zar zor tanınabilir. Bu, morfolojik uzmanların azlığı ile birlikte, türlerin morfolojik olarak tanımlanmasında büyük zorluklar yaratmaktadır. Bu nedenle, sineklerin tür tanımlaması için moleküler biyoloji yöntemlerinin uygulanması ortaya çıkmıştır, bu da morfolojik tanımlamanın zorluğunu azaltır ve gelişim evresi 3,4,5,6,7'den bağımsızdır.
Moleküler biyoloji yöntemlerine dayalı olarak nekrofil sineklerin tür tanımlamasındaki ilk adım, DNA'nın verimli bir şekilde ekstraksiyonudur, ancak böcek DNA ekstraksiyonu için özel kitler şu anda yaygın olarak mevcut değildir. Ve nekrofilik sineklerin DNA ekstraksiyonu için ortak kan kitlerinin nasıl kullanılacağı adli olarak daha alakalı hale gelir. Suç mahallerinde bulunan nekrofilik sinekler genellikle sakatlanır veya çürüme ve DNA bozulmasına uğrar. Sinek örnekleri, alındıktan sonra DNA ekstraksiyonu için hemen mevcut değildir veya mümkünse, kanıt koruma gereklilikleri nedeniyle tam örneklerin saklanması gerekir. Yukarıdaki gereksinimlere dayanarak, bu çalışmada, proteinaz K sindirimine dayalı kan DNA kitini uyguladık ve üç taze Chrysomya megacephala (Diptera, Lepidoptera) örneği seçtik (Şekil 1), iki yıl boyunca alkole yerleştirilmiş bir eski C. megacephala örneği ve iki yıl boyunca ışık korumalı depoya yerleştirilen bir C. megacephala örneği, beş örneğin her birini tarttık, DNA ekstraksiyonu için böcek toraks dokusunu seçti. Eski ve yeni örneklerden ekstrakte edilen DNA'nın kalitesi ve saflığı karşılaştırılarak, ekstrakte edilen DNA'nın PCR amplifikasyonu ve elektroforezi, mitokondriyal CO 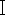 gen dizisinde bulunan nekrofilik sinek spesifik primerler ile gerçekleştirildi.
gen dizisinde bulunan nekrofilik sinek spesifik primerler ile gerçekleştirildi.
Protokol
NOT: Bu protokolde toplam beş C . megacephala numunesi kullanıldı - üç taze numune (Taze 1, Taze 2 ve Taze 3), 2 yıl boyunca alkolde saklanan bir numune (Eski 1) ve 2 yıl boyunca kuru kapalı depoda saklanan bir numune sadece ışıktan korunarak (Eski 2). Numuneler deney gereksinimlerine göre etiketlenmelidir.
1. Genel numune saklama ve hazırlıklar
- Numune seçimi ve hazırlanması
NOT: Nekrofag sineklerini yürütmek için etil asetat uygularken çeker ocakta çalıştığınızdan emin olun. Tartmadan önce sıvıyı sineğin yüzeyinden çıkarın.- Taze numuneler: Toplanan üç sinek numunesini etil asetat ile öldürdükten sonra gaz şişelerine koyun. Numuneleri tartın ve Taze 1, Taze 2 ve Taze 3 olarak adlandırın ve deneylerde hemen kullanın.
NOT: Bu protokoldeki taze sinek örneklerinin kütleleri 56.8 mg, 49.3 mg ve 52.1 mg'dır. - Eski numune 1: Etil asetat tarafından öldürülen ve alkol dolu santrifüj tüplerinde 2 yıl boyunca hava geçirmez bir muhafaza içinde, oda sıcaklığında ışıktan korunan sinek numunelerini çıkarın. Yüzey sıvısını filtre kağıdı ile adsorbe ettikten sonra numuneyi tartın; Eski 1 deyin.
NOT: Bu protokolde Eski 1'in kütlesi 42.3 mg idi. - Eski numune 2: Etil asetat tarafından öldürülen ve oda sıcaklığında ışıktan korunarak hava geçirmez bir muhafaza altında 2 yıl boyunca bir santrifüj tüpünde saklanan sinek örneğini çıkarın. Tartın ve ona Eski 2 deyin.
- Taze numuneler: Toplanan üç sinek numunesini etil asetat ile öldürdükten sonra gaz şişelerine koyun. Numuneleri tartın ve Taze 1, Taze 2 ve Taze 3 olarak adlandırın ve deneylerde hemen kullanın.
- Ekstraksiyon öncesi hazırlık
- Paslanmaz çelik bir kabı soğutmak için az miktarda sıvı nitrojen ekleyin; Tüm sıvı nitrojen buharlaşana kadar bekleyin.
- Kabın içine bir sinek örneği koyun; Sıvı nitrojenin sıçramasını ve böcek örneğine çarpmasını önlemek için sıvı nitrojeni yavaşça dökün.
- Numuneleri sıvı nitrojen içinde dondurun. Sıvı nitrojen buharlaştıktan sonra numuneleri çıkarın.
- Göğüs kafesini ayrı ayrı ayırın, 2 mL'lik bir santrifüj tüpüne yerleştirin ve mümkün olan en küçük dilimler halinde kesin.
NOT: Numuneyi tamamen parçalanabilmesi için küçük parçalara ayırın ve DNA büyük miktarlarda salınabilir. - Her sinek için yukarıdaki adımları tekrarlayın, ayrı ayrı dondurun ve ardından DNA çapraz kontaminasyonunu önlemek için yeni bir santrifüj tüpüne çıkarın.
2. DNA ekstraksiyonu
NOT: Tüm santrifüj adımları, oda sıcaklığında (15-25 °C) bir mikrosantrifüjde gerçekleştirilmelidir. Tüm adımlar, asepsi ilkelerine sıkı sıkıya bağlı kalarak ve çapraz kontaminasyonu önlemek için gerçekleştirilmelidir.
- Doku lizisi
- Kırpılmış bir numune içeren 2 mL'lik bir santrifüj tüpüne 180 μL doku lizis tamponu ekleyin.
- 20 μL proteinaz K ekleyin. 3 000 rpm'de 10 saniye girdaplayarak iyice karıştırın ve böcek dokuları tamamen parçalanana kadar 56 ° C'de inkübe edin.
NOT: Doku tam olarak sindirilmemişse daha fazla Proteinaz K eklenmelidir. Lizis genellikle 1-3 saat içinde tamamlanır, ayrıca gece boyunca lizis süresini uzatabilir.
- DNA çökelmesi
- 15 saniye boyunca 3.000 rpm'de girdap. Numuneye 200 μL lizis tamponu ekleyin ve 15 saniye boyunca 3.000 rpm'de girdaplayarak iyice karıştırın.
- 200 μL etanol (%96-100) ekleyin ve 3.000 rpm'de 15 saniye girdaplayarak tekrar iyice karıştırın.
NOT: Lizis tamponu ve etanol, zamandan tasarruf etmek için tek adımda önceden eklenebilir. Lizis tamponu ve etanol ilavesiyle beyaz bir çökelti oluşabilir.
- Karışımı, 2 mL'lik bir toplama tüpüne yerleştirilmiş DNA adsorpsiyon kolonuna pipetleyin. 6.000 × g'da 1 dakika santrifüjleyin. Akış ve toplama tüpünü atın.
- Önceki adımdaki DNA adsorpsiyon kolonunu yeni bir 2 mL toplama tüpüne yerleştirin, 500 μL protein uzaklaştırma tamponu ekleyin ve 1 dakika boyunca 6.000 × g'da santrifüjleyin. Akış ve toplama tüpünü atın.
- DNA adsorpsiyon kolonunu yeni bir 2 mL toplama tüpüne aktarın, 500 μL tuzdan arındırma tamponu ekleyin ve DNA adsorpsiyon kolon zarını kurutmak için 3 dakika boyunca 20.000 × g'da santrifüjleyin. Akış ve toplama tüpünü atın.
NOT: Bu santrifüjleme adımı, bir sonraki elüsyondan önce herhangi bir kalıntı etanolün uzaklaştırılmasını sağlar. Herhangi bir etanol taşınması varsa, 20.000 × g'da 1 dakika boyunca tekrar santrifüjleyin. - DNA adsorpsiyon kolonunu temiz bir 2 mL mikrosantrifüj tüpüne yerleştirin, 100 μL DNA elüsyon tamponunu doğrudan kolon zarına pipetleyin, oda sıcaklığında 1 dakika inkübe edin ve ardından 6.000 × g'da 1 dakika santrifüjleyin.
NOT: 100 μL ile elüsyon (200 μL yerine), elüattaki nihai DNA konsantrasyonunu arttırır, ancak aynı zamanda genel DNA verimini de azaltır. DNA verimini en üst düzeye çıkarmak için, elüsyonu adım 2.8'de açıklandığı gibi bir kez tekrarlayın. - DNA örneklerini uzun süreli saklama için 4 °C'de (1 haftaya kadar) veya -80 °C'de saklayın.
3. DNA konsantrasyonu tespiti
- Mikroplaka okuyucu ile DNA saflığını ve nükleik asit konsantrasyonunu karşılaştırmak için OD 260 ve OD 280 değerlerini belirleyin. Her örnekte üç kez tekrarlayın.
- Ekstrakte edilen DNA'nın konsantrasyonunu, her numune için üç kopya ile eşlik eden kitini kullanarak florometre ile belirleyin.
- İki adet 0.5 mL'lik santrifüj tüpüne 190 μL çalışma solüsyonu alın, Standart # 1 ve Standart # 2'nin her birinden 10 μL alın, bunları çalışma solüsyonlarına ekleyin ve en az 15 dakika boyunca ışıktan uzak tutun.
NOT: Standart #1 ve Standart #2, belirli bir DNA konsantrasyonu için doğru şekilde kalibre edilmiştir. Doğru bir standart eğrinin oluşturulmasını sağlamak için standart çözümler doğru bir şekilde yapılandırılmalıdır. Standart #1, 0.2 ng/μL çift sarmallı DNA (dsDNA) örneğidir; standart #2 2.000 ng/μL'dir. Çalışma solüsyonu, özellikle dsDNA'ya bağlanan bir boyadır. - 2 μL test DNA'sı alın ve 0,5 mL'lik bir santrifüj tüpünde 198 μL çalışma solüsyonu ile karıştırın ve en az 15 dakika ışıktan uzak tutun.
NOT: DNA konsantrasyonu düşükse, 195 μL çalışma solüsyonu ile 5 μL test DNA'sı ekleyin. - 15 dakika sonra cihazı açın ve dsDNA Konsantrasyon Ölçümü | Uzun menzilli. İlk olarak, standart eğriyi elde etmek için Standart #1'i ve ardından Standart #2'yi test edin.
NOT: Standart çözüm, yapılandırıldıktan sonra aynı gün kullanılmalıdır; Çok uzun süre bırakmak, standart eğride büyük bir hataya neden olacaktır. - Test edilecek numuneleri tahlil kuyucuklarına tek tek yerleştirin, DNA spiking hacmini 2 μL'ye ayarlayın, ölçümü üç kez tekrarlayın, ortalama değeri alın ve kaydedin.
- İki adet 0.5 mL'lik santrifüj tüpüne 190 μL çalışma solüsyonu alın, Standart # 1 ve Standart # 2'nin her birinden 10 μL alın, bunları çalışma solüsyonlarına ekleyin ve en az 15 dakika boyunca ışıktan uzak tutun.
4. PCR ve elektroforetik algılama
NOT: 278 bp uzunluğundaki mitokondriyal CO 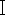 gen dizisi, ileri primer C1-J-2495: CAGCTACTTTATGAGCTTTAGG ve ters primer C1-N-2800: CATTTCAAGCTGTAAGCATC8 ile PCR amplifikasyonu için alındı ve daha sonra amplifikasyon etkisini doğrulamak için% 2 agaroz jel elektroforezi yapıldı ve amplifikasyon ürünlerinin uzunluğu doğrulandı.
gen dizisi, ileri primer C1-J-2495: CAGCTACTTTATGAGCTTTAGG ve ters primer C1-N-2800: CATTTCAAGCTGTAAGCATC8 ile PCR amplifikasyonu için alındı ve daha sonra amplifikasyon etkisini doğrulamak için% 2 agaroz jel elektroforezi yapıldı ve amplifikasyon ürünlerinin uzunluğu doğrulandı.
- 10 μL 2x Taq karışımı, her primerden 1 μL, 5 μL ddH2O ve 3 μL şablon DNA ekleyerek 20 μL PCR amplifikasyon sistemi kurun; Bir santrifüjde 10 saniye boyunca iyice karıştırın.
- Aşağıdaki PCR döngü parametrelerini kullanın: 10 dakika boyunca 95 °C predenatürasyon; denatürasyon 30 sn boyunca 95 °C, tavlama 30 sn boyunca 48 °C, toplam 40 döngü için 45 sn boyunca 72 °C; ve son uzatma 72 °C'de 10 dakika.
- PCR'den sonra ürünleri %2 agaroz jel elektroforezine tabi tutun ve elektroforezden sonra fotoğraf analizi için bir jel görüntüleme sistemine yerleştirin.
Sonuçlar
Ekstrakte edilen DNA çözeltisinin OD260 ve OD280 değerlerini ölçmek için bir mikroplaka okuyucu kullandık ve ardından DNA'nın saflığını değerlendirmek için OD260 / OD280 değerlerini elde ettik. Tüm taze numunelerin OD260/OD280'i ve eski numune 1'in 2'den büyüktü. Eski numune 2'nin OD260/OD280'i, ortalama 2.187 olmasına rağmen maksimum 1.753 değerine sahipti ve hem OD280 hem de OD280'in küçük (≤0.01) değerleri nedeniyle üç ölçümü büyük ölçüde dalgalandı (Tablo 1). ...
Tartışmalar
DNA ekstraksiyonu, nekrofilik sineklerin moleküler tanımlanmasında en kritik bağlantıdır ve ekstraksiyon yöntemi ve ekstrakte edilen DNA'nın kalitesi, sonraki tespiti doğrudan etkiler. Bu deneyde, özel bir böcek DNA ekstraksiyon kiti satın almaya gerek kalmadan, ortak bir kan kiti kullanarak nekrofil sineklerden DNA'yı başarıyla çıkardık, bu da böcek DNA'sı ekstraksiyonunun gerçekleştirilmesini kolaylaştırıyor.
Sineklerin yüzeyi, özellikle epidermal kitinin% 60-70'e ...
Açıklamalar
Yazarlar, rekabet eden herhangi bir mali çıkarları olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (82060341,81560304) ve Hainan Eyaleti Akademisyen İnovasyon Platformu Bilimsel Araştırma Projesi (YSPTZX202134) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Buffer AE | Qiagen | 172026832 | DNA elution buffer |
| Buffer AL | Qiagen | 172028374 | lysis buffer |
| Buffer ATL | Qiagen | 172028162 | tissue lysis buffer |
| Buffer AW1 | Qiagen | 172028760 | protein removal buffer |
| Buffer AW2 | Qiagen | 57203108 | desalination buffer |
| C1-J-2495 | Taihe Biotechnology | TW21109216 | forword primer |
| C1-N-2800 | Taihe Biotechnology | TW21109217 | reverse primer |
| D2000 DNA ladder | Real-Times(Beijing) Biotechnology | RTM415 | Measure the position of electrophoretic bands |
| DNeasy Mini spin column | Qiagen | 166050343 | DNA adsorption column |
| Dry Bath Incubator | Miulab | DKT200-2D | used for heating |
| MIX-30S Mini Mixer | Miulab | MUC881206 | oscillatory action |
| Proteinase K | Qiagen | 172026218 | Inactivation of intracellular nucleases and other proteins |
| Qubit 3.0 Fluorometer | Thermo Fisher Scientific | 2321611188 | |
| Speed Micro-Centrifuge | Scilogex | 9013001121 | centrifuge |
| Standard#1 | Thermo Fisher Scientific | 2342797 | |
| Standard#2 | Thermo Fisher Scientific | 2342797 | |
| Tanon 3500R Gel Imager | Tanon | 16T5553R-455 | gel imaging |
| Taq Mix Pro | Monad | 00007808-140534 | PCR Mix |
| Taq Mix Pro | Monad | 00007808-140534 | PCR Mix |
| Thermo Cycler | Zhuhai Hema | VRB020A | ordinary PCR |
| Working Solution | Thermo Fisher Scientific | 2342797 |
Referanslar
- Amendt, J., Richards, C. S., Campobasso, C. P., Zehner, R., Hall, M. J. Forensic entomology: applications and limitations. Forensic Sci Med Pathol. 7 (4), 379-392 (2011).
- Wydra, J., Matuszewski, S. The optimal post-eclosion interval while estimating the post-mortem interval based on an empty puparium. Forensic Sci Med Pathol. 17 (2), 192-198 (2021).
- Mazzanti, M., Alessandrini, F., Tagliabracci, A., Wells, J. D., Campobasso, C. P. DNA degradation and genetic analysis of empty puparia: genetic identification limits in forensic entomology. Forensic Sci Int. 195 (1-3), 99-102 (2010).
- Odeniran, P. O., et al. molecular identification and distribution of Trypanosome-transmitting Dipterans from cattle settlements in Southwest Nigeria. Acta Parasitol. 66 (1), 116-128 (2021).
- Wells, J. D., Stevens, J. R. Application of DNA-based methods in forensic entomology. Annu Rev Entomol. 53, 103-120 (2008).
- Kotrba, M., et al. DNA barcoding in forensic entomology-establishing a DNA reference library of potentially forensic relevant arthropod species. J Forensic Sci. 64 (2), 593-601 (2019).
- Weedon, M. N., et al. Use of SNP chips to detect rare pathogenic variants: Retrospective, population based diagnostic evaluation. BMJ. 372, 214 (2021).
- Cai, J. -. F., et al. The availability of mitochondrial DNA cytochrome oxidasegene for the distinction of forensically important flies in China. Acta Entomologica Sinica. 48 (3), 380-385 (2005).
- Khayrova, A., Lopatin, S., Varlamov, V. Obtaining chitin, chitosan and their melanin complexes from insects. Int J Biol Macromol. 167, 1319-1328 (2021).
- Guo, Y. Q., et al. Comparison of three DNA extracting methods from different parts of common necrophagous flies. J Henan Univ Sci Tech (Med Sci). 36 (02), 130-133 (2018).
- Du, H., Xie, H., Ma, M., Igarashi, Y., Luo, F. Modified methods obtain high-quality DNA and RNA from anaerobic activated sludge at a wide range of temperatures. J Microbiol Methods. 199, 106532 (2022).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J Vis Exp. (48), e2699 (2011).
- Masago, K., et al. Comparison between fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of DNA and RNA extracted from frozen and FFPE tissues from lung cancer patients: A real-world use of genomic tests. Medicina (Kaunas). 57 (12), 1375 (2021).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clin Chim Acta. 479, 14-19 (2018).
- Adams, Z. J., Hall, M. J. Methods used for the killing and preservation of blowfly larvae, and their effect on post-mortem larval length. Forensic Sci Int. 138 (1-3), 50-61 (2003).
- Fliegerova, K., et al. Effect of DNA extraction and sample preservation method on rumen bacterial population. Anaerobe. 29, 80-84 (2014).
- Rodrigues, B. L., Galati, E. A. B. Molecular taxonomy of phlebotomine sand flies (Diptera, Psychodidae) with emphasis on DNA barcoding: A review. Acta Trop. 238, 106778 (2023).
Erratum
Formal Correction: Erratum: DNA Extraction and Comparison Between Old and Fresh Necrophilic Fly Samples
Posted by JoVE Editors on 8/12/2024. Citeable Link.
This corrects the article 10.3791/66737
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır