È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Estrazione del DNA e confronto tra campioni di mosca necrofila vecchi e freschi
* Questi autori hanno contribuito in egual misura
In questo articolo
Erratum Notice
Riepilogo
Questo articolo descrive un protocollo per l'estrazione del DNA di mosche necrofile fresche e vecchie utilizzando un kit di estrazione del DNA comune modificato.
Abstract
Un totale di cinque campioni di Chrysomya megacephala - tre campioni freschi, un campione conservato in alcol per 2 anni e un campione conservato in un deposito sigillato a secco per 2 anni protetto solo dalla luce - sono stati selezionati per indagare se un kit di estrazione del DNA del sangue potesse estrarre il DNA dai moscerini necrofili e per determinare se l'alcol potesse prolungare la conservazione del DNA dei moscerini necrofili. In primo luogo, il kit di estrazione del DNA del sangue è stato utilizzato per estrarre il DNA dai tessuti del torace. Quindi, la purezza e la concentrazione del DNA sono state esaminate utilizzando un lettore di micropiastre e un fluorimetro. Infine, l'amplificazione PCR e l'elettroforesi del DNA estratto sono state eseguite con primer necrofili specifici per la mosca situati nella sequenza genica mitocondriale CO I. I risultati hanno mostrato che la purezza del DNA di tutti i campioni era superiore a 2,0. È stato osservato che la concentrazione di DNA era del seguente ordine: campioni freschi > vecchi campioni conservati in alcool > vecchi campioni non trattati. Tutti i campioni avevano bande elettroforetiche specifiche dopo l'amplificazione della PCR. In conclusione, un kit per l'estrazione del DNA del sangue può essere utilizzato per estrarre con successo il DNA dalle mosche necrofile e la concentrazione di DNA dei campioni di mosca freschi è maggiore di quella dei vecchi campioni di mosca. Le mosche possono essere conservate a lungo nell'alcool.
Introduzione
La deduzione dell'ora della morte è sempre stata una delle questioni chiave e difficili da risolvere nella pratica giudiziaria. Nella pratica delle scienze forensi, per un caso penale, determinare l'intervallo post-mortem gioca un ruolo cruciale nel dedurre l'ora del crimine, bloccare il sospetto e restringere l'ambito dell'indagine. I metodi tradizionali per dedurre l'ora della morte si basano principalmente su fenomeni post-mortem precoci, che generalmente possono essere utilizzati solo per dedurre l'ora della morte entro 24 ore. Tuttavia, il lungo periodo della morte non può essere determinato da fenomeni post mortem. È ora generalmente riconosciuto nella comunità delle scienze forensi che l'entomologia forense ha il potenziale per essere un metodo efficace per dedurre un tempo di morte più lungo.
Gli insetti necrofagi prendono il nome dalle loro larve che si nutrono di cadaveri. Tra questi, ogni volta che è presente un cadavere, le mosche necrofile adulte saranno le prime a raggiungere il cadavere e deporre le uova o le larve. Le larve si nutrono di tessuto cadaverico e maturano in pupe, che si involano negli adulti. Le mosche necrofile svolgono un ruolo enorme nella pratica della scienza forense a causa del loro ciclo di vita regolare e della distribuzione geografica, ad esempio deducendo l'ora della morte e determinando il luogo della morte 1,2. Tuttavia, l'ostacolo all'uso di mosche necrofile nella pratica forense è l'identificazione delle specie. I metodi morfologici sono ancora utilizzati come metodo autorevole per l'identificazione delle specie di mosche necrofile. Tuttavia, l'identificazione morfologica delle specie richiede un alto grado di integrità degli insetti. Se le mosche si trovavano in diversi stadi di sviluppo, o a causa di cambiamenti morfologici causati da scelte ambientali, tutto ciò rende più difficile l'esame morfologico. In particolare, la morfologia delle pupe e dei gusci pupali, che si trovano più spesso sulla scena del crimine, è a malapena riconoscibile. Questo, insieme alla scarsità di esperti morfologici, rende estremamente difficile l'identificazione morfologica delle specie. Pertanto, è emersa l'applicazione di metodi di biologia molecolare per l'identificazione delle specie di mosche, che riduce la difficoltà di identificazione morfologica ed è indipendente dallo stadio di sviluppo 3,4,5,6,7.
Il primo passo nell'identificazione delle specie di mosche necrofile basata su metodi di biologia molecolare è l'estrazione efficiente del DNA, mentre attualmente non sono comunemente disponibili kit specializzati per l'estrazione del DNA degli insetti. E come utilizzare i comuni kit di sangue per l'estrazione del DNA delle mosche necrofile diventa più rilevante dal punto di vista forense. Le mosche necrofile trovate sulle scene del crimine sono spesso mutilate o hanno subito carie e degradazione del DNA. I campioni di mosca non sono immediatamente disponibili per l'estrazione del DNA dopo l'acquisizione o, se possibile, i campioni completi devono essere conservati a causa dei requisiti di conservazione delle prove. Sulla base dei requisiti di cui sopra, in questo studio, abbiamo applicato il kit di DNA del sangue basato sulla digestione della proteinasi K e selezionato tre campioni freschi di Chrysomya megacephala (Ditteri, Lepidotteri) (Figura 1), un vecchio campione di C. megacephala posto in alcol per due anni e un campione di C. megacephala posto in una conservazione protetta dalla luce per due anni, pesato ciascuno dei cinque campioni, eletto il tessuto toracico dell'insetto per l'estrazione del DNA. Confrontando la qualità e la purezza del DNA estratto dai campioni vecchi e nuovi, l'amplificazione PCR e l'elettroforesi del DNA estratto sono state eseguite con primer specifici per mosche necrofile situati nella sequenza genica mitocondriale del CO  .
.
Protocollo
NOTA: In questo protocollo sono stati utilizzati un totale di cinque campioni di C. megacephala : tre campioni freschi (Fresh 1, Fresh 2 e Fresh 3), un campione conservato in alcool per 2 anni (Old 1) e un campione conservato in una conservazione sigillata a secco per 2 anni al riparo dalla luce (Old 2). I campioni devono essere etichettati secondo i requisiti sperimentali.
1. Conservazione e preparazioni generali dei campioni
- Selezione e preparazione dei campioni
NOTA: Assicurarsi di lavorare nella cappa aspirante quando si applica l'acetato di etile per eseguire mosche necrofaghe. Rimuovere il liquido dalla superficie della mosca prima di pesare.- Campioni freschi: Mettere tre campioni di mosche raccolti in fiale di gas dopo averle uccise con acetato di etile. Pesare e denominare i campioni come Fresh 1, Fresh 2 e Fresh 3 e utilizzarli immediatamente negli esperimenti.
NOTA: I campioni di mosca fresca in questo protocollo avevano masse di 56,8 mg, 49,3 mg e 52,1 mg. - Vecchio campione 1: Prelevare campioni di mosca uccisi dall'acetato di etile e conservati in provette da centrifuga riempite di alcol per 2 anni in contenimento ermetico, al riparo dalla luce a temperatura ambiente. Pesare il campione dopo aver adsorbito il liquido superficiale con carta da filtro; chiamalo Vecchio 1.
NOTA: La massa di Old 1 era di 42,3 mg in questo protocollo. - Vecchio campione 2: Estrarre il campione di mosca ucciso dall'acetato di etile e conservato in una provetta da centrifuga per 2 anni in contenimento ermetico, al riparo dalla luce a temperatura ambiente. Pesa e chiamalo Vecchio 2.
- Campioni freschi: Mettere tre campioni di mosche raccolti in fiale di gas dopo averle uccise con acetato di etile. Pesare e denominare i campioni come Fresh 1, Fresh 2 e Fresh 3 e utilizzarli immediatamente negli esperimenti.
- Preparazione prima dell'estrazione
- Aggiungere una piccola quantità di azoto liquido per raffreddare un contenitore di acciaio inossidabile; Attendere che tutto l'azoto liquido sia evaporato.
- Metti un campione di mosca nel contenitore; Versare lentamente l'azoto liquido per evitare che l'azoto liquido schizzi e colpisca il campione di insetto.
- Congelare i campioni in azoto liquido. Rimuovere i campioni dopo che l'azoto liquido è evaporato.
- Separare il torace singolarmente, metterlo in una provetta da centrifuga da 2 ml e tagliarlo a fette il più piccole possibile.
NOTA: Tagliare il campione in piccoli pezzi in modo che possa essere completamente tagliato e il DNA possa essere rilasciato in grandi quantità. - Ripetere i passaggi precedenti per ogni mosca, congelare singolarmente e quindi rimuoverla in una nuova provetta da centrifuga per prevenire la contaminazione incrociata del DNA.
2. Estrazione del DNA
NOTA: Tutte le fasi di centrifugazione devono essere eseguite a temperatura ambiente (15-25 °C) in una microcentrifuga. Tutti i passaggi devono essere eseguiti nel rigoroso rispetto dei principi dell'asepsi e per evitare la contaminazione incrociata.
- Lisi tissutale
- Aggiungere 180 μl di tampone per lisi tissutale a una provetta da centrifuga da 2 mL contenente un campione clippato.
- Aggiungere 20 μl di proteinasi K. Mescolare accuratamente agitando a 3 000 giri/min per 10 s e incubare a 56 °C fino a quando i tessuti degli insetti non sono completamente lisati.
NOTA: Aggiungere più proteinasi K se il tessuto non è completamente digerito. La lisi è solitamente completa in 1-3 ore, inoltre può prolungare il tempo di lisi durante la notte.
- Precipitazione del DNA
- Vortice a 3.000 giri/min per 15 s. Aggiungere 200 μL di tampone di lisi al campione e mescolare accuratamente agitando a 3.000 giri/min per 15 s.
- Aggiungere 200 μl di etanolo (96-100%) e mescolare nuovamente accuratamente vorticando a 3.000 giri/min per 15 s.
NOTA: Il tampone di lisi e l'etanolo possono essere preaggiunti insieme in un unico passaggio per risparmiare tempo. Un precipitato bianco può formarsi con l'aggiunta di tampone di lisi ed etanolo.
- Inserire la miscela nella colonna di adsorbimento del DNA posta in una provetta di raccolta da 2 mL. Centrifugare a 6.000 × g per 1 min. Scartare il flusso di passaggio e la provetta di raccolta.
- Posizionare la colonna di adsorbimento del DNA della fase precedente in una nuova provetta di raccolta da 2 mL, aggiungere 500 μl di tampone per la rimozione delle proteine e centrifugare a 6.000 × g per 1 minuto. Scartare il flusso di passaggio e la provetta di raccolta.
- Trasferire la colonna di adsorbimento del DNA in una nuova provetta di raccolta da 2 mL, aggiungere 500 μl di tampone di desalinizzazione e centrifugare a 20.000 × g per 3 minuti per asciugare la membrana della colonna di adsorbimento del DNA. Scartare il flusso di passaggio e la provetta di raccolta.
NOTA: Questa fase di centrifugazione garantisce la rimozione di eventuali residui di etanolo prima della successiva eluizione. In caso di riporto di etanolo, centrifugare nuovamente a 20.000 × g per 1 minuto. - Posizionare la colonna di adsorbimento del DNA in una provetta da microcentrifuga pulita da 2 mL, pipettare direttamente 100 μl di tampone di eluizione del DNA sulla membrana della colonna, incubare a temperatura ambiente per 1 minuto e quindi centrifugare a 6.000 × g per 1 minuto per eluire.
NOTA: L'eluizione con 100 μL (invece di 200 μL) aumenta la concentrazione finale di DNA nell'eluato, ma diminuisce anche la resa complessiva del DNA. Per massimizzare la resa del DNA, ripetere l'eluizione una volta come descritto al punto 2.8. - Conservare i campioni di DNA a 4 °C (fino a 1 settimana) o -80 °C per la conservazione a lungo termine.
3. Rilevamento della concentrazione di DNA
- Determinare i valori di OD 260 e OD 280 per confrontare la purezza del DNA e la concentrazione di acido nucleico mediante lettore di micropiastre. Ripetere tre volte su ogni campione.
- Determinare la concentrazione del DNA estratto mediante fluorimetro utilizzando il kit complementare, con tre repliche per ogni campione.
- Prelevare 190 μL di soluzione di lavoro in due provette da centrifuga da 0,5 mL, prelevare 10 μL ciascuno di Standard #1 e Standard #2, aggiungerli alle soluzioni di lavoro e tenerli al riparo dalla luce per non meno di 15 minuti.
NOTA: Lo standard #1 e lo standard #2 sono accuratamente calibrati per una certa concentrazione di DNA. Le soluzioni standard devono essere configurate accuratamente per garantire la formazione di una curva standard accurata. Lo standard #1 è un campione di DNA a doppio filamento (dsDNA) da 0,2 ng/μL; lo standard #2 è di 2.000 ng/μL. La soluzione funzionante è un colorante che si lega specificamente al dsDNA. - Prelevare 2 μL di DNA in esame e mescolarlo con 198 μL di soluzione di lavoro in una provetta da centrifuga da 0,5 mL e tenerlo lontano dalla luce per non meno di 15 minuti.
NOTA: Se la concentrazione di DNA è bassa, aggiungere 5 μL di DNA di prova con 195 μL di soluzione di lavoro. - Dopo 15 minuti, accendere lo strumento e selezionare Misurazione della concentrazione di dsDNA | Lungo raggio. Innanzitutto, testare lo standard #1 e poi lo standard #2 per ottenere la curva standard.
NOTA: La soluzione standard deve essere utilizzata lo stesso giorno successivo alla configurazione; Lasciarlo troppo a lungo comporterà un grosso errore nella curva standard. - Posizionare i campioni da analizzare nei pozzetti del saggio uno per uno, regolare il volume di picco del DNA a 2 μl, ripetere la misurazione tre volte, prendere il valore medio e registrare.
- Prelevare 190 μL di soluzione di lavoro in due provette da centrifuga da 0,5 mL, prelevare 10 μL ciascuno di Standard #1 e Standard #2, aggiungerli alle soluzioni di lavoro e tenerli al riparo dalla luce per non meno di 15 minuti.
4. PCR e rilevamento elettroforetico
NOTA: La sequenza del gene CO 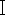 mitocondriale con una lunghezza di 278 bp è stata prelevata per l'amplificazione PCR con il primer diretto C1-J-2495: CAGCTACTTTATGAGCTTTAGG e il primer inverso C1-N-2800: CATTTCAAGCTGTGTAAGCATC8, e quindi è stata eseguita l'elettroforesi su gel di agarosio al 2% per verificare l'effetto di amplificazione e la lunghezza dei prodotti di amplificazione.
mitocondriale con una lunghezza di 278 bp è stata prelevata per l'amplificazione PCR con il primer diretto C1-J-2495: CAGCTACTTTATGAGCTTTAGG e il primer inverso C1-N-2800: CATTTCAAGCTGTGTAAGCATC8, e quindi è stata eseguita l'elettroforesi su gel di agarosio al 2% per verificare l'effetto di amplificazione e la lunghezza dei prodotti di amplificazione.
- Impostare 20 μL del sistema di amplificazione PCR aggiungendo 10 μL di miscela 2x Taq, 1 μL di ciascun primer, 5 μL di ddH2O e 3 μL di DNA stampo; Mescolare bene per 10 s in una centrifuga.
- Utilizzare i seguenti parametri del ciclo PCR: predenaturazione 95 °C per 10 min; denaturazione 95 °C per 30 s, ricottura 48 °C per 30 s, prolunga 72 °C per 45 s per un totale di 40 cicli; e prolungamento finale 72 °C per 10 min.
- Sottoporre i prodotti dopo la PCR all'elettroforesi su gel di agarosio al 2% e, dopo l'elettroforesi, posizionarli su un sistema di imaging su gel per l'analisi fotografica.
Risultati
Abbiamo utilizzato un lettore di micropiastre per misurare i valori di OD260 e OD280 della soluzione di DNA estratta e quindi abbiamo ottenuto i valori OD260/OD280 per valutare la purezza del DNA. L'OD260/OD280 di tutti i campioni freschi e del vecchio campione 1 era maggiore di 2. L'OD260/OD280 del vecchio campione 2 aveva un valore massimo di 2,187 anche se la media era 1,753 e le sue tre misurazioni fluttuavano notevolmente a causa dei piccoli valori (≤0,01) sia del suo OD280 che dell'OD280 (Tabella 1
Discussione
L'estrazione del DNA è l'anello più critico nell'identificazione molecolare delle mosche necrofile e il suo metodo di estrazione e la qualità del DNA estratto influenzano direttamente la successiva rilevazione. In questo esperimento, abbiamo estratto con successo il DNA dalle mosche necrofile utilizzando un comune kit di sangue, senza la necessità di acquistare uno speciale kit di estrazione del DNA degli insetti, che rende l'estrazione del DNA degli insetti più facile da realizzare.
La s...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è supportato dalla National Natural Science Foundation of China (82060341,81560304) e dall'Academician Innovation Platform Scientific Research Project della provincia di Hainan (YSPTZX202134).
Materiali
| Name | Company | Catalog Number | Comments |
| Buffer AE | Qiagen | 172026832 | DNA elution buffer |
| Buffer AL | Qiagen | 172028374 | lysis buffer |
| Buffer ATL | Qiagen | 172028162 | tissue lysis buffer |
| Buffer AW1 | Qiagen | 172028760 | protein removal buffer |
| Buffer AW2 | Qiagen | 57203108 | desalination buffer |
| C1-J-2495 | Taihe Biotechnology | TW21109216 | forword primer |
| C1-N-2800 | Taihe Biotechnology | TW21109217 | reverse primer |
| D2000 DNA ladder | Real-Times(Beijing) Biotechnology | RTM415 | Measure the position of electrophoretic bands |
| DNeasy Mini spin column | Qiagen | 166050343 | DNA adsorption column |
| Dry Bath Incubator | Miulab | DKT200-2D | used for heating |
| MIX-30S Mini Mixer | Miulab | MUC881206 | oscillatory action |
| Proteinase K | Qiagen | 172026218 | Inactivation of intracellular nucleases and other proteins |
| Qubit 3.0 Fluorometer | Thermo Fisher Scientific | 2321611188 | |
| Speed Micro-Centrifuge | Scilogex | 9013001121 | centrifuge |
| Standard#1 | Thermo Fisher Scientific | 2342797 | |
| Standard#2 | Thermo Fisher Scientific | 2342797 | |
| Tanon 3500R Gel Imager | Tanon | 16T5553R-455 | gel imaging |
| Taq Mix Pro | Monad | 00007808-140534 | PCR Mix |
| Taq Mix Pro | Monad | 00007808-140534 | PCR Mix |
| Thermo Cycler | Zhuhai Hema | VRB020A | ordinary PCR |
| Working Solution | Thermo Fisher Scientific | 2342797 |
Riferimenti
- Amendt, J., Richards, C. S., Campobasso, C. P., Zehner, R., Hall, M. J. Forensic entomology: applications and limitations. Forensic Sci Med Pathol. 7 (4), 379-392 (2011).
- Wydra, J., Matuszewski, S. The optimal post-eclosion interval while estimating the post-mortem interval based on an empty puparium. Forensic Sci Med Pathol. 17 (2), 192-198 (2021).
- Mazzanti, M., Alessandrini, F., Tagliabracci, A., Wells, J. D., Campobasso, C. P. DNA degradation and genetic analysis of empty puparia: genetic identification limits in forensic entomology. Forensic Sci Int. 195 (1-3), 99-102 (2010).
- Odeniran, P. O., et al. molecular identification and distribution of Trypanosome-transmitting Dipterans from cattle settlements in Southwest Nigeria. Acta Parasitol. 66 (1), 116-128 (2021).
- Wells, J. D., Stevens, J. R. Application of DNA-based methods in forensic entomology. Annu Rev Entomol. 53, 103-120 (2008).
- Kotrba, M., et al. DNA barcoding in forensic entomology-establishing a DNA reference library of potentially forensic relevant arthropod species. J Forensic Sci. 64 (2), 593-601 (2019).
- Weedon, M. N., et al. Use of SNP chips to detect rare pathogenic variants: Retrospective, population based diagnostic evaluation. BMJ. 372, 214 (2021).
- Cai, J. -. F., et al. The availability of mitochondrial DNA cytochrome oxidasegene for the distinction of forensically important flies in China. Acta Entomologica Sinica. 48 (3), 380-385 (2005).
- Khayrova, A., Lopatin, S., Varlamov, V. Obtaining chitin, chitosan and their melanin complexes from insects. Int J Biol Macromol. 167, 1319-1328 (2021).
- Guo, Y. Q., et al. Comparison of three DNA extracting methods from different parts of common necrophagous flies. J Henan Univ Sci Tech (Med Sci). 36 (02), 130-133 (2018).
- Du, H., Xie, H., Ma, M., Igarashi, Y., Luo, F. Modified methods obtain high-quality DNA and RNA from anaerobic activated sludge at a wide range of temperatures. J Microbiol Methods. 199, 106532 (2022).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J Vis Exp. (48), e2699 (2011).
- Masago, K., et al. Comparison between fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of DNA and RNA extracted from frozen and FFPE tissues from lung cancer patients: A real-world use of genomic tests. Medicina (Kaunas). 57 (12), 1375 (2021).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clin Chim Acta. 479, 14-19 (2018).
- Adams, Z. J., Hall, M. J. Methods used for the killing and preservation of blowfly larvae, and their effect on post-mortem larval length. Forensic Sci Int. 138 (1-3), 50-61 (2003).
- Fliegerova, K., et al. Effect of DNA extraction and sample preservation method on rumen bacterial population. Anaerobe. 29, 80-84 (2014).
- Rodrigues, B. L., Galati, E. A. B. Molecular taxonomy of phlebotomine sand flies (Diptera, Psychodidae) with emphasis on DNA barcoding: A review. Acta Trop. 238, 106778 (2023).
Erratum
Formal Correction: Erratum: DNA Extraction and Comparison Between Old and Fresh Necrophilic Fly Samples
Posted by JoVE Editors on 8/12/2024. Citeable Link.
This corrects the article 10.3791/66737
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon