A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיצוי DNA והשוואה בין דגימות זבוב נקרופילי ישן וטרי
* These authors contributed equally
In This Article
Erratum Notice
Summary
מאמר זה מתאר פרוטוקול למיצוי DNA של זבוב נקרופילי טרי וישן באמצעות ערכת מיצוי DNA משותפת שונה.
Abstract
בסך הכל נבחרו חמש דגימות של Chrysomya megacephala - שלוש דגימות טריות, דגימה אחת שאוחסנה באלכוהול במשך שנתיים, ודגימה אחת שאוחסנה באחסון אטום יבש במשך שנתיים המוגנת מפני אור בלבד - כדי לחקור אם ערכת מיצוי DNA בדם יכולה להפיק DNA מזבובים נקרופיליים ולקבוע אם אלכוהול יכול להאריך את שימור הדנ"א של זבובים נקרופיליים. ראשית, ערכת מיצוי הדנ"א בדם שימשה להפקת דנ"א מרקמות בית החזה שלהם. לאחר מכן, טוהר הדנ"א וריכוזו נבדקו באמצעות קורא מיקרו-צלחות ופלואורומטר. לבסוף, הגברה PCR ואלקטרופורזה של הדנ"א שחולץ נעשו עם פריימרים ספציפיים לזבוב נקרופילי הממוקם ברצף הגן CO I המיטוכונדריאלי. התוצאות הראו כי טוהר הדנ"א של כל הדגימות היה גדול מ-2.0. ריכוז הדנ"א נצפה בסדר הבא: דגימות טריות > דגימות ישנות שהשתמרו באלכוהול > דגימות ישנות שלא טופלו. לכל הדגימות היו רצועות אלקטרופורטיות ספציפיות לאחר הגברה של PCR. לסיכום, ניתן להשתמש בערכת מיצוי DNA בדם כדי לחלץ דנ"א מזבובים נקרופיליים בהצלחה, וריכוז הדנ"א של דגימות זבובים טריים גדול מזה של דגימות זבובים ישנים. הזבובים יכולים להיות מאוחסנים באלכוהול במשך זמן רב.
Introduction
היקש זמן המוות היה מאז ומתמיד אחד הנושאים המרכזיים והקשים לפתרון בפרקטיקה השיפוטית. בפרקטיקה של מדע פורנזי, עבור תיק פלילי, קביעת מרווח לאחר המוות משחקת תפקיד מכריע בהסקת זמן הפשע, נעילת החשוד וצמצום היקף החקירה. שיטות מסורתיות להסיק את זמן המוות מבוססות בעיקר על תופעות מוקדמות לאחר המוות, אשר בדרך כלל ניתן להשתמש בהן רק כדי להסיק את זמן המוות בתוך 24 שעות. עם זאת, זמן המוות הארוך אינו יכול להיקבע על ידי תופעות שלאחר המוות. כיום מקובל בקהילת המדע הפורנזי כי לאנטומולוגיה משפטית יש פוטנציאל להיות שיטה יעילה להסיק זמן מוות ארוך יותר.
חרקים נקרופגיים נקראים על שם הזחלים שלהם הניזונים מגוויות. ביניהם, בכל פעם שיש גופה, הזבובים הנקרופיליים הבוגרים יהיו הראשונים להגיע לגופה ולהטיל את ביציהם או זחליהם. הזחלים ניזונים מרקמת הגופה ומבשילים לגלמים, המתגלגלים לבוגרים. זבובים נקרופיליים ממלאים תפקיד עצום בפועל של מדע פורנזי בגלל מחזור החיים הרגיל שלהם ותפוצה גיאוגרפית, למשל, ניכוי זמן המוות וקביעת מקום המוות 1,2. עם זאת, המחסום לשימוש בזבובים נקרופיליים בפרקטיקה משפטית הוא זיהוי מינים. שיטות מורפולוגיות עדיין משמשות כשיטה המוסמכת לזיהוי מינים של זבובים נקרופיליים. עם זאת, זיהוי מינים מורפולוגיים דורש רמה גבוהה של שלמות חרקים. אם הזבובים היו בשלבי התפתחות שונים, או עקב שינויים מורפולוגיים שנגרמו כתוצאה מבחירות סביבתיות, כל אלה מקשים על הבדיקה המורפולוגית. בפרט, המורפולוגיה של גלמים וקליפות גולמים, אשר נמצאים לרוב בזירת הפשע, בקושי ניתן לזיהוי. עובדה זו, יחד עם מיעוטם של מומחים מורפולוגיים, מקשה מאוד על זיהוי המינים מבחינה מורפולוגית. לכן, התפתחה שיטת הביולוגיה המולקולרית לזיהוי מינים של זבובים, המפחיתה את הקושי בזיהוי מורפולוגי ואינה תלויה בשלב ההתפתחותי 3,4,5,6,7.
הצעד הראשון בזיהוי מינים של זבובים נקרופיליים המבוסס על שיטות ביולוגיה מולקולרית הוא מיצוי יעיל של DNA, בעוד ערכות מיוחדות למיצוי DNA של חרקים אינן זמינות כיום בדרך כלל. וכיצד להשתמש בערכות דם נפוצות למיצוי DNA של זבובים נקרופיליים הופך רלוונטי יותר מבחינה משפטית. זבובים נקרופיליים שנמצאו בזירות פשע מושחתים לעתים קרובות או עברו ריקבון והשפלת DNA. דגימות זבובים אינן זמינות באופן מיידי למיצוי DNA לאחר הרכישה, או במידת האפשר, יש לשמור דגימות שלמות עקב דרישות שימור ראיות. בהתבסס על הדרישות לעיל, במחקר זה, יישמנו את ערכת הדנ"א של הדם המבוססת על עיכול פרוטאינאז K, ובחרנו שלוש דגימות טריות של Chrysomya megacephala (Diptera, Lepidoptera) (איור 1), דגימה ישנה אחת של C. megacephala שהושמה באלכוהול במשך שנתיים, ודגימה אחת של C. megacephala שהושמה באחסון מוגן אור במשך שנתיים, שקלנו כל אחת מחמש הדגימות, בחר את רקמת בית החזה של החרק למיצוי DNA. השוואת האיכות והטוהר של הדנ"א שהופק מהדגימות הישנות והחדשות, הגברה PCR ואלקטרופורזה של הדנ"א שחולץ בוצעו באמצעות פריימרים ספציפיים לזבוב נקרופילי הממוקמים ברצף הגן CO 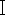 מיטוכונדריאלי.
מיטוכונדריאלי.
Protocol
הערה: בפרוטוקול זה נעשה שימוש בסך הכל בחמש דגימות של C. megacephala – שלוש דגימות טריות (Fresh 1, Fresh 2 ו-Fresh 3), דגימה אחת שאוחסנה באלכוהול במשך שנתיים (Old 1), ודגימה אחת שאוחסנה באחסון יבש אטום למשך שנתיים כשהיא מוגנת מפני אור בלבד (Old 2). הדגימות חייבות להיות מסומנות בהתאם לדרישות הניסוי.
1. אחסון דגימות כללי והכנות
- בחירת דוגמאות והכנתן
הערה: הקפד לעבוד במכסה האדים בעת מריחת אתיל אצטט לביצוע זבובים נקרופגיים. הסר את הנוזל מפני השטח של הזבוב לפני השקילה.- דגימות טריות: הניחו שלוש דגימות זבובים שנאספו בבקבוקוני גז לאחר שהרגו אותן עם אתיל אצטט. שקלו וקראו לדגימות בשם Fresh 1, Fresh 2 ו-Fresh 3 והשתמשו בהן מיד בניסויים.
הערה: דגימות הזבוב הטרי בפרוטוקול זה היו בעלות מסות של 56.8 מ"ג, 49.3 מ"ג ו-52.1 מ"ג. - דוגמה ישנה 1: הוציאו דגימות זבובים שנהרגו על ידי אתיל אצטט ואוחסנו בצינורות צנטריפוגות מלאות אלכוהול במשך שנתיים בהכלה אטומה, מוגנות מפני אור בטמפרטורת החדר. לשקול את המדגם לאחר ספיגת נוזל פני השטח עם נייר מסנן; תקראו לזה ישן 1.
הערה: המסה של Old 1 הייתה 42.3 מ"ג בפרוטוקול זה. - דגימה ישנה 2: הוציאו את דגימת הזבוב שנהרגה על ידי אתיל אצטט ואוחסנו בצינור צנטריפוגה במשך שנתיים בהכלה אטומה, מוגנת מפני אור בטמפרטורת החדר. לשקול ולקרוא לזה ישן 2.
- דגימות טריות: הניחו שלוש דגימות זבובים שנאספו בבקבוקוני גז לאחר שהרגו אותן עם אתיל אצטט. שקלו וקראו לדגימות בשם Fresh 1, Fresh 2 ו-Fresh 3 והשתמשו בהן מיד בניסויים.
- הכנה לפני מיצוי
- מוסיפים כמות קטנה של חנקן נוזלי כדי לקרר מיכל נירוסטה; המתן עד שכל החנקן הנוזלי יתאדה.
- שים מדגם זבוב במיכל; שפכו פנימה את החנקן הנוזלי באיטיות כדי למנוע מהחנקן הנוזלי להתיז ולהשפיע על דגימת החרק.
- מקפיאים את הדגימות בחנקן נוזלי. הסר דגימות לאחר שהחנקן הנוזלי מתאדה.
- מפרידים את בית החזה בנפרד, מניחים בצינור צנטריפוגה של 2 מ"ל וחותכים לפרוסות הקטנות ביותר האפשריות.
הערה: חתכו את הדגימה לחתיכות קטנות כדי שניתן יהיה לבקע אותה במלואה, וניתן יהיה לשחרר דנ"א בכמויות גדולות. - חזור על השלבים לעיל עבור כל זבוב, הקפא בנפרד, ולאחר מכן הסר לצינור צנטריפוגה חדש כדי למנוע זיהום צולב DNA.
2. מיצוי DNA
הערה: כל שלבי הצנטריפוגה חייבים להתבצע בטמפרטורת החדר (15-25 מעלות צלזיוס) במיקרוצנטריפוגה. כל השלבים חייבים להתבצע תוך הקפדה על עקרונות האספסיס וכדי למנוע זיהום צולב.
- ליזה רקמתית
- הוסף 180 μL של חיץ ליזה רקמות לצינור צנטריפוגה 2 מ"ל המכיל דגימה חתוכה.
- מוסיפים 20 μL של פרוטאינאז K. מערבבים היטב על ידי ערבול ב 3,000 סל"ד במשך 10 שניות ודגרים ב 56 ° C עד רקמות החרק הם lysed לחלוטין.
הערה: להוסיף עוד פרוטאינאז K צריך להיות אם הרקמה אינה מתעכלת במלואה. ליזיס הוא בדרך כלל להשלים בתוך 1-3 שעות, גם יכול להאריך את זמן ליזה בן לילה.
- משקעים DNA
- מערבולת ב-3,000 סל"ד למשך 15 שניות. הוסיפו חיץ ליזה של 200 μL לדגימה, וערבבו היטב על ידי מערבולות ב-3,000 סל"ד במשך 15 שניות.
- מוסיפים 200 μL אתנול (96-100%) ומערבבים שוב ביסודיות על ידי ערבול ב-3,000 סל"ד במשך 15 שניות.
הערה: ניתן לחבר מראש חיץ ליזיס ואתנול יחד בשלב אחד כדי לחסוך זמן. משקע לבן עשוי להיווצר על תוספת של חיץ ליזיס ואתנול.
- יש להכניס את התערובת לעמודת ספיחת הדנ"א הממוקמת בצינור איסוף של 2 מ"ל. צנטריפוגה ב-6,000 × גרם למשך דקה. יש להשליך את הזרימה ואת צינור האיסוף.
- הניחו את עמודת ספיחת הדנ"א מהשלב הקודם בצינור איסוף חדש של 2 מ"ל, הוסיפו 500 מיקרוליטר של חיץ להסרת חלבונים וצנטריפוגה ב-6,000 × גרם למשך דקה אחת. יש להשליך את הזרימה ואת צינור האיסוף.
- מעבירים את עמודת ספיחת הדנ"א לצינור איסוף חדש של 2 מ"ל, מוסיפים 500 מיקרוליטר של חיץ התפלה, וצנטריפוגות ב-20,000 × גרם למשך 3 דקות כדי לייבש את קרום עמודת ספיחה הדנ"א. יש להשליך את הזרימה ואת צינור האיסוף.
הערה: שלב צנטריפוגה זה מבטיח הסרה של כל שאריות אתנול לפני ההדבקה הבאה. אם יש סחבת כלשהי של אתנול, צנטריפוגה שוב ב 20,000 × גרם למשך דקה אחת. - מניחים את עמודת ספיחת הדנ"א בצינור מיקרוצנטריפוגה נקי של 2 מ"ל, מזרימים ישירות 100 מיקרוליטר של חיץ אלוציית DNA על קרום העמודה, דוגרים בטמפרטורת החדר למשך דקה אחת, ואז צנטריפוגה ב 6,000 × גרם למשך דקה אחת כדי ללוטש.
הערה: Elution עם 100 μL (במקום 200 μL) מגדיל את ריכוז ה- DNA הסופי ב- eluate אך גם מקטין את תפוקת ה- DNA הכוללת. כדי למקסם את תפוקת הדנ"א, חזור על ההדחה פעם אחת כמתואר בשלב 2.8. - אחסנו את דגימות הדנ"א בטמפרטורה של 4°C (עד שבוע) או -80°C לאחסון לטווח ארוך.
3. זיהוי ריכוז DNA
- קבע את הערכים של OD 260 ו- OD 280 כדי להשוות את טוהר ה- DNA וריכוז חומצות הגרעין באמצעות קורא מיקרו-צלחות. חזור על הפעולה שלוש פעמים בכל דגימה.
- קבע את ריכוז הדנ"א המופק על ידי פלואורומטר באמצעות הערכה הנלווית לו, עם שלושה עותקים משוכפלים לכל דגימה.
- קח 190 μL של פתרון עבודה לתוך שני צינורות צנטריפוגות 0.5 מ"ל, לקחת 10 μL כל אחד של תקן #1 ותקן #2, להוסיף אותם פתרונות עבודה, ולהרחיק אותם מאור במשך לא פחות מ 15 דקות.
הערה: תקן #1 ותקן #2 מכוילים במדויק עבור ריכוז מסוים של DNA. פתרונות סטנדרטיים צריכים להיות מוגדרים במדויק כדי להבטיח היווצרות של עקומה סטנדרטית מדויקת. תקן #1 הוא דגימת DNA דו-גדילי (dsDNA) בגודל 0.2 ng/μL; תקן #2 הוא 2,000 ננוגרם/מיקרוליטר. פתרון העבודה הוא צבע שנקשר במיוחד ל- dsDNA. - קח 2 μL של DNA הבדיקה וערבב אותו עם 198 μL של פתרון עבודה בצינור צנטריפוגה 0.5 מ"ל, ולשמור הרחק מאור במשך לא פחות מ 15 דקות.
הערה: אם ריכוז הדנ"א נמוך, הוסף 5 μL של DNA בדיקה עם 195 μL של פתרון עבודה. - לאחר 15 דקות, הפעל את המכשיר ובחר מדידת ריכוז dsDNA | טווח ארוך. ראשית, בדוק תקן #1, ולאחר מכן, תקן #2 כדי להשיג את העקומה הסטנדרטית.
הערה: יש להשתמש בפתרון הסטנדרטי באותו יום לאחר הגדרתו; השארתו למשך זמן רב מדי תגרום לשגיאה גדולה בעקומה הסטנדרטית. - הניחו את הדגימות לבדיקה בבארות הבדיקה בזו אחר זו, התאימו את נפח זינוק הדנ"א ל-2 מיקרוליטר, חזרו על המדידה שלוש פעמים, קחו את הערך הממוצע ורשמו.
- קח 190 μL של פתרון עבודה לתוך שני צינורות צנטריפוגות 0.5 מ"ל, לקחת 10 μL כל אחד של תקן #1 ותקן #2, להוסיף אותם פתרונות עבודה, ולהרחיק אותם מאור במשך לא פחות מ 15 דקות.
4. PCR וזיהוי אלקטרופורטי
הערה: רצף הגן CO 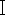 מיטוכונדריאלי באורך של 278 bp נלקח להגברת PCR עם פריימר קדמי C1-J-2495: CAGCTACTTTATGAGCTTTAGG, ופריימר הפוך C1-N-2800: CATTTCAAGCTGTGTAAGCATC8, ולאחר מכן 2% אלקטרופורזה ג'ל אגרוז נעשה כדי לאמת את אפקט ההגברה ואת אורך מוצרי ההגברה אומת.
מיטוכונדריאלי באורך של 278 bp נלקח להגברת PCR עם פריימר קדמי C1-J-2495: CAGCTACTTTATGAGCTTTAGG, ופריימר הפוך C1-N-2800: CATTTCAAGCTGTGTAAGCATC8, ולאחר מכן 2% אלקטרופורזה ג'ל אגרוז נעשה כדי לאמת את אפקט ההגברה ואת אורך מוצרי ההגברה אומת.
- הגדר 20 μL של מערכת הגברה PCR על ידי הוספת 10 μL של 2x תערובת Taq, 1 μL של כל פריימר, 5 μL של ddH2O, ו 3 μL של DNA תבנית; מערבבים היטב 10 שניות בצנטריפוגה.
- השתמש בפרמטרים הבאים של מחזור PCR: predenaturation 95 °C למשך 10 דקות; דנטורציה 95 ° C עבור 30 שניות, חישול 48 ° C עבור 30 שניות, הארכה 72 ° C עבור 45 s עבור סך של 40 מחזורים; והארכה סופית 72°C למשך 10 דקות.
- יש להעביר את המוצרים לאחר PCR לאלקטרופורזה של ג'ל אגרוז 2%, ולאחר אלקטרופורזה, להניח אותם על מערכת הדמיה ג'ל לניתוח תמונות.
תוצאות
השתמשנו בקורא מיקרו-צלחות כדי למדוד את הערכים של OD260 ו-OD280 של תמיסת הדנ"א שחולצה, ולאחר מכן קיבלנו את ערכי OD260/OD280 כדי להעריך את טוהר הדנ"א. OD260/OD280 של כל הדגימות הטריות והמדגם הישן 1 היה גדול מ- 2. הערך המרבי של OD260/OD280 של מדגם 2 הישן היה 2.187 למרות שהממוצע היה 1.753, ושלוש המדידות שלו השתנו מאוד בגלל הער...
Discussion
מיצוי DNA הוא החוליה הקריטית ביותר בזיהוי מולקולרי של זבובים נקרופיליים, ושיטת המיצוי שלו ואיכות הדנ"א המופק משפיעים ישירות על הגילוי לאחר מכן. בניסוי זה חילצנו בהצלחה דנ"א מזבובים נקרופיליים באמצעות ערכת דם נפוצה, ללא צורך ברכישת ערכת מיצוי דנ"א מיוחדת של חרקים, מה שמקל על מיצוי דנ"א של חרקי...
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכת על ידי הקרן הלאומית למדעי הטבע של סין (82060341,81560304) ועל ידי פרויקט המחקר המדעי של פלטפורמת החדשנות האקדמית של מחוז האינאן (YSPTZX202134).
Materials
| Name | Company | Catalog Number | Comments |
| Buffer AE | Qiagen | 172026832 | DNA elution buffer |
| Buffer AL | Qiagen | 172028374 | lysis buffer |
| Buffer ATL | Qiagen | 172028162 | tissue lysis buffer |
| Buffer AW1 | Qiagen | 172028760 | protein removal buffer |
| Buffer AW2 | Qiagen | 57203108 | desalination buffer |
| C1-J-2495 | Taihe Biotechnology | TW21109216 | forword primer |
| C1-N-2800 | Taihe Biotechnology | TW21109217 | reverse primer |
| D2000 DNA ladder | Real-Times(Beijing) Biotechnology | RTM415 | Measure the position of electrophoretic bands |
| DNeasy Mini spin column | Qiagen | 166050343 | DNA adsorption column |
| Dry Bath Incubator | Miulab | DKT200-2D | used for heating |
| MIX-30S Mini Mixer | Miulab | MUC881206 | oscillatory action |
| Proteinase K | Qiagen | 172026218 | Inactivation of intracellular nucleases and other proteins |
| Qubit 3.0 Fluorometer | Thermo Fisher Scientific | 2321611188 | |
| Speed Micro-Centrifuge | Scilogex | 9013001121 | centrifuge |
| Standard#1 | Thermo Fisher Scientific | 2342797 | |
| Standard#2 | Thermo Fisher Scientific | 2342797 | |
| Tanon 3500R Gel Imager | Tanon | 16T5553R-455 | gel imaging |
| Taq Mix Pro | Monad | 00007808-140534 | PCR Mix |
| Taq Mix Pro | Monad | 00007808-140534 | PCR Mix |
| Thermo Cycler | Zhuhai Hema | VRB020A | ordinary PCR |
| Working Solution | Thermo Fisher Scientific | 2342797 |
References
- Amendt, J., Richards, C. S., Campobasso, C. P., Zehner, R., Hall, M. J. Forensic entomology: applications and limitations. Forensic Sci Med Pathol. 7 (4), 379-392 (2011).
- Wydra, J., Matuszewski, S. The optimal post-eclosion interval while estimating the post-mortem interval based on an empty puparium. Forensic Sci Med Pathol. 17 (2), 192-198 (2021).
- Mazzanti, M., Alessandrini, F., Tagliabracci, A., Wells, J. D., Campobasso, C. P. DNA degradation and genetic analysis of empty puparia: genetic identification limits in forensic entomology. Forensic Sci Int. 195 (1-3), 99-102 (2010).
- Odeniran, P. O., et al. molecular identification and distribution of Trypanosome-transmitting Dipterans from cattle settlements in Southwest Nigeria. Acta Parasitol. 66 (1), 116-128 (2021).
- Wells, J. D., Stevens, J. R. Application of DNA-based methods in forensic entomology. Annu Rev Entomol. 53, 103-120 (2008).
- Kotrba, M., et al. DNA barcoding in forensic entomology-establishing a DNA reference library of potentially forensic relevant arthropod species. J Forensic Sci. 64 (2), 593-601 (2019).
- Weedon, M. N., et al. Use of SNP chips to detect rare pathogenic variants: Retrospective, population based diagnostic evaluation. BMJ. 372, 214 (2021).
- Cai, J. -. F., et al. The availability of mitochondrial DNA cytochrome oxidasegene for the distinction of forensically important flies in China. Acta Entomologica Sinica. 48 (3), 380-385 (2005).
- Khayrova, A., Lopatin, S., Varlamov, V. Obtaining chitin, chitosan and their melanin complexes from insects. Int J Biol Macromol. 167, 1319-1328 (2021).
- Guo, Y. Q., et al. Comparison of three DNA extracting methods from different parts of common necrophagous flies. J Henan Univ Sci Tech (Med Sci). 36 (02), 130-133 (2018).
- Du, H., Xie, H., Ma, M., Igarashi, Y., Luo, F. Modified methods obtain high-quality DNA and RNA from anaerobic activated sludge at a wide range of temperatures. J Microbiol Methods. 199, 106532 (2022).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J Vis Exp. (48), e2699 (2011).
- Masago, K., et al. Comparison between fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of DNA and RNA extracted from frozen and FFPE tissues from lung cancer patients: A real-world use of genomic tests. Medicina (Kaunas). 57 (12), 1375 (2021).
- Ponti, G., et al. The value of fluorimetry (Qubit) and spectrophotometry (NanoDrop) in the quantification of cell-free DNA (cfDNA) in malignant melanoma and prostate cancer patients. Clin Chim Acta. 479, 14-19 (2018).
- Adams, Z. J., Hall, M. J. Methods used for the killing and preservation of blowfly larvae, and their effect on post-mortem larval length. Forensic Sci Int. 138 (1-3), 50-61 (2003).
- Fliegerova, K., et al. Effect of DNA extraction and sample preservation method on rumen bacterial population. Anaerobe. 29, 80-84 (2014).
- Rodrigues, B. L., Galati, E. A. B. Molecular taxonomy of phlebotomine sand flies (Diptera, Psychodidae) with emphasis on DNA barcoding: A review. Acta Trop. 238, 106778 (2023).
Erratum
Formal Correction: Erratum: DNA Extraction and Comparison Between Old and Fresh Necrophilic Fly Samples
Posted by JoVE Editors on 8/12/2024. Citeable Link.
This corrects the article 10.3791/66737
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved