Method Article
تشخيص داء بعد الوفاة في عن طريق مقايسة تفاعل البوليميراز المتسلسل للنسخ العكسي في الوقت الحقيقي LN34 المحدث والمضاعف
In This Article
Summary
يوضح هذا البروتوكول مقايسة تفاعل البوليميراز المتسلسل للنسخ العكسي في الوقت الفعلي (RT-PCR) لفيروس lysssavirus LN34 من جمع الأنسجة إلى تفسير النتائج ، بما في ذلك تحديثات التسلسلات والتركيبات الأولية لتحسين أداء الفحص لبعض فيروسات ليسا واللاجومورف غير داء. نوضح أيضا إعداد الفحص لتنسيق LN34 متعدد الإرسال أحادي البئر (LN34M).
Abstract
داء هو مرض حيواني المنشأ قاتل يسببه داء بفيروس Lyssa (RABV) وفيروسات الحمض النووي الريبي السلبية ذات الصلة من جنس Lyssavirus (عائلة Rhabdoviridae). يستهدف اختبار LN34 المنطقة الرائدة المحفوظة للغاية وجين البروتين النووي لجينوم فيروس lyssa، ويستخدم البادئات المتدهورة ومسبار TaqMan الذي يحتوي على نيوكليوتيدات مقفلة للكشف عن الحمض النووي الريبي عبر جنس Lyssavirus المتنوع. يجب إجراء نتيجة سلبية لداء فقط إذا تم فحص مقطع عرضي كامل لجذع الدماغ وثلاثة فصوص من المخيخ. ومع ذلك ، فإن تحديد الحمض النووي الريبي لفيروس Lyssa في أي نسيج هو تشخيص لعدوى داء. يتم جمع الأنسجة وتجانسها في كاشف TRIzol ، والذي يعطل الفيروس أيضا. يتم إجراء استخراج الحمض النووي الريبي باستخدام مجموعة أدوات استخراج تجارية قائمة على عمود الدوران. يتم تحضير الخلطات الرئيسية في مساحة نظيفة ويتم تقسيسها في صفيحة 96 بئر قبل إضافة عينة من الحمض النووي الريبي. في الإعدادات السريرية ، يتم اختبار كل عينة بواسطة RT-PCR في الوقت الفعلي لوجود الحمض النووي الريبي لفيروس lyssa في ثلاث نسخ ومنفردة للمضيف β -actin mRNA. يتم تضمين عناصر التحكم الإيجابية والسلبية عند الاستخراج وخطوات RT-PCR في الوقت الفعلي للبروتوكول. يتضمن تحليل البيانات الضبط اليدوي للعتبات لتوحيد قيم Ct عبر عمليات تشغيل الأجهزة. يتم تحديد النتائج الإيجابية من خلال وجود تضخيم نموذجي في مقايسة فيروس عموم الحالة (Ct ≤ 35). يتم تحديد النتائج السلبية من خلال عدم وجود تضخيم نموذجي في مقايسة فيروس عموم الحالة والكشف عن المدخل المرسال المضيف β-الأكتين (Ct ≤ 33). يمكن أن تؤدي ملاحظة القيم خارج هذه النطاقات أو فشل عناصر التحكم في الفحص إلى إبطال التشغيل أو يؤدي إلى نتائج غير حاسمة للعينة. يجب اتباع البروتوكول عن كثب لضمان حساسية وخصوصية عالية للمقايس. يمكن أن تؤثر التعديلات الإجرائية على أداء الفحص وتؤدي إلى نتائج إيجابية كاذبة أو سلبية خاطئة أو غير قابلة للتفسير.
Introduction
يصف هذا البروتوكول إجراء الاختبار التشخيصي لداء باستخدام مقايسة تفاعل البوليميراز المتسلسل للنسخ العكسي في الوقت الحقيقي (RT-PCR) LN34 من جمع العينات من خلال تفسير النتيجة. سيتم تقسيم الإجراء إلى ثلاثة أقسام: جمع عينات الدماغ حسب الصلة بمقايسة LN34 (القسم 1) ، واستخراج الحمض النووي الريبي اليدوي المستند إلى العمود باستخدام مجموعة Direct-zol RNA Miniprep (Zymo Research R2051) (القسم 2) ، ومقايسة RT-PCR في الوقت الفعلي LN34 التي تم إعدادها باستخدام مجموعة AgPath-ID One-Step RT-PCR (ThermoFisher Scientific AM1005) (القسم 3). يمكن إجراء استخراج الحمض النووي الريبي و RT-PCR باستخدام منتجات أخرى ، ولكن يجب التحقق من صحة المجموعات قبل الاستخدام لضمان استخراج الحمض النووي الريبي لفيروس Lyssavirus وتضخيمه بشكل مناسب.
يصف القسم 1 جمع أنسجة المخ المناسبة لاستخدامها في اختبار LN34 في الوقت الفعلي RT-PCR. لا يتم تضمين وصف تشريح وقطع الرأس وإزالة الدماغ. قد تحتوي العينات على عوامل معدية. يجب اتباع إجراءات السلامة الأحيائية المفصلة في السلامة البيولوجية في المختبرات الميكروبيولوجية والطبية الحيوية الإصدار السادس1 للتخفيف من المخاطر. يجب اعتبار العينات معدية حتى الانتهاء من التعطيل. يجب إجراء تعطيل الفيروس والتحقق من صحة الفحص في كل مختبر وفقا لمعايير تلك المؤسسة. يجب أن تتبع المختبرات إجراءات السلامة والجودة القياسية التي تحددها مؤسستها عند تنفيذ اختبار تشخيصي جديد.
بناء على ما هو معروف عن انتشار فيروس داء أثناء الإصابة ، فإن جذع الدماغ والمخيخ هما أفضل الأنسجة لتشخيص داء ، ويوصى بهذه الأنسجة لاختبار داء من قبل منظمة الصحة العالمية والمنظمة العالمية لصحة2،3،4،5. نظرا لأن انتشار الفيروس قد يكون من جانب واحد (الشكل 1) ، خاصة في الكبيرة ، يجب فحص مقطع عرضي كامل من جذع الدماغ وثلاثة فصوص من المخيخ بحثا عن استبعاد داء. وبالنسبة للعينات التي لا تستوفي هذه المعايير الدنيا، قد يرفض المختبر العينة باعتبارها غير كافية للاختبار أو يختار الاختبار لأغراض الترصد أو القاعدة. إذا لم يتم استلام الأنسجة المطلوبة ، ولكن اختار المختبر اختبار العينة ، فيجب تفسير نتيجة الاختبار السلبية على أنها غير حاسمة لداء لهذا لأن وجود الحمض النووي الريبي الفيروسي في الأنسجة الأخرى يمكن أن يتأخر أو منخفض الوفرة أو متقطع أو غير موجود. وهناك حاجة إلى جمع العينات المطلوبة أو إجراء اختبارات إضافية لاستبعاد داء في هذه الحالة. ومع ذلك ، فإن تحديد الحمض النووي الريبي لفيروس Lyssa في أي نسيج هو تشخيص لعدوى داء3،6. أمثلة على العينات التي يمكن اختبارها للكشف عن الحمض النووي الريبي لفيروس داء من أجل القاعدة أو المراقبة (ولكن لا تستبعد) عدوى داء هي القشرة والحصين والحبل الشوكي والعينات المتدهورة والجلد واللعاب والقرنية. يجب إجراء تقييم نوعي لحالة كل عينة عند الوصول إلى المختبر. يمكن أن يحافظ التبريد على عينة لمدة 72 ساعة على الأقل ولكن لا ينبغي استخدامه على المدى الطويل. قد تقلل دورات التجميد والذوبان المتكررة من حساسية الاختبار ، ويجب تجنب أكثر من خمس دورات تجميد وذوبان. إذا كانت حالة الأنسجة تمنع التحديد الواثق لهياكل الدماغ ، فيجب تحديد العينة على أنها غير مرضية. في حالة العينة غير المرضية ، لا يزال من الممكن إجراء الاختبار للقضاء على داء (ولكن لا استبعاده). يتم الإبلاغ عن نتائج الاختبار الإيجابية على هذا النحو. يجب الإبلاغ عن النتائج السلبية أو غير الحاسمة على الأنسجة غير المرضية على أنها غير حاسمة لمنع سوء التفسير على أنه تشخيص سلبي.
تم تطوير هذا البروتوكول من الإجراءات المنشورة7،8،9 ويتضمن بادئات محدثة تستهدف منطقة قائد جينوم فيروس الليسا وتسلسل ترميز البروتين النووي. يستهدف المسبار تسلسلا قصيرا ومحفوظا للغاية ويستخدم النيوكليوتيدات المقفلة للسماح بالكشف على نطاق واسع. يكتشف الاختبار الحمض النووي الريبي من فيروسات الليسا المتنوعة بتركيزات متفاوتة8. يوضح هذا البروتوكول الإجراءات المختبرية لإجراء اختبار تفاعل البوليميراز المتسلسل في الوقت الفعلي LN34 ، ولكن الكشف الدقيق والحساس عن الحمض النووي الريبي لفيروس الحالة الليساية يعتمد على عناصر أخرى غير مشمولة في هذا البروتوكول ، مثل تخزين العينات ، وحفظ السجلات ، وتدريب / كفاءة الموظفين ، وتتبع النتائج ، وتفسير النتائج ، وضمان الجودة ، وتدابير سلامة المختبرات ، واستكشاف الأخطاء وإصلاحها. المقايسات القائمة على تفاعل البوليميراز المتسلسل عرضة للتلوث المتبادل بسبب حساسيتها العالية. يمكن تجنب التلوث المتبادل من خلال الالتزام بالممارسات المختبرية الجيدة ، مثل تبديل القفازات بشكل متكرر ، والتعامل مع عينة واحدة في كل مرة ، وتطهير أسطح العمل بعوامل تطهير فعالة بين العينات ، وإبقاء الأنابيب مغلقة وعينات منفصلة عن كواشف تفاعل البوليميراز المتسلسل . يمكن فصل كواشف وعينات تفاعل البوليميراز المتسلسل بسهولة عن طريق استخدام سير عمل أحادي الجانب وفصل مناطق عمل ما قبل التضخيم وما بعد التضخيم. على سبيل المثال ، قم بإعداد خلطات تفاعل البوليميراز المتسلسل الرئيسية في مكان منفصل ماديا عن مكان التعامل مع العينات. قم بتغيير القفازات في كثير من الأحيان لتجنب تلوث كواشف تفاعل البوليميراز المتسلسل بالعينات أو الحطام أو الحمض النووي الريبي الإيجابي. يجب نقل لوحة أو أنابيب PCR بعد إضافة ماستر ميكس إلى موقع ثان حيث يمكن إضافة عينة وتحكم الحمض النووي الريبي. الأهم من ذلك ، لا ينبغي التلاعب بمنتجات تفاعل البوليميراز المتسلسل في المناطق التي يتم فيها تحضير العينات أو الخلطات الرئيسية.
لا يوجد بديل عن الممارسة العملية والخبرة عند إجراء الاختبارات التشخيصية. يجب تدريب جميع الموظفين الجدد، ويجب تقييم كفاءات موظفي الاختبار مرة واحدة على الأقل في السنة وفقا لمتطلبات مدير المختبر المعني. يجب ملاحظة أي ملاحظات لنتائج غير عادية أو فشل الفحص والتحقيق فيها وتصحيحها على الفور. يجب التحقق من صحة كل مجموعة جديدة من الكواشف باستخدام عينات ذات قيم Ct معروفة (مثل عنصر تحكم إيجابي أو عينة مؤرشفة). يجب أن تخضع جميع المعدات للصيانة الروتينية ، على النحو الذي اقترحته الشركة المصنعة ، ويجب التحقق من أداء الفحص بعد أي صيانة أو إصلاح. يجب مراقبة مستويات درجة الحرارة على المعدات القابلة للتطبيق لضمان بقاء الثلاجات والمجمدات ضمن المعايير المحددة لنطاق درجة حرارة مقبول للكواشف المستخدمة في الاختبارات التشخيصية.
يمكن أن تؤثر التعديلات الإجرائية على أداء الفحص وقد تؤدي إلى نتائج إيجابية خاطئة أو سلبية خاطئة أو غير قابلة للتفسير. يجب اتباع التوصيات عن كثب لضمان حساسية عالية للفحص وخصوصيته. يجب على المختبر الذي يرغب في إدراج تعديلات على هذا البروتوكول التحقق من صحة الطرق المعدلة وتأكيدها بالتشاور مع مركز السيطرة على الأمراض.
Protocol
تم الحصول على عينات من أنسجة المخ بعد الوفاة من خلال المراقبة الروتينية أو الأنشطة التشخيصية لفرع فيروس الجدري وداء (CDC; أتلانتا ، جورجيا ، الولايات المتحدة الأمريكية).
1. جمع أنسجة المخ لتشخيص داء بعد الوفاة في بواسطة اختبار LN34 فيروس lyssavirus في الوقت الحقيقي RT-PCR
ملاحظة: قد تحتوي العينات على عوامل معدية. ارتد معدات الحماية الشخصية المناسبة (قفازات مطاطية ثقيلة أو قفازات أخرى مقاومة للقطع ، وثوب مختبر ، ومئزر مقاوم للماء ، وقناع جراحي ، وأحذية ، وأكمام واقية ، وواقي للوجه) واتبع لوائح السلامة المطلوبة لاستخدام العينات وتخزينها والتخلص منها. التطعيم قبل التعرض لداء ، والاختبار المصلي المنتظم ، والتطعيمات المعززة (حسب الضرورة) مطلوبة لأي شخص قبل العمل مع فيروسات الليسا أو العينات المعروفة أو المحتملة 2،3،4،6،10 أو اختبارها أو إنتاجها أو تنفيذها.
- قم بتسمية أنبوب جمع عينات واحد لكل عينة بملصق انضمام. املأ كل أنبوب لجمع العينات ب 1 مل من كاشف TRIzol أو مخزن مؤقت آخر للتجانس وجزء من حبات MagNA Lyser (يشار إليها فيما يلي ب "الخرز الخزفي"). لإضافة حبات السيراميك ، اسكب بعناية من أنبوب الخرز في أنبوب جمع العينات. تحتوي أنابيب الخرز الخزفي بشكل عام على ما يكفي من الخرز ل 2-5 عينات ، باستخدام ما لا يقل عن 20 حبة قطرها 1.4 مم لكل عينة.
تنبيه: كاشف TRIzol (المشار إليه فيما يلي ب "مخزن التجانس") هو مادة كيميائية خطرة. ملامسة الأحماض أو المبيض يحرر الغازات السامة ؛ ضمان التهوية الكافية يرجى الرجوع إلى ورقة بيانات السلامة لمزيد من المعلومات. إذا استبدل المستخدمون كاشف TRIzol أو كاشف TRI بمخزن مؤقت آخر للتجانس ، فمن الضروري التحقق الإضافي. يعمل TRIzol كمخزن مؤقت للتجانس / التحلل للعينة ، ومخزن مؤقت لتعطيل فيروس lyssa، ومخزن مؤقت لاستقرار الحمض النووي الريبي لهذا البروتوكول. سيتطلب استخدام مخزن مؤقت بديل للتجانس التحقق من صحة كفاءة الاستخراج والتعطيل والاستقرار في مقارنة جنبا إلى جنب الخاضعة للرقابة. - قم بتنظيف وتطهير سطح العمل بمطهر مركبات الأمونيوم الرباعية (QAC) لمدة دقيقتين ووضع وسادة ماصة مبطنة بالبلاستيك. ضع الكواشف والإمدادات فقط للعينة الأولى في خزانة السلامة البيولوجية من الفئة الثانية (BSC) مع ميزات لاستنفاد الأبخرة الخطرة خارج الغرفة.
ملاحظة: ارجع إلى إرشادات الشركة المصنعة لمعرفة حدود تخزين QAC المخفف. تأكد من أن الوسادة المبطنة بالبلاستيك لا تمنع تدفق الهواء لخزانة السلامة البيولوجية. إذا تعطل تدفق الهواء ، فلا تستخدم وسادة. - اجمع الأنسجة التي تمثل مقطعا عرضيا كاملا لجذع الدماغ والمخيخ باستخدام مشرط نظيف يستخدم مرة واحدة.
ملاحظة: يجب إجراء التلاعب بالأنسجة بطريقة لا تريسلات أو تنتج جزيئات محمولة في الهواء. أغطية الدخان أو خزانات السلامة الحيوية غير مطلوبة ، ولكن يوصى باستخدام خزانات السلامة الحيوية ذات التهوية لأنها توفر حماية إضافية من الروائح والأبخرة والطفيليات الخارجية وشظايا العظام.
تنبيه: يعد استخدام مشرط مع مادة يحتمل أن تكون مصابة بفيروس الحالة أمرا خطيرا ، ويجب على المستخدمين اتخاذ احتياطات السلامة المناسبة. يوصى باستخدام ملقط للاستخدام مرة واحدة.- بالنسبة للحيوانات الصغيرة (مثل الخفافيش) ، يمكن جمع جذع الدماغ والمخيخ بالكامل.
- بالنسبة للحيوانات الكبيرة ، اجمع مقطعا عرضيا كاملا من جذع الدماغ والأنسجة من كل من الفصوص الثلاثة للمخيخ.
- اختياري: في حالة إجراء اختبار الأجسام المضادة الفلورية المباشرة (DFA) ، اجمع انطباعات الدماغ في هذه المرحلة. استخدم الأنسجة المتبقية بعد جمع انطباعات الدماغ ل DFA لاستخراج الحمض النووي الريبي واختباره بواسطة مقايسة LN34.
ملاحظة: إذا تمت إضافة TRIzol إلى العينات، فلن يكون من الممكن استخدام العينات لطرق الكشف المستندة إلى المستضد أو عزل الفيروسات.
- تحضير عينات للتجانس واستخراج الحمض النووي الريبي.
ملاحظة: يمكن أن تتأثر كفاءة استخراج الحمض النووي الريبي وتعطيل الفيروس باستخدام الكثير من الأنسجة. يجب ألا تتجاوز كمية الأنسجة حوالي 1/10 حجم مخزن التجانس المستخدم. إذا تم استخدام المزيد من الأنسجة ، فقم بزيادة كمية مخزن التجانس وفقا لذلك لضمان استخراج الحمض النووي الريبي بكفاءة ونجاح.- بالنسبة للحيوانات الصغيرة ، ضع جميع الأنسجة المطلوبة في أنبوب يحتوي على مخزن مؤقت للتجانس وخرز للاستخراج. لا تتجاوز 100 ملغ من العينة في 1 مل من مخزن التجانس ؛ بالنسبة للعينات الأكبر حجما ، قم بزيادة حجم المخزن المؤقت للتجانس أو استخدم أنابيب متعددة لتعكس عينة نسبة 1:10: المخزن المؤقت.
- بالنسبة للحيوانات الكبيرة ، قم بفرم الأنسجة وتجانسها جيدا وإزالة جزء تمثيلي من أنبوب مملوء مسبقا بمخزن مؤقت للتجانس والخرز. لا تتجاوز 100 ملغ من العينة في 1 مل من مخزن التجانس ؛ بالنسبة للعينات الأكبر حجما ، قم بزيادة حجم المخزن المؤقت للتجانس أو استخدم أنابيب متعددة لتعكس عينة نسبة 1:10: المخزن المؤقت.
- الخيار 1 (مضرب الخرزة): تجانس الأنسجة باستخدام مضرب الخرز ، 1 مل من العازلة ، وخرز السيراميك. قد يلزم استخدام عدة أنابيب سعة 2 مل أو أنابيب أكبر.
- الخيار 1 (مضرب الخرزة): قم بتنظيف وتطهير محطة العمل والمعدات وأنابيب العينات الخارجية باستخدام مطهر QAC (1: 256). دعها تقف لمدة 2 دقيقة.
- الخيار 1 (مضرب الخرزة): داخل BSC ، قم بتحميل دوار جهاز طرد مركزي بعينة (عينات) متجانسة. جهاز طرد مركزي جميع العينات عند 10,000-16,000 × جم لمدة دقيقتين في جهاز طرد مركزي صغير على الطاولة. قم بتفريغ دوار الطرد المركزي داخل BSC.
- الخيار 1 (مضرب الخرزة): اتركه لمدة دقيقتين.
- الخيار 1 (مضرب الخرزة): نقل 120 ميكرولتر من الجانس إلى أنبوب مملوء مسبقا ب 1 مل من المخزن المؤقت للتجانس.
تنبيه: قد ينتج عن التجانس الهباء الجوي ويجب إجراؤه في BSC. - الخيار 2 (مشرط): قم بفرم الأنسجة المطلوبة جيدا باستخدام مشرط يستخدم مرة واحدة ، وتشويه بمسحة ، وانقل المسحة إلى أنبوب مملوء مسبقا بمخزن مؤقت للتجانس وخرز. لا تتجاوز 100 ملغ من العينة في 1 مل من مخزن التجانس ؛ بالنسبة للعينات الأكبر حجما ، قم بزيادة حجم المخزن المؤقت للتجانس أو استخدم أنابيب متعددة لتعكس عينة نسبة 1:10: عازلة.
تنبيه: يعد استخدام مشرط مع مادة يحتمل أن تكون مصابة بفيروس الحالة أمرا خطيرا ، ويجب على المستخدمين اتخاذ احتياطات السلامة المناسبة.
- اجمع أي مناديل متبقية في الحاوية الأصلية أو في حاوية جديدة فارغة تحمل علامة الانضمام. قم بتخزين هذه الأنسجة في حالة الحاجة إلى إعادة الاختبار أو التوصيف الإضافي.
- قم بتنظيف وتطهير محطة العمل والمعدات وخارج أنابيب العينة باستخدام مطهر QAC 1: 256. دعها تقف لمدة 2 دقيقة.
- كرر الخطوات 1.2-1.5 لجميع العينات المتبقية.
- قم بتجانس العينات باستخدام مضرب حبة صغير لمدة 60 ثانية على الأقل. افحص الأنابيب بصريا. كرر مضرب الخرز لمدة 60 ثانية إضافية إذا بقيت قطع كبيرة من المناديل. هذه الخطوة اختيارية إذا كانت الأنسجة متجانسة تماما في الخطوة 1.4.2.1 أعلاه.
ملاحظة: من المهم التأكد من تجانس الأنسجة تماما. سيؤدي التجانس غير المكتمل إلى تقليل إنتاجية الحمض النووي الريبي. - اتركيه لمدة 5 دقائق على الأقل في درجة حرارة الغرفة (RT).
- قم بتنظيف وتطهير محطة العمل والمعدات وخارج أنابيب العينة باستخدام مطهر QAC (1: 256).
ملاحظة: تعتبر العينة غير معدية في هذا الوقت ويمكن إزالتها من مختبر داء. - قم بمعالجة العينات على الفور في مخزن مؤقت للتجانس لاستخراج الحمض النووي الريبي ، أو تخزينها في RT (20 درجة مئوية إلى 25 درجة مئوية) أو مبردة (4 درجات مئوية إلى 8 درجات مئوية) لعدة أيام ، أو تخزينها في درجة حرارة -16 درجة مئوية أو أكثر برودة للتخزين طويل الأجل.
2. بروتوكول لاستخراج الحمض النووي الريبي باستخدام مجموعة RNA MiniPrep
- قم بإعداد مساحة العمل ضمن BSC.
- قم بتنظيف سطح عمل BSC باستخدام 70٪ من الإيثانول قبل بدء العمل لإزالة الغبار أو الملوثات البيئية الأخرى. قم بإجراء إزالة تلوث إضافي للأسطح باستخدام مطهر QAC (1: 256) أو RNase AWAY أو RNaseZap (وفقا لتوصيات الشركة المصنعة).
- ضع وسادة عمل ماصة مبطنة بالبلاستيك ، ووضع الكواشف والإمدادات والعينة في BSC.
ملاحظة: تأكد من أن الوسادة المبطنة بالبلاستيك لا تمنع تدفق هواء BSC. إذا تعطل تدفق الهواء ، فلا تستخدم وسادة. - ضع جميع أنابيب التجميع في رف نظيف لأنابيب الطرد المركزي الدقيقة. املأ مسبقا أنبوب طرد مركزي دقيق سعة 1.5 مل ب 300 ميكرولتر من الإيثانول بنسبة 100٪ لكل عينة من الدماغ غير الخفاش. بالنسبة للعينات التي تحتوي على القليل من الأنسجة (عينة دماغ الخفافيش ، أو عينة غير دماغية ، أو عينة متدهورة) ، املأ مسبقا أنبوب طرد مركزي دقيق سعة 1.5 مل ب 600 ميكرولتر من الإيثانول بنسبة 100٪ لكل منها.
- تحضير العينة
- اجمع جميع العينات المحضرة في القسم 1 في رف أنبوبي في BSC. قم بإذابة أي عينات مجمدة قبل الاختبار مباشرة.
- قم بإذابة التحكم في الاستخراج.
ملاحظة: يوصى باختيار عينة لا تحتوي على الحمض النووي الريبي لفيروس الحالة العصيبية. يجب اختبار العينة مسبقا بنطاق قيمة Ct المتوقع لمقايسة بيتا أكتين. على سبيل المثال ، خلايا زراعة الأنسجة المسبقة أو حالة داء السلبية التي تم اختبارها مسبقا (بشري أو حيواني).
- جهاز الطرد المركزي جميع العينات عند 10,000-16,000 × جم لمدة 2 متر في جهاز طرد مركزي صغير منضدي.
- انقل المادة الطافية إلى أنبوب طرد مركزي دقيق معقم جديد يحتوي على 100٪ من الإيثانول. تأكد من أن المادة الطافية صافية ، بدون دهون واضحة أو أنسجة صلبة. تجنب تجمع الدهون والأنسجة الصلبة.
- بالنسبة لأنسجة المخ غير الخفاشية: انقل 300 ميكرولتر من المادة المطفية.
- بالنسبة للعينات ذات الأنسجة الصغيرة (عينة دماغ الخفافيش ، أو عينة غير دماغية ، أو عينة متدهورة) ، انقل 600 ميكرولتر من المادة الطافية.
- قم بتخزين المتجانس المتبقي في أنبوب طرد مركزي دقيق لولبي عند ≤-16 درجة مئوية.
- الماصة لأعلى ولأسفل 10 مرات للخلط.
- لكل عينة ، انقل 600 ميكرولتر من خليط الإيثانول الطافي إلى عمود دوران في أنبوب تجميع.
- جهاز طرد مركزي حتى يمر السائل عبر العمود (1 دقيقة عند 10,000-16,000 × جم). تجاهل التدفق.
- كرر إذا كان هناك أكثر من 600 ميكرولتر من خليط المخزن المؤقت لتجانس الإيثانول لعينة.
- انقل كل عمود إلى أنبوب تجميع جديد.
- أضف 400 ميكرولتر من مخزن الغسيل المسبق للحمض النووي الريبي إلى كل عمود وجهاز طرد مركزي عند 10,000-16,000 × جم لمدة 30 ثانية.
- تجاهل التدفق وأعد كل عمود إلى نفس أنبوب التجميع.
- كرر الخطوات 2.10-2.11.
- أضف 700 ميكرولتر من مخزن غسيل الحمض النووي الريبي إلى كل عمود وجهاز طرد مركزي عند 10,000-16,000 × جم لمدة دقيقتين. تأكد من مرور المخزن المؤقت للغسيل عبر كل عمود تماما.
- انقل كل عمود بعناية إلى أنبوب خال من RNase.
- تخلص من التدفق وأنبوب التجميع من 2.13.
- أضف 50 ميكرولتر من الماء الخالي من DNase / RNase مباشرة إلى مصفوفة العمود لتصفية الحمض النووي الريبي.
ملاحظة: لا تلمس مصفوفة العمود بطرف الماصة. - احتضن لمدة 30 ثانية في RT ، ثم جهاز الطرد المركزي عند 10,000-16,000 × جم لمدة 1 دقيقة.
- انقل الحمض النووي الريبي بعناية إلى مدخل علوي مسطح جديد يسمى أنبوب الطرد المركزي الدقيق. انقل الحمض النووي الريبي المستخرج إلى الجليد للاختبار الفوري. يحفظ على المدى الطويل عند -70 درجة مئوية أو أكثر برودة.
ملاحظة: يمكن أن يؤدي التخزين في درجات حرارة أكثر دفئا أو ذوبان الجليد المتكرر إلى تدهور الحمض النووي الريبي ويؤثر على نتائج التشخيص.
3. بروتوكول لمقايسة LN34 pan-lyssavirus في الوقت الحقيقي RT-PCR
- تحضير الكواشف.
- التحكم الإيجابي الاصطناعي
- إذا تم إنتاج الحمض النووي الريبي الإيجابي الاصطناعي بواسطة CDC8 ، فاتبع التعليمات الموجودة على العبوة للتخزين وإعادة التكوين والاقتباس. تخطي هذه الخطوة إذا كانت الحصص ذات الاستخدام الواحد من الحمض النووي الريبي للتحكم الإيجابي في متناول اليد بالفعل.
ملاحظة: يجب التعامل مع الحمض النووي الريبي للتحكم الإيجابي عند تركيزات العمل في منطقة إضافة القالب وليس في نفس المنطقة مثل تحضير الماسترمكس. يجب أن ينتج الحمض النووي الريبي للتحكم الإيجابي قيمة عتبة الدورة (Ct) ضمن النطاق المتوقع المحدد لمجموعة معينة. بين عمليات التشغيل ، يجب ألا تختلف قيمة LN34 Ct للتحكم الإيجابي RNA بأكثر من قيم ±1.5 Ct. - قم بإذابة كمية تستخدم مرة واحدة من تخزين ≤ -70 درجة مئوية قبل الاستخدام مباشرة على كتلة الثلج أو الثلج. لا تجميد وتذوب ، وتخلص من الحصص المحفوظة لفترة طويلة في درجات حرارة مبردة.
ملاحظة: يجب تشغيل عنصر تحكم إيجابي في ثلاث نسخ في مقايسة LN34 ؛ لن يتم تضخيم التحكم الإيجابيالاصطناعي 8 في مقايسة بيتا أكتين.
- إذا تم إنتاج الحمض النووي الريبي الإيجابي الاصطناعي بواسطة CDC8 ، فاتبع التعليمات الموجودة على العبوة للتخزين وإعادة التكوين والاقتباس. تخطي هذه الخطوة إذا كانت الحصص ذات الاستخدام الواحد من الحمض النووي الريبي للتحكم الإيجابي في متناول اليد بالفعل.
- التحكم في الاستخراج والعينات: ضع العينات المستخرجة حديثا على الثلج (أو كتلة الثلج) أو قم بإذابة العينات من تخزين ≤ -70 درجة مئوية على الثلج (أو كتلة الثلج) مباشرة قبل الاستخدام.
ملاحظة: يجب إذابة الحمض النووي الريبي ومعالجته في منطقة مخصصة لإضافة عينة أو قالب منفصلة عن المناطق المستخدمة لإعداد الماستر ميكس أو التلاعب بمنتجات تفاعل البوليميراز المتسلسل أو كميات كبيرة من المواد الفيروسية (على سبيل المثال ، توليد التحكم الإيجابي ، الانتشار الفيروسي)
- التحكم الإيجابي الاصطناعي
- قم بإعداد كواشف الماسترميكس في منطقة تحضير الماسترميكس.
- تحضير Mastermix لمقايسة LN34 RT-PCR singleplex
ملاحظة: يمكن للمستخدمين اختبار العينات بتنسيق singleplex (الخطوة 3.2.1) أو تعدد الإرسال (الخطوة 3.2.2). وأداء كل من 3-2-1 و3-3-2 ليس ضروريا. يجب إذابة كواشف التحكم في القوالب ومعالجتها في منطقة نظيفة منفصلة عن معالجة العينات ، والتشريح ، و PCR ، وغيرها من المناطق التي يتم فيها التلاعب بالمواد الفيروسية. يمكن تحقيق ذلك من خلال غرف منفصلة أو نظام خزانة مع تدفق عينة من جانب واحد.- قم بإنشاء خلطات أولية ومسبار بتركيزات العمل كما هو موضح في الجدول 1 والجدول 2. تخطي هذه الخطوة إذا كانت حصص التخفيف العاملة للبادئات والمجسات في متناول اليد بالفعل.
- تقوم Aliquot بالبادئات والمجسات في مخزون تخزين 1.5 مل و 50 ميكرولتر من مخزون العمل وتخزينها في درجة حرارة ≤ -16 درجة مئوية في الظلام. تخطي هذه الخطوة إذا كانت حصص التخفيف العاملة للبادئات والمجسات في متناول اليد بالفعل.
ملاحظة: يوصى بتنفيذ الخطوة 3.2.1.2. - قم بإذابة المخزن المؤقت RT-PCR بخطوة واحدة ، ولا يوجد تحكم في القالب ، والبادئات ، والمجسات من ≤ -16 درجة مئوية على كتلة الثلج أو الثلج في منطقة تحضير Mastermix.
ملاحظة: استخدم الكواشف حتى تاريخ انتهاء الصلاحية أو فشل الأداء، أيهما يأتي أولا. - قم بعمل دوامة وطرد مركزي لفترة وجيزة جميع المخازن المؤقتة والبادئات والمجسات قبل الاستخدام.
- قم بتخزين إنزيم RT-PCR المكون من خطوة واحدة على الثلج أو في كتلة ثلجية حتى الاستخدام.
- عينات الحمض النووي الريبي
ملاحظة: استخدم الحمض النووي الريبي المستخرج حديثا كلما أمكن ذلك ، حيث قد يؤثر التجميد والذوبان على الأداء - قم بتخزين عينات الحمض النووي الريبي على الثلج أو كتلة الثلج حتى الاستخدام.
- قم بإذابة أي عينات من الحمض النووي الريبي المجمدة على الجليد أو كتلة الجليد.
- قم بتسمية أنبوب طرد مركزي دقيق واحد لكل اختبار (LN34 و βA).
- حدد عدد التفاعلات (N) المراد إعدادها لكل فحص.
- احسب عدد التفاعلات لمقايسة LN34 بضرب عدد العينات في 3 وإضافة 6 لآبار تفاعل التحكم بالإضافة إلى 10٪ تفاعلات إضافية لحساب الحجم المفقود أثناء سحب العينات. (على سبيل المثال ل 10 عينات: (10 × 3) + 6 = 36 تفاعلا ؛ التفاعلات الزائدة: (36 × 0.1) + 36 = 3.6 + 36 = 39.6 إجمالي التفاعلات ، أو 40 تفاعلا مقربا لأعلى)
ملاحظة: بالنسبة للاختبارات السريرية ، يقترح اختبار جميع العينات ثلاث نسخ ل LN34. لأغراض المراقبة ، يمكن اختبار كل عينة في نسختين. يوصى باستخدام ثلاث نسخ أثناء إعداد الفحص الأولي لضمان تباين منخفض بين التكرارات والتقنية الجيدة. - احسب عدد التفاعلات لمقايسة βA بإضافة عدد العينات بالإضافة إلى 4 آبار تفاعل تحكم بالإضافة إلى 10٪ تفاعلات إضافية لحساب الحجم المفقود أثناء سحب العينات.
- حدد حجم كل كاشف للخلطات الرئيسية LN34 و βA باستخدام الجدول 2.
- قم بتعيين آبار لكل عينة ليتم اختبارها في ثلاث نسخ في مقايسة LN34 وقم بتفرد لمقايسة βA باستخدام خريطة لوحة 96 بئر.
- قم بتوزيع 23 ميكرولتر من ماسترميكس فحص LN34 في كل LN34 مخصص جيدا بعد الدوران لفترة وجيزة والدوران لأسفل لمدة 30 ثانية باستخدام جهاز طرد مركزي دقيق على الطاولة لتجميع السائل في قاع الأنبوب. تجنب إدخال الفقاعات.
- قم بتوزيع الكواشف 23 ميكرولتر من مزيج الفحص βA الرئيسي في كل علامة βA مخصصة جيدا بعد الدوامة لفترة وجيزة والدوران لأسفل لمدة 30 ثانية في جهاز طرد مركزي دقيق على سطح الطاولة لتجميع السائل في الأسفل.
- قم بإعداد تفاعلات عدم التحكم في القالب (NTC) عن طريق سحب 2 ميكرولتر من الماء من فئة PCR في كل بئر NTC.
- قم بتغطية الآبار ونقل اللوحة إلى منطقة إضافة القالب.
- لفترة وجيزة دوامة وطرد مركزي الأنابيب التي تحتوي على عينات الحمض النووي الريبي.
- الماصة 2 ميكرولتر من الحمض النووي الريبي المستخرج من العينة الأولى في كل بئر مصنف لتلك العينة. تجنب إدخال الفقاعات.
- تأكد من سحب الحمض النووي الريبي إلى الماصة عن طريق التصور.
- الماصة على جانب البئر لضمان إضافة العينة إلى البئر الصحيح.
- تجنب التلويح بأطراف الماصة التي تحتوي على الحمض النووي الريبي فوق الآبار المفتوحة قدر الإمكان.
- كرر الخطوة 3.2.10 للعينات المتبقية والحمض النووي الريبي للتحكم الإيجابي.
- ضع الغطاء اللاصق البصري فوق الآبار بعد إضافة جميع العينات وأدوات التحكم. احرص على تغطية جميع الآبار وإغلاقها تماما.
- جهاز طرد مركزي عند 500 × جم لمدة 1 دقيقة في RT في جهاز طرد مركزي منضدية أو استخدم جهاز طرد من نوع الدوار للسلطة.
- ضع اللوحة المختومة في أداة PCR في الوقت الفعلي تمت معايرتها لأصباغ مراسل FAM و VIC / HEX واضبطها على معلمات التدوير الموضحة في الجدول 3.
- قم بإعداد الخلطات الرئيسية لمقايسة LN34 Multiplexed (LN34M).
- قم بتسمية أنبوب طرد مركزي دقيق واحد LN34M وفقا للجدول 2.
- حدد عدد التفاعلات (N) المراد إعدادها لكل فحص.
- احسب عدد تفاعلات مقايسة LN34M بضرب عدد العينات في 3 وإضافة 6 لآبار تفاعل التحكم بالإضافة إلى 10٪ تفاعلات إضافية لحساب الحجم المفقود أثناء سحب العينات. (على سبيل المثال ، ل 10 عينات: (10 × 3) + 6 = 36 تفاعلا ؛ ردود الفعل الزائدة: (36 × 0.1) + 36 = 3.6 + 36 = 39.6 إجمالي التفاعلات ، أو 40 تفاعلا مقربا لأعلى)
- اختر إما تنسيق 25 ميكرولتر أو 12.5 ميكرولتر. حدد حجم كل كاشف لمزيج LN34M الرئيسي باستخدام الجدول 2.
- قم بتعيين آبار لكل عينة ليتم اختبارها في ثلاث نسخ في مقايسة LN34M باستخدام خريطة لوحة 96 بئر.
- توزيع الكواشف لمقايسة LN34M في الآبار. قم بتدوير الأنابيب لفترة وجيزة لتجميع السائل في القاع قبل توزيع 23 ميكرولتر (لتفاعل 25 ميكرولتر) أو 10.5 ميكرولتر (لتفاعل 12.5 ميكرولتر) من المزيج الرئيسي في كل بئر مخصص. تجنب إدخال الفقاعات.
- قم بإعداد تفاعلات NTC عن طريق سحب 2 ميكرولتر من الماء من فئة PCR في كل بئر NTC.
- قم بتغطية الآبار ونقل اللوحة إلى منطقة إضافة القالب.
- لفترة وجيزة ، قم بتدوير الأنابيب التي تحتوي على عينات الحمض النووي الريبي لجمع السائل في الأسفل.
- الماصة 2 ميكرولتر من الحمض النووي الريبي المستخرج من العينة الأولى في كل بئر مصنف لتلك العينة. تجنب إدخال الفقاعات.
- تأكد من سحب الحمض النووي الريبي إلى تصور الماصة.
- الماصة على جانب البئر لضمان إضافة العينة إلى البئر الصحيح.
- تجنب التلويح بأطراف الماصة التي تحتوي على الحمض النووي الريبي فوق الآبار المفتوحة قدر الإمكان.
- كرر الخطوة 3.3.8 للعينات المتبقية والحمض النووي الريبي للتحكم الإيجابي.
- بعد إضافة العينة الأخيرة / عنصر التحكم ، ضع الغطاء اللاصق البصري فوق الآبار ، مع التأكد من تغطية جميع الآبار وإغلاقها تماما.
- جهاز طرد مركزي عند 500 × جم لمدة 1 دقيقة في RT في جهاز طرد مركزي منضدية أو استخدم جهاز طرد من نوع الدوار للسلطة.
- ضع اللوحة المختومة في جهاز PCR في الوقت الفعلي تمت معايرتها لأصباغ مراسل FAM و VIC / HEX واضبطها على معلمات ركوب الدراجات ، كما هو موضح في الجدول 3. اضبط الصبغة المرجعية السلبية على ROX وقم بتشغيلها في الوضع القياسي (لا تعمل في الوضع السريع)
ملاحظة: هذا الإعداد خاص بالأدوات المذكورة في هذا البروتوكول ويتطلب استخدام كاشف RT-PCR من خطوة واحدة يحتوي على ROX كصبغة سلبية. تتطلب الأدوات البديلة طرقا مختلفة لتحديد إعدادات التشغيل المثلى. ضمان الصيانة العادية للجهاز لكل مصنع للحصول على أفضل أداء.
- تحضير Mastermix لمقايسة LN34 RT-PCR singleplex
4. تفسير النتائج
- قم بتعيين خط أساس تلقائي وحسابات عتبة يدوية باستخدام قيمة 0.2 ل LN34/FAM و 0.05 ل βA / HEX / VIC.
ملاحظة: هذا الإعداد خاص بالأدوات المذكورة في هذا البروتوكول ويتطلب استخدام كاشف RT-PCR من خطوة واحدة يحتوي على ROX كصبغة سلبية. تتطلب الأدوات البديلة نهجا مختلفة لحساب قيم خط الأساس والعتبة. - تحديد نتيجة التشخيص باستخدام الإرشادات الواردة في الجدول 4 إذا تم تنفيذ جميع الضوابط كما هو متوقع (الجدول 5).
- قم بتأكيد جميع قيم Ct أو Cq من خلال عرض مخططات التضخيم.
- تحقق من أي نتائج غير عادية على النحو الموصى به.
5. الاحتفاظ بالعينة وتخزينها
- قم بتخزين جميع العينات المجمدة عند -16 درجة مئوية أو أقل حتى اكتمال الاختبار والإبلاغ عن النتائج. احتفظ بالأنسجة الأصلية لتأكيد النتائج أو تحديد المضيف للأنواع في حالة نتائج الاختبار غير العادية.
- استخدام معرفات عينة فريدة؛ قم بتسمية جميع الأنابيب والتقارير والأعمال الورقية بمعرفات عينة فريدة كاملة.
- احتفظ بالعينات الوسيطة (على المدى القصير) في حالة الحاجة إلى تكرار الاختبار.
- احتفظ بالعينات الإيجابية التمثيلية حسب الحاجة لاستخدامها كعناصر تحكم ، والطباعة الوبائية ، وأغراض أخرى.
- قم بتخزين الحمض النووي الريبي عند ≤-70 درجة مئوية للتخزين طويل الأجل.
النتائج
تظهر الصور التمثيلية من اختبار LN34 الناجح الذي تم تشغيله على أداة تفاعل البوليميراز المتسلسل في الوقت الفعلي ABI ViiA7 في الشكل 2. يسمح عرض النتائج المرسومة على مقياس لوغاريتمي بعرض سهل لقيمة Ct ، وهي النقطة التي يعبر عندها المنحنى خط العتبة (الشكل 2 أ ، ج). عند رسمه على مقياس خطي ، سيظهر التضخيم الناجح كمنحنى سيني (أو على شكل "S") (الشكل 2 ب ، د) ، بينما يجب أن تظهر النتائج السلبية كخط مستقيم ومسطح. يوصى بعرض النتائج في كل من طرق العرض الخطية ومقياس السجل لتحديد الحالات الشاذة أو الأخطاء المحتملة. يمكن رؤية النتائج الإيجابية والسلبية النموذجية في عرض المؤامرة متعددة المكونات في الشكل 2E ، F ، على التوالي ، حيث يمكن ملاحظة مستوى مضان الصبغة التي تضع علامة على المسبار (FAM ل LN34 ، VIC / HEX ل βA) بالنسبة إلى الصبغة السلبية في المخزن المؤقت للتفاعل (ROX).
تظهر أمثلة على النتائج غير الطبيعية في الشكل 3. يمكن استخدام المقارنات بين الرسوم البيانية للتشغيل الناجح (الشكل 2) والرسوم البيانية غير الطبيعية (الشكل 3) لعزل عمليات التشغيل غير النمطية ومشكلات الأدوات. يوضح الشكل 3 أ إشارة تعبر العتبة ، مما ينتج عنه قيمة Ct ل LN34 ، لكن منحنى التضخيم غير نمطي للغاية ، ويزداد خطيا. تظهر المخطط متعدد المكونات (الشكل 3 ب) أيضا خطا متموجا غير نموذجي للعينة الموجبة. يسلط هذا المثال الضوء على أهمية عرض مخططات التضخيم وليس مجرد نسخ قيم Ct. تأكد دائما من أن منحنيات التضخيم تبدو طبيعية لجميع العينات. ينصح أيضا بعرض المؤامرة متعددة المكونات للتأكد من عدم وجود مخالفات. في بعض الأحيان ، يمكن لإشارات خط الأساس الفوضوية أن تولد قيم Ct في الحالات التي لم يحدث فيها تضخيم. إذا ظهرت إشارات التضخيم خطية ، فمن المقترح تعديل خط الأساس لمعرفة ما إذا كان المنحنى يختفي. في حالة وجود أي إشارة غير عادية ، يجب تكرار التشغيل بأكمله. يوصى بتنظيف لوحة الخلفية وتشغيلها على أداة PCR في الوقت الفعلي إذا استمرت المشكلات. إذا كان ذلك متاحا ، يمكن تشغيل منتجات PCR على هلام الاغاروز و / أو تسلسلها لاستكشاف أي نتائج غير عادية وإصلاحها. لا ينصح باستخدام نتائج الرحلان الكهربائي للهلام أو التسلسل لتحديد نتائج التشخيص.
أظهرت الدراسات السابقة تباينا منخفضا بين التكرارات وتشغيل الفحص والمشغل والمختبر لمقايسة LN347. إذا لوحظ تباين كبير (>±فرق 1.5 قيراطات) بين التكرارات من نفس العينة ، فيجب إعادة اختبار هذا الحمض النووي الريبي. يمكن أن يحدث التباين العالي بسبب مشكلات في الماصات أو الممارسات المختبرية أو سوء السحب أو أجهزة PCR في الوقت الفعلي. قد تشير الملاحظة المتكررة للتباين العالي عبر عدة عينات أو عبر عمليات الفحص إلى مشكلات نظامية. قد تظهر العينات ذات الحمض النووي الريبي المنخفض ، والتي تقترب من عتبة الفحص لعينة موجبة (Ct 35) ، تباينا أعلى في قيم Ct بين التكرارات. قد يكون التشاور مع مركز السيطرة على الأمراض واستكشاف الأخطاء وإصلاحها ضروريا لمعالجة سبب التباين المستمر أو النتائج غير المتسقة أو فشل الفحص.
الحساسية العالية للمقايسات القائمة على تفاعل البوليميراز المتسلسل تجعلها بطبيعتها عرضة للتلوث. ويعد الالتزام الصارم بالممارسات المختبرية الجيدة أفضل طريقة للتخفيف من انتقال التلوث. من المهم معرفة كيفية تحديد التلوث المحتمل. يجب الاشتباه في تلوث الكاشف إذا لم يكن هناك عنصر تحكم في القالب ومشتبه في أن آبار العينة السالبة في تشغيل الفحص تنتج جميعها قيم Ct متشابهة. كرر الاختبار باستخدام حصص جديدة من كواشف تفاعل البوليميراز المتسلسل (العازلة والماء والبادئات والإنزيم) ونفس الحمض النووي الريبي. إذا أنتجت جميع العينات ومراقبة الاستخراج قيما متشابهة للأشعة المقطعية ولكن NTC سالب ، فيجب التحقيق في تلوث كواشف الاستخراج ، ويجب تكرار الاستخراج باستخدام كواشف جديدة. من الممارسات الجيدة عمل حصص صغيرة من الكواشف من أجل تقليل مخاطر التلوث وتجنب إمكانية التخلص من كميات كبيرة من الكواشف باهظة الثمن. يصعب تحديد التلوث المتبادل للعينة. في حالة الاشتباه في تلوث العينة ، كرر جمع العينات بدءا من الأنسجة الأصلية. في بعض الحالات ، يمكن أن يؤكد تسلسل الحمض النووي الريبي الفيروسي التلوث ، خاصة عندما يكون الحمض النووي الريبي الملوث مختلفا تماما عن المتغير الفيروسي المتوقع (مثل فيروس التحكم المستخدم في المختبر). يمكن أن يحدد تسلسل عينتين تمت معالجتهما في نفس الوقت ما إذا كانت التسلسلات الفيروسية متطابقة ولكنها قد تكون غير مفيدة إذا كان من المتوقع أن تكون التسلسلات متشابهة جدا (على سبيل المثال ، نفس المتغير الذي تم جمعه في نفس المقاطعة). في حالة الاشتباه في تلوث العينة بالحمض النووي الريبي الإيجابي ، يمكن للمرء تشغيل أمبليكون فحص LN34 على هلام الاغاروز للتمييز بين الحمض النووي الريبي لفيروس الليسا (165 نقطة أساس) عن الحمض النووي الريبي الإيجابي للتحكم (99 نقطة أساس). تسلسل القالب المستخدم لتوليد الحمض النووي الريبي للتحكم الإيجابي الذي يوفره مركز السيطرةعلى الأمراض 8.
بالنسبة لمسببات الأمراض الأخرى ، يمكن استخدام المختبرات لتعيين العتبة يدويا للتخلص من "الضوضاء" مثل التضخيم الضعيف الموضح في السماوي في الشكل 4. لا ينصح بهذه الممارسة لتشخيص داء لأنها يمكن أن تؤدي إلى نتائج سلبية خاطئة ذات عواقب وخيمة لأن داء قاتل بنسبة 100٪ تقريبا. لا تقم بتغيير العتبة يدويا لإنتاج نتائج سلبية لعينات التضخيم الضعيفة أو المتأخرة. يجب إعادة استخراج هذه العينات و / أو إعادة اختبارها لاستبعاد داء.
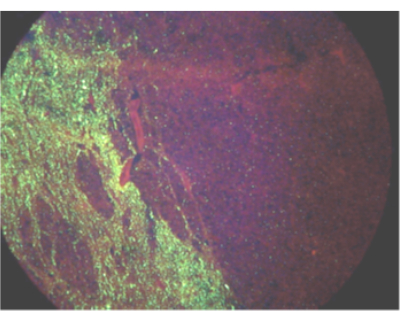
الشكل 1: مجال الرؤية الذي يوضح الانتشار الأحادي الجانب لمستضد فيروس داء في حمار مصاب عن طريق اختبار الأجسام المضادة الفلورية المباشر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
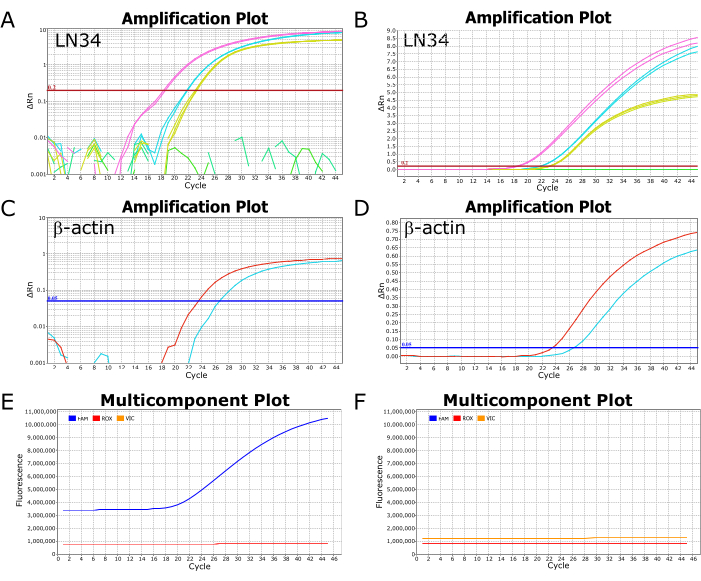
الشكل 2: التضخيم والمخططات متعددة المكونات من تشغيل مقايسة LN34 ناجح. (A-D) يتم رسم بيانات النتيجة على مقياس سجل (A ، C) ومقياس خطي (B ، D) لمقايسة LN34 و βA. تصور اللوحتان A و B نتائج LN34 من عينتين (باللونين الوردي والسماوي) مقارنة بالتحكم الإيجابي (باللون الأصفر). في اللوحة B ، يوجد خط أخضر مسطح يصور عينة سلبية إضافية في التشغيل. في A ، لا يظهر الخط (الخطوط) الخضراء أي تضخيم ويتم تصويره على أنه أجزاء مكسورة. تم تعيين عتبة مقايسة LN34 يدويا إلى 0.2 وتظهر بالخط الأفقي الأحمر. (ج، د) نتائج مقايسة βA لعيلتين (حمراء وسماوية). تم تعيين عتبة المقايسة βA يدويا عند 0.05. (ه، و) تصور المخططات متعددة المكونات التألق (RFU) في كل دورة ل FAM (LN34) و VIC (βA) و ROX (صبغة سلبية موجودة في المخزن المؤقت AgPath-ID). يجب أن تظل مستويات ROX ثابتة عبر جميع الدورات. يتم عرض عينة موجبة نموذجية في اللوحة E. يزداد تألق FAM كمنحنى سيني يبدأ من الدورة 18 لهذه العينة. يتم عرض عينة سالبة نموذجية في اللوحة F ، حيث يظل مستوى FAM موازيا لمستوى ROX عبر جميع الدورات. البيانات مأخوذة من أداة تفاعل البوليميراز المتسلسل في الوقت الفعلي ABI ViiA7. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: صور تمثيلية للإشارة النادرة غير النمطية التي لوحظت في اختبار LN34 تعمل على جهاز PCR في الوقت الفعلي ViiA7. (أ-و) قطع التضخيم (A ، C ، E) ومتعددة المكونات (B ، D ، F) المنتجة بسبب تلوث الآبار. لا تمثل الزيادة الخطية (A ، C) والتقلبات المتموجة (B ، D) في مضان FAM تضخيما حقيقيا بناء على شكل المنحنيات وحجم التغير الفلوري. من المحتمل أن تمثل اللوحات من A إلى D عينات سالبة على الرغم من إنتاج قيمة Ct للنسخ المتماثلة الموضحة في اللوحين A و B. تظهر اللوحتان E و F إشارة متموجة غريبة يمكن رؤيتها بسهولة أكبر في المؤامرة متعددة المكونات. يجب التحقيق في هذا النوع من الإشارات وقد يشير إلى مشكلات في الأداة ، على الرغم من أن جميع عناصر التحكم تم تنفيذها كما هو متوقع في هذا التشغيل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
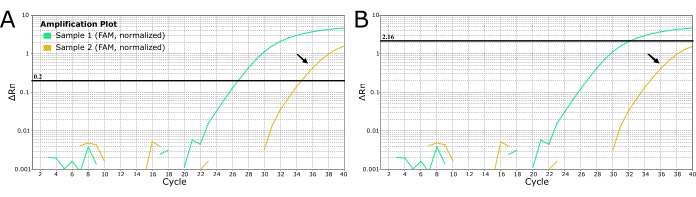
الشكل 4: منحنيات LN34 في الوقت الفعلي RT-PCR من عينتين مشتبهتين لداء تظهر طريقتين لتحديد قيم العتبة. (أ) تم ضبط عتبة LN34 على 0.2 (موصى بها لجميع عمليات التشغيل). (ب) تحديد عتبة مختلفة يدويا لكل إشارة لإخفاء الجري يتم تحديدها على أنها "ضوضاء" (إشارة تضخيم متأخرة). لا ينصح بالطريقة المستخدمة في اللوحة B لداء بسبب العواقب الوخيمة لفقدان نتيجة إيجابية حقيقية. يمكن أن يشير التضخيم المتأخر إلى عينة إيجابية ضعيفة أو تثبيط تفاعل البوليميراز المتسلسل أو فشل الاستخراج في الحالة الإيجابية. يمكن أن يشير أيضا إلى التلوث المتبادل. تنتج العينة الذهبية (المشار إليها بالأسهم السوداء) قيمة Ct عند قطع الفحص ولا ينبغي اعتبارها سالبة. يجب إعادة استخراج العينات ذات التضخيم المتأخر وإعادة اختبارها. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: تسلسلات وتركيزات التمهيدي والمسبار المستخدمة في فحوصات RT-PCR في الوقت الفعلي LN34lys (singleplex LN34) و LN34M (LN34 و βA متعددة الإرسال). تم تمييز مجسات LN34 بصبغة FAM الفلورية في الطرف 5 و Black Hole Quencher (BHQ1) في النهاية 3'. تم تمييز مسبار βA بصبغة سداسية الفلورية في الطرف 5 ومروي الثقب الأسود (BHQ1) في النهاية 3. يشار إلى القواعد المعدلة بالنيوكليوتيدات المقفلة من خلال علامة زائد تسبق القاعدة في التسلسل. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: تم إعداد الفحص لمقايسات LN34lys و Actin3 و LN34M. يمكن العثور على أسماء التمهيدي والمسبار وتسلسله وتركيزاته في الجدول 1. LN34_F1 يتوافق مع ACGCTTAACAACCAGATCAAAGAA7. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 3: معلمات ركوب الدراجات لأدوات ABI. هام: تأكد من التشغيل في الوضع القياسي ، وليس في الوضع السريع . يجب اختيار ROX كصبغة مرجعية سلبية. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 4: خوارزمية لتفسير نتائج LN34 في الوقت الفعلي RT-PCR لتنسيقات أحادية الإرسال (أعلى ، جدول أزرق) وتعدد الإرسال (أسفل ، جدول أحمر). يجب اعتبار نتيجة LN34 الإيجابية إيجابية ، حتى لو كانت نتيجة βA سلبية أو غير حاسمة. إذا لم يتم اكتشاف أمبليكون LN34 ، فيجب ≤ قطع قيمة Ct βA المدرجة ليتم اعتباره سالبا. تشير قيم βA Ct إلى جودة العينة التي يتم اختبارها وتحديد التثبيط المحتمل. قد يؤثر التركيز المنخفض في العينة السريرية الأصلية على منحنيات نمو βA ، مما يؤدي إلى عدم تضخيم ملحوظ. تشمل العوامل الإضافية المساهمة في الفشل في الكشف عن β-actin سوء استخراج الحمض النووي الريبي بسبب فقدان الحمض النووي الريبي أو ترحيل مثبطات تفاعل البوليميراز المتسلسل ، وإعداد وتقنية الفحص غير الصحيحة ، ونوع العينة أو جودتها غير المرضية ، وخلل في الكواشف أو المعدات. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 5: إجراءات وتفسيرات النتائج الشائعة لضوابط فحص LN34. يجب أن تؤدي جميع الضوابط الثلاثة (الحمض النووي الريبي الإيجابي لداء ، والتحكم السلبي في الاستخراج لداء ، وعدم وجود عنصر تحكم في القالب إلى نتائج متوقعة لتمرير الجري. قد يشير الفشل في التحكم الإيجابي أو عدم وجود تحكم في القالب إلى حدوث ماصة أو كاشف أو فشل في المعدات. يجب تكرار التشغيل بأكمله ، بما في ذلك جميع عينات الحمض النووي الريبي التي تم اختبارها. قد يشير فشل التحكم في الاستخراج إلى وجود مشكلة أثناء الاستخراج ، مثل فشل الكاشف أو سوء السحب أو التلوث المتبادل. يجب تكرار استخراج جميع العينات. يجب أن يكون فشل الضوابط نادرا بالنسبة لموظفي المختبر ذوي الخبرة. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
يتطلب تشغيل مقايسة LN34 الناجح تحكما إيجابيا وتحكما في الاستخراج ولا تعمل أي تفاعلات تحكم في القالب كما هو متوقع في كل عملية فحص أو يجب إبطال التشغيل وتكراره. يجب أن تعبر جميع تفاعلات التكرار الثلاثة للتحكم الإيجابي LN34 العتبة ضمن النطاق المحدد ، أو يجب تكرار التشغيل. لن يتم تضخيم التحكم الإيجابي في الحمض النووي الريبي الموصوف في المنشورات السابقة7،8 في مقايسة βA. يجب ألا تظهر تفاعلات التحكم في القالب منحنيات تضخيم تعبر خط العتبة إما لمقايسة LN34 أو βA. يجب ألا يظهر التحكم في الاستخراج تضخيما ل LN34. وإذا لوحظ تضخيم غير متوقع في المجلس الوطني الانتقالي أو التحكم في الاستخراج، فقد يشير ذلك إلى تلوث ويبطل اختبار التشغيل والتكرار لجميع العينات (انظر الجدول 5). قد يفكر المستخدمون في إضافة عناصر تحكم إضافية ، بما في ذلك التحكم في عدم المعالجة أو التحكم في الاستخراج بدون عينة ، لمراقبة تلوث المضيف βA لكواشف الاستخراج.
مع اقتراب معدل الوفيات الناجم عن داء من 100٪ ، يوصى بإجراء مزيد من التحقيق في أي تضخيم ضعيف أو غير طبيعي ، حتى لو لم ينتج عنه قيمة CT. يجب ألا تظهر التفاعلات السلبية أو NTC أي تضخيم ، ويجب أن يظهر التألق كخط مسطح مواز لمضان ROX في العرض متعدد المكونات. قد تشير ملاحظات المنحنيات ، خاصة في التكرارات المتعددة ، إلى تلوث متبادل أو نتيجة إيجابية ضعيفة. يجب تضخيم جميع التكرارات لعينة موجبة للحصول على نتيجة إيجابية صحيحة. إذا تم تضخيم مجموعة فرعية فقط من التكرارات في أي من المقايسين ، فيجب إعادة اختبار العينة. علاوة على ذلك ، يجب اعتبار أي عينة تنتج نتائج متغيرة للغاية (فروق قيمة Ct > ±1.5 بين التكرارات) غير صالحة ، ويجب إعادة اختبار العينة. إذا استمرت المشكلة، فيجب إعادة استخراج العينة.
من المتوقع أن يكون للعينة الإيجابية لداء المستخرجة من جذع الدماغ وأنسجة المخيخ التي تم جمعها وتخزينها بشكل صحيح قيمة Ct أقل من 35 دورة لمقايسة LN34. يجب إعادة اختبار جميع العينات غير الحاسمة بواسطة LN34 RT-PCR في الوقت الفعلي. إذا كانت العينة غير حاسمة عند تكرار الاختبار وتم إجراء جميع الضوابط كما هو متوقع ، يوصى بإعادة استخراج الحمض النووي الريبي. قد تشير العينات ذات الحمض النووي الريبي الفيروسي المنخفض (LN34 Ct > 35) إلى مشاكل محتملة مثل التلوث أو انخفاض الحمل الفيروسي أو تثبيط تفاعل البوليميراز المتسلسل أو فشل الاستخراج. اجمع قطعا جديدة من الدماغ من الأنسجة الأصلية ، وقم باستخراج الحمض النووي الريبي ، وأعد اختبار العينة. وبالمثل ، قد تشير قيم Ct > 33 (singleplex) أو 37 (LN34M) أو عدم وجود تضخيم في مقايسة βA إلى فشل استخراج الحمض النووي الريبي. كرر الاستخراج لمثل هذه العينات ، ثم كرر الاختبار لكل من LN34 والأكتين. إذا أسفرت العينة عن نتيجة غير حاسمة مرة أخرى بعد الاختبار المتكرر ، فاستخدم طريقة ثانوية مثل اختبار DFA (ويسمى أيضا FAT) أو DRIT أو عزل الفيروسات. إذا لوحظت نتائج متضاربة مستمرة أو نتائج غير حاسمة، يرجى استشارة المختبر المرجعي لداء لإجراء الاختبارات التأكيدية.
إذا كانت المثبطات موجودة في استخراج الحمض النووي الريبي ، فقد تؤدي فحوصات تفاعل البوليميراز المتسلسل إلى نتيجة سلبية خاطئة. إذا كان هناك اشتباه في تثبيط أو لوحظ تثبيط تفاعلات التحكم في βA (مثل قيمة Ct > 33 أو قيمة Ct > 37) لعينة معينة ، فيجب اختبار الحمض النووي الريبي المستخرج عند 2 أو أكثر من التخفيفات (على سبيل المثال ، 1:10 و 1: 100 في الماء الخالي من النوكلياز) لتخفيف أي مثبطات محتملة لتفاعل البوليميراز المتسلسل (PCR). بالنسبة للعينات الصعبة ، يمكن زيادة مدخلات الحمض النووي الريبي إلى 8.5 ميكرولتر في تفاعل RT-PCR عن طريق عدم إضافة أي ماء. قد يكشف هذا عن زيادة التثبيط (قيمة Ct اللاحقة مقارنة ب 2 ميكرولتر RNA المدخل) أو انخفاض مستوى الحمض النووي الريبي في العينة الأصلية (قيمة Ct السابقة عند استخدام 8.5 ميكرولتر مقارنة ب 2 ميكرولتر RNA المدخل).
لا يفرق اختبار LN34 بين فيروسات الليسا أو يحدد متغيرات فيروس داء. يمكن تسلسل amplicon اختبار LN34 لنمط متغير فيروس داء منخفض الدقة أو تحديد أنواع فيروس الليسا11.
Disclosures
لا شيء للإفصاح عنه
Acknowledgements
نحن نقدر جهود وتعاون العديد من مختبرات اختبار تشخيص داء التي ساهمت في تنفيذ اختبار LN34 والتحقق من صحته وتحسينه من خلال مشاركة البيانات المفتوحة والتغذية الراجعة. استخدام الأسماء التجارية والمصادر التجارية هو لتحديد الهوية فقط ولا يعني مصادقة مراكز السيطرة على الأمراض والوقاية منها أو وزارة الصحة والخدمات الإنسانية الأمريكية أو المؤسسات التابعة للمؤلفين. لا تعكس الاستنتاجات والنتائج والآراء التي أعرب عنها المؤلفون بالضرورة الموقف الرسمي لوزارة الصحة والخدمات الإنسانية الأمريكية أو مراكز السيطرة على الأمراض والوقاية منها أو المؤسسات التابعة للمؤلفين.
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Fast | Applied Biosystems | N/A | Do not substitute without validation |
| 7500 Fast Dx | Applied Biosystems | N/A | Do not substitute without validation |
| ABI ViiA 7 | Applied Biosystems | N/A | Do not substitute without validation |
| AgPath-ID One-Step RT-PCR Kit | ThermoFisher Scientific | AM1005 | Do not substitute without validation |
| Beadbug6 | Benchmark Scientific | D1036 | |
| Direct-zol RNA MiniPrep kit | Zymo Research | R2052 | |
| MagNA Lyser green beads | Roche | 3358941001 | |
| Microcentrifuge | Eppendorf | 5425 R | |
| Optical 96-well Reaction Plates | ThermoFisher Scientific | 4346907 | |
| Optical Adhesive covers | ThermoFisher Scientific | 4311971 | Alternative: caps |
| Polyester fiber-tipped applicator swabs | BD BBL Polyester Fiber Tipped Application Swab | 220690 | |
| QuantStudio 6Flex | Applied Biosystems | 4485691 | Do not substitute without validation |
| Quaternary ammonium disinfectant (1:256) | LYSOL | WBB56939 | Do not substitute without validation |
| RNase AWAY | ThermoFisher Scientific | 7002PK | |
| RNaseZap | ThermoFisher Scientific | AM9780 | |
| Single-use scalpel, a scalpel with a safety mechanism | Integra Miltex | 4-510 | |
| Sterile polyproylene microcentrifuge tubes (1.5 mL), nuclease free | Sarstedt | 72.692.405 | |
| Sterile polyproylene microcentrifuge tubes (2 mL), nuclease free | Sarstedt | 72.694.600 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | Do not substitute without validation |
References
- Meechan, P. J., Potts, J. . Biosafety in Microbiological and Biomedical Laboratories. , (2020).
- . Terrestrial Manual 2023 Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals (2023)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/handle/10665/310836 (2018)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/bitstream/handle/10665/310837/9789241515306-eng.pdf?ua=1 (2019)
- . Protocol for postmortem diagnosis of rabies in animals by direct fluorescent antibody testing: A minimum standard for rabies diagnosis in the United States Available from: https://www.cdc.gov/rabies/pdf/RabiesDFASPv2.pdf (2003)
- World Health Organization. . WHO Expert Consultation on Rabies: Third Report. , (2018).
- Gigante, C. M., et al. Multi-site evaluation of the LN34 pan-lyssavirus real-time RT-PCR assay for postmortem rabies diagnostics. PLoS One. 13 (5), e0197074 (2018).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR assay for the detection of highly variable rabies virus and other lyssaviruses. PLoS Negl Trop Dis. 11 (1), e0005258 (2017).
- Gigante, C. M., Wicker, V., Wilkins, K., Seiders, M., Zhao, H., Patel, P., Orciari, L., Condori, R. E., Dettinger, L., Yager, P., Xia, D., Li, Y., et al. Optimization of pan-lyssavirus LN34 assay for streamlined rabies diagnostics by real-time RT-PCR. Journal Virological Methods. , (2024).
- Rao, A. K., et al. Use of a modified preexposure prophylaxis vaccination schedule to prevent human rabies: recommendations of the advisory committee on immunization practices-United States, 2022. Morbidity and Mortality Weekly Report. 71 (18), 619 (2022).
- Condori, R. E., et al. Using the LN34 Pan-Lyssavirus Real-Time RT-PCR assay for rabies diagnosis and rapid genetic typing from formalin-fixed human brain tissue. Viruses. 12 (1), 120 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved