Method Article
업데이트된 멀티플렉스 LN34 Real-Time 역전사-중합효소 연쇄 반응 분석을 통한 동물 광견병의 사후 진단
요약
이 프로토콜은 조직 채취에서 결과 해석에 이르기까지 pan-lyssavirus LN34 real-time reverse transcription-polymerase chain reaction(RT-PCR) 분석을 보여주며, 여기에는 일부 비광견병 lyssavirus 및 lagomorphs에 대한 분석 성능을 개선하기 위한 프라이머 염기서열 및 제형 업데이트가 포함됩니다. 또한 단일 웰 LN34 다중화(LN34M) 형식에 대한 분석 설정을 시연합니다.
초록
광견병은 리사바이러스 광견병(RABV) 및 리사바이러스 속( Rhabdoviridae과)의 관련 음성 가닥 RNA 바이러스에 의해 발생하는 치명적인 인수공통전염병입니다. LN34 분석은 리사바이러스 게놈의 고도로 보존된 리더 영역과 핵단백질 유전자를 표적으로 하며, 다양한 리사바이러스 속의 RNA를 검출하기 위해 축퇴 프라이머와 잠긴 뉴클레오티드를 포함하는 TaqMan 프로브를 활용합니다. 광견병에 대한 음성 소견은 뇌간과 소뇌의 3개 엽의 전체 단면을 검사하는 경우에만 이루어져야 합니다. 그러나 모든 조직에서 리사바이러스 RNA를 확인하는 것은 광견병 감염을 진단하는 것입니다. 조직은 TRIzol 시약에서 수집 및 균질화되며, 이 시약은 바이러스를 비활성화합니다. RNA 추출은 스핀 컬럼 기반 상용 추출 키트를 사용하여 수행됩니다. 마스터 믹스는 깨끗한 공간에서 준비되고 샘플 RNA를 추가하기 전에 96 웰 플레이트에 분주됩니다. 임상 환경에서 각 샘플은 실시간 RT-PCR로 숙주 β 액틴 mRNA에 대해 3회 및 단독으로 lyssavirus RNA의 존재 여부를 테스트합니다. 양성 및 음성 대조군은 프로토콜의 추출 및 real-time RT-PCR 단계에 포함됩니다. 데이터 분석에는 기기 실행 전반에 걸쳐 Ct 값을 표준화하기 위한 임계값의 수동 조정이 포함됩니다. 양성 결과는 pan-lyssavirus 분석에서 일반적인 증폭의 존재 여부에 따라 결정됩니다(Ct ≤ 35). 음성 결과는 pan-lyssavirus assay에서 일반적인 증폭의 부재 및 숙주 β-actin mRNA의 검출에 의해 결정됩니다(Ct ≤ 33). 이 범위를 벗어난 값이 관찰되거나 분석 제어가 실패하면 실행이 무효화되거나 검체에 대한 결론이 나지 않을 수 있습니다. 높은 분석 감도와 특이성을 보장하기 위해 프로토콜을 면밀히 따라야 합니다. 절차적 수정은 분석 성능에 영향을 미칠 수 있으며 위양성, 위음성 또는 해석할 수 없는 결과를 초래할 수 있습니다.
서문
이 프로토콜은 샘플 채취부터 결과 해석까지 LN34 pan-lyssavirus real-time reverse transcription-polymerase chain reaction(RT-PCR) 분석을 사용하여 광견병 진단 검사를 수행하는 절차를 설명합니다. 이 절차는 LN34 분석과 관련된 뇌 샘플 수집(섹션 1), Direct-zol RNA Miniprep 키트(Zymo Research R2051)를 사용한 수동 컬럼 기반 RNA 추출(섹션 2), AgPath-ID One-Step RT-PCR 키트(ThermoFisher Scientific AM1005)를 사용하여 설정한 LN34 real-time RT-PCR 분석(섹션 3)의 세 부분으로 나뉩니다. RNA 추출 및 RT-PCR은 다른 제품을 사용하여 수행할 수 있지만 리사바이러스 RNA가 적절하게 추출 및 증폭되는지 확인하기 위해 사용 전에 키트를 검증해야 합니다.
섹션 1은 LN34 real-time RT-PCR 분석에 사용할 적절한 뇌 조직의 수집에 대해 설명합니다. 동물 부검, 참수, 뇌 제거에 대한 설명은 포함되지 않습니다. 샘플에는 감염원이 포함되어 있을 수 있습니다. 위험을 완화하기 위해 Biosafety in Microbiological and Biomedical Laboratories 6th Edition1 에 자세히 설명된 생물안전성 절차를 따라야 합니다. 샘플은 불활성화가 완료될 때까지 전염성이 있는 것으로 간주되어야 합니다. 바이러스 불활성화 및 분석 검증은 해당 기관의 표준에 따라 각 실험실에서 수행해야 합니다. 실험실은 새로운 진단 테스트를 구현할 때 해당 기관에서 결정한 표준 안전 및 품질 절차를 따라야 합니다.
감염 중 광견병 바이러스의 확산에 대해 알려진 바에 따르면 뇌간과 소뇌는 광견병 진단에 가장 적합한 조직이며, 이러한 조직은 세계보건기구(WHO)와 세계동물보건기구(World Organization for Animal Health)에서 광견병 검사에 권장하고 있습니다 2,3,4,5. 바이러스 확산은 일방적일 수 있으므로(그림 1), 특히 대형 동물에서 뇌간과 소뇌의 3엽을 완전히 절단하여 광견병 가능성을 배제해야 합니다. 이러한 최소 기준을 충족하지 않는 샘플의 경우, 실험실은 샘플이 테스트에 불충분하다고 거부하거나 감시 또는 규칙 적용 목적으로 테스트를 선택할 수 있습니다. 필요한 조직을 받지 못했지만 실험실에서 샘플을 검사하기로 선택한 경우, 다른 조직에 바이러스 RNA가 지연되거나, 풍부량이 적거나, 간헐적이거나, 존재하지 않을 수 있기 때문에 음성 검사 결과는 해당 동물의 광견병에 대한 결정적인 결론을 내리지 못하는 것으로 해석되어야 합니다. 이 경우 광견병을 배제하기 위해 필요한 샘플을 수집하거나 추가 검사가 필요합니다. 그러나 모든 조직에서 리사바이러스 RNA를 확인하는 것은 광견병 감염으로 진단됩니다 3,6. 광견병 감염 규칙 또는 감시(배제하지 않음)를 위한 광견병 바이러스 RNA에 대해 검사할 수 있는 샘플의 예로는 피질, 해마, 척수, 분해된 샘플, 피부, 타액 및 각막이 있습니다. 각 샘플의 상태에 대한 정성적 평가는 실험실에 도착하는 즉시 이루어져야 합니다. 냉장 보관은 샘플을 최소 72시간 동안 보존할 수 있지만 장기간 사용해서는 안 됩니다. 동결-해동 주기가 반복되면 테스트 감도가 감소할 수 있으며 5회 이상의 동결-해동 주기는 피해야 합니다. 조직의 상태가 뇌 구조를 확실하게 식별할 수 없는 경우, 샘플은 불만족스러운 것으로 식별되어야 합니다. 만족스럽지 않은 검체의 경우, 광견병을 배제하기 위해(그러나 배제할 수는 없지만) 검사를 수행할 수 있습니다. 양성 테스트 결과는 이와 같이 보고됩니다. 불만족스러운 조직에 대한 부정적이거나 결론이 나지 않은 결과는 부정적인 진단으로 오해되는 것을 방지하기 위해 결정적이지 않은 것으로 보고해야 합니다.
이 프로토콜은 발표된 절차 7,8,9에서 개발되었으며 lyssavirus 게놈 리더 영역 및 핵단백질 코딩 서열을 표적으로 하는 업데이트된 프라이머를 포함합니다. 이 프로브는 짧고 보존성이 높은 염기서열을 표적으로 하며 잠긴 뉴클레오티드를 사용하여 광범위한 검출을 가능하게 합니다. 이 분석은 다양한 농도의 다양한 리사바이러스에서 RNA를 검출합니다8. 이 프로토콜은 LN34 Real-Time PCR 분석을 수행하기 위한 실험실 절차를 보여주지만, lyssavirus RNA의 정확하고 민감한 검출은 검체 보관, 기록 보관, 인력 교육/역량, 결과 추적, 결과 해석, 품질 보증, 실험실 안전 조치 및 문제 해결과 같이 이 프로토콜에서 광범위하게 다루지 않는 다른 요소에 따라 달라집니다. PCR 기반 분석은 높은 감도로 인해 교차 오염이 발생하기 쉽습니다. 교차 오염은 장갑을 자주 교체하고, 한 번에 하나의 샘플을 취급하고, 샘플 사이에 효과적인 오염 제거제로 작업 표면을 소독하고, 튜브를 닫고 샘플을 PCR 시약과 분리하는 것과 같은 우수한 실험실 관행을 준수하여 방지할 수 있습니다. PCR 시약과 샘플은 일방적인 워크플로우를 사용하고 사전 증폭 및 사후 증폭 작업 영역을 분리하여 쉽게 분리할 수 있습니다. 예를 들어, 샘플이 취급되는 곳과 물리적으로 분리된 위치에서 PCR 마스터믹스를 준비합니다. PCR 시약이 샘플, 파편 또는 양성 대조군 RNA로 오염되지 않도록 장갑을 자주 교체하십시오. PCR 플레이트 또는 튜브는 마스터믹스 첨가 후 샘플 및 대조군 RNA를 추가할 수 있는 두 번째 위치로 이동해야 합니다. 중요한 것은 PCR 산물이 샘플 또는 마스터믹스가 준비되는 영역에서 조작되어서는 안 된다는 것입니다.
진단 테스트를 수행할 때 실습과 경험을 대체할 수 있는 것은 없습니다. 모든 신입 사원은 교육을 받아야 하며, 해당 연구소 책임자의 요구 사항에 따라 최소 1년에 한 번 테스트 인력에 대한 역량 평가를 받아야 합니다. 비정상적인 결과나 분석 실패에 대한 관찰은 즉시 기록, 조사 및 수정해야 합니다. 각각의 새로운 시약 로트는 알려진 Ct 값(예: 양성 대조군 또는 보관된 샘플)을 사용하여 검증해야 합니다. 모든 장비는 제조업체가 제안한 대로 정기적인 유지 관리를 받아야 하며 유지 보수 또는 수리 후에 분석 성능을 확인해야 합니다. 냉장고와 냉동고가 진단 테스트에 사용되는 시약에 대해 허용 가능한 온도 범위에 대해 설정된 기준 내에서 유지되도록 해당 장비에서 온도 수준을 모니터링해야 합니다.
절차적 수정은 분석 성능에 영향을 미칠 수 있으며 위양성, 위음성 또는 해석할 수 없는 결과를 초래할 수 있습니다. 높은 분석 민감도와 특이성을 보장하기 위해 권장 사항을 면밀히 따라야 합니다. 이 프로토콜에 대한 수정 사항을 통합하고자 하는 실험실은 CDC와 협의하여 수정된 방법을 검증하고 확인해야 합니다.
프로토콜
사후 뇌 조직 샘플은 폭스 바이러스 및 광견병 분과(Doxvirus and Rabies Branch, CDC; 미국 조지아주 애틀랜타).
1. LN34 pan-lyssavirus real-time RT-PCR assay에 의한 동물 광견병 사후 진단을 위한 뇌 조직 수집
참고: 샘플에는 감염원이 포함되어 있을 수 있습니다. 적절한 개인 보호 장비(PPE)(두꺼운 고무 장갑 또는 기타 절단 방지 장갑, 실험실 가운, 방수 앞치마, 수술용 마스크, 부츠, 보호 슬리브 및 안면 보호대)를 착용하고 샘플의 사용, 보관 및 폐기에 필요한 안전 규정을 따릅니다. 리사바이러스 또는 알려지거나 감염 가능성이 있는 검체로 작업, 테스트, 생산 또는 연구 활동을 수행하기 전에 누구나 노출 전 광견병 예방 접종, 정기적인 혈청학적 검사 및 추가 예방 접종(필요한 경우)이 필요합니다 2,3,4,6,10.
- 시료당 하나의 시료 채취 튜브에 부착 라벨을 부착합니다. 각 시료 채취 튜브에 1mL의 TRIzol 시약 또는 기타 균질화 완충액과 MagNA Lyser 비드 일부(이하 "세라믹 비드")를 채웁니다. 세라믹 비드를 추가하려면 비드 튜브에서 샘플 수집 튜브로 조심스럽게 붓습니다. 세라믹 비드 튜브에는 일반적으로 샘플당 최소 20개의 1.4mm 직경 비드를 사용하여 2-5개의 샘플에 충분한 비드가 포함되어 있습니다.
주의: TRIzol 시약(이하 "균질화 완충액")은 유해 화학 물질입니다. 산 또는 표백제와의 접촉은 독성 가스를 방출합니다. 적절한 환기를 보장하십시오. 자세한 내용은 안전 데이터 시트를 참조하십시오. 사용자가 다른 균질화 버퍼를 TRIzol 시약 또는 TRI 시약으로 대체하는 경우 추가 검증이 필요합니다. TRIzol은 이 프로토콜에 대한 시료 균질화/용해 완충액, 리사바이러스 불활성화 완충액 및 RNA 안정성 완충액으로 작용합니다. 대체 균질화 완충액을 사용하려면 통제된 나란히 비교를 통해 추출 효율, 불활성화 및 안정성을 검증해야 합니다. - 4차 암모늄 화합물(QAC) 소독제로 작업 표면을 2분 동안 청소 및 소독하고 플라스틱 안감을 덧댄 흡수 패드를 놓습니다. 첫 번째 샘플에 대한 시약과 소모품만 놓습니다.amp위험한 연기를 방 밖으로 배출하는 기능이 있는 클래스 II 생물 안전 캐비닛(BSC)에 넣습니다.
참고: 희석된 QAC의 보관 한계에 대한 제조업체의 지침을 참조하십시오. 플라스틱 안감을 덀 패드가 생물 안전 캐비닛의 공기 흐름을 막지 않는지 확인하십시오. 공기 흐름이 방해되면 패드를 사용하지 마십시오. - 깨끗한 일회용 메스를 사용하여 뇌간과 소뇌의 전체 단면을 나타내는 조직을 수집합니다.
참고: 조직의 조작은 액체를 에어로졸화하거나 공기 중 입자를 생성하지 않는 방식으로 수행해야 합니다. 흄 후드 또는 생물 안전 캐비닛은 필요하지 않지만 냄새, 연기, 외부 기생충 및 뼈 조각으로부터 추가적인 보호를 제공하므로 환기 된 생물 안전 캐비닛이 권장됩니다.
주의: 리사 바이러스에 감염되었을 가능성이 있는 물질이 포함된 메스를 사용하는 것은 위험하므로 사용자는 적절한 안전 예방 조치를 취해야 합니다. 일회용 집게를 사용하는 것이 좋습니다.- 박쥐와 같은 작은 동물의 경우 뇌간과 소뇌 전체를 채취할 수 있습니다.
- 더 큰 동물의 경우, 소뇌의 세 엽 각각에서 뇌간과 조직의 전체 단면을 채취하십시오.
- 선택 사항: 직접 형광 항체(DFA) 검사를 수행하는 경우 이 시점에서 뇌 인상을 수집합니다. RNA 추출 및 LN34 assay에 의한 테스트를 위해 DFA에 대한 뇌 인상을 수집한 후 남은 조직을 사용합니다.
참고: TRIzol을 샘플에 추가하면 샘플은 더 이상 항원 기반 검출 방법 또는 바이러스 분리에 사용할 수 없습니다.
- 균질화 및 RNA 추출을 위한 시료를 준비합니다.
참고: RNA 추출 및 바이러스 불활성화의 효율성은 조직을 너무 많이 사용하면 영향을 받을 수 있습니다. 조직의 양은 사용된 균질화 완충액 부피의 약 1/10을 초과해서는 안 됩니다. 더 많은 조직을 사용하는 경우 효율적이고 성공적인 RNA 추출을 보장하기 위해 그에 따라 균질화 완충액의 양을 늘리십시오.- 작은 동물의 경우, 추출을 위해 필요한 모든 조직을 균질화 완충액과 비드가 들어 있는 튜브에 넣습니다. 100 ml의 균질화 완충액에서 1 mg의 샘플을 초과하지 마십시오. 더 큰 샘플의 경우 균질화 버퍼의 부피를 늘리거나 여러 튜브를 사용하여 1:10 비율의 샘플인 buffer를 반영합니다.
- 더 큰 동물의 경우, 조직을 철저히 다지고 균질화한 다음 균질화 완충액과 비드로 미리 채워진 튜브의 대표 부분을 제거합니다. 100 ml의 균질화 완충액에서 1 mg의 샘플을 초과하지 마십시오. 더 큰 샘플의 경우 균질화 버퍼의 부피를 늘리거나 여러 튜브를 사용하여 1:10 비율의 샘플인 buffer를 반영합니다.
- 옵션 1(비드 비터): 비드 비터, 1mL의 완충액 및 세라믹 비드를 사용하여 조직을 균질화합니다. 여러 개의 2mL 튜브 또는 더 큰 튜브를 사용해야 할 수 있습니다.
- 옵션 1(비드 비터): QAC 소독제(1:256)로 워크스테이션, 장비 및 외부 샘플 튜브를 세척하고 소독합니다. 2분 동안 그대로 두십시오.
- 옵션 1(비드 비터): BSC 내부에 균질화된 샘플이 담긴 원심분리기 로터를 로드합니다. 탁상용 마이크로 원심분리기에서 10,000-16,000 × g 의 모든 샘플을 2분 동안 원심분리합니다. BSC 내부에 원심분리기 로터를 내립니다.
- 옵션 1 (비드 비터): 2분 동안 그대로 둡니다.
- 옵션 1(비드 비터): 120μL의 균질액을 1mL의 균질화 완충액이 미리 채워진 튜브로 옮깁니다.
주의: 균질화는 에어로졸을 생성할 수 있으므로 BSC에서 수행해야 합니다. - 옵션 2(메스): 일회용 메스를 사용하여 필요한 조직을 잘게 다지고 면봉으로 도포한 다음 면봉을 균질화 완충액과 비드가 미리 채워진 튜브로 옮깁니다. 100 ml의 균질화 완충액에서 1 mg의 샘플을 초과하지 마십시오. 더 큰 샘플의 경우 균질화 버퍼의 부피를 늘리거나 여러 튜브를 사용하여 1:10 비율의 sample:buffer를 반영합니다.
주의: 리사 바이러스에 감염되었을 가능성이 있는 물질이 포함된 메스를 사용하는 것은 위험하므로 사용자는 적절한 안전 예방 조치를 취해야 합니다.
- 남은 조직을 원래 용기 또는 accession label이 표시된 새 빈 용기에 모으십시오. 재검사 또는 추가 특성 분석이 필요한 경우를 대비하여 이 조직을 보관하십시오.
- 워크스테이션, 장비 및 샘플 튜브 외부를 QAC 소독제 1:256으로 청소하고 소독합니다. 2분 동안 그대로 두십시오.
- 나머지 모든 샘플에 대해 1.2-1.5단계를 반복합니다.
- 미니 비드 비터로 최소 60초 동안 샘플을 균질화합니다. 튜브를 육안으로 검사하십시오. 큰 조직 조각이 남아 있으면 비드 비터를 60초 더 반복합니다. 이 단계는 조직이 위의 1.4.2.1 단계에서 완전히 균질화된 경우 선택 사항입니다.
참고: 조직이 완전히 균질화되었는지 확인하는 것이 중요합니다. 불완전한 균질화는 RNA 수율을 감소시킵니다. - 실온(RT)에서 최소 5분 동안 그대로 두십시오.
- 워크스테이션, 장비 및 시료 튜브 외부를 QAC 소독제로 세척하고 소독합니다(1:256).
참고: 샘플은 현재 감염성이 없는 것으로 간주되며 광견병 실험실에서 제거할 수 있습니다. - RNA 추출을 위해 균질화 완충액에서 시료를 즉시 처리하고, 실온(20°C - 25°C) 또는 냉장(4°C - 8°C)에서 며칠 동안 보관하거나, 장기 보관을 위해 -16°C 이하에서 보관하십시오.
2. RNA MiniPrep 키트를 사용한 RNA 추출 프로토콜
- BSC 아래에 작업 공간을 설정합니다.
- 먼지나 기타 환경 오염 물질을 제거하기 위해 작업을 시작하기 전에 70% 에탄올을 사용하여 BSC 작업 표면을 청소하십시오. QAC 소독제(1:256), RNase AWAY 또는 RNaseZap(제조업체의 권장 사항에 따름)으로 추가 표면 오염 제거를 수행합니다.
- 플라스틱 안감을 덧댄 흡수성 작업 패드를 배치하고 시약, 소모품 및 샘플을 BSC에 놓습니다.
알림: 플라스틱 안감 패드가 BSC의 공기 흐름을 차단하지 않는지 확인하십시오. 공기 흐름이 방해되면 패드를 사용하지 마십시오. - 모든 수집 튜브를 마이크로 원심분리기 튜브를 위한 깨끗한 랙에 배치합니다. 박쥐가 아닌 각 뇌 샘플에 대해 300μL의 100% 에탄올로 1.5mL 마이크로 원심분리 튜브 1개를 미리 채웁니다. 조직이 거의 없는 샘플(박쥐 뇌 샘플, 비뇌 샘플 또는 변질된 샘플)의 경우 1.5mL 마이크로 원심분리 튜브 1개에 각각 600μL의 100% 에탄올을 미리 채웁니다.
- 시료 전처리
- 섹션 1에서 준비한 모든 샘플을 BSC의 튜브 랙에 수집합니다. 테스트 직전에 얼어붙은 샘플을 해동하십시오.
- 추출 컨트롤을 해동합니다.
참고: lyssavirus RNA가 없는 샘플을 선택하는 것이 좋습니다. 샘플은 이전에 beta-actin 분석에 대한 예상 Ct 값 범위로 테스트해야 합니다. 예를 들어, 사전 분취된 조직 배양 세포 또는 이전에 검사된 음성 광견병 사례(인간 또는 동물)가 있습니다.
- 탁상용 마이크로 원심분리기에서 10,000-16,000 × g 의 모든 샘플을 2m 동안 원심분리기합니다.
- 상등액을 100% 에탄올이 함유된 새로운 멸균 마이크로 원심분리기 튜브로 옮깁니다. 상등액이 명백한 지질이나 고체 조직이 없이 투명한지 확인하십시오. 지질과 고형 조직의 수집을 피하십시오.
- 박쥐가 아닌 뇌 조직의 경우: 300μL의 상층액을 전달합니다.
- 조직이 거의 없는 샘플(박쥐 뇌 샘플, 비뇌 샘플 또는 변질된 샘플)의 경우 600μL의 상층액을 전달합니다.
- 나머지 균질액을 ≤-16°C의 스크류 탑 마이크로 원심분리기 튜브에 보관하십시오.
- 피펫을 위아래로 10회 반복하여 혼합합니다.
- 각 샘플에 대해 600μL의 에탄올-상등액 혼합물을 수집 튜브의 스핀 컬럼으로 옮깁니다.
- 액체가 컬럼을 통과할 때까지 원심분리기를 사용합니다(10,000-16,000 × g에서 1분). 플로우 스루를 폐기합니다.
- 샘플에 대해 600μL 이상의 에탄올-균질화 완충액 혼합물이 있는 경우 반복합니다.
- 각 컬럼을 새 수집 튜브로 옮깁니다.
- 각 컬럼에 400μL의 RNA prewash buffer를 추가하고 10,000-16,000 × g 에서 30초 동안 원심분리합니다.
- 플로우 스루(flow-through)를 폐기하고 각 컬럼을 동일한 수집 튜브로 되돌립니다.
- 2.10-2.11단계를 반복합니다.
- 각 컬럼에 700μL의 RNA 세척 버퍼를 추가하고 10,000-16,000 × g 에서 2분 동안 원심분리합니다. 세척 버퍼가 각 열을 완전히 통과했는지 확인합니다.
- 각 컬럼을 RNase가 없는 튜브로 조심스럽게 옮깁니다.
- 2.13에서 플로우 스루와 수집 튜브를 폐기합니다.
- 50μL의 DNase/RNase-Free 물을 컬럼 매트릭스에 직접 첨가하여 RNA를 용리시킵니다.
참고: 피펫 팁으로 컬럼 매트릭스를 만지지 마십시오. - RT에서 30초 동안 배양한 다음 10,000-16,000 × g 에서 1분 동안 원심분리합니다.
- RNA를 마이크로 원심분리기 튜브라고 표시된 새로운 나사 상단, 평평한 바닥 접근으로 조심스럽게 옮깁니다. 추출된 RNA를 얼음으로 옮겨 즉시 검사할 수 있습니다. -70 °C 이하에서 장기간 보관하십시오.
참고: 더 따뜻한 온도에서 보관하거나 동결-해동을 반복하면 RNA가 저하되고 진단 결과에 영향을 미칠 수 있습니다.
3. LN34 pan-lyssavirus real-time RT-PCR assay를 위한 프로토콜
- 시약을 준비합니다.
- 인공 포지티브 컨트롤
- 인공 양성 대조군 RNA가 CDC8에 의해 생성되는 경우, 보관, 재구성 및 분취를 위해 포장에 있는 지침을 따르십시오. positive control RNA의 single-use 부분 표본이 이미 사용 가능한 경우 이 단계를 건너뜁니다.
참고: 작업 농도의 양성 대조군 RNA는 마스터믹스 제제와 동일한 영역이 아닌 템플릿 첨가 영역에서 처리해야 합니다. 양성 대조군 RNA는 주어진 로트에 대해 결정된 예상 범위 내에서 cycle threshold(Ct) 값을 생성해야 합니다. 실행 간에 양성 대조군 RNA에 대한 LN34 Ct 값은 ±1.5 Ct 값 이상으로 차이가 나지 않아야 합니다. - 일회용 부분 표본을 얼음 또는 얼음 블록에 사용하기 직전에 -70 °C ≤ 보관에서 해동합니다. 동결-해동하지 말고 냉장 온도에서 장기간 보관된 부분 표본을 폐기하십시오.
참고: 양성 대조군은 LN34 분석에서 세 번 실행해야 합니다. 인공 양성 대조군8 은 베타-액틴 분석에서 증폭되지 않습니다.
- 인공 양성 대조군 RNA가 CDC8에 의해 생성되는 경우, 보관, 재구성 및 분취를 위해 포장에 있는 지침을 따르십시오. positive control RNA의 single-use 부분 표본이 이미 사용 가능한 경우 이 단계를 건너뜁니다.
- 추출 제어 및 샘플: 갓 추출한 샘플을 얼음(또는 얼음 블록)에 놓거나 샘플을 사용하기 직전에 얼음(또는 얼음 블록)에 ≤-70°C 보관하여 해동합니다.
참고: RNA는 PCR 산물 또는 다량의 바이러스 물질(예: 양성 대조군 생성, 바이러스 증식)의 마스터믹스 준비 또는 조작에 사용되는 영역과 분리된 샘플 또는 템플릿 추가를 위해 지정된 영역에서 해동 및 처리해야 합니다.
- 인공 포지티브 컨트롤
- 마스터믹스 준비 영역에서 마스터믹스 시약을 준비합니다.
- singleplex LN34 RT-PCR 분석의 마스터믹스 준비
참고: 사용자는 싱글플렉스(3.2.1단계) 또는 멀티플렉스(3.2.2단계) 형식으로 샘플을 테스트할 수 있습니다. 3.2.1과 3.3.2를 모두 수행할 필요는 없습니다. 마스터믹스 제처리, 프라이머 및 프로브 부분 표본, 템플릿 제어 시약은 샘플 처리, 부검, PCR 및 기타 바이러스 물질이 조작되는 영역과 분리된 깨끗한 영역에서 해동 및 조작해서는 안 됩니다. 이는 별도의 공간 또는 일방적인 시료 흐름이 있는 캐비닛 시스템을 통해 달성할 수 있습니다.- 표 1 및 표 2에 표시된 대로 작업 농도에서 프라이머 및 프로브 혼합물을 생성합니다. primer와 probe의 working dilution aliquots가 이미 준비되어 있는 경우 이 단계를 건너뜁니다.
- 부분 표본 프라이머 및 프로브를 1.5mL 보관 스톡과 50μL 작업 스톡에 넣고 어두운 곳에서 ≤-16°C에서 보관합니다. primer와 probe의 working dilution aliquots가 이미 준비되어 있는 경우 이 단계를 건너뜁니다.
참고: 3.2.1.2단계를 수행하는 것이 좋습니다. - 마스터믹스 준비 영역의 얼음 또는 얼음 블록에 ≤-16°C 보관에서 1단계 RT-PCR 버퍼, 템플릿 제어 없음, 프라이머 및 프로브를 해동합니다.
참고: 만료 날짜 또는 성능 장애 중 먼저 도래하는 날짜까지 시약을 사용하십시오. - 사용하기 전에 모든 버퍼, 프라이머 및 프로브를 간단히 와류와 원심분리합니다.
- 원스텝 RT-PCR 효소를 사용할 때까지 얼음 위 또는 얼음 블록에 보관하십시오.
- RNA 샘플
참고: 동결-해동이 성능에 영향을 미칠 수 있으므로 가능하면 새로 추출한 RNA를 사용하십시오. - RNA 샘플을 사용할 때까지 얼음이나 얼음 블록에 보관하십시오.
- 얼음이나 얼음 블록에서 동결된 RNA 샘플을 해동합니다.
- 분석법당 하나의 마이크로 원심분리기 튜브(LN34 및 βA)에 라벨을 부착합니다.
- 분석당 설정할 반응 수(N)를 결정합니다.
- 샘플 수에 3을 곱하고 대조 반응 웰에 6을 더하고 피펫팅 중 손실된 부피를 설명하기 위해 10%의 추가 반응을 더하여 LN34 분석의 반응 수를 계산합니다. (예: 10개 샘플의 경우: (10 x 3) + 6 = 36회 반응, 초과 반응: (36 x 0.1) + 36 = 3.6 + 36 = 총 39.6회 반응 또는 40회 반올림)
참고: 임상 테스트의 경우 LN34에 대해 모든 샘플을 세 번 테스트하는 것이 좋습니다. 감시 목적으로 각 샘플을 중복으로 테스트할 수 있습니다. 초기 분석 온보딩 중에 triplicate를 사용하여 반복실험과 우수한 기법 간의 변동성을 낮추는 것이 좋습니다. - 피펫팅 중 손실된 부피를 고려하여 샘플 수와 4개의 대조 반응 웰 및 10%의 추가 반응을 추가하여 βA 분석에 대한 반응 수를 계산합니다.
- 표 2를 사용하여 LN34 및 βA 마스터믹스에 대한 각 시약의 부피를 측정합니다.
- LN34 분석에서 세 번 테스트할 각 샘플에 대해 웰을 지정하고 96 웰 플레이트 맵을 사용하여 βA 분석에 대해 단일화합니다.
- 탁상용 마이크로 원심분리기를 사용하여 30초 동안 잠시 볼텍싱하고 회전한 후 할당된 각 LN34에 23μL의 LN34 분석 마스터믹스를 분배하여 튜브 바닥에서 액체를 수집합니다. 거품을 도입하지 마십시오.
- 탁상용 마이크로 원심분리기에서 30초 동안 잠시 볼텍싱하고 회전한 후 할당된 각 βA 라벨링 웰에 23μL의 βA 분석 마스터믹스 시약을 투약하여 바닥에서 액체를 수집합니다.
- 각 NTC 웰에 2 μL의 PCR 등급 물을 피펫팅하여 NTC(No Template Control) 반응을 설정합니다.
- 웰을 덮고 플레이트를 템플릿 추가 영역으로 옮깁니다.
- RNA 샘플이 들어있는 튜브를 간단히 와류와 원심 분리하십시오.
- 첫 번째 샘플에서 추출된 RNA 2 μL를 해당 샘플에 대해 표지된 각 웰로 피펫팅합니다. 거품을 도입하지 마십시오.
- 시각화를 통해 RNA가 피펫으로 유입되었는지 확인합니다.
- 샘플이 올바른 웰에 추가되었는지 확인하기 위해 웰 측면에 피펫을 놓습니다.
- RNA가 포함된 피펫 팁을 열린 웰 위로 가능한 한 흔드는 것을 피하십시오.
- 나머지 샘플과 positive control RNA에 대해 3.2.10단계를 반복합니다.
- 모든 샘플을 추가한 후 웰 위에 광학 접착 덮개를 놓습니다.amp르와 대조군. 모든 웰을 덮고 완전히 밀봉하도록 주의하십시오.
- 500 × g 의 원심분리기를 탁상용 원심분리기에서 RT에서 1분 동안 또는 샐러드 스피너 타입의 플레이트 스피너를 사용합니다.
- 밀봉된 플레이트를 FAM 및 VIC/HEX 리포터 염료에 대해 보정된 Real-Time PCR 기기에 넣고 표 3에 표시된 사이클링 매개변수로 설정합니다.
- LN34 Multiplexed(LN34M) 분석을 위한 마스터 믹스를 준비합니다.
- 표 2에 따라 하나의 마이크로 원심분리기 튜브 LN34M에 라벨을 붙입니다.
- 분석당 설정할 반응 수(N)를 결정합니다.
- 샘플 수에 3을 곱하여 LN34M 분석의 반응 수를 계산하고, 대조 반응 웰에 6을 더하고 피펫팅 중 손실된 부피를 고려하여 10%의 추가 반응을 더합니다. (예: 10개 샘플의 경우: (10 x 3) + 6 = 36회 반응, 초과 반응: (36 x 0.1) + 36 = 3.6 + 36 = 총 39.6회 반응 또는 40회 반올림)
- 25 μL 또는 12.5 μL 형식을 선택할 수 있습니다. 표 2를 사용하여 LN34M 마스터믹스에 대한 각 시약의 부피를 측정합니다.
- 96웰 플레이트 맵을 사용하여 LN34M 분석에서 세 번 테스트할 각 샘플에 대한 웰을 지정합니다.
- LN34M 분석용 시약을 웰에 분주합니다. 23 μL(25 μL 반응의 경우) 또는 10.5 μL(12.5 μL 반응의 경우)의 마스터 믹스를 할당된 각 웰에 분배하기 전에 간단히 와류와 스핀 다운 튜브를 사용하여 바닥에서 액체를 수집합니다. 거품을 도입하지 마십시오.
- 각 NTC 웰에 2 μL의 PCR 등급 물을 피펫팅하여 NTC 반응을 설정합니다.
- 웰을 덮고 플레이트를 템플릿 추가 영역으로 옮깁니다.
- RNA 샘플이 들어있는 튜브를 간단히 소용돌이치고 스핀 다운 튜브하여 바닥에서 액체를 수집합니다.
- 첫 번째 샘플에서 추출된 RNA 2 μL를 해당 샘플에 대해 표지된 각 웰로 피펫팅합니다. 거품을 도입하지 마십시오.
- RNA가 파이펫 시각화에 유입되는지 확인합니다.
- 샘플이 올바른 웰에 추가되었는지 확인하기 위해 웰 측면에 피펫을 놓습니다.
- RNA가 포함된 피펫 팁을 열린 웰 위로 가능한 한 흔드는 것을 피하십시오.
- 나머지 샘플과 양성 대조군 RNA에 대해 3.3.8단계를 반복합니다.
- 마지막 샘플/대조군을 추가한 후 웰 위에 광학 접착 덮개를 놓고 모든 웰이 덮이고 완전히 밀봉되었는지 확인합니다.
- 500 × g 의 원심분리기를 탁상용 원심분리기에서 RT에서 1분 동안 원심분리기하거나 샐러드 스피너 타입의 플레이트 스피너를 사용합니다.
- 밀봉된 플레이트를 FAM 및 VIC/HEX 리포터 염료에 대해 보정된 Real-Time PCR 기기에 넣고 표 3과 같이 사이클링 매개변수로 설정합니다. 패시브 레퍼런스 염료를 ROX로 설정하고 표준 모드에서 실행합니다(고속 모드에서는 실행하지 않음).
참고: 이 설정은 이 프로토콜에 언급된 기기에 따라 다르며 ROX를 수동 염료로 포함하는 1단계 RT-PCR 시약을 사용해야 합니다. 대체 기기는 최적의 실행 설정을 결정하기 위해 다양한 접근 방식이 필요합니다. 최상의 성능을 위해 제조업체에 따라 정상적인 기기 유지 보수를 보장하십시오.
- singleplex LN34 RT-PCR 분석의 마스터믹스 준비
4. 결과 해석
- LN34/FAM의 경우 0.2, βA/HEX/VIC의 경우 0.05 값을 사용하여 자동 기준선 및 수동 임계값 계산을 설정합니다.
참고: 이 설정은 이 프로토콜에 언급된 기기에 따라 다르며 ROX를 수동 염료로 포함하는 1단계 RT-PCR 시약을 사용해야 합니다. 대체 기기는 기준선 및 임계값을 계산하기 위해 다양한 접근 방식이 필요합니다. - 모든 대조군이 예상대로 수행된 경우 표 4 의 지침에 따라 진단 결과를 확인합니다(표 5).
- 증폭 플롯을 확인하여 모든 Ct 또는 Cq 값을 확인합니다.
- 권장 사항에 따라 비정상적인 결과를 조사합니다.
5. 샘플 보유 및 보관
- 테스트가 완료되고 결과가 보고될 때까지 모든 샘플을 -16°C 이하에서 냉동 보관합니다. 결과를 확인하거나 비정상적인 테스트 결과의 경우 숙주 동물을 종으로 식별하기 위해 원래 조직을 유지합니다.
- 고유한 샘플 식별자를 사용합니다. 모든 튜브, 보고서 및 서류에 완전한 고유 시료 식별자를 표시하십시오.
- 반복 테스트가 필요한 경우를 대비하여 중간 샘플(단기)을 보관하십시오.
- 대조군, 역학적 유형 지정 및 기타 목적으로 사용하기 위해 필요에 따라 대표 양성 샘플을 보관합니다.
- 장기 보관을 위해 RNA를 ≤-70°C에 보관하십시오.
결과
ABI ViiA7 Real-Time PCR 기기에서 실행된 성공적인 LN34 분석의 대표 이미지가 그림 2에 나와 있습니다. 로그 눈금으로 표시된 결과를 보면 곡선이 임계값을 교차하는 지점인 Ct 값을 쉽게 볼 수 있습니다(그림 2A, C). 선형 스케일로 플롯할 때 성공적인 증폭은 시그모이드(또는 "S"자형) 곡선(그림 2B, D)으로 나타나고, 음의 결과는 직선의 평평한 선으로 나타나야 합니다. 선형 및 로그 스케일 보기 모두에서 결과를 보는 것은 가능한 이상 또는 오류를 식별하기 위해 권장됩니다. 다성분 플롯 보기의 일반적인 양성 및 음성 결과는 각각 그림 2E, F에서 확인할 수 있으며, 여기서 프로브를 라벨링하는 염료의 형광 수준(LN34의 경우 FAM, βA의 경우 VIC/HEX)을 반응 버퍼(ROX)의 수동 염료와 관련하여 관찰할 수 있습니다.
비정상적인 결과의 예가 그림 3에 나와 있습니다. 성공적인 실행 그래프(그림 2)와 비정상 그래프(그림 3)를 비교하는 데 사용하여 비정형 실행 및 계측 문제를 분리할 수 있습니다. 그림 3A 는 신호가 임계값을 교차하여 LN34에 대한 Ct 값을 생성하는 것을 보여주지만, 증폭 곡선은 매우 비정형적이며 선형으로 증가합니다. 다성분(그림 3B) 플롯은 또한 양성 샘플의 일반적이지 않은 물결 선을 보여줍니다. 이 예제에서는 단순히 Ct 값을 복사하는 것이 아니라 증폭 플롯을 보는 것이 중요하다는 점을 강조합니다. 항상 증폭 곡선이 모든 샘플에 대해 정상으로 보이는지 확인하십시오. 다성분 플롯을 보는 것도 불규칙성이 없는지 확인하는 것이 좋습니다. 경우에 따라 지저분한 기준선 신호는 증폭이 발생하지 않은 경우 Ct 값을 생성할 수 있습니다. 증폭 신호가 선형으로 나타나면 곡선이 사라지는지 확인하기 위해 기준선을 조정하는 것이 좋습니다. 비정상적인 신호가 있는 경우 전체 실행을 반복해야 합니다. 문제가 지속되면 Real-Time PCR 기기에서 배경 플레이트를 세척하고 실행하는 것이 좋습니다. 사용 가능한 경우, PCR 산물을 아가로스 겔에서 실행하거나 염기서열분석을 수행하여 비정상적인 결과를 해결할 수 있습니다. 진단 결과를 결정하기 위해 겔 전기영동 또는 염기서열분석 결과를 사용하는 것은 권장되지 않습니다.
이전 연구에서는 LN34 분석에 대한 반복실험, 분석 실행, 작업자 및 실험실 간의 변동성이 낮은 것으로 나타났습니다7. 동일한 샘플의 반복실험 간에 높은 변동성(>±1.5 Ct 차이)이 관찰되면 해당 RNA를 다시 검사해야 합니다. 높은 변동성은 파이펫, 실험실 관행, 잘못된 파이펫팅 또는 Real-Time PCR 기계의 문제로 인해 발생할 수 있습니다. 여러 샘플 또는 분석 실행에 걸쳐 높은 변동성이 반복적으로 관찰되는 것은 체계적인 문제를 나타낼 수 있습니다. RNA가 낮고 양성 샘플(Ct 35)에 대한 분석 임계값에 근접한 샘플은 반복 간 Ct 값에서 더 높은 변동성을 나타낼 수 있습니다. 지속적인 변동성, 일관되지 않은 결과 또는 분석 실패의 원인을 해결하기 위해 CDC와의 상담 및 문제 해결이 필요할 수 있습니다.
PCR 기반 분석법의 높은 감도로 인해 본질적으로 오염에 취약합니다. 우수한 실험실 관행을 엄격하게 준수하는 것이 교차 오염을 완화하는 가장 좋은 방법입니다. 잠재적인 오염을 식별하는 방법을 아는 것이 중요합니다. 템플릿 제어가 없고 분석 실행에서 음성 샘플 웰이 모두 유사한 Ct 값을 생성하는 것으로 의심되는 경우 시약 오염을 의심해야 합니다. PCR 시약(완충액, 물, 프라이머 및 효소)의 새로운 부분 표본과 동일한 RNA로 테스트를 반복합니다. 모든 샘플과 추출 대조군에서 유사한 CT 값이 생성되지만 NTC가 음성인 경우 추출 시약의 오염을 조사하고 새로운 시약을 사용하여 추출을 반복해야 합니다. 오염 위험을 줄이고 많은 양의 값비싼 시약을 폐기할 가능성을 피하기 위해 소량의 시약 부분 표본을 만드는 것이 좋습니다. 시료 교차 오염은 식별하기가 더 어렵습니다. 시료 오염이 의심되는 경우, 원래 조직부터 검체 채취를 반복합니다. 경우에 따라 바이러스 RNA의 염기서열분석(sequencing)을 통해 오염을 확인할 수 있으며, 특히 오염된 RNA가 예상되는 바이러스 변이체(예: 실험실에서 사용되는 대조군 바이러스)와 매우 다른 경우 더욱 그렇습니다. 동시에 처리된 두 샘플의 염기서열분석을 통해 바이러스 염기서열이 동일한지 확인할 수 있지만 염기서열이 매우 유사할 것으로 예상되는 경우(예: 동일한 카운티에서 수집된 동일한 변이체) 정보가 제공되지 않을 수 있습니다. positive control RNA로 인한 시료 오염이 의심되는 경우 아가로스 겔에서 LN34 분석 앰플리콘을 실행하여 lyssavirus RNA(165bp)와 positive control RNA(99bp)를 구별할 수 있습니다. CDC8에서 제공하는 양성 대조군 RNA를 생성하는 데 사용되는 템플릿의 염기서열입니다.
다른 병원균의 경우, Laboratorians를 사용하여 그림 4에서 청록색으로 표시된 약한 증폭과 같은 "노이즈"를 제거하기 위해 임계값을 수동으로 설정할 수 있습니다. 이 방법은 광견병이 거의 100% 치명적이기 때문에 끔찍한 결과를 초래하는 위음성 결과로 이어질 수 있으므로 광견병 진단에 권장되지 않습니다. 약하거나 늦은 증폭 샘플에 대해 부정적인 결과를 생성하기 위해 임계값을 수동으로 변경하지 마십시오. 이러한 샘플은 광견병을 배제하기 위해 다시 추출 및/또는 재검사해야 합니다.
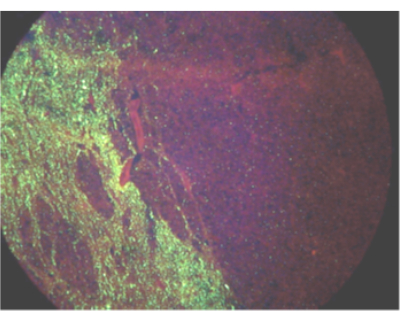
그림 1: 직접 형광 항체 검사에 의한 감염된 당나귀에서 광견병 바이러스 항원의 일방적 확산을 보여주는 시야.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
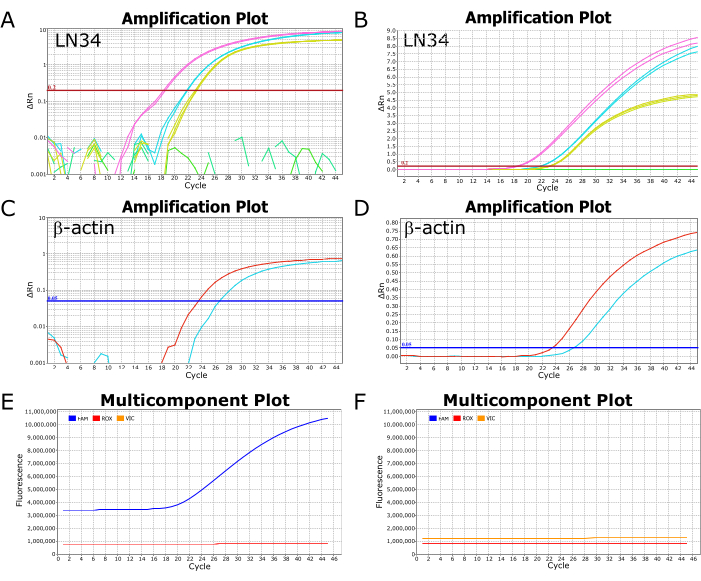
그림 2: 성공적인 LN34 분석 실행의 증폭 및 다성분 플롯. (A-D) 결과 데이터는 LN34 및 βA 분석에 대한 (A,C) 로그 스케일 및 (B,D) 선형 스케일에 플롯됩니다. 패널 A와 B는 양성 대조군(노란색)과 비교하여 두 샘플(분홍색 및 청록색)의 LN34 결과를 보여줍니다. 패널 B에는 런에서 추가 음성 샘플을 나타내는 평평한 녹색 선이 있습니다. A에서 녹색 선은 증폭을 보여주지 않으며 끊어진 세그먼트로 표시됩니다. LN34 분석의 임계값은 수동으로 0.2로 설정되었으며 빨간색 수평선으로 표시됩니다. (씨,디) 두 개의 샘플(빨간색 및 청록색)에 대한 βA 분석 결과. βA 분석의 임계값은 0.05로 수동으로 설정했습니다. (E,F) 다성분 플롯은 FAM(LN34), VIC(βA) 및 ROX(AgPath-ID 완충액에 존재하는 수동 염료)에 대한 각 주기에서 형광(RFU)을 보여줍니다. ROX 수준은 모든 사이클에서 일정하게 유지되어야 합니다. 일반적인 양성 샘플이 패널 E에 표시되어 있습니다. FAM 형광은 이 샘플의 경우 주기 18에서 시작하여 시그모이드 곡선으로 증가합니다. 일반적인 음성 샘플은 패널 F에 표시되며, 여기서 FAM 수준은 모든 주기에서 ROX 수준과 평행하게 유지됩니다. 데이터는 ABI ViiA7 Real-Time PCR 기기에서 가져온 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: LN34 분석에서 관찰된 희귀한 비정형 신호의 대표 이미지는 ViiA7 Real-Time PCR 기기에서 실행됩니다. (아프) 유정 오염으로 인해 생성된 증폭(A,C,E) 및 다성분(B,D,F) 플롯. FAM 형광의 선형 증가(A,C) 및 물결 모양 변동(B,D)은 곡선의 모양과 형광 변화의 크기에 따른 실제 증폭을 나타내지 않습니다. 패널 A에서 D는 패널 A와 B에 표시된 반복실험에 대해 Ct 값이 생성되었음에도 불구하고 음성 샘플을 나타낼 가능성이 높습니다. 패널 E와 F는 다성분 플롯에서 더 쉽게 볼 수 있는 이상한 물결 모양 신호를 보여줍니다. 이러한 유형의 신호는 조사해야 하며, 이 실행에서 모든 제어가 예상대로 수행되었음에도 불구하고 기기 문제를 나타낼 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
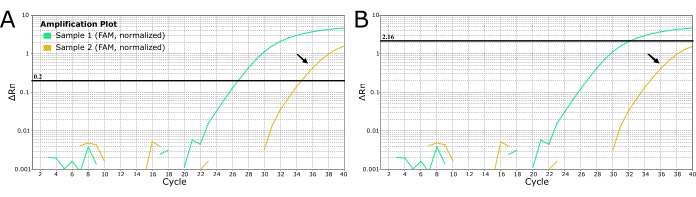
그림 4: 2개의 광견병에서 추출한 LN34 실시간 RT-PCR 곡선은 임계값을 설정하는 두 가지 방법을 보여주는 샘플로 의심됩니다. (A) LN34 임계값은 0.2로 설정되었습니다(모든 실행에 권장됨). (B) "노이즈"(늦은 증폭 신호)로 결정된 신호를 마스킹하기 위해 각 실행에 대해 다른 임계값을 수동으로 결정합니다. 패널 B 에서 사용된 방법은 진양성 결과를 놓칠 경우 심각한 결과를 초래할 수 있기 때문에 광견병에는 권장되지 않습니다. 늦은 증폭은 약한 양성 샘플, PCR 억제 또는 양성 사례의 추출 실패를 나타낼 수 있습니다. 또한 교차 오염을 나타낼 수도 있습니다. 황금색 샘플(검은색 화살표로 표시)은 분석의 컷오프에서 Ct 값을 생성하며 음성으로 간주되어서는 안 됩니다. 증폭이 늦은 샘플은 다시 추출하고 다시 테스트해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: LN34lys(singleplex LN34), LN34M(LN34 및 βA multiplexed) real-time RT-PCR 분석에 사용된 프라이머 및 프로브 염기서열 및 농도. LN34 프로브는 5말단에 형광 FAM 염료로, 3말단에 블랙홀 소광제(BHQ1)로 표지됩니다. βA 프로브는 5말단에 형광 HEX 염료로, 3말단에 블랙홀 소광제(BHQ1)로 표지됩니다. 잠긴 뉴클레오티드 변형 염기는 염기서열에서 염기 앞에 더하기로 표시됩니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: LN34lys, Actin3 및 LN34M 분석을 위해 설정된 분석. 프라이머 및 프로브 이름, 염기서열 및 농도는 표 1에서 확인할 수 있습니다. LN34_F1 ACGCTTAACAACCAGATCAAAGAA7에 해당합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: ABI 기기의 사이클링 매개변수. 중요: FAST 모드가 아닌 STANDARD 모드에서 실행해야 합니다. ROX는 수동 참조 염료로 선택해야 합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 4: 싱글플렉스(위, 파란색 테이블) 및 멀티플렉스(아래, 빨간색 테이블) 형식에 대한 LN34 실시간 RT-PCR 결과 해석 알고리즘. 양성 LN34 결과는 βA 결과가 음성이거나 결정적이지 않더라도 양성으로 간주되어야 합니다. LN34 앰플리콘이 검출되지 않으면 βA Ct는 음수로 간주되기 위해 나열된 Ct 값 컷오프≤되어야 합니다. βA Ct 값은 테스트 중인 샘플의 품질을 나타내고 가능한 억제를 식별합니다. 원래 임상 검체의 낮은 농도는 βA 성장 곡선에 영향을 미쳐 눈에 띄는 증폭을 일으키지 않을 수 있습니다. β-actin을 검출하지 못하는 또 다른 요인으로는 RNA 손실 또는 PCR 억제제의 캐리오버로 인한 RNA 추출 불량, 잘못된 분석 설정 및 기술, 불만족스러운 시료 유형 또는 품질, 시약 또는 장비의 오작동 등이 있습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 5: LN34 분석 대조군에 대한 일반적인 결과의 작용 및 해석. 세 가지 대조군(광견병 양성 대조군 RNA, 광견병 음성 추출 대조군 및 템플릿 없음 대조군)은 모두 실행이 통과되기 위해 예상되는 결과를 생성해야 합니다. 양성 대조군의 실패 또는 템플릿 대조군이 없는 경우 피펫팅 오류, 시약 또는 장비 고장을 나타낼 수 있습니다. 테스트된 모든 RNA 샘플을 포함한 전체 실행을 반복해야 합니다. 추출 제어의 실패는 시약 실패, 피펫팅 오류 또는 교차 오염과 같은 추출 중 문제를 나타낼 수 있습니다. 모든 샘플의 추출을 반복해야 합니다. 제어 실패는 숙련된 실험실 직원에게는 드문 일이어야 합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
성공적인 LN34 분석 실행을 위해서는 positive control, extraction control이 필요하며, 각 분석 실행에서 template control 반응이 예상대로 수행되지 않거나 run을 무효화하고 반복해야 합니다. 3개의 LN34 양성 대조군 복제 반응은 모두 지정된 범위 내에서 임계값을 초과해야 하며, 그렇지 않으면 run을 반복해야 합니다. 이전 간행물 7,8에 설명된 양성 대조군 RNA는 βA 분석에서 증폭되지 않습니다. 템플릿 없음 제어 반응은 LN34 또는 βA 분석에 대한 임계값 선을 교차하는 증폭 곡선을 나타내지 않아야 합니다. 추출 제어는 LN34에 대한 증폭을 나타내지 않아야 합니다. NTC 또는 추출 대조군에서 예기치 않은 증폭이 관찰되면 오염을 나타내고 모든 샘플에 대한 실행 및 반복 테스트를 무효화할 수 있습니다(표 5 참조). 사용자는 추출 시약의 숙주 βA 오염을 모니터링하기 위해 무공정 대조군 또는 무시료 추출 대조군을 포함한 추가 대조군을 추가하는 것을 고려할 수 있습니다.
광견병 치사율이 100%에 가까워짐에 따라, 약하거나 비정상적인 증폭은 Ct 값을 생성하지 않더라도 추가 조사가 권장됩니다. 음성 반응 또는 NTC 반응은 증폭을 나타내지 않아야 하며, 형광은 다성분 보기에서 ROX 형광과 평행한 평평한 선으로 나타나야 합니다. 특히 다중 반복에서 곡선의 관찰은 교차 오염 또는 약한 양성 결과를 나타낼 수 있습니다. 양성 샘플에 대한 모든 반복실험은 유효한 양성 결과를 위해 증폭되어야 합니다. 두 분석 중 하나에서 반복의 하위 집합만 증폭되는 경우 샘플을 다시 테스트해야 합니다. 또한 매우 다양한 결과(반복 간 Ct 값 차이 > ±1.5)를 생성하는 샘플은 유효하지 않은 것으로 간주되어야 하며 샘플을 다시 검사해야 합니다. 문제가 지속되면 샘플을 다시 추출해야 합니다.
적절하게 수집 및 저장된 뇌간과 소뇌 조직에서 추출한 광견병 양성 샘플은 LN34 분석에 대해 35주기 미만의 Ct 값을 가질 것으로 예상됩니다. 결론이 나지 않은 모든 샘플은 LN34 실시간 RT-PCR로 다시 테스트해야 합니다. 반복 테스트에서 샘플이 결정적이지 않고 모든 대조군이 예상대로 수행된 경우 RNA를 다시 추출하는 것이 좋습니다. 바이러스 RNA(LN34 Ct > 35)가 낮은 샘플은 오염, 낮은 바이러스 부하, PCR 억제 또는 추출 실패와 같은 잠재적인 문제를 나타낼 수 있습니다. 원래 조직에서 새로운 뇌 조각을 채취하여 RNA를 추출하고 샘플을 다시 테스트합니다. 마찬가지로 Ct 값이 33(singleplex), 37(LN34M)> 또는 βA 분석에서 증폭이 없는 경우 RNA 추출에 실패했음을 나타낼 수 있습니다. 이러한 샘플에 대해 추출을 반복한 다음 LN34 및 actin에 대해 테스트를 반복합니다. 반복된 테스트 후에도 샘플에서 다시 결론을 내리지 못한 결과가 나오면 DFA(FAT) 테스트, DRIT 또는 바이러스 분리와 같은 보조 방법을 사용하십시오. 계속해서 불일치하는 결과 또는 결론이 나지 않는 결과가 관찰되는 경우, 광견병 참조 실험실에 문의하여 확인 검사를 받으십시오.
RNA 추출에 억제제가 존재하는 경우 PCR 분석에서 위음성 결과가 생성될 수 있습니다. 특정 샘플에 대해 βA 조절 반응(예: Ct 값 > 33 또는 Ct 값 > 37)의 억제가 의심되거나 억제가 관찰되는 경우, 추출된 RNA를 2회 이상의 희석액(예: 뉴클레아제가 없는 물에서 1:10 및 1:100)으로 테스트하여 잠재적인 PCR 억제제를 희석해야 합니다. 까다로운 샘플의 경우 물을 첨가하지 않음으로써 RT-PCR 반응에서 RNA 입력량을 8.5μL까지 증가시킬 수 있습니다. 이는 원래 샘플에서 억제 증가(2 μL 입력 RNA에 비해 나중에 Ct 값) 또는 낮은 RNA 수준(2 μL 입력 RNA에 비해 8.5 μL를 사용할 때 더 빠른 Ct 값)을 나타낼 수 있습니다.
LN34 분석은 리사바이러스를 구별하거나 광견병 바이러스 변종을 결정하지 않습니다. LN34 분석 앰플리콘은 저분해능 광견병 바이러스 변이 유형 지정 또는 리사바이러스 종11의 식별을 위해 염기서열분석을 할 수 있습니다.
공개
공개 없음
감사의 말
우리는 공개 데이터 공유 및 피드백을 통해 LN34 분석의 구현, 검증 및 최적화에 기여한 많은 광견병 진단 검사 실험실의 노력과 협력에 감사드립니다. 상표명 및 상업적 출처의 사용은 신원 확인을 위한 것일 뿐이며 질병통제예방센터(Centers for Disease Control and Prevention), 미국 보건복지부(U.S. Department of Health and Human Services) 또는 저자의 관련 기관의 승인을 의미하지 않습니다. 저자가 표명한 결론, 연구 결과 및 의견이 미국 보건복지부(Department of Health and Human Services), 질병통제예방센터(Centers for Disease Control and Prevention) 또는 저자의 관련 기관의 공식 입장을 반드시 반영하는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| 7500 Fast | Applied Biosystems | N/A | Do not substitute without validation |
| 7500 Fast Dx | Applied Biosystems | N/A | Do not substitute without validation |
| ABI ViiA 7 | Applied Biosystems | N/A | Do not substitute without validation |
| AgPath-ID One-Step RT-PCR Kit | ThermoFisher Scientific | AM1005 | Do not substitute without validation |
| Beadbug6 | Benchmark Scientific | D1036 | |
| Direct-zol RNA MiniPrep kit | Zymo Research | R2052 | |
| MagNA Lyser green beads | Roche | 3358941001 | |
| Microcentrifuge | Eppendorf | 5425 R | |
| Optical 96-well Reaction Plates | ThermoFisher Scientific | 4346907 | |
| Optical Adhesive covers | ThermoFisher Scientific | 4311971 | Alternative: caps |
| Polyester fiber-tipped applicator swabs | BD BBL Polyester Fiber Tipped Application Swab | 220690 | |
| QuantStudio 6Flex | Applied Biosystems | 4485691 | Do not substitute without validation |
| Quaternary ammonium disinfectant (1:256) | LYSOL | WBB56939 | Do not substitute without validation |
| RNase AWAY | ThermoFisher Scientific | 7002PK | |
| RNaseZap | ThermoFisher Scientific | AM9780 | |
| Single-use scalpel, a scalpel with a safety mechanism | Integra Miltex | 4-510 | |
| Sterile polyproylene microcentrifuge tubes (1.5 mL), nuclease free | Sarstedt | 72.692.405 | |
| Sterile polyproylene microcentrifuge tubes (2 mL), nuclease free | Sarstedt | 72.694.600 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | Do not substitute without validation |
참고문헌
- Meechan, P. J., Potts, J. . Biosafety in Microbiological and Biomedical Laboratories. , (2020).
- . Terrestrial Manual 2023 Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals (2023)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/handle/10665/310836 (2018)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/bitstream/handle/10665/310837/9789241515306-eng.pdf?ua=1 (2019)
- . Protocol for postmortem diagnosis of rabies in animals by direct fluorescent antibody testing: A minimum standard for rabies diagnosis in the United States Available from: https://www.cdc.gov/rabies/pdf/RabiesDFASPv2.pdf (2003)
- World Health Organization. . WHO Expert Consultation on Rabies: Third Report. , (2018).
- Gigante, C. M., et al. Multi-site evaluation of the LN34 pan-lyssavirus real-time RT-PCR assay for postmortem rabies diagnostics. PLoS One. 13 (5), e0197074 (2018).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR assay for the detection of highly variable rabies virus and other lyssaviruses. PLoS Negl Trop Dis. 11 (1), e0005258 (2017).
- Gigante, C. M., Wicker, V., Wilkins, K., Seiders, M., Zhao, H., Patel, P., Orciari, L., Condori, R. E., Dettinger, L., Yager, P., Xia, D., Li, Y., et al. Optimization of pan-lyssavirus LN34 assay for streamlined rabies diagnostics by real-time RT-PCR. Journal Virological Methods. , (2024).
- Rao, A. K., et al. Use of a modified preexposure prophylaxis vaccination schedule to prevent human rabies: recommendations of the advisory committee on immunization practices-United States, 2022. Morbidity and Mortality Weekly Report. 71 (18), 619 (2022).
- Condori, R. E., et al. Using the LN34 Pan-Lyssavirus Real-Time RT-PCR assay for rabies diagnosis and rapid genetic typing from formalin-fixed human brain tissue. Viruses. 12 (1), 120 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유