Method Article
Güncellenmiş, Çoğullanmış LN34 Gerçek Zamanlı Ters Transkripsiyon-Polimeraz Zincir Reaksiyonu Testi ile Hayvanlarda Kuduz Postmortem Tanısı
Bu Makalede
Özet
Bu protokol, bazı kuduz olmayan lizavirüsler ve lagomorflar için test performansını iyileştirmek için primer dizileri ve formülasyonlardaki güncellemeler de dahil olmak üzere, doku toplamadan sonuç yorumlamaya kadar pan-lizavirüs LN34 gerçek zamanlı ters transkripsiyon-polimeraz zincir reaksiyonu (RT-PCR) testini gösterir. Ayrıca, tek kuyulu LN34 çoğullanmış (LN34M) formatı için tahlil kurulumunu da gösteriyoruz.
Özet
Kuduz, Lyssavirus rudis (RABV) ve Lyssavirus cinsinden ( Rhabdoviridae familyası) ilgili negatif iplikli RNA virüslerinin neden olduğu ölümcül bir zoonotik hastalıktır. LN34 testi, lyssavirus genomunun yüksek oranda korunmuş lider bölgesini ve nükleoprotein genini hedefler ve çeşitli Lyssavirus cinsi boyunca RNA'yı tespit etmek için dejenere primerler ve kilitli nükleotidler içeren bir TaqMan probu kullanır. Kuduz için olumsuz bir bulgu ancak beyin sapının tam bir kesiti ve beyinciğin üç lobu incelendiğinde yapılmalıdır; bununla birlikte, herhangi bir dokuda lyssavirus RNA'sının tanımlanması, kuduz enfeksiyonunun tanısıdır. Doku, virüsü de inaktive eden TRIzol reaktifinde toplanır ve homojenize edilir. RNA ekstraksiyonu, spin kolonu bazlı bir ticari ekstraksiyon kiti kullanılarak gerçekleştirilir. Ana karışımlar temiz bir alanda hazırlanır ve numune RNA eklenmeden önce 96 oyuklu bir plakaya alınır. Klinik ortamlarda, her numune, konakçı β-aktin mRNA'sı için üç kopya ve tek başına lizsavirüs RNA'sının varlığı için gerçek zamanlı RT-PCR ile test edilir. Pozitif ve negatif kontroller, protokolün ekstraksiyon ve gerçek zamanlı RT-PCR adımlarına dahil edilir. Veri analizi, cihaz çalışmalarında Ct değerlerini standartlaştırmak için eşiklerin manuel olarak ayarlanmasını içerir. Pozitif sonuçlar, pan-lizsavirüs testinde tipik amplifikasyonun varlığı ile belirlenir (Ct ≤ 35). Negatif sonuçlar, pan-lizavirüs testinde tipik amplifikasyonun olmaması ve konakçı β-aktin mRNA'nın (Ct ≤ 33) saptanması ile belirlenir. Bu aralıkların dışındaki değerlerin gözlemlenmesi veya tahlil kontrollerinin başarısız olması, çalışmayı geçersiz kılabilir veya bir numune için kesin olmayan sonuçlara neden olabilir. Yüksek tahlil duyarlılığı ve özgüllüğü sağlamak için protokol yakından takip edilmelidir. Prosedürel değişiklikler test performansını etkileyebilir ve yanlış pozitif, yanlış negatif veya yorumlanamayan sonuçlara yol açabilir.
Giriş
Bu protokol, numune toplamadan sonuç yorumlamaya kadar LN34 pan-lizsavirüs gerçek zamanlı ters transkripsiyon-polimeraz zincir reaksiyonu (RT-PCR) testi kullanılarak kuduz tanı testi prosedürünü açıklar. Prosedür üç bölüme ayrılacaktır: LN34 testi ile ilgili olarak beyin örneği toplama (Bölüm 1), Direct-zol RNA Miniprep kiti (Zymo Research R2051) (Bölüm 2) kullanılarak manuel sütun tabanlı RNA ekstraksiyonu ve AgPath-ID Tek Adımlı RT-PCR kiti (ThermoFisher Scientific AM1005) (Bölüm 3) kullanılarak kurulan LN34 gerçek zamanlı RT-PCR testi. RNA ekstraksiyonu ve RT-PCR diğer ürünler kullanılarak gerçekleştirilebilir, ancak Lyssavirus RNA'nın uygun şekilde ekstrakte edildiğinden ve amplifiye edildiğinden emin olmak için kitler kullanımdan önce doğrulanmalıdır.
Bölüm 1, LN34 gerçek zamanlı RT-PCR testinde kullanılacak uygun beyin dokularının toplanmasını açıklar. Hayvan nekropsisi, dekapitasyon ve beynin çıkarılmasının tanımı dahil değildir. Örnekler enfeksiyöz ajanlar içerebilir. Riski azaltmak için Mikrobiyoloji ve Biyomedikal Laboratuvarlarda Biyogüvenlik 6. Baskı1'de ayrıntıları verilen biyogüvenlik prosedürleri izlenmelidir. Numuneler, inaktivasyon tamamlanana kadar bulaşıcı olarak kabul edilmelidir. Viral inaktivasyon ve tahlil validasyonu her laboratuvarda o kurumun standartlarına göre yapılmalıdır. Laboratuvarlar, yeni bir tanı testini uygularken kurumları tarafından belirlenen standart güvenlik ve kalite prosedürlerini takip etmelidir.
Enfeksiyon sırasında kuduz virüsünün yayılması hakkında bilinenlere dayanarak, beyin sapı ve beyincik kuduz teşhisi için en iyi dokulardır ve bu dokular Dünya Sağlık Örgütü ve Dünya Hayvan Sağlığı Örgütü tarafından kuduz testi için önerilmektedir 2,3,4,5. Virüs yayılımı tek taraflı olabileceğinden (Şekil 1), özellikle daha büyük hayvanlarda, kuduz ekarte etmek için beyin sapının tam bir kesiti ve beyinciğin üç lobu incelenmelidir. Bu minimum kriterleri karşılamayan numuneler için laboratuvar, numuneyi test için yetersiz bulunarak reddedebilir veya gözetim ya da kural koyma amacıyla test etmeyi tercih edebilir. Gerekli dokular alınmazsa, ancak laboratuvar numuneyi test etmeyi seçerse, negatif bir test sonucu, o hayvan için kuduz için yetersiz olarak yorumlanmalıdır, çünkü diğer dokulardaki viral RNA varlığı gecikebilir, düşük bolluk, aralıklı olabilir veya mevcut olmayabilir. Bu durumda kuduzdan korunmak için gerekli örneklerin toplanması veya ek testler gereklidir. Bununla birlikte, herhangi bir dokuda lizavirüs RNA'sının tanımlanması, kuduz enfeksiyonunun tanısıdır 3,6. Kuduz virüsü RNA'sı için kural veya sürveyans (ancak dışlanamaz) kuduz enfeksiyonu için test edilebilecek örneklere örnek olarak korteks, hipokampus, omurilik, bozulmuş örnekler, deri, tükürük ve kornea verilebilir. Laboratuvara varışta her numunenin durumunun kalitatif bir değerlendirmesi yapılmalıdır. Soğutma, bir numuneyi en az 72 saat koruyabilir ancak uzun süreli kullanılmamalıdır. Tekrarlanan donma-çözülme döngüleri test hassasiyetini azaltabilir ve beşten fazla donma-çözülme döngüsünden kaçınılmalıdır. Dokunun durumu, beyin yapılarının güvenli bir şekilde tanımlanmasını engelliyorsa, örnek tatmin edici olmayan olarak tanımlanmalıdır. Yetersiz bir örnek durumunda, kuduzu yönetmek (ancak dışlamamak) için testler hala yapılabilir. Pozitif test sonuçları bu şekilde rapor edilir. Yetersiz doku üzerinde negatif veya sonuçsuz sonuçlar, negatif tanı olarak yanlış yorumlamayı önlemek için sonuçsuz olarak rapor edilmelidir.
Bu protokol, yayınlanmış prosedürler 7,8,9'dan geliştirilmiştir ve lizsavirüs genom lider bölgesini ve nükleoprotein kodlama dizisini hedefleyen güncellenmiş primerleri içerir. Prob kısa, yüksek oranda korunmuş bir diziyi hedefler ve geniş algılamaya izin vermek için kilitli nükleotidler kullanır. Test, değişen konsantrasyonlarda çeşitli lizavirüslerden RNA'yı tespit eder8. Bu protokol, LN34 gerçek zamanlı PCR testini gerçekleştirmek için laboratuvar prosedürlerini gösterir, ancak lizavirüs RNA'sının doğru ve hassas tespiti, numune saklama, kayıt tutma, personel eğitimi/yetkinliği, sonuç izleme, sonuç yorumlama, kalite güvencesi, laboratuvar güvenlik önlemleri ve sorun giderme gibi bu protokolde kapsamlı olarak ele alınmayan diğer unsurlara bağlıdır. PCR bazlı tahliller, yüksek hassasiyetleri nedeniyle çapraz kontaminasyona eğilimlidir. Sık sık eldiven değiştirmek, her seferinde bir numuneyi kullanmak, numuneler arasında çalışma yüzeylerini etkili dekontamine edici maddelerle dezenfekte etmek ve tüpleri kapalı ve numuneleri PCR reaktiflerinden ayrı tutmak gibi iyi laboratuvar uygulamalarına bağlı kalarak çapraz kontaminasyon önlenebilir. PCR reaktifleri ve numuneleri, tek taraflı bir iş akışı kullanılarak ve amplifikasyon öncesi ve amplifikasyon sonrası çalışma alanlarını ayırarak kolayca ayrılabilir. Örneğin, PCR mastermikslerini numunelerin işlendiği yerden fiziksel olarak ayrı bir yerde hazırlayın. PCR reaktiflerinin numuneler, kalıntılar veya pozitif kontrol RNA'sı ile kontaminasyonunu önlemek için eldivenleri sık sık değiştirin. PCR plakası veya tüpleri, mastermix ilavesinden sonra numune ve kontrol RNA'sının eklenebileceği ikinci bir konuma taşınmalıdır. Daha da önemlisi, PCR ürünleri, numunelerin veya mastermikslerin hazırlandığı alanlarda manipüle edilmemelidir.
Tanı testleri yapılırken uygulamalı uygulama ve deneyimin yerini hiçbir şey tutamaz. Tüm yeni çalışanlar eğitilmeli ve test personeli, ilgili laboratuvar direktörünün gerekliliklerine uygun olarak yılda en az bir kez yeterlilik açısından değerlendirilmelidir. Olağandışı sonuçlara veya tahlil başarısızlığına ilişkin herhangi bir gözlem not edilmeli, araştırılmalı ve derhal düzeltilmelidir. Her yeni reaktif lotu, bilinen Ct değerlerine sahip numuneler (pozitif kontrol veya arşivlenmiş numune gibi) kullanılarak doğrulanmalıdır. Tüm ekipman, üretici tarafından önerildiği gibi rutin bakıma tabi tutulmalı ve herhangi bir bakım veya onarımdan sonra tahlil performansı doğrulanmalıdır. Buzdolaplarının ve dondurucuların, teşhis testinde kullanılan reaktifler için kabul edilebilir bir sıcaklık aralığı için belirlenen kriterler içinde kalmasını sağlamak için ilgili ekipmanda sıcaklık seviyeleri izlenmelidir.
Prosedürel değişiklikler test performansını etkileyebilir ve yanlış pozitif, yanlış negatif veya yorumlanamayan sonuçlara yol açabilir. Yüksek tahlil duyarlılığı ve özgüllüğü sağlamak için öneriler yakından takip edilmelidir. Bu protokolde değişiklikler yapmak isteyen bir laboratuvar, CDC ile istişare ederek değiştirilmiş yöntemleri doğrulamalı ve onaylamalıdır.
Protokol
Postmortem beyin dokusu örnekleri, Poxvirus ve Kuduz Şubesi'nin (CDC; Atlanta, GA, ABD).
1. LN34 pan-lyssavirus gerçek zamanlı RT-PCR testi ile hayvanlarda kuduzun ölüm sonrası teşhisi için beyin dokusunun toplanması
NOT: Numuneler bulaşıcı ajanlar içerebilir. Uygun kişisel koruyucu ekipman (KKD) (ağır lastik eldivenler veya diğer kesilmeye dayanıklı eldivenler, laboratuvar önlüğü, su geçirmez önlük, cerrahi maske, botlar, koruyucu kılıflar ve yüz siperi) giyin ve numunelerin kullanımı, saklanması ve atılması için gerekli güvenlik düzenlemelerine uyun. Maruziyet öncesi kuduz aşısı, düzenli serolojik testler ve güçlendirici aşılar (gerektiğinde), lyssavirüsler veya bilinen veya potansiyel olarak enfekte olmuş örneklerle çalışmadan, test etmeden, üretmeden veya araştırma faaliyetleri gerçekleştirmeden önce herkes için gereklidir 2,3,4,6,10.
- Numune başına bir numune toplama tüpünü bir erişim etiketi ile etiketleyin. Her numune toplama tüpünü 1 mL TRIzol reaktifi veya başka bir homojenizasyon tamponu ve bir kısım MagNA Lyser boncukları (bundan böyle "seramik boncuklar" olarak anılacaktır) ile doldurun. Seramik boncuklar eklemek için, boncuk tüpünden numune toplama tüpüne dikkatlice dökün. Seramik boncuk tüpleri genellikle numune başına en az 20 adet 1,4 mm çapında boncuk kullanarak 2-5 numune için yeterli boncuk içerir.
DİKKAT: TRİZOL reaktifi (bundan böyle "homojenizasyon tamponu" olarak anılacaktır) tehlikeli bir kimyasaldır; asitler veya ağartıcı ile temas toksik gazları serbest bırakır; yeterli havalandırma sağlayın; Daha fazla bilgi için lütfen güvenlik bilgi formuna bakın. Kullanıcılar TRIzol reaktifini veya TRI reaktifini başka bir homojenizasyon tamponu ile değiştirirse, ek doğrulama gereklidir. TRIzol, bu protokol için bir numune homojenizasyon/lizis tamponu, lizsavirüs inaktivasyon tamponu ve RNA stabilite tamponu görevi görür. Alternatif bir homojenizasyon tamponunun kullanılması, kontrollü bir yan yana karşılaştırmada ekstraksiyon verimliliğinin, inaktivasyonun ve stabilitenin doğrulanmasını gerektirecektir. - Çalışma yüzeyini 2 dakika boyunca kuaterner amonyum bileşikleri (QAC) dezenfektanı ile temizleyin ve dezenfekte edin ve plastik astarlı emici bir ped yerleştirin. İlk numune için yalnızca reaktifleri ve sarf malzemelerini, odanın dışındaki tehlikeli dumanları dışarı atma özelliklerine sahip Sınıf II biyolojik güvenlik kabinine (BSC) yerleştirin.
NOT: Seyreltilmiş QAC'nin depolama sınırları için üreticinin kılavuzuna bakın. Plastik astarlı pedin biyolojik güvenlik kabininin hava akışını engellemediğinden emin olun. Hava akışı bozulursa, ped kullanmayın. - Temiz, tek kullanımlık bir neşter kullanarak beyin sapı ve beyinciğin tam bir kesitini temsil eden dokuyu toplayın.
NOT: Dokuların manipülasyonu, sıvıları aerosol haline getirmeyecek veya havadaki partiküller üretmeyecek şekilde yapılmalıdır. Çeker ocaklar veya biyogüvenlik kabinleri gerekli değildir, ancak kokulardan, dumanlardan, ektoparazitlerden ve kemik parçalarından ek koruma sağladıkları için havalandırmalı biyogüvenlik kabinleri önerilir.
DİKKAT: Lyssavirus ile potansiyel olarak enfekte olmuş materyal içeren bir neşter kullanımı tehlikelidir ve kullanıcılar uygun güvenlik önlemlerini almalıdır. Tek kullanımlık forseps kullanılması tavsiye edilir.- Küçük hayvanlar için (yarasalar gibi), tüm beyin sapı ve beyincik toplanabilir.
- Daha büyük hayvanlar için, beyinciğin üç lobunun her birinden tam bir beyin sapı ve doku kesiti toplayın.
- İSTEĞE BAĞLI: Doğrudan floresan antikor (DFA) testi yapıyorsanız, bu noktada beyin izlenimlerini toplayın. RNA ekstraksiyonu ve LN34 testi ile test etmek için DFA için beyin izlenimlerini topladıktan sonra kalan dokuyu kullanın.
NOT: Numunelere TRIzol eklenirse, numuneler artık antijen bazlı tespit yöntemleri veya virüs izolasyonu için kullanılamaz.
- Homojenizasyon ve RNA ekstraksiyonu için numuneler hazırlayın.
NOT: RNA ekstraksiyonunun ve virüs inaktivasyonunun etkinliği, çok fazla doku kullanılmasından etkilenebilir. Doku miktarı, kullanılan homojenizasyon tamponunun hacminin kabaca 1/10'unu geçmemelidir. Daha fazla doku kullanılıyorsa, verimli ve başarılı RNA ekstraksiyonunu sağlamak için homojenizasyon tamponu miktarını buna göre artırın.- Küçük hayvanlar için, gerekli tüm dokuları homojenizasyon tamponu ve ekstraksiyon için boncuklar içeren bir tüpe yerleştirin. 1 mL homojenizasyon tamponunda 100 mg numuneyi aşmayın; Daha büyük numuneler için, homojenizasyon tamponunun hacmini artırın veya 1:10 oranlı bir numuneyi yansıtmak için birden fazla tüp kullanın: tampon.
- Daha büyük hayvanlar için, dokuyu iyice kıyın ve homojenize edin ve homojenizasyon tamponu ve boncuklarla önceden doldurulmuş bir tüpe temsili bir kısım çıkarın. 1 mL homojenizasyon tamponunda 100 mg numuneyi aşmayın; Daha büyük numuneler için, homojenizasyon tamponunun hacmini artırın veya 1:10 oranlı bir numuneyi yansıtmak için birden fazla tüp kullanın: tampon.
- Seçenek 1 (Boncuk çırpıcı): Bir boncuk çırpıcı, 1 mL tampon ve seramik boncuklar kullanarak dokuyu homojenize edin. Birkaç 2 mL'lik tüp veya daha büyük tüplerin kullanılması gerekebilir.
- Seçenek 1 (Boncuk çırpıcı): İş istasyonunu, ekipmanı ve dış numune tüplerini QAC dezenfektan (1:256) ile temizleyin ve dezenfekte edin. 2 dakika bekletin.
- Seçenek 1 (Boncuk çırpıcı): BSC'nin içine homojenize numune(ler) içeren bir santrifüj rotoru yükleyin. Tüm numuneleri 10.000-16.000 × g'da 2 dakika boyunca masa üstü mikrosantrifüjde santrifüjleyin. BSC'nin içindeki santrifüj rotorunu boşaltın.
- Seçenek 1 (Boncuk çırpıcı): 2 dakika bekletin.
- Seçenek 1 (Boncuk çırpıcı): 120 μL homojenatı, 1 mL homojenizasyon tamponu ile önceden doldurulmuş bir tüpe aktarın.
DİKKAT: Homojenizasyon aerosol üretebilir ve bir BSC'de gerçekleştirilmelidir. - Seçenek 2 (Neşter): Tek kullanımlık bir neşter kullanarak gerekli dokuları ince bir şekilde kıyın, bir çubukla sürün ve çubuğu homojenizasyon tamponu ve boncuklarla önceden doldurulmuş bir tüpe aktarın. 1 mL homojenizasyon tamponunda 100 mg numuneyi aşmayın; Daha büyük numuneler için, homojenizasyon tamponunun hacmini artırın veya 1:10 oranlı bir numune: tamponu yansıtmak için birden fazla tüp kullanın.
DİKKAT: Lyssavirus ile potansiyel olarak enfekte olmuş materyal içeren bir neşter kullanımı tehlikelidir ve kullanıcılar uygun güvenlik önlemlerini almalıdır.
- Kalan dokuları orijinal kabına veya bir erişim etiketi ile etiketlenmiş yeni, boş bir kaba toplayın. Bu dokuyu yeniden test etme veya ek karakterizasyon gerektiğinde saklayın.
- İş istasyonunu, ekipmanı ve numune tüplerinin dışını QAC dezenfektan 1:256 ile temizleyin ve dezenfekte edin. 2 dakika bekletin.
- Kalan tüm numuneler için 1.2-1.5 adımlarını tekrarlayın.
- Numuneleri mini boncuk çırpıcı ile en az 60 saniye homojenize edin. Tüpleri görsel olarak inceleyin. Büyük doku parçaları kalırsa boncuk çırpıcıyı 60 saniye daha tekrarlayın. Yukarıdaki adım 1.4.2.1'de doku tamamen homojenize edilmişse bu adım isteğe bağlıdır.
NOT: Dokunun tamamen homojenize edildiğinden emin olmak önemlidir. Eksik homojenizasyon RNA verimini düşürecektir. - Oda sıcaklığında (RT) en az 5 dakika bekletin.
- İş istasyonunu, ekipmanı ve numune tüplerinin dışını QAC dezenfektanı ile temizleyin ve dezenfekte edin (1:256).
NOT: Numune şu anda bulaşıcı olmayan olarak kabul edilir ve kuduz laboratuvarından çıkarılabilir. - Numuneleri RNA ekstraksiyonu için hemen homojenizasyon tamponunda işleyin, RT'de (20 °C ila 25 °C) veya buzdolabında (4 °C ila 8 °C) birkaç gün saklayın veya uzun süreli depolama için -16 °C veya daha soğukta saklayın.
2. RNA MiniPrep kitini kullanarak RNA ekstraksiyonu için protokol
- BSC altında çalışma alanını ayarlayın.
- Toz veya diğer çevresel kirleticileri temizlemek için çalışmaya başlamadan önce BSC çalışma yüzeyini %70 etanol kullanarak temizleyin. QAC dezenfektan (1:256), RNase AWAY veya RNaseZap (üreticinin tavsiyelerine göre) ile ek yüzey dekontaminasyonu gerçekleştirin.
- Plastik astarlı emici bir çalışma pedi yerleştirin ve reaktifleri, sarf malzemelerini ve numuneyi BSC'ye yerleştirin.
NOT: Plastik astarlı pedin BSC'nin hava akışını engellemediğinden emin olun. Hava akışı bozulursa, ped kullanmayın. - Tüm toplama tüplerini mikrosantrifüj tüpleri için temiz bir rafa yerleştirin. Her yarasa olmayan beyin örneği için 1.5 mL'lik bir mikrosantrifüj tüpünü 300 μL %100 etanol ile önceden doldurun. Az dokuya sahip numuneler için (yarasa beyin numunesi, beyin olmayan numune veya bozulmuş numune), her biri için 600 μL %100 etanol ile 1.5 mL'lik bir mikrosantrifüj tüpünü önceden doldurun.
- Numune hazırlama
- Bölüm 1'de hazırlanan tüm numuneleri BSC'deki bir tüp rafında toplayın. Testten hemen önce donmuş numuneleri çözün.
- Bir ayıklama denetimini çözün.
NOT: Lizsavirüs RNA'sı olmayan bir numunenin seçilmesi önerilir; numune daha önce beta-aktin testi için beklenen bir Ct değer aralığı ile test edilmelidir. Örneğin, önceden alıntılanmış doku kültürü hücreleri veya daha önce test edilmiş bir negatif kuduz vakası (insan veya hayvan).
- Tüm numuneleri 10.000-16.000 × g'da 2 m boyunca masa üstü mikrosantrifüjde santrifüjleyin.
- Süpernatanı% 100 etanol içeren yeni bir steril mikrosantrifüj tüpüne aktarın. Süpernatantın belirgin lipitler veya katı doku olmadan berrak olduğundan emin olun. Lipitlerin ve katı dokuların toplanmasından kaçının.
- Yarasa olmayan beyin dokusu için: 300 μL süpernatan aktarın.
- Küçük dokuya sahip numuneler için (yarasa beyin numunesi, beyin olmayan numune veya bozulmuş numune), 600 μL süpernatan aktarın.
- Kalan homojenatı ≤-16 °C'de vidalı bir mikrosantrifüj tüpünde saklayın.
- Karıştırmak için 10 kez yukarı ve aşağı pipetleyin.
- Her numune için, 600 μL etanol-süpernatan karışımını bir toplama tüpündeki bir döndürme kolonuna aktarın.
- Sıvı kolondan geçene kadar santrifüjleyin (10.000-16.000 × g'da 1 dakika). Akışı atın.
- Bir numune için 600 μL'den fazla etanol homojenizasyon tampon karışımı varsa tekrarlayın.
- Her sütunu yeni bir toplama tüpüne aktarın.
- Her kolona 400 μL RNA ön yıkama tamponu ekleyin ve 30 saniye boyunca 10.000-16.000 × g'da santrifüjleyin.
- Akışı atın ve her sütunu aynı toplama tüpüne geri koyun.
- 2.10-2.11 arasındaki adımları tekrarlayın.
- Her kolona 700 μL RNA yıkama tamponu ekleyin ve 10.000-16.000 × g'da 2 dakika santrifüjleyin. Yıkama tamponunun her bir kolondan tamamen geçtiğinden emin olun.
- Her sütunu dikkatlice RNaz içermeyen bir tüpe aktarın.
- Akış geçişini ve toplama borusunu 2.13'ten atın.
- RNA'yı elüte etmek için 50 μL DNase/RNase içermeyen suyu doğrudan kolon matrisine ekleyin.
NOT: Pipet ucuyla sütun matrisine dokunmayın. - RT'de 30 saniye inkübe edin, ardından 10.000-16.000 × g'da 1 dakika santrifüjleyin.
- RNA'yı dikkatlice yeni bir vidalı üst düz tabanlı erişim etiketli mikrosantrifüj tüpüne aktarın. Çıkarılan RNA'yı hemen test etmek için buza taşıyın. -70 °C veya daha soğukta uzun süre saklayın.
NOT: Daha yüksek sıcaklıklarda depolama veya tekrarlanan donma-çözülmeler, RNA'nın bozulmasına neden olabilir ve teşhis sonuçlarını etkileyebilir.
3. LN34 pan-lyssavirus gerçek zamanlı RT-PCR testi için protokol
- Reaktifleri hazırlayın.
- Yapay pozitif kontrol
- CDC8 tarafından yapay bir pozitif kontrol RNA'sı üretilirse, depolama, sulandırma ve alikotasyon için ambalaj üzerindeki talimatları izleyin. Pozitif kontrol RNA'sının tek kullanımlık alikotları zaten elinizdeyse bu adımı atlayın.
NOT: Çalışma konsantrasyonlarında pozitif kontrol RNA'sı, mastermix hazırlama ile aynı alanda değil, şablon ekleme alanında ele alınmalıdır. Pozitif kontrol RNA'sı, belirli bir lot için belirlenen beklenen aralıkta bir döngü eşiği (Ct) değeri üretmelidir. Çalışmalar arasında, pozitif kontrol RNA'sı için LN34 Ct değeri, ±1.5 Ct değerinden daha fazla farklılık göstermemelidir. - Tek kullanımlık bir alikotu buz veya buz bloğu üzerinde kullanmadan hemen önce ≤ -70 ° C'lik depolamadan çözün. Dondurmayın, çözmeyin ve soğutulmuş sıcaklıklarda uzun süre tutulan alikotları atmayın.
NOT: LN34 testinde pozitif bir kontrol üç nüsha halinde çalıştırılmalıdır; Yapay pozitif kontrol8 , beta-aktin testinde amplifiye olmayacaktır.
- CDC8 tarafından yapay bir pozitif kontrol RNA'sı üretilirse, depolama, sulandırma ve alikotasyon için ambalaj üzerindeki talimatları izleyin. Pozitif kontrol RNA'sının tek kullanımlık alikotları zaten elinizdeyse bu adımı atlayın.
- Ekstraksiyon kontrolü ve numuneler: Kullanmadan hemen önce taze ekstrakte edilmiş numuneleri buz (veya buz bloğu) üzerine yerleştirin veya ≤ -70 °C depolamadan numuneleri buz (veya buz bloğu) üzerinde çözdürün.
NOT: RNA, mastermix hazırlanması veya PCR ürünlerinin veya büyük miktarlarda viral materyalin manipülasyonu için kullanılan alanlardan (örn., pozitif kontrol üretimi, viral yayılma) ayrı bir numune veya şablon ekleme için belirlenmiş bir alanda çözülmeli ve işlenmelidir.
- Yapay pozitif kontrol
- Mastermix hazırlama alanında mastermix reaktiflerini hazırlayın.
- Singleplex LN34 RT-PCR testinin Mastermix hazırlanması
NOT: Kullanıcılar numuneleri singleplex (adım 3.2.1) veya multipleks (adım 3.2.2) formatında test edebilir. Hem 3.2.1 hem de 3.3.2'nin gerçekleştirilmesi gerekli değildir. Mastermix hazırlama, primer ve prob alikotasyonu ve hiçbir şablon kontrol reaktifi, numune işleme, nekropsi, PCR ve viral materyallerin manipüle edildiği diğer alanlardan ayrı temiz bir alanda çözülmeli ve manipüle edilmemelidir. Bu, ayrı odalar veya tek taraflı numune akışına sahip bir dolap sistemi aracılığıyla sağlanabilir.- Tablo 1 ve Tablo 2'de gösterildiği gibi çalışma konsantrasyonlarında astar ve prob karışımları oluşturun. Primerlerin ve probların çalışma seyreltme alikotları zaten elinizdeyse bu adımı atlayın.
- Primerleri ve probları 1,5 mL depolama stoklarına ve 50 μL çalışma stoklarına alın ve karanlıkta ≤ -16 ° C'de saklayın. Primerlerin ve probların çalışma seyreltme alikotları zaten elinizdeyse bu adımı atlayın.
NOT: Adım 3.2.1.2'nin gerçekleştirilmesi önerilir. - Mastermix hazırlama alanındaki buz veya buz bloğu üzerinde ≤ -16 ° C'de depolamadan tek adımlı RT-PCR tamponunu, şablon kontrolü yok, primerleri ve probları çözün.
NOT: Hangisi önce gelirse, son kullanma tarihine veya performans hatasına kadar reaktifleri kullanın. - Kullanmadan önce tüm tamponları, primerleri ve probları kısaca vorteksleyin ve santrifüjleyin.
- Tek adımlı RT-PCR enzimini kullanılana kadar buz üzerinde veya bir buz bloğunda saklayın.
- RNA örnekleri
NOT: Donma-çözülme performansı etkileyebileceğinden, mümkün olduğunda yeni çıkarılmış RNA kullanın - RNA örneklerini kullanılana kadar buz veya buz bloğu üzerinde saklayın.
- Donmuş RNA örneklerini buz veya buz bloğu üzerinde çözün.
- Test başına bir mikrosantrifüj tüpünü etiketleyin (LN34 ve βA).
- Test başına kurulacak reaksiyon sayısını (N) belirleyin.
- Numune sayısını 3 ile çarparak ve kontrol reaksiyonu kuyuları için 6 ekleyerek ve pipetleme sırasında kaybedilen hacmi hesaba katmak için %10 ekstra reaksiyon ekleyerek LN34 testi için reaksiyon sayısını hesaplayın. (örn. 10 örnek için: (10 x 3) + 6 = 36 reaksiyon; fazla reaksiyonlar: (36 x 0.1) + 36 = 3.6 + 36 = 39.6 toplam reaksiyon veya 40 reaksiyon yuvarlanır)
NOT: Klinik testler için, tüm numunelerin LN34 için üç kopya halinde test edilmesi önerilir. Gözetim amacıyla, her numune iki kopya halinde test edilebilir. Replikasyonlar ve iyi teknik arasında düşük değişkenlik sağlamak için ilk tahlil katılımı sırasında üçlü kullanılması önerilir. - Pipetleme sırasında kaybedilen hacmi hesaba katmak için numune sayısı artı 4 kontrol reaksiyonu kuyusu ve %10 ekstra reaksiyon ekleyerek βA testi için reaksiyon sayısını hesaplayın.
- Tablo 2'yi kullanarak LN34 ve βA mastermixleri için her bir reaktifin hacmini belirleyin.
- LN34 tahlilinde üç nükte halinde test edilecek her numune için kuyucukları belirleyin ve 96 kuyulu bir plaka haritası kullanarak βA tahlili için tekilleştirin.
- Tüpün dibindeki sıvıyı toplamak için bir masa üstü mikrosantrifüj kullanarak 30 saniye boyunca kısa bir süre girdaplama ve döndürme işleminden sonra atanan her LN34'e 23 μL LN34 tahlil mastermix'i dağıtın. Baloncukları tanıtmaktan kaçının.
- Altta sıvı toplamak için bir masa üstü mikrosantrifüjde 30 saniye boyunca kısa bir süre girdaplandırdıktan ve döndürdükten sonra, atanan her βA etiketli her bir βA tahlil mastermixine 23 μL βA tahlil mastermix'i dağıtın.
- Her NTC kuyucuğuna 2 μL PCR dereceli su pipetleyerek şablon kontrolü (NTC) reaksiyonlarını ayarlayın.
- Kuyuları örtün ve plakayı şablon ekleme alanına aktarın.
- RNA örneklerini içeren tüpleri kısaca vorteksleyin ve santrifüjleyin.
- İlk numuneden 2 μL ekstrakte edilmiş RNA'yı, o numune için etiketlenmiş her bir oyuğa pipetleyin. Baloncukları tanıtmaktan kaçının.
- Görselleştirme yoluyla RNA'nın pipete çekildiğinden emin olun.
- Numunenin doğru kuyuya eklendiğinden emin olmak için kuyunun yan tarafına pipetleyin.
- RNA içeren pipet uçlarını mümkün olduğunca açık kuyucukların üzerinde sallamaktan kaçının.
- Kalan numuneler ve pozitif kontrol RNA'sı için 3.2.10 adımını tekrarlayın.
- Tüm numuneleri ve kontrolleri ekledikten sonra optik yapışkan kapağı kuyucukların üzerine yerleştirin. Tüm kuyuları kapatmaya ve tamamen kapatmaya dikkat edin.
- Bir masa üstü santrifüjde RT'de 1 dakika boyunca 500 × g'da santrifüjleyin veya salata döndürücü tipi bir tabak döndürücü kullanın.
- Mühürlü plakayı FAM ve VIC/HEX raportör boyaları için kalibre edilmiş gerçek zamanlı bir PCR cihazına yerleştirin ve Tablo 3'te gösterilen döngü parametrelerine ayarlayın.
- LN34 Çoğullanmış (LN34M) testi için ana karışımları hazırlayın.
- Bir mikrosantrifüj tüpü LN34M'yi Tablo 2'ye göre etiketleyin.
- Test başına kurulacak reaksiyon sayısını (N) belirleyin.
- Numune sayısını 3 ile çarparak LN34M testi için reaksiyon sayısını hesaplayın ve kontrol reaksiyonu kuyuları için 6 artı pipetleme sırasında kaybedilen hacmi hesaba katmak için %10 ekstra reaksiyon ekleyin. (örneğin, 10 örnek için: (10 x 3) + 6 = 36 reaksiyon; fazla reaksiyonlar: (36 x 0.1) + 36 = 3.6 + 36 = 39.6 toplam reaksiyon veya 40 reaksiyon yuvarlanır)
- 25 μL veya 12,5 μL formatını seçin. Tablo 34'yi kullanarak LN2M mastermix için her bir reaktifin hacmini belirleyin.
- 34 kuyulu bir plaka haritası kullanarak LN96M tahlilinde üç nüsha halinde test edilecek her numune için kuyuları belirleyin.
- LN34M tahlili için reaktifleri kuyulara dağıtın. Atanan her bir kuyucuğa 23 μL (25 μL reaksiyon için) veya 10.5 μL (12.5 μL reaksiyon için) ana karışım dağıtmadan önce altta sıvı toplamak için tüpleri kısaca vorteksleyin ve döndürün. Baloncukları tanıtmaktan kaçının.
- Her bir NTC kuyusuna 2 μL PCR sınıfı su pipetleyerek NTC reaksiyonlarını ayarlayın.
- Kuyuları örtün ve plakayı şablon ekleme alanına aktarın.
- Altta sıvı toplamak için RNA örneklerini içeren tüpleri kısaca girdaplayın ve döndürün.
- İlk numuneden 2 μL ekstrakte edilmiş RNA'yı, o numune için etiketlenmiş her bir oyuğa pipetleyin. Baloncukları tanıtmaktan kaçının.
- RNA'nın pipet görselleştirmesine çekildiğinden emin olun.
- Numunenin doğru kuyuya eklendiğinden emin olmak için kuyunun yan tarafına pipetleyin.
- RNA içeren pipet uçlarını mümkün olduğunca açık kuyucukların üzerinde sallamaktan kaçının.
- Kalan numuneler ve pozitif kontrol RNA'sı için adım 3.3.8'i tekrarlayın.
- Son numuneyi/kontrolü ekledikten sonra, tüm kuyucukların tamamen kapatıldığından ve kapatıldığından emin olarak optik yapışkan kapağı kuyucukların üzerine yerleştirin.
- Bir masa üstü santrifüjde RT'de 1 dakika boyunca 500 × g'da santrifüjleyin veya salata döndürücü tipi bir tabak döndürücü kullanın.
- Mühürlü plakayı FAM ve VIC/HEX raportör boyaları için kalibre edilmiş gerçek zamanlı bir PCR cihazına yerleştirin ve Tablo 3'te gösterildiği gibi döngü parametrelerine ayarlayın. Pasif referans boyayı ROX olarak ayarlayın ve Standart Modda çalıştırın (Hızlı Modda çalıştırmayın)
NOT: Bu ayar, bu protokolde bahsedilen aletlere özgüdür ve pasif boya olarak ROX içeren tek adımlı bir RT-PCR reaktifinin kullanılmasını gerektirir. Alternatif cihazlar, optimum çalışma ayarlarını belirlemek için farklı yaklaşımlar gerektirir. En iyi performans için üreticiye göre normal cihaz bakımını sağlayın.
- Singleplex LN34 RT-PCR testinin Mastermix hazırlanması
4. Sonuçların yorumlanması
- LN34/FAM için 0,2 ve βA/HEX/VIC için 0,05 değerini kullanarak otomatik bir referans değer ve manuel eşik hesaplamaları ayarlayın.
NOT: Bu ayar, bu protokolde bahsedilen aletlere özgüdür ve pasif boya olarak ROX içeren tek adımlı bir RT-PCR reaktifinin kullanılmasını gerektirir. Alternatif araçlar, temel ve eşik değerleri hesaplamak için farklı yaklaşımlar gerektirir. - Tüm kontroller beklendiği gibi yapıldıysa Tablo 4'teki kılavuzu kullanarak tanılama sonucunu belirleyin (Tablo 5).
- Amplifikasyon grafiklerini görüntüleyerek tüm Ct veya Cq değerlerini onaylayın.
- Olağandışı sonuçları önerildiği gibi araştırın.
5. Numune Saklama ve Depolama
- Test tamamlanana ve sonuçlar rapor edilene kadar tüm numuneleri -16 °C veya daha düşük bir sıcaklıkta donmuş halde saklayın. Olağandışı test sonuçları olması durumunda sonuçları doğrulamak veya konakçı hayvanı türe tanımlamak için orijinal dokuları saklayın.
- Benzersiz örnek tanımlayıcılar kullanın; Tüm tüpleri, raporları ve evrakları tam benzersiz örnek tanımlayıcılarla etiketleyin.
- Tekrar testinin gerekli olması durumunda ara numuneleri (kısa süreli) saklayın.
- Temsili pozitif numuneleri kontrol, epidemiyolojik tipleme ve diğer amaçlar için gerektiği gibi saklayın.
- Uzun süreli depolama için RNA'yı ≤-70 °C'de saklayın.
Sonuçlar
Bir ABI ViiA34 gerçek zamanlı PCR cihazında çalıştırılan başarılı bir LN7 testinden elde edilen temsili görüntüler Şekil 2'de gösterilmektedir. Logaritmik bir ölçekte çizilen sonuçların görüntülenmesi, eğrinin eşik çizgisini geçtiği nokta olan Ct değerinin kolayca görüntülenmesini sağlar (Şekil 2A,C). Doğrusal bir ölçekte çizildiğinde, başarılı amplifikasyon sigmoidal (veya "S" şeklinde) bir eğri olarak görünecektir (Şekil 2B, D), negatif sonuçlar ise düz, düz bir çizgi olarak görünmelidir. Olası anormallikleri veya hataları belirlemek için sonuçların hem doğrusal hem de günlük ölçeği görünümlerinde görüntülenmesi önerilir. Çok bileşenli çizim görünümündeki tipik pozitif ve negatif sonuçlar, sırasıyla Şekil 2E, F'de görülebilir, burada probu etiketleyen boyanın floresan seviyesi (LN34 için FAM, βA için VIC/HEX) reaksiyon tamponundaki pasif boyaya göre gözlemlenebilir.
Anormal sonuç örnekleri Şekil 3'te gösterilmiştir. Başarılı çalıştırmaların grafikleri (Şekil 2) ve anormal grafikler (Şekil 3) arasındaki karşılaştırmalar, atipik çalıştırmaları ve cihaz sorunlarını izole etmek için kullanılabilir. Şekil 3A , eşiği geçen, LN34 için bir Ct değeri üreten bir sinyali göstermektedir, ancak amplifikasyon eğrisi çok atipiktir ve doğrusal olarak artar. Çok bileşenli (Şekil 3B) çizim ayrıca pozitif bir numune için tipik olmayan dalgalı bir çizgi gösterir. Bu örnek, amplifikasyon grafiklerini görüntülemenin ve yalnızca Ct değerlerini kopyalamanın önemini vurgulamaktadır. Amplifikasyon eğrilerinin her zaman tüm numuneler için normal göründüğünden emin olun. Herhangi bir düzensizlik olmadığından emin olmak için çok bileşenli grafiğin görüntülenmesi de tavsiye edilir. Bazen, dağınık temel sinyaller, amplifikasyonun meydana gelmediği durumlarda Ct değerleri üretebilir. Amplifikasyon sinyalleri doğrusal görünüyorsa, eğrinin kaybolup kaybolmadığını görmek için taban çizgisinin ayarlanması önerilir. Herhangi bir olağandışı sinyal durumunda, tüm çalışma tekrarlanmalıdır. Sorun devam ederse, gerçek zamanlı PCR cihazınızda bir arka plan plakasının temizlenmesi ve çalıştırılması önerilir. Varsa, PCR ürünleri bir agaroz jel üzerinde çalıştırılabilir ve/veya olağandışı sonuçları gidermek için sıralanabilir. Tanısal sonuçları belirlemek için jel elektroforezi veya dizileme sonuçlarının kullanılması önerilmez.
Önceki çalışmalar, LN34 testi7 için replikasyonlar, tahlil çalışması, operatör ve laboratuvar arasında düşük değişkenlik göstermiştir. Aynı numunenin replikaları arasında yüksek değişkenlik (>±1.5 Ct fark) gözlenirse, o RNA tekrar test edilmelidir. Yüksek değişkenliğe pipetler, laboratuvar uygulamaları, yanlış pipetleme veya gerçek zamanlı PCR makineleriyle ilgili sorunlar neden olabilir. Birkaç numunede veya tahlil çalışmaları boyunca yüksek değişkenliğin tekrar tekrar gözlemlenmesi, sistemik sorunları gösterebilir. Pozitif bir numune (Ct 35) için tahlil eşiğine yaklaşan düşük RNA'lı numuneler, replikasyonlar arasında Ct değerlerinde daha yüksek değişkenlik gösterebilir. Kalıcı değişkenliğin, tutarsız sonuçların veya test başarısızlığının nedenini ele almak için CDC ile istişare ve sorun giderme gerekli olabilir.
PCR bazlı tahlillerin yüksek hassasiyeti, onları doğal olarak kontaminasyona karşı duyarlı hale getirir. İyi laboratuvar uygulamalarına sıkı sıkıya bağlı kalmak, çapraz kontaminasyonu azaltmanın en iyi yoludur. Potansiyel kontaminasyonun nasıl tanımlanacağını bilmek önemlidir. Bir tahlil çalışmasında şablon kontrolü ve şüpheli negatif numune kuyucuklarının tümü benzer Ct değerleri üretmiyorsa, reaktif kontaminasyonundan şüphelenilmelidir. PCR reaktiflerinin yeni alikotları (tampon, su, primerler ve enzim) ve aynı RNA ile testi tekrarlayın. Tüm numuneler ve ekstraksiyon kontrolü benzer CT değerleri üretiyorsa ancak NTC negatifse, ekstraksiyon reaktiflerinin kontaminasyonu araştırılmalı ve ekstraksiyon yeni reaktifler kullanılarak tekrarlanmalıdır. Kontaminasyon riskini azaltmak ve büyük hacimlerde pahalı reaktiflerin atılması olasılığını önlemek için küçük reaktif alikotları yapmak iyi bir uygulamadır. Numune çapraz kontaminasyonunun tanımlanması daha zordur. Numune kontaminasyonundan şüpheleniliyorsa, orijinal dokulardan başlayarak numune alımını tekrarlayın. Bazı durumlarda, viral RNA'nın dizilimi, özellikle kontamine RNA beklenen viral varyanttan (laboratuvarda kullanılan bir kontrol virüsü gibi) çok farklı olduğunda, kontaminasyonu doğrulayabilir. Aynı anda işlenen iki örneğin dizilenmesi, viral dizilerin aynı olup olmadığını belirleyebilir, ancak dizilerin çok benzer olması bekleniyorsa (örneğin, aynı ilçede toplanan aynı varyant) bilgilendirici olmayabilir. Pozitif kontrol RNA'sı ile numune kontaminasyonundan şüpheleniliyorsa, lizsavirüs RNA'sını (165 bp) pozitif kontrol RNA'sından (99 bp) ayırt etmek için LN34 test amplikonları bir agaroz jel üzerinde çalıştırılabilir. CDC8 tarafından sağlanan pozitif kontrol RNA'sını oluşturmak için kullanılan şablonun sırası.
Diğer patojenler için, Şekil 4'te camgöbeğinde gösterilen zayıf amplifikasyon gibi "gürültüden" kurtulmak için eşiği manuel olarak ayarlamak için laborantlar kullanılabilir. Bu uygulama kuduz teşhisi için önerilmez, çünkü kuduz neredeyse% 100 ölümcül olduğu için korkunç sonuçları olan yanlış negatif sonuçlara yol açabilir. Zayıf veya geç amplifikasyon numuneleri için negatif sonuçlar elde etmek için eşiği manuel olarak DEĞİŞTİRMEYİN. Kuduzu ekarte etmek için bu numuneler yeniden çıkarılmalı ve / veya yeniden test edilmelidir.
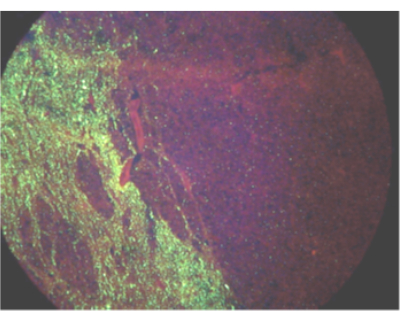
Şekil 1: Enfekte bir eşekte kuduz virüsü antijeninin doğrudan floresan antikor testi ile tek taraflı yayılımını gösteren görüş alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
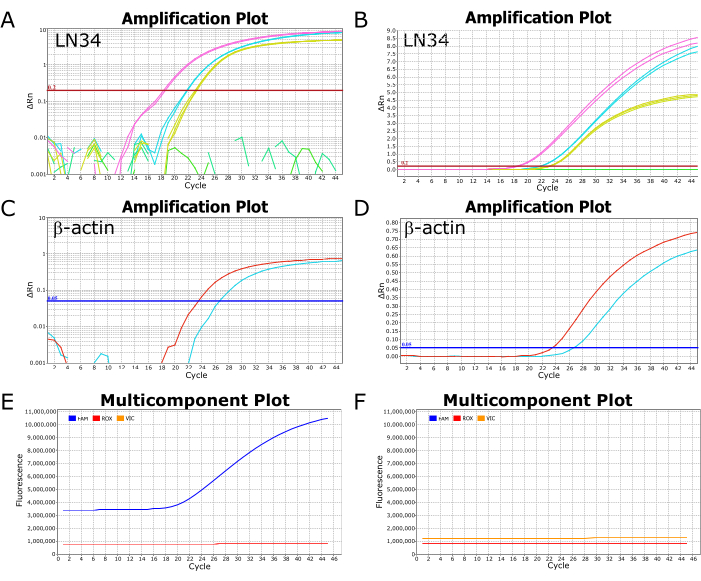
Şekil 2: Başarılı bir LN34 tahlil çalışmasından amplifikasyon ve çok bileşenli grafikler. (AD) Sonuç verileri, LN34 ve βA testi için bir (A,C) log ölçeğinde ve (B,D) doğrusal ölçekte çizilir. Panel A ve B, pozitif kontrole (sarı renkte) kıyasla iki numuneden (pembe ve camgöbeği) elde edilen LN34 sonuçlarını göstermektedir. Panel B'de, çalışmadaki ek bir negatif örneği gösteren düz yeşil bir çizgi vardır. A'da yeşil çizgi(ler) herhangi bir amplifikasyon göstermez ve kırık segmentler olarak gösterilir. LN34 testi için eşik manuel olarak 0.2'ye ayarlandı ve kırmızı yatay çizgi ile gösterildi. (C,D) İki numune (kırmızı ve camgöbeği) için βA testinden elde edilen sonuçlar. βA testi için eşik değer manuel olarak 0.05 olarak ayarlandı. (E,F) Çok bileşenli grafikler, FAM (LN34), VIC (βA) ve ROX (AgPath-ID tamponunda bulunan pasif boya) için her döngüde floresanı (RFU) gösterir. ROX seviyeleri tüm döngüler boyunca sabit kalmalıdır. Tipik bir pozitif numune panel E'de gösterilmiştir; FAM floresansı, bu numune için döngü 18'den başlayarak sigmoidal bir eğri olarak artar. Tipik bir negatif örnek, FAM seviyesinin tüm döngüler boyunca ROX seviyesine paralel kaldığı panel F'de gösterilmiştir. Veriler bir ABI ViiA7 gerçek zamanlı PCR cihazından alınmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: LN34 testinde gözlemlenen nadir, atipik sinyalin temsili görüntüleri, bir ViiA7 gerçek zamanlı PCR cihazında çalışır. (A-F) Amplifikasyon (A,C,E) ve çok bileşenli (B,D,F) parseller iyi kirlenme nedeniyle üretilir. FAM floresansındaki doğrusal artış (A,C) ve dalgalı dalgalanmalar (B,D), eğrilerin şekline ve floresan değişiminin büyüklüğüne bağlı olarak gerçek amplifikasyonu temsil etmez. A'dan D'ye kadar olan paneller, A ve B panellerinde gösterilen kopya için bir Ct değeri üretilmiş olsa bile, muhtemelen negatif numuneleri temsil eder. E ve F panelleri, çok bileşenli çizimde daha kolay görülen garip dalgalı bir sinyal gösterir. Bu tür sinyaller araştırılmalıdır ve bu çalışmada tüm kontroller beklendiği gibi gerçekleştirilse bile cihaz sorunlarını gösterebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
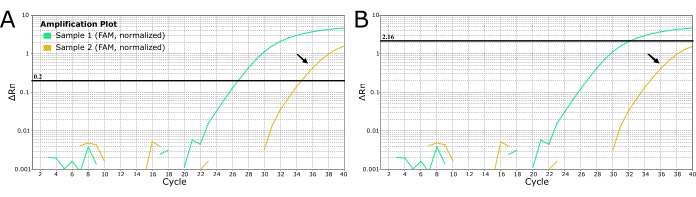
Şekil 4: 2 kuduz şüpheli numuneden alınan LN34 gerçek zamanlı RT-PCR eğrileri, eşik değerleri ayarlamak için iki yöntemi göstermektedir. (A) LN34 eşiği 0,2 olarak ayarlanmıştır (tüm çalıştırmalar için önerilir). (B) "Gürültü" olarak belirlenen sinyali maskelemek için her çalıştırma için manuel olarak farklı bir eşik belirleme (geç amplifikasyon sinyali). Panel B'de kullanılan yöntem, gerçek bir pozitif sonucun kaçırılmasının ciddi sonuçları nedeniyle kuduz için TAVSİYE EDİLMEMEKTEDİR. Geç amplifikasyon, pozitif bir durumda zayıf bir pozitif numuneyi, PCR inhibisyonunu veya başarısız ekstraksiyonu gösterebilir. Ayrıca çapraz kontaminasyonu da gösterebilir. Altın numune (siyah oklarla gösterilir) tahlilin kesilmesinde bir Ct değeri üretir ve negatif olarak kabul edilmemelidir. Geç amplifikasyonlu numuneler yeniden ekstrakte edilmeli ve tekrar test edilmelidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: LN34lys (singleplex LN34), LN34M (LN34 ve βA çoğullanmış) gerçek zamanlı RT-PCR testlerinde kullanılan primer ve prob dizileri ve konsantrasyonları. LN34 probları, 5. uçta floresan FAM boyası ve 3. uçta Kara Delik söndürücü (BHQ1) ile etiketlenmiştir. βA probu, 5. uçta floresan HEX boyası ve 3. uçta Kara Delik söndürücü (BHQ1) ile etiketlenmiştir. Kilitli nükleotid ile modifiye edilmiş bazlar, dizideki bazdan önce bir artı ile gösterilir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: LN34lys, Actin3 ve LN34M testleri için test kurulumu. Primer ve prob adları, dizileri ve konsantrasyonları Tablo 1'de bulunabilir. LN34_F1, ACGCTTAACAACCAGATCAAAGAA7'ye karşılık gelir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: ABI cihazları için döngü parametreleri. ÖNEMLİ: HIZLI modda değil, STANDART modda çalıştırdığınızdan emin olun. Pasif referans boya olarak ROX seçilmelidir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 4: Singleplex (üst, mavi tablo) ve multipleks (alt, kırmızı tablo) formatlar için LN34 gerçek zamanlı RT-PCR sonuçlarının yorumlanması için algoritma. Pozitif bir LN34 sonucu, βA sonucu negatif veya sonuçsuz olsa bile pozitif olarak kabul edilmelidir. LN34 amplikonu tespit edilmezse, βA Ct'nin negatif olarak kabul edilebilmesi için listelenen Ct değeri sınırının ≤ edilmesi gerekir. βA Ct değerleri, test edilen numunenin kalitesini gösterir ve olası inhibisyonu tanımlar. Orijinal klinik örnekteki düşük konsantrasyon, βA büyüme eğrilerini etkileyebilir ve bu da fark edilebilir bir amplifikasyona yol açmaz. β-aktinin tespit edilememesine katkıda bulunan ek faktörler arasında, RNA kaybı veya PCR inhibitörlerinin taşınması nedeniyle RNA'nın zayıf ekstraksiyonu, yanlış test kurulumu ve tekniği, yetersiz numune tipi veya kalitesi ve reaktiflerin veya ekipmanın arızalanması yer alır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 5: LN34 tahlil kontrolleri için ortak sonuçların eylemleri ve yorumları. Her üç kontrol de (kuduz pozitif kontrol RNA'sı, kuduz negatif ekstraksiyon kontrolü ve hiçbir şablon kontrolünün bir çalıştırmanın geçmesi için beklenen sonuçları üretmesi gerekmez. Pozitif kontroldeki arıza veya şablon kontrolünün olmaması, yanlış pipetleme, reaktif veya ekipman arızasını gösterebilir. Test edilen tüm RNA örnekleri de dahil olmak üzere tüm çalışma tekrarlanmalıdır. Ekstraksiyon kontrolünün başarısız olması, ekstraksiyon sırasında reaktif arızası, yanlış pipetleme veya çapraz kontaminasyon gibi bir soruna işaret edebilir. Tüm numunelerin ekstraksiyonu tekrarlanmalıdır. Deneyimli laboratuvar personeli için kontrollerin başarısız olması nadir olmalıdır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Başarılı bir LN34 tahlil çalıştırması, pozitif bir kontrol, ekstraksiyon kontrolü gerektirir ve her tahlil çalışmasında beklendiği gibi hiçbir şablon kontrol reaksiyonu gerçekleşmez veya çalıştırma geçersiz kılınmalı ve tekrarlanmalıdır. Üç LN34 pozitif kontrol çoğaltma reaksiyonunun tümü, belirtilen aralık içinde eşiği geçmeli veya çalışma tekrarlanmalıdır. Önceki yayınlar 7,8'de açıklanan pozitif kontrol RNA'sı, βA tahlilinde amplifiye olmayacaktır. Şablon olmayan kontrol reaksiyonları, LN34 veya βA testi için eşik çizgisini geçen amplifikasyon eğrileri sergilememelidir. Ekstraksiyon kontrolü, LN34 için amplifikasyon göstermemelidir. NTC'de veya ekstraksiyon kontrolünde beklenmeyen amplifikasyon gözlenirse, kontaminasyonu gösterebilir ve tüm numuneler için çalıştırmayı ve tekrar testini geçersiz kılabilir (bkz. Tablo 5). Kullanıcılar, ekstraksiyon reaktiflerinin ana bilgisayar βA kontaminasyonunu izlemek için proses gerektirmeyen kontrol veya numune içermeyen ekstraksiyon kontrolü dahil olmak üzere ek kontroller eklemeyi düşünebilir.
Kuduz mortalitesi %100'e yaklaştıkça, herhangi bir zayıf veya anormal amplifikasyonun, bir Ct değeri üretmese bile, daha fazla araştırılması önerilir. Negatif veya NTC reaksiyonları herhangi bir amplifikasyon göstermemeli ve floresan, çok bileşenli görünümde ROX floresansına paralel düz bir çizgi olarak görünmelidir. Eğrilerin gözlemlenmesi, özellikle çoklu kopyalarda, çapraz kontaminasyonu veya zayıf bir pozitif sonucu gösterebilir. Pozitif bir numune için tüm replikalar, geçerli bir pozitif sonuç için amplifiye edilmelidir. Her iki tahlilde de yalnızca bir kopya alt kümesi çoğalırsa, numune yeniden test edilmelidir. Ayrıca, oldukça değişken sonuçlar üreten herhangi bir numune (Ct değeri farkları > ±kopyalar arasındaki 1.5) geçersiz kabul edilmeli ve numune yeniden test edilmelidir. Sorun devam ederse, örnek yeniden ayıklanmalıdır.
Uygun şekilde toplanmış ve depolanmış beyin sapı ve beyincik dokusundan ekstrakte edilen kuduz pozitif bir numunenin, LN34 testi için 35 döngüden daha az bir Ct değerine sahip olması beklenmektedir. Tüm kesin olmayan numuneler LN34 gerçek zamanlı RT-PCR ile yeniden test edilmelidir. Tekrarlanan testten sonra numune sonuçsuz kalırsa ve tüm kontroller beklendiği gibi gerçekleştirilirse, RNA'nın yeniden çıkarılması önerilir. Düşük viral RNA'ya (LN34 Ct > 35) sahip numuneler, kontaminasyon, düşük virüs yükü, PCR inhibisyonu veya başarısız ekstraksiyon gibi potansiyel sorunları gösterebilir. Orijinal dokudan beynin taze parçalarını toplayın, RNA ekstraksiyonu yapın ve numuneyi yeniden test edin. Benzer şekilde, Ct değerleri > 33 (singleplex), 37 (LN34M) veya βA testinde amplifikasyon olmaması, başarısız RNA ekstraksiyonunu gösterebilir. Bu tür numuneler için ekstraksiyonu tekrarlayın, ardından hem LN34 hem de aktin için testi tekrarlayın. Bir numune, tekrarlanan testlerden sonra tekrar kesin olmayan bir sonuç verirse, DFA (FAT olarak da adlandırılır) testi, DRIT veya virüs izolasyonu gibi ikincil bir yöntem kullanın. Devam eden uyumsuz sonuçlar veya kesin olmayan sonuçlar gözlemlenirse, doğrulayıcı test için lütfen bir kuduz referans laboratuvarına danışın.
Bir RNA ekstraksiyonunda inhibitörler varsa, PCR testleri yanlış bir negatif sonuç verebilir. Belirli bir numune için βA kontrol reaksiyonlarının (Ct değeri > 33 veya Ct değeri > 37 gibi) inhibisyonundan şüpheleniliyorsa veya inhibisyonu not edilirse, ekstrakte edilen RNA 2 veya daha fazla seyreltmede test edilmelidir (ör., nükleaz içermeyen suda 1:10 ve 1:100) herhangi bir potansiyel PCR inhibitörünü seyreltmek için. Zor numuneler için, RT-PCR reaksiyonunda RNA girişi herhangi bir su ilave edilmeden 8.5 μL'ye çıkarılabilir. Bu, orijinal numunede artmış inhibisyon (2 μL giriş RNA'sına kıyasla daha geç Ct değeri) veya düşük RNA seviyesi (2 μL giriş RNA'sına kıyasla 8.5 μL kullanıldığında daha erken Ct değeri) ortaya çıkarabilir.
LN34 testi, lizavirüsler arasında ayrım yapmaz veya kuduz virüsü varyantlarını belirlemez. LN34 test amplisonu, düşük çözünürlüklü kuduz virüsü varyant tiplemesi veya lyssavirus türü11'in tanımlanması için dizilenebilir.
Açıklamalar
İfşa edilecek yok
Teşekkürler
Açık veri paylaşımı ve geri bildirimleri yoluyla LN34 testinin uygulanmasına, doğrulanmasına ve optimizasyonuna katkıda bulunan birçok kuduz tanı test laboratuvarının çabalarını ve işbirliğini takdir ediyoruz. Ticari adların ve ticari kaynakların kullanımı yalnızca tanımlama amaçlıdır ve Hastalık Kontrol ve Önleme Merkezleri, ABD Sağlık ve İnsan Hizmetleri Bakanlığı veya yazarların bağlı kurumları tarafından onaylandığı anlamına gelmez. Yazarlar tarafından ifade edilen sonuçlar, bulgular ve görüşler, ABD Sağlık ve İnsan Hizmetleri Bakanlığı, Hastalık Kontrol ve Önleme Merkezleri veya yazarların bağlı kurumlarının resmi tutumunu yansıtmayabilir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 7500 Fast | Applied Biosystems | N/A | Do not substitute without validation |
| 7500 Fast Dx | Applied Biosystems | N/A | Do not substitute without validation |
| ABI ViiA 7 | Applied Biosystems | N/A | Do not substitute without validation |
| AgPath-ID One-Step RT-PCR Kit | ThermoFisher Scientific | AM1005 | Do not substitute without validation |
| Beadbug6 | Benchmark Scientific | D1036 | |
| Direct-zol RNA MiniPrep kit | Zymo Research | R2052 | |
| MagNA Lyser green beads | Roche | 3358941001 | |
| Microcentrifuge | Eppendorf | 5425 R | |
| Optical 96-well Reaction Plates | ThermoFisher Scientific | 4346907 | |
| Optical Adhesive covers | ThermoFisher Scientific | 4311971 | Alternative: caps |
| Polyester fiber-tipped applicator swabs | BD BBL Polyester Fiber Tipped Application Swab | 220690 | |
| QuantStudio 6Flex | Applied Biosystems | 4485691 | Do not substitute without validation |
| Quaternary ammonium disinfectant (1:256) | LYSOL | WBB56939 | Do not substitute without validation |
| RNase AWAY | ThermoFisher Scientific | 7002PK | |
| RNaseZap | ThermoFisher Scientific | AM9780 | |
| Single-use scalpel, a scalpel with a safety mechanism | Integra Miltex | 4-510 | |
| Sterile polyproylene microcentrifuge tubes (1.5 mL), nuclease free | Sarstedt | 72.692.405 | |
| Sterile polyproylene microcentrifuge tubes (2 mL), nuclease free | Sarstedt | 72.694.600 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | Do not substitute without validation |
Referanslar
- Meechan, P. J., Potts, J. . Biosafety in Microbiological and Biomedical Laboratories. , (2020).
- . Terrestrial Manual 2023 Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals (2023)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/handle/10665/310836 (2018)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/bitstream/handle/10665/310837/9789241515306-eng.pdf?ua=1 (2019)
- . Protocol for postmortem diagnosis of rabies in animals by direct fluorescent antibody testing: A minimum standard for rabies diagnosis in the United States Available from: https://www.cdc.gov/rabies/pdf/RabiesDFASPv2.pdf (2003)
- World Health Organization. . WHO Expert Consultation on Rabies: Third Report. , (2018).
- Gigante, C. M., et al. Multi-site evaluation of the LN34 pan-lyssavirus real-time RT-PCR assay for postmortem rabies diagnostics. PLoS One. 13 (5), e0197074 (2018).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR assay for the detection of highly variable rabies virus and other lyssaviruses. PLoS Negl Trop Dis. 11 (1), e0005258 (2017).
- Gigante, C. M., Wicker, V., Wilkins, K., Seiders, M., Zhao, H., Patel, P., Orciari, L., Condori, R. E., Dettinger, L., Yager, P., Xia, D., Li, Y., et al. Optimization of pan-lyssavirus LN34 assay for streamlined rabies diagnostics by real-time RT-PCR. Journal Virological Methods. , (2024).
- Rao, A. K., et al. Use of a modified preexposure prophylaxis vaccination schedule to prevent human rabies: recommendations of the advisory committee on immunization practices-United States, 2022. Morbidity and Mortality Weekly Report. 71 (18), 619 (2022).
- Condori, R. E., et al. Using the LN34 Pan-Lyssavirus Real-Time RT-PCR assay for rabies diagnosis and rapid genetic typing from formalin-fixed human brain tissue. Viruses. 12 (1), 120 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır