Method Article
通过更新的多重 LN34 实时逆转录聚合酶链反应测定法对动物狂犬病进行尸检诊断
摘要
该方案展示了从组织收集到结果解释的泛溶血病毒 LN34 实时逆转录聚合酶链反应 (RT-PCR) 测定,包括引物序列和配方的更新,以提高一些非狂犬病溶血病毒和兔形虫的测定性能。我们还演示了单孔 LN34 多通路 (LN34M) 规格的分析设置。
摘要
狂犬病是由 Lyssavirus 狂犬病 (RABV) 和 Lyssavirus 属( 弹状病毒科)的相关阴性链 RNA 病毒引起的致命性人畜共患疾病。LN34 检测试剂盒靶向 Lyssavirus 基因组中高度保守的前导区域和核蛋白基因,并利用简并引物和含有锁定核苷酸的 TaqMan 探针来检测不同 Lyssavirus 属的 RNA。只有在检查脑干的完整横断面和小脑的三个叶时,才应做出狂犬病阴性结果;然而,在任何组织中鉴定出 Lyssavirus RNA 都可以诊断为狂犬病感染。收集组织并在 TRIzol 试剂中匀浆,该试剂也会灭活病毒。使用基于离心柱的商业提取试剂盒进行 RNA 提取。在干净的空间内制备预混液,并在加入样品 RNA 之前分装到 96 孔板中。在临床环境中,通过实时 RT-PCR 检测每个样品是否存在一式三份和单个宿主 β 肌动蛋白 mRNA 的溶血病毒 RNA。在方案的提取和实时 RT-PCR 步骤中包括阳性和阴性对照。数据分析涉及手动调整阈值,以标准化仪器运行期间的 Ct 值。阳性结果由泛溶血病毒测定 (Ct ≤ 35) 中的典型扩增确定。阴性结果是通过泛溶血病毒测定中不存在典型扩增和宿主 β-肌动蛋白 mRNA (Ct ≤ 33) 的检测来确定的。观察到超出这些范围的值或检测对照失败可能会使运行无效或导致样本结果不确定。应严格遵循该方案,以确保高检测灵敏度和特异性。程序修改会影响检测性能并导致假阳性、假阴性或无法解释的结果。
引言
该方案描述了使用 LN34 泛溶血病毒实时逆转录聚合酶链反应 (RT-PCR) 测定法从样本采集到结果解释进行狂犬病诊断检测的程序。该程序将分为三个部分:与 LN34 测定相关的脑样本采集(第 1 部分),使用 Direct-zol RNA 小量制备试剂盒 (Zymo Research R2051) 进行基于柱的手动 RNA 提取(第 2 部分)和使用 AgPath-ID 一步法 RT-PCR 试剂盒 (ThermoFisher Scientific AM1005) 设置的 LN34 实时 RT-PCR 测定(第 3 部分)。可以使用其他产品进行 RNA 提取和 RT-PCR,但试剂盒应在使用前进行验证,以确保 Lyssavirus RNA 得到适当的提取和扩增。
第 1 节描述了用于 LN34 实时 RT-PCR 测定的适当脑组织的收集。不包括动物尸检、斩首和摘除大脑的描述。样本可能含有传染性病原体。应遵循微生物和生物医学实验室生物安全第 6 版1 中详述的生物安全程序,以降低风险。在灭活完成之前,样本应被视为具有传染性。应根据该机构的标准在每个实验室进行病毒灭活和检测验证。实验室在实施新的诊断检测时,应遵循其机构确定的标准安全和质量程序。
根据对狂犬病病毒在感染过程中传播的了解,脑干和小脑是诊断狂犬病的最佳组织,世界卫生组织和世界动物卫生组织建议将这些组织用于狂犬病检测 2,3,4,5。由于病毒可能是单侧传播的(图 1),尤其是在较大的动物中,因此应检查脑干的完整横截面和小脑的三个叶是否排除狂犬病。对于不符合这些最低标准的样本,实验室可能会因样本不足而拒绝检测,或者选择出于监测或规则目的进行检测。如果未收到所需的组织,但实验室选择检测样本,则应将阴性检测结果解释为该动物的狂犬病不确定,因为病毒 RNA 在其他组织中的存在可能会延迟、低丰度、间歇性或不存在。在这种情况下,需要收集所需的样本或进行额外的检测以排除狂犬病。然而,在任何组织中鉴定出溶血病毒 RNA 都可以诊断为狂犬病感染 3,6。可以进行狂犬病病毒 RNA 检测以进行狂犬病病毒 RNA 检测以用于规则或监测(但不排除)狂犬病感染的样本示例包括皮质、海马体、脊髓、降解样本、皮肤、唾液和角膜。到达实验室后,应对每个样本的状况进行定性评估。冷藏可以将样品保存至少 72 小时,但不应长期使用。重复冻融循环可能会降低测试灵敏度,应避免超过五次冻融循环。如果组织状况妨碍对大脑结构的可靠鉴定,则应将样品鉴定为不满意。如果样本不满意,仍然可以进行检测以排除(但不排除)狂犬病。阳性检测结果会按此方式报告。不满意组织的阴性或不确定结果应报告为不确定,以防止误解为阴性诊断。
该方案是根据已发布的程序 7,8,9 开发的,包括靶向 lyssavirus 基因组前导区域和核蛋白编码序列的更新引物。该探针靶向一个短的、高度保守的序列,并使用锁定的核苷酸进行广泛的检测。该检测试剂盒可检测不同浓度的不同 lyssavirus 的 RNA8。该方案演示了进行 LN34 实时 PCR 检测的实验室程序,但溶血病毒 RNA 的准确和灵敏检测取决于该方案中未广泛涵盖的其他要素,例如样本储存、记录保存、人员培训/能力、结果跟踪、结果解释、质量保证、实验室安全措施和故障排除。基于 PCR 的分析由于其高灵敏度而容易发生交叉污染。通过遵守良好的实验室规范,可以避免交叉污染,例如经常更换手套、一次处理一个样品、在样品之间使用有效的去污剂对工作表面进行消毒,以及保持试管密闭并将样品与 PCR 试剂分开。通过采用单侧工作流程并分离扩增前和扩增后工作区域,可以轻松分离 PCR 试剂和样品。例如,在与处理样品的位置物理分开的位置制备 PCR 预混液。经常更换手套,以避免 PCR 试剂被样品、碎片或阳性对照 RNA 污染。添加预混液后,应将 PCR 板或试管移至可以添加样品和对照 RNA 的第二个位置。重要的是,不应在制备样品或预混液的区域作 PCR 产物。
在进行诊断测试时,实践和经验是无可替代的。所有新员工都应接受培训,并应按照相关实验室主任的要求,每年至少进行一次测试人员的能力评估。应立即记录、调查和纠正任何异常结果或检测失败的情况。每批新试剂都应使用具有已知 Ct 值的样品(例如阳性对照或存档样品)进行验证。所有设备都应按照制造商的建议进行日常维护,并且在任何维护或维修后应验证分析性能。应监测适用设备上的温度水平,以确保冰箱和冰柜保持在诊断检测试剂可接受温度范围的标准范围内。
程序修改会影响检测性能,并可能导致假阳性、假阴性或无法解释的结果。应严格遵循这些建议,以确保检测的高灵敏度和特异性。希望对本方案进行修改的实验室应与 CDC 协商验证和确认修改后的方法。
研究方案
死后脑组织样本是通过痘病毒和狂犬病分部 (CDC;美国佐治亚州亚特兰大)。
1. 收集脑组织,通过 LN34 泛溶血病毒实时 RT-PCR 测定法对动物狂犬病进行尸检诊断
注意:样品可能含有传染性病原体。穿戴适当的个人防护装备 (PPE)(厚橡胶手套或其他防割手套、实验室防护服、防水围裙、外科口罩、靴子、防护袖和面罩),并遵守规定的样本使用、储存和处置安全规定。在处理、检测、生产或进行溶血病毒或已知或可能感染的标本的研究活动之前,任何人都需要进行暴露前狂犬病疫苗接种、定期血清学检测和加强免疫接种(如有必要)2,3,4,6,10。
- 用登录标签标记每个样品的一个样品收集管。用 1 mL TRIzol 试剂或其他匀浆缓冲液和一部分 MagNA Lyser 微珠(以下简称“陶瓷微珠”)填充每个样品收集管。要添加陶瓷珠,请小心地从珠管中倒入样品收集管中。陶瓷珠管通常包含足够 2-5 个样品的磁珠,每个样品至少使用 20 个 1.4 mm 直径的磁珠。
注意:TRIzol 试剂(以下简称“均质缓冲液”)是一种危险化学品;与酸或漂白剂接触放出有毒气体;确保足够的通风;有关更多信息,请参阅安全数据表。如果用户将 TRIzol 试剂或 TRI 试剂替换为另一种匀浆缓冲液,则需要进行额外的验证。TRIzol 用作该方案的样品匀浆/裂解缓冲液、裂解病毒灭活缓冲液和 RNA 稳定性缓冲液。使用替代均质缓冲液需要在受控的并排比较中验证提取效率、灭活和稳定性。 - 用季铵化合物 (QAC) 消毒剂清洁和消毒工作台面 2 分钟,然后铺设塑料衬里的吸水垫。仅将第一个样品的试剂和用品放入具有将有害烟雾排放到房间外的 II 级生物安全柜 (BSC) 中。
注意: 请参阅制造商指南,了解稀释后的 QAC 的仓储限制。确保塑料衬垫不会阻塞生物安全柜的气流。如果气流中断,请勿使用垫子。 - 使用干净的一次性手术刀收集代表脑干和小脑完整横截面的组织。
注意:组织作应以不会雾化液体或产生空气中颗粒的方式进行。不需要通风柜或生物安全柜,但建议使用通风生物安全柜,因为它们可以提供额外的保护,防止异味、烟雾、体外寄生虫和骨头碎片。
注意:使用带有可能感染 lyssavirus 的材料的手术刀是危险的,用户应采取适当的安全预防措施。建议使用一次性镊子。- 对于小动物(如蝙蝠),可以收集整个脑干和小脑。
- 对于较大的动物,从小脑的三个叶中的每一个收集脑干和组织的完整横截面。
- 可选:如果进行直接荧光抗体 (DFA) 测试,此时收集脑印记。使用收集脑印模后剩余的组织进行 DFA 进行 RNA 提取和通过 LN34 测定进行测试。
注:如果将 TRIzol 添加到样品中,则样品不能再用于基于抗原的检测方法或病毒分离。
- 准备用于均质化和 RNA 提取的样品。
注:使用过多的组织可能会影响 RNA 提取和病毒灭活的效率。组织量不应超过所用匀浆缓冲液体积的 1/10。如果使用更多组织,则相应地增加匀浆缓冲液的量,以确保高效和成功的 RNA 提取。- 对于小动物,将所有需要的组织放入含有均质缓冲液和珠子的试管中进行提取。1 mL 匀浆缓冲液中的样品量不得超过 100 mg;对于较大的样品,增加均质缓冲液的体积或使用多个试管来反映 1:10 比例的样品:缓冲液。
- 对于较大的动物,将组织彻底切碎并匀浆,然后将代表性部分取出到预填充有匀浆缓冲液和珠子的试管中。1 mL 匀浆缓冲液中的样品量不得超过 100 mg;对于较大的样品,增加均质缓冲液的体积或使用多个试管来反映 1:10 比例的样品:缓冲液。
- 选项 1(微珠打浆机):使用微珠打浆机、1 mL 缓冲液和陶瓷微珠匀浆组织。可能需要使用几根 2 mL 试管或更大的试管。
- 选项 1(珠子打浆器):使用 QAC 消毒剂 (1:256) 清洁和消毒工作站、设备和外部样品管。静置 2 分钟。
- 选项 1(微珠打浆器):在 BSC 内,将均质化样品加载到离心机转子中。在台式微量离心机中以 10,000-16,000 × g 离心所有样品 2 分钟。在 BSC 内卸载离心机转子。
- 选项 1(打珠器):静置 2 分钟。
- 选项 1(微珠打浆器):将 120 μL 匀浆转移到预装有 1 mL 匀浆缓冲液的试管中。
注意:均质化可能会产生气溶胶,应在 BSC 中进行。 - 选项 2(手术刀):使用一次性手术刀将所需组织切碎,用棉签涂抹,然后将棉签转移到预装了均质缓冲液和珠子的试管中。1 mL 匀浆缓冲液中的样品量不得超过 100 mg;对于较大的样品,增加均质缓冲液的体积或使用多管以反映 1:10 的样品:缓冲液比例。
注意:使用带有可能感染 lyssavirus 的材料的手术刀是危险的,用户应采取适当的安全预防措施。
- 将任何剩余的组织收集到原始容器中或标有登录标签的新空容器中。储存这些组织,以备需要重新检测或额外表征时使用。
- 使用 QAC 消毒剂 1:256 清洁和消毒工作站、设备和样品管外部。静置 2 分钟。
- 对所有剩余样品重复步骤 1.2-1.5。
- 用迷你珠子打浆器匀浆样品至少 60 秒。目视检查管子。如果仍有大组织块,则重复珠子打浆器再打 60 秒。如果在上述步骤 1.4.2.1 中组织完全匀浆,则此步骤是可选的。
注意:确保组织彻底均质很重要。不完全匀浆会降低 RNA 产量。 - 在室温 (RT) 下静置至少 5 分钟。
- 使用 QAC 消毒剂 (1:256) 清洁和消毒工作站、设备和样品管外部。
注意:该样本目前被认为具有非传染性,可以从狂犬病实验室中取出。 - 立即在匀浆缓冲液中处理样品以进行 RNA 提取,在 RT(20 °C 至 25 °C)或冷藏(4 °C 至 8 °C)下储存数天,或在 -16 °C 或更低温度下储存以进行长期储存。
2. 使用 RNA MiniPrep 试剂盒提取 RNA 的方案
- 在 BSC 下设置工作区。
- 在开始工作之前,使用 70% 乙醇清洁 BSC 工作台面,以去除灰尘或其他环境污染物。使用 QAC 消毒剂 (1:256)、RNase AWAY 或 RNaseZap(根据制造商的建议)进行额外的表面净化。
- 铺设一个塑料衬里的吸收性工作垫,并将试剂、用品和样品放入 BSC 中。
注意: 确保塑料衬里垫不会阻塞 BSC 的气流。如果气流中断,请勿使用垫子。 - 将所有收集管放在干净的微量离心管架上。对于每个非蝙蝠脑样品,用 300 μL 100% 乙醇预填充一个 1.5 mL 微量离心管。对于组织较少的样品(蝙蝠脑样品、非脑样品或变质样品),每个样品预装一个 1.5 mL 微量离心管,每管预装 600 μL 100% 乙醇。
- 样品制备
- 将第 1 部分制备的所有样品收集在 BSC 的试管架中。在测试前解冻任何冷冻样品。
- Thaw an extraction control 解冻。
注:建议选择不含溶血病毒 RNA 的样品;样品应事先使用 β-肌动蛋白测定的预期 Ct 值范围进行测试。例如,预先分装的组织培养细胞或先前检测的狂犬病阴性病例(人类或动物)。
- 在台式微量离心机中以 10,000-16,000 × g 离心所有样品 2 m。
- 将上清液转移到含有 100% 乙醇的新无菌微量离心管中。确保上清液澄清,无明显的脂质或实体组织。避免脂质和实体组织的聚集。
- 对于非蝙蝠脑组织:转移 300 μL 上清液。
- 对于组织较少的样品(蝙蝠脑样品、非脑样品或变质样品),转移 600 μL 上清液。
- 将剩余的匀浆储存在 ≤-16 °C 的螺旋盖微量离心管中。
- 上下移液 10 次以混合。
- 对于每个样品,将 600 μL 乙醇-上清液混合物转移到收集管中的离心柱中。
- 离心直至液体通过色谱柱(在 10,000-16,000 × g 下 1 分钟)。丢弃流出物。
- 如果样品的乙醇-均质缓冲液混合物超过 600 μL,则重复此作。
- 将每根色谱柱转移到新的收集管中。
- 向每根柱中加入 400 μL RNA 预洗缓冲液,并以 10,000-16,000 × g 离心 30 秒。
- 丢弃流通液,并将每根色谱柱返回到同一收集管中。
- 重复步骤 2.10-2.11。
- 向每根柱中加入 700 μL RNA 洗涤缓冲液,并以 10,000-16,000 × g 离心 2 分钟。确保洗涤缓冲液完全通过每根色谱柱。
- 小心地将每根色谱柱转移到无 RNase 的试管中。
- 丢弃 2.13 中的流通管和收集管。
- 将 50 μL 不含 DNase/RNase 的水直接添加到柱基质中以洗脱 RNA。
注:请勿用移液器吸头接触色谱柱基质。 - 在 RT 下孵育 30 秒,然后以 10,000-16,000 × g 离心 1 分钟。
- 小心地将 RNA 转移到新的螺旋顶部平底登录标记的微量离心管中。将提取的 RNA 移至冰中立即检测。在 -70 °C 或更低温度下长期储存。
注:在较高温度下储存或反复冻融会导致 RNA 降解并影响诊断结果。
3. LN34 泛溶血病毒实时 RT-PCR 检测方案
- 准备试剂。
- 人工阳性对照
- 如果 CDC8 生产人工阳性对照 RNA,请按照包装上的说明进行储存、重构和分装。如果手头已有一次性等分试样的阳性对照 RNA,请跳过此步骤。
注:工作浓度的阳性对照 RNA 应在模板添加区域处理,而不是与预混液制备在同一区域处理。阳性对照 RNA 应在给定批次确定的预期范围内产生循环阈值 (Ct) 值。在两次运行之间,阳性对照 RNA 的 LN34 Ct 值相差不应超过 ±1.5 Ct 值。 - 在冰块上使用之前,从 ≤ -70 °C 储存中解冻一次性等分试样。不要冻融,并丢弃在冷藏温度下长时间保存的等分试样。
注:阳性对照应在 LN34 测定中一式三份运行;人工阳性对照8 不会在 β-肌动蛋白测定中扩增。
- 如果 CDC8 生产人工阳性对照 RNA,请按照包装上的说明进行储存、重构和分装。如果手头已有一次性等分试样的阳性对照 RNA,请跳过此步骤。
- 提取控制和样品:将新鲜提取的样品放在冰(或冰块)上,或在使用前立即将储存在 ≤ -70 °C 的冰(或冰块)上的样品解冻。
注:应在指定用于样品或模板添加的区域解冻和处理 RNA,该区域应与用于预混液制备或作 PCR 产物或大量病毒物质的区域(例如,阳性对照生成、病毒繁殖)分开
- 人工阳性对照
- 在 Mastermix 制备区制备 Mastermix 试剂。
- 单重 LN34 RT-PCR 检测的 Mastermix 制备
注:用户可以以单重(步骤 3.2.1)或多路(步骤 3.2.2)格式测试样品。无需同时执行 3.2.1 和 3.3.2。主混液制备、引物和探针等分试样以及无模板对照试剂应在与样品处理、坏死检查、PCR 和作病毒材料的其他区域分开的清洁区域中解冻和作。这可以通过单独的房间或具有单侧样品流的机柜系统来实现。- 生成工作浓度的引物和探针混合物,如 表 1 和 表 2 所示。如果引物和探针的工作稀释等分试样已经在手头,请跳过此步骤。
- 将引物和探针分装到 1.5 mL 储存储备液和 50 μL 工作储备液中,并在 ≤ -16°C 避光下储存。如果引物和探针的工作稀释等分试样已经在手头,请跳过此步骤。
注意:建议执行步骤 3.2.1.2。 - 将一步法 RT-PCR 缓冲液、无模板对照、引物和探针从 ≤ -16 °C 储存在预混液制备区域的冰上或冰块中解冻。
注意:在有效期或性能故障之前使用试剂,以先到者为准。 - 使用前,对所有缓冲液、引物和探针进行短暂涡旋和离心。
- 将一步法 RT-PCR 酶储存在冰上或冰块中直至使用。
- RNA 样品
注:尽可能使用新鲜提取的 RNA,因为冻融可能会影响性能 - 将 RNA 样品储存在冰或冰块上直至使用。
- 在冰上或冰块上解冻任何冷冻的 RNA 样品。
- 每次检测标记一个微量离心管(LN34 和 βA)。
- 确定每次分析要设置的反应数 (N)。
- 通过将样品数量乘以 3 并加上 6 对照反应孔加上 10% 的额外反应来计算 LN34 分析的反应数,以解决移液过程中的体积损失。(例如,对于 10 个样品:(10 x 3) + 6 = 36 个反应;过量反应:(36 x 0.1) + 36 = 3.6 + 36 = 39.6 个反应总数,或四舍五入 40 个反应)
注:对于临床测试,建议对所有样品一式三份进行 LN34 检测。出于监测目的,每个样本可能会一式两份进行测试。建议在初始分析载入期间使用一式三份,以确保重复之间的低变异性和良好的技术。 - 通过将样品数加上 4 个对照反应孔加上 10% 的额外反应来计算 βA 测定的反应数,以考虑移液过程中的体积损失。
- 使用 表 2 确定 LN34 和 βA 预混液的每种试剂的体积。
- 在 LN34 测定中为每个要测试的样品指定一式三份的孔,并使用 96 孔板图将一式两份用于 βA 测定。
- 使用台式微量离心机短暂涡旋并旋转 30 秒后,将 23 μL LN34 检测预混液分配到分配的每个 LN34 中,以收集管底部的液体。避免引入气泡。
- 在台式微量离心机中短暂涡旋并旋转 30 秒以收集底部液体后,将试剂 23 μL βA 测定预混液分配到分配的每个 βA 标记的孔中。
- 将 2 μL PCR 级水移液到每个 NTC 孔中,构建无模板对照 (NTC) 反应。
- 盖上孔并将板转移到模板添加区域。
- 短暂涡旋并离心含有 RNA 样品的试管。
- 将第一个样品中 2 μL 提取的 RNA 移液到为该样品标记的每个孔中。避免引入气泡。
- 确保通过可视化将 RNA 吸入移液器中。
- 在孔的侧面移液,以确保将样品添加到正确的孔中。
- 尽可能避免在开放的孔上挥动含有 RNA 的移液器吸头。
- 对剩余样品和阳性对照 RNA 重复步骤 3.2.10。
- 添加所有样品和对照后,将光学胶粘剂盖在孔上。小心覆盖所有孔并完全密封。
- 在台式离心机中在 RT 下以 500 × g 离心 1 分钟,或使用沙拉旋转器型板旋转器。
- 将密封板放入针对 FAM 和 VIC/HEX 报告基因染料校准的实时 PCR 仪器中,并将其设置为 表 3 中所示的循环参数。
- 准备用于 LN34 多重 (LN34M) 测定的预混液。
- 根据 表 2 标记一个微量离心管 LN34M。
- 确定每次分析要设置的反应数 (N)。
- 通过将样品数量乘以 3 并加上对照反应孔 6 加上 10% 的额外反应来计算 LN34M 检测的反应数,以解决移液过程中的体积损失。(例如,对于 10 个样品:(10 x 3) + 6 = 36 个反应;超额反应:(36 x 0.1) + 36 = 3.6 + 36 = 39.6 个反应总数,或 40 个反应四舍五入)
- 选择 25 μL 或 12.5 μL 规格。使用 表 2 确定 LN34M 预混液的每种试剂的体积。
- 使用 96 孔板图为 LN34M 测定中要测试的每个样品指定孔,一式三份。
- 将用于 LN34M 分析的试剂分配到孔中。短暂涡旋并离心管以收集底部液体,然后将 23 μL(用于 25 μL 反应)或 10.5 μL(用于 12.5 μL 反应)预混液分配到每个分配的孔中。避免引入气泡。
- 将 2 μL PCR 级水移液到每个 NTC 孔中,构建 NTC 反应。
- 盖上孔并将板转移到模板添加区域。
- 短暂涡旋并旋转含有 RNA 样品的试管,以收集底部的液体。
- 将第一个样品中 2 μL 提取的 RNA 移液到为该样品标记的每个孔中。避免引入气泡。
- 确保将 RNA 吸入移液器可视化中。
- 在孔的侧面移液,以确保将样品添加到正确的孔中。
- 尽可能避免在开放的孔上挥动含有 RNA 的移液器吸头。
- 对剩余样品和阳性对照 RNA 重复步骤 3.3.8。
- 添加最后一个样品/对照品后,将光学胶粘剂盖在孔上,确保所有孔都被覆盖并完全密封。
- 在台式离心机中在 RT 下以 500 × g 离心 1 分钟,或使用沙拉旋转器型板旋转器。
- 将密封板放入针对 FAM 和 VIC/HEX 报告基因染料校准的实时 PCR 仪器中,并将其设置为循环参数,如 表 3 所示。将惰性参比染料设置为 ROX 并在 标准模式下 运行(不要在快速模式下运行)
注:此设置特定于本方案中提到的仪器,并且需要使用含有 ROX 作为惰性染料的一步法 RT-PCR 试剂。其他仪器需要不同的方法来确定最佳运行设置。确保按照制造商的要求进行正常的仪器维护,以获得最佳性能。
- 单重 LN34 RT-PCR 检测的 Mastermix 制备
4. 结果解释
- 使用 LN34/FAM 的值 0.2 和 βA/HEX/VIC 的值 0.05 设置自动基线和手动阈值计算。
注:此设置特定于本方案中提到的仪器,并且需要使用含有 ROX 作为惰性染料的一步法 RT-PCR 试剂。替代工具需要不同的方法来计算基线和阈值。 - 如果所有对照都按预期执行,则使用 表 4 中的指南确定诊断结果(表 5)。
- 通过查看扩增曲线确认所有 Ct 或 Cq 值。
- 按照建议调查任何异常结果。
5. 样品保留和储存
- 将所有样品冷冻在 -16 °C 或更低温度下,直到检测完成并报告结果。保留原始组织以确认结果,或在检测结果异常的情况下识别宿主动物。
- 使用唯一的样品标识符;使用完整的唯一样品标识符标记所有试管、报告和文书工作。
- 保留中间样品(短期),以防需要重复检测。
- 根据需要保留具有代表性的阳性样品,以用作对照、流行病学分型和其他目的。
- 将 RNA 储存在 ≤-70 °C 下进行长期储存。
结果
图 2 显示了在 ABI ViiA7 实时荧光定量 PCR 仪器上成功运行 LN34 分析的代表性图像。查看在对数刻度上绘制的结果可以轻松查看 Ct 值,即曲线穿过阈值线的点(图 2A,C)。当在线性尺度上绘制时,成功的扩增将显示为 S 形(或“S”形)曲线(图 2B、D),而阴性结果应显示为直线、平坦的线。建议在线性视图和对数刻度视图中查看结果,以识别可能的异常或错误。多组分图视图中的典型阳性和阴性结果分别如图 2E、F 所示,其中可以观察到标记探针的染料(LN34 的 FAM,βA 的 VIC/HEX)相对于反应缓冲液 (ROX) 中的惰性染料的荧光水平。
异常结果的示例如图 3 所示。成功运行曲线图(图 2)和异常曲线图(图 3)之间的比较可用于隔离非典型运行和仪器问题。 图 3A 显示信号越过阈值,产生 LN34 的 Ct 值,但放大曲线非常不典型,呈线性增加。多组分(图 3B)图还显示了一条波浪线,这在阳性样品中并不常见。此示例强调了查看扩增图而不是简单地复制 Ct 值的重要性。始终确保所有样品的扩增曲线看起来正常。此外,还建议查看多组分图,以确保不存在不规则性。有时,在没有发生放大的情况下,杂乱的基线信号会产生 Ct 值。如果放大信号呈线性,建议调整基线以查看曲线是否消失。如果出现任何异常信号,则应重复整个运行。如果问题仍然存在,建议在实时荧光定量 PCR 仪器上清洁并运行背景板。如果可用,可以在琼脂糖凝胶上运行和/或对 PCR 产物进行测序,以解决任何异常结果。不建议使用凝胶电泳或测序的结果来确定诊断结果。
先前的研究表明,LN34 检测的重复、检测运行、作员和实验室之间的变异性较低7。如果观察到同一样品的重复样本之间存在高变异性(>±1.5 Ct 差异),则应重新检测该 RNA。移液器、实验室作、移液错误或实时荧光定量 PCR 机的问题可能导致高变异性。在多个样品或不同分析运行中重复观察到高变异性可能表明存在系统性问题。接近阳性样品的检测阈值 (Ct 35) 的低 RNA 样品在重复之间可能表现出更高的 Ct 值变异性。可能需要咨询 CDC 并进行故障排除,以解决持续变异性、结果不一致或检测失败的原因。
基于 PCR 的分析的高灵敏度使其本身容易受到污染。严格遵守良好的实验室规范是减少交叉污染的最佳方法。知道如何识别潜在的污染很重要。如果检测运行中没有模板对照和可疑的阴性样品孔都产生相似的 Ct 值,则应怀疑试剂污染。使用新等分试样的 PCR 试剂(缓冲液、水、引物和酶)和相同的 RNA 重复检测。如果所有样品和提取对照产生相似的 CT 值,但 NTC 为阴性,则应调查提取试剂的污染,并应使用新试剂重复提取。最好将试剂分成小份,以降低污染风险并避免丢弃大量昂贵试剂的可能性。样品交叉污染更难识别。如果怀疑样品污染,请从原始组织开始重复样品采集。在某些情况下,病毒 RNA 的测序可以确认污染,尤其是当污染 RNA 与预期的病毒变体(例如实验室中使用的对照病毒)非常不同时。对同时处理的两个样本进行测序可以确定病毒序列是否相同,但如果预计序列非常相似(例如,在同一县收集的相同变体),则可能没有信息。如果怀疑阳性对照 RNA 污染了样品,可以在琼脂糖凝胶上运行 LN34 检测扩增子,以区分溶血病毒 RNA (165 bp) 和阳性对照 RNA (99 bp)。用于生成 CDC8 提供的阳性对照 RNA 的模板序列。
对于其他病原体,可以使用实验室人员手动设置阈值以消除“噪声”,例如 图 4 中青色所示的弱扩增。不建议将这种做法用于狂犬病诊断,因为它可能导致假阴性结果,并造成可怕的后果,因为狂犬病几乎是 100% 致命的。请勿手动更改阈值以产生弱扩增或晚期扩增样品的阴性结果。必须重新提取和/或重新检测这些样本以排除狂犬病。
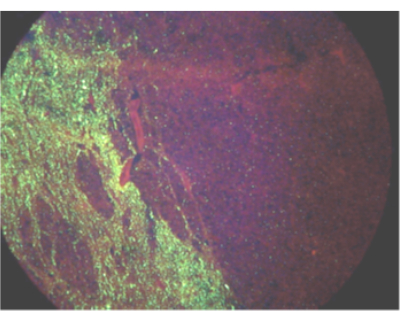
图 1:通过直接荧光抗体测试显示狂犬病病毒抗原在受感染驴体内单侧传播的视野。请点击此处查看此图的较大版本。
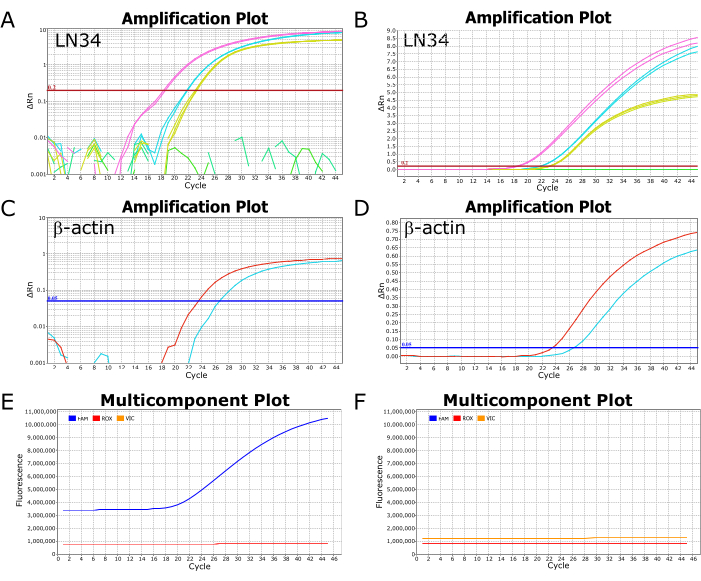
图 2:成功运行 LN34 分析的扩增和多组分图。(A-D) LN34 和 βA 分析的结果数据绘制在 (A,C) 对数刻度和 (B,D) 线性刻度上。图 A 和 B 描述了两个样品(粉红色和青色)与阳性对照(黄色)的 LN34 结果的比较。在图 B 中,有一条平坦的绿线,描绘了运行中的额外阴性样品。在 A 中,绿线不显示任何扩增,并被描绘为虚线段。LN34 测定的阈值手动设置为 0.2,由红色水平线表示。(C,D)两个样品(红色和青色)的 βA 分析结果。将 βA 检测的阈值手动设置为 0.05。(东、女)多组分图描述了 FAM (LN34)、VIC (βA) 和 ROX(AgPath-ID 缓冲液中存在的惰性染料)在每个循环中的荧光 (RFU)。ROX 水平在所有周期中都应保持平稳。图 E 显示了一个典型的阳性样品;对于该样品,FAM 荧光从第 18 周期开始呈 S 形曲线增加。典型的阴性样品如图 F 所示,其中 FAM 水平在所有周期中都与 ROX 水平平行。数据来自 ABI ViiA7 实时荧光定量 PCR 仪器。请单击此处查看此图的较大版本。

图 3:在 ViiA7 实时荧光定量 PCR 仪器上运行的 LN34 检测中观察到的罕见非典型信号的代表性图像。 (A-F)由于孔污染而产生的扩增 (A、C、E) 和多组分 (B、D、F) 图。FAM 荧光中的线性增加 (A,C) 和波浪波动 (B,D) 并不代表基于曲线形状和荧光变化幅度的真实扩增。图 A 到 D 可能表示阴性样本,即使为图 A 和 B 中所示的重复生成了 Ct 值。图 E 和 F 显示了一个奇数波浪信号,在多组分图中更容易看到。应调查此类信号,它可能表明仪器存在问题,即使所有控件在此运行中均按预期执行。请单击此处查看此图的较大版本。
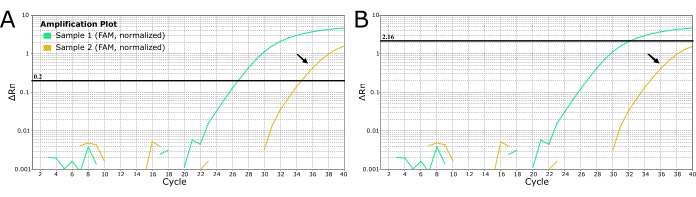
图 4:来自 2 个狂犬病疑似样本的 LN34 实时 RT-PCR 曲线,显示了两种设置阈值的方法。 (A) LN34 阈值设置为 0.2(建议用于所有运行)。(B) 手动确定每次运行的不同阈值,以掩盖确定为“噪声”(延迟放大信号)的信号。不建议将图 B 中使用的方法用于狂犬病,因为错过真阳性结果会带来严重后果。晚期扩增可能表明阳性样本较弱、PCR 抑制或阳性病例提取失败。它也可能表明交叉污染。黄金样品(由黑色箭头表示)在检测的临界值处产生 Ct 值,不应被视为阴性。扩增较晚的样本应重新提取和重新检测。 请单击此处查看此图的较大版本。
表 1:LN34lys(单重 LN34)、LN34M(LN34 和 βA 多重)实时 RT-PCR 检测中使用的引物和探针序列和浓度。 LN34 探针的 5 端用荧光 FAM 染料标记,3 端用黑洞淬灭剂 (BHQ1) 标记。βA 探针的 5' 端用荧光 HEX 染料标记,3' 端用黑洞淬灭剂 (BHQ1) 标记。锁定的核苷酸修饰碱基在序列中碱基前用加号表示。 请点击此处下载此表格。
表 2:LN34lys、Actin3 和 LN34M 检测的检测设置。 引物和探针名称、序列和浓度见 表 1。LN34_F1对应于 ACGCTTAACAACCAGATCAAAGAA7。 请点击此处下载此表格。
表 3:ABI 仪器的循环参数。 重要说明:确保在 STANDARD 模式下运行,而不是 在 FAST 模式下运行。应选择 ROX 作为惰性参比染料。 请点击此处下载此表格。
表 4:单重(上图,蓝色表)和多重(下图,红色表)格式的 LN34 实时 RT-PCR 结果解析算法。 LN34 阳性结果应被视为阳性,即使 βA 结果为阴性或不确定。如果未检测到 LN34 扩增子,则必须将 βA Ct ≤列出的 Ct 临界值视为阴性。βA Ct 值表示被测样品的质量并确定可能的抑制因素。原始临床样本中的低浓度可能会影响 βA 生长曲线,导致无法识别扩增。未能检测到 β-肌动蛋白的其他因素包括 RNA 丢失或 PCR 抑制剂残留导致 RNA 提取不良、检测设置和技术不正确、样品类型或质量不满意以及试剂或设备故障。 请点击此处下载此表格。
表 5:LN34 检测对照的常见结果的作和解释。 所有三个对照(狂犬病阳性对照 RNA、狂犬病阴性提取对照和无模板对照)必须产生预期结果才能使运行通过。阳性对照失败或无模板对照可能表明移液错误、试剂或设备故障。必须重复整个运行,包括所有测试的 RNA 样品。萃取控制失败可能表明萃取过程中存在问题,例如试剂故障、移液错误或交叉污染。必须重复提取所有样品。对于有经验的实验室人员来说,控制失败应该很少见。 请点击此处下载此表格。
讨论
成功的 LN34 检测运行需要阳性对照、提取控制,并且在每次检测运行中没有模板对照反应按预期进行,否则该运行必须无效并重复。所有 3 个 LN34 阳性对照重复反应都应在指定范围内超过阈值,否则应重复运行。先前出版物 7,8 中描述的阳性对照 RNA 不会在 βA 测定中扩增。无模板对照反应不应表现出超过 LN34 或 βA 测定阈值线的扩增曲线。提取对照不应表现出 LN34 的扩增。如果在 NTC 或提取对照中观察到意外扩增,则可能表明存在污染,并使所有样品的运行和重复检测无效(见表 5)。用户可以考虑添加额外的对照,包括无过程对照或无样品萃取对照,以监测提取试剂的宿主 βA 污染。
当狂犬病致死率接近 100% 时,建议进一步调查任何微弱或异常的扩增,即使它没有产生 Ct 值。阴性或 NTC 反应不应表现出任何扩增,并且荧光应显示为平行于多组分视图中 ROX 荧光的平线。曲线观察结果,尤其是在多次重复中,可能表明交叉污染或阳性结果较弱。阳性样品的所有重复样品都应进行扩增以获得有效的阳性结果。如果在任一检测中只有一个重复子集扩增,则应重新检测样品。此外,任何产生高度可变结果(重复之间的 Ct 值差异 > ±1.5)的样品都应被视为无效,并且应重新测试样品。如果问题仍然存在,则应重新提取样本。
从正确收集和储存的脑干和小脑组织中提取的狂犬病阳性样本预计在 LN34 测定中的Ct 值小于 35 个循环。所有不确定的样品必须通过 LN34 实时 RT-PCR 重新检测。如果重复检测后样品不确定,并且所有对照均按预期进行,则建议重新提取 RNA。病毒 RNA 含量低 (LN34 Ct > 35) 的样品可能表明存在潜在问题,例如污染、病毒载量低、PCR 抑制或提取失败。从原始组织中收集大脑的新鲜碎片,进行 RNA 提取,并重新检测样本。同样,βA 检测中 Ct 值> 33(单重)、37 (LN34M) 或无扩增可能表明 RNA 提取失败。对此类样品重复提取,然后重复检测 LN34 和肌动蛋白。如果样品在重复检测后再次产生不确定的结果,请使用 DFA(也称为 FAT)检测、DRIT 或病毒分离等辅助方法。如果观察到持续不一致的结果或不确定的结果,请咨询狂犬病参考实验室进行确认检测。
如果 RNA 提取中存在抑制剂,PCR 检测可能会产生假阴性结果。如果怀疑特定样品存在抑制或注意到 βA 对照反应(例如 Ct 值 > 33 或 Ct 值 > 37)受到抑制,则应以 2 倍或更多稀释度(例如,在无核酸酶水中以 1:10 和 1:100 的比例)测试提取的 RNA,以稀释任何潜在的 PCR 抑制剂。对于困难的样品,在 RT-PCR 反应中,如果不添加任何水,即可将 RNA 起始量增加到 8.5 μL。这可能显示原始样品中的抑制作用增加(与 2 μL 起始 RNA 相比,Ct 值更高)或低 RNA 水平(使用 8.5 μL 与 2 μL 起始 RNA 相比,Ct 值更早)。
LN34 检测不区分 Lyssavirus 或确定狂犬病病毒变体。LN34 检测扩增子可用于低分辨率狂犬病病毒变体分型或溶血病毒种类11 的鉴定。
披露声明
无需披露
致谢
我们感谢许多狂犬病诊断检测实验室的努力和合作,他们通过开放数据共享和反馈为 LN34 检测的实施、验证和优化做出了贡献。使用商品名称和商业来源仅用于识别身份,并不意味着得到美国疾病控制和预防中心、美国卫生与公众服务部或作者的附属机构的认可。作者表达的结论、发现和观点并不一定反映美国卫生与公众服务部、疾病控制和预防中心或作者所属机构的官方立场。
材料
| Name | Company | Catalog Number | Comments |
| 7500 Fast | Applied Biosystems | N/A | Do not substitute without validation |
| 7500 Fast Dx | Applied Biosystems | N/A | Do not substitute without validation |
| ABI ViiA 7 | Applied Biosystems | N/A | Do not substitute without validation |
| AgPath-ID One-Step RT-PCR Kit | ThermoFisher Scientific | AM1005 | Do not substitute without validation |
| Beadbug6 | Benchmark Scientific | D1036 | |
| Direct-zol RNA MiniPrep kit | Zymo Research | R2052 | |
| MagNA Lyser green beads | Roche | 3358941001 | |
| Microcentrifuge | Eppendorf | 5425 R | |
| Optical 96-well Reaction Plates | ThermoFisher Scientific | 4346907 | |
| Optical Adhesive covers | ThermoFisher Scientific | 4311971 | Alternative: caps |
| Polyester fiber-tipped applicator swabs | BD BBL Polyester Fiber Tipped Application Swab | 220690 | |
| QuantStudio 6Flex | Applied Biosystems | 4485691 | Do not substitute without validation |
| Quaternary ammonium disinfectant (1:256) | LYSOL | WBB56939 | Do not substitute without validation |
| RNase AWAY | ThermoFisher Scientific | 7002PK | |
| RNaseZap | ThermoFisher Scientific | AM9780 | |
| Single-use scalpel, a scalpel with a safety mechanism | Integra Miltex | 4-510 | |
| Sterile polyproylene microcentrifuge tubes (1.5 mL), nuclease free | Sarstedt | 72.692.405 | |
| Sterile polyproylene microcentrifuge tubes (2 mL), nuclease free | Sarstedt | 72.694.600 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | Do not substitute without validation |
参考文献
- Meechan, P. J., Potts, J. . Biosafety in Microbiological and Biomedical Laboratories. , (2020).
- . Terrestrial Manual 2023 Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals (2023)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/handle/10665/310836 (2018)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/bitstream/handle/10665/310837/9789241515306-eng.pdf?ua=1 (2019)
- . Protocol for postmortem diagnosis of rabies in animals by direct fluorescent antibody testing: A minimum standard for rabies diagnosis in the United States Available from: https://www.cdc.gov/rabies/pdf/RabiesDFASPv2.pdf (2003)
- World Health Organization. . WHO Expert Consultation on Rabies: Third Report. , (2018).
- Gigante, C. M., et al. Multi-site evaluation of the LN34 pan-lyssavirus real-time RT-PCR assay for postmortem rabies diagnostics. PLoS One. 13 (5), e0197074 (2018).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR assay for the detection of highly variable rabies virus and other lyssaviruses. PLoS Negl Trop Dis. 11 (1), e0005258 (2017).
- Gigante, C. M., Wicker, V., Wilkins, K., Seiders, M., Zhao, H., Patel, P., Orciari, L., Condori, R. E., Dettinger, L., Yager, P., Xia, D., Li, Y., et al. Optimization of pan-lyssavirus LN34 assay for streamlined rabies diagnostics by real-time RT-PCR. Journal Virological Methods. , (2024).
- Rao, A. K., et al. Use of a modified preexposure prophylaxis vaccination schedule to prevent human rabies: recommendations of the advisory committee on immunization practices-United States, 2022. Morbidity and Mortality Weekly Report. 71 (18), 619 (2022).
- Condori, R. E., et al. Using the LN34 Pan-Lyssavirus Real-Time RT-PCR assay for rabies diagnosis and rapid genetic typing from formalin-fixed human brain tissue. Viruses. 12 (1), 120 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。