Method Article
Посмертная диагностика бешенства у животных с помощью обновленного мультиплексного анализа полимеразной цепной реакции с обратной транскрипцией LN34 в реальном времени
В этой статье
Резюме
В этом протоколе демонстрируется анализ полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени на основе пан-лиссавируса LN34 от сбора тканей до интерпретации результатов, включая обновление последовательностей праймеров и составов для повышения эффективности анализа некоторых лиссавирусов и зайцеобразных, не вызывающих бешенство. Мы также демонстрируем установку анализа для однолуночного мультиплексированного формата LN34 (LN34M).
Аннотация
Бешенство является смертельным зоонозным заболеванием, вызываемым лиссавирусным бешенством (RABV) и родственными вирусами с отрицательной цепью РНК из рода Lyssavirus (семейство Rhabdoviridae). Анализ LN34 нацелен на высококонсервативную ведущую область и ген нуклеопротеина генома лиссавируса и использует вырожденные праймеры и зонд TaqMan, содержащий заблокированные нуклеотиды, для обнаружения РНК в разнообразном роде лиссавирусов . Отрицательный результат на бешенство должен быть сделан только в том случае, если исследуется полный срез ствола мозга и три доли мозжечка; тем не менее, идентификация РНК лиссавируса в любой ткани является диагностическим признаком инфекции бешенства. Ткань собирается и гомогенизируется в реагенте TRIzol, который также инактивирует вирус. Экстракция РНК выполняется с помощью коммерческого набора для экстракции на основе спин-колонки. Мастер-смеси готовятся в чистом помещении и аликвотируются в 96-луночный планшет перед добавлением образца РНК. В клинических условиях каждый образец проверяется методом ОТ-ПЦР в реальном времени на наличие РНК лиссавируса в трех экземплярах и отдельно на мРНК β-актина хозяина. Положительный и отрицательный контроль включается в этапы экстракции и ОТ-ПЦР в режиме реального времени протокола. Анализ данных включает ручную настройку пороговых значений для стандартизации значений Ct при каждом прогоне прибора. Положительные результаты определяются наличием типичной амплификации в анализе пан-лиссавируса (Ct ≤ 35). Отрицательные результаты определяются отсутствием типичной амплификации в анализе пан-лиссавируса и обнаружением мРНК β-актина хозяина (Ct ≤ 33). Наблюдение значений за пределами этих диапазонов или неудача в пробирном контроле может привести к аннулированию прогона или к неубедительным результатам для образца. Протокол должен тщательно соблюдаться для обеспечения высокой чувствительности и специфичности анализа. Процедурные изменения могут повлиять на эффективность анализа и привести к ложноположительным, ложноотрицательным или неинтерпретируемым результатам.
Введение
В настоящем протоколе описана процедура диагностического тестирования на бешенство с использованием анализа полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) пан-лиссавируса LN34 в реальном времени от сбора образца до интерпретации результатов. Процедура будет разбита на три раздела: сбор образцов мозга в соответствии с анализом LN34 (раздел 1), ручная экстракция РНК на основе столбцов с использованием набора Direct-zol RNA Miniprep (Zymo Research R2051) (раздел 2) и анализ LN34 в реальном времени с использованием набора AgPath-ID One-Step RT-PCR (ThermoFisher Scientific AM1005) (раздел 3). Экстракцию РНК и ОТ-ПЦР можно проводить с использованием других продуктов, но наборы должны быть валидированы перед использованием, чтобы убедиться в том, что РНК лиссавируса экстрагируется и амплифицируется надлежащим образом.
В разделе 1 описывается сбор соответствующих тканей мозга, которые будут использоваться в анализе ОТ-ПЦР LN34 в реальном времени. Описание вскрытия животных, обезглавливания и удаления мозга не включено. Образцы могут содержать инфекционные агенты. Для снижения риска следует соблюдать процедуры биобезопасности, подробно описанные в документе «Биобезопасность в микробиологических и биомедицинских лабораториях», 6-е издание1 . Образцы следует считать инфекционными до завершения инактивации. Инактивация вируса и валидация анализов должны проводиться в каждой лаборатории в соответствии со стандартами этого учреждения. Лаборатории должны следовать стандартным процедурам безопасности и качества, определенным их учреждением, при проведении нового диагностического теста.
Исходя из того, что известно о распространении вируса бешенства во время инфекции, ствол мозга и мозжечок являются лучшими тканями для диагностики бешенства, и эти ткани рекомендованы для тестирования на бешенство Всемирной организацией здравоохранения и Всемирной организацией по охране здоровья животных 2,3,4,5. Поскольку распространение вируса может быть односторонним (рис. 1), особенно у крупных животных, следует исследовать полный срез ствола мозга и трех долей мозжечка на предмет исключения бешенства. В случае образцов, которые не соответствуют этим минимальным критериям, лаборатория может отклонить образец как недостаточный для тестирования или принять решение о проведении испытаний в целях надзора или соблюдения правил. Если необходимые ткани не получены, но лаборатория решает проверить образец, отрицательный результат теста следует интерпретировать как неубедительный для бешенства у этого животного, поскольку присутствие вирусной РНК в других тканях может быть замедленным, иметь низкую численность, прерывистое или отсутствовать. В этом случае необходим сбор необходимых образцов или дополнительное тестирование, чтобы исключить бешенство. Тем не менее, идентификация РНК лиссавируса в любой ткани является диагностикой бешенства3,6. Примерами образцов, которые могут быть проверены на РНК вируса бешенства для инклюзии или эпиднадзора (но не исключения) инфекции бешенства, являются кора, гиппокамп, спинной мозг, деградировавшие образцы, кожа, слюна и роговица. Качественная оценка состояния каждого образца должна быть произведена по прибытии в лабораторию. Охлаждение может сохранить образец не менее 72 часов, но его не следует использовать в течение длительного времени. Повторные циклы замораживания-размораживания могут снизить чувствительность теста, поэтому следует избегать более пяти циклов замораживания-оттаивания. Если состояние ткани не позволяет уверенно идентифицировать структуры головного мозга, образец следует признать неудовлетворительным. В случае неудовлетворительного образца все еще можно провести тестирование, чтобы исключить бешенство (но не исключить). Об этом сообщается о положительных результатах теста. Отрицательные или неубедительные результаты по неудовлетворительным тканям должны быть сообщены как неубедительные, чтобы предотвратить неверную интерпретацию как негативный диагноз.
Этот протокол был разработан на основе опубликованных процедур 7,8,9 и включает обновленные праймеры, нацеленные на ведущую область генома лиссавируса и кодирующую последовательность нуклеопротеина. Зонд нацелен на короткую, высококонсервативную последовательность и использует заблокированные нуклеотиды для обеспечения широкого обнаружения. Анализ обнаруживает РНК различных лиссавирусов в различных концентрациях8. В этом протоколе демонстрируются лабораторные процедуры для проведения ПЦР-анализа LN34 в реальном времени, но точное и чувствительное обнаружение РНК лиссавируса зависит от других элементов, которые не подробно описаны в этом протоколе, таких как хранение образцов, ведение документации, обучение/компетентность персонала, отслеживание результатов, интерпретация результатов, обеспечение качества, меры безопасности лаборатории и устранение неполадок. Анализы на основе ПЦР подвержены перекрестной контаминации из-за их высокой чувствительности. Перекрестного загрязнения можно избежать, придерживаясь надлежащих лабораторных методов, таких как частая смена перчаток, работа с одним образцом за раз, дезинфекция рабочих поверхностей с помощью эффективных обеззараживающих средств между образцами, а также закрытие пробирок и отделение образцов от ПЦР-реагентов. ПЦР-реагенты и образцы могут быть легко разделены за счет использования одностороннего рабочего процесса и разделения рабочих зон до и после амплификации. Например, готовьте мастермиксы для ПЦР в месте, физически отдельном от места, где обрабатываются образцы. Часто меняйте перчатки, чтобы избежать загрязнения ПЦР-реагентов образцами, мусором или положительной контрольной РНК. После добавления мастермикса планшет или пробирки для ПЦР следует переместить во второе место, где можно добавить образец и контрольную РНК. Важно отметить, что продукты ПЦР не следует манипулировать в зонах, где готовятся образцы или мастермиксы.
Ничто не заменит практическую практику и опыт при выполнении диагностических тестов. Все новые сотрудники должны пройти обучение, а персонал, проводящий испытания, должен оцениваться на компетентность не реже одного раза в год в соответствии с требованиями директора соответствующей лаборатории. Любые наблюдения необычных результатов или неудачи анализа должны быть немедленно отмечены, исследованы и исправлены. Каждая новая партия реагентов должна быть валидирована с использованием образцов с известными значениями Ct (например, положительный контроль или архивный образец). Все оборудование должно проходить плановое техническое обслуживание в соответствии с рекомендациями производителя, а эффективность анализа должна быть проверена после любого технического обслуживания или ремонта. Уровень температуры должен контролироваться на соответствующем оборудовании, чтобы холодильники и морозильники оставались в пределах критериев, установленных для приемлемого температурного диапазона для реагентов, используемых в диагностических испытаниях.
Процедурные изменения могут повлиять на эффективность анализа и привести к ложноположительным, ложноотрицательным или неинтерпретируемым результатам. Рекомендации должны строго соблюдаться для обеспечения высокой чувствительности и специфичности анализа. Лаборатория, желающая внести изменения в этот протокол, должна проверить и подтвердить измененные методы по согласованию с CDC.
протокол
Посмертные образцы тканей мозга были получены в ходе рутинного эпиднадзора или диагностических мероприятий Отделения по борьбе с поксвирусами и бешенством (CDC; Атланта, Джорджия, США).
1. Забор ткани головного мозга для посмертной диагностики бешенства у животных с помощью анализа ОТ-ПЦР в реальном времени на пан-лиссавирус LN34
ПРИМЕЧАНИЕ: Образцы могут содержать инфекционные агенты. Носите соответствующие средства индивидуальной защиты (СИЗ) (тяжелые резиновые перчатки или другие перчатки, устойчивые к порезам, лабораторный халат, водонепроницаемый фартук, хирургическую маску, ботинки, защитные рукава и лицевой щиток) и соблюдайте необходимые правила безопасности при использовании, хранении и утилизации образцов. Предконтактная вакцинация против бешенства, регулярное серологическое тестирование и ревакцинация (по мере необходимости) требуются для любого лица, прежде чем работать, тестировать, производить или проводить исследовательскую деятельность с лиссавирусами или известными или потенциально инфицированными образцами 2,3,4,6,10.
- Пометьте одну пробирку для сбора образцов на каждый образец этикеткой. Заполните каждую пробирку для сбора образцов 1 мл реагента TRIzol или другого гомогенизационного буфера и порцией шариков MagNA Lyser (далее «керамические шарики»). Чтобы добавить керамические бусины, аккуратно вылейте из пробирки с бусинами в пробирку для сбора образцов. Пробирки с керамическими бусинами обычно содержат достаточное количество бусин для 2-5 образцов, используя не менее 20 бусин диаметром 1,4 мм на образец.
ВНИМАНИЕ: Реагент ТРИзол (далее «буфер для гомогенизации») является опасным химическим веществом; контакт с кислотами или отбеливателем выделяет токсичные газы; обеспечить достаточную вентиляцию; Для получения дополнительной информации обратитесь к паспорту безопасности. Если пользователи заменяют реагент TRIzol или реагент TRI на другой гомогенизационный буфер, необходима дополнительная валидация. Тризол действует как буфер для гомогенизации/лизиса образца, буфер для инактивации лиссавируса и буфер стабильности РНК для этого протокола. Использование альтернативного гомогенизационного буфера потребует проверки эффективности экстракции, инактивации и стабильности в контролируемом параллельном сравнении. - Очистите и продезинфицируйте рабочую поверхность дезинфицирующим средством из четвертичных аммониевых соединений (QAC) в течение 2 минут и разложите абсорбирующую прокладку с пластиковой подкладкой. Поместите только реагенты и расходные материалы для первого образца в шкаф биологической безопасности класса II (BSC) с функциями отвода опасных паров за пределы помещения.
ПРИМЕЧАНИЕ: Обратитесь к руководству производителя по предельным значениям хранения разбавленного QAC. Убедитесь, что прокладка с пластиковой облицовкой не блокирует поток воздуха в шкафу биологической безопасности. Если поток воздуха нарушен, не используйте прокладку. - Соберите ткань, представляющую собой полное сечение ствола мозга и мозжечка, с помощью чистого одноразового скальпеля.
ПРИМЕЧАНИЕ: Манипуляции с тканями должны проводиться таким образом, чтобы жидкости не распылялись и не образовывались частицы в воздухе. Вытяжные шкафы или шкафы биобезопасности не требуются, но рекомендуются вентилируемые шкафы биобезопасности, поскольку они обеспечивают дополнительную защиту от запахов, испарений, эктопаразитов и фрагментов костей.
ВНИМАНИЕ: Использование скальпеля с материалом, потенциально инфицированным лиссавирусом, опасно, и пользователи должны принимать соответствующие меры предосторожности. Рекомендуется использовать одноразовые щипцы.- У мелких животных (например, летучих мышей) может быть собран весь ствол мозга и мозжечок.
- Для более крупных животных соберите полный поперечный срез ствола мозга и ткани из каждой из трех долей мозжечка.
- ДОПОЛНИТЕЛЬНО: При проведении прямого теста на флуоресцентные антитела (DFA) соберите отпечатки мозга на этом этапе. Используйте ткань, оставшуюся после сбора оттисков мозга, на DFA для выделения РНК и тестирования методом анализа LN34.
ПРИМЕЧАНИЕ: Если в образцы добавлен TRIzol, образцы больше нельзя использовать для методов обнаружения на основе антигенов или выделения вирусов.
- Подготовка образцов для гомогенизации и экстракции РНК.
ПРИМЕЧАНИЕ: Эффективность экстракции РНК и инактивации вируса может быть снижена при использовании слишком большого количества ткани. Количество ткани не должно превышать примерно 1/10 объема используемого гомогенизационного буфера. Если используется больше ткани, увеличьте количество гомогенизационного буфера соответственно, чтобы обеспечить эффективную и успешную экстракцию РНК.- Для мелких животных поместите все необходимые ткани в пробирку, содержащую гомогенизационный буфер и шарики для экстракции. Не превышайте 100 мг образца в 1 мл гомогенизационного буфера; Для больших образцов увеличьте объем гомогенизационного буфера или используйте несколько пробирок для отражения соотношения выборка: буфер 1:10.
- Для более крупных животных тщательно измельчите и гомогенизируйте ткань и удалите репрезентативную порцию в трубку, предварительно заполненную гомогенизационным буфером и гранулами. Не превышайте 100 мг образца в 1 мл гомогенизационного буфера; Для больших образцов увеличьте объем гомогенизационного буфера или используйте несколько пробирок для отражения соотношения выборка: буфер 1:10.
- Вариант 1 (Взбиватель для бусин): Гомогенизируйте ткань с помощью взбивателя для бисера, 1 мл буфера и керамических шариков. Может потребоваться использование нескольких пробирок объемом 2 мл или более крупных пробирок.
- Вариант 1 (Взбиватель бусин): Очистите и продезинфицируйте рабочую станцию, оборудование и внешние пробирки с образцами дезинфицирующим средством QAC (1:256). Дайте постоять 2 минуты.
- Вариант 1 (Взбиватель шариков): Внутри BSC загрузите ротор центрифуги с гомогенизированными образцами. Центрифугируйте все образцы при концентрации 10 000-16 000 × г в течение 2 минут в настольной микроцентрифуге. Выгрузите ротор центрифуги внутрь ДСК.
- Вариант 1 (Взбиватель бусин): Дайте постоять 2 минуты.
- Вариант 1 (Бисер): Перелейте 120 μL гомогената в пробирку, предварительно заполненную 1 мл гомогенизационного буфера.
ВНИМАНИЕ: Гомогенизация может привести к образованию аэрозолей и должна выполняться в BSC. - Вариант 2 (Скальпель): Мелко измельчите необходимые салфетки с помощью одноразового скальпеля, смажьте тампоном и переложите тампон в трубку, предварительно заполненную гомогенизационным буфером и шариками. Не превышайте 100 мг образца в 1 мл гомогенизационного буфера; Для больших образцов увеличьте объем гомогенизационного буфера или используйте несколько пробирок для отражения соотношения выборка:буфер 1:10.
ВНИМАНИЕ: Использование скальпеля с материалом, потенциально инфицированным лиссавирусом, опасно, и пользователи должны принимать соответствующие меры предосторожности.
- Соберите все оставшиеся салфетки в исходный контейнер или в новый, пустой контейнер с этикеткой доступа. Храните эту ткань на случай, если потребуется повторное тестирование или дополнительная характеристика.
- Очистите и продезинфицируйте рабочую станцию, оборудование и внешнюю часть пробирок с образцами с помощью дезинфицирующего средства QAC 1:256. Дайте постоять 2 минуты.
- Повторите шаги 1.2-1.5 для всех оставшихся образцов.
- Гомогенизируйте образцы с помощью мини-бисера в течение не менее 60 с. Визуально осмотрите трубки. Повторяйте взбивание бусин еще 60 секунд, если остаются большие кусочки ткани. Этот шаг является необязательным, если ткань полностью гомогенизирована на шаге 1.4.2.1 выше.
ПРИМЕЧАНИЕ: Важно убедиться, что ткань полностью гомогенизирована. Неполная гомогенизация приведет к снижению выхода РНК. - Оставьте на 5 минут при комнатной температуре (RT).
- Очистите и продезинфицируйте рабочую станцию, оборудование и внешнюю поверхность пробирок для образцов с помощью дезинфицирующего средства QAC (1:256).
ПРИМЕЧАНИЕ: В настоящее время образец считается неинфекционным и может быть изъят из лаборатории по борьбе с бешенством. - Немедленно обработайте образцы в гомогенизационном буфере для экстракции РНК, храните при RT (от 20 °C до 25 °C) или в холодильнике (от 4 °C до 8 °C) в течение нескольких дней или храните при температуре -16 °C или ниже для длительного хранения.
2. Протокол экстракции РНК с помощью набора RNA MiniPrep
- Настройте рабочую область в BSC.
- Перед началом работы очистите рабочую поверхность BSC с использованием 70% этанола для удаления пыли или других загрязнителей окружающей среды. Проведите дополнительную дезинфекцию поверхностей дезинфицирующим средством QAC (1:256), RNase AWAY или RNaseZap (в соответствии с рекомендациями производителя).
- Разложите абсорбирующую рабочую площадку с пластиковой подкладкой и поместите реагенты, расходные материалы и образец в ДСК.
ПРИМЕЧАНИЕ: Убедитесь, что прокладка с пластиковой облицовкой не блокирует поток воздуха из BSC. Если поток воздуха нарушен, не используйте прокладку. - Разложите все пробирки для сбора в чистом штативе для микроцентрифужных пробирок. Предварительно заполните одну микроцентрифужную пробирку объемом 1,5 мл 300 мкл 100% этанола для каждого образца мозга не летучих мышей. Для образцов с небольшим количеством ткани (образец мозга летучей мыши, образец без мозга или образец с испорченным состоянием) предварительно заполните одну микроцентрифужную пробирку объемом 1,5 мл 600 мкл 100% этанола для каждой.
- Подготовка образцов
- Соберите все образцы, подготовленные в разделе 1, в штативе для пробирок в BSC. Разморозьте все замороженные образцы непосредственно перед тестированием.
- Разморозьте контроль вытяжки.
ПРИМЕЧАНИЕ: Рекомендуется выбирать образец без РНК лиссавируса; образец должен быть предварительно протестирован с ожидаемым диапазоном значений Ct для анализа бета-актина. Например, предварительно аликвотированные клетки культуры тканей или ранее протестированный отрицательный случай бешенства (человека или животного).
- Центрифугируйте все образцы при давлении 10 000-16 000 × г в течение 2 м в настольной микроцентрифуге.
- Перенесите надосадочную жидкость в новую стерильную микроцентрифужную пробирку, содержащую 100% этанол. Следите за тем, чтобы надосадочная жидкость была прозрачной, без явных липидов или твердых тканей. Избегайте сбора липидов и твердых тканей.
- Для тканей мозга, не являющихся летучими мышами: пересадка 300 мкл надосадочной жидкости.
- Для образцов с небольшим количеством ткани (образец мозга летучей мыши, образец без мозга или образец с ухудшением состояния) переведите 600 мкл надосадочной жидкости.
- Оставшийся гомогенат храните в микроцентрифужной пробирке с завинчивающейся крышкой при температуре ≤-16 °C.
- Перемешайте пипеткой вверх и вниз 10 раз.
- Для каждого образца перенесите 600 мкл смеси этанола и надосадочной жидкости в спиновую колонку в сборной пробирке.
- Центрифугируйте до тех пор, пока жидкость не пройдет через колонну (1 мин при 10 000-16 000 × г). Откажитесь от проточного потока.
- Повторите, если в образце содержится более 600 μл буферной смеси этанола и гомогенизации.
- Перенесите каждую колонку в новую пробирку для сбора.
- Добавьте 400 μL буфера для предварительной промывки РНК в каждую колонку и центрифугируйте при 10 000-16 000 × г в течение 30 с.
- Выбросьте проточный поток и верните каждую колонну в ту же сборную трубку.
- Повторите шаги 2.10-2.11.
- Добавьте 700 μL промывочного буфера РНК в каждую колонку и центрифугируйте при 10 000-16 000 × г в течение 2 минут. Убедитесь, что промывочный буфер полностью прошел через каждую колонну.
- Осторожно переложите каждую колонку в пробирку, не содержащую РНКазы.
- Выбросьте проточную и сборную трубки с 2.13.
- Добавьте 50 мкл воды, не содержащей ДНКазы/РНКазы, непосредственно в матрицу колонки для элюирования РНК.
ПРИМЕЧАНИЕ: Не прикасайтесь к матрице колонки наконечником пипетки. - Инкубировать в течение 30 с при RT, затем центрифугировать при 10 000-16 000 × г в течение 1 минуты.
- Осторожно перенесите РНК в новую микроцентрифужную пробирку с винтовым верхом, плоским дном, меченую. Переместите извлеченную РНК на лед для немедленного тестирования. Хранить длительное время при температуре -70 °C или холоднее.
ПРИМЕЧАНИЕ: Хранение при более высоких температурах или повторные замораживания-оттаивания могут привести к деградации РНК и повлиять на результаты диагностики.
3. Протокол для анализа ОТ-ПЦР в реальном времени на пан-лиссавирус LN34
- Подготовьте реактивы.
- Искусственный положительный контроль
- Если CDC8 продуцирует искусственную положительную контрольную РНК, следуйте инструкциям на упаковке по хранению, восстановлению и аликвотированию. Пропустите этот шаг, если одноразовые аликвоты положительной контрольной РНК уже находятся под рукой.
ПРИМЕЧАНИЕ: Положительная контрольная РНК в рабочих концентрациях должна обрабатываться в зоне добавления матрицы, а не в той же зоне, что и приготовление мастермикса. Положительная контрольная РНК должна производить пороговое значение цикла (Ct) в пределах ожидаемого диапазона, определенного для данной партии. Между прогонами значение LN34 Ct для положительной контрольной РНК не должно отличаться более чем на ±1,5 Ct. - Разморозьте одноразовую аликвоту при ≤ -70 °C непосредственно перед использованием на льду или ледяной глыбе. Не замораживайте-размораживайте и выбрасывайте аликвоты, хранящиеся в течение длительного времени при охлажденных температурах.
ПРИМЕЧАНИЕ: Положительный контроль должен быть проведен в трех экземплярах в анализе LN34; Искусственный положительный контроль8 не будет амплифицироваться в анализе бета-актина.
- Если CDC8 продуцирует искусственную положительную контрольную РНК, следуйте инструкциям на упаковке по хранению, восстановлению и аликвотированию. Пропустите этот шаг, если одноразовые аликвоты положительной контрольной РНК уже находятся под рукой.
- Контроль экстракции и пробы: Поместите свежеизвлеченные образцы на лед (или ледяную глыбу) или разморозьте образцы из хранения при температуре ≤-70 °C на льду (или ледяной глыбе) непосредственно перед использованием.
РНК следует размораживать и обрабатывать в зоне, предназначенной для добавления образца или матрицы, которая отделена от зон, используемых для приготовления мастермикса или манипуляций с продуктами ПЦР или большими количествами вирусного материала (например, генерация положительного контроля, распространение вируса)
- Искусственный положительный контроль
- Приготовьте реактивы mastermix в зоне подготовки mastermix.
- Mastermix приготовление одноплексного анализа LN34 RT-PCR
ПРИМЕЧАНИЕ: Пользователи могут тестировать образцы в формате одиночного (шаг 3.2.1) или мультиплекса (шаг 3.2.2). Выполнение как пунктов 3.2.1, так и 3.3.2 не является необходимым. Приготовление Mastermix, аликвотирование праймера и зонда, а также отсутствие контрольных реагентов шаблонов должны размораживаться и манипулироваться в чистой зоне, отдельной от обработки образцов, вскрытия, ПЦР и других областей, где происходит манипулирование вирусными материалами. Это может быть достигнуто за счет отдельных помещений или системы шкафов с односторонним потоком проб.- Сгенерируйте смеси грунтовки и зонда при рабочих концентрациях, как указано в Таблице 1 и Таблице 2. Пропустите этот шаг, если рабочие аликвоты разведения праймеров и щупов уже находятся на руках.
- Аликвотные праймеры и зонды помещают в запасные массы объемом 1,5 мл и рабочие массы объемом 50 мкл и хранят при температуре ≤-16°C в темное время суток. Пропустите этот шаг, если рабочие аликвоты разведения праймеров и щупов уже находятся на руках.
ПРИМЕЧАНИЕ: Рекомендуется выполнить шаг 3.2.1.2. - Размораживание одноступенчатого буфера ОТ-ПЦР, без контроля шаблонов, праймеров и зондов при хранении при температуре ≤-16 °C на льду или блоке льда в зоне приготовления мастермикса.
ПРИМЕЧАНИЕ: Используйте реагенты до истечения срока годности или сбоя производительности, в зависимости от того, что наступит раньше. - Перед использованием кратко оберните и центрифугируйте все буферы, праймеры и зонды.
- Храните фермент одноэтапной ОТ-ПЦР на льду или в блоке льда до использования.
- Образцы РНК
ПРИМЕЧАНИЕ: По возможности используйте свежеизвлеченную РНК, так как замораживание-оттаивание может повлиять на производительность. - Храните образцы РНК на льду или ледяной глыбе до использования.
- Разморозьте все замороженные образцы РНК на льду или ледяной глыбе.
- Пометьте одну микроцентрифужную пробирку для каждого анализа (LN34 и βA).
- Определите количество реакций (N), которые необходимо настроить для каждого анализа.
- Рассчитайте количество реакций для анализа LN34, умножив количество образцов на 3 и прибавив 6 для контрольных реакционных лунок плюс 10% дополнительных реакций, чтобы учесть потерю объема во время пипетирования. (например, для 10 образцов: (10 x 3) + 6 = 36 реакций; избыточные реакции: (36 x 0,1) + 36 = 3,6 + 36 = 39,6 всего реакций, или 40 реакций с округлением в большую сторону)
ПРИМЕЧАНИЕ: Для клинических испытаний рекомендуется тестировать все образцы в трех экземплярах на LN34. В целях надзора каждый образец может быть протестирован в двух экземплярах. Рекомендуется использовать трипликат во время первоначального анализа для обеспечения низкой вариабельности между репликациями и хорошей техникой. - Рассчитайте количество реакций для анализа βA, сложив количество образцов плюс 4 контрольные реакционные лунки плюс 10% дополнительных реакций, чтобы учесть потерю объема во время пипетирования.
- Определите объем каждого реагента для мастерсмесей LN34 и βA с помощью таблицы 2.
- Назначьте лунки для каждого образца, который будет исследован в трех экземплярах в анализе LN34 и в сингликате для анализа βA, используя карту 96-луночных планшетов.
- Дозируйте 23 мкл мастермикса для анализа LN34 в каждую назначенную смесь LN34 после кратковременного вортекса и вращения вниз в течение 30 с с помощью настольной микроцентрифуги для сбора жидкости на дне пробирки. Избегайте образования пузырей.
- Диспенсируйте реагенты 23 мкл мастермикса для анализа βА в каждую назначенную βA-меченную смесь после кратковременного вортекса и вращения в течение 30 с в настольной микроцентрифуге для сбора жидкости на дне.
- Настройте реакции без контроля шаблонов (NTC), пипетируя 2 мкл воды для ПЦР в каждую лунку NTC.
- Закройте колодцы и переложите пластину в область добавления шаблона.
- Кратковременно сделайте вихревой и центрифугируйте пробирки, содержащие образцы РНК.
- Пипеткой введите 2 мкл экстрагированной РНК из первого образца в каждую лунку, помеченную для этого образца. Избегайте образования пузырей.
- Убедитесь, что РНК была втянута в пипетку с помощью визуализации.
- Нанесите пипетку на боковую часть лунки, чтобы убедиться, что образец добавлен в нужную лунку.
- По возможности избегайте размахивания наконечниками пипеток, содержащими РНК, над открытыми лунками.
- Повторите шаг 3.2.10 для остальных образцов и положительной контрольной РНК.
- Поместите оптическую адгезивную крышку на лунки после добавления всех образцов и контрольных образцов. Будьте внимательны, чтобы закрыть все лунки и полностью загерметизировать.
- Центрифугируйте при 500 × г в течение 1 минуты при RT в настольной центрифуге или используйте вращатель для салатов.
- Поместите запечатанный планшет в прибор для ПЦР в реальном времени, откалиброванный для использования репортерных красителей FAM и VIC/HEX, и установите для него параметры цикла, показанные в таблице 3.
- Подготовить исходные смеси для мультиплексного анализа LN34 (LN34M).
- Промаркируйте одну микроцентрифужную пробирку LN34M в соответствии с таблицей 2.
- Определите количество реакций (N), которые необходимо настроить для каждого анализа.
- Рассчитайте количество реакций для анализа LN34M, умножив количество образцов на 3 и прибавив 6 для контрольных реакционных лунок плюс 10% дополнительных реакций, чтобы учесть потерю объема во время пипетирования. (например, для 10 образцов: (10 x 3) + 6 = 36 реакций; избыточные реакции: (36 x 0,1) + 36 = 3,6 + 36 = 39,6 общих реакций, или 40 реакций с округлением в большую сторону)
- Выберите формат 25 μL или 12,5 μL. Определите объем каждого реагента для мастермикса LN34M с помощью таблицы 2.
- Назначьте лунки для каждого образца, подлежащего испытанию в трех экземплярах в анализе LN34M, используя карту 96-луночных планшетов.
- Дозируйте реагенты для анализа LN34M в лунки. Кратковременно закрутите трубки и прокрутите вниз для сбора жидкости на дне перед выдачей 23 мкл (для реакции 25 мкл) или 10,5 мкл (для реакции 12,5 мкл) мастер-смеси в каждую назначенную лунку. Избегайте образования пузырей.
- Настройте реакции NTC, пипетируя 2 мкл воды для ПЦР в каждую лунку NTC.
- Закройте колодцы и переложите пластину в область добавления шаблона.
- Кратковременно закрутите и закрутите вниз трубки, содержащие образцы РНК, чтобы собрать жидкость на дне.
- Пипеткой введите 2 мкл экстрагированной РНК из первого образца в каждую лунку, помеченную для этого образца. Избегайте образования пузырей.
- Убедитесь, что РНК втянута в визуализацию пипетки.
- Нанесите пипетку на боковую часть лунки, чтобы убедиться, что образец добавлен в нужную лунку.
- По возможности избегайте размахивания наконечниками пипеток, содержащими РНК, над открытыми лунками.
- Повторите шаг 3.3.8 для остальных образцов и положительной контрольной РНК.
- После добавления последнего образца/контрольного образца наденьте на лунки оптическую адгезивную крышку, убедившись, что все лунки закрыты и полностью герметизированы.
- Центрифугируйте при 500 × г в течение 1 мин при RT в настольной центрифуге или используйте спиннер салатного типа.
- Поместите герметичную пластину в прибор для ПЦР в реальном времени, откалиброванный для репортерных красителей FAM и VIC/HEX, и установите для него параметры цикла, как показано в таблице 3. Установите пассивный эталонный краситель на ROX и запускайте в стандартном режиме (не запускайте в быстром режиме)
ПРИМЕЧАНИЕ: Эта настройка специфична для инструментов, упомянутых в данном протоколе, и требует использования одноэтапного реагента ОТ-ПЦР, содержащего ROX в качестве пассивного красителя. Альтернативные приборы требуют других подходов для определения оптимальных настроек работы. Обеспечьте регулярное техническое обслуживание прибора в соответствии с требованиями производителя для достижения наилучшей производительности.
- Mastermix приготовление одноплексного анализа LN34 RT-PCR
4. Интерпретация результатов
- Установите автоматический базовый уровень и ручные расчеты пороговых значений со значением 0,2 для LN34/FAM и 0,05 для βA/HEX/VIC.
ПРИМЕЧАНИЕ: Эта настройка специфична для инструментов, упомянутых в данном протоколе, и требует использования одноэтапного реагента ОТ-ПЦР, содержащего ROX в качестве пассивного красителя. Альтернативные инструменты требуют других подходов к расчету базовых и пороговых значений. - Определите результат диагностики с помощью указаний, приведенных в таблице 4 , если все элементы управления работали должным образом (таблица 5).
- Подтвердите все значения Ct или Cq путем просмотра графиков усиления.
- Исследуйте любые необычные результаты в соответствии с рекомендациями.
5. Удержание и хранение проб
- Храните все образцы в замороженном состоянии при температуре -16 °C или ниже до завершения тестирования и получения результатов. Сохраните исходные ткани для подтверждения результатов или идентификации животного-хозяина до вида в случае необычных результатов тестов.
- Используйте уникальные идентификаторы образцов; Пометьте все пробирки, отчеты и документы полными уникальными идентификаторами образцов.
- Сохраняйте промежуточные образцы (кратковременно) на случай, если потребуется повторное тестирование.
- Сохраняйте репрезентативные положительные образцы по мере необходимости для использования в качестве контроля, эпидемиологического типирования и других целей.
- Храните РНК при температуре ≤-70 °C для длительного хранения.
Результаты
Репрезентативные изображения успешного прогона анализа LN34 на приборе ABI ViiA7 для ПЦР в реальном времени показаны на рисунке 2. Просмотр результатов, построенных на логарифмической шкале, позволяет легко увидеть значение Ct, точку, в которой кривая пересекает пороговую линию (рис. 2A, C). При построении графика в линейном масштабе успешное усиление будет отображаться в виде сигмоидальной (или «S»-образной) кривой (рис. 2B, D), в то время как отрицательные результаты должны отображаться в виде прямой плоской линии. Для выявления возможных аномалий или ошибок рекомендуется просматривать результаты как в линейном, так и в логарифмическом масштабе. Типичные положительные и отрицательные результаты на многокомпонентном графике можно увидеть на рисунках 2E,F, соответственно, где можно наблюдать уровень флуоресценции красителя, маркирующего зонд (FAM для LN34, VIC/HEX для βA), относительно пассивного красителя в реакционном буфере (ROX).
Примеры аномальных результатов показаны на рисунке 3. Сравнение графиков успешных прогонов (рис. 2) и аномальных графиков (рис. 3) может быть использовано для выделения нетипичных прогонов и проблем с приборами. На рисунке 3A показан сигнал, пересекающий пороговое значение, что приводит к значению Ct для LN34, но кривая усиления очень нетипична и линейно увеличивается. Многокомпонентный график (рисунок 3B) также показывает волнистую линию, что не характерно для положительной пробы. Этот пример подчеркивает важность просмотра графиков усиления, а не простого копирования значений Ct. Всегда следите за тем, чтобы кривые усиления выглядели нормально для всех образцов. При просмотре многокомпонентного графика также рекомендуется убедиться в отсутствии неровностей. Иногда беспорядочные базовые сигналы могут генерировать значения Ct в тех случаях, когда усиление не произошло. Если сигналы усиления кажутся линейными, рекомендуется скорректировать базовую линию, чтобы увидеть, исчезнет ли кривая. В случае появления какого-либо необычного сигнала, весь прогон должен быть повторен. Если проблемы не устранены, рекомендуется очистить и запустить фоновую пластину на приборе для ПЦР в реальном времени. Если это возможно, продукты ПЦР могут быть запущены на агарозном геле и/или секвенированы для устранения любых необычных результатов. Не рекомендуется использовать результаты гель-электрофореза или секвенирования для определения результатов диагностики.
Предыдущие исследования показали низкую вариабельность между репликами, прогоном анализа, оператором и лабораторией для анализа LN347. Если наблюдается высокая вариабельность (разница >±1,5 Кт) между репликатами одного и того же образца, эту РНК следует повторно протестировать. Высокая вариабельность может быть вызвана проблемами с пипетками, лабораторными методами, неправильным пипетированием или машинами для ПЦР в реальном времени. Повторное наблюдение высокой вариабельности в нескольких образцах или в нескольких прогонах анализа может указывать на системные проблемы. Образцы с низким уровнем РНК, приближающиеся к порогу анализа для положительного образца (Ct 35), могут демонстрировать более высокую вариабельность значений Ct между репликациями. Может потребоваться консультация с CDC и устранение неполадок для устранения причины стойкой вариабельности, противоречивых результатов или неудачи анализа.
Высокая чувствительность анализов на основе ПЦР делает их по своей природе восприимчивыми к загрязнению. Строгое соблюдение надлежащей лабораторной практики является наилучшим способом смягчения последствий перекрестного загрязнения. Важно знать, как определить потенциальное загрязнение. Загрязнение реагентами следует подозревать, если нет контрольной матрицы, и при подозрении на отрицательные пробы в пробирном прогоне все дают одинаковые значения Ct. Повторите тестирование с новыми аликвотами ПЦР-реагентов (буфер, вода, праймеры и фермент) и той же РНК. Если все образцы и контроль экстракции показывают одинаковые значения КТ, но NTC отрицательный, следует исследовать загрязнение экстракционных реагентов и повторить экстракцию с использованием новых реагентов. Хорошей практикой является внесение небольших аликвот реагентов, чтобы снизить риск загрязнения и избежать возможности выброса больших объемов дорогостоящих реактивов. Перекрестное загрязнение проб выявить сложнее. При подозрении на загрязнение образца повторите сбор образца, начиная с исходных тканей. В некоторых случаях секвенирование вирусной РНК может подтвердить заражение, особенно когда загрязняющая РНК сильно отличается от ожидаемого вирусного варианта (например, контрольного вируса, используемого в лаборатории). Секвенирование двух образцов, обработанных одновременно, может определить, идентичны ли вирусные последовательности, но может быть неинформативным, если ожидается, что последовательности будут очень похожими (например, один и тот же вариант собран в одном и том же округе). При подозрении на загрязнение образца положительной контрольной РНК можно провести ампликоны анализа LN34 на агарозном геле, чтобы дифференцировать РНК лиссавируса (165.о.) от положительной контрольной РНК (99.о.). Последовательность матрицы, используемой для генерации положительной контрольной РНК, предоставленной CDC8.
Для других патогенов можно использовать лабораторы для установки порога вручную, чтобы избавиться от «шума», такого как слабая амплификация, показанная голубым цветом на рисунке 4. Эта практика НЕ рекомендуется для диагностики бешенства, потому что она может привести к ложноотрицательным результатам с тяжелыми последствиями, поскольку бешенство почти на 100% смертельно. НЕ изменяйте пороговое значение вручную для получения отрицательных результатов для образцов со слабой или поздней амплификацией. Эти образцы должны быть повторно извлечены и/или повторно протестированы, чтобы исключить бешенство.
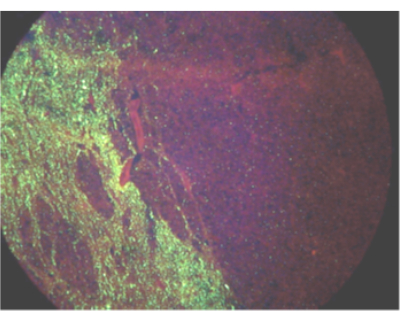
Рисунок 1: Поле зрения, показывающее одностороннее распространение антигена вируса бешенства у инфицированного осла с помощью прямого флуоресцентного теста на антитела. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
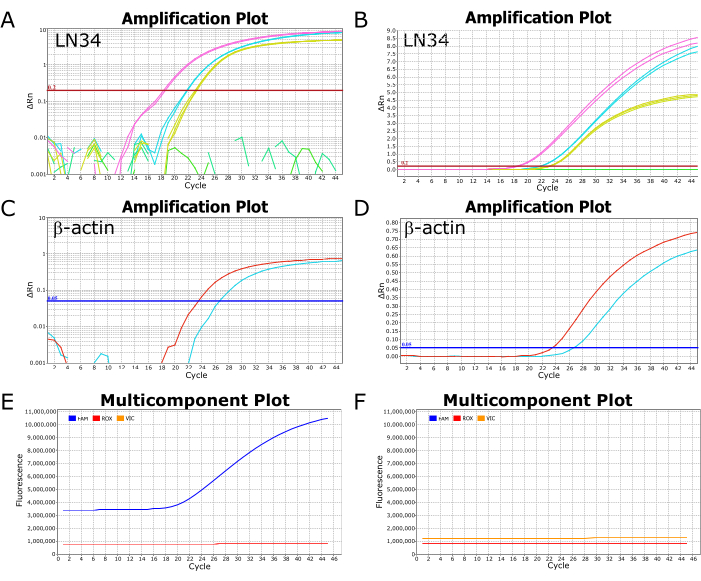
Рисунок 2: Амплификация и многокомпонентные графики из успешного прогона анализа LN34. (A-D) Данные результатов отображаются в логарифмической шкале (A,C) и линейной шкале (B,D) для анализа LN34 и βA. На панелях A и B показаны результаты LN34 из двух образцов (розовым и голубым) в сравнении с положительным контролем (желтым цветом). На панели В есть плоская зеленая линия, которая изображает дополнительный отрицательный образец в прогоне. В A зеленые линии не показывают никакого усиления и изображены в виде ломающихся сегментов. Пороговое значение для анализа LN34 было установлено вручную на 0,2 и показано красной горизонтальной линией. (К,Г) Результаты анализа βA для двух образцов (красного и голубого). Пороговое значение для анализа βA было установлено вручную на уровне 0,05. (Э,Ж) Многокомпонентные графики отображают флуоресценцию (RFU) в каждом цикле для FAM (LN34), VIC (βA) и ROX (пассивный краситель, присутствующий в буфере AgPath-ID). Уровни ROX должны оставаться плоскими на протяжении всех циклов. Типичная положительная проба показана на панели Е; Флуоресценция FAM увеличивается как сигмоидальная кривая, начиная с цикла 18 для этого образца. Типичный отрицательный образец показан на панели F, где уровень FAM остается параллельным уровню ROX на протяжении всех циклов. Данные получены с помощью прибора ABI ViiA7 для ПЦР в реальном времени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Репрезентативные изображения редкого, нетипичного сигнала, наблюдаемого при анализе LN34 на ПЦР-приборе ViiA7 в реальном времени. (А-Ж) Амплификационные (A,C,E) и многокомпонентные (B,D,F) графики, полученные из-за загрязнения скважины. Линейное увеличение (A,C) и волнистые флуктуации (B,D) флуоресценции FAM не представляют собой истинное усиление, основанное на форме кривых и величине изменения флуоресценции. Панели от A до D, вероятно, представляют собой отрицательные образцы, даже несмотря на то, что значение Ct было получено для реплики, показанной на панелях A и B. На панелях E и F показан странный волнистый сигнал, который легче увидеть на многокомпонентном графике. Этот тип сигнала должен быть исследован и может указывать на проблемы с прибором, даже если все элементы управления в этом прогоне работали должным образом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
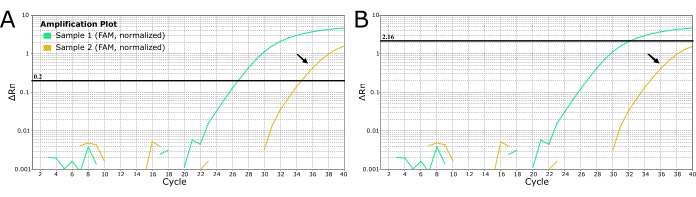
Рисунок 4: Кривые ОТ-ПЦР LN34 в реальном времени из 2 образцов с подозрением на бешенство, демонстрирующие два метода установки пороговых значений. (A) Пороговое значение LN34 было установлено на 0,2 (рекомендуется для всех запусков). (B) Ручное определение другого порога для каждого прогона для маскировки сигнала, определенного как «шум» (сигнал позднего усиления). Метод, используемый на панели В , НЕ рекомендуется при бешенстве из-за тяжелых последствий отсутствия истинного положительного результата. Поздняя амплификация может указывать на слабый положительный образец, ингибирование ПЦР или неудачное извлечение в положительном случае. Это также может указывать на перекрестное загрязнение. Золотая проба (обозначена черными стрелками) дает значение Ct в момент отсечки пробы, и ее не следует считать отрицательной. Образцы с поздней амплификацией должны быть повторно экстрагированы и повторно протестированы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Последовательности и концентрации праймеров и зондов, используемые в анализах ОТ-ПЦР в реальном времени LN34lys (одиночный LN34), LN34M (LN34 и мультиплексированный βA). Зонды LN34 маркируются флуоресцентным красителем FAM на 5-м конце и гасителем черной дыры (BHQ1) на 3-м конце. ΒA зонд помечен флуоресцентным HEX-красителем на 5'-конце и гасителем черной дыры (BHQ1) на 3'-конце. Заблокированные нуклеотидно-модифицированные основания обозначаются плюсом перед основанием в последовательности. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Настройка анализа для анализов LN34lys, Actin3 и LN34M. Названия праймеров и зондов, последовательности и концентрации можно найти в таблице 1. LN34_F1 соответствует ACGCTTAACAACCAGATCAAAGAA7. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Циклические параметры для приборов ABI. ВАЖНО: Убедитесь, что вы работаете в СТАНДАРТНОМ режиме, а не в БЫСТРОМ . В качестве пассивного эталонного красителя следует выбирать ROX. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Алгоритм интерпретации результатов ОТ-ПЦР LN34 в реальном времени для форматов синглплекс (вверху, синяя таблица) и мультиплекс (внизу, красная таблица). Положительный результат LN34 следует считать положительным, даже если результат βA отрицательный или неубедительный. Если ампликон LN34 не обнаруживается, βA Ct должен быть ≤ указанного порогового значения Ct, чтобы считаться отрицательным. Значения βA Ct указывают на качество исследуемого образца и выявляют возможное торможение. Низкая концентрация в исходном клиническом образце может влиять на кривые роста βA, что приводит к отсутствию заметной амплификации. Дополнительными факторами, способствующими неспособности обнаружить β-актин, являются плохая экстракция РНК из-за потери РНК или переноса ингибиторов ПЦР, неправильная настройка и методика анализа, неудовлетворительный тип или качество образца, а также неисправность реагентов или оборудования. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 5: Действия и интерпретация общих результатов для контроля LN34. Все три контроля (РНК положительного контроля на бешенство, контроль отрицательной экстракции на бешенство и отсутствие контрольной матрицы должны давать ожидаемые результаты для прохождения прогона. Сбой в положительном контроле или отсутствие контрольной матрицы может указывать на неправильное пипетирование, отказ реагента или оборудования. Весь прогон, включая все протестированные образцы РНК, должен быть повторен. Сбой в контроле экстракции может указывать на проблему во время экстракции, такую как отказ реагента, неправильное пипетирование или перекрестное загрязнение. Извлечение всех образцов необходимо повторить. Сбои в работе органов контроля должны быть редкими для опытного персонала лаборатории. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Для успешного прогона LN34 требуется положительный контроль, контроль экстракции, и никакие реакции шаблонного контроля не работают так, как ожидалось в каждом прогоне анализа, или прогон должен быть аннулирован и повторен. Все три реакции положительного контроля LN34 должны пресечь пороговое значение в указанном диапазоне, либо прогон должен быть повторен. Описанная в предыдущих публикациях положительная контрольная РНК 7,8 не будет амплифицироваться в βA-анализе. Реакции без контроля матрицы не должны иметь кривых амплификации, которые пересекают пороговую линию для анализа LN34 или βA. Система управления экстракцией не должна демонстрировать усиление для LN34. Если в NTC или контроле экстракции наблюдается неожиданная амплификация, это может указывать на загрязнение и привести к недействительности запуска и повторного тестирования для всех образцов (см. Таблицу 5). Пользователи могут рассмотреть возможность добавления дополнительных средств контроля, в том числе контроля без технологического процесса или без контроля экстракции, для мониторинга загрязнения экстракционных реагентов βА хозяином.
Поскольку смертность от бешенства приближается к 100%, рекомендуется дополнительно исследовать любую слабую или аномальную амплификацию, даже если она не дает значения Ct. Отрицательные реакции или реакции NTC не должны демонстрировать какой-либо амплификации, а флуоресценция должна проявляться в виде плоской линии, параллельной флуоресценции ROX в многокомпонентном изображении. Наблюдения за кривыми, особенно в нескольких повторениях, могут указывать на перекрестное загрязнение или слабый положительный результат. Все реплики для положительного образца должны быть амплифицированы для получения достоверного положительного результата. Если в каком-либо анализе амплифицируется только подмножество репликатов, образец следует повторно испытать. Кроме того, любая выборка, дающая сильно вариабельные результаты (разница значений Ct > ±1,5 между повторами), должна считаться недействительной, и образец должен быть повторно протестирован. Если проблема не устранена, образец следует извлечь повторно.
Ожидается, что положительный на бешенство образец, извлеченный из должным образом собранного и сохраненного ствола мозга и ткани мозжечка, будет иметь значение Ct менее 35 циклов для анализа LN34. Все неубедительные образцы должны быть повторно протестированы с помощью LN34 методом ОТ-ПЦР в реальном времени. Если при повторном тестировании образец не дает убедительных результатов и все контрольные работы проводятся в соответствии с ожиданиями, рекомендуется повторная экстракция РНК. Образцы с низким уровнем вирусной РНК (LN34 Ct > 35) могут указывать на потенциальные проблемы, такие как контаминация, низкая вирусная нагрузка, ингибирование ПЦР или неудачная экстракция. Соберите свежие кусочки мозга из исходной ткани, выполните экстракцию РНК и повторное тестирование образца. Аналогичным образом, значения Ct > 33 (синглплекс), 37 (LN34M) или отсутствие амплификации в анализе βA могут указывать на неудачную экстракцию РНК. Повторите экстракцию для таких образцов, затем повторите тестирование для LN34 и актина. Если после повторного тестирования образец снова дает неубедительный результат, используйте вторичный метод, такой как тест DFA (также называемый FAT), DRIT или выделение вируса. Если наблюдаются продолжающиеся противоречивые результаты или неубедительные результаты, обратитесь в референс-лабораторию по бешенству для подтверждения тестирования.
Если ингибиторы присутствуют при экстракции РНК, ПЦР-анализы могут дать ложноотрицательный результат. Если есть подозрение на ингибирование или отмечается ингибирование контрольных реакций βА (таких как значение Ct > 33 или значение Ct > 37) для конкретного образца, экстрагированную РНК следует протестировать при 2 или более разведениях (например, 1:10 и 1:100 в воде, свободной от нуклеаз) для разбавления любых потенциальных ингибиторов ПЦР. Для сложных образцов поступление РНК может быть увеличено до 8,5 мкл в реакции ОТ-ПЦР, если не добавлять воду. Это может свидетельствовать о повышенном ингибировании (более позднее значение Ct по сравнению с 2 мкл входной РНК) или низком уровне РНК в исходном образце (более раннее значение Ct при использовании 8,5 мкл по сравнению с 2 мкл входной РНК).
Анализ LN34 не делает различий между лиссавирусами и не определяет варианты вируса бешенства. Ампликон анализа LN34 может быть секвенирован для типирования вариантов вируса бешенства с низким разрешением или идентификации вида лиссавируса11.
Раскрытие информации
Нечего разглашать
Благодарности
Мы признательны за усилия и сотрудничество многих лабораторий по диагностике бешенства, которые внесли свой вклад во внедрение, валидацию и оптимизацию анализа LN34 посредством открытого обмена данными и обратной связи. Использование торговых наименований и коммерческих источников осуществляется только в целях идентификации и не подразумевает одобрения со стороны Центров по контролю и профилактике заболеваний, Министерства здравоохранения и социальных служб США или аффилированных учреждений авторов. Выводы, выводы и мнения, выраженные авторами, не обязательно отражают официальную позицию Министерства здравоохранения и социальных служб США, Центров по контролю и профилактике заболеваний или аффилированных с авторами учреждений.
Материалы
| Name | Company | Catalog Number | Comments |
| 7500 Fast | Applied Biosystems | N/A | Do not substitute without validation |
| 7500 Fast Dx | Applied Biosystems | N/A | Do not substitute without validation |
| ABI ViiA 7 | Applied Biosystems | N/A | Do not substitute without validation |
| AgPath-ID One-Step RT-PCR Kit | ThermoFisher Scientific | AM1005 | Do not substitute without validation |
| Beadbug6 | Benchmark Scientific | D1036 | |
| Direct-zol RNA MiniPrep kit | Zymo Research | R2052 | |
| MagNA Lyser green beads | Roche | 3358941001 | |
| Microcentrifuge | Eppendorf | 5425 R | |
| Optical 96-well Reaction Plates | ThermoFisher Scientific | 4346907 | |
| Optical Adhesive covers | ThermoFisher Scientific | 4311971 | Alternative: caps |
| Polyester fiber-tipped applicator swabs | BD BBL Polyester Fiber Tipped Application Swab | 220690 | |
| QuantStudio 6Flex | Applied Biosystems | 4485691 | Do not substitute without validation |
| Quaternary ammonium disinfectant (1:256) | LYSOL | WBB56939 | Do not substitute without validation |
| RNase AWAY | ThermoFisher Scientific | 7002PK | |
| RNaseZap | ThermoFisher Scientific | AM9780 | |
| Single-use scalpel, a scalpel with a safety mechanism | Integra Miltex | 4-510 | |
| Sterile polyproylene microcentrifuge tubes (1.5 mL), nuclease free | Sarstedt | 72.692.405 | |
| Sterile polyproylene microcentrifuge tubes (2 mL), nuclease free | Sarstedt | 72.694.600 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | Do not substitute without validation |
Ссылки
- Meechan, P. J., Potts, J. . Biosafety in Microbiological and Biomedical Laboratories. , (2020).
- . Terrestrial Manual 2023 Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals (2023)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/handle/10665/310836 (2018)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/bitstream/handle/10665/310837/9789241515306-eng.pdf?ua=1 (2019)
- . Protocol for postmortem diagnosis of rabies in animals by direct fluorescent antibody testing: A minimum standard for rabies diagnosis in the United States Available from: https://www.cdc.gov/rabies/pdf/RabiesDFASPv2.pdf (2003)
- World Health Organization. . WHO Expert Consultation on Rabies: Third Report. , (2018).
- Gigante, C. M., et al. Multi-site evaluation of the LN34 pan-lyssavirus real-time RT-PCR assay for postmortem rabies diagnostics. PLoS One. 13 (5), e0197074 (2018).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR assay for the detection of highly variable rabies virus and other lyssaviruses. PLoS Negl Trop Dis. 11 (1), e0005258 (2017).
- Gigante, C. M., Wicker, V., Wilkins, K., Seiders, M., Zhao, H., Patel, P., Orciari, L., Condori, R. E., Dettinger, L., Yager, P., Xia, D., Li, Y., et al. Optimization of pan-lyssavirus LN34 assay for streamlined rabies diagnostics by real-time RT-PCR. Journal Virological Methods. , (2024).
- Rao, A. K., et al. Use of a modified preexposure prophylaxis vaccination schedule to prevent human rabies: recommendations of the advisory committee on immunization practices-United States, 2022. Morbidity and Mortality Weekly Report. 71 (18), 619 (2022).
- Condori, R. E., et al. Using the LN34 Pan-Lyssavirus Real-Time RT-PCR assay for rabies diagnosis and rapid genetic typing from formalin-fixed human brain tissue. Viruses. 12 (1), 120 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены