Method Article
אבחון לאחר המוות של כלבת בבעלי חיים על ידי מבחן תגובת שרשרת פולימראז LN34 המעודכן והמרובה בזמן אמת
In This Article
Summary
פרוטוקול זה מדגים את בדיקת תגובת שרשרת פולימראז (RT-PCR) בזמן אמת של pan-lyssavirus LN34 מאיסוף רקמות ועד לפירוש התוצאה, כולל עדכונים לרצפי פריימר ותכשירים לשיפור ביצועי הבדיקה עבור כמה נגיפי ליסה ולגומורפים שאינם כלבת. אנו גם מדגימים את מערך הבדיקה עבור פורמט LN34 מרובב (LN34M) בעל באר אחת.
Abstract
כלבת היא מחלה זואונוטית קטלנית הנגרמת על ידי כלבת ליסה וירוס (RABV) ונגיפי RNA שליליים קשורים מהסוג Lyssavirus (משפחת Rhabdoviridae). בדיקת LN34 מכוונת לאזור המוביל השמור ביותר ולגן הנוקלאופרוטאין של גנום נגיף הליסה ומשתמשת בפריימרים מנוונים ובבדיקה TaqMan המכילה נוקלאוטידים נעולים כדי לזהות RNA על פני הסוג המגוון של Lyssavirus . יש לקבוע ממצא שלילי לכלבת רק אם בוחנים חתך מלא של גזע המוח ושלוש אונות של המוח הקטן; עם זאת, זיהוי RNA של נגיף הליסה בכל רקמה הוא אבחון של זיהום בכלבת. הרקמה נאספת והומוגנית במגיב TRIzol, שגם מנטרל את הנגיף. מיצוי RNA מתבצע באמצעות ערכת מיצוי מסחרית מבוססת עמוד ספין. תערובות מאסטר מוכנות בחלל נקי ומוכנסות לצלחת של 96 בארות לפני הוספת RNA לדוגמה. במסגרות קליניות, כל דגימה נבדקת על ידי RT-PCR בזמן אמת לנוכחות RNA של נגיף הליסה בשלוש עותקים ובודדים עבור מארח β--actin mRNA. בקרות חיוביות ושליליות כלולות בשלבי החילוץ וה-RT-PCR בזמן אמת של הפרוטוקול. ניתוח נתונים כולל התאמה ידנית של הספים כדי לתקנן ערכי Ct על פני ריצות מכשירים. תוצאות חיוביות נקבעות על ידי נוכחות של הגברה אופיינית בבדיקת הפאן-ליסה (Ct ≤ 35). תוצאות שליליות נקבעות על ידי היעדר הגברה אופיינית בבדיקת הפאן-ליסה וזיהוי mRNA של β-אקטין מארח (Ct ≤ 33). תצפית על ערכים מחוץ לטווחים אלה או כשל בבקרות הבדיקה עלולה לפסול את הריצה או לגרום לתוצאות לא חד משמעיות עבור דגימה. יש לעקוב מקרוב אחר הפרוטוקול כדי להבטיח רגישות וספציפיות גבוהה לבדיקה. שינויים פרוצדורליים יכולים להשפיע על ביצועי הבדיקה ולהוביל לתוצאות חיוביות כוזבות, שליליות כוזבות או בלתי ניתנות לפירוש.
Introduction
פרוטוקול זה מתאר את ההליך לבדיקת אבחון כלבת באמצעות בדיקת LN34 pan-lyssavirus בזמן אמת תגובת שרשרת פולימראז (RT-PCR) מאיסוף הדגימות ועד לפירוש התוצאות. הנוהל יחולק לשלושה חלקים: איסוף דגימות מוח כרלוונטי לבדיקת LN34 (סעיף 1), מיצוי RNA ידני מבוסס עמודות באמצעות ערכת Direct-zol RNA Miniprep (Zymo Research R2051) (סעיף 2), ובדיקת RT-PCR בזמן אמת LN34 שהוגדרה באמצעות ערכת AgPath-ID One-Step RT-PCR (ThermoFisher Scientific AM1005) (סעיף 3). ניתן לבצע מיצוי RNA ו-RT-PCR באמצעות מוצרים אחרים, אך יש לאמת ערכות לפני השימוש כדי להבטיח ש-RNA של Lyssavirus מופק ומוגבר כראוי.
סעיף 1 מתאר את איסוף רקמות המוח המתאימות לשימוש בבדיקת RT-PCR בזמן אמת LN34. תיאור של נתיחת בעלי חיים, עריפת ראשים והסרת מוח אינם כלולים. דגימות עשויות להכיל גורמים זיהומיים. יש לעקוב אחר נהלי בטיחות ביולוגית המפורטים בבטיחות ביולוגית במעבדות מיקרוביולוגיות וביו-רפואיות מהדורה6 1 כדי להפחית את הסיכון. דגימות צריכות להיחשב זיהומיות עד להשלמת ההשבתה. יש לבצע השבתה ויראלית ואימות בדיקה בכל מעבדה בהתאם לסטנדרטים של אותו מוסד. מעבדות צריכות לעקוב אחר נהלי בטיחות ואיכות סטנדרטיים שנקבעו על ידי המוסד שלהן בעת יישום בדיקת אבחון חדשה.
בהתבסס על מה שידוע על התפשטות נגיף הכלבת במהלך הזיהום, גזע המוח והמוח הקטן הם הרקמות הטובות ביותר לאבחון כלבת, ורקמות אלו מומלצות לבדיקת כלבת על ידי ארגון הבריאות העולמי והארגון העולמי לבריאות בעלי חיים 2,3,4,5. מאחר שהתפשטות הנגיף עשויה להיות חד-צדדית (איור 1), במיוחד בחיות גדולות יותר, יש לבחון חתך שלם של גזע המוח ושלוש אונות של המוח הקטן כדי לשלול כלבת. עבור דגימות שאינן עומדות בקריטריונים מינימליים אלה, המעבדה עשויה לדחות את הדגימה כלא מספקת לבדיקה או לבחור בבדיקה למטרות מעקב או כלל. אם הרקמות הנדרשות לא מתקבלות, אך המעבדה בוחרת לבדוק את הדגימה, יש לפרש תוצאת בדיקה שלילית כלא חד משמעית עבור כלבת עבור אותו בעל חיים מכיוון שנוכחות RNA ויראלית ברקמות אחרות יכולה להתעכב, שפע נמוך, לסירוגין או לא קיים. יש צורך באיסוף הדגימות הנדרשות או בדיקות נוספות כדי לשלול כלבת במקרה זה. עם זאת, זיהוי RNA של נגיף הליסה בכל רקמה הוא אבחנה של זיהום כלבת 3,6. דוגמאות לדגימות שעשויות להיבדק ל-RNA של נגיף הכלבת לצורך שליטה או מעקב (אך לא לשלול) זיהום בכלבת הן קליפת המוח, ההיפוקמפוס, חוט השדרה, דגימות מושפלות, עור, רוק וקרנית. יש לבצע הערכה איכותית של מצבה של כל דגימה עם הגעתה למעבדה. קירור יכול לשמר דגימה למשך 72 שעות לפחות, אך אין להשתמש בו לטווח ארוך. מחזורי הקפאה-הפשרה חוזרים ונשנים עלולים להפחית את רגישות הבדיקה, ויש להימנע מיותר מחמישה מחזורי הקפאה-הפשרה. אם מצב הרקמה מונע זיהוי בטוח של מבני מוח, יש לזהות את הדגימה כלא מספקת. במקרה של דגימה לא מספקת, עדיין ניתן לבצע בדיקות כדי לשלול (אך לא לשלול) כלבת. תוצאות בדיקה חיוביות מדווחות ככאלה. יש לדווח על תוצאות שליליות או לא חד משמעיות על רקמה לא מספקת כלא חד משמעיות כדי למנוע פרשנות שגויה כאבחנה שלילית.
פרוטוקול זה פותח על סמך נהלים שפורסמו 7,8,9 וכולל פריימרים מעודכנים המכוונים לאזור מוביל הגנום של נגיף הליסה ורצף קידוד נוקלאופרוטאין. הגשושית מכוונת לרצף קצר ושמור מאוד ומשתמשת בנוקלאוטידים נעולים כדי לאפשר זיהוי רחב. הבדיקה מזהה RNA מנגיפי ליסה מגוונים בריכוזים משתנים8. פרוטוקול זה מדגים את נהלי המעבדה לביצוע בדיקת PCR בזמן אמת LN34, אך זיהוי מדויק ורגיש של RNA של נגיף הליסה תלוי באלמנטים אחרים שאינם מכוסים בהרחבה בפרוטוקול זה, כגון אחסון דגימות, שמירת רשומות, הכשרה/כשירות כוח אדם, מעקב אחר תוצאות, פרשנות תוצאות, אבטחת איכות, אמצעי בטיחות מעבדה ופתרון בעיות. בדיקות מבוססות PCR מועדות לזיהום צולב בשל רגישותן הגבוהה. ניתן למנוע זיהום צולב על ידי הקפדה על נוהלי מעבדה טובים, כגון החלפת כפפות לעתים קרובות, טיפול בדגימה אחת בכל פעם, חיטוי משטחי עבודה עם חומרי טיהור יעילים בין דגימות, ושמירה על צינורות סגורים ודגימות נפרדות מריאגנטים של PCR. ניתן להפריד בקלות ריאגנטים ודגימות PCR על ידי שימוש בזרימת עבודה חד צדדית והפרדת אזורי עבודה לפני הגברה ואחרי הגברה. לדוגמה, הכינו תערובות מאסטר של PCR במיקום נפרד פיזית מהמקום שבו מטפלים בדגימות. החלף כפפות לעתים קרובות כדי למנוע זיהום של ריאגנטים PCR עם דגימות, פסולת או RNA בקרה חיובית. יש להעביר את לוחית ה-PCR או הצינורות לאחר הוספת מאסטרמיקס למיקום שני בו ניתן להוסיף דגימה ו-RNA בקרה. חשוב לציין, אין לבצע מניפולציות על מוצרי PCR באזורים שבהם מכינים דגימות או תערובות מאסטר.
אין תחליף לתרגול מעשי וניסיון בעת ביצוע בדיקות אבחון. יש להכשיר את כל העובדים החדשים, ולהעריך את כשירותם של אנשי הבדיקה לפחות פעם בשנה בהתאם לדרישות מנהל המעבדה הרלוונטי. יש לציין, לחקור ולתקן מיד כל תצפית של תוצאות חריגות או כשל בבדיקה. יש לאמת כל אצווה חדשה של ריאגנטים באמצעות דגימות עם ערכי Ct ידועים (כגון בקרה חיובית או דגימה בארכיון). כל הציוד צריך לעבור תחזוקה שוטפת, כפי שהציע היצרן, ויש לאמת את ביצועי הבדיקה לאחר כל תחזוקה או תיקון. יש לעקוב אחר רמות הטמפרטורה בציוד הרלוונטי כדי להבטיח שמקררים ומקפיאים יישארו בקריטריונים שנקבעו לטווח טמפרטורות מקובל עבור ריאגנטים המשמשים בבדיקות אבחון.
שינויים פרוצדורליים יכולים להשפיע על ביצועי הבדיקה ועלולים להוביל לתוצאות חיוביות כוזבות, שליליות כוזבות או בלתי ניתנות לפרשנות. יש לעקוב מקרוב אחר ההמלצות כדי להבטיח רגישות וספציפיות גבוהה לבדיקה. מעבדה המעוניינת לשלב שינויים בפרוטוקול זה צריכה לאמת ולאשר את השיטות ששונו בהתייעצות עם ה-CDC.
Protocol
דגימות רקמת מוח לאחר המוות התקבלו באמצעות מעקב שגרתי או פעילויות אבחון של ענף האבעבועות והכלבת (CDC; אטלנטה, ג'ורג'יה, ארה"ב).
1. איסוף רקמת מוח לאבחון כלבת לאחר המוות בבעלי חיים על ידי בדיקת RT-PCR בזמן אמת LN34 pan-lyssavirus
הערה: דגימות עשויות להכיל גורמים זיהומיים. ללבוש ציוד מגן אישי מתאים (PPE) (כפפות גומי כבדות או כפפות אחרות עמידות בפני חיתוך, חלוק מעבדה, סינר עמיד למים, מסכה כירורגית, מגפיים, שרוולי מגן ומגן פנים) ופעל לפי תקנות הבטיחות הנדרשות לשימוש, אחסון וסילוק דגימות. חיסון כלבת לפני חשיפה, בדיקות סרולוגיות קבועות וחיסוני דחף (לפי הצורך) נדרשים לכל מי שעובד עם, בודק, מייצר או מבצע פעילויות מחקר עם נגיפי ליסה, או דגימות ידועות או שעלולות להיות נגועות 2,3,4,6,10.
- סמן צינור איסוף דגימות אחד לכל דגימה עם תווית הצטרפות. מלאו כל צינור איסוף דגימות ב-1 מ"ל של ריאגנט TRIzol או מאגר הומוגניזציה אחר וחלק מחרוזי MagNA Lyser (להלן "חרוזי קרמיקה"). כדי להוסיף חרוזי קרמיקה, שפכו בזהירות מצינור החרוזים לתוך צינור איסוף הדגימות. צינורות של חרוזי קרמיקה מכילים בדרך כלל מספיק חרוזים ל-2-5 דגימות, תוך שימוש ב-20 חרוזים בקוטר 1.4 מ"מ לפחות לדגימה.
זהירות: מגיב TRIzol (להלן "מאגר הומוגניזציה") הוא כימיקל מסוכן; מגע עם חומצות או אקונומיקה משחרר גזים רעילים; להבטיח אוורור נאות; אנא עיין בגיליון נתוני הבטיחות למידע נוסף. אם משתמשים מחליפים את מגיב TRIzol או מגיב TRI במאגר הומוגניזציה אחר, יש צורך באימות נוסף. TRIzol פועל כמאגר הומוגניזציה/ליזה של דגימה, מאגר אינאקטיבציה של וירוס ליסה ומאגר יציבות RNA עבור פרוטוקול זה. השימוש במאגר הומוגניזציה חלופי ידרוש אימות של יעילות החילוץ, ההשבתה והיציבות בהשוואה מבוקרת זה לצד זה. - נקו וחטאו את משטח העבודה עם חומר חיטוי תרכובות אמוניום רבעוניות (QAC) למשך 2 דקות והניחו כרית סופגת מרופדת פלסטיק. הנח רק ריאגנטים ואספקה עבור הדגימה הראשונה בארון בטיחות ביולוגי מסוג II (BSC) עם תכונות לפליטת אדים מסוכנים מחוץ לחדר.
הערה: עיין בהנחיות היצרן למגבלות האחסון של QAC מדולל. ודא שהרפידה המרופדת בפלסטיק אינה חוסמת את זרימת האוויר של ארון הבטיחות הביולוגי. אם זרימת האוויר מופרעת, אל תשתמש ברפיד. - אסוף רקמה המייצגת חתך מלא של גזע המוח והמוח הקטן באמצעות אזמל נקי לשימוש חד פעמי.
הערה: מניפולציה של רקמות צריכה להתבצע באופן שאינו מרסס נוזלים או מייצר חלקיקים הנישאים באוויר. אין צורך בקולטי אדים או ארונות בטיחות ביולוגית, אך מומלץ להשתמש בארונות בטיחות ביולוגית מאווררים מכיוון שהם מספקים הגנה נוספת מפני ריחות, אדים, טפילים חיצוניים ושברי עצמות.
זהירות: שימוש באזמל עם חומר שעלול להיות נגוע בנגיף הליסה הוא מסוכן, ועל המשתמשים לנקוט באמצעי זהירות מתאימים. מומלץ להשתמש במלקחיים חד פעמיים.- עבור חיות קטנות (כמו עטלפים), כל גזע המוח והמוח הקטן עשויים להיאסף.
- עבור בעלי חיים גדולים יותר, אספו חתך רוחב מלא של גזע המוח והרקמה מכל אחת משלוש האונות של המוח הקטן.
- אופציונלי: אם מבצעים את בדיקת הנוגדנים הפלואורסצנטיים הישירים (DFA), אספו רשמים מוחיים בשלב זה. השתמש ברקמה שנותרה לאחר איסוף טביעות מוח עבור DFA למיצוי RNA ובדיקה על ידי בדיקת LN34.
הערה: אם TRIzol מתווסף לדגימות, לא ניתן עוד להשתמש בדגימות לשיטות זיהוי מבוססות אנטיגן או לבידוד וירוסים.
- הכן דגימות להומוגניזציה ומיצוי RNA.
הערה: היעילות של מיצוי RNA והשבתת הנגיף עלולה להיות מושפעת משימוש ביותר מדי רקמות. כמות הרקמה לא תעלה על בערך 1/10 מנפח מאגר ההומוגניזציה בו נעשה שימוש. אם נעשה שימוש ביותר רקמות, הגדל את כמות מאגר ההומוגניזציה בהתאם כדי להבטיח מיצוי RNA יעיל ומוצלח.- עבור בעלי חיים קטנים, הנח את כל הרקמות הנדרשות בצינור המכיל מאגר הומוגניזציה וחרוזים לחילוץ. אין לחרוג מ-100 מ"ג דגימה ב-1 מ"ל של מאגר הומוגניזציה; עבור דגימות גדולות יותר, הגדל את נפח מאגר ההומוגניזציה או השתמש במספר צינורות כדי לשקף דגימה ביחס של 1:10: מאגר.
- עבור בעלי חיים גדולים יותר, יש לטחון ולהומוגניזציה של הרקמה ביסודיות ולהסיר חלק מייצג לצינור מלא מראש במאגר הומוגניזציה וחרוזים. אין לחרוג מ-100 מ"ג דגימה ב-1 מ"ל של מאגר הומוגניזציה; עבור דגימות גדולות יותר, הגדל את נפח מאגר ההומוגניזציה או השתמש במספר צינורות כדי לשקף דגימה ביחס של 1:10: מאגר.
- אפשרות 1 (מקצף חרוזים): הומוגניזציה של רקמות באמצעות מקצף חרוזים, 1 מ"ל חיץ וחרוזי קרמיקה. ייתכן שיהיה צורך להשתמש במספר צינורות של 2 מ"ל או צינורות גדולים יותר.
- אפשרות 1 (מקצף חרוזים): נקה וחטא את תחנת העבודה, הציוד וצינורות הדגימה החיצוניים עם חומר חיטוי QAC (1:256). תן לזה לעמוד 2 דקות.
- אפשרות 1 (מקצף חרוזים): בתוך ה-BSC, טען רוטור צנטריפוגה עם דגימות הומוגניות. צנטריפוגה כל הדגימה ב-10,000-16,000 × גרם למשך 2 דקות במיקרו-צנטריפוגה שולחנית. פרק את רוטור הצנטריפוגה בתוך ה-BSC.
- אפשרות 1 (מקצף חרוזים): תן לזה לעמוד במשך 2 דקות.
- אפשרות 1 (מקצף חרוזים): העבר 120 מיקרוליטר של הומוגנאט לצינור מלא מראש ב-1 מ"ל של מאגר הומוגניזציה.
זהירות: הומוגניזציה עלולה לייצר אירוסולים ויש לבצע אותה ב-BSC. - אפשרות 2 (אזמל): טחנו דק את הרקמות הנדרשות באמצעות אזמל חד פעמי, מרחו בעזרת ספוגית והעבירו את הספוגית לצינור מלא מראש במאגר הומוגניזציה וחרוזים. אין לחרוג מ-100 מ"ג דגימה ב-1 מ"ל של מאגר הומוגניזציה; עבור דגימות גדולות יותר, הגדל את נפח מאגר ההומוגניזציה או השתמש במספר צינורות כדי לשקף מדגם ביחס של 1:10: מאגר.
זהירות: שימוש באזמל עם חומר שעלול להיות נגוע בנגיף הליסה הוא מסוכן, ועל המשתמשים לנקוט באמצעי זהירות מתאימים.
- אסוף את כל הטישו שנותר למיכל המקורי או למיכל חדש וריק המסומן בתווית הצטרפות. אחסן רקמה זו למקרה שתידרש בדיקה חוזרת או אפיון נוסף.
- נקה וחטא את תחנת העבודה, הציוד ומחוץ לצינורות הדגימה עם חומר חיטוי QAC 1:256. תן לזה לעמוד 2 דקות.
- חזור על שלבים 1.2-1.5 עבור כל הדוגמאות הנותרות.
- הומוגניזציה של דגימות עם מקצף חרוזים מיני למשך 60 שניות לפחות. בדוק חזותית את הצינורות. חזור על מקצף החרוזים למשך 60 שניות נוספות אם נותרו חתיכות רקמה גדולות. שלב זה הוא אופציונלי אם הרקמה הומוגנית לחלוטין בשלב 1.4.2.1 לעיל.
הערה: חשוב לוודא שהרקמה הומוגנית ביסודיות. הומוגניזציה לא מלאה תפחית את תפוקת ה-RNA. - הניחו לשבת לפחות 5 דקות בטמפרטורת החדר (RT).
- נקה וחטא את תחנת העבודה, הציוד ומחוץ לצינורות הדגימה עם חומר חיטוי QAC (1:256).
הערה: הדגימה נחשבת לא זיהומית בשלב זה וניתן להוציאה ממעבדת הכלבת. - עבד מיד דגימות במאגר הומוגניזציה למיצוי RNA, אחסן ב-RT (20 מעלות צלזיוס עד 25 מעלות צלזיוס) או בקירור (4 מעלות צלזיוס עד 8 מעלות צלזיוס) למשך מספר ימים, או אחסן ב-16 מעלות צלזיוס או קר יותר לאחסון לטווח ארוך.
2. פרוטוקול למיצוי RNA באמצעות ערכת RNA MiniPrep
- הגדר את סביבת העבודה תחת ה-BSC.
- נקה את משטח העבודה BSC באמצעות 70% אתנול לפני תחילת העבודה כדי להסיר אבק או מזהמים סביבתיים אחרים. בצע טיהור משטח נוסף עם חומר חיטוי QAC (1:256), RNase AWAY או RNaseZap (בהתאם להמלצות היצרן).
- הניחו משטח עבודה סופג מרופד פלסטיק, והניחו ריאגנטים, אספקה והדגימה ב-BSC.
הערה: ודא שהרפידה המרופדת בפלסטיק אינה חוסמת את זרימת האוויר של ה-BSC. אם זרימת האוויר מופרעת, אל תשתמש ברפיד. - הניחו את כל צינורות האיסוף במתלה נקי לצינורות מיקרוצנטריפוגה. מלא מראש צינור מיקרו-צנטריפוגה אחד של 1.5 מ"ל ב-300 מיקרוליטר של 100% אתנול עבור כל דגימת מוח שאינה עטלף. עבור דגימות עם מעט רקמה (דגימת מוח של עטלף, דגימה שאינה מוחית או דגימה פגומה), מלא מראש צינור מיקרו-צנטריפוגה אחד של 1.5 מ"ל ב-600 מיקרוליטר של 100% אתנול לכל אחד.
- הכנת מדגם
- אסוף את כל הדגימות שהוכנו בסעיף 1 במתלה צינור ב-BSC. הפשירו דגימות קפואות ממש לפני הבדיקה.
- להפשיר בקרת חילוץ.
הערה: מומלץ לבחור דגימה ללא RNA של נגיף הליסה; יש לבדוק את הדגימה בעבר עם טווח ערכי Ct צפוי עבור בדיקת בטא-אקטין. לדוגמה, תאי תרבית רקמה שנבדקו מראש או מקרה כלבת שלילי שנבדק בעבר (אדם או בעל חיים).
- צנטריפוגה כל הדגימות ב-10,000-16,000 × גרם ל-2 מ' במיקרו-צנטריפוגה שולחנית.
- העבירו את הסופרנטנט לתוך צינור מיקרו-צנטריפוגה סטרילי חדש המכיל 100% אתנול. ודא שהסופרנטנט צלול, ללא שומנים ברורים או רקמה מוצקה. הימנע מאיסוף שומנים ורקמות מוצקות.
- לרקמת מוח שאינה עטלף: העבירו 300 מיקרוליטר של סופרנטנט.
- עבור דגימות עם מעט רקמה (דגימת מוח של עטלף, דגימה שאינה מוחית או דגימה פגומה), העבירו 600 מיקרוליטר של סופרנטנט.
- אחסן את ההומוגנאט הנותר בצינור מיקרוצנטריפוגה מוברג בטמפרטורה של ≤-16 מעלות צלזיוס.
- פיפטה למעלה ולמטה 10 פעמים לערבוב.
- עבור כל דגימה, העבירו 600 מיקרוליטר מתערובת האתנול-סופרנטנט לעמודת ספין בצינור איסוף.
- צנטריפוגה עד שהנוזל עבר דרך העמודה (דקה אחת בטמפרטורה של 10,000-16,000 × גרם). השליכו את הזרימה.
- חזור על הפעולה אם יש יותר מ-600 מיקרוליטר של תערובת חיץ אתנול-הומוגניזציה עבור דגימה.
- מעבירים כל עמודה לצינור איסוף חדש.
- הוסף 400 מיקרוליטר של מאגר שטיפה מוקדמת של RNA לכל עמודה וצנטריפוגה ב-10,000-16,000 × גרם למשך 30 שניות.
- השלך את הזרימה והחזר כל עמודה לאותו צינור איסוף.
- חזור על שלבים 2.10-2.11.
- הוסף 700 מיקרוליטר של מאגר שטיפת RNA לכל עמודה וצנטריפוגה ב-10,000-16,000 × גרם למשך 2 דקות. ודא שמאגר הכביסה עבר דרך כל עמודה לחלוטין.
- העבירו כל עמודה בזהירות לתוך שפופרת נטולת RNase.
- השלך את הזרימה ואת צינור האיסוף מ-2.13.
- הוסף 50 מיקרוליטר של מים נטולי DNase/RNase ישירות למטריצת העמודה כדי לסלק RNA.
הערה: אל תיגע במטריצת העמודות עם קצה הפיפטה. - דגירה במשך 30 שניות ב- RT, ואז צנטריפוגה ב 10,000-16,000 × גרם למשך דקה.
- העבר בזהירות RNA לחיבור תחתון שטוח חדש עם בורג שכותרתו צינור מיקרוצנטריפוגה. העבר את ה-RNA המופק לקרח לבדיקה מיידית. יש לאחסן לטווח ארוך בטמפרטורה של -70 מעלות צלזיוס או קר יותר.
הערה: אחסון בטמפרטורות חמות יותר או הפשרה חוזרת ונשנית של הקפאה עלול להוביל לפירוק RNA ולהשפיע על תוצאות האבחון.
3. פרוטוקול לבדיקת RT-PCR בזמן אמת של LN34 pan-lyssavirus
- הכן ריאגנטים.
- בקרה חיובית מלאכותית
- אם RNA בקרה חיובי מלאכותי מיוצר על ידי CDC8, עקוב אחר ההוראות שעל האריזה לאחסון, בנייה מחדש וציטוטים. דלג על שלב זה אם כבר קיימים כמויות חד-פעמיות של RNA בקרה חיובית.
הערה: יש לטפל ב-RNA בקרה חיובית בריכוזי עבודה באזור הוספת התבנית ולא באותו אזור כמו הכנת מאסטרמיקס. RNA בקרה חיובית אמור לייצר ערך סף מחזור (Ct) בטווח הצפוי שנקבע עבור מנה נתונה. בין ריצות, ערך ה-LN34 Ct עבור ה-RNA הבקרה החיובי לא אמור להיות שונה ביותר מ-±1.5 ערכי Ct. - הפשירו מנה חד פעמית מאחסון של ≤ -70 מעלות צלזיוס ממש לפני השימוש על קרח או גוש קרח. אין להקפיא ולהפשיר, ולהשליך את המזון השמור לזמן ממושך בטמפרטורות קירור.
הערה: יש להפעיל בקרה חיובית בשלוש פעמים בבדיקת LN34; הבקרה החיוביתהמלאכותית 8 לא תוגבר במבחן הבטא-אקטין.
- אם RNA בקרה חיובי מלאכותי מיוצר על ידי CDC8, עקוב אחר ההוראות שעל האריזה לאחסון, בנייה מחדש וציטוטים. דלג על שלב זה אם כבר קיימים כמויות חד-פעמיות של RNA בקרה חיובית.
- בקרת מיצוי ודגימות: הנח דגימות טריות שחולצו על קרח (או גוש קרח) או הפשיר דגימות מאחסון של ≤-70 מעלות צלזיוס על קרח (או גוש קרח) מיד לפני השימוש.
הערה: יש להפשיר ולעבד RNA באזור המיועד להוספת דגימה או תבנית הנפרד מאזורים המשמשים להכנת מאסטרמיקס או מניפולציה של מוצרי PCR או כמויות גדולות של חומר ויראלי (למשל, יצירת בקרה חיובית, התפשטות ויראלית)
- בקרה חיובית מלאכותית
- הכן ריאגנטים של מאסטרמיקס באזור הכנת המאסטרמיקס.
- הכנת Mastermix של בדיקת סינגלפלקס LN34 RT-PCR
הערה: משתמשים יכולים לבדוק דוגמאות בפורמט יחיד (שלב 3.2.1) או מולטיפלקס (שלב 3.2.2). אין צורך לבצע גם את 3.2.1 וגם את 3.3.2. יש להפשיר ולתפעל את הכנת מאסטרמיקס, פריימר ובדיקה, וללא ריאגנטים לבקרת תבניות באזור נקי בנפרד מעיבוד דגימות, נקרופסיה, PCR ואזורים אחרים שבהם חומרים נגיפיים עוברים מניפולציה. ניתן להשיג זאת באמצעות חדרים נפרדים או מערכת ארונות עם זרימת דגימה חד צדדית.- צור תערובות פריימר ובדיקה בריכוזי עבודה כפי שמצוין בטבלה 1 ובטבלה 2. דלג על שלב זה אם דילול העבודה של פריימרים ובדיקות כבר בהישג יד.
- Aliquot פריימרים ובדיקות למלאי אחסון של 1.5 מ"ל ומלאי עבודה של 50 מיקרוליטר ומאחסנים בטמפרטורה של ≤-16 מעלות צלזיוס בחושך. דלג על שלב זה אם דילול העבודה של פריימרים ובדיקות כבר בהישג יד.
הערה: מומלץ לבצע את שלב 3.2.1.2. - הפשירו מאגר RT-PCR שלב אחד, ללא בקרת תבנית, פריימרים ובדיקות מאחסון של ≤ -16 מעלות צלזיוס על קרח או גוש קרח באזור הכנת המאסטרמיקס.
הערה: השתמש בריאגנטים עד לתאריך התפוגה או לכשל בביצועים, המוקדם מביניהם. - בקצרה מערבולת וצנטריפוגה את כל המאגרים, הפריימרים והבדיקות לפני השימוש.
- יש לאחסן אנזים RT-PCR שלב אחד על קרח או בגוש קרח עד לשימוש.
- דגימות RNA
הערה: השתמש ב-RNA טרי שחולץ במידת האפשר, מכיוון שהפשרה בהקפאה עלולה להשפיע על הביצועים - אחסן דגימות RNA על קרח או גוש קרח עד לשימוש.
- הפשירו כל דגימות RNA קפואות על קרח או גוש קרח.
- סמן צינור מיקרו-צנטריפוגה אחד לכל בדיקה (LN34 ו-βA).
- קבע את מספר התגובות (N) שיש להגדיר לכל בדיקה.
- חשב את מספר התגובות עבור בדיקת LN34 על ידי הכפלת מספר הדגימות ב-3 והוספת 6 עבור בארות תגובה בקרה בתוספת 10% תגובות נוספות כדי להסביר את הנפח שאבד במהלך הפיפטינג. (לדוגמה, עבור 10 דגימות: (10 x 3) + 6 = 36 תגובות; עודף תגובות: (36 x 0.1) + 36 = 3.6 + 36 = 39.6 סה"כ תגובות, או 40 תגובות מעוגלות כלפי מעלה)
הערה: לבדיקה קלינית, מומלץ לבדוק את כל הדגימות בשלוש עותקים עבור LN34. למטרות מעקב, כל דגימה עשויה להיבדק בכפולות. מומלץ להשתמש בטריפליקט במהלך קליטת הבדיקה הראשונית כדי להבטיח שונות נמוכה בין שכפולים לטכניקה טובה. - חשב את מספר התגובות עבור בדיקת βA על ידי הוספת מספר הדגימות בתוספת 4 בארות תגובה בקרה בתוספת 10% תגובות נוספות כדי לקחת בחשבון את הנפח שאבד במהלך הפיפטינג.
- קבע את הנפח של כל מגיב עבור תערובות המאסטר LN34 ו-βA באמצעות טבלה 2.
- ייעד בארות עבור כל דגימה שתיבדק בשלוש פעמים בבדיקת LN34 וסינגליקציה עבור בדיקת βA באמצעות מפת לוח של 96 בארות.
- הוצא 23 מיקרוליטר של תערובת מאסטר של בדיקת LN34 לכל LN34 שהוקצה היטב לאחר מערבולת קצרה וסיבוב מטה במשך 30 שניות באמצעות מיקרוצנטריפוגה שולחנית לאיסוף נוזלים בתחתית הצינור. הימנע מהכנסת בועות.
- הוצא ריאגנטים 23 מיקרוליטר של תערובת מאסטר של בדיקת βA לכל תווית βA שהוקצתה היטב לאחר מערבולת קצרה וסיבוב מטה במשך 30 שניות במיקרו-צנטריפוגה שולחנית כדי לאסוף נוזלים בתחתית.
- הגדר את תגובות ללא בקרת תבנית (NTC) על ידי הזרמת 2 מיקרוליטר של מים בדרגת PCR לכל באר NTC.
- מכסים בארות ומעבירים את הצלחת לאזור הוספת תבנית.
- מערבולת וצנטריפוגה קצרה את הצינורות המכילים את דגימות ה-RNA.
- פיפטה 2 מיקרוליטר של RNA שחולץ מהדגימה הראשונה לכל באר שסומנה עבור אותה דגימה. הימנע מהכנסת בועות.
- ודא שה-RNA נמשך לתוך הפיפטה על ידי הדמיה.
- פיפטה בצד הבאר כדי להבטיח שהדגימה מתווספת לבאר הנכונה.
- הימנע ככל האפשר מנופף בקצות פיפטות המכילות RNA מעל בארות פתוחות.
- חזור על שלב 3.2.10 עבור הדגימות הנותרות ו-RNA הבקרה החיובי.
- הנח את מכסה הדבק האופטי מעל הבארות לאחר הוספת כל הדגימות והבקרות. הקפידו לכסות את כל הבארות ולאטום לחלוטין.
- צנטריפוגה במשקל 500 × גרם למשך דקה ב- RT בצנטריפוגה שולחנית או השתמש בספינר צלחת מסוג ספינר סלט.
- הנח את הצלחת האטומה במכשיר PCR בזמן אמת המכויל לצבעי דיווח FAM ו-VIC/HEX והגדר אותה לפרמטרי הרכיבה המוצגים בטבלה 3.
- הכן תערובות מאסטר לבדיקת LN34 Multiplexed (LN34M).
- סמן צינור מיקרוצנטריפוגה אחד LN34M לפי טבלה 2.
- קבע את מספר התגובות (N) שיש להגדיר לכל בדיקה.
- חשב את מספר התגובות עבור בדיקת LN34M על ידי הכפלת מספר הדגימות ב-3 והוסף 6 עבור בארות תגובה בקרה בתוספת 10% תגובות נוספות כדי לקחת בחשבון את הנפח שאבד במהלך הפיפטה. (למשל, עבור 10 דגימות: (10 x 3) + 6 = 36 תגובות; תגובות עודפות: (36 x 0.1) + 36 = 3.6 + 36 = 39.6 סה"כ תגובות, או 40 תגובות מעוגלות כלפי מעלה)
- בחר בתבנית של 25 μL או 12.5 μL. קבע את הנפח של כל מגיב עבור ה-LN34M mastermix באמצעות טבלה 2.
- ייעד בארות לכל דגימה שתיבדק בשלוש פעמים בבדיקת LN34M באמצעות מפת לוח 96 בארות.
- הוצאת ריאגנטים לבדיקת LN34M לבארות. מערבולת קצרה וסובב צינורות כדי לאסוף נוזלים בתחתית לפני הוצאת 23 מיקרוליטר (עבור תגובה של 25 מיקרוליטר) או 10.5 מיקרוליטר (עבור תגובה של 12.5 מיקרוליטר) של תערובת מאסטר לכל באר שהוקצתה. הימנע מהכנסת בועות.
- הגדר את תגובות ה-NTC על ידי פיפטינג של 2 מיקרוליטר של מים בדרגת PCR לכל באר NTC.
- מכסים בארות ומעבירים את הצלחת לאזור הוספת תבנית.
- מערבולת קצרה וסובב צינורות את הצינורות המכילים את דגימות ה-RNA כדי לאסוף נוזל בתחתית.
- פיפטה 2 מיקרוליטר של RNA שחולץ מהדגימה הראשונה לכל באר שסומנה עבור אותה דגימה. הימנע מהכנסת בועות.
- ודא ש-RNA נמשך לתוך הדמיית הפיפטה.
- פיפטה בצד הבאר כדי להבטיח שהדגימה מתווספת לבאר הנכונה.
- הימנע ככל האפשר מנופף בקצות פיפטות המכילות RNA מעל בארות פתוחות.
- חזור על שלב 3.3.8 עבור הדגימות הנותרות ו-RNA הבקרה החיובי.
- לאחר הוספת הדגימה/הבקרה האחרונה, הנח את מכסה הדבק האופטי מעל הבארות, וודא שכל הבארות מכוסות ואטומות לחלוטין.
- צנטריפוגה במשקל 500 × גרם למשך דקה ב- RT בצנטריפוגה שולחנית או השתמש בספינר צלחת מסוג ספינר סלט.
- הנח את הצלחת האטומה במכשיר PCR בזמן אמת המכויל לצבעי דיווח FAM ו-VIC/HEX והגדר אותה לפרמטרי הרכיבה, כפי שמוצג בטבלה 3. הגדר את צבע הייחוס הפסיבי ל-ROX והפעל במצב רגיל (אל תפעל במצב מהיר)
הערה: הגדרה זו ספציפית למכשירים המוזכרים בפרוטוקול זה ומחייבת שימוש במגיב RT-PCR חד-שלבי המכיל ROX כצבע פסיבי. מכשירים חלופיים דורשים גישות שונות כדי לקבוע הגדרות ריצה אופטימליות. הקפידו על תחזוקה תקינה של המכשיר לפי היצרן לקבלת הביצועים הטובים ביותר.
- הכנת Mastermix של בדיקת סינגלפלקס LN34 RT-PCR
4. פרשנות תוצאות
- הגדר חישובי סף בסיסיים וידניים אוטומטיים באמצעות ערך של 0.2 עבור LN34/FAM ו-0.05 עבור βA/HEX/VIC.
הערה: הגדרה זו ספציפית למכשירים המוזכרים בפרוטוקול זה ומחייבת שימוש במגיב RT-PCR חד-שלבי המכיל ROX כצבע פסיבי. מכשירים חלופיים דורשים גישות שונות לחישוב ערכי בסיס וסף. - קבע את תוצאת האבחון באמצעות ההנחיות בטבלה 4 אם כל הפקדים בוצעו כצפוי (טבלה 5).
- אשר את כל ערכי Ct או Cq על-ידי הצגת תרשימי הגברה.
- בדוק כל תוצאה חריגה כפי שהומלץ.
5. שמירה ואחסון של דוגמאות
- אחסן את כל הדגימות קפואות בטמפרטורה של -16 מעלות צלזיוס ומטה עד להשלמת הבדיקה ודיווח התוצאות. שמור את הרקמות המקוריות כדי לאשר תוצאות או לזהות את בעל החיים המארח למינים במקרה של תוצאות בדיקה חריגות.
- השתמש במזהי דגימה ייחודיים; סמן את כל השפופרות, הדוחות והניירת עם מזהי מדגם ייחודיים מלאים.
- שמור דגימות ביניים (לטווח קצר) למקרה שתידרש בדיקה חוזרת.
- שמור דגימות חיוביות מייצגות לפי הצורך לשימוש כבקרות, הקלדה אפידמיולוגית ומטרות אחרות.
- אחסן RNA בטמפרטורה של ≤-70 מעלות צלזיוס לאחסון לטווח ארוך.
תוצאות
תמונות מייצגות מבדיקת LN34 מוצלחת על מכשיר PCR בזמן אמת ABI ViiA7 מוצגות באיור 2. צפייה בתוצאות המשורטטות בקנה מידה לוגריתמי מאפשרת צפייה קלה בערך Ct, הנקודה שבה העקומה חוצה את קו הסף (איור 2A,C). כאשר משורטטים בקנה מידה ליניארי, הגברה מוצלחת תופיע כעקומה סיגמואידית (או בצורת "S") (איור 2B,D), בעוד שתוצאות שליליות צריכות להופיע כקו ישר ושטוח. מומלץ להציג תוצאות הן בתצוגות ליניאריות והן בתצוגות בקנה מידה של יומן כדי לזהות חריגות או שגיאות אפשריות. ניתן לראות תוצאות חיוביות ושליליות אופייניות בתצוגת העלילה הרב-רכיבית באיור 2E,F, בהתאמה, שם ניתן לראות את רמת הקרינה של הצבע המסמן את הגשושית (FAM עבור LN34, VIC/HEX עבור βA) ביחס לצבע הפסיבי במאגר התגובה (ROX).
דוגמאות לתוצאות חריגות מוצגות באיור 3. ניתן להשתמש בהשוואות בין גרפים של ריצות מוצלחות (איור 2) וגרפים חריגים (איור 3) כדי לבודד ריצות לא טיפוסיות ובעיות מכשירים. איור 3A מציג אות החוצה את הסף, ומייצר ערך Ct עבור LN34, אך עקומת ההגברה מאוד לא טיפוסית, וגדלה באופן ליניארי. התרשים הרב-רכיבי (איור 3B) מראה גם קו גלי שאינו אופייני לדגימה חיובית. דוגמה זו מדגישה את החשיבות של צפייה בעלילות ההגברה ולא רק העתקת ערכי Ct. ודא תמיד שעקומות ההגברה נראות תקינות עבור כל הדגימות. מומלץ גם לצפות בחלקה מרובת הרכיבים כדי לוודא שאין אי סדרים. לעיתים, אותות בסיס מבולגנים יכולים ליצור ערכי Ct במקרים בהם לא התרחשה הגברה. אם אותות ההגברה נראים ליניאריים, מוצע להתאים את קו הבסיס כדי לראות אם העקומה נעלמת. במקרה של אות יוצא דופן כלשהו, יש לחזור על כל הריצה כולה. מומלץ לנקות ולהפעיל לוחית רקע במכשיר ה-PCR בזמן אמת אם הבעיות נמשכות. אם זמין, ניתן להריץ מוצרי PCR על ג'ל אגרוז ו/או לרצף כדי לפתור בעיות חריגות. לא מומלץ להשתמש בתוצאות של אלקטרופורזה או ריצוף ג'ל כדי לקבוע תוצאות אבחון.
מחקרים קודמים הראו שונות נמוכה בין שכפולים, הפעלת בדיקה, מפעיל ומעבדה עבור בדיקת LN347. אם נצפתה שונות גבוהה (>±הפרש של 1.5 Ct) בין שכפולים של אותה דגימה, יש לבדוק מחדש את ה-RNA. שונות גבוהה יכולה להיגרם מבעיות עם פיפטות, שיטות מעבדה, פיפטינג שגוי או מכונות PCR בזמן אמת. תצפית חוזרת ונשנית על שונות גבוהה על פני מספר דגימות או על פני ריצות בדיקה עשויה להצביע על בעיות מערכתיות. דגימות עם RNA נמוך, המתקרבות לסף הבדיקה עבור דגימה חיובית (Ct 35), עשויות להפגין שונות גבוהה יותר בערכי Ct בין שכפולים. ייתכן שיהיה צורך בהתייעצות עם ה-CDC ופתרון בעיות כדי לטפל בגורם לשונות המתמשכת, לתוצאות לא עקביות או לכשל בבדיקה.
הרגישות הגבוהה של בדיקות מבוססות PCR הופכת אותן מטבען לרגישות לזיהום. הקפדה על שיטות מעבדה טובות היא הדרך הטובה ביותר להפחית זיהום צולב. חשוב לדעת כיצד לזהות זיהום פוטנציאלי. יש לחשוד בזיהום מגיב אם אין בקרת תבנית וחשוד שבארות דגימה שליליות בהפעלת בדיקה מייצרות ערכי Ct דומים. חזור על הבדיקה עם כמויות חדשות של ריאגנטים PCR (בופר, מים, פריימרים ואנזים) ואותו RNA. אם כל הדגימות ובקרת המיצוי מייצרות ערכי CT דומים אך NTC שלילי, יש לחקור זיהום של ריאגנטים למיצוי ולחזור על המיצוי באמצעות ריאגנטים חדשים. מומלץ להכין כמויות קטנות של ריאגנטים על מנת להפחית את הסיכון לזיהום ולמנוע את האפשרות להשליך כמויות גדולות של ריאגנטים יקרים. זיהום צולב של דגימה קשה יותר לזיהוי. אם יש חשד לזיהום דגימה, חזור על איסוף הדגימה החל מהרקמות המקוריות. במקרים מסוימים, ריצוף של ה-RNA הנגיפי יכול לאשר זיהום, במיוחד כאשר ה-RNA המזהם שונה מאוד מהוריאנט הנגיפי הצפוי (כגון וירוס ביקורת המשמש במעבדה). ריצוף של שתי דגימות שעובדו בו זמנית יכול לקבוע אם הרצפים הוויראליים זהים אך עשוי להיות לא אינפורמטיבי אם הרצפים צפויים להיות דומים מאוד (לדוגמה, אותו וריאנט שנאסף באותו מחוז). אם יש חשד לזיהום דגימה ב-RNA בקרה חיובית, ניתן להפעיל את אמפליקוני בדיקת LN34 על ג'ל אגרוז כדי להבדיל בין RNA של וירוס ליסה (165 bp) לבין RNA בקרה חיובית (99 bp). רצף התבנית המשמש ליצירת ה-RNA הבקרה החיובי המסופק על ידי CDC8.
עבור פתוגנים אחרים, ניתן להשתמש במעבדות כדי להגדיר את הסף באופן ידני כדי להיפטר מ"רעש" כמו ההגברה החלשה המוצגת בציאן באיור 4. נוהג זה אינו מומלץ לאבחון כלבת מכיוון שהוא עלול להוביל לתוצאות שליליות כוזבות עם השלכות קשות מכיוון שכלבת היא כמעט 100% קטלנית. אל תשנה ידנית את הסף כדי להפיק תוצאות שליליות עבור חלשות או מאוחרות ampדגימות ampדגימה. יש לחלץ דגימות אלו מחדש ו/או להיבדק מחדש כדי לשלול כלבת.
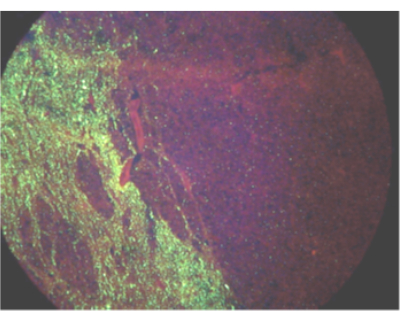
איור 1: שדה ראייה המראה התפשטות חד צדדית של אנטיגן נגיף הכלבת בחמור נגוע על ידי בדיקת נוגדנים פלואורסצנטית ישירה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
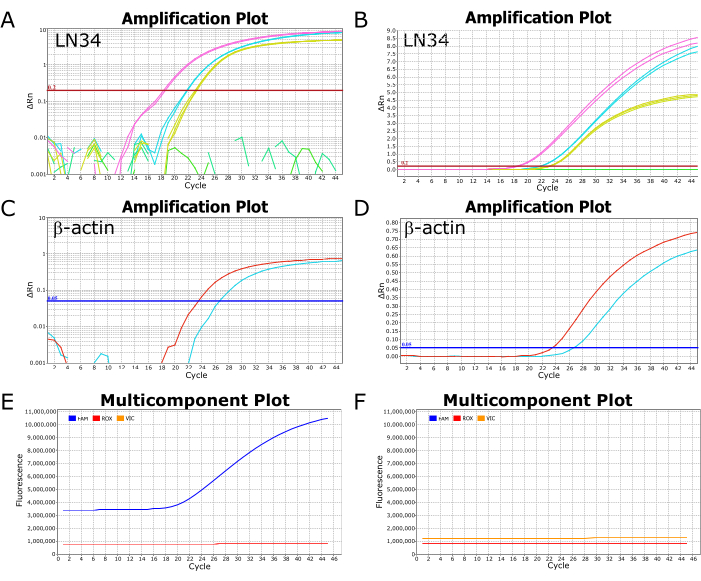
איור 2: הגברה ותרשימים מרובי רכיבים מריצת בדיקת LN34 מוצלחת. (A-D) נתוני התוצאה משורטטים בסולם לוג (A,C) ובסולם ליניארי (B,D) עבור מבחן LN34 ו-βA. לוחות A ו-B מתארים תוצאות LN34 משתי דגימות (בוורוד ובציאן) בהשוואה לבקרה החיובית (בצהוב). בפאנל B, יש קו ירוק שטוח המתאר דגימה שלילית נוספת בריצה. ב-A, הקווים הירוקים אינם מראים הגברה כלשהי ומתוארים כמקטעים שבורים. הסף לבדיקת LN34 הוגדר ידנית ל-0.2 ומוצג על ידי הקו האופקי האדום. (ג,ד) תוצאות מבדיקת βA עבור שתי דגימות (אדום וציאן). הסף לבדיקת βA נקבע ידנית על 0.05. (ה,ו) עלילות מרובות רכיבים מתארות את הקרינה (RFU) בכל מחזור עבור FAM (LN34), VIC (βA) ו-ROX (צבע פסיבי הקיים במאגר AgPath-ID). רמות ה-ROX צריכות להישאר שטוחות לאורך כל המחזורים. דגימה חיובית טיפוסית מוצגת בפאנל E; הקרינה של FAM עולה כעקומה סיגמואידית החל ממחזור 18 עבור דגימה זו. דגימה שלילית טיפוסית מוצגת בפאנל F, שבו רמת ה-FAM נשארת מקבילה לרמת ה-ROX בכל המחזורים. הנתונים הם ממכשיר PCR בזמן אמת ABI ViiA7. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: תמונות מייצגות של האות הנדיר והלא טיפוסי שנצפה בבדיקת LN34 פועל על מכשיר PCR זמן-אמת ViiA7. (א-ו) חלקות הגברה (A,C,E) ומרובות רכיבים (B,D,F) המיוצרות עקב זיהום באר. העלייה הליניארית (A,C) והתנודות הגליות (B,D) בקרינה FAM אינן מייצגות הגברה אמיתית המבוססת על צורת העקומות וגודל שינוי הקרינה. לוחות A עד D מייצגים ככל הנראה דגימות שליליות למרות שערך Ct הופק עבור השכפול המוצג בלוחות A ו-B. לוחות E ו-F מציגים אות גלי מוזר שניתן לראות ביתר קלות בתרשים מרובה הרכיבים. יש לחקור סוג זה של אות ועשוי להצביע על בעיות במכשירים, למרות שכל הפקדים בוצעו כצפוי בריצה זו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
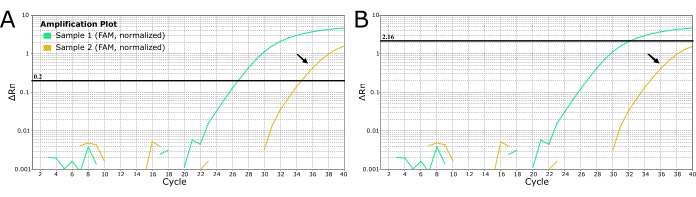
איור 4: עקומות RT-PCR בזמן אמת של LN34 מ-2 דגימות חשודות בכלבת המציגות שתי שיטות לקביעת ערכי סף. (A) סף LN34 נקבע ל-0.2 (מומלץ לכל הריצות). (ב) קביעה ידנית של סף שונה עבור כל ריצה כדי להסוות אות שנקבע כ"רעש" (אות הגברה מאוחר). השיטה המשמשת בפאנל B אינה מומלצת לכלבת בשל ההשלכות החמורות של החמצת תוצאה חיובית אמיתית. הגברה מאוחרת יכולה להצביע על דגימה חיובית חלשה, עיכוב PCR או מיצוי כושל במקרה חיובי. זה יכול גם להצביע על זיהום צולב. דגימת הזהב (המסומנת על ידי חיצים שחורים) מייצרת ערך Ct בחתך הבדיקה ואין להתייחס אליה כשלילית. יש לחלץ מחדש דגימות עם הגברה מאוחרת ולבדוק אותן מחדש. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה 1: רצפים וריכוזים של פריימר ובדיקה המשמשים במבחני RT-PCR בזמן אמת LN34lys (סינגלפלקס LN34), LN34M (LN34 ו-βA מרובבים). בדיקות LN34 מסומנות בצבע FAM פלואורסצנטי בקצה 5 ומרווה חור שחור (BHQ1) בקצה 3'. בדיקת βA מסומנת בצבע ה-HEX הפלואורסצנטי בקצה ה-5 ומרווה החור השחור (BHQ1) בקצה ה-3'. בסיסים נעולים שעברו שינוי נוקלאוטיד מסומנים על ידי פלוס לפני הבסיס ברצף. אנא לחץ כאן להורדת טבלה זו.
טבלה 2: מבחן שהוגדר עבור מבחני LN34lys, Actin3 ו-LN34M. ניתן למצוא שמות פריימר ובדיקה, רצפים וריכוזים בטבלה 1. LN34_F1 תואם ל- ACGCTTAACAACCAGATCAAAGAA7. אנא לחץ כאן להורדת טבלה זו.
טבלה 3: פרמטרי רכיבה על אופניים עבור מכשירי ABI. חשוב: הקפד לפעול במצב רגיל , לא במצב FAST . יש לבחור ROX כצבע הייחוס הפסיבי. אנא לחץ כאן להורדת טבלה זו.
טבלה 4: אלגוריתם לפירוש תוצאות RT-PCR בזמן אמת של LN34 עבור פורמטים של סינגלפלקס (עליון, טבלה כחולה) ומולטיפלקס (למטה, טבלה אדומה). תוצאת LN34 חיובית צריכה להיחשב חיובית, גם אם תוצאת βA שלילית או לא חד משמעית. אם LN34 amplicon אינו מזוהה, יש ≤ את βA Ct מחיתוך ערך ה-Ct הרשום כדי להיחשב שלילי. ערכי βA Ct מציינים את איכות הדגימה הנבדקת ומזהים עיכוב אפשרי. ריכוז נמוך בדגימה הקלינית המקורית עשוי להשפיע על עקומות הצמיחה של βA, מה שלא מוביל להגברה ניכרת. גורמים תורמים נוספים לכישלון באיתור β-אקטין כוללים מיצוי לקוי של RNA עקב אובדן RNA או העברת מעכבי PCR, הגדרה וטכניקה שגויים של בדיקה, סוג דגימה או איכות לא משביעי רצון ותקלה של ריאגנטים או ציוד. אנא לחץ כאן להורדת טבלה זו.
טבלה 5: פעולות ופרשנויות של תוצאות נפוצות עבור בקרות בדיקת LN34. כל שלושת הבקרות (RNA בקרה חיובית לכלבת, בקרת מיצוי שלילית לכלבת ואף בקרת תבנית לא חייבת לייצר תוצאות צפויות כדי שריצת ריצה תעבור. כשל בבקרה החיובית או היעדר בקרת תבנית עשויים להצביע על כשל שגוי, מגיב או כשל בציוד. יש לחזור על כל הריצה, כולל כל דגימות ה-RNA שנבדקו. כשל בבקרת החילוץ עשוי להצביע על בעיה במהלך החילוץ, כגון כשל במגיב , שגיאה או זיהום צולב. יש לחזור על מיצוי כל הדגימות. כשל בבקרות אמור להיות נדיר עבור אנשי מעבדה מנוסים. אנא לחץ כאן להורדת טבלה זו.
Discussion
ריצת בדיקת LN34 מוצלחת דורשת בקרה חיובית, בקרת חילוץ, ואין תגובות בקרת תבנית מבוצעות כצפוי בכל ריצת בדיקה או שיש לבטל את הריצה ולחזור עליה. כל שלוש תגובות שכפול הבקרה החיוביות של LN34 צריכות לחצות את הסף בטווח שצוין, או לחזור על הריצה. ה-RNA הבקרה החיובי שתואר בפרסומים קודמים 7,8 לא יגבר בבדיקת βA. תגובות הבקרה ללא תבנית לא אמורות להציג עקומות הגברה החוצות את קו הסף עבור מבחן LN34 או βA. בקרת החילוץ לא אמורה להפגין ampעבור LN34. אם נצפתה הגברה בלתי צפויה בבקרת ה-NTC או החילוץ, היא עלולה להצביע על זיהום ולבטל את תוקף הריצה והבדיקה החוזרת עבור כל הדגימות (ראה טבלה 5). משתמשים עשויים לשקול להוסיף בקרות נוספות, כולל בקרת אי-תהליך או בקרת מיצוי ללא דגימה, כדי לנטר זיהום βA מארח של ריאגנטים למיצוי.
ככל שמקרי המוות מכלבת מתקרבים ל-100%, מומלץ לחקור עוד יותר כל הגברה חלשה או חריגה, גם אם היא אינה מייצרת ערך Ct. תגובות שליליות או NTC לא אמורות להראות שום הגברה, והפלואורסצנציה צריכה להופיע כקו שטוח במקביל לפלואורסצנציה של ROX בתצוגה מרובת רכיבים. תצפיות על עקומות, במיוחד במספר שכפולים, עשויות להצביע על זיהום צולב או תוצאה חיובית חלשה. יש להגביר את כל השכפולים עבור דגימה חיובית לקבלת תוצאה חיובית תקפה. אם רק תת-קבוצה של שכפולים מתגברת בכל אחת מהבדיקות, יש לבדוק מחדש את הדגימה. יתר על כן, כל דגימה המניבה תוצאות משתנות מאוד (הבדלי ערכי Ct > ±1.5 בין שכפולים) צריכה להיחשב כלא חוקית, ויש לבדוק מחדש את הדגימה. אם הבעיה נמשכת, יש לחלץ מחדש את הדגימה.
דגימה חיובית לכלבת שחולצה מרקמת גזע המוח והמוח הקטן שנאספו ומאוחסנים כראוי צפויה להיות בעלת ערך Ct של פחות מ-35 מחזורים עבור בדיקת LN34. יש לבדוק מחדש את כל הדגימות הלא חד-משמעיות על ידי RT-PCR בזמן אמת LN34. אם הדגימה אינה חד משמעית בבדיקה חוזרת וכל הבקרות מבוצעות כצפוי, מומלץ חילוץ מחדש של RNA. דגימות עם RNA נגיפי נמוך (LN34 Ct > 35) עשויות להצביע על בעיות פוטנציאליות כגון זיהום, עומס וירוס נמוך, עיכוב PCR או מיצוי כושל. אספו חתיכות טריות של המוח מהרקמה המקורית, בצעו מיצוי רנ"א ובדקו מחדש את הדגימה. כמו כן, ערכי Ct > 33 (סינגלפלקס), 37 (LN34M), או ללא הגברה בבדיקת βA עשויים להצביע על מיצוי RNA כושל. חזור על מיצוי עבור דגימות כאלה, ולאחר מכן חזור על הבדיקה הן עבור LN34 והן עבור אקטין. אם דגימה מייצרת שוב תוצאה לא חד משמעית לאחר בדיקה חוזרת, השתמש בשיטה משנית כגון בדיקת DFA (נקראת גם FAT), DRIT או בידוד וירוסים. אם נצפות תוצאות לא תואמות מתמשכות או תוצאות לא חד משמעיות, אנא התייעץ עם מעבדת ייחוס כלבת לבדיקות אישור.
אם קיימים מעכבים במיצוי RNA, בדיקות PCR עשויות לייצר תוצאה שלילית כוזבת. אם יש חשד לעיכוב או עיכוב של תגובות הבקרה של βA (כגון ערך Ct > 33 או ערך Ct > 37) עבור דגימה מסוימת, יש לבדוק RNA מופק ב-2 דילולים או יותר (למשל, 1:10 ו-1:100 במים נטולי נוקלאז) כדי לדלל מעכבי PCR פוטנציאליים. עבור דגימות קשות, ניתן להגדיל את כניסת ה-RNA ל-8.5 מיקרוליטר בתגובת RT-PCR על ידי אי הוספת מים. זה עשוי לחשוף עיכוב מוגבר (ערך Ct מאוחר יותר בהשוואה ל-RNA קלט של 2 מיקרוליטר) או רמת RNA נמוכה בדגימה המקורית (ערך Ct מוקדם יותר בעת שימוש ב-8.5 מיקרוליטר בהשוואה ל-RNA קלט של 2 מיקרוליטר).
בדיקת LN34 אינה מבדילה בין נגיפי ליסה או קובעת גרסאות של נגיף הכלבת. ניתן לרצף את אמפליקון הבדיקה LN34 עבור סוג וריאנט נגיף הכלבת ברזולוציה נמוכה או זיהוי של מיני נגיף ליסה11.
Disclosures
אף אחד לא לחשוף
Acknowledgements
אנו מכירים במאמצים ובשיתוף הפעולה של מעבדות רבות לבדיקת אבחון כלבת שתרמו ליישום, אימות ואופטימיזציה של בדיקת LN34 באמצעות שיתוף הנתונים הפתוחים והמשוב שלהן. השימוש בשמות מסחריים ובמקורות מסחריים הוא לזיהוי בלבד ואינו מרמז על תמיכה של המרכזים לבקרת מחלות ומניעתן, משרד הבריאות ושירותי האנוש של ארה"ב או המוסדות המסונפים למחברים. המסקנות, הממצאים והדעות המובעות על ידי המחברים אינם משקפים בהכרח את העמדה הרשמית של משרד הבריאות ושירותי האנוש של ארה"ב, המרכזים לבקרת מחלות ומניעתן או המוסדות המסונפים למחברים.
Materials
| Name | Company | Catalog Number | Comments |
| 7500 Fast | Applied Biosystems | N/A | Do not substitute without validation |
| 7500 Fast Dx | Applied Biosystems | N/A | Do not substitute without validation |
| ABI ViiA 7 | Applied Biosystems | N/A | Do not substitute without validation |
| AgPath-ID One-Step RT-PCR Kit | ThermoFisher Scientific | AM1005 | Do not substitute without validation |
| Beadbug6 | Benchmark Scientific | D1036 | |
| Direct-zol RNA MiniPrep kit | Zymo Research | R2052 | |
| MagNA Lyser green beads | Roche | 3358941001 | |
| Microcentrifuge | Eppendorf | 5425 R | |
| Optical 96-well Reaction Plates | ThermoFisher Scientific | 4346907 | |
| Optical Adhesive covers | ThermoFisher Scientific | 4311971 | Alternative: caps |
| Polyester fiber-tipped applicator swabs | BD BBL Polyester Fiber Tipped Application Swab | 220690 | |
| QuantStudio 6Flex | Applied Biosystems | 4485691 | Do not substitute without validation |
| Quaternary ammonium disinfectant (1:256) | LYSOL | WBB56939 | Do not substitute without validation |
| RNase AWAY | ThermoFisher Scientific | 7002PK | |
| RNaseZap | ThermoFisher Scientific | AM9780 | |
| Single-use scalpel, a scalpel with a safety mechanism | Integra Miltex | 4-510 | |
| Sterile polyproylene microcentrifuge tubes (1.5 mL), nuclease free | Sarstedt | 72.692.405 | |
| Sterile polyproylene microcentrifuge tubes (2 mL), nuclease free | Sarstedt | 72.694.600 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | Do not substitute without validation |
References
- Meechan, P. J., Potts, J. . Biosafety in Microbiological and Biomedical Laboratories. , (2020).
- . Terrestrial Manual 2023 Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals (2023)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/handle/10665/310836 (2018)
- . Laboratory Techniques in Rabies Available from: https://iris.who.int/bitstream/handle/10665/310837/9789241515306-eng.pdf?ua=1 (2019)
- . Protocol for postmortem diagnosis of rabies in animals by direct fluorescent antibody testing: A minimum standard for rabies diagnosis in the United States Available from: https://www.cdc.gov/rabies/pdf/RabiesDFASPv2.pdf (2003)
- World Health Organization. . WHO Expert Consultation on Rabies: Third Report. , (2018).
- Gigante, C. M., et al. Multi-site evaluation of the LN34 pan-lyssavirus real-time RT-PCR assay for postmortem rabies diagnostics. PLoS One. 13 (5), e0197074 (2018).
- Wadhwa, A., et al. A Pan-Lyssavirus Taqman Real-Time RT-PCR assay for the detection of highly variable rabies virus and other lyssaviruses. PLoS Negl Trop Dis. 11 (1), e0005258 (2017).
- Gigante, C. M., Wicker, V., Wilkins, K., Seiders, M., Zhao, H., Patel, P., Orciari, L., Condori, R. E., Dettinger, L., Yager, P., Xia, D., Li, Y., et al. Optimization of pan-lyssavirus LN34 assay for streamlined rabies diagnostics by real-time RT-PCR. Journal Virological Methods. , (2024).
- Rao, A. K., et al. Use of a modified preexposure prophylaxis vaccination schedule to prevent human rabies: recommendations of the advisory committee on immunization practices-United States, 2022. Morbidity and Mortality Weekly Report. 71 (18), 619 (2022).
- Condori, R. E., et al. Using the LN34 Pan-Lyssavirus Real-Time RT-PCR assay for rabies diagnosis and rapid genetic typing from formalin-fixed human brain tissue. Viruses. 12 (1), 120 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved