A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الإنتاج والفحص المجهري للتصوير مدى الحياة للخلايا الحية متعدد المعلمات (FLIM) للكرويات متعددة الخلايا
* These authors contributed equally
In This Article
Summary
هنا ، نصف طرق تكوين كروية متعددة الخلايا مختلفة لإجراء الفحص المجهري للخلايا الحية متعدد المعلمات للمتابعة. باستخدام المجهر التصويري مدى الحياة الفلوري (FLIM) ، والتألق الذاتي الخلوي ، والأصباغ الملطخة ، والجسيمات النانوية ، يتم إثبات نهج تحليل استقلاب الخلايا ، ونقص الأكسجة ، وموت الخلايا في السرطان الحي ثلاثي الأبعاد (3D) والأجسام الكروية المشتقة من الخلايا الجذعية.
Abstract
كرويات الورم متعددة الخلايا هي نموذج microaggregate الأنسجة 3D شعبية لإعادة إنتاج البيئة المكروية للورم ، واختبار وتحسين العلاجات الدوائية واستخدام أجهزة الاستشعار الحيوية والنانوية في سياق 3D. تعد سهولة إنتاجها وحجمها الذي يمكن التنبؤ به ونموها وتدرجات المغذيات والأيض المرصودة مهمة لتلخيص البيئة المكروية للخلايا الشبيهة ب 3D. ومع ذلك ، يمكن أن يؤثر عدم التجانس الكروي وتنوع طرق إنتاجها على التمثيل الغذائي الكلي للخلايا ، والقدرة على البقاء ، والاستجابة الدوائية. هذا يجعل من الصعب اختيار المنهجية الأنسب ، مع الأخذ في الاعتبار المتطلبات في الحجم ، والتباين ، واحتياجات التصنيع الحيوي ، واستخدامها كما هو الحال في نماذج الأنسجة 3D في المختبر في بيولوجيا الخلايا الجذعية والسرطانية. على وجه الخصوص ، يمكن أن يؤثر إنتاج الكرة الأرضية على توافقها مع المجهر الحي الكمي ، مثل التصوير الأيضي البصري ، أو الفحص المجهري للتصوير مدى الحياة (FLIM) ، أو مراقبة نقص الأكسجة الكروي باستخدام أجهزة الاستشعار النانوية ، أو الجدوى. هنا ، يتم تقديم عدد من بروتوكولات تكوين كروية تقليدية ، مما يسلط الضوء على توافقها مع المجهر الحي واسع المجال ، والبؤري ، وثنائي الفوتون. كما يتم تقديم التصوير التكميلي لخط أنابيب التحليل باستخدام FLIM متعدد التألق الذاتي ، وباستخدام أنواع مختلفة من السرطان وكروية الخلايا الجذعية.
Introduction
تمثل الأجسام الكروية متعددة الخلايا مجموعة من نماذج الأنسجة 3D التي تم الحصول عليها عن طريق التجميع الذاتي للخلايا وإظهار شكل كروي. وهي تستخدم على نطاق واسع لتقليد التفاعل بين الخلايا والخلايا والمصفوفة في المختبر وإعادة إنتاج سياق 3D ضمن العديد من التركيبات المشتقة من السرطان والخلايا الجذعية. يتم استخدام العديد من التقنيات لتقليل ارتباط الخلية وتعزيز التجميع. وتشمل هذه طريقة التعليق والإفلات التي تعتمد على التوتر السطحي1 ؛ طرق صد مرفقات الخلايا مثل ألواح التعلق المنخفضة للغاية والقوالب الدقيقةوالآبار الدقيقة 2,3 ؛ النهج القائم على الموجات الصوتية4 ؛ طرق التجميع المستحثة بالتدفق (قوارير دوارة ، مفاعل حيوي ، وأجهزة الموائع الدقيقة)5 ؛ التكوين بمساعدة الجسيمات المغناطيسية6 واستخدام المصفوفات والسقالات الاصطناعية المعززة للتجميع والقائمة على ECM7،8،9.
في أبحاث السرطان وتطويره والتحقق من صحة العلاجات الدوائية الجديدة ، تعد الكائنات الكروية نموذجا جذابا نظرا لقدرتها على تلخيص التدرجات المحدودة الانتشار المكاني للمغذيات ومنتجات النفايات و O2 ، مما يؤدي غالبا إلى تكوين نواة نخرية ، نموذجية للأورام الصلبة10,11. تتحدى هذه النماذج الأكثر موثوقية وتطورا في المختبر الحاجة إلى الاستخدام المكثف للنماذج الحيوانية (قانون تحديث إدارة الغذاء والدواء [FDA] 2.012) ، وفقا لمبدأ 3Rs للبحوث الحيوانية (الاستبدال والتقليل والصقل). بالإضافة إلى السرطان ، تجد الأجسام الكروية تطبيقها في أبحاث الخلايا الجذعية. على سبيل المثال ، تتمتع الخلايا الجذعية متعددة القدرات بالقدرة على تكوين أجسام جنينية (EB) ، والتي يمكن استخدامها لتمايز الخلايا الجذعية المستحثة متعددة القدرات (iPSCs) نحو أنواع الخلايا المتخصصة التي يصعب الحصول عليها مباشرة من المرضى ، مثل خلايا السلائف العصبية13 أو خلايا المبيض الحبيبية13,14. علاوة على ذلك ، غالبا ما يكون تكوين EB هو الخطوة الأولى في تطوير نماذج عضوية أكثر تعقيدا ، على سبيل المثال ، العصبية15 ، شبكيةالعين 16 ، القلب17 ، الكبد18 ، المعدة19 ، والعضوية المعوية20. يجب مراعاة العوامل بما في ذلك الحجم والتكرار والإنتاجية والتطبيقات النهائية عند اختيار طريقة تكوين كروية مناسبة للتجارب.
يمكن أن يؤدي التعقيد المتزايد لثقافة 3D إلى تباين أعلى مقارنة بثقافة 2D. عوامل مثل تكوين المغذيات21 ، تبخر الوسائط22 ، اللزوجة23 ، التحكم في الأس الهيدروجيني24 ، طريقة تكوين كروية ، وحتى الوقت في الثقافة25,26 يمكن أن يؤدي إلى الحصول على كرويات متفاوتة التشكل والأحجام والجدوى والمقاومة الكيميائية المختلفة27,28. أظهرت الأبحاث الحديثة أن تدرجات الأكسجين الكروية ليست ثابتة دائما وتتأثر بطريقة التكوين وحجم الكرة واللزوجة خارج الخلية ، مما يؤثر على عدم تجانس الكرة29. لتحسين قابلية التكاثر وإمكانية الوصول إلى البيانات على الأجسام الكروية ، تم تطوير قاعدة معارف MISpheroID26 ، وتحديد خط الخلية ، ووسط الثقافة ، وطريقة التكوين ، وحجم الكائنات الكروية باعتبارها الحد الأدنى من المعلومات للحصول على نتيجة قابلة للتكرار. لذلك ، تم إجراء مقارنة مفصلة للعديد من الإنتاجية العالية (SphericalPlate 5D ، والقوالب الدقيقة المصنوعة في المختبر ، وقوالب الأنسجة الدقيقة) وطرق التعلق المنخفضة (أي ألواح 96 بئرا المطلية ب Biofloat و Lipidure ، سواء كانت خالية من السقالات أو قائمة على السقالات) (الشكل 1 والجدول 1) ، بما في ذلك حجم البئر (مع إعطاء تقدير للحد الأقصى لحجم الكرة الأرضية) ، والمواد الاستهلاكية المستخدمة ، ووقت التحضير وإمكانية مراقبة الأجسام الكروية دون نقلها إلى أطباق الفحص المجهري. هذا الأخير يتيح دراسات طويلة الأجل ، في حين أن الكرويات المنتجة بطرق عالية الإنتاجية غالبا ما تؤدي إلى تجارب نقطة النهاية. جميع الطرق باستثناء شبكات 5DspheriPlate لا تجلب التألق الذاتي غير المرغوب فيه ، مما يتيح استخدامها المباشر في الفحص المجهري.
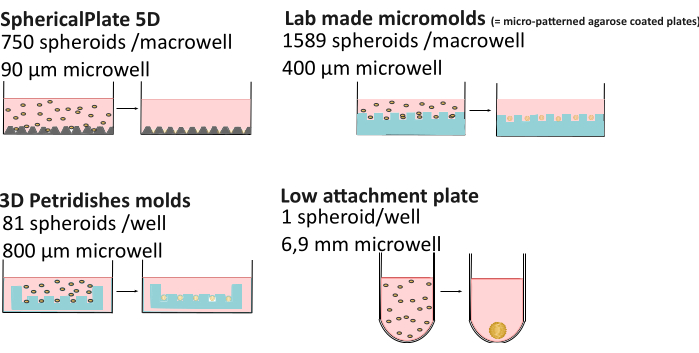
الشكل 1: شرح طرق تكوين الكرة الأرضية. طرق عالية الإنتاجية مثل SphericalPlate 5D ، التي دمجت الآبار الدقيقة الحاصلة على براءة اختراع في اللوحة ، بينما تستخدم القوالب الدقيقة المنتجة في المختبر وقوالب MicroTissue طوابع لصنع آبار دقيقة متعددة في الأغاروز (الأزرق). تستخدم الألواح منخفضة التعلق مثل Lipidure (Amsbio) و Biofloat (Sarstedt) طلاءا غير ملتصق يمنع التصاق سطح الخلية ويعزز التجميع الذاتي للخلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| 5D SpheriPlate | قوالب دقيقة منتجة ذاتيا | الأنسجة الدقيقة | طرق التعلق المنخفضة | |
| عدد الكرويات / البئر | 750 | 1589 | 81 | 1 |
| قطر البئر | 90 ميكرومتر | 400 ميكرومتر | 800 ميكرومتر | 1 مم |
| حجم الثقافة | 1 مل | 5 مل | 1 مل | 200 ميكرولتر |
| المواد الاستهلاكية الأخرى | / | 7 مل من 3٪ أغاروز | 500 ميكرولتر من 2٪ أغاروز | / * |
| وقت التحضير | 10 دقائق | 2 ساعة + 3 أيام تكييف الوسائط | 0.5 ساعة + 15 دقيقة تكييف الوسائط | 10-30 دقيقة + 1 ساعة تجفيف |
| رصد | نعم | لا** | نعم | نعم |
| الفلورسنت الذاتي | نعم | لا | لا | لا |
| قابله | لا | نعم | نعم | لا** |
| كلف | €€ | € | €€€€ | €€€€: طلاء وماتريجيل |
| €€: لوحة تجارية 96 بئر | ||||
| * تحتاج بعض خطوط الخلايا إلى إضافة ECM (أي 2٪ -5٪ Matrigel) لتشكيل كرويات مدمجة. | ||||
| ** الطلاء قابل لإعادة الاستخدام حتى ينفد. ومع ذلك ، ستستهلك كل لوحة كمية صغيرة من الوسائط ويمكن أن يتراكم الغبار بمرور الوقت. هناك حاجة إلى تعقيم المرشح بانتظام. | ||||
الجدول 1: مقارنة طرق تكوين كروية متعددة29. "المراقبة": القدرة على مراقبة كروية دون الحاجة إلى نقلها إلى طبق الفحص المجهري. €: 0-50€, €€: 50-150€ , €€€: 150-500€ , €€€€: >500€
يتيح الفحص المجهري الفلوري المراقبة المباشرة للجوانب البيولوجية الرئيسية داخل الأجسام الكروية ، بما في ذلك موت الخلايا ، والقدرة على البقاء ، والانتشار ، والتمثيل الغذائي ، واللزوجة ، وحتى الخصائص الميكانيكية30. يوفر الفحص المجهري للتصوير مدى الحياة الفلوري (FLIM) بعدا كميا إضافيا لدراسة تفاعلات مسبار الفلورسنت داخل بيئتها (الدقيقة)31،32،33،34 ، مما يسمح بحل أطياف الانبعاثات المتداخلة وفقا لأعمار الانبعاثات المختلفة35,36 والتحقيق في استقلاب الخلية على أساس التألق الذاتي الخلوي الداخلي. وبالتالي ، يمكن قياس مركبات الفلورسنت الذاتي الخلوية واسعة الانتشار مثل نيكوتيناميد الأدينين ثنائي النوكليوتيد الفوسفات (NAD (P) H) ، أحادي النوكليوتيد الفلافين (FMN) ، فلافين الأدينين ثنائي النوكليوتيد (FAD) ، البروتوبورفيرين التاسع ، وغيرها يمكن قياسها باستخدام FLIM واحد وفوتونين وتكون بمثابة "مستشعرات" جوهرية لهدم الجلوكوز ، والفسفرة التأكسدية (OxPhos) وتوفر نظرة عامة على حالة الأكسدة والاختزال الخلوية. يوجد NAD (P) H في السيتوبلازم الحر ، أو في أشكال الميتوكوندريا المرتبطة بالبروتين37,38. وبالمثل ، فإن الحالة المؤكسدة ل FAD هي الفلورسنت مع عمر أطول للشكل الحر. عادة ما تتضمن مجهرات NAD (P) H و FAD FLIM المثارة ثنائية الفوتون ، بهدف منع التلف الضوئيللعينة 39. في كثير من الأحيان ، يمكن دمج "التصوير الأيضي البصري" FLIM مع استخدام المجسات القائمة على الصبغة ، وأجهزة الاستشعار الحيوية المشفرة وراثيا ، والفحص المجهري للتصوير مدى الحياة للفسفور (PLIM) ، والقياسات القائمة على الكثافة النسبية من أجل توفير صورة أكثر اكتمالا لعملية التمثيل الغذائي الكروي أو العضوي ، والأوكسجين ، والانتشار ، وصلاحية الخلية29،30،31. بالإضافة إلى ذلك ، يمكن أيضا دمج FLIM مع طريقة نقل طاقة الرنين Förster (FRET) لقياس التباين مدى الحياة للفلوروفور المانح عندما يكون على اتصال وثيق مع المستقبل للتحقيق في ارتباط الدواء بمجاله المستهدف33،40،41.
عادة ما يتم تحليل صور FLIM المكتسبة لحساب العمر بكسل تلو الآخر. حاليا ، هناك ما لا يقل عن 3 استراتيجيات شائعة تستخدم للحصول على عمر مضان: شبه كمي "FLIM'42 السريع"42 (يشار إليه أحيانا باسم "tau sense" 43,44) ، وتركيب منحنى الاضمحلال ، باستخدام تركيب أسي واحد أو اثنين أو ثلاثة ، ونهج "خال من التركيب" مع تحويل الطور وتحليل مخطط الطور. اعتمادا على البائع ، يمكن استخدام البرامج المقدمة (LAS X أو Symphotime أو SPCImage وما إلى ذلك) أو البرامج مفتوحة المصدر (على سبيل المثال ، FLIMfit45 أو FLIMJ46 أو غيرها47) للتعامل مع بيانات FLIM المقاسة. عادة ما تكون البرامج التي يوفرها البائع مفيدة لتحليل البيانات الأولية ، في حين أن الحلول مفتوحة المصدر يمكن أن توفر دراسات أكثر دقة باستخدام ، على سبيل المثال ، مخططات المرحلة والتصور 3D.
على الرغم من فائدة وجاذبية FLIM كطريقة لدراسة الكرات ، يتوفر عدد قليل جدا من البروتوكولات التجريبية ، وهناك نقص عام في المعرفة في اختيار أنسب طريقة تشكيل لتجارب الفحص المجهري الحية متعددة المعلمات الناجحة التي تتضمن FLIM. هنا ، يتم تقديم مقارنة مفصلة لبروتوكولات تكوين كروية شائعة الاستخدام بناء على مورفولوجيتها وصلاحيتها وأكسجينها مع مستشعر نانوي لاستشعار الأكسجين (MMIR1) تم التحقق من صحته مؤخرا وتميزه بالأشعة تحت الحمراء البعيدة والقريبة من الأشعة تحت الحمراء (NIR). يتم تشريب الجسيمات النانوية الكاتيونية بصبغتين مراسلتين ، المرجع O 2-aza-BODIPY غير الحساس (الإثارة 650 نانومتر ، الانبعاث 675 نانومتر) و NIR O2 الحساس للميتالوبورفيرين ، PtTPTBPF (الإثارة 620 نانومتر ، الانبعاث 760 نانومتر). يتيح MMIR1 التحليل في الوقت الفعلي لتدرجات الأكسجين على مجهر مضان تقليدي (باستخدام التحليل النسبي) أو مجهر عمر الفسفرة (PLIM) دون إدخال سمية خلوية والسماح بإشارات مستقرة ومراقبة طويلة الأجل وتعدد الإرسال25,29. اعتمادا على الحاجة إلى تلطيخ الأصباغ أو أجهزة الاستشعار النانوية أو الإنتاجية الكروية أو نوع الخلية ، يمكن اختيار بروتوكول التكوين الأنسب. نظرا لأن دراسات صلاحية الكائنات الكروية والأوكسجين ذات صلة بدراسات السرطان والكرويات المشتقة من الخلايا الجذعية ، فإن البروتوكولات المقدمة تتضمن أيضا أمثلة ونتائج نموذجية متوقعة ل NAD (P) H-FLIM و FAD-FLIM مع هذه النماذج. تستهدف خطوط أنابيب التصوير والتحليل المقدمة منصات الفحص المجهري FLIM الأكثر شيوعا القائمة على عد الفوتون الأحادي المرتبطة بالوقت.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. توليد كرويات متعددة الخلايا
- زراعة الخلايا
ملاحظة: يمكن جمع مزارع الخلايا من مجموعة ثقافة النوع الأمريكية (ATCC) أو Lonza أو Sigma-Aldrich أو بائعين آخرين. يوفر ATCC جميع معلومات المناولة المطلوبة ، بما في ذلك وسائط النمو المفضلة ، وإجراءات الاستزراع الفرعي ، ومستوى السلامة الأحيائية ، ومعدل النمو ، وملامح STR. هنا ، يتم استخدام 500 خلية / كروية من خط خلايا سرطان القولون البشري HCT116 في وسائط McCoy's 5A (VWR ، 392-0420) مع 10٪ FBS و 1 mM Sodium Pyruvate. بالنسبة للتجارب طويلة المدى التي تتم مراقبتها يوميا ، يمكن إضافة 10 mM HEPES ، الرقم الهيدروجيني 7.2 إلى الوسائط.- تنمو ثقافة الخلايا للوصول إلى التقاء 70٪ -90٪.
- شطف الخلايا مع PBS معقمة مسخنة مسبقا (37 درجة مئوية) (5 مل ل 25 سم2 أو 10 مل لكل 75 سم2 قارورة).
- أضف 0.05٪ تربسين - 1 مللي مول محلول EDTA (0.5 مل لكل 25 سم² أو 1 مل لكل 75 سم2 قارورة) واحتضانها لمدة 5-10 دقائق عند 37 درجة مئوية في 5٪ CO2 ، 95٪ رطوبة للوصول إلى انفصال الخلايا.
ملاحظة: التحكم في انفصال الخلايا تحت مجهر ضوء الإرسال (برايتفيلد). يمكن أن يؤثر التعرض المفرط للخلايا لمحلول الإنزيم المنفصل على صلاحيتها. - تحييد التربسين عن طريق إضافة وسائط زراعة الخلايا الزائدة التي تحتوي على 10٪ FBS (على الأقل 5 مل من الوسائط لكل 1 مل من محلول التفكك).
ملاحظة: بالنسبة للخلايا المستزرعة على وسائط استزراع منخفضة FBS أو خالية من FBS ، يمكن إجراء تحييد التربسين بإضافة 0.5 مل من FBS بنسبة 100٪ إلى مزرعة الخلايا المعالجة بالتريبسين ، متبوعا بالطرد المركزي لنقل الخلايا إلى وسائط المزرعة الأصلية. - فصل مجاميع الخلايا عن طريق السحب للحصول على تعليق أحادي الخلية في الوسائط.
ملاحظة: تعمل الماصة باستخدام ماصة مصلية بطرف ماصة سعة 1000 ميكرولتر في الأعلى على تحسين توليد تعليق أحادي الخلية بشكل كبير في حجم كبير من ثقافة الخلايا المعلقة. - استخدم غرفة العد (مقياس الدم أو البدائل التي يحكمها نيوباور) لحساب عدد الخلايا لكل 1 مل من تعليق الخلية.
- تمييع تعليق الخلية للحصول على العدد المطلوب من الخلايا لكل ملليلتر.
- أضف محلول مسبار O2 المركز (الجسيمات النانوية) إلى تعليق الخلية بتركيز نهائي قدره 10 ميكروغرام / مل للتحليل النسبي ل O2.
ملاحظة: لضمان تعليق خلية متجانسة (مع المسبار) ، أعد التعليق عدة مرات قبل تكوين كروي. إذا لم يكن مسبار O2 مطلوبا ، فتخط هذه الخطوة وتابع تشكيل الأجسام الكروية. يجب تطبيق بروتوكول معدل عند التعامل مع iPSCs. باختصار ، تزرع iPSCs في مستعمرات على ألواح مطلية ب Geltrex ويتم تمريرها باستخدام ReLeSR كما هو موضح في البروتوكول48 المقدم من البائع. في يوم تكوين كروي ، يجب أن تكون المستعمرات كبيرة ومضغوطة وتعرض مراكز متعددة الطبقات ذات حدود مميزة. شطف الخلايا مع PBS معقمة مسخنة. أضف 1 مل من كاشف تفكك الخلايا اللطيف (GCDR) واحتضانه عند 37 درجة مئوية لمدة 8-10 دقائق. استخدم طرف 1000 ميكرولتر لفصل الخلايا برفق عن البئر والحصول على تعليق أحادي الخلية. انقل معلق الخلية الواحدة إلى أنبوب مخروطي معقم سعة 50 مل وأضف 4 مل من وسط DMEM-F12 المسخن مسبقا لتحييد GCDR. اغسل البئر ب 1 مل من DMEM-F12 وانقله إلى بقية تعليق الخلية. أجهزة الطرد المركزي في 300 × ز لمدة 5 دقائق. أعد التعليق في 1 مل من الوسائط المناسبة لمزيد من التجارب. بالنسبة للتجارب الموصوفة في هذه المخطوطة ، تم استخدام مثبط الصخور mTeSR + 10 μM. عد وتخفيف تعليق الخلية للحصول على العدد المطلوب من الخلايا لكل ملليلتر.
- طرق تشكيل كروية
- 3D طبق بتري قوالب صغيرة
ملاحظة: تستخدم طريقة الإنتاجية العالية هذه لتوليد عدد كبير من الكرويات (81 كروية) في وقت واحد في مصفوفة micromold 9 × 9 بقطر 800 ميكرومتر وعمق 800 ميكرومتر.- شطف القوالب الصغيرة لصب أطباق بتري 3D في dH2O ووضعها في حاوية قابلة للتعقيم.
- قم بقياس 2 جم من مسحوق الأغاروز الكهربائي وضعه في زجاجة زجاجية جافة آمنة للأوتوكلاف سعة 200 مل.
ملاحظة: تأكد من أن الزجاجة ومسحوق الأغاروز جافان بدون سائل أو رطوبة. - قوالب الأوتوكلاف الصغيرة لصب أطباق وزجاجات بتري 3D مع مسحوق الأغاروز لمدة 30 دقيقة في دورة جافة.
- اصنع محلول ملحي 0.9 واط / فولت بإضافة 0.9 جم من كلوريد الصوديوم في 100 مل من الماء عالي النقاء وتعقيمه عن طريق التعقيم.
ملاحظة: يوصى باستخدام كلوريد الصوديوم من قبل الشركة المصنعة. يزيد من استقرار الأغاروز. - تحضير محلول الأغاروز عن طريق إضافة محلول ملحي معقم إلى مسحوق الأغاروز المعقم. المسمار على الغطاء مثبتة بشكل غير محكم لتجنب تراكم الضغط. حرك الزجاجة لخلط مسحوق الأغاروز.
- اسلقي مسحوق الأغاروز وحوبه باستخدام فرن الميكروويف. أوقف الميكروويف بشكل متكرر (~ كل 10 ثوان). حرك الزجاجة وكرر حتى يذوب الأغاروز.
تنبيه: محلول الأغاروز ساخن ويتطلب معالجة دقيقة. قد يؤدي الاهتزاز مباشرة بعد إجراء الذوبان إلى انفجار المحلول خارج الوعاء. لتجنب الحوادث ، استخدم أوعية كبيرة مملوءة بما يكفي بما لا يزيد عن 50٪ من السعة واستخدم الحماية الشخصية المناسبة (القفازات ، وقفاز الفرن ، وحماية العين ، ومعطف المختبر). - دع محلول الأغاروز المذاب يبرد إلى 60-70 درجة مئوية. باستخدام تقنيات وظروف معقمة ، أغاروز ماصة منصهرة في القالب الصغير (500 ميكرولتر لسلسلة 12 أو 330 ميكرولتر لسلسلة 24).
ملاحظة: تجنب تكوين الفقاعات أثناء خلط أو سحب الأغاروز. قم بإزالة أي فقاعات صغيرة محاصرة في الميزات الصغيرة للقالب الصغير عن طريق السحب أو التخريد اللطيف قبل أن يصلب الأغاروز. - دع الأغاروز يصلب لمدة 2-3 دقائق. بعد ذلك ، قم بثني القالب الصغير بعناية لإزالة طبق 3D Petri ونقله إلى طبق زراعة الأنسجة 12 جيدا.
ملاحظة: قد يؤدي الإفراط في ثني القالب الصغير إلى تكوين تشققات داخل قالب الأغاروز. - لموازنة طبق 3D Petri ، أضف 2.5 مل / وسط زراعة خلايا البئر. احتضان لمدة 15 دقيقة أو أكثر. قم بإزالة وسط الاستزراع واستبدله بوسط جديد. كرر مرة أخرى لموازنة طبق 3D Petri مع وسيط ثقافة.
ملاحظة: يمكن مقاطعة البروتوكول هنا حتى بذر الخلية. للتخزين طويل الأجل (حتى 2 أسابيع عند 4 درجات مئوية) ، استخدم حل PBS بدلا من المتوسط. - قم بإزالة طبق 3D Petri المحيط بوسط الاستزراع (أو PBS) تماما وبدقة قم بإزالة الوسائط داخل طبق 3D Petri عن طريق إمالة لوحة زراعة الأنسجة.
- قم بزرع 190 ميكرولتر بعناية من معلق الخلية الذي يحتوي على 40500 خلية قطرة في غرفة بذر الخلايا (انظر الخطوة 1.1).
ملاحظة: يحدد عدد الآبار الدقيقة في طوابع الأغاروز عدد الكرويات المنتجة لكل طابع. في هذه الحالة ، يحتوي قالب الأغاروز هذا على 81 بئرا صغيرا (81 × 500 خلية / كروية). يسمح تباين تركيز الخلية في التعليق المضاف إلى البئر الكبير بتغيير رقم الخلية لكل كروي ، وبالتالي التحكم في حجم الكروي. - السماح ~ 10 دقيقة للخلايا لتستقر في ميزات 3D Petri dsh. ثم أضف 2 مل من الوسط إلى الخارج من طبق 3D Petri.
- ضع لوحة زراعة الأنسجة في حاضنة زراعة الخلايا وتبادل الوسط المحيط بطبق بتري 3D حسب الحاجة.
- لوحة مرفقة منخفضة
ملاحظة: تستخدم هذه الطريقة لتوليد كروي واحد لكل بئر. الألواح المطلية (Lipidure أو Biofloat) متاحة تجاريا (تخطي الخطوات 1.2.2.1-1.2.2.4). بدلا من ذلك ، يمكن شراء الطلاء بشكل منفصل واستخدامه لطلاء الألواح متعددة الآبار غير المعالجة. يوصى بملء الآبار عند حواف 96 بئرا بالماء المعقم أو PBS بسبب التبخر الأسرع في هذه الآبار ، مما يحد من عدد الآبار الكروية إلى 60. في حالة الحاجة إلى عدد أقل من الأجسام الكروية ، املأ الآبار الفارغة المحيطة بالماء أو برنامج تلفزيوني. استخدم نصائح خالية من الغبار للتعامل مع السوائل لتجنب جلب جزيئات صغيرة إلى الآبار ، لأنها تتداخل مع تكوين الكرة الأرضية.- تحضير محلول طلاء 0.5 w/v٪ عن طريق إذابة 0.25 g من مسحوق البوليمر في 50 mL من الإيثانول في وعاء زجاجي. تصفية تعقيم الطلاء.
ملاحظة: يجب تنفيذ تعقيم المرشح وجميع الخطوات التالية في ظروف معقمة تحت التدفق الصفحي. - أضف 200 ميكرولتر من محلول الطلاء إلى كل بئر من صفيحة استزراع قاع U 96.
- احتضان لمدة 1 دقيقة وخلع الطلاء الزائد.
ملاحظة: يمكن استخدام محلول الطلاء عدة مرات. تخزينها في وعاء زجاجي في درجة حرارة الغرفة (RT). لا ينصح باستخدام الحاويات البلاستيكية ، حيث يمكن أن يذوب البلاستيك جزئيا ويصبح جزءا من المحلول. في حالة وجود غبار ، قم بتعقيم المرشح باستخدام مرشحات حقنة بولي إيثر سلفون (PES) أو نايلون 0.22 ميكرومتر أو مرشحات حقنة من النايلون. - دع اللوحة المكونة من 96 بئرا تجف في الهواء لمدة 1 ساعة تقريبا.
ملاحظة: إذا كانت الخلايا بحاجة إلى مصفوفة خارج الخلية، فانتقل إلى الخطوة 1.2.3. يمكن تخزين الألواح المطلية في RT عند لفها بالألمنيوم لمدة تصل إلى 1 شهر. عند بذر كمية أقل من الخلايا / البئر ، يمكن أن يساعد الطرد المركزي للوحة لمدة 5 دقائق عند 300 جم في سحب الخلايا.
- تحضير محلول طلاء 0.5 w/v٪ عن طريق إذابة 0.25 g من مسحوق البوليمر في 50 mL من الإيثانول في وعاء زجاجي. تصفية تعقيم الطلاء.
- بروتوكول التكوين بمساعدة المصفوفة خارج الخلية
ملاحظة: بعض خطوط الخلايا لا تنتج ما يكفي من المصفوفة خارج الخلية (ECM) نفسها وتحتاج إلى إضافة ECM مثل Matrigel أو Cultrex أو Geltrex من أجل تكوين كرويات مدمجة49،50،51. بالنسبة لأنواع الخلايا مثل سرطان الثدي MDA-MB-231 ، الحليمة الجلدية البشرية ، خلايا سرطان البروستاتا وغيرها ، من الممكن استخدام الخطوة 1.2.2 مع التعديلات التالية52 ، والتي تتطلب إضافة ECM. يفضل استخدام أطراف خالية من الغبار للتعامل مع السوائل لتجنب تداخل الغبار مع تكوين الكرة الأرضية. يجب تنفيذ الخطوات 1 و 4-7 تحت خزانة السلامة البيولوجية (الفئة الثانية).- تابع الخطوات 1-2-2-1-1-1-2-2-4 (الألواح منخفضة التعلق) للمعالجة السطحية.
- قم بتبريد الطبق المكون من 96 بئرا مسبقا على حرارة 4 درجات مئوية في الثلاجة.
- قم بإعداد جهاز الطرد المركزي باستخدام المحول الصحيح للوحة 96 بئرا وقم بتبريده مسبقا لمدة 4 درجات مئوية.
- تحضير محلول 5٪ من مصفوفة الغشاء القاعدي (BMM) في وسائط زراعة الخلايا المبردة مسبقا (4 درجات مئوية).
ملاحظة: BMM بسرعة عبر الروابط في RT. عند المناولة ، احتفظ بالأسهم والحلول على الجليد. - قم بإعداد تعليق الخلية (انظر الخطوة 1.1).
- أضف 50 ميكرولتر من محلول BMM في كل بئر.
- أضف برفق 50 ميكرولتر من تعليق الخلية إلى كل بئر فوق محلول BMM (25000 خلية / بئر).
ملاحظة: لا تقم بتفجير هذا الحجم في البئر ، وإلا ستنتشر الخلايا على جوانب الآبار ولن تتجمع في القاع. يمكن الحصول على عدد أقل من الخلايا لكل بئر عن طريق ضبط كثافة الخلية وفقا لذلك. لن تشكل جميع الخلايا كرويات في جميع كثافات البذر. يجب إجراء التحسين نوع الخلية والأبعاد المطلوبة. مع الأحجام المقدمة ، يكون التركيز النهائي ل BMM 2.5٪. إذا كانت هناك حاجة إلى تركيز مختلف ، فيجب تحضير محلول المخزون بتركيز أقل / أعلى. - أجهزة الطرد المركزي لوحة 96 بئر لمدة 5 دقائق عند 300 × جم و 4 درجات مئوية.
ملاحظة: بدون هذه الخطوة ، لا تتجمع الخلايا بشكل صحيح في قاع البئر ، مما يتسبب في تكوين العديد من الركام الأصغر. يجب تبريد أجهزة الطرد المركزي لتجنب التشابك في هذه المرحلة. - ضع اللوحة في حاضنة زراعة الخلايا. تعتبر الركام ناضجة في اليوم 4 بعد البذر.
ملاحظة: للاطلاع على بروتوكولات إضافية بشأن تكوين الكرة الأرضية، يرجى الرجوع إلى الملف التكميلي 1.
- 3D طبق بتري قوالب صغيرة
2. الفحص المجهري الحي للكرويات
- تحضير كرويات لتحليل التصوير الحي
ملاحظة: اعتمادا على تصميم التجربة (على سبيل المثال ، المراقبة طويلة الأجل أو تحليل نقطة النهاية ، أو إعداد المجهر ، أو الخصائص الطيفية للتألق المقاس) أو بسبب عدم توافق طريقة إنتاج الكرة مع الفحص المجهري (على سبيل المثال ، سمك العينة ، التألق الذاتي للمادة ، تعويم الأجسام الكروية أثناء التصوير) المراقبة المباشرة للكرويات في اللوحة ، حيث تم إنتاجها ، قد لا يكون ممكنا. يشرح البروتوكول تحضير الأجسام الكروية للتصوير ، وهي مناسبة لمعظم المجاهر ذات المجال العريض والمجاهر متحدة البؤر.- تحضير وسائط التصوير وتسخينها (37 درجة مئوية): DMEM مكمل ب HEPES-Na ، ودرجة الحموضة 7.2 (10 مللي مول) ، وبيروفات الصوديوم (1 مللي مول) ، و L-glutamine (2 mM) ، والجلوكوز (5 mM) ، بدون الفينول الأحمر.
ملاحظة: يمكن استخدام بيكربونات الصوديوم بمفردها أو بالاشتراك مع HEPES-Na ، إذا تم توفير التحكم في CO2 أثناء التصوير24. بعض أنواع زراعة الخلايا لا يمكن أن تتسامح مع وجود HEPES. اعتمادا على التصميم التجريبي ، يمكن تعديل محتوى البيروفات والجلوتامين والجلوكوز. - قم بإعداد أطباق مجهرية معقمة (متوفرة تجاريا أو مصنوعة في المختبر) بأسطح زجاجية مغلفة (للالتصاق كروي قوي) أو غير مطلية (التصاق كروي منخفض) (سمك # 1.5).
ملاحظة: تعتمد الحاجة ونوع الطلاء على نوع الخلية ، وخصائص التصاق الكائنات الكروية ، ومعدل هجرة الخلايا من واجهة الثقافة 3D إلى 2D. من المهم مراعاة ذلك ، لأن الطلاء يمكن أن يسهل فقدان تنظيم 3D ، وتغيير شكل التدرجات الدقيقة في الأجسام الكروية ، ونتيجة لذلك ، سلوك الخلية. بالنسبة لبعض التجارب (على سبيل المثال ، حلل التصوير الاستجابة لتحفيز الدواء) ، يلزم التصاق كروي قوي بالسطح ، ويفضل طلاء بالجيلاتين أو BMM أو الكولاجين أو الكولاجين / poly-D-lysine أو poly-D-lysine. - اغسل بلطف الأجسام الكروية الملطخة بالمسبار O2 من الآبار الدقيقة للأغاروز ذي الأنماط الدقيقة أو الصفيحة ذات 96 بئرا وانقل الكرويات التي لا تزال عائمة إلى قارورة سعة 2 مل.
ملاحظة: لضمان جمع جميع الكرات الكروية من طريقة الإنتاجية العالية ، اشطف القالب 1-3 مرات بالحجم الإضافي لوسائط الاستزراع ، مع الجمع بين جميع المعلقات الكروية في قارورة واحدة. بالنسبة للكرويات الموجودة في لوحة منخفضة التعلق ، اجمع الكرات واحدة تلو الأخرى من الآبار الفردية إلى قارورة أو مباشرة إلى طبق الفحص المجهري إذا كان عدد صغير من الأجسام الكروية كافيا للتجربة. عند نقل الأجسام الكروية الكبيرة ، اقطع نهاية طرف الماصة لضمان عدم حدوث ضرر أثناء الماصة. - اترك القارورة في وضع عمودي لمدة تصل إلى 5 دقائق للسماح للكرويات بالاستقرار في قاع القارورة ، لتشكيل حبيبات مرئية.
- قم بإزالة الوسائط من الأنبوب ، وترك الأجسام الكروية دون عائق ، وأعد تعليقها برفق في كمية كافية من الثقافة الطازجة.
ملاحظة: لتسهيل التعامل مع الكرة ، يمكن أيضا نقل الأجسام الكروية إلى وسائط التصوير في هذه المرحلة على دفعات صغيرة ؛ راجع الخطوتين 2.1.7 و2.1.8. يجب معاملة الكائنات الكروية من المجموعات التجريبية المختلفة على قدم المساواة ، حيث يمكن أن يؤثر تكوين الوسائط ووقت التهيئة المسبقة للوسائط على عملية التمثيل الغذائي. - أثناء طفو الأجسام الكروية ، انقل حجما متساويا من التعليق الكروي لكل بئر من طبق الفحص المجهري.
- احتضان الكرويات لمدة 1-2 ساعة عند 37 درجة مئوية في حاضنة CO2 لضمان ارتباطها بسطح طبق / بئر الفحص المجهري. للتصوير ، تابع الخطوة 2.1.9. لتلطيخ الأجسام الكروية مع تحقيقات إضافية المضي قدما في الخطوة 2.1.8.
ملاحظة: معدل هجرة الخلايا من كروي 3D إلى واجهة السطح 2D هو دالة للوقت. لتجنب فقدان تنظيم 3D ، يجب تحسين وقت الحضانة فيما يتعلق بنوع الخلية ونوع طلاء السطح وتصميم التجربة. على سبيل المثال ، يحتاج HCT116 ، اعتمادا على حجم كروي ، إلى ساعتين على الأقل للحصول على مرفق كروي مناسب بالسطح المطلي بالكولاجين IV / poly-D-lysine ، في حين أن مرفق hDPSC والانتقال إلى واجهة 2D سريع للغاية ، مما يؤدي إلى فقدان التنظيم ثلاثي الأبعاد في 1-2 ساعة. لتجنب تصوير "كرويات 2D" بسبب الانتشار المفرط ، يتم استخدام الأسطح الزجاجية غير المطلية مع تقليل وقت الحضانة. - أضف مسبار (مسابار) مضان بتركيزات موصى بها أو محسنة تجريبيا إلى حجم معروف من التعليق الكروي. احتضان لمدة 1 ساعة عند 37 درجة مئوية حاضنة CO2 قبل التصوير.
ملاحظة: بالنسبة للمقايسة الحية / الميتة ، استخدم يوديد البروبيديوم والكالسيين جرين-AM بتركيز نهائي قياسي 1 ميكروغرام / مل. لتجنب التأثير السام لتلطيخ يوديد البروبيديوم على الأجسام الجنينية iPSC ، كان تركيز يوديد البروبيديوم النهائي 0.5 ميكروغرام / مل. يمكن إطالة وقت تحميل المسبار إذا لم يكن انتشار المسبار فعالا بسبب الحجم الكروي الكبير. يجب دائما اعتبار وقت التحميل جزءا من إجمالي وقت الحضانة اللازم لربط الكرة الأرضية بالسطح. إذا كانت هناك حاجة إلى وقت أطول للتعلق الكروي ، فيجب ترتيب إجراء التلوين في نهاية هذه الفترة. كن على علم بأن وقت الحضانة الأطول قد يؤدي إلى فقدان منظمة 3D. - قم بإزالة وسائط زراعة الخلايا أو الوسائط التي تحتوي على مجسات الفلورسنت واستبدلها بالحجم الضروري من وسائط التصوير. لضمان عدم وجود خلفية مضان للوسائط في طريق التصوير الكروي ، كرر خطوة تبادل الوسائط (الغسيل) حتى 5 مرات.
ملاحظة: لتجنب إزالة الكرة أثناء تبادل الوسائط ، يوصى بنضح الوسائط بعناية باستخدام ماصة 200 ميكرولتر من حواف أطباق الفحص المجهري وإجراء إضافة الوسائط بجانب الحائط أو بشكل جانبي في طبق الفحص المجهري. - تابع على الفور الخطوة 2.2.1 من بروتوكول التصوير.
ملاحظة: يمكن أن يؤثر الفاصل الطويل جدا بين التحضير للتصوير واكتساب التصوير الفعلي على استقلاب الخلية (على سبيل المثال ، عن طريق تغيير التركيب المتوسط) ، والجدوى (بعض مجسات الفلورسنت المستخدمة لتحليل نقطة النهاية لها تأثيرات سامة ، والتي يمكن أن تحفز موت الخلايا بعد فترة حضانة طويلة) وكذلك تؤدي إلى فقدان تنظيم 3D. إذا كان يجب مقارنة مجموعات متعددة من الكائنات الكروية أو الظروف التجريبية ، فيجب تطوير التصميم التجريبي وفقا لذلك للحفاظ على توقيت العلاج والتكييف المسبق وإجراءات التصوير متساوية قدر الإمكان بين المجموعات التي تم تحليلها.
- تحضير وسائط التصوير وتسخينها (37 درجة مئوية): DMEM مكمل ب HEPES-Na ، ودرجة الحموضة 7.2 (10 مللي مول) ، وبيروفات الصوديوم (1 مللي مول) ، و L-glutamine (2 mM) ، والجلوكوز (5 mM) ، بدون الفينول الأحمر.
- الحصول على الصور
ملاحظة: يصف البروتوكول التصوير متعدد المعلمات للكرويات الحية باستخدام المجهر متحد البؤر Stellaris 8 Falcon (Leica) وبرنامج Leica Application Suite X (LAS X) الإصدار 4.7. ومع ذلك ، لن تكون هناك حاجة إلا إلى تعديلات طفيفة لإجراء مثل هذا التحليل على منصات الفحص المجهري البديلة.- قم بتشغيل وحدة التحكم في درجة الحرارة قبل 30-60 دقيقة من التصوير. اضبط السرعة اللازمة للتهوية ودرجة الحرارة (35-37 درجة مئوية).
ملاحظة: إذا كان بالإضافة إلى التحكم في درجة الحرارة ، يجب التحكم في تركيز الغاز (على سبيل المثال ، CO2 أو O2) أثناء التصوير ، فيجب أيضا بدء تشغيل الأجهزة المقابلة مسبقا للوصول إلى الظروف اللازمة قبل التصوير. - قم بتشغيل المجهر والأجهزة المتصلة (مثل ليزر WLL والكمبيوتر ومضخة المياه لهدف الغمر في الماء والكتل الإلكترونية التشغيلية الأخرى). ابدأ تشغيل برنامج التحكم في المجهر (على سبيل المثال ، وضع آلة LAS X أو وضع الماكينة مع التحكم البيئي) المزود بإعداد المجهر الدقيق وقم بتهيئة معايرة المرحلة.
- اختر الهدف المطلوب في البرنامج وقم بتطبيق سائل الغمر إذا لزم الأمر.
ملاحظة: بالنسبة للفحص المجهري الحي ، يوصى باستخدام أهداف غمر الماء أو الجلسرين التي لها مسافة عمل كافية ("طويلة") ، على سبيل المثال ، HC Fluotar L 25x / 0.95 W مقابل الأشعة تحت الحمراء (مسافة عمل 2.4 مم) ، HC PL Apo 40x / 1.25 GLYC (مسافة عمل 0.35 مم) أو على الأقل NA = 0.4 أو أعلى لأهداف الهواء. يعتمد اختيار التكبير ومسافة العمل على طبيعة وحجم العينة المصورة وإشارات التألق المقاسة (السطوع ، العائد الكمي ، كفاءة التلوين ، انظر على سبيل المثال ، مناقشة الأصباغ والجسيمات النانوية53). تتطلب الأجسام الكبيرة (الأجسام الكروية أو العضوية ، >حجم 500 ميكرومتر) ، أو "المفاعل الحيوي" أو رقائق الموائع الدقيقة أهدافا طويلة لمسافة العمل وتكبيرا أقل ، بينما يتطلب تحليل الخلايا الفردية أو عضيات الخلية تكبيرا عاليا ، وغالبا ما يتحقق ذلك عن طريق التصوير "الفسيفساء". - قم بإعداد طبق الفحص المجهري مع كرويات على المسرح. اضبط التركيز وابحث عن كائن / منطقة اهتمام (ROI).
ملاحظة: إذا كان يجب العثور على أشياء صغيرة أو فلورية ضعيفة أو ضعيفة التباين أو نادرة وكان العثور على التركيز صعبا ، فمن المستحسن التركيز المسبق على جدران طبق الفحص المجهري و "غربلة" السطح بحثا عن الكائن محل الاهتمام بواسطة السربنتين ، بدءا من أحد أركان البئر. - اختر نافذة فتح المشروع وانقر فوق الرمز المقابل ، إنشاء مشروع جديد. أعط اسما قياسيا (على سبيل المثال ، بدءا من "وصف YY-MM-DD +") إلى ملف مشروع البحث. أثناء التصوير ، سيتم حفظ جميع الصور المنتجة تلقائيا في ملف .lif للمشروع الذي تم إنشاؤه.
- افتح نافذة الاستحواذ . اضبط الطول الموجي لإثارة ليزر الضوء الأبيض (WLL) والنطاق المطلوب من كاشفات المسح الهجين أو الرنين (نوع HyD S أو HyD X أو HyD R) بناء على الخصائص الطيفية المعروفة للتألق المقاس (أطياف الإثارة / الامتصاص والانبعاث). اختر أنواع الخط أو الإطار للمسح الضوئي.
ملاحظة: بالنسبة لمعظم الأصباغ الفلورية المتاحة تجاريا، يمكن العثور على الخصائص الطيفية (أو إضافتها) في حزمة LAS X Dye Assistant. اختر الكاشف ذو نطاق حساسية الأطياف المناسب المتوافق مع الخصائص الطيفية للمسبار ، وفي حالة FLIM ، متوافق مع عد الفوتون (أي HyD X أو HyD R). بالنسبة للتصوير متعدد المعلمات ، اضبط WLL في مواضع إثارة متعددة (على سبيل المثال ، للتصوير المتزامن ل FAD / Flavins وقناتين مضان لمسبار MMIR1 O2 النسبي - مرجعي وحساس ، قد تكون إعدادات الإثارة / الانبعاث 460 نانومتر / 510-590 نانومتر HyD X1 و 614 نانومتر / 631-690 HyD X3 و 724-800 نانومتر HyD R وفقا لذلك في تسلسل مسح تسلسلي واحد أو اثنين). من المهم تعيين الكاشف المناسب لجمع الانبعاثات ، حيث يمكن أن يكون للكاشفات حساسية طيفية مختلفة54. - (اختياري ل FLIM) في نافذة الاستحواذ ، اختر وضع FLIM لإجراء التصوير جنبا إلى جنب مع عد الفوتون (مجموعة الاضمحلال). على الفور ، سيتم فتح "وحدة FLIM إضافية في برنامج LAS X" للتنقل وتحليل بيانات FLIM.
- (اختياري ل FLIM) اختر معدل تكرار نبض WLL بناء على متوسط عمر الفلوروفور المتوقع.
ملاحظة: يجب ضبط تردد نبضة الليزر لجمع الاضمحلال الفلوري الكامل. يمكن القيام بذلك باستخدام ميزة Pulse Picker المثبتة على المجهر. سيؤدي تداخل اضمحلال التألق مع نبضة الليزر إلى تقصير عمر التألق المقدر. يوصى بفترات نبضية أطول من 4-5 مرات من متوسط عمر التألق المتوقع (على سبيل المثال ، 25 نانوثانية / 40 ميجاهرتز لعمر يصل إلى 5 نانوثانية). العديد من أجهزة الليزر النبضية لها معدل تكرار ثابت 80 ميجاهرتز (مثالي فقط لنطاق يصل إلى 2-3 نانوثانية). هذا مهم لاختيار الفلوروفورات الصحيحة للتجربة. - ابدأ معاينة التصوير باستخدام وضع FAST LIVE واضبط التركيز البؤري الدقيق لكائن التصوير على قسم مهم.
تنبيه: اتبع بدقة قواعد سلامة الليزر. ضع في اعتبارك دائما قواعد سلامة الليزر وانتظر حتى يتوقف التصوير قبل تشغيل ضوء الإرسال أو النظر إلى العدسة أو العينة.
ملاحظة: في وضع FAST LIVE ، يتم تطبيق مسح ضوئي عالي السرعة يبلغ 600 هرتز (يتوافق مع الحد الأقصى لمعدل الإطارات 4.43/s في حالة استخدام وضع المسح الضوئي X ثنائي الاتجاه)، ودقة 256 × 256 بكسل تلقائيا على الصورة للحفاظ على التألق في مأمن من التبييض الضوئي. افتح الثقب (على سبيل المثال ، إلى 3-4 AU) و / أو قم بزيادة شدة الليزر إذا كانت إشارة التألق ضعيفة جدا بحيث لا يمكن التركيز على الجسم. تجنب جمع الاضمحلال غير الكامل. - (اختياري ل FLIM) من خلال النظر إلى الرسم البياني لشدة البكسل الذي يظهر أثناء التصوير في نافذة وحدة FLIM (الوضع المباشر ) ، اضبط شدة الليزر / حجم الثقب المناسب والدقة لتحقيق معدل العد ~ 1 حد نبضة الفوتون / الليزر (الخط الأحمر). تجنب الذهاب أعلى بكثير من 1 لاستبعاد خطر تأثير التراكم. إذا لزم الأمر ، اضبط معدل تكرار نبضة WLL للحصول على مجموعة اضمحلال كاملة في نافذة اضمحلال (لتجنب تجميع الاضمحلال غير الكامل ، انظر الخطوة 2.2.8).
ملاحظة: إذا كان عدد الفوتونات (الشدة) غير كاف لإعادة بناء اضمحلال موثوق به لتحليل التركيب أو سحابة مخطط الطور ، فقم بتطبيق عدة تكرارات مسح (إطارات أو خطوط ، أو قم بإعداد وقت المسح) ، وقم بزيادة كثافة الليزر و / أو التضحية بالدقة (حجم عائد الاستثمار الممسوح ضوئيا). كن على علم بأن تقليل معدل تكرار الليزر يتطلب جمع المزيد من الفوتونات لإعادة بناء الاضمحلال بشكل موثوق ، وقد تكون هناك حاجة إلى تصحيح إضافي لمعلمات التصوير. كن على دراية بالتأثير المحتمل للضوء الشديد والإضاءة المستمرة الطويلة على صلاحية الخلية والتمثيل الغذائي55. يمكن أن يكون التأثير السلبي على الجدوى والتمثيل الغذائي مختلفا في كل حالة على حدة ، اعتمادا على شدة ضوء الإثارة ومدته وطوله الموجي ، بالإضافة إلى طريقة التصوير (على سبيل المثال ، التصوير أحادي الفوتون مقابل التصوير متعدد الفوتونات). اضبط معلمات التصوير وفقا لذلك ، وإذا لزم الأمر ، تحكم في صلاحية / موت الخلية بواسطة Calcein Green-AM أو كثافة يوديد البروبيديوم في التجارب التجريبية56. حيثما أمكن ، ينبغي النظر في مزيد من التحسينات لبروتوكول تلطيخ مسبار التألق للوصول إلى إشارة مضان كافية أثناء الفحص المجهري الحي. - (اختياري لمكدس z 3D) أثناء وجودك في Fast Live ، قم بتعيين الإحداثيات واتجاه المسح الضوئي ونسبها إلى البداية والنهاية في نافذة Z-stack (وضع المسح الضوئي XYZ). اختر حجم الخطوة Z أو عدد الخطوات.
ملاحظة: بينما يقوم البرنامج تلقائيا بحساب العدد "الأمثل" من الخطوات ، بناء على الدقة المستخدمة ومعلمات المسح الضوئي ، يمكن أن تتطلب إعادة البناء ثلاثية الأبعاد الحية عادة عددا أقل من الخطوات لتحقيق اكتساب سريع ، على سبيل المثال ، حجم خطوة 1-2 ميكرومتر ، حجم مكدس 50-100 ميكرومتر ، مسح ثنائي الاتجاه ، يتطلب 2-3 دقائق من إجمالي وقت المسح. كن على علم بأن العضيات تحت الخلوية والخلايا ونموذج الخلية 3D يمكن أن تتحرك أيضا أثناء القياسات. بالإضافة إلى ذلك ، نظرا لعمق اختراق الضوء وحدود التشتت ، يمكن عادة تحقيق عمق مسح 50-100 ميكرومتر فقط على FLIM متحد البؤر. - عند تطبيق جميع الإعدادات اللازمة ، ابدأ التصوير.
- أعط الصورة اسما مناسبا.
- ابحث عن كائن التصوير التالي في وضع ضوء الإرسال وكرر إجراء التصوير باستخدام إعدادات التصوير المحسنة مسبقا (الخطوات 2.2.8-2.2.12).
ملاحظة: بالنسبة للمقارنة القائمة على الشدة أو تحليل نسبة الشدة (على سبيل المثال ، تحليل الأوكسجين القائم على مسبار MMIR O2 ) ، احتفظ دائما بنفس إعدادات التصوير لجميع الكائنات التي تم تحليلها (التكبير ونوع العدسة الموضوعية ، وشدة الليزر ، وتردد الطاقة والنبضة ، والطول الموجي للإثارة ، ونطاق الكاشفات ، والثقب ، وسرعة المسح ، ووقت مكوث البكسل ودقته). ومع ذلك ، نظرا لأن عمر التألق لا يعتمد على شدة التألق ويتطلب عددا مناسبا من الفوتونات التي سيتم جمعها لحساب موثوق به ، يمكن إعادة ضبط معلمات التصوير FLIM خلال التجربة للحفاظ على أرقام الفوتونات المجمعة قابلة للمقارنة بين العلاجات المختلفة أو الظروف التجريبية. لذلك ، بالنسبة للتحليل متعدد المعلمات حيث يلزم إجراء تحليل قائم على الشدة والتحليل القائم على العمر الفلوري ، يجب تطبيق إعدادات التصوير العالمية المحسنة لجميع الكائنات في المجموعات التجريبية المقارنة. بالنسبة للمقارنة "FLIM فقط" ، من الممكن مقارنة الصور التي تم الحصول عليها بإعدادات تصوير مختلفة قليلا حيث يوفر برنامج LAS X حساب IRF لقياس الصورة الفردية42. ومع ذلك ، بالنسبة لتحليل FLIM المناسب خارج LAS X (على سبيل المثال ، FLIMfit45) ، يجب قياس وظيفة استجابة الجهاز (IRF) لكل حالة تصوير مختلفة ، حيث لا يمكن تصديرها من برنامج التصوير. وبالتالي ، من أجل بساطة التصميم التجريبي وعبء العمل ، يوصى بتطبيق نفس إعدادات التصوير لجميع الصور في مجموعة البيانات. بعد ذلك ، يمكن إجراء قياسات IRF المقابلة باستخدام الفلوروفورات المروية أو الفلورية السريعة مدى الحياة (ضمن نطاق ps) مع خصائص الانبعاث للقناة الطيفية المقاسة57،58،59 ، بواسطة تلألؤ جسيمات الذهبالنانوية 60 أو عن طريق إشارة الجيل التوافقي الثاني للفوتونات المتعددة FLIM61. في برنامج LAS X ، يمكن تحميل معلمات التصوير المحسنة مسبقا لمشروع جديد بالنقر بزر الماوس الأيمن على الملف محل الاهتمام واختيار تطبيق إعدادات الصورة. - عند الانتهاء من جلسة التصوير ، احفظ مشروع التصوير. لإنهاء جلسة التصوير ، قم بإزالة العينة من مرحلة الفحص المجهري وتنظيف الهدف من سائل الغمر (إذا تم استخدامه) وفقا للإجراء القياسي المطبق في مرفق التصوير. أغلق المشروع والبرنامج. قم بإيقاف تشغيل المجهر والليزر وجميع الأجهزة المتصلة.
- تابع تحليل بيانات التصوير (الخطوة 2.3).
- قم بتشغيل وحدة التحكم في درجة الحرارة قبل 30-60 دقيقة من التصوير. اضبط السرعة اللازمة للتهوية ودرجة الحرارة (35-37 درجة مئوية).
- معالجة الصور NAD (P) H / FAD-FLIM مع وحدة LAS X FLIM وفيجي
ملاحظة: يصف البروتوكول تحليل عمر مضان للكرويات المصورة لبيانات مجال التردد على أمثلة من NAD (P) H و FAD / Flavins autofluorescence FLIM. أصبح قياس التألق الذاتي NAD (P) H معيارا ذهبيا لتحليل التمثيل الغذائي ، حيث ترتبط مكونات عمر التألق الذاتي NAD (P) H القصيرة والطويلة بتحلل السكر أو الفسفرة التأكسدية (OxPhos) ، على التوالي. يمكن تحليل ذلك من خلال التحول على مخطط طوري على طول المسار الأيضي نحو المعايير المقاسة ل NAD (P) H الحر أو NAD (P) H المرتبط بالبروتين31,62. لتحليل مسار التحول الأيضي ، وكذلك لمقارنة موضع سحب الطور (انظر الملاحظة أدناه الخطوة 2.3.6) على مخطط بين المجموعات التجريبية ، تم تنفيذ تحليل إحداثيات طور مبسط ، بناء على حساب المركز الهندسي (centroid) لسحابة الطور29. يوضح البروتوكول الموصوف حساب إحداثيات النقطه الوسطى في فيجي وقياس المسافة بين نقطتين على مخطط طوري باستخدام الإحداثيات (على سبيل المثال ، المسافة من السنترويد لسحابة الطور الكروية NAD (P) H ذاتية التألق إلى نقطة نظرية "NAD (P) H" الحرة). وبالمثل ، يمكن تحليل FAD وإشارات التألق الذاتي الأخرى. مجموعة بيانات 1 مع .lif (يلزم وجود برنامج LAS X) أو .ptu يتم توفير تنسيقات الملفات لتعلم هذا الإجراء (الملف التكميلي 2, الملف التكميلي 3, الملف التكميلي 4, الملف التكميلي 5, الملف التكميلي 6, الملف التكميلي 7, الملف التكميلي 8, الملف التكميلي 9, و الملف التكميلي 10).- افتح وحدة FLIM في LAS X ، وحدد فتح المشروع ، وقم بتحميل ملف الصورة الكروية (.lif) لتحليل NAD (P) H / FAD للتألق الذاتي.
ملاحظة: نظرا للأخطاء المحتملة وفقدان البيانات الوسيطة في وحدة FLIM ، استخدم نسخة من ملف الصورة الكروية الأصلي (.lif) لتحليل NAD (P) H / FAD ، مع الحفاظ على الملف الخام دون تغيير. - حدد صورة واحدة وانتقل إلى واجهة تحليل FLIM. انقر فوق Phasor للوصول إلى مخطط phasor وتنشيط وضع تحليل الطور. قم بتطبيق المرشح (الوسيط أو المويج) واضبط العتبة لتقليل الضوضاء وتحسين رؤية البيانات لجميع تحليلات الطور. اختر التوافقيات. لتحليل التحول الأيضي بناء على بيانات NAD (P) H ، تابع الخطوات 2.3.3-2.3.5. للمقارنة العامة لمخططات الطور ، انتقل من الخطوة 2.3.6.
ملاحظة: قم بتطبيق إعدادات التحليل (نوع المرشح ، والتوافقيات ، والعتبة ، والتجميع ، وعائد الاستثمار على الطور) بالتساوي على جميع الصور في مجموعة بيانات مقارنة. - (اختياري لتحليل NAD (P) H) اختر أي صورة متعلقة بمجموعة البيانات واستخدم خيار مؤشر نسبة الرسم لمكونين لتحديد موقع موضع 0.45 نانوثانية بدقة على دائرة عالمية لمساحة مخطط طور قياسي. سيتم تعيين هذا الموضع لمتوسط عمر مضان لمحلول متجانس نقي من NAD (P) H ، والذي عادة ما يكون قريبا من الاضمحلال الأسيالأحادي 62.
ملاحظة: Free-NADH و Free-NAD (P) H لهما خصائص طيفية متشابهة وقيم مماثلة لعمر التألق في محلول الماء ، مع مكونين قصيرين العمر ، 0.3 نانوثانية و 0.7 نانوثانية63. وبالتالي ، من أجل بساطة التحليل القائم على الطور وبسبب الاختلاف البسيط بين مكونات العمر ، يتم قبول اضمحلال الفلورة الخاص بهم ليكون أحادي الأس ، مما يسمح بتخصيص سحابة الطور على دائرة عالمية. يمكن أيضا قياس متوسط العمر المرجعي لشكل NAD (P) H الحر ورسمه في فضاء الطور لإجراء تحليل مماثل. تم اختيار العمر المرجعي بناء على الأدبيات62 ؛ لاحظ أنه في مصادر أخرى ، يمكن العثور على قيمة مختلفة قليلا ل NAD (P) H الحر في المحلول (0.4 ns64). - (اختياري لتحليل NAD (P) H) قم بتصدير مخطط الطور مع عمر NAD (P) H المجاني المخصص (انظر الخطوة 2.3.3) بالنقر بزر الماوس الأيمن على قطعة الأرض وتحديد تصدير البيانات. تصدير مخطط phasor كملف بتنسيق .tiff إلى مجلد تخزين معين.
ملاحظة: حجم البكسل الأصلي لصورة مخطط الطور المصدرة من وحدة LAS X FLIM هو دائما 1024 × 600 بكسل. إذا تم استخدام برنامج آخر لتصدير البيانات والتحليل المسبق ، فتأكد من تصدير جميع صور مخطط الطور بنفس الحجم والدقة. - لتصدير سحابة phasor ذات الصلة بالكرة ، استخدم أداة Draw Cursor في وحدة LAS X FLIM لاختيار عائد الاستثمار الكروي على الصورة. تصدير مخطط المرحلة الذي تم إنشاؤه كما هو موضح في الخطوة 2.3.4.
ملاحظة: سيتم تعيين إحداثيات g و s المقابلة (على غرار x و y) لمساحة الطور لكل بكسل من عائد الاستثمار المختار ، وفقا لعمرها الافتراضي ، وتحويلها إلى مجموعة بيانات مجال التردد64,65. ستشكل مجموعة وحدات البكسل ذات القيم المتشابهة tf (عمر الطور) و tm (عمر التعديل) نمطا سحابيا (سحابة الطور) على مخطط ، حيث يعكس الترميز اللوني (مع نطاق من الأزرق الغامق إلى الأحمر) وفرة قيم العمر. من خلال موضع السحابة على دائرة عالمية أو داخلها ، يمكن تمييز الاضمحلالات الأحادية أو المتعددة الأسية. تظهر بعض وسائط القياس مضانا قويا (تلقائيا) ، مما يؤدي إلى ظهور سحابة مقابلة على مخطط طوري ، والذي لا يمكن إزالته ببساطة باستخدام عتبة الشدة. سيؤثر هذا النمط على حساب إحداثيات النقطه الوسطى ويجب استبعاده من مخطط الطور المصدر. يسمح العمل مع عائد الاستثمار الكروي باستبعاد وحدات البكسل غير ذات الصلة من تحليل المرحلة الإضافي. - كرر إجراء تصدير مخطط الطور لجميع عائد الاستثمار الكروي في مجموعة بيانات (انظر الخطوتين 2.3.4 و2.3.6). بالإضافة إلى ذلك، تحقق من مجموعة الصور .tiff المصدرة لضمان مجموعة البيانات الكاملة لمزيد من التحليل المقارن والتأكد من أن جميع الصور المصدرة لها نفس حجم البكسل (انظر الملاحظة في الخطوة 2.3.4).
ملاحظة: في هذه المرحلة من البروتوكول ، يجب أن تتضمن مجموعة الصور phasor مع موقع NAD (P) H المجاني (استنادا إلى الأدبيات أو البيانات التي تم الحصول عليها تجريبيا) وجميع مخططات الطور الكروية ROI (أو أنماط عائد الاستثمار البديلة إذا لزم الأمر للتحليل المحدد). من هذه الخطوة ، سيتم إجراء مزيد من التحليل في فيجي وبعد ذلك في جدول بيانات. باستخدام نافذة أداة التحليل ، قم بتعيين خيار المقياس في FIJI ، وتأكد من معايرة جميع صور رسم الطور بنفس نوع الوحدة ، على سبيل المثال ، بالبكسل فقط. إذا لم يكن الأمر كذلك ، فقم بتعيين طول الوحدة في نافذة Set Scale للوحدة المختارة (على سبيل المثال ، للمقياس المستند إلى البكسل ، ضع 1 في حقل المسافة بالبكسل واضبط وحدة الطول على Pixel). لمزيد من المقارنة ، قم بقياس جميع البيانات المصدرة باستخدام نفس نوع الوحدة. - (اختياري لتحليل NAD (P) H) تحديد موضع نقطة البكسل لمتوسط عمر مضان NAD (P) H حر على صورة مخطط الطور المصدرة المقابلة (انظر الخطوة 2.3.3): افتح صورة الطور باستخدام FIJI ، وقم بتكبير الصورة لتصور بوضوح بدقة بكسل التقاطع بين نصف الدائرة العالمية وخط مؤشر النسبة لمكونين ؛ استخدم أداة عائد الاستثمار المستطيل لتحديد التقاطع.
ملاحظة: تأكد من أن التحديد المستطيل عبارة عن منطقة صغيرة حول نقطة التقاطع لتحديد إحداثياتها بدقة في الخطوة التالية (الخطوة 2.3.9). - (اختياري لتحليل NAD (P) H) افتح أداة التحليل ، واختر نافذة ضبط القياسات ، وحدد Centroid كمعلمة قياس. انقر فوق قياس في نافذة أداة التحليل لتحديد إحداثيات النقطه الوسطى للنقطة المرجعية المجانية NAD (P) H. تصدير هذه الإحداثيات إلى جدول بيانات.
ملاحظة: سيتم استخدام إحداثيات FREE-NAD (P) H كنقطة مرجعية لمقارنة المسافات من هذه النقطة إلى موقع سحابة الطور الكروي في مجموعة بيانات (طريقة توصيف التحول الأيضي بين تحلل السكر و OxPhos في تحليل التألق الذاتي NAD (P) H FLIM) - باستخدام فيجي ، افتح صورة سحابة الطور الكروية. افتح أداة نافذة الصورة، اختر ضبط، وحدد عتبة اللون في شريط الأدوات. حدد طريقة العتبة التي تختارها (على سبيل المثال ، Otsu) ، وقم بتعيين قيمة Hue وقيمة السطوع لتضييق المعلمات لاختيار جزء سحابة الطور مع إحداثيات البكسل الأكثر وفرة. انقر فوق تحديد لتحديد منطقة الكتلة.
ملاحظة: احتفظ بنفس معلمات العتبة لجميع صور مخطط الطور ، والتي يجب تحليلها. بالنسبة لبيانات NAD (P) H-FLIM المقدمة ، تم اختيار طريقة العتبة Otsu مع مجموعة Hue Value 9 وقيمة السطوع 160 وتطبيقها على جميع صور phasor. بدلا من ذلك ، يمكن نسخ المنطقة المحددة إلى ROI Manager (اتبع المسار تحرير > التحديد > إضافة إلى المدير) لإنشاء مكتبة من عائد استثمار المرحلة لمزيد من التحليل. - مع الاحتفاظ بالتحديد ، احسب إحداثيات النقطه الوسطى للمنطقة المحددة باتباع الإجراء الموضح في الخطوة 2.3.9. تصدير هذه الإحداثيات إلى ملف جدول البيانات.
- كرر الخطوتين 2.3.9 و2.3.10 لتحديد إحداثيات النقطه الوسطى لجميع صور مرحلة عائد الاستثمار لإنشاء مجموعة بيانات في جدول البيانات.
ملاحظة: يساعد استخدام مكتبة عائد الاستثمار لمدير عائد الاستثمار على تبسيط تحليل عائد الاستثمار وتنظيمه (راجع الخطوة 2.3.10) - (اختياري لتحليل NAD (P) H) افتح جدول البيانات باستخدام إحداثيات NAD(P)H وعائد الاستثمار الكروي المرجعي المصدر من مجموعات مقارنة مختلفة. احسب المسافة بين كل نقطة مركزية كروية فردية للإشارة إلى موضع NAD (P) H الحر باستخدام الإحداثيات المحددة والمعادلة التالية:
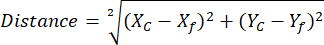
حيث ، Xc و Yc هي إحداثيات مركزية ، Xf و Yf هي الإحداثيات المرجعية.
ملاحظة: تطبيق معلمة centroid لتحديد التحول نحو العمر المرجعي مناسب فقط في حالة وجود جميع centroids من مجموعة بيانات على نفس المسار الخطي نحو النقطة المرجعية. للتحقق من ذلك ، يجب رسم جميع نقاط centroid من مجموعة البيانات مع النقطة المرجعية في نفس مساحة الإحداثيات ، ويجب إجراء محاذاة الاتجاه الخطي. إذا كان معامل R2 لخط الاتجاه الخطي المرسوم عبر جميع النقاط قريبا من 1 (على سبيل المثال ، R2 هو 0.8-0.99) ، يفترض أن يكون تحليل المسافة مناسبا. - تنظيم جميع البيانات وفقا للمقارنة وإجراء التحليل الإحصائي باستخدام أي برنامج مطابق (على سبيل المثال ، Origin ، MatLab). اختيار الاختبار الإحصائي المناسب وفقا لخصائص مجموعة البيانات (التوزيع الطبيعي ، عدد الوحدات الإحصائية ، إلخ).
ملاحظة: لتحليل NAD (P) H ، قارن قيم المسافة لتوصيف التحول الأيضي اعتمادا على الظروف التجريبية. لمقارنة أي مخططات طور بين المجموعات التجريبية ، قم بإجراء مقارنة إحداثيات سنترويدات سحابة ROI.
- افتح وحدة FLIM في LAS X ، وحدد فتح المشروع ، وقم بتحميل ملف الصورة الكروية (.lif) لتحليل NAD (P) H / FAD للتألق الذاتي.
Access restricted. Please log in or start a trial to view this content.
النتائج
اختيار طريقة تكوين كروية مناسبة
يمكن أن تؤثر طريقة تكوين الكرة المختارة بشكل كبير على حجم الكرات وشكلها وكثافة الخلية وصلاحيتها وحساسية الدواء (الشكل 2). في السابق ، تمت مقارنة تأثيرات العديد من الطرق عالية الإنتاجية (SphericalPlate 5D ، والقوالب الدقيقة المصنوعة في الم...
Access restricted. Please log in or start a trial to view this content.
Discussion
أصبحت الكرات متعددة الخلايا طريقة مفضلة في دراسات البيئات الدقيقة المتخصصة للأورام والخلايا الجذعية ، واكتشاف الأدوية ، وتطوير "لبنات بناء الأنسجة" للتصنيع الحيوي. يمكن أن تحاكي البنية الداخلية غير المتجانسة للكرويات وتدرجات العناصر الغذائية والأوكسجين تلك الموجودة في الأنسجة والأورا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
لا شيء للكشف عنه.
Acknowledgements
وحظي هذا العمل بدعم من منح صندوق البحوث الخاصة (BOF) المقدم من جامعة غنت (BOF/STA/202009/003; BOF / IOP / 2022/058) ، ومؤسسة الأبحاث فلاندرز (FWO ، I001922N) والاتحاد الأوروبي ، fliMAGIN3D-DN Horizon Europe-MSCA-DN No. 101073507.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | Also available from Sigma |
| 10 mL serological pipets | VWR | 612-3700 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 12 well cell-culture plates, sterile | Greiner bio-one | 665-180 | Similar products are also available from Sarstedt, Corning and other companies. |
| 12 Well Chamber slide, removable | Ibidi | 81201 | Also available from Grace Bio-Labs, ThermoFisher Scientific and others |
| 15 mL centrifuge tubes | Nerbe plus | 02-502-3001 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 3D Petri Dish micromolds | Microtissue | Z764000-6EA | |
| 6 well cell-culture plates, sterile | Greiner bio-one | 657160 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 70% ethanol | ChemLab | CL02.0537.5000 | |
| Biofloat | Sarstedt | 83.3925.400 | Commercial available coated 96-well plate for spheroid formation |
| Calcein Green-AM | Tebubio | AS-89201 | Apply in dilution 1:1000 |
| CellSens Dimension software | Olympus | version 3 | |
| Collagen from human placenta, type IV | Sigma | C5533 | For the preparation of 0.07 mg/mL Collagen and 0.03 mg/mL Poly-D-lysine coated microscopy dishes |
| Confocal FLIM Microscope | Leica Microsystems | N/A | Stellaris 8 Falcon inverted microscope with white-light laser, HyD X detectors, climate / T control chamber (OkoLab), 25x/0.95 W objective |
| D(+)-Glucose | Merck | 8342 | Prepare 1 M stock solution, 1:100 for preparation of imaging medium (final concentration 10 mM) |
| Dulbecco's modified Eagle's medium (DMEM), phenol red-, glucose-, pyruvate- and glutamine-free | Sigma-Aldrich | D5030-10X1L | For preparation of imaging medium |
| Fetal Bovine Serum (FBS) | Gibco | 10270-098 | Also available from Sigma. Needs to be heat-inactivated before use. |
| HEPES (1M) | Gibco | 15630-080 | Dilution 1/100 for preparation of imaging medium (final concentration 10 mM) |
| Human colon cancer cells HCT116 | ATCC | ||
| ImageJ | NIH | version 1.54f | |
| Leica Application Suite X (LAS X) | Leica Microsystems | version 4.6.1.27508 | |
| L-glutamine | Gibco | 25030 | Also available from Sigma. Apply in dilution 1:100. |
| Lipidure-CM5206 | Amsbio | AMS.52000034GB1G | |
| McCoy's 5A, need addition of 1 mM Sodium Pyruvate and 10 mM HEPES | VWR | 392-0420 | Standard growth medium for HCT116 cells |
| micro-patterned 3D-printed PDMS stamps | N/A | N/A | Provided by the Centre for Microsystems Technology, Professor Dr. Jan Vanfleteren, Ghent University |
| NaCl | Chemlab | CL00.1429.100 | |
| Neubauer couting chamber | Fisher Scientific | 15980396 | |
| O2 probes: MMIR1 | N/A | N/A | Full characterization, validation and some applications can be found at: https://www.biorxiv.org/content/10.1101/2023.12.11.571110 v1 |
| PBS | Fisher scientific | Gibco18912014 | Dissolve PBS tablet in 500 mL of distilled water. |
| Pen Strep :Penicillin (10,000 U/mL) / streptomycin (10,000 μg/mL) 100x solution | Gibco | 15140-122 | Also available from Sigma. Apply in dilution 1:100. |
| Poly-D-lysine | Sigma | P6407-5mg | For the preparation of 0.07 mg/mL Collagen and 0.03 mg/mL Poly-D-lysine coated microscopy dishes |
| Propidium Iodide | Sigma-Aldrich | 25535-16-4 | Cell death staining, use 1 µg/mL at 1h incubation |
| PVDF syringe filter 0.22 µm | Novolab | A35149 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Sodium pyruvate (100 mM) | Gibco | 11360-070 | Dilution 1/100 for preparation of imaging medium (final concentration 1mM) |
| SphericalPlate 5D 24-well | Kugelmeiers | SP5D-24W | |
| sterile petridish | Greiner bio-one | 633181 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Tissue culture flask (25 cm² ) | VWR | 734-2311 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Tissue culture flask (75 cm²) | VWR | 734-2313 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| U-bottom 96-well plate | VWR | 10062-900 | Similar products are also available from Sarstedt, Corning, Greiner Bio-one and other companies |
| Ultrapure Agarose | Invitrogen (Life Technologies) | 16500-500 | Other types of Agarose such as Agarose low melting point (A-9414, Sigma), Agarose for routine use (A-9539, Sigma) |
| Widefield fluorescence inverted microscope | Olympus | N/A | Inverted fluorescence microscope IX81, with motorised Z-axis control, CoolLED pE4000 (16 channels, 365-770 nm), ORCA-Flash4.0LT (Hamamatsu) cMOS camera, glass warming plate Okolab, CellSens Dimension v.3 software and air objectives 4x/0.13 UPlanFLN and 40x/0.6 LUCPlanFLN. (Optional, for high-resolution imaging) 60x/1.0 LUMPLFLN water |
References
- Foty, R. A simple hanging drop cell culture protocol for generation of 3d spheroids. J Vis Exp. (51), e2720(2011).
- Moskovits, N., et al. Establishing 3-dimensional spheroids from patient-derived tumor samples and evaluating their sensitivity to drugs. J Vis Exp. (190), e64564(2022).
- Griner, L. M., et al. Generation of high-throughput three-dimensional tumor spheroids for drug screening. J Vis Exp. (139), e57476(2018).
- Qian, Y., Wei, X., Chen, K., Xu, M. Three-dimensional acoustic assembly device for mass manufacturing of cell spheroids. J Vis Exp. (200), e66078(2023).
- He, H., et al. Dynamic formation of cellular aggregates of chondrocytes and mesenchymal stem cells in spinner flask. Cell Prolif. 52 (4), e12587(2019).
- Perez, J. E., Nagle, I., Wilhelm, C. Magnetic molding of tumor spheroids: Emerging model for cancer screening. Biofabrication. 13 (1), 015018(2020).
- Kingsley, D. M., et al. Laser-based 3d bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomater. 95, 357-370 (2019).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Danilevicius, P., et al. laser-made 3D microscaffolds for tissue spheroid encagement. Biointerphases. 10 (2), 021011(2015).
- Jamieson, L. E., Harrison, D. J., Campbell, C. Chemical analysis of multicellular tumour spheroids. Analyst. 140 (12), 3910-3920 (2015).
- Dmitriev, R., Borisov, S., Jenkins, J., Papkovsky, D. Multiparametric imaging of tumor spheroids with ultra-bright and tunable nanoparticle O2 probes. SPIE BiOS. 9328, (2015).
- Zushin, P. -J. H., Mukherjee, S., Wu, J. C. FDA Modernization Act 2.0: transitioning beyond animal models with human cells, organoids, and AI/ML-based approaches. J Clin Invest. 133 (21), e175824(2023).
- Kim, D. -S., et al. Robust enhancement of neural differentiation from human es and ips cells regardless of their innate difference in differentiation propensity. Stem Cell Rev Rep. 6 (2), 270-281 (2010).
- Hart, D., Gutiérrez, D. R., Biason-Lauber, A. Generation of a human ovarian granulosa cell model from induced pluripotent stem cells. bioRxiv. , 2022(2022).
- Chiaradia, I., et al. Tissue morphology influences the temporal program of human brain organoid development. Cell Stem Cell. 30 (10), 1351-1367 (2023).
- Wagstaff, E. L., Ten Asbroek, A. L., Ten Brink, J. B., Jansonius, N. M., Bergen, A. A. An alternative approach to produce versatile retinal organoids with accelerated ganglion cell development. Sci Rep. 11 (1), 1101(2021).
- Thavandiran, N., et al. Design and formulation of functional pluripotent stem cell-derived cardiac microtissues. Proc Natl Acad Sci U S A. 110 (49), E4698-E4707 (2013).
- Harrison, S. P., et al. Scalable production of tissue-like vascularized liver organoids from human pscs. Exp Mol Med. 55 (9), 2005-2024 (2023).
- Noguchi, T. -A. K., Kurisaki, A. Formation of stomach tissue by organoid culture using mouse embryonic stem cells. Methods Mol Biol. 2017, 217-228 (2017).
- Takahashi, J., et al. Suspension culture in a rotating bioreactor for efficient generation of human intestinal organoids. Cell Reports Methods. 2 (11), 100337(2022).
- Lagziel, S., Gottlieb, E., Shlomi, T. Mind your media. Nat Metab. 2 (12), 1369-1372 (2020).
- Das, V., Fürst, T., Gurská, S., Džubák, P., Hajdúch, M. Reproducibility of uniform spheroid formation in 384-well plates: The effect of medium evaporation. J Biomol Screen. 21 (9), 923-930 (2016).
- Bera, K., et al. Extracellular fluid viscosity enhances cell migration and cancer dissemination. Nature. 611 (7935), 365-373 (2022).
- Michl, J., Park, K. C., Swietach, P. Evidence-based guidelines for controlling ph in mammalian live-cell culture systems. Commun Biol. 2, 144(2019).
- Okkelman, I. A., Vercruysse, C., Kondrashina, A. V., Borisov, S. M., Dmitriev, R. I. Affordable oxygen microscopy-assisted biofabrication of multicellular spheroids. J Vis Exp. (182), e63403(2022).
- Peirsman, A., et al. Mispheroid: A knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948(2016).
- Froehlich, K., et al. Generation of multicellular breast cancer tumor spheroids: Comparison of different protocols. J Mammary Gland Biol Neoplasia. 21 (3-4), 89-98 (2016).
- Debruyne, A. C., et al. Live microscopy of multicellular spheroids with the multimodal near-infrared nanoparticles reveals differences in oxygenation gradients. ACS Nano. 18 (19), 12168-12186 (2024).
- Debruyne, A. C., Okkelman, I. A., Dmitriev, R. I. Balance between the cell viability and death in 3D. Semin Cell Dev Biol. 144, 55-66 (2023).
- Barroso, M., Monaghan, M. G., Niesner, R., Dmitriev, R. I. Probing organoid metabolism using fluorescence lifetime imaging microscopy (flim): The next frontier of drug discovery and disease understanding. Adv Drug Deliv Rev. 201, 115081(2023).
- Becker, W. Fluorescence lifetime imaging-techniques and applications. J Microsc. 247 (2), 119-136 (2012).
- Dmitriev, R. I., Intes, X., Barroso, M. M. Luminescence lifetime imaging of three-dimensional biological objects. J Cell Sci. 134 (9), 1-17 (2021).
- Sarder, P., Maji, D., Achilefu, S. Molecular probes for fluorescence lifetime imaging. Bioconjug Chem. 26 (6), 963-974 (2015).
- Alfonso-Garcia, A., et al. Mesoscopic fluorescence lifetime imaging: Fundamental principles, clinical applications and future directions. J Biophotonics. 14 (6), e202000472(2021).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: Fundamentals and advances in instrumentation, analysis, and applications. J Biomed Opt. 25 (7), 1-43 (2020).
- Yellen, G. Fueling thought: Management of glycolysis and oxidative phosphorylation in neuronal metabolism. J Cell Biol. 217 (7), 2235-2246 (2018).
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomark Med. 4 (2), 241-263 (2010).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of nad (p) h and fad. Antioxid Redox Signal. 30 (6), 875-889 (2019).
- Verma, A., et al. Fluorescence lifetime imaging for quantification of targeted drug delivery in varying tumor microenvironments. bioRxiv. , 2024(2024).
- Smith, J. T., et al. In vivo quantitative fret small animal imaging: Intensity versus lifetime-based fret. Biophys Rep. 3 (2), 100110(2023).
- Alvarez, L. A., et al. Application Note: SP8 Falcon: A novel concept in fluorescence lifetime imaging enabling video-rate confocal flim. Nat Methods. , (2019).
- Roberti, M. J., et al. TauSense: A fluorescence lifetime-based tool set for everyday imaging. Nat. Methods. , https://www.nature.com/articles/d42473-020-00364-w.pdf (2020).
- Auer, J. M. T., Murphy, L. C., Xiao, D., Li, D. U., Wheeler, A. P. Non-fitting flim-fret facilitates analysis of protein interactions in live zebrafish embryos. J Microsc. 291 (1), 43-56 (2023).
- Warren, S. C., et al. Rapid global fitting of large fluorescence lifetime imaging microscopy datasets. PLoS One. 8 (8), e70687(2013).
- Gao, D., et al. Flimj: An open-source imagej toolkit for fluorescence lifetime image data analysis. PloS One. 15 (12), e0238327(2020).
- Tullis, I. D. C., Ameer-Beg, S. M., Barber, P. R., Rankov, V., Vojnovic, B. Mapping femtosecond pulse front distortion and group velocity dispersion in multiphoton microscopy. Proc. SPIE 6089, Multiphoton Microscopy in the Biomedical Sciences VI. , 60890(2006).
- Zhou, Y., et al. One-step derivation of functional mesenchymal stem cells from human pluripotent stem cells. Bio Protoc. 8 (22), e3080(2018).
- Benton, G., Arnaoutova, I., George, J., Kleinman, H. K., Koblinski, J. Matrigel: From discovery and ECM mimicry to assays and models for cancer research. Adv Drug Deliv Rev. 79-80, 3-18 (2014).
- Badea, M. A., et al. Influence of matrigel on single-and multiple-spheroid cultures in breast cancer research. SLAS Discov. 24 (5), 563-578 (2019).
- Lang, S., Sharrard, R., Stark, M., Villette, J., Maitland, N. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Barra, J., et al. DMT1-dependent endosome-mitochondria interactions regulate mitochondrial iron translocation and metastatic outgrowth. Oncogene. 43 (9), 650-667 (2024).
- Dmitriev, R. I., Papkovsky, D. B. Intracellular probes for imaging oxygen concentration: How good are they. Methods Appl Fluoresc. 3 (3), 034001(2015).
- Schweikhard, V., et al. Application Note: The power HyD family of detectors for confocal microscopy. Nat Methods. , https://www.nature.com/articles/d42473-020-00398-0 (2020).
- Alam, S. R., Wallrabe, H., Christopher, K. G., Siller, K. H., Periasamy, A. Characterization of mitochondrial dysfunction due to laser damage by 2-photon flim microscopy. Sci Rep. 12 (1), 11938(2022).
- Bush, P. G., Wokosin, D. L., Hall, A. C. Two-versus one photon excitation laser scanning microscopy: Critical importance of excitation wavelength. Front Biosci. 12, 2646-2657 (2007).
- Liu, M., et al. Instrument response standard in time-resolved fluorescence spectroscopy at visible wavelength: Quenched fluorescein sodium. Appl Spectrosc. 68 (5), 577-583 (2014).
- Szabelski, M., et al. Collisional quenching of erythrosine b as a potential reference dye for impulse response function evaluation. Appl Spectrosc. 63 (3), 363-368 (2009).
- Chib, R., et al. Standard reference for instrument response function in fluorescence lifetime measurements in visible and near infrared. Meas Sci Technol. 27 (2), 027001(2015).
- Talbot, C. B., et al. Application of ultrafast gold luminescence to measuring the instrument response function for multispectral multiphoton fluorescence lifetime imaging. Opt Express. 19 (15), 13848-13861 (2011).
- Becker, W. Recording the instrument response function of a multiphoton flim system. Becker & Hickl. , Available from: https://www.becker-hickl.com/literature/application-notes/recording-the-instrument-response-function-of-a-multiphoton-flim-system/ (2007).
- Leben, R., Köhler, M., Radbruch, H., Hauser, A. E., Niesner, R. A. Systematic enzyme mapping of cellular metabolism by phasor-analyzed label-free nad (p) h fluorescence lifetime imaging. Int J Mol Sci. 20 (22), 5565(2019).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using nadh and nadph autofluorescence. Free Radic Biol Med. 100, 53-65 (2016).
- Gottlieb, D., Asadipour, B., Kostina, P., Ung, T. P. L., Stringari, C. FLUTE: A python gui for interactive phasor analysis of flim data. Biol Imaging. 3, e21(2023).
- Malacrida, L., Ranjit, S., Jameson, D. M., Gratton, E. The phasor plot: A universal circle to advance fluorescence lifetime analysis and interpretation. Annu Rev Biophys. 50, 575-593 (2021).
- Okkelman, I., Vandenberghe, W., Dmitriev, R. Role of preconditioning with oxygen and glucose deprivation in promoting differentiation of dental pulp stem cells in 3D culture. Mol Biol Cell. 34 (2), 1212(2022).
- Park, J. H., et al. The effect of bmp-mimetic peptide tethering bioinks on the differentiation of dental pulp stem cells (DPSCs) in 3D bioprinted dental constructs. Biofabrication. 12 (3), 035029(2020).
- Pașca, S. P. The rise of three-dimensional human brain cultures. Nature. 553 (7689), 437-445 (2018).
- Dmitriev, R. I., Zhdanov, A. V., Nolan, Y. M., Papkovsky, D. B. Imaging of neurosphere oxygenation with phosphorescent probes. Biomaterials. 34 (37), 9307-9317 (2013).
- Bryanskaya, E. O., et al. High levels of FAD autofluorescence indicate pathology preceding cell death. Biochim Biophys Acta Gen Subj. 1868 (1), 130520(2024).
- Han, S. J., Kwon, S., Kim, K. S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 21 (1), 152(2021).
- Okkelman, I. A., Neto, N., Papkovsky, D. B., Monaghan, M. G., Dmitriev, R. I. A deeper understanding of intestinal organoid metabolism revealed by combining fluorescence lifetime imaging microscopy (flim) and extracellular flux analyses. Redox Biol. 30, 101420(2020).
- Gstraunthaler, G., Seppi, T., Pfaller, W. Impact of culture conditions, culture media volumes, and glucose content on metabolic properties of renal epithelial cell cultures: Are renal cells in tissue culture hypoxic. Cell Physiol Biochem. 9 (3), 150-172 (1999).
- Glickman, R. D. Phototoxicity to the retina: Mechanisms of damage. Int J Toxicol. 21 (6), 473-490 (2002).
- Golub, A. S., Pittman, R. N. Monitoring Parameters of Oxygen Transport to Cells in the Microcirculation. Quenched-Phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , The Royal Society of Chemistry. (2018).
- Nishigaki, T., Wood, C. D., Shiba, K., Baba, S. A., Darszon, A. Stroboscopic illumination using light-emitting diodes reduces phototoxicity in fluorescence cell imaging. Biotechniques. 41 (2), 191-197 (2006).
- Penjweini, R., Loew, H. G., Hamblin, M. R., Kratky, K. W. Long-term monitoring of live cell proliferation in presence of pvp-hypericin: A new strategy using ms pulses of led and the fluorescent dye cfse. J Microsc. 245 (1), 100-108 (2012).
- Carrasco Kind, M., et al. flimview: A software framework to handle, visualize and analyze flim data. F1000Research. 9, 574(2020).
- Schrimpf, W., Barth, A., Hendrix, J., Lamb, D. C. Pam: A framework for integrated analysis of imaging, single-molecule, and ensemble fluorescence data. Biophys J. 114 (7), 1518-1528 (2018).
- Chen, S. -J., Sinsuebphon, N., Barroso, M., Intes, X., Michalet, X. Optical Molecular Probes, Imaging and Drug Delivery. , Optica Publishing Group. (2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved