A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור ומיקרוסקופ הדמיה לכל החיים של תאים חיים מרובי פרמטרים (FLIM) של ספרואידים רב-תאיים
* These authors contributed equally
In This Article
Summary
במאמר זה, אנו מתארים שיטות שונות ליצירת ספרואידים רב-תאיים לביצוע מעקב אחר מיקרוסקופ תאים חיים מרובי פרמטרים. באמצעות מיקרוסקופ הדמיה פלואורסצנטי לכל החיים (FLIM), אוטופלואורסצנטיות תאית, צבעי צביעה וננו-חלקיקים, מודגמת הגישה לניתוח מטבוליזם של תאים, היפוקסיה ומוות תאי בסרטן תלת-ממדי חי (3D) ובספרואידים שמקורם בתאי גזע.
Abstract
ספרואידים סרטניים רב-תאיים הם מודל מיקרו-אגרגטים תלת-ממדי פופולרי לשחזור מיקרו-סביבה של גידולים, בדיקה ואופטימיזציה של טיפולים תרופתיים ושימוש בביו-חיישנים וננו-חיישנים בהקשר תלת-ממדי. קלות הייצור שלהם, גודלם הצפוי, הצמיחה ושיפועי החומרים המזינים והמטבוליטים שנצפו חשובים כדי לשחזר את המיקרו-סביבה התאית דמוית הנישה התלת-ממדית. עם זאת, הטרוגניות ספרואידית ושונות של שיטות הייצור שלהם יכולות להשפיע על חילוף החומרים הכולל בתאים, על הכדאיות ועל התגובה לתרופות. זה מקשה על בחירת המתודולוגיה המתאימה ביותר, בהתחשב בדרישות בגודל, שונות, צרכים של ייצור ביולוגי, ושימוש כמו מודלים תלת ממדיים של רקמות במבחנה בביולוגיה של תאי גזע וסרטן. בפרט, ייצור ספרואידים יכול להשפיע על התאמתם למיקרוסקופיות חיות כמותיות, כגון דימות מטבולי אופטי, מיקרוסקופ הדמיה פלואורסצנטית לכל החיים (FLIM), ניטור היפוקסיה ספרואידית באמצעות ננו-חיישנים, או כדאיות. כאן מוצגים מספר פרוטוקולים קונבנציונליים להיווצרות ספרואידים, המדגישים את התאמתם למיקרוסקופים חיים של שדה רחב, קונפוקלי ושני פוטונים. הדמיית המעקב לצנרת הניתוח עם FLIM אוטופלואורסצנטי מרובה, ותוך שימוש בסוגים שונים של סרטן וכדורי תאי גזע, מוצגת גם כן.
Introduction
ספרואידים רב-תאיים מייצגים קבוצה של מודלים תלת-ממדיים של רקמות המתקבלות על ידי צבירה עצמית של תאים ומציגים צורה כדורית. הם נמצאים בשימוש נרחב כדי לחקות אינטראקציה בין תאים ומטריצות תאים במבחנה ולשחזר הקשר תלת-ממדי בתוך מספר רב של מבנים שמקורם בסרטן ובתאי גזע. מספר טכניקות משמשות כדי להפחית את התקשרות התא ולקדם את הצבירה. אלה כוללים את שיטת התלייה-טיפה המסתמכת על מתח פני השטח1; שיטות דוחות התקשרות תאים כגון לוחות התקשרות נמוכים במיוחד, תבניות מיקרו ומיקרו-בארות 2,3; גישה מבוססת גלים אקוסטיים4; שיטות צבירה המושרות על ידי זרימה (צלוחיות ספינר, ביוריאקטור והתקנים מיקרופלואידים)5; היווצרות בעזרת חלקיקים מגנטיים6 ושימוש במטריצות ופיגומים סינתטיים ומבוססי ECM המקדמים צבירה 7,8,9.
במחקר, פיתוח ותיקוף של טיפולים תרופתיים חדשים, ספרואידים הם מודל אטרקטיבי בשל יכולתם לשחזר את השיפועים המוגבלים בדיפוזיה מרחבית של חומרים מזינים, תוצרי פסולת ו-O2, מה שמוביל לעתים קרובות להיווצרות ליבה נמקית, האופיינית לגידולים מוצקים10,11. מודלים מבינים אמינים ומתוחכמים יותר אלה מאתגרים את הצורך בשימוש נרחב במודלים של בעלי חיים (חוק המודרניזציה של מנהל המזון והתרופות האמריקאי (FDA) 2.012), על פי עקרון 3Rs של מחקר בבעלי חיים (החלפה, הפחתה ועידון). בנוסף לסרטן, ספרואידים מוצאים את יישומם במחקר תאי גזע. לדוגמה, לתאי גזע פלוריפוטנטיים יש את היכולת ליצור גופים עובריים (EB), אשר יכולים לשמש להתמיינות של תאי גזע פלוריפוטנטיים מושרים (iPSCs) לעבר סוגי תאים מיוחדים שמאתגרים להשיג ישירות ממטופלות, כגון תאים מקדימים עצביים13 או תאי גרנולוזה בשחלות 13,14. יתר על כן, היווצרות EB היא לעתים קרובות הצעד הראשון בפיתוח מודלים אורגנואידים מורכבים יותר, למשל, עצבי15, רשתית16, לב17, כבד18, קיבה19, ואורגנואידים במעיים20. יש לקחת בחשבון גורמים הכוללים גודל, יכולת שחזור, תפוקה ויישומים במורד הזרם בעת בחירת שיטת היווצרות ספרואידים מתאימה לניסויים.
המורכבות המוגברת של תרבות תלת-ממדית יכולה להוביל לשונות גבוהה יותר בהשוואה לתרבות דו-ממדית. גורמים כגון הרכב תזונתי21, אידוי מדיה22, צמיגות23, בקרת pH24, שיטת היווצרות ספרואידים, ואפילו הזמן בתרבית25,26 יכולים לגרום לקבלת ספרואידים בעלי מורפולוגיה משתנה, גדלים, כדאיות ועמידות כימותרפית שונה27,28. מחקרים אחרונים הראו כי שיפועי חמצן ספרואידים אינם תמיד סטטיים ומושפעים משיטת היווצרות, גודל הספרואיד וצמיגות חוץ-תאית, המשפיעים על ההטרוגניות הספרואידית29. כדי לשפר את יכולת השחזור ונגישות הנתונים על ספרואידים, בסיס הידע MISpheroID פותח26, המזהה קו תאים, מדיום תרבית, שיטת היווצרות וגודל ספרואידים כמידע המינימלי לתוצאה הניתנת לשחזור. לכן, נעשתה השוואה מפורטת של מספר רב של תפוקות גבוהות (SphericalPlate 5D, מיקרותבניות מיוצרות במעבדה ותבניות מיקרו-רקמות) ושיטות חיבור נמוכות (כלומר, לוחות 96 בארות מצופות Biofloat וליפדור, שניהם נטולי פיגומים ומבוססי פיגומים) (איור 1 וטבלה 1), כולל גודל הבאר (בהינתן הערכה של גודל הספרואיד המרבי), חומרים מתכלים בשימוש, זמן הכנה והאפשרות לנטר ספרואידים מבלי להעבירם לצלחות מיקרוסקופיה. האחרון מאפשר מחקרים ארוכי טווח, בעוד ספרואידים המיוצרים בשיטות תפוקה גבוהה מביאים לעתים קרובות לניסויים בנקודות קצה. כל השיטות למעט הרשתות של 5DspheriPlate אינן מביאות אוטופלואורסצנטיות לא רצויות, ובכך מאפשרות שימוש ישיר בהן במיקרוסקופיה.
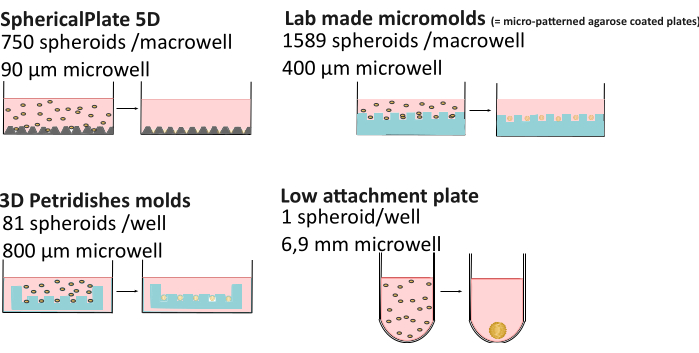
איור 1: שיטות היווצרות ספרואידים מוסברות. שיטות בעלות תפוקה גבוהה כגון SphericalPlate 5D, אשר שילבה מיקרו-בארות מוגנות בפטנט בצלחת, בעוד שהמיקרו-תבניות המיוצרות במעבדה ותבניות MicroTissue משתמשות בבולים כדי ליצור מיקרו-בארות מרובות באגרוז (כחול). לוחות בעלי חיבור נמוך כגון Lipidure (Amsbio) ו- Biofloat (Sarstedt) משתמשים בציפוי לא נדבק המעכב היצמדות לפני השטח של התא ומקדם צבירה עצמית של תאים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| 5D SpheriPlate | מיקרותבניות בייצור עצמי | מיקרו-רקמה | שיטות התקשרות נמוכות | |
| מספר ספרואידים/באר | 750 | 1589 | 81 | 1 |
| קוטר באר | 90 מיקרומטר | 400 מיקרומטר | 800 מיקרומטר | 1 מ"מ |
| נפח תרבות | 1 מ"ל | 5 מ"ל | 1 מ"ל | 200 מיקרוליטר |
| חומרים מתכלים אחרים | / | 7 מ"ל של 3% agarose | 500 μL של 2% agarose | / * |
| זמן הכנה | 10 דק' | שעתיים + 3 ימים עיבוד מדיה | 0.5 שעות + 15 דקות עיבוד מדיה | 10-30 דקות + שעה ייבוש |
| ניטור | כן | לא** | כן | כן |
| אוטופלואורסצנט | כן | לא | לא | לא |
| לשימוש חוזר | לא | כן | כן | לא** |
| עלות | €€ | € | €€€€ | €€€€: ציפוי ומטריג'ל |
| €€: צלחת מסחרית 96 בארות | ||||
| *קווי תאים מסוימים זקוקים לתוספת של ECM (כלומר 2%-5% מטריג'ל) כדי ליצור ספרואידים קומפקטיים. | ||||
| **הציפוי ניתן לשימוש חוזר עד להתרוקנות. עם זאת, כל צלחת תצרוך כמות קטנה של מדיה ואבק יכול להצטבר עם הזמן. יש צורך בעיקור מסננים באופן קבוע. | ||||
טבלה 1: השוואה בין שיטות היווצרות ספרואידים מרובים29. "ניטור": היכולת לפקח על ספרואיד ללא צורך בהעברה לצלחת מיקרוסקופיה. €: 0-50€, €€: 50-150€ , €€: 150-500€ , €€€: >500€
מיקרוסקופ פלואורסצנטי מאפשר ניטור ישיר של ההיבטים הביולוגיים המרכזיים בתוך הספרואידים, כולל מוות תאי, כדאיות, התפשטות, חילוף חומרים, צמיגות ואפילו תכונות מכניות30. מיקרוסקופ הדמיה פלואורסצנטי לכל החיים (FLIM) מספק ממד כמותי נוסף לחקר אינטראקציות של גשושיות פלואורסצנטיות בתוך סביבתן (מיקרו) 31,32,33,34, ומאפשר לפתור את ספקטרום הפליטה החופף על פי זמני חיי פליטה שונים 35,36 וחקירת חילוף החומרים בתאים בהתבסס על אוטופלואורסצנטיות תאית פנימית. לפיכך, תרכובות אוטופלואורסצנטיות תאיות נפוצות כגון ניקוטין-אמיד אדנין די-נוקלאוטיד פוספט (NAD(P)H), פלבין מונונוקלאוטיד (FMN), פלבין אדנין דינוקלאוטיד (FAD), פרוטופורפירין IX ואחרים ניתנים למדידה באמצעות FLIM של פוטון אחד או שניים ומשמשים כ"חיישנים" פנימיים של קטבוליזם גלוקוז, זרחן חמצוני (OxPhos) ומספקים סקירה כללית של מצב חמצון-חיזור התא. NAD(P)H קיים בציטופלזמה חופשית, או במיטוכונדריה37,38 הקשורות לחלבון. באופן דומה, המצב המחומצן של FAD הוא פלואורסצנטי עם אורך חיים ארוך יותר של הצורה החופשית. מיקרוסקופיות NAD(P)H ו-FAD כוללות בדרך כלל FLIM מעורר של שני פוטונים, במטרה למנוע נזק לאור מדגם39. לעתים קרובות, ניתן לשלב FLIM 'הדמיה מטבולית אופטית' עם שימוש בבדיקות מבוססות צבע, ביו-חיישנים מקודדים גנטית, מיקרוסקופ הדמיה לכל החיים של זרחן (PLIM), ומדידות מבוססות עוצמה רציומטרית על מנת לספק תמונה מלאה יותר של חילוף חומרים ספרואידי או אורגנואידים, חמצון, שגשוג וכדאיות התא 29,30,31. בנוסף, FLIM יכול גם להיות משולב עם שיטת Förster resonance energy transfer (FRET) כדי למדוד את השונות לאורך החיים של פלואורופור התורם כאשר הוא נמצא בקשר הדוק עם המקבל כדי לחקור את הקישור של תרופה עם תחום היעד שלה 33,40,41.
תמונות FLIM שנרכשו מנותחות בדרך כלל כדי לחשב את אורך החיים פיקסל אחר פיקסל. נכון לעכשיו, ישנן לפחות 3 אסטרטגיות נפוצות המשמשות להשגת אורך חיים פלואורסצנטי: 'FLIM מהיר' 42 כמותי למחצה (המכונה לעתים 'חוש טאו'43,44), התאמת עקומת דעיכה, באמצעות התאמה מעריכית אחת, שתיים או שלוש, וגישה 'ללא התאמה' עם טרנספורמציית פאזור וניתוח תרשים פאזור. בהתאם לספק, ניתן להשתמש בתוכנה המסופקת (LAS X, Symphotime, SPCImage וכו') או בתוכנת קוד פתוח (למשל, FLIMfit45, FLIMJ46 או אחרים47) לטיפול בנתוני FLIM שנמדדו. בדרך כלל, תוכנה המסופקת על ידי ספק שימושית לניתוח נתונים ראשוני, בעוד שפתרונות קוד פתוח יכולים לספק מחקרים מדויקים יותר באמצעות, למשל, תרשימי phasor והדמיה תלת-ממדית.
למרות התועלת והאטרקטיביות של FLIM כשיטה לחקר ספרואידים, מעט מאוד פרוטוקולים ניסיוניים זמינים, וקיים חוסר ידע כללי בבחירת שיטת ההיווצרות המתאימה ביותר לניסויים מוצלחים במיקרוסקופ רב-פרמטרי חי הכוללים FLIM. כאן, מוצגת השוואה מפורטת של פרוטוקולי היווצרות ספרואידים נפוצים בהתבסס על המורפולוגיה, הכדאיות והחמצון שלהם עם ננו-חיישן חישת חמצן (MMIR1) שאומת לאחרונה ואופיין לאחרונה באדום רחוק וקרוב לאינפרא אדום (NIR). הננו-חלקיק הקטיוני ספוג בשני צבעי כתב, הייחוס O2-insensitive aza-BODIPY (עירור 650 ננומטר, פליטה 675 ננומטר) ו-NIR O2-sensitive metalloporphyrin, PtTPTBPF (עירור 620 ננומטר, פליטה 760 ננומטר). MMIR1 מאפשר ניתוח בזמן אמת של שיפועי חמצן במיקרוסקופ פלואורסצנטי קונבנציונלי (באמצעות ניתוח יחסימטרי) או במיקרוסקופ חיי זרחן (PLIM) מבלי להציג רעילות תאית ומאפשר אותות יציבים, ניטור לטווח ארוך וריבוב25,29. בהתאם לצורך להכתים באמצעות צבעים או ננו-חיישנים, תפוקת ספרואידים או סוג התא, ניתן לבחור את פרוטוקול ההיווצרות המתאים ביותר. מכיוון שמחקרי הכדאיות והחמצון של ספרואידים רלוונטיים למחקרים של סרטן וספרואידים שמקורם בתאי גזע, הפרוטוקולים המוצגים כוללים גם דוגמאות ותוצאות אופייניות צפויות של NAD(P)H-FLIM ו- FAD-FLIM עם מודלים אלה. צינורות ההדמיה והניתוח המוצגים מכוונים לפלטפורמות המיקרוסקופ הפופולריות ביותר מבוססות ספירת פוטונים בודדים מבוססות ספירת פוטונים בזמן.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. דור של ספרואידים רב תאיים
- תרבית תאים
הערה: ניתן לאסוף תרביות תאים מאוסף תרביות הסוג האמריקאי (ATCC), Lonza, Sigma-Aldrich או ספקים אחרים. ATCC מספק את כל מידע הטיפול הנדרש, כולל מדיית גידול מועדפת, נהלי תת-תרבות, רמת בטיחות ביולוגית, קצב צמיחה ופרופילי STR. כאן, 500 תאים/ספרואיד של קו תאי סרטן המעי הגס האנושי HCT116 משמש במדיה 5A של McCoy (VWR, 392-0420) בתוספת 10% FBS ו 1 mM נתרן פירובט. עבור ניסויים ארוכי טווח המנוטרים מדי יום, 10 mM HEPES, pH 7.2 ניתן להוסיף לתקשורת.- גידול תרבית תאים כדי להגיע למפגש של 70%-90%.
- יש לשטוף תאים עם PBS סטרילי שחומם מראש (37°C) (5 מ"ל עבור 25 ס"מ2 או 10 מ"ל לכל 75 ס"מ2 צלוחיות).
- הוסף 0.05% טריפסין - 1 mM תמיסת EDTA (0.5 מ"ל עבור 25 סמ"ר או 1 מ"ל לכל 75 ס"מ2 צלוחיות) ודגרה במשך 5-10 דקות ב 37 ° C ב 5% CO2, 95% לחות כדי להגיע ניתוק התא.
הערה: בקרת ניתוק תאים תחת מיקרוסקופ אור השידור (שדה בהיר). חשיפת יתר של תאים לתמיסת האנזים המנתקת עלולה להשפיע על יכולת הקיום שלהם. - נטרול טריפסין על ידי הוספת מדיה עודפת של תרבית תאים המכילה 10% FBS (לפחות 5 מ"ל של מדיה לכל 1 מ"ל של תמיסת דיסוציאציה).
הערה: עבור תאים בתרבית בתרבית FBS נמוכה או מדיה ללא FBS, נטרול טריפסין יכול להיעשות עם תוספת של 0.5 מ"ל של 100% FBS לתרבית תאים שטופלה בטריפסין, ולאחר מכן צנטריפוגה כדי להעביר תאים למדיה התרבית המקורית שלהם. - נתק צברי תאים על ידי פיפטינג כדי להשיג תרחיף חד-תאי במדיה.
הערה: פיפטה עם פיפטה סרולוגית עם קצה פיפטה של 1000 μL בחלק העליון משפרת מאוד את יצירת התרחיף של תא בודד בנפח גדול של תרבית תאי תרחיף. - השתמש בתא ספירה (נויבאואר פסק המוציטומטר או חלופות) כדי לספור את מספר התא לכל 1 מ"ל של תרחיף התא.
- לדלל את השעיית התא כדי להשיג את המספר הרצוי של תאים למיליליטר.
- הוסף תמיסת בדיקה מרוכזת O2 (ננו-חלקיקים) לתרחיף התא בריכוז סופי של 10 מיקרוגרם/מ"ל לאנליזה יחסימטרית של O2.
הערה: כדי להבטיח תרחיף תאים הומוגני (עם הבדיקה), השהה מחדש מספר פעמים לפני היווצרות הספרואידים. אם הבדיקה O2 אינה נדרשת, דלג על שלב זה והמשך עם היווצרות הספרואידים. יש להחיל פרוטוקול שונה בעת טיפול בתאי גזע פלוריפוטנטיים מושרים (iPSC). בקצרה, iPSCs גדלים במושבות על לוחות מצופים Geltrex ועוברים באמצעות ReLeSR כמתואר בפרוטוקול48 שסופק על ידי הספק. ביום היווצרות הספרואידים, מושבות צריכות להיות גדולות, קומפקטיות ולהציג מרכזים רב-שכבתיים עם גבולות ברורים. יש לשטוף תאים עם PBS סטרילי שחומם מראש. הוסף 1 מ"ל של מגיב דיסוציאציה תאים עדין (GCDR) ודגור ב 37 ° C במשך 8-10 דקות. השתמש בקצה של 1000 μL כדי לנתק בעדינות תאים מהבאר ולקבל תרחיף חד-תאי. העבר תרחיף תא בודד לצינור חרוטי סטרילי של 50 מ"ל והוסף 4 מ"ל של תווך DMEM-F12 שחומם מראש כדי לנטרל את ה- GCDR. לשטוף את הבאר עם 1 מ"ל של DMEM-F12 ולהעביר אותו לשאר השעיית התא. צנטריפוגה ב 300 x גרם במשך 5 דקות. השהה מחדש ב 1 מ"ל של מדיה מתאימה לניסויים נוספים. עבור ניסויים המתוארים בכתב יד זה, mTeSR + 10 μM Rock Inhibitor שימש. לספור ולדלל את השעיית התא כדי להשיג את מספר התאים הרצוי למיליליטר.
- שיטות היווצרות ספרואידים
- 3D פטרי צלחת מיקרו-תבניות
הערה: שיטת תפוקה גבוהה זו משמשת ליצירת מספר גבוה של ספרואידים (81 ספרואידים) במערך 9 x 9 מיקרועובש בקוטר 800 מיקרומטר ובעומק 800 מיקרומטר.- שוטפים מיקרו-תבניות ליציקת צלחות פטרי תלת-ממדיות ב-dH2O ומכניסים למיכל הניתן להרכבה.
- מדדו 2 גרם של אבקת אגרוז ברמת אלקטרופורזה והכניסו אותה לבקבוק זכוכית יבש בנפח 200 מ"ל בטוח לשימוש עצמי.
הערה: יש לוודא שהבקבוק ואבקת האגרוז יבשים ללא נוזלים או לחות. - Autoclave micro-molds ליציקת צלחות פטרי 3D ובקבוקים עם אבקת agarose במשך 30 דקות על מחזור יבש.
- צור תמיסת מלח 0.9 w / v% על ידי תוספת של 0.9 גרם NaCl ב 100 מ"ל של מים טהורים במיוחד ולעקר על ידי autoclaving.
הערה: NaCl מומלץ על ידי היצרן. זה מגביר את יציבות האגרוז. - הכינו את תמיסת האגרוז על ידי הוספת המלח הסטרילי לאבקת האגרוז המעוקרת. יש להבריג את המכסה בצורה רופפת כדי למנוע הצטברות לחץ. מערבבים את הבקבוק כדי לערבב את אבקת האגרוז.
- מרתיחים וממיסים את אבקת האגרוז באמצעות מיקרוגל. עצור את המיקרוגל לעתים קרובות (~ כל 10 שניות). מערבלים את הבקבוק וחוזרים על הפעולה עד להמסת האגרוז.
זהירות: תמיסת האגרוז חמה ודורשת טיפול זהיר. טלטול מיד לאחר הליך ההתכה עלול לגרום לתמיסה להתפרץ החוצה מהכלי. כדי למנוע תאונות, יש להשתמש בכלים גדולים מספיק מלאים עד 50% מהקיבולת ולהשתמש בהגנה אישית מתאימה (כפפות, כפפת תנור, מגן עיניים ומעיל מעבדה). - תנו לתמיסת האגרוז המומסת להתקרר ל-60-70 מעלות צלזיוס. באמצעות טכניקות ותנאים אספטיים, פיפטה מותכת אגרוז לתוך מיקרו-תבנית (500 μL עבור 12 סדרות או 330 μL עבור 24 סדרות).
הערה: הימנעו מהיווצרות בועות בזמן ערבוב או פיפטציה של אגרוז. הסירו את כל הבועות הקטנות הכלואות בתווי הפנים הקטנים של המיקרו-עובש על ידי פיפטינג או גירוד עדין לפני שהאגרוז מתמצק. - נותנים לאגרוז להתמצק כ-2-3 דקות. לאחר מכן, בזהירות להגמיש את micro-mold כדי להסיר את צלחת פטרי 3D ולהעביר צלחת תרבית 12 רקמות היטב.
הערה: כיפוף יתר של המיקרו-עובש עלול להוביל להיווצרות סדקים בתוך תבנית האגרוז. - כדי לאזן את צלחת פטרי 3D, להוסיף 2.5 מ"ל / באר תרבית תאים מדיום. יש לדגור במשך 15 דקות או יותר. הסר את מדיום התרבות והחלף אותו במדיום טרי. חזור על הפעולה פעם נוספת כדי לאזן את צלחת הפטרי התלת-ממדית עם מדיום תרבית.
הערה: ניתן להפסיק את הפרוטוקול כאן עד לזריעת תאים. לאחסון לטווח ארוך (עד שבועיים ב-4°C), השתמש בתמיסת PBS במקום בינונית. - הסר לחלוטין את צלחת הפטרי התלת-ממדית המקיפה את מדיום התרבית (או PBS) והסר במדויק את המדיה בתוך צלחת הפטרי התלת-ממדית על ידי הטיית צלחת תרבית הרקמות.
- זרעו בזהירות 190 מיקרוליטר של תרחיף תאים המכיל 40,500 תאים בטיפה לתוך תא זריעת התאים (ראה שלב 1.1).
הערה: מספר הבארות הזעירות בבולי אגרוז קובע את מספר הספרואידים המיוצרים לכל בול. במקרה זה, עובש אגרוז זה מכיל 81 microwells (81 x 500 תאים / spheroid). וריאציה של ריכוז התא בתרחיף המתווסף למקרובאר מאפשרת לשנות את מספר התא לכל ספרואיד, ובכך לשלוט בגודל הספרואיד. - המתן ~ 10 דקות לתאים להתיישב בתכונות של 3D Petri dsh. לאחר מכן, להוסיף 2 מ"ל של בינוני לחלק החיצוני של צלחת פטרי 3D.
- הניחו את צלחת תרבית הרקמה באינקובטור תרביות התאים והחליפו את התווך המקיף את צלחת הפטרי התלת-ממדית לפי הצורך.
- צלחת חיבור נמוכה
הערה: שיטה זו משמשת ליצירת ספרואיד יחיד לכל באר. צלחות מצופות (Lipidure או Biofloat) זמינות מסחרית (דלג על שלבים 1.2.2.1-1.2.2.4). לחילופין, ניתן לרכוש את הציפוי בנפרד ולהשתמש בו לציפוי צלחות מרובות בארות לא מטופלות. מומלץ למלא בארות בשולי לוחות 96 בארות במים סטריליים או PBS עקב אידוי מהיר יותר בבארות אלה, ובכך להגביל את מספר הבארות לספרואידים ל-60. במקרה שיש צורך בפחות ספרואידים, מלאו את הבארות הריקות שמסביב במים או PBS. השתמש טיפים ללא אבק לטיפול בנוזלים כדי למנוע הבאת חלקיקים קטנים לתוך הבארות, כפי שהם מפריעים היווצרות הספרואידים.- הכן תמיסת ציפוי 0.5 w / v % על ידי המסת 0.25 גרם של אבקת פולימר ב 50 מ"ל אתנול במיכל בקבוק זכוכית. מסננים ומעקרים את הציפוי.
הערה: עיקור מסנן וכל השלבים הבאים צריכים להתבצע בתנאים סטריליים תחת זרימה למינרית. - הוסף 200 μL של תמיסת הציפוי לכל באר של צלחת תרבית 96 U-bottom.
- דוגרים במשך דקה ומורידים את עודפי הציפוי.
הערה: ניתן להשתמש בתמיסת הציפוי מספר פעמים. יש לאחסן במיכל זכוכית בטמפרטורת החדר (RT). מיכלי פלסטיק אינם מומלצים, מכיוון שהפלסטיק יכול להתמוסס חלקית ולהפוך לחלק מהפתרון. אם קיים אבק, יש לעקר את המסנן באמצעות מסנני מזרק פוליאתרסולפון (PES) או מזרק ניילון בגודל 0.22 מיקרומטר. - תנו לצלחת בת 96 הבארות להתייבש באוויר במשך כשעה.
הערה: אם תאים זקוקים למטריצה חוץ-תאית, המשך לשלב 1.2.3. ניתן לאחסן לוחות מצופים ב- RT כאשר הם עטופים באלומיניום עד חודש אחד. כאשר זורעים כמות נמוכה יותר של תאים / ובכן, צנטריפוגה של הצלחת במשך 5 דקות ב 300 גרם יכול לעזור למשוך את התאים למטה.
- הכן תמיסת ציפוי 0.5 w / v % על ידי המסת 0.25 גרם של אבקת פולימר ב 50 מ"ל אתנול במיכל בקבוק זכוכית. מסננים ומעקרים את הציפוי.
- פרוטוקול היווצרות חוץ-תאי בעזרת מטריצה
הערה: קווי תאים מסוימים אינם מייצרים מספיק מטריצה חוץ-תאית (ECM) בעצמם וזקוקים לתוספת של ECM כגון Matrigel, Cultrex או Geltrex כדי ליצור ספרואידים קומפקטיים 49,50,51. עבור סוגי תאים כגון סרטן השד MDA-MB-231, פפילה עורית אנושית, תאי סרטן הערמונית ועוד, ניתן להשתמש בשלב 1.2.2 עם השינויים הבאים52, הדורשים תוספת של ECM. עדיף להשתמש בטיפים נטולי אבק לטיפול בנוזלים כדי למנוע מאבק שמפריע להיווצרות הספרואידים. שלבים 1 ו-4-7 חייבים להתבצע תחת ארון בטיחות ביולוגי (Class II).- המשך בשלבים 1.2.2.1-1.2.2.4 (לוחות חיבור נמוכים) לטיפול במשטח.
- מצננים מראש את הצלחת בת 96 הבארות ב-4°C במקרר.
- הכן את הצנטריפוגה עם המתאם הנכון עבור צלחת 96 באר מראש אותו עבור 4 ° C.
- הכינו תמיסה של 5% של מטריצת קרום מרתף (BMM) במדיית תרבית תאים מקוררת מראש (4°C).
הערה: BMM מצליב במהירות קישורים ב- RT. בעת הטיפול, שמור את המלאי והפתרונות על הקרח. - הכן את מתלה התא (ראה שלב 1.1).
- הוסף 50 μL של תמיסת BMM לכל באר.
- הוסף בעדינות 50 μL של תרחיף תאים לכל באר על גבי תמיסת BMM (25,000 תאים / באר).
הערה: אין לפוצץ נפח זה לתוך הבאר, אחרת התאים יתפזרו בצידי הבארות ולא ייאספו בתחתית. ניתן להשיג מספר נמוך יותר של תאים לכל באר על ידי התאמת צפיפות התאים בהתאם. לא כל התאים ייצרו ספרואידים בכלל צפיפויות זריעה; האופטימיזציה חייבת להתבצע מסוג התא הרצוי מבחינת ממדים. עם הכרכים שסופקו, הריכוז הסופי של BMM הוא 2.5%. אם יש צורך בריכוז שונה, יש להכין את תמיסת המלאי בריכוז נמוך / גבוה יותר. - צנטריפוגה את צלחת 96 בארות במשך 5 דקות ב 300 x גרם ו 4 ° C.
הערה: ללא שלב זה, תאים אינם מצטברים כראוי בתחתית הבאר, מה שגורם להיווצרות מספר אגרגטים קטנים יותר. יש לקרר את הצנטריפוגה כדי למנוע הצלבה בשלב זה. - מניחים את הצלחת באינקובטור תרביות התא. אגרגטים נחשבים בוגרים ביום 4 לאחר הזריעה.
הערה: לקבלת פרוטוקולים נוספים על היווצרות ספרואידים, עיין בקובץ משלים 1.
- 3D פטרי צלחת מיקרו-תבניות
2. מיקרוסקופ חי של ספרואידים
- הכנת ספרואידים לניתוח הדמיה חיה
הערה: בהתאם לתכנון הניסוי (למשל, ניטור ארוך טווח או ניתוח נקודות קצה, הגדרת מיקרוסקופ או תכונות ספקטרליות של הפלואורסצנטיות הנמדדת) או עקב חוסר תאימות של שיטת ייצור הספרואידים עם המיקרוסקופ (למשל, עובי דגימה, אוטופלואורסצנטיות של החומר, ציפה של ספרואידים במהלך ההדמיה) ניטור ישיר של ספרואידים בצלחת, היכן הם הופקו, ייתכן שלא יהיה אפשרי. הפרוטוקול מסביר את הכנת הספרואידים להדמיה, המתאימים לרוב המיקרוסקופים הרחבים והקונפוקליים ההפוכים.- יש להכין ולחמם מראש (37°C) אמצעי הדמיה: DMEM בתוספת HEPES-Na, pH 7.2 (10 מ"מ), נתרן פירובט (1 מ"מ), L-גלוטמין (2 מ"מ) וגלוקוז (5 מ"מ), ללא פנול אדום.
הערה: ניתן להשתמש בסודיום ביקרבונט לבד או בשילוב עם HEPES-NA, אם בקרתCO2 מסופקת במהלך הדמיה24. סוגים מסוימים של תרביות תאים אינם יכולים לסבול נוכחות של HEPES. בהתאם לתכנון הניסוי, ניתן לשנות את תכולת הפירובט, הגלוטמין והגלוקוז. - הכינו כלי מיקרוסקופיה סטריליים (זמינים מסחרית או מתוצרת מעבדה) עם משטחי זכוכית מצופים (להידבקות ספרואידית חזקה) או לא מצופים (הידבקות ספרואידית נמוכה) (עובי #1.5).
הערה: הצורך וסוג הציפוי תלויים בסוג התא, בתכונות ההיצמדות של הספרואידים ובקצב נדידת התאים שלהם מממשק תרבית תלת-ממדית לדו-ממדית. חשוב לקחת זאת בחשבון, שכן הציפוי יכול להקל על אובדן הארגון התלת-ממדי, לשנות את צורת המיקרו-שיפועים בספרואידים, וכתוצאה מכך, את התנהגות התא. עבור ניסויים מסוימים (למשל, הדמיה ניתחה את התגובה לגירוי תרופתי), נדרשת היצמדות ספרואידית חזקה לפני השטח, ועדיף ציפוי בג'לטין, BMM, קולגן, קולגן/פולי-D-ליזין או פולי-D-ליזין. - שטפו בעדינות את הספרואידים המוכתמים בבדיקה O2 מהמיקרו-בארות של האגרוז המיקרו-מעוצב או צלחת 96 בארות והעבירו ספרואידים שעדיין צפים לבקבוקון של 2 מ"ל.
הערה: כדי להבטיח איסוף של כל הספרואידים משיטת התפוקה הגבוהה, שטפו את התבנית 1-3 פעמים עם נפח נוסף של מדיה תרבותית, תוך שילוב כל מתלי הספרואידים בבקבוקון אחד. עבור ספרואידים בצלחת חיבור נמוכה, אספו ספרואידים בזה אחר זה מבארות בודדות לבקבוקון או ישירות לצלחת מיקרוסקופיה אם מספר קטן של ספרואידים מספיק לניסוי. בעת העברת ספרואידים גדולים, חתכו את קצה קצה הפיפט כדי להבטיח שלא ייגרם נזק במהלך הפיפט. - השאירו את הבקבוקון במצב אנכי עד 5 דקות כדי לאפשר לכדוריות להתיישב בתחתית הבקבוקון, וליצור גלולה גלויה.
- הסר את המדיה מן הצינור, משאיר spheroids ללא הפרעה, בעדינות resuspend אותם בכמות מספקת של תרבית טרייה.
הערה: לנוחות הטיפול בספרואידים, העברת ספרואידים למדיית ההדמיה יכולה להיעשות בשלב זה גם בקבוצות קטנות; ראה שלבים 2.1.7 ו- 2.1.8. יש להתייחס לספרואידים מקבוצות הניסוי השונות באופן שווה, שכן הרכב המדיה וזמן ההתניה המוקדמת של המדיה יכולים להשפיע על חילוף החומרים שלהם. - בזמן שהספרואידים צפים, מעבירים נפח שווה של תרחיף ספרואידי לכל באר של צלחת המיקרוסקופ.
- לדגור על ספרואידים במשך 1-2 שעות ב 37 ° C באינקובטור CO2 כדי להבטיח את חיבורם לפני השטח של צלחת המיקרוסקופ / היטב. להדמיה, המשך לשלב 2.1.9. עבור צביעה של spheroids עם בדיקות נוספות להמשיך עם שלב 2.1.8.
הערה: קצב נדידת התאים מהספרואיד התלת-ממדי לממשק פני השטח הדו-ממדי הוא פונקציה של זמן. כדי למנוע אובדן ארגון תלת ממדי, זמן הדגירה חייב להיות אופטימלי ביחס לסוג התא, סוג ציפוי פני השטח ועיצוב הניסוי. לדוגמה, HCT116, בהתאם לגודל הספרואידים, זקוק לפחות שעתיים לחיבור ספרואידי תקין למשטח המצופה קולגן IV/פולי-D-ליזין, בעוד שחיבור hDPSC והעברה לממשק דו-ממדי מהירים ביותר, מה שמוביל לאובדן ארגון תלת-ממדי תוך 1-2 שעות. כדי להימנע מהדמיית 'ספרואידים דו-ממדיים' עקב התפשטות יתר, משתמשים במשטחי זכוכית לא מצופים עם קיצור זמן הדגירה. - הוסף בדיקות פלואורסצנטיות בריכוזים מומלצים או מותאמים אמפירית לנפח ידוע של תרחיף ספרואידי. יש לדגור במשך שעה אחת ב-37°C CO2 אינקובטור לפני ההדמיה.
הערה: לבדיקה חיה/מתה, יש להשתמש בפרופידיום יודיד ובקלצין Green-AM בריכוז סופי סטנדרטי של 1 מיקרוגרם/מ"ל. כדי למנוע את ההשפעה הרעילה של צביעת יודיד פרופידיום על גופים עובריים iPSC, ריכוז הפרופידיום יודיד הסופי היה 0.5 מיקרוגרם / מ"ל. זמן טעינת הגשושית יכול להיות ממושך אם הדיפוזיה של הגשושית אינה יעילה בגלל גודל הספרואיד הגדול. זמן הטעינה צריך תמיד להיחשב כחלק מזמן הדגירה הכולל הדרוש לחיבור ספרואיד על פני השטח. אם יש צורך בזמן ארוך יותר לחיבור ספרואידים, יש להסדיר את הליך הצביעה בתום תקופה זו. היו מודעים לכך שזמן דגירה ארוך יותר עלול להוביל לאובדן הארגון התלת-ממדי. - הסר מדיה של תרבית תאים או מדיה המכילה בדיקות פלואורסצנטיות והחלף אותה בנפח הכרחי של מדיית הדמיה. כדי להבטיח שאין רקע פלואורסצנטי של מדיה בדרך להדמיה ספרואידית, חזור על שלב חילופי המדיה (שטיפה) עד 5 פעמים.
הערה: כדי למנוע הסרת כדוריד במהלך חילופי מדיה, מומלץ לשאוף בזהירות מדיה עם פיפטה 200 μL משולי כלי המיקרוסקופ ולבצע את הוספת המדיה ליד הקיר או לצדדים בצלחת המיקרוסקופ. - המשך מיד לשלב 2.2.1 של פרוטוקול ההדמיה.
הערה: הפסקה ארוכה מדי בין ההכנה לדימות לבין רכישת הדמיה בפועל יכולה להשפיע על חילוף החומרים של התא (למשל, באמצעות שינוי הרכב המדיום), על הכדאיות (לחלק מהגשושיות הפלואורסצנטיות המשמשות לניתוח נקודות קצה יש השפעות רעילות, שיכולות לעורר מוות תאי לאחר תקופת דגירה ארוכה) כמו גם להוביל לאובדן ארגון תלת-ממדי. אם יש להשוות מספר קבוצות של ספרואידים או תנאי ניסוי, יש לפתח את תכנון הניסוי בהתאם כדי לשמור על תזמון הטיפול, ההתניה המוקדמת והליכי ההדמיה שווים ככל האפשר בין הקבוצות המנותחות.
- יש להכין ולחמם מראש (37°C) אמצעי הדמיה: DMEM בתוספת HEPES-Na, pH 7.2 (10 מ"מ), נתרן פירובט (1 מ"מ), L-גלוטמין (2 מ"מ) וגלוקוז (5 מ"מ), ללא פנול אדום.
- רכישת תמונות
הערה: הפרוטוקול מתאר הדמיה מולטי-פרמטרית של ספרואידים חיים באמצעות מיקרוסקופ קונפוקלי Stellaris 8 Falcon (Leica) ותוכנת Leica Application Suite X (LAS X) גרסה 4.7. עם זאת, רק שינויים קלים יידרשו לבצע ניתוח כזה על פלטפורמות מיקרוסקופיה חלופיות.- הפעל את יחידת בקרת האקלים בטמפרטורה 30-60 דקות לפני ההדמיה. הגדר את המהירות הדרושה של אוורור וטמפרטורה (35-37 מעלות צלזיוס).
הערה: אם בנוסף לבקרת טמפרטורה, יש לשלוט בריכוז הגזים (למשל, CO2 או O2) במהלך ההדמיה, יש להפעיל מראש את המכשירים המתאימים כדי להגיע לתנאים הדרושים לפני ההדמיה. - הפעל את המיקרוסקופ ואת המכשירים המחוברים (כלומר, לייזר WLL, מחשב, משאבת מים עבור מטרת טבילת המים, ובלוקים אלקטרוניים הפעלה אחרים). הפעל את תוכנת בקרת המיקרוסקופ (לדוגמה, מצב מכונה LAS X או מצב מכונה עם בקרת סביבה) המסופקת עם הגדרת המיקרוסקופ המדויקת ואתחל את כיול השלב.
- בחר את המטרה הנדרשת בתוכנה והחל את נוזל הטבילה במידת הצורך.
הערה: עבור מיקרוסקופיה חיה, מומלץ להשתמש במטרות טבילה במים או גליצרול בעלות מרחק עבודה מספיק ('ארוך'), לדוגמה, HC Fluotar L 25x/0.95 W VIS IR (מרחק עבודה של 2.4 מ"מ), HC PL Apo 40x/1.25 GLYC (מרחק עבודה של 0.35 מ"מ) או לפחות NA = 0.4 ומעלה עבור מטרות האוויר. בחירת ההגדלה ומרחק העבודה תלויה באופי ובגודל הדגימה המצולמת ובאותות הפלואורסצנטיים הנמדדים (בהירות, תפוקה קוונטית, יעילות צביעה, ראו למשל דיון על צבעים וננו-חלקיקים53). עצמים גדולים (ספרואידים או אורגנואידים, בגודל >500 מיקרומטר), "ביו-ריאקטור" או שבבים מיקרופלואידים דורשים מטרות למרחקי עבודה ארוכים והגדלה נמוכה יותר, בעוד שניתוח של תאים בודדים או אברוני תאים דורש הגדלה גבוהה, המושגת לעתים קרובות באמצעות דימות "פסיפס". - הגדר את צלחת המיקרוסקופ עם ספרואידים על הבמה. התאם את המיקוד ומצא אובייקט/אזור עניין (ROI).
הערה: אם יש צורך למצוא חפצים קטנים, פלואורסצנטיים חלשים, ניגודיות ירודה או נדירים וקשה למצוא את הפוקוס, מומלץ להתמקד מראש בדפנות צלחת המיקרוסקופ ו'לסנן' את פני השטח עבור האובייקט המעניין על ידי סרפנטין, החל מאחת מפינות הבאר. - בחר בחלון פתח פרויקט ולחץ על הסמל המתאים, צור פרויקט חדש. תן שם סטנדרטי (לדוגמה, החל מ"תיאור YY-MM-DD+") לקובץ פרויקט המחקר. במהלך ההדמיה, כל התמונות שהופקו יישמרו באופן אוטומטי בקובץ .lif של הפרויקט שנוצר.
- פתח את החלון רכישה . הגדר את אורך גל העירור של לייזר האור הלבן (WLL) ואת הטווח הנדרש של גלאי סריקה היברידיים או תהודה (מסוג HyD S, HyD X או HyD R) בהתבסס על התכונות הספקטרליות הידועות של הפלואורסצנטיות הנמדדת (ספקטרום עירור/בליעה ופליטה). בחר סוגי סריקה מסוג 'קו' או 'מסגרת '.
הערה: עבור רוב הצבעים הפלואורסצנטיים הזמינים באופן מסחרי, ניתן למצוא (או להוסיף) את התכונות הספקטרליות בחבילת LAS X Dye Assistant. בחר את הגלאי עם טווח רגישות הספקטרום המתאים התואם לתכונות הספקטרליות של הגשושית, ובמקרה של FLIM, תואם לספירת פוטונים (כלומר, HyD X או HyD R). עבור הדמיה רב-פרמטרית הגדר את ה-WLL במיקומי עירור מרובים (לדוגמה, עבור הדמיה סימולטנית של FAD/Flavins ושני ערוצים פלואורסצנטיים של בדיקת MMIR1 O2 ביחס - ייחוס ורגישות, הגדרות העירור/פליטה עשויות להיות 460 ננומטר/510-590 ננומטר HyD X1 ו-614 ננומטר/631-690 HyD X3 ו-724-800 ננומטר HyD R בהתאם ברצף סריקה רציף אחד או שניים). חשוב להקצות את הגלאי המתאים לאיסוף הפליטה, שכן גלאים יכולים להיות בעלי רגישות ספקטרלית שונה54. - (אופציונלי עבור FLIM) בחלון Acquisition , בחר במצב FLIM לביצוע הדמיה בשילוב עם ספירת פוטונים (אוסף דעיכה). באופן מיידי ייפתח 'מודול FLIM נוסף בתוכנת LAS X' לניווט וניתוח נתוני FLIM.
- (אופציונלי עבור FLIM) בחר את קצב החזרה של דופק WLL בהתבסס על אורך החיים הממוצע הצפוי של פלואורופור.
הערה: יש לכוונן את תדירות פולס הלייזר כדי לאסוף את הדעיכה הפלואורסצנטית המלאה. ניתן לעשות זאת באמצעות תכונת בורר הדופק המותקנת במיקרוסקופ. החפיפה של דעיכת הפלואורסצנטיות עם פולס הלייזר תוביל לקיצור אורך החיים הפלואורסצנטי המשוער. מומלץ מרווחי פולסים ארוכים פי 4-5 מאורך החיים הפלואורסצנטי הממוצע הצפוי (למשל, 25 ns/40 MHz עבור אורך חיים של עד 5 ns). לייזרים פועמים רבים הם בעלי קצב חזרה קבוע של 80 MHz (אידיאלי רק לטווח של עד 2-3 ns). זה חשוב לבחירת הפלואורופורים הנכונים לניסוי. - הפעל את הדמיית התצוגה המקדימה באמצעות מצב FAST LIVE והתאם את המיקוד העדין של אובייקט ההדמיה במקטע מעניין.
התראה: יש להקפיד על כללי הבטיחות בלייזר. שקול תמיד את כללי הבטיחות בלייזר והמתן עד שההדמיה תיפסק לפני שתדליק את נורית השידור, תסתכל לתוך העינית או הדגימה.
הערה: במצב FAST LIVE , סריקה במהירות גבוהה של 600 הרץ (מתאימה לקצב פריימים מרבי של 4.43/שנייה אם נעשה שימוש במצב סריקה X דו-כיווני), רזולוציה של 256 x 256 פיקסלים מוחלת אוטומטית על התמונה כדי לשמור על הפלואורסצנטיות מפני הלבנה. פתח את חור הסיכה (למשל, ל 3-4 AU) ו / או הגדל את עוצמת הלייזר אם האות הפלואורסצנטי חלש מכדי להתמקד באובייקט. הימנעו מאיסוף ריקבון חלקי. - (אופציונלי עבור FLIM) על-ידי התבוננות בהיסטוגרמה של עוצמת פיקסלים המופיעה במהלך ההדמיה בחלון מודול FLIM (מצב חי ), התאם את עוצמת הלייזר/גודל חור הסיכה והרזולוציה המתאימים כדי להשיג את קצב הספירה ~1 מגבלת פולס פוטון/לייזר (קו אדום). הימנע מעלייה משמעותית מ- 1 כדי למנוע סיכון של אפקט ערימה. במידת הצורך, התאם את קצב החזרה על דופק WLL כך שיהיה אוסף דעיכה מלא בחלון דעיכה (כדי למנוע איסוף דעיכה חלקי, ראה שלב 2.2.8).
הערה: אם מספר הפוטונים (עוצמה) אינו מספיק כדי לשחזר דעיכה אמינה לצורך ניתוח מתאים או ענן התוויית פאזור, החל מספר חזרות סריקה (מסגרות או קווים, או הגדר זמן סריקה), הגדל את עוצמת הלייזר ו / או הקריב את הרזולוציה (גודל ROI סרוק). שימו לב שהפחתת קצב חזרת הלייזר דורשת איסוף פוטונים רבים יותר לצורך שחזור דעיכה אמין, וייתכן שיהיה צורך בתיקון נוסף של פרמטרי ההדמיה. היו מודעים להשפעה הפוטנציאלית של אור אינטנסיבי ותאורה מתמשכת ארוכה על יכולת הקיום של התא וחילוף החומרים55. ההשפעה השלילית על הכדאיות וחילוף החומרים יכולה להיות שונה בכל מקרה בנפרד, בהתאם לעוצמה, משך ואורך הגל של אור העירור, כמו גם שיטת הדמיה (למשל, דימות קונפוקלי של פוטון אחד לעומת דימות מולטיפוטון). להתאים את פרמטרי ההדמיה בהתאם, ובמידת הצורך, לשלוט בכדאיות התא / מוות על ידי Calcein Green-AM או עוצמת יודיד פרופידיום בניסויי פיילוט56. במידת האפשר, יש לשקול אופטימיזציות נוספות של פרוטוקול צביעת הבדיקה הפלואורסצנטית כדי להגיע לאות פלואורסצנטי הולם במהלך מיקרוסקופיה חיה. - (אופציונלי עבור ערימת z תלת-ממדית) ב-Fast Live הגדר את הקואורדינטות, סרוק את כיוון הסריקה, וייחס אותן להתחלה ולסיום בחלון Z-stack (מצב סריקה XYZ). בחר גודל Z-step או מספר שלבים.
הערה: בעוד שהתוכנה מחשבת באופן אוטומטי את מספר השלבים 'האופטימלי', בהתבסס על רזולוציה משומשת ופרמטרי סריקה, שחזור תלת-ממדי חי יכול בדרך כלל לדרוש מספר קטן יותר של צעדים כדי להשיג רכישה מהירה, למשל, גודל צעד של 1-2 מיקרומטר, גודל ערימה של 50-100 מיקרומטר, סריקה דו-כיוונית, הדורשת 2-3 דקות מזמן הסריקה הכולל. שימו לב שהאברונים התת-תאיים, התאים ומודל התא התלת-ממדי יכולים גם הם לנוע במהלך מדידות. בנוסף, בשל עומק חדירת האור ומגבלות הפיזור, בדרך כלל ניתן להשיג רק עומק סריקה של 50-100 מיקרומטר על FLIM קונפוקלי. - כאשר כל ההגדרות הדרושות מוחלות, התחל בהדמיה.
- תן לתמונה שם מתאים.
- חפש את אובייקט ההדמיה הבא במצב אור שידור וחזור על הליך ההדמיה עם הגדרות הדמיה שמוטבו בעבר (שלבים 2.2.8-2.2.12).
הערה: עבור השוואה מבוססת עוצמה או ניתוח יחס עוצמה (לדוגמה, ניתוח חמצון מבוסס בדיקה MMIR O2), שמור תמיד על אותן הגדרות הדמיה עבור כל האובייקטים שנותחו (הגדלה וסוג עדשה אובייקטיבית, עוצמת לייזר, עוצמה ותדר דופק, אורך גל עירור, טווח גלאים, חור סיכה, מהירות סריקה, זמן שהייה פיקסלים ורזולוציה). עם זאת, מכיוון שאורך החיים הפלואורסצנטי אינו תלוי בעוצמת הפלואורסצנטיות ודורש איסוף מספר מתאים של פוטונים לצורך חישוב אמין, ניתן להתאים מחדש את פרמטרי ההדמיה של FLIM במהלך הניסוי כדי לשמור על מספרי הפוטונים שנאספו דומים בין טיפולים שונים או תנאי ניסוי. לכן, עבור ניתוח רב-פרמטרי שבו יש צורך בניתוח מבוסס עוצמה וניתוח מבוסס פלואורסצנטיות לכל החיים, יש להחיל הגדרות הדמיה אוניברסליות אופטימליות עבור כל האובייקטים בקבוצות הניסוי שהושוו. להשוואה "FLIM בלבד" ניתן להשוות תמונות שנרכשו עם הגדרות הדמיה מעט שונות מכיוון שתוכנת LAS X מספקת חישוב של IRF למדידת תמונה בודדת42. עם זאת, עבור ניתוח התאמת FLIM מחוץ ל- LAS X (לדוגמה,FLIMfit 45) יש למדוד את פונקציית תגובת המכשיר (IRF) עבור כל תנאי הדמיה שונים, מכיוון שלא ניתן לייצא אותה מתוכנת ההדמיה. לכן, עבור הפשטות של עיצוב הניסוי ועומס העבודה, מומלץ להחיל את אותן הגדרות הדמיה עבור כל התמונות בערכת הנתונים. לאחר מכן, ניתן לבצע את מדידות ה-IRF המתאימות באמצעות פלואורופורים מרווים או פלואורסצנטיים מהירים (בטווח ps) עם תכונות הפליטה של הערוץ הספקטרלי הנמדד 57,58,59, על ידי ננו-חלקיקי זהב לומינסנציה 60 או על ידי אות דור הרמוני שני עבור מולטיפוטון FLIM61. בתוכנת LAS X, ניתן לטעון את פרמטרי ההדמיה הממוטבים בעבר עבור פרויקט חדש על ידי לחיצה ימנית על הקובץ המעניין ובחירה באפשרות החל הגדרות תמונה. - לאחר סיום הפעלת ההדמיה, שמור את פרויקט ההדמיה. לסיום ההדמיה, יש להוציא את הדגימה משלב המיקרוסקופ ולנקות את המטרה מנוזל הטבילה (אם נעשה בו שימוש) בהתאם להליך הסטנדרטי המיושם במתקן ההדמיה. סגור את הפרויקט ואת התוכנה. כבה את המיקרוסקופ, הלייזרים וכל המכשירים המחוברים.
- המשך בניתוח נתוני הדמיה (שלב 2.3).
- הפעל את יחידת בקרת האקלים בטמפרטורה 30-60 דקות לפני ההדמיה. הגדר את המהירות הדרושה של אוורור וטמפרטורה (35-37 מעלות צלזיוס).
- עיבוד תמונה NAD(P)H/FAD-FLIM PHASOR עם מודול LAS X FLIM ופיג'י
הערה: הפרוטוקול מתאר ניתוח משך חיים פלואורסצנטי של ספרואידים מצולמים עבור נתוני תחום תדר על דוגמאות של NAD(P)H ו- FAD/Flavins autofluorescence FLIM. מדידת NAD(P)H אוטופלואורסצנטיות הפכה לתקן זהב לאנליזה מטבולית, כאשר רכיבים קצרים וארוכים יותר של NAD(P)H לכל החיים קשורים לגליקוליזה או זרחן חמצוני (OxPhos), בהתאמה. ניתן לנתח זאת על ידי הסטה בחלקת פאזור לאורך המסלול המטבולי לעבר הסטנדרטים הנמדדים של NAD(P)H חופשי או NAD(P)H הקשור לחלבון31,62. כדי לנתח את מסלול השינוי המטבולי, כמו גם להשוות את מיקומם של ענני פאזור (ראה הערה להלן שלב 2.3.6) על מגרש בין קבוצות ניסוי, יושם ניתוח קואורדינטות פאזור מפושט, המבוסס על חישוב המרכז הגיאומטרי (צנטרויד) של ענן הפאזור29. הפרוטוקול המתואר מדגים את חישוב הקואורדינטות הצנטרואידיות בפיג'י ומדידת המרחק בין שתי נקודות בחלקת פאזור באמצעות קואורדינטות (למשל, המרחק מצנטרואיד של ענן הפזור האוטופלואורסצנטי NAD(P)H הספרואידי לנקודה תאורטית "NAD(P)H" חופשית). באופן דומה, FAD ואותות autofluorescence אחרים ניתן לנתח. ערכת נתונים 1 עם .lif (נדרשת תוכנת LAS X) או .ptu תבניות קובץ ללימוד הליך זה מסופקות (קובץ משלים 2, קובץ משלים 3, קובץ משלים 4, קובץ משלים 5, קובץ משלים 6, קובץ משלים 7, קובץ משלים 8, קובץ משלים 9, ו קובץ משלים 10).- פתח את מודול FLIM ב- LAS X, בחר Open Project וטען את קובץ התמונה הספרואידי ( .lif) לניתוח NAD(P)H/FAD אוטופלואורסצנטי.
הערה: עקב באגים פוטנציאליים ואובדן נתוני ביניים במודול FLIM, השתמש בעותק של קובץ התמונה הספרואידי המקורי ( .lif) לניתוח NAD(P)H/FAD, תוך שמירה על הקובץ הגולמי ללא שינוי. - בחר תמונה בודדת ונווט אל ממשק הניתוח FLIM. לחץ על Phasor כדי לגשת להתוויית Phasor ולהפעיל את מצב ניתוח phasor. החל מסנן (חציון או Wavelet) והגדר סף כדי למזער את הרעש ולשפר את ניראות הנתונים עבור כל ניתוחי הפאזורים. בחר את ההרמוניות. לניתוח השינוי המטבולי בהתבסס על נתוני NAD(P)H, המשך בשלבים 2.3.3-2.3.5. להשוואה כללית של חלקות פאזור, המשך משלב 2.3.6.
הערה: החל הגדרות ניתוח (סוג מסנן, הרמוניות, סף, בינינג והחזר השקעה על פאזור) באופן שווה על כל התמונות בערכת נתונים שהושוו. - (אופציונלי לניתוח NAD(P)H) בחרו תמונה כלשהי הקשורה לערכת נתונים והשתמשו באפשרות 'סמן יחס משיכה לשני רכיבים ' כדי לאתר במדויק את המיקום של 0.45 ns על מעגל אוניברסלי של מרחב התוויית פאסור סטנדרטי. מיקום זה יוקצה למשך חיים פלואורסצנטי ממוצע של תמיסה הומוגנית טהורה של NAD(P)H חופשי, אשר בדרך כלל קרוב לדעיכה מונו-מעריכית62.
הערה: ל-Free-NADH ול-Free-NAD(P)H יש תכונות ספקטרליות דומות וערכים דומים של משך חיים פלואורסצנטי בתמיסת מים, עם שני רכיבים בעלי אורך חיים קצר, 0.3 ns ו-0.7 ns63. לפיכך, למען פשטות האנליזה מבוססת הפזור ובשל הבדל קטן בין מרכיבי החיים הדעיכה הפלואורסצנטית שלהם מתקבלת כמונו-אקספוננציאלית, המאפשרת הקצאה של ענן הפזור על מעגל אוניברסלי. ניתן גם למדוד ולשרטט את אורך החיים הממוצע של צורת NAD(P)H חופשית במרחב פאזור לצורך ניתוח דומה. אורך חיי הייחוס נבחר על סמך הספרות62; שים לב שבמקורות אחרים, ניתן למצוא ערך שונה במקצת של NAD(P)H חופשי בתמיסה (0.4 ns64). - (אופציונלי לניתוח NAD(P)H) יצא את תרשים הפאסור עם תקופת החיים החופשית המוקצית של NAD(P)H (ראה שלב 2.3.3) על-ידי לחיצה ימנית על התוויית ובחירה באפשרות ייצוא נתונים. ייצא את התוויית הפאסור כקובץ בתבנית .tiff לתיקיית אחסון ייעודית.
הערה: גודל הפיקסלים המקורי של תמונת התוויית הפסור המיוצאת ממודול LAS X FLIM הוא תמיד 1024 x 600 פיקסלים. אם תוכנה אחרת משמשת לייצוא נתונים ולניתוח מראש, ודא שכל תמונות התוויית הפסור מיוצאות באותו גודל ובאותו רזולוציה. - כדי לייצא ענן phasor הקשור לספרואידים, השתמש בכלי Draw Cursor במודול LAS X FLIM כדי לבחור את החזר ההשקעה של הספרואיד בתמונה. יצא את התוויית הפסור שנוצרה כמתואר בשלב 2.3.4.
הערה: הקואורדינטות g ו-s המתאימות (בדומה ל-x ו-y) של מרחב הפאסור יוקצו לכל פיקסל של החזר ההשקעה שנבחר, בהתאם לתקופות החיים שלהן, שיהפכו למערך נתונים של תחום תדרים64,65. אשכול הפיקסלים עם ערכים דומים של tf (אורך חיי פאזה) ו- tm (אורך חיי אפנון) ייצור תבנית ענן (ענן פאזור) על חלקה, כאשר קידוד צבע (בטווח שבין כחול עמוק לאדום) ישקף את שפע ערכי החיים. על ידי מיקום הענן על מעגל אוניברסלי או בפנים, ניתן להבחין בדעיכה מונו או רב-מעריכית. חלק ממדיות המדידה מציגות פלואורסצנטיות חזקה (אוטומטית), מה שמוביל להופעת ענן מקביל על חלקת פאזור, שלא ניתן פשוט להסיר אותו בסף העוצמה. תבנית זו תשפיע על חישוב הקואורדינטות הצנטרואידיות ויש להוציא אותה מחלקת הפזור המיוצאת. עבודה עם החזר השקעה ספרואידי מאפשרת להוציא את הפיקסלים שאינם קשורים מניתוח פאסור נוסף. - חזור על הליך ייצוא התוויית phasor עבור כל החזר ההשקעה על ספרואידים בערכת נתונים (ראה שלבים 2.3.4 ו- 2.3.6). בנוסף, בדוק את הערכה המיוצאת של תמונות .tiff כדי להבטיח את ערכת הנתונים המלאה לניתוח השוואתי נוסף ולוודא שגודל הפיקסלים של כל התמונות המיוצאות זהה (ראה הערה בשלב 2.3.4).
הערה: בשלב זה של הפרוטוקול, ערכת התמונות חייבת לכלול פאזור עם מיקום NAD(P)H חופשי (בהתבסס על ספרות או נתונים שהתקבלו אמפירית) וכל תרשימי החזר ההשקעה הספרואידי (או תבניות ROI חלופיות במידת הצורך לניתוח הספציפי). משלב זה, ניתוח נוסף ייעשה בפיג'י ולאחר מכן בגיליון אלקטרוני. השתמשו בחלון הכלי אנליזה , באפשרות 'קבע קנה מידה ' ב-FIJI, וודאו שכל תמונות התוויית הפאסור מכוילות באותו סוג יחידה, למשל בפיקסלים בלבד. אם לא, הגדר את אורך היחידה בחלון Set Scale עבור החלון שנבחר (לדוגמה, עבור קנה מידה מבוסס פיקסלים, מקם 1 בשדה מרחק בפיקסלים והגדר את יחידת האורך ל - Pixel). להשוואה נוספת, מדוד את כל הנתונים המיוצאים באמצעות אותו סוג יחידה. - (אופציונלי לניתוח NAD(P)H) קבע את מיקום נקודת הפיקסלים של אורך חיים פלואורסצנטי ממוצע של NAD(P)H חופשי בתמונת התוויית הפאזור המיוצאת המתאימה (ראה שלב 2.3.3): פתח את תמונת הפאזור עם FIJI, הגדל את התמונה כדי להציג בבירור ברזולוציית פיקסלים את ההצטלבות בין חצי עיגול אוניברסלי לקו סמן יחס לשני רכיבים ; השתמש בכלי החזר השקעה מלבני כדי לבחור את הצומת.
הערה: ודא שהבחירה המלבנית היא שטח קטן סביב נקודת ההצטלבות לצורך קביעה מדויקת של הקואורדינטות שלה בשלב הבא (שלב 2.3.9). - (אופציונלי לניתוח NAD(P)H) פתחו את הכלי אנליזה , בחרו בחלון 'קבע מדידות ' ובחרו Centroid כפרמטר מדידה. לחץ על מדידה בחלון הכלי ניתוח כדי לקבוע את הקואורדינטות הצנטרואידיות של נקודת הייחוס החופשית NAD(P)H. יצא קואורדינטות אלה לגיליון אלקטרוני.
הערה: קואורדינטות Free-NAD(P)H ישמשו כנקודת ייחוס להשוואת המרחקים מנקודה זו למיקום ענן הפזור הספרואידי במערך נתונים (הדרך לאפיין את המעבר המטבולי בין גליקוליזה לאוקספוס בניתוח אוטופלואורסנציה של NAD(P)H FLIM) - באמצעות FIJI, פתח את התמונה של ענן phasor spheroid . פתחו את הכלי Image window, בחרו 'התאמה' ובחרו 'סף צבע' בסרגל הכלים. בחר בשיטת הסף שבחרת (לדוגמה, Otsu), והגדר את ערך הגוון וערך הבהירות כדי לצמצם את הפרמטרים לבחירת חלק ענן Phasor עם קואורדינטות הפיקסלים הנפוצות ביותר. לחץ על בחר כדי להגדיר את אזור האשכול.
הערה: שמור על פרמטרי סף זהים לכל תמונות התוויית הפאזור, שיש לנתח. עבור נתוני NAD(P)H-FLIM המוצגים, נבחרה שיטת הסף Otsu עם ערכת ערך גוון 9 וערך בהירות 160 והוחלה על כל תמונות הפאזור. לחלופין, ניתן להעתיק את האזור שנבחר ל - ROI Manager (עקוב אחר הנתיב Edit > Selection > Add to Manager) כדי ליצור ספריה של החזר השקעה של phasor לצורך ניתוח נוסף. - תוך שמירה על הבחירה, חשב את הקואורדינטות הצנטרואידיות של האזור שנבחר בהתאם להליך המתואר בשלב 2.3.9. יצא קואורדינטות אלה לקובץ הגיליון האלקטרוני.
- חזור על שלבים 2.3.9 ו- 2.3.10 כדי לקבוע קואורדינטות צנטרוידיות לכל תמונות הפסור של החזר ההשקעה כדי ליצור ערכת נתונים בגיליון האלקטרוני.
הערה: השימוש בספריית ROI Manager ROI עוזר לפשט ולארגן את ניתוח החזר ההשקעה (ראה שלב 2.3.10) - (אופציונלי לניתוח NAD(P)H) פתח את הגיליון האלקטרוני עם קואורדינטות ROIs ללא NAD(P)H ו- SPHEROID מיוצאות מקבוצות השוואה שונות. חשב את המרחק בין כל צנטרויד פסור ספרואידי בודד כדי להתייחס למיקום NAD(P)H חופשי באמצעות קואורדינטות קבועות והמשוואה הבאה:
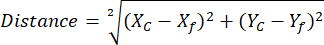
כאשר, Xc ו- Yc הן קואורדינטות צנטרוידיות, Xf ו- Yf הן קואורדינטות הייחוס.
הערה: יישום פרמטר צנטרואידי לקביעת המעבר לעבר אורך חיי הייחוס מתאים רק במקרה שכל הצנטרואידים ממערך נתונים שוכבים על אותו מסלול ליניארי לכיוון נקודת הייחוס. כדי לבדוק זאת, יש לשרטט את כל נקודות הצנטרויד מערכת הנתונים יחד עם נקודת הייחוס באותו מרחב קואורדינטות, ולבצע את יישור המגמה הלינארי. אם מקדם R2 של קו המגמה הליניארי המשורטט דרך כל הנקודות קרוב ל-1 (למשל, R2 הוא 0.8-0.99), מניחים שניתוח המרחק מתאים. - ארגן את כל הנתונים בהתאם לצורך השוואה ובצע ניתוח סטטיסטי תוך שימוש בכל תוכנה מתאימה (למשל, Origin, MatLab). בחר את המבחן הסטטיסטי המתאים בהתאם למאפייני מערך הנתונים (תקינות ההתפלגות, מספר היחידות הסטטיסטיות וכו').
הערה: עבור ניתוח NAD(P)H, השווה ערכי מרחק כדי לאפיין את השינוי המטבולי בהתאם לתנאי הניסוי. להשוואה של חלקות פאזור כלשהן בין קבוצות ניסוי, בצע את ההשוואה של קואורדינטות ענן פזור ROI.
- פתח את מודול FLIM ב- LAS X, בחר Open Project וטען את קובץ התמונה הספרואידי ( .lif) לניתוח NAD(P)H/FAD אוטופלואורסצנטי.
Access restricted. Please log in or start a trial to view this content.
תוצאות
בחירת שיטת היווצרות הספרואידים המתאימה
שיטת היווצרות הספרואידים שנבחרה יכולה להשפיע מאוד על גודלם, צורתם, צפיפות התא, הכדאיות והרגישות של הספרואידים לתרופות (איור 2). בעבר, הושוו ההשפעות של מספר רב של תפוקות גבוהות (SphericalPlate 5D, מיקרו-תבניות מיוצרות במעבדה ותבניות ...
Access restricted. Please log in or start a trial to view this content.
Discussion
ספרואידים רב-תאיים הופכים לשיטת בחירה במחקרים של מיקרו-סביבות נישה של גידולים ותאי גזע, גילוי תרופות ופיתוח "אבני הבניין של הרקמות" לייצור ביולוגי. הארכיטקטורה הפנימית ההטרוגנית של הספרואידים, שיפועים של חומרים מזינים וחמצון יכולים לחקות את אלה של רקמות in vivo וגידולים בסביבה פשוטה ונ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקי קרן המחקר המיוחדת (BOF) של אוניברסיטת גנט (BOF/STA/202009/003; BOF/IOP/2022/058), קרן המחקר פלנדריה (FWO, I001922N) והאיחוד האירופי, fliMAGIN3D-DN Horizon Europe-MSCA-DN מס '101073507.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | Also available from Sigma |
| 10 mL serological pipets | VWR | 612-3700 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 12 well cell-culture plates, sterile | Greiner bio-one | 665-180 | Similar products are also available from Sarstedt, Corning and other companies. |
| 12 Well Chamber slide, removable | Ibidi | 81201 | Also available from Grace Bio-Labs, ThermoFisher Scientific and others |
| 15 mL centrifuge tubes | Nerbe plus | 02-502-3001 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 3D Petri Dish micromolds | Microtissue | Z764000-6EA | |
| 6 well cell-culture plates, sterile | Greiner bio-one | 657160 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 70% ethanol | ChemLab | CL02.0537.5000 | |
| Biofloat | Sarstedt | 83.3925.400 | Commercial available coated 96-well plate for spheroid formation |
| Calcein Green-AM | Tebubio | AS-89201 | Apply in dilution 1:1000 |
| CellSens Dimension software | Olympus | version 3 | |
| Collagen from human placenta, type IV | Sigma | C5533 | For the preparation of 0.07 mg/mL Collagen and 0.03 mg/mL Poly-D-lysine coated microscopy dishes |
| Confocal FLIM Microscope | Leica Microsystems | N/A | Stellaris 8 Falcon inverted microscope with white-light laser, HyD X detectors, climate / T control chamber (OkoLab), 25x/0.95 W objective |
| D(+)-Glucose | Merck | 8342 | Prepare 1 M stock solution, 1:100 for preparation of imaging medium (final concentration 10 mM) |
| Dulbecco's modified Eagle's medium (DMEM), phenol red-, glucose-, pyruvate- and glutamine-free | Sigma-Aldrich | D5030-10X1L | For preparation of imaging medium |
| Fetal Bovine Serum (FBS) | Gibco | 10270-098 | Also available from Sigma. Needs to be heat-inactivated before use. |
| HEPES (1M) | Gibco | 15630-080 | Dilution 1/100 for preparation of imaging medium (final concentration 10 mM) |
| Human colon cancer cells HCT116 | ATCC | ||
| ImageJ | NIH | version 1.54f | |
| Leica Application Suite X (LAS X) | Leica Microsystems | version 4.6.1.27508 | |
| L-glutamine | Gibco | 25030 | Also available from Sigma. Apply in dilution 1:100. |
| Lipidure-CM5206 | Amsbio | AMS.52000034GB1G | |
| McCoy's 5A, need addition of 1 mM Sodium Pyruvate and 10 mM HEPES | VWR | 392-0420 | Standard growth medium for HCT116 cells |
| micro-patterned 3D-printed PDMS stamps | N/A | N/A | Provided by the Centre for Microsystems Technology, Professor Dr. Jan Vanfleteren, Ghent University |
| NaCl | Chemlab | CL00.1429.100 | |
| Neubauer couting chamber | Fisher Scientific | 15980396 | |
| O2 probes: MMIR1 | N/A | N/A | Full characterization, validation and some applications can be found at: https://www.biorxiv.org/content/10.1101/2023.12.11.571110 v1 |
| PBS | Fisher scientific | Gibco18912014 | Dissolve PBS tablet in 500 mL of distilled water. |
| Pen Strep :Penicillin (10,000 U/mL) / streptomycin (10,000 μg/mL) 100x solution | Gibco | 15140-122 | Also available from Sigma. Apply in dilution 1:100. |
| Poly-D-lysine | Sigma | P6407-5mg | For the preparation of 0.07 mg/mL Collagen and 0.03 mg/mL Poly-D-lysine coated microscopy dishes |
| Propidium Iodide | Sigma-Aldrich | 25535-16-4 | Cell death staining, use 1 µg/mL at 1h incubation |
| PVDF syringe filter 0.22 µm | Novolab | A35149 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Sodium pyruvate (100 mM) | Gibco | 11360-070 | Dilution 1/100 for preparation of imaging medium (final concentration 1mM) |
| SphericalPlate 5D 24-well | Kugelmeiers | SP5D-24W | |
| sterile petridish | Greiner bio-one | 633181 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Tissue culture flask (25 cm² ) | VWR | 734-2311 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Tissue culture flask (75 cm²) | VWR | 734-2313 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| U-bottom 96-well plate | VWR | 10062-900 | Similar products are also available from Sarstedt, Corning, Greiner Bio-one and other companies |
| Ultrapure Agarose | Invitrogen (Life Technologies) | 16500-500 | Other types of Agarose such as Agarose low melting point (A-9414, Sigma), Agarose for routine use (A-9539, Sigma) |
| Widefield fluorescence inverted microscope | Olympus | N/A | Inverted fluorescence microscope IX81, with motorised Z-axis control, CoolLED pE4000 (16 channels, 365-770 nm), ORCA-Flash4.0LT (Hamamatsu) cMOS camera, glass warming plate Okolab, CellSens Dimension v.3 software and air objectives 4x/0.13 UPlanFLN and 40x/0.6 LUCPlanFLN. (Optional, for high-resolution imaging) 60x/1.0 LUMPLFLN water |
References
- Foty, R. A simple hanging drop cell culture protocol for generation of 3d spheroids. J Vis Exp. (51), e2720(2011).
- Moskovits, N., et al. Establishing 3-dimensional spheroids from patient-derived tumor samples and evaluating their sensitivity to drugs. J Vis Exp. (190), e64564(2022).
- Griner, L. M., et al. Generation of high-throughput three-dimensional tumor spheroids for drug screening. J Vis Exp. (139), e57476(2018).
- Qian, Y., Wei, X., Chen, K., Xu, M. Three-dimensional acoustic assembly device for mass manufacturing of cell spheroids. J Vis Exp. (200), e66078(2023).
- He, H., et al. Dynamic formation of cellular aggregates of chondrocytes and mesenchymal stem cells in spinner flask. Cell Prolif. 52 (4), e12587(2019).
- Perez, J. E., Nagle, I., Wilhelm, C. Magnetic molding of tumor spheroids: Emerging model for cancer screening. Biofabrication. 13 (1), 015018(2020).
- Kingsley, D. M., et al. Laser-based 3d bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomater. 95, 357-370 (2019).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Danilevicius, P., et al. laser-made 3D microscaffolds for tissue spheroid encagement. Biointerphases. 10 (2), 021011(2015).
- Jamieson, L. E., Harrison, D. J., Campbell, C. Chemical analysis of multicellular tumour spheroids. Analyst. 140 (12), 3910-3920 (2015).
- Dmitriev, R., Borisov, S., Jenkins, J., Papkovsky, D. Multiparametric imaging of tumor spheroids with ultra-bright and tunable nanoparticle O2 probes. SPIE BiOS. 9328, (2015).
- Zushin, P. -J. H., Mukherjee, S., Wu, J. C. FDA Modernization Act 2.0: transitioning beyond animal models with human cells, organoids, and AI/ML-based approaches. J Clin Invest. 133 (21), e175824(2023).
- Kim, D. -S., et al. Robust enhancement of neural differentiation from human es and ips cells regardless of their innate difference in differentiation propensity. Stem Cell Rev Rep. 6 (2), 270-281 (2010).
- Hart, D., Gutiérrez, D. R., Biason-Lauber, A. Generation of a human ovarian granulosa cell model from induced pluripotent stem cells. bioRxiv. , 2022(2022).
- Chiaradia, I., et al. Tissue morphology influences the temporal program of human brain organoid development. Cell Stem Cell. 30 (10), 1351-1367 (2023).
- Wagstaff, E. L., Ten Asbroek, A. L., Ten Brink, J. B., Jansonius, N. M., Bergen, A. A. An alternative approach to produce versatile retinal organoids with accelerated ganglion cell development. Sci Rep. 11 (1), 1101(2021).
- Thavandiran, N., et al. Design and formulation of functional pluripotent stem cell-derived cardiac microtissues. Proc Natl Acad Sci U S A. 110 (49), E4698-E4707 (2013).
- Harrison, S. P., et al. Scalable production of tissue-like vascularized liver organoids from human pscs. Exp Mol Med. 55 (9), 2005-2024 (2023).
- Noguchi, T. -A. K., Kurisaki, A. Formation of stomach tissue by organoid culture using mouse embryonic stem cells. Methods Mol Biol. 2017, 217-228 (2017).
- Takahashi, J., et al. Suspension culture in a rotating bioreactor for efficient generation of human intestinal organoids. Cell Reports Methods. 2 (11), 100337(2022).
- Lagziel, S., Gottlieb, E., Shlomi, T. Mind your media. Nat Metab. 2 (12), 1369-1372 (2020).
- Das, V., Fürst, T., Gurská, S., Džubák, P., Hajdúch, M. Reproducibility of uniform spheroid formation in 384-well plates: The effect of medium evaporation. J Biomol Screen. 21 (9), 923-930 (2016).
- Bera, K., et al. Extracellular fluid viscosity enhances cell migration and cancer dissemination. Nature. 611 (7935), 365-373 (2022).
- Michl, J., Park, K. C., Swietach, P. Evidence-based guidelines for controlling ph in mammalian live-cell culture systems. Commun Biol. 2, 144(2019).
- Okkelman, I. A., Vercruysse, C., Kondrashina, A. V., Borisov, S. M., Dmitriev, R. I. Affordable oxygen microscopy-assisted biofabrication of multicellular spheroids. J Vis Exp. (182), e63403(2022).
- Peirsman, A., et al. Mispheroid: A knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948(2016).
- Froehlich, K., et al. Generation of multicellular breast cancer tumor spheroids: Comparison of different protocols. J Mammary Gland Biol Neoplasia. 21 (3-4), 89-98 (2016).
- Debruyne, A. C., et al. Live microscopy of multicellular spheroids with the multimodal near-infrared nanoparticles reveals differences in oxygenation gradients. ACS Nano. 18 (19), 12168-12186 (2024).
- Debruyne, A. C., Okkelman, I. A., Dmitriev, R. I. Balance between the cell viability and death in 3D. Semin Cell Dev Biol. 144, 55-66 (2023).
- Barroso, M., Monaghan, M. G., Niesner, R., Dmitriev, R. I. Probing organoid metabolism using fluorescence lifetime imaging microscopy (flim): The next frontier of drug discovery and disease understanding. Adv Drug Deliv Rev. 201, 115081(2023).
- Becker, W. Fluorescence lifetime imaging-techniques and applications. J Microsc. 247 (2), 119-136 (2012).
- Dmitriev, R. I., Intes, X., Barroso, M. M. Luminescence lifetime imaging of three-dimensional biological objects. J Cell Sci. 134 (9), 1-17 (2021).
- Sarder, P., Maji, D., Achilefu, S. Molecular probes for fluorescence lifetime imaging. Bioconjug Chem. 26 (6), 963-974 (2015).
- Alfonso-Garcia, A., et al. Mesoscopic fluorescence lifetime imaging: Fundamental principles, clinical applications and future directions. J Biophotonics. 14 (6), e202000472(2021).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: Fundamentals and advances in instrumentation, analysis, and applications. J Biomed Opt. 25 (7), 1-43 (2020).
- Yellen, G. Fueling thought: Management of glycolysis and oxidative phosphorylation in neuronal metabolism. J Cell Biol. 217 (7), 2235-2246 (2018).
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomark Med. 4 (2), 241-263 (2010).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of nad (p) h and fad. Antioxid Redox Signal. 30 (6), 875-889 (2019).
- Verma, A., et al. Fluorescence lifetime imaging for quantification of targeted drug delivery in varying tumor microenvironments. bioRxiv. , 2024(2024).
- Smith, J. T., et al. In vivo quantitative fret small animal imaging: Intensity versus lifetime-based fret. Biophys Rep. 3 (2), 100110(2023).
- Alvarez, L. A., et al. Application Note: SP8 Falcon: A novel concept in fluorescence lifetime imaging enabling video-rate confocal flim. Nat Methods. , (2019).
- Roberti, M. J., et al. TauSense: A fluorescence lifetime-based tool set for everyday imaging. Nat. Methods. , https://www.nature.com/articles/d42473-020-00364-w.pdf (2020).
- Auer, J. M. T., Murphy, L. C., Xiao, D., Li, D. U., Wheeler, A. P. Non-fitting flim-fret facilitates analysis of protein interactions in live zebrafish embryos. J Microsc. 291 (1), 43-56 (2023).
- Warren, S. C., et al. Rapid global fitting of large fluorescence lifetime imaging microscopy datasets. PLoS One. 8 (8), e70687(2013).
- Gao, D., et al. Flimj: An open-source imagej toolkit for fluorescence lifetime image data analysis. PloS One. 15 (12), e0238327(2020).
- Tullis, I. D. C., Ameer-Beg, S. M., Barber, P. R., Rankov, V., Vojnovic, B. Mapping femtosecond pulse front distortion and group velocity dispersion in multiphoton microscopy. Proc. SPIE 6089, Multiphoton Microscopy in the Biomedical Sciences VI. , 60890(2006).
- Zhou, Y., et al. One-step derivation of functional mesenchymal stem cells from human pluripotent stem cells. Bio Protoc. 8 (22), e3080(2018).
- Benton, G., Arnaoutova, I., George, J., Kleinman, H. K., Koblinski, J. Matrigel: From discovery and ECM mimicry to assays and models for cancer research. Adv Drug Deliv Rev. 79-80, 3-18 (2014).
- Badea, M. A., et al. Influence of matrigel on single-and multiple-spheroid cultures in breast cancer research. SLAS Discov. 24 (5), 563-578 (2019).
- Lang, S., Sharrard, R., Stark, M., Villette, J., Maitland, N. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Barra, J., et al. DMT1-dependent endosome-mitochondria interactions regulate mitochondrial iron translocation and metastatic outgrowth. Oncogene. 43 (9), 650-667 (2024).
- Dmitriev, R. I., Papkovsky, D. B. Intracellular probes for imaging oxygen concentration: How good are they. Methods Appl Fluoresc. 3 (3), 034001(2015).
- Schweikhard, V., et al. Application Note: The power HyD family of detectors for confocal microscopy. Nat Methods. , https://www.nature.com/articles/d42473-020-00398-0 (2020).
- Alam, S. R., Wallrabe, H., Christopher, K. G., Siller, K. H., Periasamy, A. Characterization of mitochondrial dysfunction due to laser damage by 2-photon flim microscopy. Sci Rep. 12 (1), 11938(2022).
- Bush, P. G., Wokosin, D. L., Hall, A. C. Two-versus one photon excitation laser scanning microscopy: Critical importance of excitation wavelength. Front Biosci. 12, 2646-2657 (2007).
- Liu, M., et al. Instrument response standard in time-resolved fluorescence spectroscopy at visible wavelength: Quenched fluorescein sodium. Appl Spectrosc. 68 (5), 577-583 (2014).
- Szabelski, M., et al. Collisional quenching of erythrosine b as a potential reference dye for impulse response function evaluation. Appl Spectrosc. 63 (3), 363-368 (2009).
- Chib, R., et al. Standard reference for instrument response function in fluorescence lifetime measurements in visible and near infrared. Meas Sci Technol. 27 (2), 027001(2015).
- Talbot, C. B., et al. Application of ultrafast gold luminescence to measuring the instrument response function for multispectral multiphoton fluorescence lifetime imaging. Opt Express. 19 (15), 13848-13861 (2011).
- Becker, W. Recording the instrument response function of a multiphoton flim system. Becker & Hickl. , Available from: https://www.becker-hickl.com/literature/application-notes/recording-the-instrument-response-function-of-a-multiphoton-flim-system/ (2007).
- Leben, R., Köhler, M., Radbruch, H., Hauser, A. E., Niesner, R. A. Systematic enzyme mapping of cellular metabolism by phasor-analyzed label-free nad (p) h fluorescence lifetime imaging. Int J Mol Sci. 20 (22), 5565(2019).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using nadh and nadph autofluorescence. Free Radic Biol Med. 100, 53-65 (2016).
- Gottlieb, D., Asadipour, B., Kostina, P., Ung, T. P. L., Stringari, C. FLUTE: A python gui for interactive phasor analysis of flim data. Biol Imaging. 3, e21(2023).
- Malacrida, L., Ranjit, S., Jameson, D. M., Gratton, E. The phasor plot: A universal circle to advance fluorescence lifetime analysis and interpretation. Annu Rev Biophys. 50, 575-593 (2021).
- Okkelman, I., Vandenberghe, W., Dmitriev, R. Role of preconditioning with oxygen and glucose deprivation in promoting differentiation of dental pulp stem cells in 3D culture. Mol Biol Cell. 34 (2), 1212(2022).
- Park, J. H., et al. The effect of bmp-mimetic peptide tethering bioinks on the differentiation of dental pulp stem cells (DPSCs) in 3D bioprinted dental constructs. Biofabrication. 12 (3), 035029(2020).
- Pașca, S. P. The rise of three-dimensional human brain cultures. Nature. 553 (7689), 437-445 (2018).
- Dmitriev, R. I., Zhdanov, A. V., Nolan, Y. M., Papkovsky, D. B. Imaging of neurosphere oxygenation with phosphorescent probes. Biomaterials. 34 (37), 9307-9317 (2013).
- Bryanskaya, E. O., et al. High levels of FAD autofluorescence indicate pathology preceding cell death. Biochim Biophys Acta Gen Subj. 1868 (1), 130520(2024).
- Han, S. J., Kwon, S., Kim, K. S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 21 (1), 152(2021).
- Okkelman, I. A., Neto, N., Papkovsky, D. B., Monaghan, M. G., Dmitriev, R. I. A deeper understanding of intestinal organoid metabolism revealed by combining fluorescence lifetime imaging microscopy (flim) and extracellular flux analyses. Redox Biol. 30, 101420(2020).
- Gstraunthaler, G., Seppi, T., Pfaller, W. Impact of culture conditions, culture media volumes, and glucose content on metabolic properties of renal epithelial cell cultures: Are renal cells in tissue culture hypoxic. Cell Physiol Biochem. 9 (3), 150-172 (1999).
- Glickman, R. D. Phototoxicity to the retina: Mechanisms of damage. Int J Toxicol. 21 (6), 473-490 (2002).
- Golub, A. S., Pittman, R. N. Monitoring Parameters of Oxygen Transport to Cells in the Microcirculation. Quenched-Phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , The Royal Society of Chemistry. (2018).
- Nishigaki, T., Wood, C. D., Shiba, K., Baba, S. A., Darszon, A. Stroboscopic illumination using light-emitting diodes reduces phototoxicity in fluorescence cell imaging. Biotechniques. 41 (2), 191-197 (2006).
- Penjweini, R., Loew, H. G., Hamblin, M. R., Kratky, K. W. Long-term monitoring of live cell proliferation in presence of pvp-hypericin: A new strategy using ms pulses of led and the fluorescent dye cfse. J Microsc. 245 (1), 100-108 (2012).
- Carrasco Kind, M., et al. flimview: A software framework to handle, visualize and analyze flim data. F1000Research. 9, 574(2020).
- Schrimpf, W., Barth, A., Hendrix, J., Lamb, D. C. Pam: A framework for integrated analysis of imaging, single-molecule, and ensemble fluorescence data. Biophys J. 114 (7), 1518-1528 (2018).
- Chen, S. -J., Sinsuebphon, N., Barroso, M., Intes, X., Michalet, X. Optical Molecular Probes, Imaging and Drug Delivery. , Optica Publishing Group. (2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved