Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Производство и многопараметрическая флуоресцентная флуоресцентная микроскопия живых клеток (FLIM) многоклеточных сфероидов
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной статье мы описываем различные методы формирования многоклеточных сфероидов для проведения последующей многопараметрической микроскопии живых клеток. С помощью флуоресцентной микроскопии с визуализацией в течение жизни (FLIM), клеточной автофлуоресценции, окрашивания красителей и наночастиц продемонстрирован подход к анализу клеточного метаболизма, гипоксии и гибели клеток в живом трехмерном (3D) раке и сфероидах, полученных из стволовых клеток.
Аннотация
Сфероиды многоклеточных опухолей являются популярной 3D-моделью микроагрегата тканей для воспроизведения микроокружения опухоли, тестирования и оптимизации медикаментозной терапии, а также использования био- и наносенсоров в 3D-контексте. Простота их производства, предсказуемый размер, рост и наблюдаемые градиенты питательных веществ и метаболитов важны для повторения 3D-нишевого клеточного микроокружения. Тем не менее, гетерогенность сфероидов и вариабельность методов их производства могут влиять на общий клеточный метаболизм, жизнеспособность и реакцию на лекарственные препараты. Это затрудняет выбор наиболее подходящей методологии с учетом требований к размеру, вариабельности, потребностям биопроизводства и использованию в качестве 3D-моделей тканей in vitro в биологии стволовых и раковых клеток. В частности, производство сфероидов может влиять на их совместимость с количественными микроскопиями в реальном времени, такими как оптическая метаболическая визуализация, флуоресцентная микроскопия в течение жизни (FLIM), мониторинг гипоксии сфероидов с помощью наносенсоров или жизнеспособность. Здесь представлен ряд традиционных протоколов формирования сфероидов, подчеркивающих их совместимость с широкоугольной, конфокальной и двухфотонной микроскопией в реальном времени. Также представлен конвейер последующей визуализации для анализа с помощью мультиплексного автофлуоресцентного FLIM и с использованием различных типов сфероидов рака и стволовых клеток.
Введение
Многоклеточные сфероиды представляют собой группу трехмерных моделей тканей, полученных путем самоагрегации клеток и имеющих сферическую форму. Они широко используются для имитации межклеточного взаимодействия и межклеточного матриксного взаимодействия in vitro и для воспроизведения 3D-контекста во множестве конструкций, полученных из раковых и стволовых клеток. Для уменьшения прикрепления клеток и стимулирования агрегации используется несколько методов. К ним относятся метод висячих капель, основанный на поверхностном натяжении1; методы отталкивания клеточных пластин, такие как пластины со сверхнизким прикреплением, микроформы и микролунки 2,3; подход на основе акустических волн4; методы проточной агрегации (колбы-спиннеры, биореакторы, микрофлюидные устройства)5; формирование с помощью магнитных частиц6 и использование стимулирующих агрегацию синтетических матриц и скаффолдов на основе ЭКМ 7,8,9.
В исследованиях, разработке и валидации новых лекарственных препаратов для лечения рака сфероиды являются привлекательной моделью благодаря своей способности повторять ограниченные пространственной диффузией градиенты питательных веществ, продуктов жизнедеятельности иO2, что часто приводит к образованию некротического ядра, типичного для солидных опухолей10,11. Эти более надежные и сложные модели in vitro бросают вызов необходимости широкого использования животных моделей (Закон о модернизации Управления по санитарному надзору за качеством пищевых продуктов и медикаментов [FDA] 2.012) в соответствии с принципом 3R исследований на животных (замена, сокращение и уточнение). Помимо рака, сфероиды находят свое применение в исследованиях стволовых клеток. Например, плюрипотентные стволовые клетки обладают способностью образовывать эмбриоидные тельца (БЭ), которые могут быть использованы для дифференцировки индуцированных плюрипотентных стволовых клеток (ИПСК) в специализированные типы клеток, которые трудно получить непосредственно от пациентов, такие как нейральные клетки-предшественники13 или гранулезные клетки яичников 13,14. Кроме того, формирование БЭ часто является первым шагом в развитии более сложных органоидных моделей, например, нейронных15, сетчатки16, сердечной17, печени18, желудка19 и кишечных органоидов20. При выборе подходящего метода формирования сфероидов для экспериментов следует учитывать такие факторы, как размер, воспроизводимость, производительность и последующие приложения.
Повышенная сложность 3D-культуры может привести к более высокой вариативности по сравнению с 2D-культурой. Такие факторы, как состав питательных веществ21, испарение среды22, вязкость23, контроль pH24, метод формирования сфероидов и даже время в культуре25,26, могут привести к получению сфероидов различной морфологии, размеров, жизнеспособности и различной химиорезистентности27,28. Недавние исследования показали, что сфероидальные градиенты кислорода не всегда статичны и зависят от способа формирования, размера сфероида и внеклеточной вязкости, что влияет на гетерогенность сфероида29. Для улучшения воспроизводимости и доступности данных о сфероидах была разработана база знанийMISpheroID26, определяющая клеточную линию, культуральную среду, метод формирования и размер сфероидов в качестве минимальной информации для воспроизводимого результата. В связи с этим было проведено подробное сравнение нескольких высокопроизводительных (SphericalPlate 5D, лабораторные микроформы и микротканевые формы) и методов с низким прикреплением (т.е. 96-луночных планшетов с покрытием Biofloat и липидура, как бескаркасных, так и на основе скаффолдов) (рис. 1 и табл. 1), включая размер лунки (с учетом оценки максимального размера сфероида), используемые расходные материалы, время приготовления и возможность мониторинга сфероидов без их транспортировки в микроскопические чашки. Последнее позволяет проводить долгосрочные исследования, в то время как сфероиды, полученные с помощью высокопроизводительных методов, часто приводят к экспериментам с конечными точками. Все методы, за исключением сеток 5DspheriPlate, не вносят нежелательную автофлуоресценцию, что позволяет использовать их непосредственно в микроскопии.
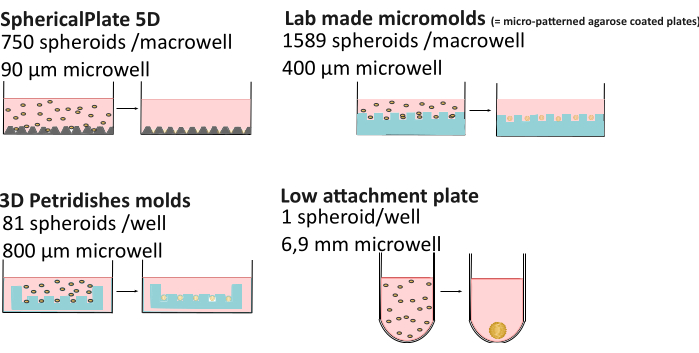
Рисунок 1: Объяснение методов формирования сфероидов. Высокопроизводительные методы, такие как SphericalPlate 5D, в который встроены запатентованные микролунки, в то время как в микроформах, произведенных в лаборатории, и формах MicroTissue используются штампы для изготовления нескольких микролунок в агарозе (синего цвета). Пластины с низким уровнем адгезии, такие как Lipidure (Amsbio) и Biofloat (Sarstedt), имеют неадгезивное покрытие, препятствующее адгезии к клеточной поверхности и способствующее самоагрегации клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| 5D SpheriPlate | Микроформы собственного производства | Микроткань | Низкие методы крепления | |
| Количество сфероидов/лунка | 750 | 1589 | 81 | 1 |
| Диаметр лунки | 90 мкм | 400 мкм | 800 мкм | 1 мм |
| Объем культуры | 1 мл | 5 мл | 1 мл | 200 μл |
| Другие расходные материалы | / | 7 мл 3% агарозы | 500 мкл 2% агарозы | / * |
| Время подготовки | 10 мин | 2 ч + 3 дня адаптация СМИ | 0,5 ч + 15 мин адаптация среды | 10–30 мин + 1 ч сушки |
| Контроль | Да | Нет** | Да | Да |
| Автофлуоресцентные | Да | Нет | Нет | Нет |
| Многоразовый | Нет | Да | Да | Нет** |
| Стоить | €€ | € | €€€€ | €€€: Покрытие и матригель |
| €€: Коммерческий 96-луночный планшет | ||||
| * Некоторые клеточные линии нуждаются в добавлении ВКМ (т.е. 2%–5% Матригеля) для образования компактных сфероидов. | ||||
| ** Покрытие можно использовать повторно до тех пор, пока оно не будет исчерпано. Однако каждая пластина будет потреблять небольшое количество среды, и со временем может накапливаться пыль. Регулярная стерилизация фильтров необходима. | ||||
Таблица 1: Сравнение методов формирования множественных сфероидов29. "Мониторинг": возможность мониторинга сфероида без необходимости переноса на микроскопическую чашку. €: 0-50€, €€: 50-150€, €€: 150-500€, €€€: >500€
Флуоресцентная микроскопия позволяет осуществлять прямой мониторинг ключевых биологических аспектов сфероидов, включая гибель клеток, жизнеспособность, пролиферацию, метаболизм, вязкость и даже механическиесвойства. Флуоресцентная микроскопия с визуализацией времени жизни (FLIM) обеспечивает дополнительное количественное измерение для изучения взаимодействий флуоресцентных зондов в их (микро)среде 31,32,33,34, позволяя разрешать перекрывающиеся спектры излучения в соответствии с различными временами жизни излучения35,36 и зондирование клеточного метаболизма на основе внутренней клеточной аутофлуоресценции. Таким образом, такие широко распространенные клеточные автофлуоресцентные соединения, как никотинамидадениндинуклеотидфосфат (NAD(P)H), флавинмононуклеотид (FMN), флавинадениндинуклеотид (FAD), протопорфирин IX и другие, могут быть измерены с помощью одно- и двухфотонного FLIM и служить внутренними «сенсорами» катаболизма глюкозы, окислительного фосфорилирования (OxPhos) и дают общее представление о окислительно-восстановительном состоянии клеток. NAD(P)H существует в свободных цитоплазматических или в связанных с белками митохондриальных формах37,38. Аналогичным образом, окисленная степень FAD флуоресцентна с более длительным временем жизни свободной формы. Микроскопии NAD(P)H и FAD обычно используют двухфотонное возбуждение FLIM, направленное на предотвращение фотоповреждения образца39. Часто «оптическая метаболическая визуализация» FLIM может сочетаться с использованием зондов на основе красителей, генетически кодированных биосенсоров, микроскопии с визуализацией в течение жизни фосфоресценции (PLIM) и измерений, основанных на ратиометрической интенсивности, чтобы обеспечить более полную картину метаболизма сфероидов или органоидов, оксигенации, пролиферации и жизнеспособности клеток 29,30,31. Кроме того, FLIM также может быть объединен с методом резонансного переноса энергии (FRET) компании Förster для измерения изменения продолжительности жизни донорского флуорофора при тесном контакте с акцептором для исследования связывания лекарственного препарата с его целевым доменом 33,40,41.
Полученные изображения FLIM обычно анализируются для вычисления времени жизни попиксельно. В настоящее время существует, по крайней мере, 3 общие стратегии, используемые для получения времени жизни флуоресценции: полуколичественная «быстрая FLIM»42 (иногда называемая «тау-чувством»43,44), аппроксимация кривой затухания с использованием одно-, двух- или трехэкспоненциальной аппроксимации и «безаппроксимирующий» подход с фазорным преобразованием и анализом векторных графиков. В зависимости от поставщика, для обработки измеренных данных FLIM может использоваться либо предоставленное (LAS X, Symphotime, SPCImage и т.д.), либо программное обеспечение с открытым исходным кодом (например, FLIMfit45, FLIMJ46 или другие47). Как правило, программное обеспечение, предоставляемое поставщиками, полезно для предварительного анализа данных, в то время как решения с открытым исходным кодом могут обеспечить более точные исследования с использованием, например, векторных графиков и 3D-визуализации.
Несмотря на полезность и привлекательность FLIM в качестве метода изучения сфероидов, существует очень мало экспериментальных протоколов, и существует общая нехватка знаний о выборе наиболее подходящего метода формирования для успешных экспериментов по мультипараметрической микроскопии с использованием FLIM. В данной работе представлено подробное сравнение широко используемых протоколов формирования сфероидов на основе их морфологии, жизнеспособности и оксигенации с недавно валидированным и охарактеризованным наносенсором для зондирования кислорода (MMIR1) в дальнем красном и ближнем инфракрасном диапазонах (NIR). Катионная наночастица пропитана двумя репортерными красителями: эталонным O 2-нечувствительным aza-BODIPY (возбуждение 650 нм, излучение 675 нм) и NIR O2-чувствительным металлопорфирином PtTPTBPF (возбуждение 620 нм, излучение 760 нм). MMIR1 позволяет анализировать градиенты кислорода в режиме реального времени на обычном флуоресцентном микроскопе (с использованием ратиометрического анализа) или фосфоресцентном микроскопе (PLIM) без введения клеточной токсичности и обеспечивая стабильные сигналы, долгосрочный мониторинг и мультиплексирование25,29. В зависимости от необходимости окрашивания красителями или наносенсорами, пропускной способности сфероида или типа клетки может быть выбран наиболее подходящий протокол формирования. Поскольку исследования жизнеспособности и оксигенации сфероидов актуальны для исследований рака и сфероидов, полученных из стволовых клеток, представленные протоколы также включают примеры и ожидаемые типичные результаты NAD(P)H-FLIM и FAD-FLIM с этими моделями. Представленные конвейеры визуализации и анализа нацелены на наиболее популярные платформы микроскопии FLIM на основе подсчета одиночных фотонов с корреляцией по времени.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Генерация многоклеточных сфероидов
- Культура клеток
ПРИМЕЧАНИЕ: Клеточные культуры могут быть собраны из American Type Culture Collection (ATCC), Lonza, Sigma-Aldrich или других поставщиков. ATCC предоставляет всю необходимую информацию по обращению, включая предпочтительные питательные среды, процедуры субкультивирования, уровень биобезопасности, скорость роста и профили STR. Здесь 500 клеток/сфероид клеточной линии рака толстой кишки человека HCT116 используется в среде McCoy's 5A (VWR, 392-0420) с добавлением 10% FBS и 1 мМ пирувата натрия. Для долгосрочных экспериментов, которые контролируются ежедневно, в среду можно добавлять 10 мМ HEPES, pH 7,2.- Выращивайте клеточную культуру до 70%-90% конфлюенции.
- Промойте клетки предварительно подогретым (37 °C) стерильным PBS (5 мл на 25 см2 или 10 мл на колбу 75 см2 ).
- Добавить 0,05% трипсин - 1 мМ раствор ЭДТА (0,5 мл на 25 см² или 1 мл на 75 см2 колбы) и инкубировать 5-10 мин при 37 °С при 5%СО2, 95% влажности до достижения отслойки клеток.
ПРИМЕЧАНИЕ: Управление отделением ячейки под микроскопом просвечивающего света (светлопольного). Чрезмерное воздействие на клетки диссоциирующего раствора фермента может повлиять на их жизнеспособность. - Нейтрализуйте трипсин путем добавления избыточной среды для клеточных культур, содержащей 10% FBS (не менее 5 мл среды на 1 мл диссоциативного раствора).
Примечание: Для клеток, культивируемых на питательных средах с низким содержанием FBS или без FBS, нейтрализация трипсина может быть выполнена путем добавления 0,5 мл 100% FBS в культуру клеток, обработанных трипсином, с последующим центрифугированием для переноса клеток в их исходные питательные среды. - Диссоциацию клеточных агрегатов методом пипетирования с получением одноклеточной суспензии в среде.
ПРИМЕЧАНИЕ: Пипетирование с помощью серологической пипетки с наконечником пипетки объемом 1000 мкл в верхней части значительно улучшает образование суспензии одиночных клеток в большом объеме культуры суспензионных клеток. - Используйте счетную камеру (гемоцитометр с линейкой Нейбауэра или альтернативы) для подсчета количества клеток на 1 мл клеточной суспензии.
- Разбавляют клеточную суспензию до получения нужного количества клеток на миллилитр.
- Добавьте концентрированный раствор зонда О2 (наночастиц) в клеточную суспензию в конечной концентрации 10 мкг/мл для ратиометрического анализаО2.
ПРИМЕЧАНИЕ: Чтобы обеспечить однородную клеточную суспензию (с помощью зонда), повторно суспендируйте несколько раз перед формированием сфероида. Если зондО2 не требуется, пропустите этот шаг и приступайте к формированию сфероидов. При работе с iPSC следует применять модифицированный протокол. Вкратце, iPSCs выращивают колониями на планшетах, покрытых Geltrex, и пассажируют с использованием ReLeSR, как описано в протоколе48, предоставленном поставщиком. В день образования сфероидов колонии должны быть большими, компактными и иметь многослойные центры с четкими границами. Промойте клетки предварительно подогретым стерильным ПБС. Добавьте 1 мл щадящего реагента для диссоциации клеток (GCDR) и инкубируйте при 37 °C в течение 8-10 минут. С помощью наконечника объемом 1000 мкл аккуратно отделите клетки от лунки и получите одноклеточную суспензию. Перенесите суспензию одиночных клеток в стерильную коническую пробирку объемом 50 мл и добавьте 4 мл предварительно подогретой среды DMEM-F12 для нейтрализации GCDR. Промойте лунку 1 мл DMEM-F12 и перенесите его на оставшуюся клеточную суспензию. Центрифугируйте при 300 х г в течение 5 мин. Ресуспендировать в 1 мл соответствующей среды для дальнейших экспериментов. Для экспериментов, описанных в данной рукописи, использовали mTeSR + 10 мкМ Rock Inhibitor. Подсчитайте и разведите клеточную суспензию для получения нужного количества клеток на миллилитр.
- Методы формирования сфероидов
- 3D чашка Петри для микроформ
ПРИМЕЧАНИЕ: Этот высокопроизводительный метод используется для одновременного получения большого количества сфероидов (81 сфероид) в микропресс-форме размером 9 x 9 с диаметром 800 мкм и глубиной 800 мкм.- Промойте микроформы для литья 3D чашек Петри в dH2O и поместите в автоклавируемую емкость.
- Отмерьте 2 г порошка агарозы электрофорезного качества и поместите его в сухую стеклянную бутылку объемом 200 мл, пригодную для автоклава.
ПРИМЕЧАНИЕ: Убедитесь, что флакон и агарозный порошок сухие, без жидкости и влаги. - Автоклавные микроформы для литья 3D чашек Петри и бутылок с агарозным порошком в течение 30 мин на сухом цикле.
- Приготовьте 0,9 мас.% физиологического раствора путем добавления 0,9 г NaCl в 100 мл сверхчистой воды и стерилизуйте автоклавированием.
ПРИМЕЧАНИЕ: NaCl рекомендован производителем. Это повышает устойчивость агарозы. - Приготовьте раствор агарозы, добавив стерильный физиологический раствор в стерилизованный порошок агарозы. Закрутите крышку плотно прилегающей плотно во избежание повышения давления. Взболтайте в бутылке, чтобы смешать порошок агарозы.
- Вскипятите и растворите порошок агарозы, используя микроволновую печь. Выключайте микроволновую печь часто (~каждые 10 секунд). Перемешайте бутылку и повторяйте, пока агароза не растворится.
ВНИМАНИЕ: Раствор агарозы горячий и требует осторожного обращения. Встряхивание сразу после процедуры плавления может привести к тому, что раствор вырвется из сосуда. Во избежание несчастных случаев используйте достаточно большие сосуды, заполненные не более чем на 50% вместимости, и используйте соответствующие средства индивидуальной защиты (перчатки, рукавица, средства защиты глаз и лабораторный халат). - Дайте растворенному раствору агарозы остыть до 60-70 °С. Используя асептические методы и условия, пипетка впрыскивает расплавленную агарозу в микроформу (500 μл для серии 12 или 330 μл для серии 24).
ПРИМЕЧАНИЕ: Избегайте образования пузырьков при смешивании или пипетировании агарозы. Удалите все мелкие пузырьки в мелких деталях микроформы с помощью пипетирования или осторожного соскабливания до того, как агароза затвердеет. - Дайте агарозе застыть около 2-3 минут. После этого осторожно согните микроформу, чтобы удалить 3D чашку Петри и перенести на 12-луночный планшет для культуры тканей.
ПРИМЕЧАНИЕ: Чрезмерное изгибание микроформы может привести к образованию трещин внутри агарозной формы. - Чтобы уравновесить 3D чашку Петри, добавьте 2,5 мл на лунку клеточную культуральную среду. Инкубируйте в течение 15 минут или дольше. Удалите питательную среду и замените ее свежей средой. Повторите еще раз, чтобы уравновесить 3D-чашку Петри с питательной средой.
ПРИМЕЧАНИЕ: Здесь протокол может быть прерван до посева клеток. Для длительного хранения (до 2 недель при 4 °С) используйте раствор PBS вместо среднего. - Полностью снимите 3D-чашку Петри, окружающую питательную среду (или PBS), и аккуратно удалите среду внутри 3D-чашки Петри, наклонив планшет для культуры тканей.
- Осторожно засейте 190 мкл клеточной суспензии, содержащей 40 500 клеток, по каплям в камеру посева клеток (см. шаг 1.1).
ПРИМЕЧАНИЕ: Количество микролунок в агарозных марках определяет количество сфероидов, производимых на одном штампе. В этом случае эта агарозная плесень содержит 81 микролунку (81 x 500 клеток/сфероид). Изменение концентрации клеток в суспензии, добавленной в макролунку, позволяет изменять количество клеток на сфероиде, тем самым контролируя размер сфероида. - Подождите ~10 минут, чтобы ячейки обосновались в функциях 3D Petri dsh. Затем добавьте 2 мл среды на внешнюю сторону 3D-чашки Петри.
- Поместите планшет для культуры тканей в инкубатор для клеточных культур и при необходимости замените среду, окружающую 3D-чашку Петри.
- Низкая крепежная пластина
ПРИМЕЧАНИЕ: Этот метод используется для создания одного сфероида на лунку. Пластины с покрытием (Lipidure или Biofloat) имеются в продаже (пропустите шаги 1.2.2.1-1.2.2.4). В качестве альтернативы покрытие можно приобрести отдельно и использовать для покрытия необработанных многолуночных пластин. Скважины по краям 96-луночных пластин рекомендуется заполнять стерильной водой или ПБС из-за более быстрого испарения в этих лунках, тем самым ограничивая количество лунок для сфероидов до 60. В случае, если сфероидов нужно меньше, заполните окружающие пустые колодцы водой или PBS. Используйте беспыльные наконечники для работы с жидкостью, чтобы избежать попадания мелких частиц в лунки, так как они мешают образованию сфероида.- Приготовьте 0,5 мас.% раствора для покрытия, растворив 0,25 г полимерного порошка в 50 мл этанола в стеклянной бутылке. Отфильтруйте и простерилизуйте покрытие.
ПРИМЕЧАНИЕ: Стерилизация фильтра и все последующие шаги должны проводиться в стерильных условиях под ламинарным потоком. - Добавьте 200 мкл раствора для нанесения покрытия в каждую лунку культуральной пластины с U-образным дном 96.
- Выдержать 1 минуту и снять излишки покрытия.
ПРИМЕЧАНИЕ: Решение для нанесения покрытия можно использовать несколько раз. Хранить в стеклянной таре при комнатной температуре (RT). Пластиковые контейнеры не рекомендуются, так как пластик может частично раствориться и стать частью раствора. Если присутствует пыль, простерилизуйте фильтр с помощью полиэфирсульфонового (PES) или нейлонового шприцевого фильтра 0,22 мкм. - Дайте 96-луночной пластине высохнуть на воздухе в течение примерно 1 часа.
Примечание: Если клеткам необходим внеклеточный матрикс, перейдите к шагу 1.2.3. Пластины с покрытием могут храниться в RT в завернутом в алюминий до 1 месяца. При посеве меньшего количества клеток/лунок, центрифугирование планшета в течение 5 минут при 300 g может помочь вытащить ячейки.
- Приготовьте 0,5 мас.% раствора для покрытия, растворив 0,25 г полимерного порошка в 50 мл этанола в стеклянной бутылке. Отфильтруйте и простерилизуйте покрытие.
- Протокол формирования внеклеточного матрикса
Примечание: Некоторые клеточные линии сами не производят достаточное количество внеклеточного матрикса (ВКМ) и нуждаются в добавлении ВКМ, таких как Matrigel, Cultrex или Geltrex, для образования компактных сфероидов 49,50,51. Для таких типов клеток, как рак молочной железы MDA-MB-231, дермальный сосок человека, клетки рака предстательной железы и другие, возможно использование шага 1.2.2 со следующими модификациями52, требующими добавления ВКМ. Желательно использовать беспыльные наконечники для работы с жидкостью, чтобы избежать попадания пыли в сфероидальную форму. Этапы 1 и 4-7 должны выполняться в шкафу биологической безопасности (класс II).- Выполните шаги 1.2.2.1-1.2.2.4 (пластины с низким уровнем крепления) для обработки поверхности.
- Предварительно охладите 96-луночную тарелку при температуре 4 °C в холодильнике.
- Подготовьте центрифугу с помощью подходящего адаптера для 96-луночного планшета и предварительно охладите ее до 4 °C.
- Приготовьте 5% раствор матрицы базальной мембраны (BMM) в предварительно охлажденной (4 °C) среде для клеточных культур.
ПРИМЕЧАНИЕ: BMM быстро слинковывает на RT. При работе держите запасы и растворы на льду. - Приготовьте клеточную суспензию (см. шаг 1.1).
- Добавьте по 50 мкл раствора BMM в каждую лунку.
- Аккуратно добавьте 50 мкл клеточной суспензии в каждую лунку поверх раствора BMM (25 000 клеток на лунку).
ПРИМЕЧАНИЕ: Не выбрасывайте этот объем в колодец, иначе ячейки будут распространяться вверх по бокам колодцев и не будут собираться на дне. Меньшее количество ячеек на лунку может быть получено путем соответствующей регулировки плотности ячеек. Не все клетки образуют сфероиды при любой плотности посева; Оптимизация должна быть выполнена по типу ячейки и желаемым размерам. При предоставленных объемах конечная концентрация BMM составляет 2,5%. Если требуется другая концентрация, исходный раствор должен быть приготовлен при более низкой/высокой концентрации. - Центрифугируйте 96-луночный планшет в течение 5 минут при 300 x g и 4 °C.
ПРИМЕЧАНИЕ: Без этого шага ячейки не могут должным образом агрегироваться на дне скважины, что приводит к образованию множества более мелких агрегатов. На этом этапе центрифугу необходимо охлаждать, чтобы избежать сшивки. - Поместите планшет в инкубатор для клеточных культур. Агрегаты считаются зрелыми на 4 день после посева.
ПРИМЕЧАНИЕ: Дополнительные протоколы по формированию сфероидов см. в Дополнительном файле 1.
- 3D чашка Петри для микроформ
2. Живая микроскопия сфероидов
- Подготовка сфероидов к анализу изображений в реальном времени
ПРИМЕЧАНИЕ: В зависимости от плана эксперимента (например, долгосрочный мониторинг или анализ конечных точек, настройка микроскопа или спектральные свойства измеряемой флуоресценции) или из-за несовместимости метода производства сфероидов с микроскопией (например, толщина образца, автофлуоресценция материала, плавающее количество сфероидов во время визуализации) прямой мониторинг сфероидов в пластине, где они были получены, может оказаться невозможным. Протокол объясняет подготовку сфероидов к визуализации, которые подходят для большинства инвертированных широкопольных и конфокальных микроскопов.- Подготовьте и подогрейте (37 °C) среды для визуализации: DMEM с добавлением HEPES-Na, pH 7,2 (10 мМ), пирувата натрия (1 мМ), L-глутамина (2 мМ) и глюкозы (5 мМ), без фенола красного.
ПРИМЕЧАНИЕ: Можно использовать бикарбонат натрия отдельно или в комбинации с HEPES-Na, если во время визуализации24 обеспечивается контроль CO2. Некоторые типы клеточных культур не переносят присутствие HEPES. В зависимости от плана эксперимента содержание пирувата, глутамина и глюкозы может быть изменено. - Приготовьте стерильные микроскопические чашки (коммерчески доступные или изготовленные в лаборатории) с покрытием (для сильной адгезии сфероида) или без покрытия (низкая адгезия сфероида) покровными стеклянными поверхностями (толщина #1,5).
Примечание: Необходимость и тип покрытия зависят от типа клеток, адгезионных свойств сфероидов и скорости их миграции клеток из 3D в 2D интерфейс культуры. Это важно учитывать, так как покрытие может способствовать потере 3D-организации, изменению формы микроградиентов у сфероидов и, как следствие, поведения клеток. Для некоторых экспериментов (например, при визуализации анализировалась реакция на стимуляцию лекарственными препаратами) требуется сильное прилегание сфероида к поверхности, и предпочтительно покрытие желатином, BMM, коллагеном, коллагеном/поли-D-лизином или поли-D-лизином. - Аккуратно промойте сфероиды, окрашенные зондомО-2 , из микролунок микроузорчатого агарозного или 96-луночного планшета и переложите еще плавающие сфероиды во флакон объемом 2 мл.
ПРИМЕЧАНИЕ: Для обеспечения сбора всех сфероидов методом высокой пропускной способности необходимо 1-3 раза промыть форму с дополнительным объемом питательных сред, объединив все сфероидные суспензии в одном флаконе. Для сфероидов в низком прикрепляющем планшете собирайте сфероиды по одному из отдельных лунок в флакон или непосредственно в чашку для микроскопии, если для эксперимента достаточно небольшого количества сфероидов. При переносе больших сфероидов обрежьте конец кончика пипетки, чтобы не повредить его во время пипетирования. - Оставьте флакон в вертикальном положении на срок до 5 минут, чтобы сфероиды осядли на дне флакона, образуя видимую гранулу.
- Извлеките среду из пробирки, оставив сфероиды нетронутыми, и аккуратно повторно суспендируйте их в достаточном количестве свежей культуры.
ПРИМЕЧАНИЕ: Для удобства работы со сфероидами перенос сфероидов на носители изображения также может быть выполнен на этом этапе небольшими партиями; Смотрите шаги 2.1.7 и 2.1.8. К сфероидам из разных экспериментальных групп следует относиться одинаково, так как состав среды и время предварительного кондиционирования среды могут влиять на их метаболизм. - Пока сфероиды находятся в плавании, переносите равный объем сфероидальной суспензии на лунку микроскопической чашки.
- Инкубируйте сфероиды в течение 1-2 ч при 37 °C в инкубаторе сСО2 , чтобы обеспечить их прикрепление к поверхности микроскопической чашки/лунки. Для визуализации перейдите к шагу 2.1.9. Для окрашивания сфероидов дополнительными зондами приступают к шагу 2.1.8.
ПРИМЕЧАНИЕ: Скорость миграции клеток от 3D-сфероида к интерфейсу 2D-поверхности является функцией времени. Чтобы избежать потери 3D-организации, время инкубации должно быть оптимизировано с учетом типа клеток, типа покрытия поверхности и плана эксперимента. Например, HCT116, в зависимости от размера сфероида, требуется не менее 2 часов для правильного прикрепления сфероида к поверхности, покрытой коллагеном IV/поли-D-лизином, в то время как прикрепление hDPSC и миграция в 2D-интерфейс происходит чрезвычайно быстро, что приводит к потере 3D-организации за 1-2 часа. Чтобы избежать визуализации «2D-сфероидов» из-за чрезмерного растекания, используются стеклянные поверхности без покрытия с уменьшенным временем инкубации. - Добавьте флуоресцентный зонд (зонды) в рекомендуемых или эмпирически оптимизированных концентрациях к известному объему сфероидной суспензии. Перед визуализацией инкубатор инкубировать в течение 1 ч при 37 °CCO2 .
ПРИМЕЧАНИЕ: Для анализа живых/мертвых веществ используйте йодид пропидия и кальцеин Грин-АМ в стандартной конечной концентрации 1 г/мл. Чтобы избежать токсического эффекта окрашивания йодидом пропидида на эмбриоидные тельца iPSC, конечная концентрация йодида пропидиума составляла 0,5 мкг/мл. Время загрузки зонда может быть увеличено, если диффузия щупа неэффективна из-за большого размера сфероида. Время загрузки всегда следует рассматривать как часть общего времени инкубации, необходимого для крепления сфероида к поверхности. Если для крепления сфероида требуется более длительное время, то процедуру окрашивания следует устраивать в конце этого срока. Имейте в виду, что более длительное время инкубации может привести к потере 3D-организации. - Удалите среды для клеточных культур или среды, содержащие флуоресцентные зонды, и замените их на необходимый объем среды для визуализации. Чтобы убедиться в отсутствии фона флуоресценции среды на пути получения сфероидальной визуализации, повторите этап замены (промывки) среды до 5 раз.
ПРИМЕЧАНИЕ: Чтобы избежать удаления сфероида во время замены среды, рекомендуется осторожно отсасывать среду пипеткой объемом 200 мкл от краев микроскопических чашек и выполнять добавление медиа у стены или сбоку в микроскопической чашке. - Немедленно перейдите к шагу 2.2.1 протокола визуализации.
Примечание: Слишком долгий перерыв между подготовкой к визуализации и фактическим получением изображений может повлиять на клеточный метаболизм (например, через изменение состава среды), жизнеспособность (некоторые флуоресцентные зонды, используемые для анализа конечных точек, обладают токсическими эффектами, которые могут стимулировать гибель клеток после длительного инкубационного периода), а также привести к потере 3D-организации. Если необходимо сравнить несколько групп сфероидов или экспериментальных условий, то план эксперимента должен быть разработан таким образом, чтобы время проведения процедур, предварительного кондиционирования и визуализации между анализируемыми группами было как можно более равномерным.
- Подготовьте и подогрейте (37 °C) среды для визуализации: DMEM с добавлением HEPES-Na, pH 7,2 (10 мМ), пирувата натрия (1 мМ), L-глутамина (2 мМ) и глюкозы (5 мМ), без фенола красного.
- Получение изображений
ПРИМЕЧАНИЕ: Протокол описывает многопараметрическую визуализацию живых сфероидов с помощью конфокального микроскопа Stellaris 8 Falcon (Leica) и программного обеспечения Leica Application Suite X (LAS X) версии 4.7. Однако для выполнения такого анализа на альтернативных платформах микроскопии потребуются лишь незначительные модификации.- Включите термоклимат-контроль за 30-60 минут до начала съемки. Установите необходимую скорость проветривания и температуру (35-37 °С).
ПРИМЕЧАНИЕ: Если в дополнение к контролю температуры необходимо контролировать концентрацию газов (например, CO2 или O2) во время визуализации, соответствующие устройства также должны быть запущены заранее, чтобы достичь необходимых условий до получения изображения. - Включите микроскоп и подключенные к нему устройства (например, лазер WLL, компьютер, водяной насос для объектива погружения в воду и другие работающие электронные блоки). Запустите программное обеспечение для управления микроскопом (например, LAS X Machine Mode или Machine Mode with Environmental Control), поставляемое с точной настройкой микроскопа, и инициализируйте калибровку предметного столика.
- Выберите нужную цель в программном обеспечении и при необходимости нанесите иммерсионную жидкость.
ПРИМЕЧАНИЕ: Для живой микроскопии рекомендуется использовать либо водные, либо глицериновые иммерсионные объективы с достаточным («длинным») рабочим расстоянием, например, HC Fluotar L 25x/0,95 W VIS IR (рабочее расстояние 2,4 мм), HC PL Apo 40x/1,25 GLYC (рабочее расстояние 0,35 мм) или не менее NA = 0,4 или выше для воздушных объективов. Выбор увеличения и рабочего расстояния зависит от характера и размера визуализируемого образца и измеряемых сигналов флуоресценции (яркость, квантовый выход, эффективность окрашивания, см., например, обсуждение красителей и наночастиц53). Большие объекты (сфероиды или органоиды размером >500 мкм), «биореакторы» или микрофлюидные чипы требуют объективов с большим рабочим расстоянием и меньшим увеличением, в то время как анализ отдельных клеток или клеточных органелл требует большого увеличения, часто достигаемого с помощью «мозаичной» визуализации. - Установите на сцене чашку для микроскопии со сфероидами. Отрегулируйте фокус и найдите объект/область интереса (ROI).
Примечание: Если необходимо найти небольшие, слабофлуоресцентные, малоконтрастные или редкие объекты, а нахождение фокуса затруднено, рекомендуется предварительно сфокусироваться на стенках микроскопической чашки и «экранировать» поверхность для интересующего объекта серпантином, начиная с одного из углов лунки. - Выберите окно « Открыть проект» и нажмите на соответствующий значок « Создать новый проект». Присвойте файлу исследовательского проекта стандартное имя (например, начиная с «YY-MM-DD+ description»). Во время создания изображений все созданные изображения будут автоматически сохранены в созданный файл проекта .lif .
- Откройте окно Приобретение . Установите длину волны возбуждения лазера белого света (WLL) и требуемый диапазон гибридных или резонансных сканирующих детекторов (типа HyD S, HyD X или HyD R) на основе известных спектральных свойств измеряемой флуоресценции (спектров возбуждения/поглощения и излучения). Выберите тип сканирования «Линия» или «Кадр ».
ПРИМЕЧАНИЕ: Для большинства коммерчески доступных флуоресцентных красителей спектральные свойства можно найти (или добавить) в пакете LAS X Dye Assistant. Выберите детектор с подходящим диапазоном спектральной чувствительности, совместимым со спектральными свойствами зонда и, в случае FLIM, совместимым с подсчетом фотонов (т. е. HyD X или HyD R). Для многопараметрической визуализации установка WLL в нескольких положениях возбуждения (например, для одновременной визуализации FAD/флавинов и двух флуоресцентных каналов ратиометрического зонда MMIR1 O2 - опорного и чувствительного, настройки возбуждения/излучения могут составлять 460 нм/510-590 нм HyD X1 и 614 нм/631-690 HyD X3 и 724-800 нм HyD R соответственно в одной или двух последовательных последовательностях сканирования). Важно назначить соответствующий детектор для сбора излучения, так как детекторы могут иметь различную спектральную чувствительность54. - (Опционально для FLIM) В окне Сбор данных выберите режим FLIM для выполнения визуализации в сочетании с подсчетом фотонов (сбором распада). Сразу же будет открыт дополнительный модуль «FLIM в программном обеспечении LAS X» для навигации и анализа данных FLIM.
- (Опционально для FLIM) Выберите частоту следования импульсов WLL в зависимости от ожидаемого среднего срока службы флуорофора.
ПРИМЕЧАНИЕ: Частота лазерного импульса должна быть отрегулирована для сбора полного затухания флуоресценции. Это можно сделать с помощью функции Pulse Picker , установленной на микроскопе. Наложение затухания флуоресценции на лазерный импульс приведет к сокращению расчетного времени жизни флуоресценции. Рекомендуется иметь интервалы импульсов в 4-5 раз больше ожидаемого среднего времени жизни флуоресценции (например, 25 нс/40 МГц для времен жизни до 5 нс). Многие импульсные лазеры имеют фиксированную частоту следования 80 МГц (идеально подходит только для диапазона до 2-3 нс). Это важно для выбора правильных флуорофоров для эксперимента. - Запустите предварительный просмотр изображения в режиме FAST LIVE и отрегулируйте точную фокусировку объекта изображения на интересующем участке.
ВНИМАНИЕ: Строго соблюдайте правила безопасности лазера. Всегда учитывайте правила безопасности лазера и дождитесь остановки изображения, прежде чем включать просвечивающий свет, смотреть в окуляр или на образец.
ПРИМЕЧАНИЕ: В режиме FAST LIVE к изображению автоматически применяется высокоскоростное сканирование с частотой 600 Гц (соответствует максимальной частоте кадров 4,43/с при использовании двунаправленного режима сканирования X) и разрешением 256 x 256 пикселей, чтобы защитить флуоресценцию от фотообесцвечивания. Откройте отверстие (например, на 3-4 а.е.) и/или увеличьте интенсивность лазера, если сигнал флуоресценции слишком слаб для фокусировки на объекте. Избегайте неполного сбора кариеса. - (Опционально для FLIM) Глядя на гистограмму интенсивности пикселей, появляющуюся во время визуализации в окне модуля FLIM (режим реального времени), отрегулируйте соответствующую интенсивность/размер и разрешение лазерного отверстия, чтобы достичь предела скорости подсчета ~1 фотон/лазерный импульс (красная линия). Избегайте значительно выше 1, чтобы исключить риск эффекта накопления. При необходимости отрегулируйте частоту следования импульсов WLL таким образом, чтобы в окне затухания отображалась полная коллекция затухания (во избежание неполной коллекции затухания см. шаг 2.2.8).
ПРИМЕЧАНИЕ: Если количество фотонов (интенсивность) недостаточно для восстановления надежного затухания для анализа подгонки или облака векторных графиков, примените несколько повторов сканирования (кадров или линий, или настройте время сканирования), увеличьте интенсивность лазера и/или пожертвуйте разрешением (размером ROI сканирования). Имейте в виду, что для уменьшения частоты лазерного следования требуется собрать больше фотонов для надежной реконструкции распада, и может потребоваться дополнительная коррекция параметров изображения. Помните о потенциальном влиянии интенсивного света и длительного непрерывного освещения на жизнеспособность клеток и метаболизм55. Негативное влияние на жизнеспособность и метаболизм может быть различным в каждом отдельном случае, в зависимости от интенсивности, продолжительности и длины волны возбуждающего света, а также от модальности визуализации (например, однофотонная конфокальная или многофотонная визуализация). Соответствующим образом отрегулируйте параметры визуализации и, при необходимости, контролируйте жизнеспособность/гибель клеток с помощью Calcein Green-AM или интенсивность йодида пропидиума в пилотных экспериментах56. По возможности следует рассмотреть возможность дальнейшей оптимизации протокола окрашивания флуоресцентным зондом для достижения адекватного флуоресцентного сигнала во время микроскопии в реальном времени. - (Опционально для 3D z-стека) В режиме Fast Live задайте координаты, направление сканирования и присвойте им значения «Начало » и «Конец » в окне Z-стека (режим сканирования XYZ). Выберите размер Z-шага или количество ступеней.
ПРИМЕЧАНИЕ: В то время как программное обеспечение автоматически рассчитывает «оптимальное» количество шагов на основе используемого разрешения и параметров сканирования, 3D-реконструкция в реальном времени обычно может потребовать меньшего количества шагов для достижения быстрого сбора, например, размер шага 1-2 мкм, размер стека 50-100 мкм, двунаправленное сканирование, требующее 2-3 минуты от общего времени сканирования. Имейте в виду, что субклеточные органеллы, клетки и 3D-модель клетки также могут перемещаться во время измерений. Кроме того, из-за глубины проникновения света и пределов рассеяния обычно можно достичь только 50-100 мкм глубины сканирования на конфокальном FLIM. - Когда все необходимые настройки применены, приступайте к созданию образа.
- Присвойте изображению подходящее имя.
- Найдите следующий объект изображения в режиме пропускающего света и повторите процедуру визуализации с предварительно оптимизированными настройками изображения (шаги 2.2.8-2.2.12).
ПРИМЕЧАНИЕ: Для сравнения на основе интенсивности или анализа отношения интенсивностей (например, анализа оксигенации на основе зонда MMIRO2) всегда сохраняйте одни и те же настройки изображения для всех анализируемых объектов (увеличение и тип линзы объектива, интенсивность лазера, мощность и частота импульсов, длина волны возбуждения, дальность детектора, точечное отверстие, скорость сканирования, время задержки пикселей и разрешение). Однако, поскольку время жизни флуоресценции не зависит от интенсивности флуоресценции и требует сбора соответствующего количества фотонов для надежного расчета, параметры визуализации FLIM могут быть скорректированы в ходе эксперимента, чтобы сохранить количество собранных фотонов сопоставимым при различных методах обработки или экспериментальных условиях. Таким образом, для многопараметрического анализа, где требуется как анализ на основе интенсивности, так и анализ на основе времени жизни флуоресценции, для всех объектов в сравниваемых экспериментальных группах необходимо применять оптимизированные универсальные настройки визуализации. Для сравнения "только FLIM" можно сравнивать изображения, полученные с немного отличающимися настройками изображения, поскольку программное обеспечение LAS X обеспечивает расчет IRF для отдельного измерения изображения42. Однако для анализа FLIM-fitting вне LAS X (например, FLIMfit45) функция отклика инструмента (IRF) должна измеряться для каждого отдельного условия визуализации, поскольку она не может быть экспортирована из программного обеспечения для визуализации. Таким образом, для простоты планирования эксперимента и рабочей нагрузки рекомендуется применять одни и те же настройки визуализации для всех изображений в наборе данных. Затем соответствующие измерения IRF могут быть выполнены с использованием гашеных или быстрых флуоресцентных флуорофоров со временем жизни (в диапазоне ps) с эмиссионными свойствами измеряемого спектрального канала 57,58,59, люминесценцией наночастиц золота 60 или сигналом генерации второй гармоники для мультифотона FLIM61. В программном обеспечении LAS X ранее оптимизированные параметры изображения можно загрузить для нового проекта, щелкнув правой кнопкой мыши на интересующем файле и выбрав «Применить настройки изображения». - Когда сеанс обработки изображений будет завершен, сохраните проект изображения. Чтобы завершить сеанс визуализации, извлеките образец из микроскопического этапа и очистите объектив от иммерсионной жидкости (если она используется) в соответствии со стандартной процедурой, реализованной в центре визуализации. Закройте проект и программное обеспечение. Выключите микроскоп, лазеры и все подключенные устройства.
- Перейдите к анализу данных визуализации (шаг 2.3).
- Включите термоклимат-контроль за 30-60 минут до начала съемки. Установите необходимую скорость проветривания и температуру (35-37 °С).
- Векторная обработка изображений NAD(P)H/FAD-FLIM с модулем LAS X FLIM и FIJI
ПРИМЕЧАНИЕ: Протокол описывает флуоресцентный анализ времени жизни визуализированных сфероидов для получения данных в частотной области на примерах автофлуоресценции NAD(P)H и FAD/Flavins FLIM. Измерение автофлуоресценции NAD(P)H стало золотым стандартом метаболического анализа, где короткие и более длительные компоненты автофлуоресценции NAD(P)H связаны с гликолизом или окислительным фосфорилированием (OxPhos) соответственно. Это можно проанализировать по сдвигу на векторном графике вдоль метаболической траектории в сторону измеренных стандартов свободного NAD(P)H или связанного с белком NAD(P)H31,62. Для анализа траектории метаболического сдвига, а также для сравнения положения векторных облаков (см. ПРИМЕЧАНИЕ ниже шаг 2.3.6) на графике между экспериментальными группами был реализован упрощенный анализ векторных координат, основанный на расчете геометрического центра (центроида) векторного облака29. Описанный протокол демонстрирует вычисление координат центроида в FIJI и измерение расстояния между двумя точками на векторном графике с использованием координат (например, расстояние от центроида сфероида автофлуоресцентного векторного облака NAD(P)H до теоретической точки «свободного NAD(P)H»). Аналогичным образом можно анализировать FAD и другие сигналы автофлуоресценции. Набор данных 1 с .lif (требуется программное обеспечение LAS X) или .ptu Форматы файлов для обучения этой процедуре предоставлены (Дополнительное дело 2, Дополнительное дело 3, Дополнительное дело 4, Дополнительное дело 5, Дополнительное дело 6, Дополнительное дело 7, Дополнительное дело 8, Дополнительное дело 9, и Дополнительный файл 10).- Откройте модуль FLIM в LAS X, выберите «Открыть проект» и загрузите файл изображения сфероида (.lif) для автофлуоресцентного анализа NAD(P)H/FAD.
ПРИМЕЧАНИЕ: В связи с возможными ошибками и промежуточными потерями данных в модуле FLIM, используйте копию исходного файла изображения сфероида (.lif) для анализа NAD(P)H/FAD, сохраняя необработанный файл без изменений. - Выберите одно изображение и перейдите к интерфейсу анализа FLIM. Нажмите кнопку Вектор, чтобы получить доступ к векторному графику и активировать режим векторного анализа. Примените фильтр (Медиана или Вейвлет) и установите Порог для минимизации шума и улучшения видимости данных для всех векторных анализов. Выберите гармоники. Для анализа метаболического сдвига на основе данных NAD(P)H перейдите к шагам 2.3.3-2.3.5. Для общего сравнения векторных графиков исходим из пункта 2.3.6.
ПРИМЕЧАНИЕ: Применяйте настройки анализа (тип фильтра, гармоники, пороговые значения, группирование и ROI векторов) одинаково ко всем изображениям в сравниваемом наборе данных. - (Опционально для анализа NAD(P)H) Выберите любое изображение, относящееся к набору данных, и используйте опцию «Нарисовать курсор для двух компонентов », чтобы точно определить положение 0,45 нс на универсальной окружности стандартного пространства векторных графиков. Это положение будет присвоено среднему времени жизни флуоресценции чистого однородного раствора свободного NAD(P)H, которое в норме близко к моноэкспоненциальному распаду62.
ПРИМЕЧАНИЕ: Free-NADH и free-NAD(P)H имеют схожие спектральные свойства и схожие значения времени жизни флуоресценции в водном растворе, с двумя короткими компонентами жизни, 0,3 нс и 0,7нс63. Таким образом, для простоты векторного анализа и из-за небольшой разницы между временными компонентами их затухание флуоресценции принято считать моноэкспоненциальным, что позволяет распределить векторное облако по универсальной окружности. Эталонное среднее время жизни формы со свободным NAD(P)H также может быть измерено и построено на графике в векторном пространстве для аналогичного анализа. Референтный срок жизни был выбран на основе литературы62; Обратите внимание, что в других источниках можно найти несколько иное значение свободного NAD(P)H в растворе (0,4 нс64). - (Опционально для анализа NAD(P)H) Экспортируйте векторный график с выделенным временем жизни free-NAD(P)H (см. шаг 2.3.3), щелкнув правой кнопкой мыши на графике и выбрав «Экспорт данных». Экспортируйте векторную диаграмму в виде файла в формате .tiff в указанную папку для хранения.
ПРИМЕЧАНИЕ: Исходный размер пикселя экспортированного векторного изображения из модуля LAS X FLIM всегда составляет 1024 x 600 пикселей. Если для экспорта и предварительного анализа данных используется другое программное обеспечение, убедитесь, что все изображения векторных графиков экспортируются с одинаковым размером и разрешением. - Чтобы экспортировать шароидное облако, связанное с сфероидами, используйте инструмент Нарисовать курсор в модуле LAS X FLIM, чтобы выбрать ROI сфероида на изображении. Экспортируйте сгенерированный векторный график, как описано в шаге 2.3.4.
ПРИМЕЧАНИЕ: Соответствующие координаты g и s (аналогично x и y) векторного пространства будут присвоены каждому пикселю выбранного ROI в соответствии с их временем жизни, преобразованные в набор данных в частотной области64,65. Кластер пикселей с одинаковыми значениями tf (время жизни фазы) и tm (время жизни модуляции) образует на графике облачный узор (фазорное облако), где цветовое кодирование (с диапазоном от глубокого синего до красного) будет отражать обилие значений времени жизни. По положению облака на универсальном круге или внутри можно различать моно- или мультиэкспоненциальные распады. Некоторые измерительные среды проявляют сильную (авто)флуоресценцию, что приводит к появлению соответствующего облака на векторном графике, которое не может быть просто удалено с помощью средств порога интенсивности. Этот шаблон влияет на вычисление координат центроида и должен быть исключен из экспортируемого векторного графика. Работа со сфероидом ROI позволяет исключить несвязанные пиксели из дальнейшего векторного анализа. - Повторите процедуру экспорта векторных графиков для всех сфероидов ROI в наборе данных (см. шаги 2.3.4 и 2.3.6). Кроме того, проверьте экспортированный набор .tiff изображений, чтобы гарантировать полный набор данных для дальнейшего сравнительного анализа и убедиться, что все экспортируемые изображения имеют одинаковый размер пикселя (см. ПРИМЕЧАНИЕ в шаге 2.3.4).
ПРИМЕЧАНИЕ: На этом этапе протокола набор изображений должен включать вектор с местоположением свободного NAD(P)H (на основе литературы или эмпирически полученных данных) и все сфероидные ROI (или альтернативные шаблоны ROI, если это необходимо для конкретного анализа). После этого шага будет проведен дальнейший анализ на Фиджи, а затем в электронной таблице. Используя окно инструмента Анализ , выберите опцию Установить масштаб в FIJI и убедитесь, что все изображения векторных графиков откалиброваны с одним и тем же типом единиц измерения, например, только в пикселях. Если нет, задайте единицу длины в окне «Задать масштаб » для выбранной единицы (например, для масштаба на основе пикселей поставьте 1 в поле «Расстояние в пикселях » и установите единицу длины в пикселях). Для дальнейшего сравнения измерьте все экспортируемые данные, используя один и тот же тип единиц измерения. - (Опционально для анализа NAD(P)H) Определите положение точки пикселя со средним временем жизни флуоресценции в свободном NAD(P)H на соответствующем экспортируемом векторном изображении (см. шаг 2.3.3): Откройте векторное изображение с помощью FIJI, увеличьте изображение, чтобы четко визуализировать с пиксельным разрешением пересечение между универсальным полукругом и линией Ratio Cursor for Two Components ; используйте инструмент Rectangle ROI для выбора перекрестка.
ПРИМЕЧАНИЕ: Убедитесь, что прямоугольное выделение представляет собой небольшую область вокруг точки пересечения для точного определения ее координат на следующем шаге (шаг 2.3.9). - (Опционально для анализа NAD(P)H) Откройте инструмент Анализ , выберите окно Задать измерения и выберите Центроид в качестве параметра измерения. Нажмите кнопку Измерить в окне инструмента Анализ, чтобы определить координаты центроида точки отсчета свободного NAD(P)H. Экспортируйте эти координаты в таблицу.
ПРИМЕЧАНИЕ: Координаты Free-NAD(P)H будут использоваться в качестве точки отсчета для сравнения расстояний от этой точки до положения сфероидного векторного облака в наборе данных (способ характеристики метаболического сдвига между гликолизом и OxPhos в автофлуоресцентном анализе NAD(P)H FLIM) - С помощью FIJI откройте изображение сфероидального векторного облака. Откройте окно «Изображение », выберите «Настройка» и выберите «Порог цвета » на панели инструментов. Выберите выбранный метод порогового значения (например, Otsu) и установите значения оттенка и яркости , чтобы сузить параметры для выбора части векторного облака с наиболее распространенными пиксельными координатами. Нажмите кнопку Выбрать, чтобы определить область кластера.
ПРИМЕЧАНИЕ: Сохраняйте одинаковые пороговые параметры для всех изображений векторных графиков, которые должны быть проанализированы. Для представленных данных NAD(P)H-FLIM был выбран метод порогового значения Otsu с установленными значениями Hue Value 9 и Brightness Value 160, который был применен ко всем векторным изображениям. Кроме того, выбранную область можно скопировать в Менеджер ROI (следуйте по пути Edit > Selection > Add to Manager) для создания библиотеки векторных ROI для дальнейшего анализа. - Сохраняя выделение, рассчитаем координаты центроида выделенной области, следуя процедуре, описанной в шаге 2.3.9. Экспортируйте эти координаты в файл таблицы.
- Повторите шаги 2.3.9 и 2.3.10 для определения координат центроида для всех векторных изображений ROI для создания набора данных в электронной таблице.
ПРИМЕЧАНИЕ: Использование библиотеки ROI Manager помогает упростить и организовать анализ ROI (см. шаг 2.3.10) - (Опционально для анализа NAD(P)H) Откройте таблицу с экспортированными координатами свободного NAD(P)H и сфероида ROI из разных групп сравнения. Вычислите расстояние между каждым отдельным центроидом вектора сфероида до опорного положения свободного NAD(P)H, используя определенные координаты и следующее уравнение:
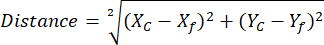
Где, X,c и Y,c — координаты центроида, Xf и Yf — координаты привязки.
ПРИМЕЧАНИЕ: Применение параметра центроида для определения сдвига в сторону опорного времени целесообразно только в том случае, если все центроиды из набора данных лежат на одной и той же линейной траектории к точке отсчета. Чтобы проверить это, все точки центроида из набора данных должны быть построены вместе с опорной точкой в том же пространстве координат, а также должно быть выполнено линейное выравнивание тренда. Если коэффициент R2 линейной линии тренда, проведенной через все точки, близок к 1 (например, R2 равен 0,8-0,99), то предполагается, что анализ расстояний является целесообразным. - Организуйте все данные соответствующим образом для сравнения и выполните статистический анализ с использованием любого соответствующего программного обеспечения (например, Origin, MatLab). Выберите подходящий статистический тест в соответствии с характеристиками набора данных (нормальность распределения, количество статистических единиц и т.д.).
ПРИМЕЧАНИЕ: Для анализа NAD(P)H сравните значения расстояний, чтобы охарактеризовать метаболический сдвиг в зависимости от условий эксперимента. Для сравнения любых векторных графиков между экспериментальными группами выполните сравнение координат центроидов векторного облака ROI.
- Откройте модуль FLIM в LAS X, выберите «Открыть проект» и загрузите файл изображения сфероида (.lif) для автофлуоресцентного анализа NAD(P)H/FAD.
Access restricted. Please log in or start a trial to view this content.
Результаты
Выбор подходящего способа формирования сфероида
Выбранный метод формирования сфероидов может существенно влиять на размер, форму, плотность клеток, жизнеспособность и чувствительность к лекарственным препаратам (рис. 2). Ранее сравнивали влияние нескольких...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Многоклеточные сфероиды становятся предпочтительным методом в изучении микроокружения опухолей и стволовых клеток, открытии лекарств и разработке «тканевых строительных блоков» для биопроизводства. Гетерогенная внутренняя архитектура, градиенты питательных веществ и оксигенации ...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Раскрывать нечего.
Благодарности
Эта работа была поддержана грантами Специального исследовательского фонда (BOF) Гентского университета (BOF/STA/202009/003; BOF/IOP/2022/058), Исследовательский фонд Фландрии (FWO, I001922N) и Европейский Союз, fliMAGIN3D-DN Horizon Europe-MSCA-DN No 101073507.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | Also available from Sigma |
| 10 mL serological pipets | VWR | 612-3700 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 12 well cell-culture plates, sterile | Greiner bio-one | 665-180 | Similar products are also available from Sarstedt, Corning and other companies. |
| 12 Well Chamber slide, removable | Ibidi | 81201 | Also available from Grace Bio-Labs, ThermoFisher Scientific and others |
| 15 mL centrifuge tubes | Nerbe plus | 02-502-3001 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 3D Petri Dish micromolds | Microtissue | Z764000-6EA | |
| 6 well cell-culture plates, sterile | Greiner bio-one | 657160 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 70% ethanol | ChemLab | CL02.0537.5000 | |
| Biofloat | Sarstedt | 83.3925.400 | Commercial available coated 96-well plate for spheroid formation |
| Calcein Green-AM | Tebubio | AS-89201 | Apply in dilution 1:1000 |
| CellSens Dimension software | Olympus | version 3 | |
| Collagen from human placenta, type IV | Sigma | C5533 | For the preparation of 0.07 mg/mL Collagen and 0.03 mg/mL Poly-D-lysine coated microscopy dishes |
| Confocal FLIM Microscope | Leica Microsystems | N/A | Stellaris 8 Falcon inverted microscope with white-light laser, HyD X detectors, climate / T control chamber (OkoLab), 25x/0.95 W objective |
| D(+)-Glucose | Merck | 8342 | Prepare 1 M stock solution, 1:100 for preparation of imaging medium (final concentration 10 mM) |
| Dulbecco's modified Eagle's medium (DMEM), phenol red-, glucose-, pyruvate- and glutamine-free | Sigma-Aldrich | D5030-10X1L | For preparation of imaging medium |
| Fetal Bovine Serum (FBS) | Gibco | 10270-098 | Also available from Sigma. Needs to be heat-inactivated before use. |
| HEPES (1M) | Gibco | 15630-080 | Dilution 1/100 for preparation of imaging medium (final concentration 10 mM) |
| Human colon cancer cells HCT116 | ATCC | ||
| ImageJ | NIH | version 1.54f | |
| Leica Application Suite X (LAS X) | Leica Microsystems | version 4.6.1.27508 | |
| L-glutamine | Gibco | 25030 | Also available from Sigma. Apply in dilution 1:100. |
| Lipidure-CM5206 | Amsbio | AMS.52000034GB1G | |
| McCoy's 5A, need addition of 1 mM Sodium Pyruvate and 10 mM HEPES | VWR | 392-0420 | Standard growth medium for HCT116 cells |
| micro-patterned 3D-printed PDMS stamps | N/A | N/A | Provided by the Centre for Microsystems Technology, Professor Dr. Jan Vanfleteren, Ghent University |
| NaCl | Chemlab | CL00.1429.100 | |
| Neubauer couting chamber | Fisher Scientific | 15980396 | |
| O2 probes: MMIR1 | N/A | N/A | Full characterization, validation and some applications can be found at: https://www.biorxiv.org/content/10.1101/2023.12.11.571110 v1 |
| PBS | Fisher scientific | Gibco18912014 | Dissolve PBS tablet in 500 mL of distilled water. |
| Pen Strep :Penicillin (10,000 U/mL) / streptomycin (10,000 μg/mL) 100x solution | Gibco | 15140-122 | Also available from Sigma. Apply in dilution 1:100. |
| Poly-D-lysine | Sigma | P6407-5mg | For the preparation of 0.07 mg/mL Collagen and 0.03 mg/mL Poly-D-lysine coated microscopy dishes |
| Propidium Iodide | Sigma-Aldrich | 25535-16-4 | Cell death staining, use 1 µg/mL at 1h incubation |
| PVDF syringe filter 0.22 µm | Novolab | A35149 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Sodium pyruvate (100 mM) | Gibco | 11360-070 | Dilution 1/100 for preparation of imaging medium (final concentration 1mM) |
| SphericalPlate 5D 24-well | Kugelmeiers | SP5D-24W | |
| sterile petridish | Greiner bio-one | 633181 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Tissue culture flask (25 cm² ) | VWR | 734-2311 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Tissue culture flask (75 cm²) | VWR | 734-2313 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| U-bottom 96-well plate | VWR | 10062-900 | Similar products are also available from Sarstedt, Corning, Greiner Bio-one and other companies |
| Ultrapure Agarose | Invitrogen (Life Technologies) | 16500-500 | Other types of Agarose such as Agarose low melting point (A-9414, Sigma), Agarose for routine use (A-9539, Sigma) |
| Widefield fluorescence inverted microscope | Olympus | N/A | Inverted fluorescence microscope IX81, with motorised Z-axis control, CoolLED pE4000 (16 channels, 365-770 nm), ORCA-Flash4.0LT (Hamamatsu) cMOS camera, glass warming plate Okolab, CellSens Dimension v.3 software and air objectives 4x/0.13 UPlanFLN and 40x/0.6 LUCPlanFLN. (Optional, for high-resolution imaging) 60x/1.0 LUMPLFLN water |
Ссылки
- Foty, R. A simple hanging drop cell culture protocol for generation of 3d spheroids. J Vis Exp. (51), e2720(2011).
- Moskovits, N., et al. Establishing 3-dimensional spheroids from patient-derived tumor samples and evaluating their sensitivity to drugs. J Vis Exp. (190), e64564(2022).
- Griner, L. M., et al. Generation of high-throughput three-dimensional tumor spheroids for drug screening. J Vis Exp. (139), e57476(2018).
- Qian, Y., Wei, X., Chen, K., Xu, M. Three-dimensional acoustic assembly device for mass manufacturing of cell spheroids. J Vis Exp. (200), e66078(2023).
- He, H., et al. Dynamic formation of cellular aggregates of chondrocytes and mesenchymal stem cells in spinner flask. Cell Prolif. 52 (4), e12587(2019).
- Perez, J. E., Nagle, I., Wilhelm, C. Magnetic molding of tumor spheroids: Emerging model for cancer screening. Biofabrication. 13 (1), 015018(2020).
- Kingsley, D. M., et al. Laser-based 3d bioprinting for spatial and size control of tumor spheroids and embryoid bodies. Acta Biomater. 95, 357-370 (2019).
- Guillaume, O., et al. Hybrid spheroid microscaffolds as modular tissue units to build macro-tissue assemblies for tissue engineering. Acta Biomater. 165, 72-85 (2023).
- Danilevicius, P., et al. laser-made 3D microscaffolds for tissue spheroid encagement. Biointerphases. 10 (2), 021011(2015).
- Jamieson, L. E., Harrison, D. J., Campbell, C. Chemical analysis of multicellular tumour spheroids. Analyst. 140 (12), 3910-3920 (2015).
- Dmitriev, R., Borisov, S., Jenkins, J., Papkovsky, D. Multiparametric imaging of tumor spheroids with ultra-bright and tunable nanoparticle O2 probes. SPIE BiOS. 9328, (2015).
- Zushin, P. -J. H., Mukherjee, S., Wu, J. C. FDA Modernization Act 2.0: transitioning beyond animal models with human cells, organoids, and AI/ML-based approaches. J Clin Invest. 133 (21), e175824(2023).
- Kim, D. -S., et al. Robust enhancement of neural differentiation from human es and ips cells regardless of their innate difference in differentiation propensity. Stem Cell Rev Rep. 6 (2), 270-281 (2010).
- Hart, D., Gutiérrez, D. R., Biason-Lauber, A. Generation of a human ovarian granulosa cell model from induced pluripotent stem cells. bioRxiv. , 2022(2022).
- Chiaradia, I., et al. Tissue morphology influences the temporal program of human brain organoid development. Cell Stem Cell. 30 (10), 1351-1367 (2023).
- Wagstaff, E. L., Ten Asbroek, A. L., Ten Brink, J. B., Jansonius, N. M., Bergen, A. A. An alternative approach to produce versatile retinal organoids with accelerated ganglion cell development. Sci Rep. 11 (1), 1101(2021).
- Thavandiran, N., et al. Design and formulation of functional pluripotent stem cell-derived cardiac microtissues. Proc Natl Acad Sci U S A. 110 (49), E4698-E4707 (2013).
- Harrison, S. P., et al. Scalable production of tissue-like vascularized liver organoids from human pscs. Exp Mol Med. 55 (9), 2005-2024 (2023).
- Noguchi, T. -A. K., Kurisaki, A. Formation of stomach tissue by organoid culture using mouse embryonic stem cells. Methods Mol Biol. 2017, 217-228 (2017).
- Takahashi, J., et al. Suspension culture in a rotating bioreactor for efficient generation of human intestinal organoids. Cell Reports Methods. 2 (11), 100337(2022).
- Lagziel, S., Gottlieb, E., Shlomi, T. Mind your media. Nat Metab. 2 (12), 1369-1372 (2020).
- Das, V., Fürst, T., Gurská, S., Džubák, P., Hajdúch, M. Reproducibility of uniform spheroid formation in 384-well plates: The effect of medium evaporation. J Biomol Screen. 21 (9), 923-930 (2016).
- Bera, K., et al. Extracellular fluid viscosity enhances cell migration and cancer dissemination. Nature. 611 (7935), 365-373 (2022).
- Michl, J., Park, K. C., Swietach, P. Evidence-based guidelines for controlling ph in mammalian live-cell culture systems. Commun Biol. 2, 144(2019).
- Okkelman, I. A., Vercruysse, C., Kondrashina, A. V., Borisov, S. M., Dmitriev, R. I. Affordable oxygen microscopy-assisted biofabrication of multicellular spheroids. J Vis Exp. (182), e63403(2022).
- Peirsman, A., et al. Mispheroid: A knowledgebase and transparency tool for minimum information in spheroid identity. Nat Methods. 18 (11), 1294-1303 (2021).
- Raghavan, S., et al. Comparative analysis of tumor spheroid generation techniques for differential in vitro drug toxicity. Oncotarget. 7 (13), 16948(2016).
- Froehlich, K., et al. Generation of multicellular breast cancer tumor spheroids: Comparison of different protocols. J Mammary Gland Biol Neoplasia. 21 (3-4), 89-98 (2016).
- Debruyne, A. C., et al. Live microscopy of multicellular spheroids with the multimodal near-infrared nanoparticles reveals differences in oxygenation gradients. ACS Nano. 18 (19), 12168-12186 (2024).
- Debruyne, A. C., Okkelman, I. A., Dmitriev, R. I. Balance between the cell viability and death in 3D. Semin Cell Dev Biol. 144, 55-66 (2023).
- Barroso, M., Monaghan, M. G., Niesner, R., Dmitriev, R. I. Probing organoid metabolism using fluorescence lifetime imaging microscopy (flim): The next frontier of drug discovery and disease understanding. Adv Drug Deliv Rev. 201, 115081(2023).
- Becker, W. Fluorescence lifetime imaging-techniques and applications. J Microsc. 247 (2), 119-136 (2012).
- Dmitriev, R. I., Intes, X., Barroso, M. M. Luminescence lifetime imaging of three-dimensional biological objects. J Cell Sci. 134 (9), 1-17 (2021).
- Sarder, P., Maji, D., Achilefu, S. Molecular probes for fluorescence lifetime imaging. Bioconjug Chem. 26 (6), 963-974 (2015).
- Alfonso-Garcia, A., et al. Mesoscopic fluorescence lifetime imaging: Fundamental principles, clinical applications and future directions. J Biophotonics. 14 (6), e202000472(2021).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: Fundamentals and advances in instrumentation, analysis, and applications. J Biomed Opt. 25 (7), 1-43 (2020).
- Yellen, G. Fueling thought: Management of glycolysis and oxidative phosphorylation in neuronal metabolism. J Cell Biol. 217 (7), 2235-2246 (2018).
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomark Med. 4 (2), 241-263 (2010).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of nad (p) h and fad. Antioxid Redox Signal. 30 (6), 875-889 (2019).
- Verma, A., et al. Fluorescence lifetime imaging for quantification of targeted drug delivery in varying tumor microenvironments. bioRxiv. , 2024(2024).
- Smith, J. T., et al. In vivo quantitative fret small animal imaging: Intensity versus lifetime-based fret. Biophys Rep. 3 (2), 100110(2023).
- Alvarez, L. A., et al. Application Note: SP8 Falcon: A novel concept in fluorescence lifetime imaging enabling video-rate confocal flim. Nat Methods. , (2019).
- Roberti, M. J., et al. TauSense: A fluorescence lifetime-based tool set for everyday imaging. Nat. Methods. , https://www.nature.com/articles/d42473-020-00364-w.pdf (2020).
- Auer, J. M. T., Murphy, L. C., Xiao, D., Li, D. U., Wheeler, A. P. Non-fitting flim-fret facilitates analysis of protein interactions in live zebrafish embryos. J Microsc. 291 (1), 43-56 (2023).
- Warren, S. C., et al. Rapid global fitting of large fluorescence lifetime imaging microscopy datasets. PLoS One. 8 (8), e70687(2013).
- Gao, D., et al. Flimj: An open-source imagej toolkit for fluorescence lifetime image data analysis. PloS One. 15 (12), e0238327(2020).
- Tullis, I. D. C., Ameer-Beg, S. M., Barber, P. R., Rankov, V., Vojnovic, B. Mapping femtosecond pulse front distortion and group velocity dispersion in multiphoton microscopy. Proc. SPIE 6089, Multiphoton Microscopy in the Biomedical Sciences VI. , 60890(2006).
- Zhou, Y., et al. One-step derivation of functional mesenchymal stem cells from human pluripotent stem cells. Bio Protoc. 8 (22), e3080(2018).
- Benton, G., Arnaoutova, I., George, J., Kleinman, H. K., Koblinski, J. Matrigel: From discovery and ECM mimicry to assays and models for cancer research. Adv Drug Deliv Rev. 79-80, 3-18 (2014).
- Badea, M. A., et al. Influence of matrigel on single-and multiple-spheroid cultures in breast cancer research. SLAS Discov. 24 (5), 563-578 (2019).
- Lang, S., Sharrard, R., Stark, M., Villette, J., Maitland, N. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Barra, J., et al. DMT1-dependent endosome-mitochondria interactions regulate mitochondrial iron translocation and metastatic outgrowth. Oncogene. 43 (9), 650-667 (2024).
- Dmitriev, R. I., Papkovsky, D. B. Intracellular probes for imaging oxygen concentration: How good are they. Methods Appl Fluoresc. 3 (3), 034001(2015).
- Schweikhard, V., et al. Application Note: The power HyD family of detectors for confocal microscopy. Nat Methods. , https://www.nature.com/articles/d42473-020-00398-0 (2020).
- Alam, S. R., Wallrabe, H., Christopher, K. G., Siller, K. H., Periasamy, A. Characterization of mitochondrial dysfunction due to laser damage by 2-photon flim microscopy. Sci Rep. 12 (1), 11938(2022).
- Bush, P. G., Wokosin, D. L., Hall, A. C. Two-versus one photon excitation laser scanning microscopy: Critical importance of excitation wavelength. Front Biosci. 12, 2646-2657 (2007).
- Liu, M., et al. Instrument response standard in time-resolved fluorescence spectroscopy at visible wavelength: Quenched fluorescein sodium. Appl Spectrosc. 68 (5), 577-583 (2014).
- Szabelski, M., et al. Collisional quenching of erythrosine b as a potential reference dye for impulse response function evaluation. Appl Spectrosc. 63 (3), 363-368 (2009).
- Chib, R., et al. Standard reference for instrument response function in fluorescence lifetime measurements in visible and near infrared. Meas Sci Technol. 27 (2), 027001(2015).
- Talbot, C. B., et al. Application of ultrafast gold luminescence to measuring the instrument response function for multispectral multiphoton fluorescence lifetime imaging. Opt Express. 19 (15), 13848-13861 (2011).
- Becker, W. Recording the instrument response function of a multiphoton flim system. Becker & Hickl. , Available from: https://www.becker-hickl.com/literature/application-notes/recording-the-instrument-response-function-of-a-multiphoton-flim-system/ (2007).
- Leben, R., Köhler, M., Radbruch, H., Hauser, A. E., Niesner, R. A. Systematic enzyme mapping of cellular metabolism by phasor-analyzed label-free nad (p) h fluorescence lifetime imaging. Int J Mol Sci. 20 (22), 5565(2019).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using nadh and nadph autofluorescence. Free Radic Biol Med. 100, 53-65 (2016).
- Gottlieb, D., Asadipour, B., Kostina, P., Ung, T. P. L., Stringari, C. FLUTE: A python gui for interactive phasor analysis of flim data. Biol Imaging. 3, e21(2023).
- Malacrida, L., Ranjit, S., Jameson, D. M., Gratton, E. The phasor plot: A universal circle to advance fluorescence lifetime analysis and interpretation. Annu Rev Biophys. 50, 575-593 (2021).
- Okkelman, I., Vandenberghe, W., Dmitriev, R. Role of preconditioning with oxygen and glucose deprivation in promoting differentiation of dental pulp stem cells in 3D culture. Mol Biol Cell. 34 (2), 1212(2022).
- Park, J. H., et al. The effect of bmp-mimetic peptide tethering bioinks on the differentiation of dental pulp stem cells (DPSCs) in 3D bioprinted dental constructs. Biofabrication. 12 (3), 035029(2020).
- Pașca, S. P. The rise of three-dimensional human brain cultures. Nature. 553 (7689), 437-445 (2018).
- Dmitriev, R. I., Zhdanov, A. V., Nolan, Y. M., Papkovsky, D. B. Imaging of neurosphere oxygenation with phosphorescent probes. Biomaterials. 34 (37), 9307-9317 (2013).
- Bryanskaya, E. O., et al. High levels of FAD autofluorescence indicate pathology preceding cell death. Biochim Biophys Acta Gen Subj. 1868 (1), 130520(2024).
- Han, S. J., Kwon, S., Kim, K. S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 21 (1), 152(2021).
- Okkelman, I. A., Neto, N., Papkovsky, D. B., Monaghan, M. G., Dmitriev, R. I. A deeper understanding of intestinal organoid metabolism revealed by combining fluorescence lifetime imaging microscopy (flim) and extracellular flux analyses. Redox Biol. 30, 101420(2020).
- Gstraunthaler, G., Seppi, T., Pfaller, W. Impact of culture conditions, culture media volumes, and glucose content on metabolic properties of renal epithelial cell cultures: Are renal cells in tissue culture hypoxic. Cell Physiol Biochem. 9 (3), 150-172 (1999).
- Glickman, R. D. Phototoxicity to the retina: Mechanisms of damage. Int J Toxicol. 21 (6), 473-490 (2002).
- Golub, A. S., Pittman, R. N. Monitoring Parameters of Oxygen Transport to Cells in the Microcirculation. Quenched-Phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , The Royal Society of Chemistry. (2018).
- Nishigaki, T., Wood, C. D., Shiba, K., Baba, S. A., Darszon, A. Stroboscopic illumination using light-emitting diodes reduces phototoxicity in fluorescence cell imaging. Biotechniques. 41 (2), 191-197 (2006).
- Penjweini, R., Loew, H. G., Hamblin, M. R., Kratky, K. W. Long-term monitoring of live cell proliferation in presence of pvp-hypericin: A new strategy using ms pulses of led and the fluorescent dye cfse. J Microsc. 245 (1), 100-108 (2012).
- Carrasco Kind, M., et al. flimview: A software framework to handle, visualize and analyze flim data. F1000Research. 9, 574(2020).
- Schrimpf, W., Barth, A., Hendrix, J., Lamb, D. C. Pam: A framework for integrated analysis of imaging, single-molecule, and ensemble fluorescence data. Biophys J. 114 (7), 1518-1528 (2018).
- Chen, S. -J., Sinsuebphon, N., Barroso, M., Intes, X., Michalet, X. Optical Molecular Probes, Imaging and Drug Delivery. , Optica Publishing Group. (2021).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены